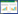扩展功能
文章信息
- 张红娜, 周玉法, 崔娜, 庞全海, 常维山
- ZHANG Hong-Na, ZHOU Yu-Fa, CUI Na, PANG Quan-Hai, CHANG Wei-Shan
- 基于盲肠菌群和回肠粘膜基因表达探讨解淀粉芽孢杆菌提高蛋鸡生产性能的潜在机制
- Exploring mechanisms for Bacillus amyloliquefaciens-mediated production performance improvement of laying hens based on cecal microflor and ileum mucosal gene expression
- 微生物学通报, 2020, 47(8): 2516-2525
- Microbiology China, 2020, 47(8): 2516-2525
- DOI: 10.13344/j.microbiol.china.200044
-
文章历史
- 收稿日期: 2020-01-15
- 接受日期: 2020-03-06
- 网络首发日期: 2020-04-09
2. 山西农业大学动物科技学院 山西 晋中 0308011;
3. 山东农业大学动物科技学院 山东 泰安 271000
2. College of Animal Science and Technology, Shanxi Agricultural University, Jinzhong, Shanxi 030801, China;
3. College of Animal Science and Technology, Shandong Agricultural University, Tai'an, Shandong 271000, China
抗生素在畜禽生产中的应用为畜牧业的健康快速发展提供了有力保障,但养殖过程中对抗生素的过度依赖,以及不合理使用甚至是滥用抗生素,导致动物产品中的药物残留严重超标,动物源耐药菌株大面积散播,已经对公共安全和生态环境造成了严重威胁[1-2]。欧盟等国家已经通过颁布法令的形式严禁在畜禽日粮中添加抗生素作为促生长剂[3]。目前在动物生产中,选择添加抗生素替代品已经引起了各国科学家的密切关注。大量的研究证实了益生菌能提高动物的生产性能、增强免疫力、缓解热应激,甚至预防和控制疾病[4-8]。
在益生菌的选择上,乳酸杆菌和芽孢杆菌备受欢迎[9-10]。芽孢杆菌在一定条件下会形成芽孢,可对抗酸、胆碱和高温等恶劣环境,在动物肠道环境内可以生存并进行繁殖,对肠道菌群起到平衡作用[11];另外,芽孢杆菌还能利用自身产生的淀粉酶和脂肪酶等去降解动物日粮中复杂的碳水化合物,提高畜禽对饲料的利用率[12-15]。
但是目前许多关于益生菌的研究仅是从饲喂结果上去反映其益生效果,而针对益生菌益生机制的研究却很少。这主要是由于畜禽消化道环境有海量的微生物菌群定殖,要想系统研究益生菌在复杂的胃肠道内发挥益生功效的机制显得较为困难,但新兴的高通量测序技术的应用为人们研究益生菌在动物肠道内发挥益生机制提供了有利手段[16-17]。因此,本研究在前期工作的基础上[15],以基因组学和转录组学技术为手段探讨蛋鸡日粮中添加解淀粉芽孢杆菌BLCC1-0238对盲肠微生物菌群和回肠粘膜基因表达的影响,从而较为系统地阐明其提高蛋鸡生产性能的作用机理。
1 材料与方法 1.1 实验设计基于课题组的前期工作[15],利用高通量测序技术比较分析基础日粮组(C组)和解淀粉芽孢杆菌BLCC1-0238添加组(0.06%,2.0×1010 CFU/g,T组)盲肠微生物菌群和回肠粘膜基因表达的差异,从基因组学和转录组学两个角度揭示益生菌提高蛋鸡生产性能的潜在机制。
1.2 主要试剂和仪器Omega Stool DNA Isolation Kit,Omega公司;TruSeqⓇ DNA PCR-Free Sample Preparation Kit,Illumina公司;SureSelect Strand-Specific RNA Library Prep Kit,Agient Technologies公司;Trizol,Invitrogen公司;Tiangen凝胶回收试剂盒,天根生化科技(北京)有限公司。
水平电泳仪,北京六一生物科技有限公司;凝胶成像系统,Bio-Rad公司;Illumina HiSeqTM 4000平台,Illumina公司;Agilent 2100生物分析仪,Agilent Technologies公司。
1.3 样品采集和处理从基础日粮组(C组)和解淀粉芽孢杆菌BLCC1-0238添加组(0.06%,2.0×1010 CFU/g,T组)分别随机选取3只蛋鸡,颈静脉放血法处死后,收取盲肠内容物和回肠中段。用细绳将盲肠口结扎并取出,放入无菌的冷冻管中,在无菌条件下收集每个样本的盲肠内容物。快速剪取回肠中段,用0.9%灭菌生理盐水冲洗后,无菌条件下用手术刀刀背刮取回肠粘膜,放置冻存管中。收集的样品均置于液氮保存。
1.4 DNA的提取和MiSeq高通量测序分析采用Omega Stool DNA Isolation Kit提取盲肠内容物DNA,测定纯度合格(OD260/OD280约为1.8)后,PCR扩增细菌16S rRNA基因V3−V4区[18],产物经2%琼脂糖凝胶电泳检测。16S rRNA V3−V4高变区使用TruSeqⓇ DNA PCR-Free Sample Preparation Kit进行文库构建,使用Illumina HiSeqTM 4000平台进行高通量测序。利用Trimmomatic序列过滤软件去除接头和低质量片段(quality score < 20)。97%的相似性作为操作分类单元(operational taxonomic unit,OTU)的划分标准,使用RDP分类软件把OTU按照不同层次进行分类,并进行信息注解。最后,进行α多样性指数分析。
1.5 总RNA提取和转录组学分析Trizol法提取总RNA,并使用Agilent 2100生物分析仪对其浓度和完整度进行检测。构建cDNA文库的RNA完整度数值(RNA integrity number,RIN)的阈值为7。用SureSelect Strand-Specific RNA Library Prep Kit进行文库构建。随后采用Illumina HiSeqTM 4000平台进行高通量测序,测序模式为双末端150 bp (PE150)。利用Trimmonmatic (V0.38)软件对原始数据进行质控及预处理,最终得到高质量的序列信息。
利用HISAT2 (V2.1.0)软件将上述高质量序列信息对比到物种基因组(Gallus gallus 5.0,V91,Ensembl),生成比对信息。然后利用StringTie (V 1.3.5)对转录样本进行拼接,最后应用Ballgown (V 2.14.1)计算基因表达水平,对基础日粮组(C组)和解淀粉芽孢杆菌添加组(T组)的差异基因进行比较分析。差异基因筛选标准为P≤0.05且差异倍数(|Log2Fold change|)≥1。最后对获得的差异基因采用Top GO (V2.34.0)和KOBAS (V3.0)进行富集分析。
1.6 统计学分析采用One-way ANOVA (SPSS 22.0)分析数据,利用Duncan多重检验进行差异性分析和样本均数比较,P < 0.05表示差异显著,具有统计学意义。
2 结果与分析 2.1 盲肠菌群多样性构建的DNA文库中,将相似性为97%的序列集归为一个OTU,结果发现C组和T组分别包含2 126和2 787个OTU,交集数目为1 001个OTU (图 1)。对盲肠菌群OTU进行α多样性分析,T组Chao1指数(2 789)和Shannon指数(5.35)均高于C组Chao1指数(2 133)和Shannon指数(5.02) (表 1),说明蛋鸡基础日粮中BLCC1-0238益生菌的添加增加了盲肠微生物菌群的多样性。Coverage指数在99.93%以上,说明分析结果能够覆盖样本数据,能够真实反映盲肠菌群情况。
|
| 图 1 T组和C组之间的OTU数量 Figure 1 Numbers of OTUs between test group and control group |
|
|
| 项目Item | C组C group | T组T group |
| Reads | 161 141 | 188 318 |
| OTUs | 2 126 | 2 787 |
| Ace | 2 187 (2 170−2 211) | 2 823 (2 811−2 841) |
| Chao1 | 2 133 (2 129−2 141) | 2 789 (2 788−2 795) |
| Shannon | 5.02 (5.01−5.03) | 5.35 (5.34−5.36) |
| Simpson | 0.016 6 (0.016 4−0.016 7) | 0.014 4 (0.014 2−0.014 6) |
| Coverage (%) | 99.93 | 99.96 |
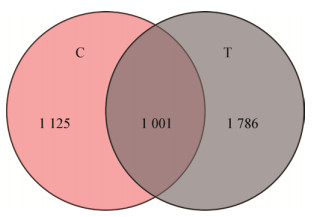
从图 2可见,T组中拟杆菌门的相对丰度显著下降,而厚壁菌门的相对丰度显著增加。另外,T组中的放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)、互氧菌门(Synergistetes)和广古菌门(Euryarchaeota)的相对丰度得到提高,而梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)的相对丰度降低了。
|
| 图 2 盲肠菌群在门水平上的组成 Figure 2 Cecal microflora taxonomic composition at phylum level |
|
|
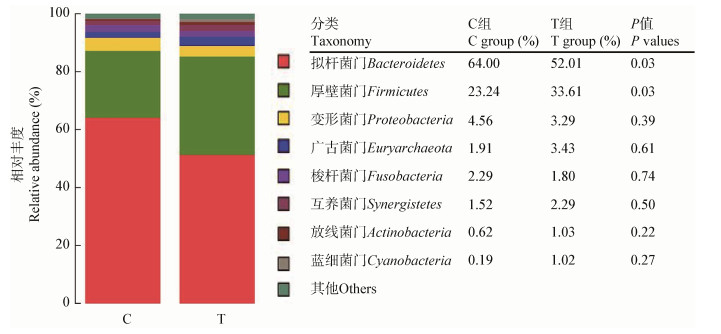
由图 3可见,拟杆菌属(Bacteroides)的相对丰度最高,其次是理研菌属(Rikenellaceae_RC9_gut_ group)和考拉杆菌属(Phascolarctobacterium)。与C组相比,T组的拟杆菌属的相对丰度显著下降,理研菌属(Rikenellaceae_RC9_gut_group)、脱硫弧菌属(Desulfovibrio)、梭杆菌属(Fusobacterium)等几个菌属的相对丰度也有下降,但差异不显著,这说明解淀粉芽孢杆菌BLCC1-0238的添加在一定程度上抑制了病原微生物的繁殖。而厚壁菌门中的考拉杆菌属(Phascolarctobacterium)、乳酸杆菌属(Lactobacillus)、瘤胃球菌科UCG-014属(Ruminococcaceae UCG-014)、厌氧棍状菌属(Anaerotruncus)、瘤胃梭菌属(Ruminiclostridium 9)、克里斯滕森氏菌属(Christensenellaceae_R-7_ group)相对丰度在T组内增加,但差异不显著。由于乳酸杆菌可参与调节微生物之间平衡,提高抗病能力,考拉杆菌属、瘤胃球菌属、厌氧棍状菌属在肠道内均可以产生短链脂肪酸,降低和改善肠道炎症,因此解淀粉芽孢杆菌BLCC1-0238的添加可通过提高这些菌群的丰度进而改善肠道微环境。
|
| 图 3 盲肠菌群在属水平上的组成 Figure 3 Cecal microflora taxonomic composition at genus level |
|
|
通过对回肠粘膜组织中转录组进行测定,结果见图 4火山图,C组和T组之间共有356个差异表达基因,包括199个上调基因和157个下调基因。其中共有18个与物质消化和吸收相关的差异表达基因(表 2),如编码蔗糖酶-异麦芽糖酶、麦芽糖化酶(α-葡萄糖苷酶)和乳糖酶的基因,醛缩酶、果糖二磷酸盐B和葡萄糖-6-磷酸酶催化亚单位的编码基因,苹果酸酶1编码基因,以及果糖二磷酸酶1和葡萄糖合成酶2的编码基因得到上调。这些与淀粉和蔗糖代谢、半乳糖代谢相关的基因得到上调,有利于动物机体把淀粉、乳糖和蔗糖等物质转变为便于机体利用的葡萄糖。

|
| 图 4 回肠粘膜差异表达基因 Figure 4 Differentially expressed genes in the ileum mucosa |
|
|
| 基因ID Gene ID |
基因符号 Gene symbol |
编码蛋白 Encoded protein |
差异倍数 Log2FC |
P值 P value |
| ENSGALG00000015544 | ALDOB | 醛缩酶,果糖二磷酸B Aldolase, fructose-bisphosphate B |
2.111 | 1.15E−04 |
| ENSGALG00000009511 | SI | 蔗糖酶-异麦芽糖Sucrase-isomaltase | 0.741 | 1.27E−03 |
| ENSGALG00000014995 | PGM5 | 葡萄糖磷酸变位酶5 Phosphoglucomutase 5 | −0.658 | 1.94E−03 |
| ENSGALG00000030034 | G6PC | 葡萄糖6磷酸酶亚基Glucose-6-phosphatase catalytic subunit | 0.977 | 2.39E−03 |
| ENSGALG00000013265 | GYS2 | 糖原合成酶2 Glycogen synthase 2 | 0.607 | 3.07E−03 |
| ENSGALG00000004222 | HK1 | 己糖激酶1 Hexokinase 1 | −0.906 | 3.83E−03 |
| ENSGALG00000031341 | MGAM | 麦芽糖酶-葡糖淀粉酶(α-葡糖苷酶) Maltase-glucoamylase (α-glucosidase) |
0.696 | 3.95E−03 |
| ENSGALG00000012260 | LCT | 乳糖酶Lactase | 0.666 | 1.25E−02 |
| ENSGALG00000009306 | SLC2A2 | 可溶载体家族2成员2 Solute carrier family 2 member 2 |
1.136 | 1.29E−02 |
| ENSGALG00000005043 | ACACB | 乙酰辅酶A羧化酶β Acetyl-CoA carboxylase beta |
−0.776 | 2.70E−02 |
| ENSGALG00000015849 | ME1 | 苹果酸酶1 Malic enzyme 1 | 0.588 | 3.66E−02 |
| ENSGALG00000012613 | FBP1 | 1, 6二磷酸果糖1 Fructose 1, 6-bisphosphatase 1 |
1.569 | 4.51E−02 |
| ENSGALG00000032679 | GCSH | 甘氨酸裂解系统蛋白H Glycine cleavage system protein H |
0.668 | 3.10E−03 |
| ENSGALG00000008317 | SDSL | 丝氨酸脱水酶样Serine dehydratase like |
0.666 | 3.87E−03 |
| ENSGALG00000023436 | HDC | 组氨酸脱羧酶Histidine decarboxylase |
−1.122 | 3.90E−03 |
| ENSGALG00000015053 | GLDC | 甘氨酸脱氢酶Glycine dehydrogenase |
1.081 | 1.24E−02 |
| ENSGALG00000030187 | CAT | 过氧化氢酶Catalase | 0.650 | 3.44E−02 |
| ENSGALG00000025844 | AMT | 氨基甲基转移酶Aminomethyltransferase | 0.708 | 3.58E−02 |
GO分析评估了两组之间差异表达基因的功能富集(图 5),主要分布于三大类功能:生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)。涉及到细胞粘附、解剖结构形态发生、系统发育、肌肉系统过程、细胞对内源性刺激反应、肠道吸收、脂类消化、细胞对生长因子刺激反应的负调节、细胞表面、刷状缘、肌动蛋白丝束和含硫化合物结合等12个亚类功能。GO分析结果中,与脂肪代谢和肠道吸收相关的基因得到显著的功能富集,说明添加解淀粉芽孢杆菌BLCC1-0238会促进动物机体对营养物质的吸收和利用。
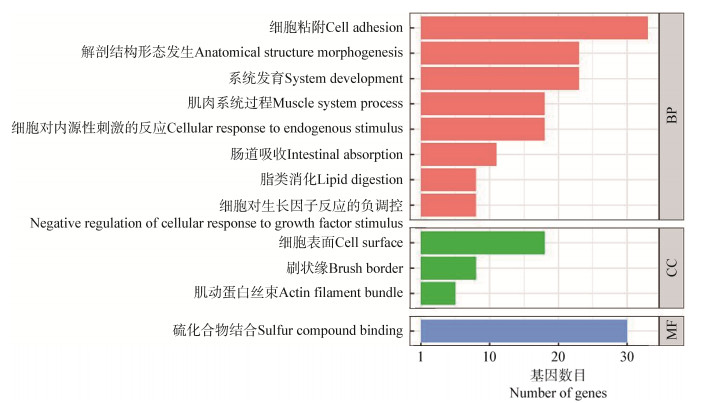
|
| 图 5 回肠粘膜差异表达基因功能聚类GO分析 Figure 5 GO analysis of differentially expressed genes in the ileum mucosa |
|
|
由图 6可见,主要有12个生物学代谢过程得到富集,包括:半乳糖代谢;视黄醇代谢;亚油酸代谢;甘氨酸、丝氨酸和苏氨酸代谢;淀粉和蔗糖代谢;血管平滑肌收缩;细胞色素P450-药物代谢;过氧化物酶体合成;细胞色素P450-外源生物代谢;戊糖和葡萄糖醛酸转换;初级胆汁酸生物合成;过氧化物酶体增殖物激活受体信号通路。该结果说明蛋鸡日粮中添加解淀粉芽孢杆菌BLCC1-0473,会调控肠道粘膜中碳水化合物代谢、氨基酸代谢、脂类消化和肠道吸收等生物学过程的相关信号通路。
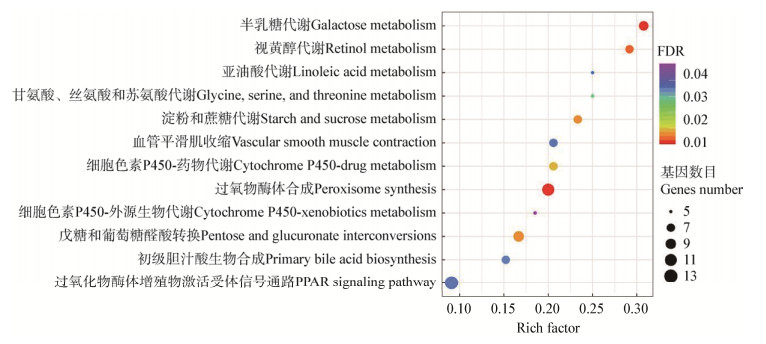
|
| 图 6 回肠粘膜差异表达基因KEGG通路分析 Figure 6 Enriched KEGG pathways based on differentially expressed genes in the ileum mucosa |
|
|
肠道微生物多样性对于蛋鸡适应环境和稳定生产性能至关重要[19-20]。本研究采用基因组学方法分析,发现在T组中微生物菌群多样性指数显著增加,有研究[21-22]表明这会提高蛋鸡的抗病能力和生产性能。同时,解淀粉芽孢杆菌BLCC1-0238显著增加了厚壁菌门的相对丰度,而降低了拟杆菌门的相对丰度,有研究[23-24]表示肠道菌群中厚壁菌门/拟杆菌门比例升高可能会提高肠道对营养吸收和能量转化能力。陈阳等研究表明梭杆菌门中一些菌属与机体胆固醇和总胆固醇的含量存在正相关,变形菌门包括很多条件性致病菌,如沙门氏菌、大肠杆菌等[25]。在本研究中,梭杆菌门和变形菌门的相对丰度与C组相比出现不同程度的降低,说明解淀粉芽孢杆菌BLCC1-0238的添加在一定程度上抑制了病原微生物的繁殖。
本研究T组中厚壁菌门中某些菌属相对丰度发生了改变,主要包括乳酸杆菌属、考拉杆菌属、瘤胃球菌属、厌氧棍状菌属和克里斯滕森氏菌。Biagi等指出乳酸杆菌属是动物肠道微环境中重要的益生菌之一,可参与调节微生物之间平衡,提高机体免疫力与抗病能力[26];Zhang等发现考拉杆菌属、瘤胃球菌属、厌氧棍状菌属在肠道内均可以产生短链脂肪酸,降低和改善肠道炎症[27];Sheng等指出反刍过程中瘤胃梭菌属的某些菌可提高饲料中纤维素和木质素的分解率[28];Goodrich等认为提高肠道内克里斯滕森氏菌的丰度对机体健康有益[29];上述菌属在本研究的T组中丰度增加,表明解淀粉芽孢杆菌BLCC1-0238的添加可使蛋鸡肠道内有益菌增加,改善肠道微环境。另外,脱硫弧菌属与肠炎、肠癌以及某些代谢疾病发生有关[29],在本研究的T组中其相对丰度的下降说明了解淀粉芽孢杆菌BLCC1-0238具有抑制有害菌繁殖的重要作用。
转录组学分析发现,解淀粉芽孢杆菌BLCC1-0238上调了与淀粉和蔗糖代谢、半乳糖代谢信号通路相关的基因表达,Goodrich等[29]表示这些信号通路有利于动物机体把淀粉、乳糖和蔗糖等物质转变为便于机体利用的葡萄糖。通过分析与碳水化合物代谢相关的差异表达基因,发现存在于肠上皮细胞的刷状边缘膜中的蔗糖酶-异麦芽糖酶、麦芽糖化酶的编码基因表达显著上调,Khan等[30]研究表明这些功能基因的上调有助于机体对营养物质的吸收。乳糖酶的基因表达也呈现显著上调,乳糖酶亚基是唯一已知的能够将乳糖降解为葡萄糖和半乳糖的β-半乳糖苷酶,Khan等[30]通过转录组分析发现这些酶的上调表达会增加机体对碳水化合物的消化吸收能力,从而降低料蛋比。另外,醛缩酶果糖二磷酸盐B和葡萄糖-6-磷酸酶催化亚单位编码基因也在T组中得到显著上调,前者是糖酵解过程的关键酶,后者是糖异生过程的关键酶,而且还具有细胞和生长因子的活性,研究[15]证实这两个酶的表达上调会为处于产蛋期的蛋鸡提供更多的能量。与三羧酸循环密切相关的乙酰辅酶A羧化酶β是脂肪酸代谢过程中的关键酶,其编码基因表达下调会减少脂肪酸的合成;与糖原分解与合成密切相关的己糖激酶1编码基因的下调会减弱糖原的分解,而果糖二磷酸酶1和葡萄糖合成酶2的上调会增强糖原的合成;这些基因表达的改变说明,解淀粉芽孢杆菌BLCC1-0238的添加为保证蛋鸡的持续产蛋提供了能量基础。在本研究中,与葡萄糖吸收利用相关的溶质载体家族2成员2的表达基因在益生菌添加组也出现了显著上调,研究[15, 17, 31]表明该基因的上调会促进蛋鸡对葡萄糖的吸收利用。
KEGG分析结果显示,不仅甘氨酸、丝氨酸和苏氨酸代谢通路被显著富集,而且参与该通路的甘氨酸裂解系统蛋白H、甘氨酸脱氢酶、丝氨酸脱水酶样和氨基甲基转移酶的编码基因也表现为显著上调,这表明解淀粉芽孢杆菌BLCC1-0238会促进甘氨酸、丝氨酸和苏氨酸代谢为机体提供更多的中间代谢产物。另外,编码过氧化氢酶的基因显著上调,有研究[32-33]表明过氧化氢酶增加会提高机体的抗氧化能力;组氨酸脱羧酶的编码基因却表现为显著下调,研究[34]表明该酶在机体内的含量降低会减少组胺的生成,从而减少机体发生过敏性炎症。GO分析的结果表明,与脂肪代谢和肠道吸收相关的基因也得到了显著的功能富集,这说明添加解淀粉芽孢杆菌BLCC1-0238会促进动物机体对营养物质的吸收和利用。
综上所述,本研究从基因组学和转录组学两个角度分析表明,日粮中添加解淀粉芽孢杆菌BLCC1-0238可以增加盲肠微生物菌群多样性,调控肠道粘膜中碳水化合物代谢、氨基酸代谢、脂类消化和肠道吸收等生物学过程相关基因的表达,增强肠道物质代谢与营养吸收能力,从而提高蛋鸡生产性能和蛋品质。然而,下一步研究中还应该进一步探讨微生物功能基因的丰度及其表达量的组学变化,这样会更加深入地揭示益生菌的作用机理。
| [1] |
Zhu YG, Johnson TA, Su JQ, et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(9): 3435-3440. DOI:10.1073/pnas.1222743110 |
| [2] |
Chi XH, Feng YJ, Zheng BW. Transmission and genetic mechanism of drug-resistant bacteria in multi-sectors[J]. Microbiology China, 2019, 46(2): 311-318. (in Chinese) 迟小惠, 冯友军, 郑焙文. 耐药菌在人-动物-环境中的传播和遗传机制[J]. 微生物学通报, 2019, 46(2): 311-318. |
| [3] |
Castanon JIR. History of the use of antibiotic as growth promoters in European poultry feeds[J]. Poultry Science, 2007, 86(11): 2466-2471. DOI:10.3382/ps.2007-00249 |
| [4] |
Sanders ME. Probiotics: definition, sources, selection, and uses[J]. Clinical Infectious Diseases, 2008, 46(S2): S58-S61. DOI:10.1086/523341 |
| [5] |
Zhang ZF, Kim IH. Effects of probiotic supplementation in different energy and nutrient density diets on performance, egg quality, excreta microflora, excreta noxious gas emission, and serum cholesterol concentrations in laying hens[J]. Journal of Animal Science, 2013, 91(10): 4781-4787. DOI:10.2527/jas.2013-6484 |
| [6] |
Bubnov RV, Babenko LP, Lazarenko LM, et al. Specific properties of probiotic strains: relevance and benefits for the host[J]. EPMA Journal, 2018, 9(2): 205-223. DOI:10.1007/s13167-018-0132-z |
| [7] |
Adhikari P, Lee CH, Cosby DE, et al. Effect of probiotics on fecal excretion, colonization in internal organs and immune gene expression in the ileum of laying hens challenged with Salmonella enteritidis[J]. Poultry Science, 2019, 98(3): 1235-1242. DOI:10.3382/ps/pey443 |
| [8] |
Du R, Wang BH, Luo YL, et al. Advance in studying the effect of probiotics on gastrointestinal tract microorganism to improve meat quality[J]. Microbiology China, 2019, 46(9): 2378-2385. (in Chinese) 杜瑞, 王柏辉, 罗玉龙, 等. 益生菌调控胃肠道菌群改善肉品质的研究进展[J]. 微生物学通报, 2019, 46(9): 2378-2385. |
| [9] |
Markowiak P, Ślizewska K. Effects of probiotics, prebiotics, and synbiotics on human health[J]. Nutrients, 2017, 9(9): 1021. DOI:10.3390/nu9091021 |
| [10] |
Johnson-Henry KC, Abrahamsson TR, Wu RY, et al. Probiotics, prebiotics, and synbiotics for the prevention of necrotizing enterocolitis[J]. Advances in Nutrition, 2016, 7(5): 928-937. DOI:10.3945/an.116.012237 |
| [11] |
Chaiyawan N, Taveeteptaikul P, Wannissorn B, et al. Characterization and probiotic properties of Bacillus strains isolated from broiler[J]. The Thai Journal of Veterinary Medicine, 2010, 40(2): 207-214. |
| [12] |
Shivaramaiah S, Pumford NR, Morgan MJ, et al. Evaluation of Bacillus species as potential candidates for direct-fed microbials in commercial poultry[J]. Poultry Science, 2011, 90(7): 1574-1580. DOI:10.3382/ps.2010-00745 |
| [13] |
Ahmed ST, Islam M, Mun HS, et al. Effects of Bacillus amyloliquefaciens as a probiotic strain on growth performance, cecal microflora, and fecal noxious gas emissions of broiler chickens[J]. Poultry Science, 2014, 93(8): 1963-1971. DOI:10.3382/ps.2013-03718 |
| [14] |
Lei XJ, Ru YJ, Zhang HF. Effect of Bacillus amyloliquefaciens-based direct-fed microbials and antibiotic on performance, nutrient digestibility, cecal microflora, and intestinal morphology in broiler chickens[J]. Journal of Applied Poultry Research, 2014, 23(3): 486-493. DOI:10.3382/japr.2014-00965 |
| [15] |
Zhou YF, Li S, Pang QH, et al. Bacillus amyloliquefaciens BLCC1-0238 can effectively improve laying performance and egg quality via enhancing immunity and regulating reproductive hormones of laying hens[J]. Probiotics and Antimicrobial Proteins, 2020, 12(1): 246-252. |
| [16] |
Liu YH, Jia YX, Liu C, et al. RNA-seq transcriptome analysis of breast muscle in Pekin ducks supplemented with the dietary probiotic Clostridium butyricum[J]. BMC Genomics, 2018, 19(1): 844. DOI:10.1186/s12864-018-5261-1 |
| [17] |
Cheng Y. Effect of Bacillus amyloliquefaciens TL on the gene expression of the broiler's ileum[D]. Wuhan: Doctoral Dissertation of Huazhong Agricultural University, 2018 程杨.解淀粉芽孢杆菌TL对肉鸡回肠组织基因表达的影响[D].武汉: 华中农业大学博士学位论文, 2018 |
| [18] |
Guo JR, Dong XF, Liu S, et al. High-throughput sequencing reveals the effect of Bacillus subtilis CGMCC 1.921 on the cecal microbiota and gene expression in ileum mucosa of laying hens[J]. Poultry Science, 2018, 97(7): 2543-2556. DOI:10.3382/ps/pey112 |
| [19] |
Abdelqader A, Al-Fataftah AR, Daş G. Effects of dietary Bacillus subtilis and inulin supplementation on performance, eggshell quality, intestinal morphology and microflora composition of laying hens in the late phase of production[J]. Animal Feed Science and Technology, 2013, 179(1/4): 103-111. |
| [20] |
Mountzouris KC, Tsitrsikos P, Palamidi I, et al. Effects of probiotic inclusion levels in broiler nutrition on growth performance, nutrient digestibility, plasma immunoglobulins, and cecal microflora composition[J]. Poultry Science, 2010, 89(1): 58-67. DOI:10.3382/ps.2009-00308 |
| [21] |
Zhang YW, Ma WF, Zhang ZD, et al. Effects of Enterococcus faecalis on egg production, egg quality and caecal microbiota of hens during the late laying period[J]. Archives of Animal Nutrition, 2019, 73(3): 208-221. DOI:10.1080/1745039X.2019.1591128 |
| [22] |
Hansen J, Gulati A, Sartor RB. The role of mucosal immunity and host genetics in defining intestinal commensal bacteria[J]. Current Opinion in Gastroenterology, 2010, 26(6): 564-571. DOI:10.1097/MOG.0b013e32833f1195 |
| [23] |
Bäckhed F, Ding H, Wang T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723. DOI:10.1073/pnas.0407076101 |
| [24] |
Ley RE, Turnbaugh PJ, Klein S, et al. Microbial ecology: human gut microbes associated with obesity[J]. Nature, 2006, 444(7122): 1022-1023. DOI:10.1038/4441022a |
| [25] |
Chen Y, Lu J, Zhu SM, et al. Effect of Gegen Qinlian Decoction and it's different compatibility groups on gut microbiota in rats with acute enteritis based on high-throughput sequencing[J]. China Journal of Chinese Materia Medica, 2020, 45(6): 1406-1417. (in Chinese) 陈阳, 陆杰, 朱思敏, 等. 基于高通量测序技术研究葛根芩连汤及其配伍对急性肠炎大鼠肠道菌群多样性的影响[J]. 中国中药杂志, 2020, 45(6): 1406-1417. |
| [26] |
Biagi E, Franceschi C, Rampelli S, et al. Gut microbiota and extreme longevity[J]. Current Biology, 2016, 26(11): 1480-1485. DOI:10.1016/j.cub.2016.04.016 |
| [27] |
Zhang Y, Ma C, Zhao J, et al. Lactobacillus casei Zhang and vitamin K2 prevent intestinal tumorigenesis in mice via adiponectin-elevated different signaling pathways[J]. Oncotarget, 2017, 8(15): 24719-24727. DOI:10.18632/oncotarget.15791 |
| [28] |
Sheng T, Zhao L, Gao LF, et al. Lignocellulosic saccharification by a newly isolated bacterium, Ruminiclostridium thermocellum M3 and cellular cellulase activities for high ratio of glucose to cellobiose[J]. Biotechnology for Biofuels, 2016, 9: 172. DOI:10.1186/s13068-016-0585-z |
| [29] |
Goodrich JK, Waters JL, Poole AC, et al. Human genetics shape the gut microbiome[J]. Cell, 2014, 159(4): 789-799. DOI:10.1016/j.cell.2014.09.053 |
| [30] |
Khan S, Wu SB, Roberts J. RNA-sequencing analysis of shell gland shows differences in gene expression profile at two time-points of eggshell formation in laying chickens[J]. BMC Genomics, 2019, 20(1): 89. DOI:10.1186/s12864-019-5460-4 |
| [31] |
Li H, Gu Z, Yang L, et al. Transcriptome profile analysis reveals an estrogen induced LncRNA associated with lipid metabolism and carcass traits in chickens (Gallus Gallus)[J]. Cellular Physiology and Biochemistry, 2018, 50(5): 1638-1658. DOI:10.1159/000494785 |
| [32] |
Lobo V, Patil A, Phatak A, et al. Free radicals, antioxidants and functional foods: impact on human health[J]. Pharmacognosy Reviews, 2010, 4(8): 118-126. DOI:10.4103/0973-7847.70902 |
| [33] |
Xie T, Bai SP, Zhang KY, et al. Effects of Lonicera confusa and Astragali Radix extracts supplementation on egg production performance, egg quality, sensory evaluation, and antioxidative parameters of laying hens during the late laying period[J]. Poultry Science, 2019, 98(10): 4838-4847. DOI:10.3382/ps/pez219 |
| [34] |
Koren O, Spor A, Felin J, et al. Human oral, gut, and plaque microbiota in patients with atherosclerosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(S1): 4592-4598. |
 2020, Vol. 47
2020, Vol. 47