扩展功能
文章信息
- 潘俊潼, 寇凤雨, 刘瑞艳, 王一然, 赵辉
- PAN Jun-Tong, KOU Feng-Yu, LIU Rui-Yan, WANG Yi-Ran, ZHAO Hui
- 常压室温等离子体-紫外复合诱变选育β-法尼烯高产菌株
- Breeding of high β-farnesene producing strain by ARTP-UV combined mutation
- 微生物学通报, 2020, 47(2): 542-551
- Microbiology China, 2020, 47(2): 542-551
- DOI: 10.13344/j.microbiol.china.190492
-
文章历史
- 收稿日期: 2019-06-11
- 接受日期: 2019-10-25
- 网络首发日期: 2019-11-22
2. 山东泓达生物科技有限公司 山东 临沂 276400
2. Shandong Hongda Biotechnology Co. Ltd., Linyi, Shandong 276400, China
β-法尼烯(β-farnesene),又称β-金合欢烯,是一种由3个异戊二烯组成的链状倍半萜烯化合物,在日化、农业、化工、能源和医药等领域有着广泛应用。在日化行业,β-法尼烯可用于日化香精配方中,要求用量控制在20%以内[1]。在农业领域,β-法尼烯在植物病虫害防治方面也起到了非常重要的作用[2];在化工领域,β-法尼烯用作橡胶添加剂可赋予橡胶较高的塑性,防止橡胶发生硬化,并且在低温下仍可使胶料保持优异的柔韧性[3];在能源领域,β-法尼烯是可替代石油、柴油和混合型航空燃油的可再生烯烃[4];在医药领域,β-法尼烯是合成维生素E的前体物质异植物醇的重要原料[5]。
β-法尼烯的合成方法有化学合成法[6-7]和微生物合成法[8-13]。微生物法合成β-法尼烯相比化学法具有反应条件温和、环境污染小、可再生等优势,因此成为国内外的研究热点。目前,国内外研究者主要利用对大肠杆菌和酵母等基因工程菌进行代谢途径的改造来获得高产β-法尼烯的基因工程菌。例如,Zhu等[9]利用酿酒酵母来源的甲羟戊酸途径在体外重建了β-法尼烯的生物催化合成体系,并采用质谱分析技术监测了发酵过程中代谢产物的含量变化,通过摇瓶发酵96 h,β-法尼烯产量最终可达1.1 g/L。You等[10]在研究中发现过表达异戊烯基二磷酸异构酶(IDI)和法尼基二磷酸合酶(FDPS)可以降低发酵过程中异戊烯焦磷酸(IPP)的积累,从而进一步提高β-法尼烯的产量,其构建的大肠杆菌基因工程菌在7 L发酵罐发酵120 h,β-法尼烯产量最高可达8.74 g/L。Meadows等[11]通过在酵母代谢途径中引入新的底物代谢途径,增强了菌株的氧化还原平衡,减少了与乙酰辅酶A生物合成有关的碳源和能量损失,将β-法尼烯的生产率提高至2.24 g/(L·h)。综上可见,目前国内外对β-法尼烯生产菌的研究主要集中在基因工程改造方面,使用诱变技术用于β-法尼烯高产菌株的选育鲜见报道。
高产菌种的选育是企业降低发酵成本、提高产品市场竞争力的有效手段之一[14-15]。传统菌种选育方法有化学诱变剂(烷化剂、碱基类似物及亚硝酸等)和物理诱变(紫外线、X射线及快中子等)[16-18]。然而,长期重复使用传统的诱变手段往往导致突变效率低、突变谱窄和抗性饱和等难题[19-20]。常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变技术是近年发展起来的新诱变技术,具有操作便捷、突变率高、安全性好等优点,广泛应用于工业微生物诱变育种领域[21-24]。此方法以氦气为工作气体的离子体源中富含多种活性能量粒子,这些活性粒子能够对微生物的遗传物质造成损伤,并诱发生物细胞启动SOS修复机制[25-26]。本研究以产β-法尼烯的E. coli EC-16为出发菌株,通过采用ARTP诱变和紫外线诱变的复合诱变技术,并利用β-法尼烯代谢合成途径中的前体物质异戊烯焦磷酸(IPP)作为筛选压力,进一步提高突变株正突变率,进行组合诱变筛选,以期最终获得一株遗传性状稳定的β-法尼烯高产突变株。
1 材料与方法 1.1 材料 1.1.1 菌种大肠杆菌基因工程菌EC-16 (Escherichia coli EC-16)由本实验室保藏。
1.1.2 主要试剂和仪器酵母抽提物和胰蛋白胨均购自英国Oxoid公司;琼脂粉、柠檬酸、柠檬酸铁胺、甘油、葡萄糖均购自Solarbio公司;正十二烷为分析纯,购自天津市科密欧化学试剂有限公司;其他常规试剂均为国产分析纯,均购自国药集团化学试剂有限公司;气相色谱所用试剂为色谱纯。
诱变育种仪,无锡源清天木生物科技有限公司;气相色谱系统(GC),氢火焰离子化检测器(FID),色谱柱为HP-5 (30 m×0.32 mm×0.25 μm)石英毛细管柱,Agilent Technologies公司;722S分光光度计,上海精密科学仪器有限公司。
1.1.3 培养基斜面培养基(g/L):胰蛋白胨10.0,酵母抽提物5.0,NaCl 10.0,琼脂粉15.0,pH 7.2。
分离培养基(g/L):胰蛋白胨10.0,酵母抽提物5.0,NaCl 10.0,异戊烯焦磷酸盐0.000 9,琼脂粉15.0,pH 7.2。
1 000×微量元素储液(g/L):(NH4)6Mo7O2·4H2O 3.7,ZnSO4·7H2O 2.9,H3BO4 24.7,CuSO4·5H2O 2.5,MnCl2·4H2O 15.8。
种子培养基(g/L):柠檬酸2.1,柠檬酸铁胺0.3,酵母抽提物5.0,甘油20.0,MgSO4 1.5,K2HPO4·3H2O 9.8,微量元素储液0.1%,pH 6.5。
发酵培养基(g/L):柠檬酸2.1,柠檬酸铁胺0.3,酵母抽提物5.0,甘油20.0,葡萄糖5.0,MgSO4 1.5,K2HPO4·3H2O 9.8,微量元素储液1 mL,pH 6.5。
1.2 方法 1.2.1 制备菌悬液选取恒温培养箱内37 ℃培养2 d的E. coli EC-16斜面菌苔,用10 mL无菌生理盐水将菌苔洗下,放入盛有玻璃珠的无菌锥形瓶中,置于30 ℃、250 r/min的振荡装置上振荡10 min使菌体分散,制备菌悬液。将菌悬液3 000 r/min离心15 min,弃上清液。菌体用无菌生理盐水悬浮并洗涤2-3次,采用细菌计数板计数,调整菌悬液浓度约为108个/mL,备用。
1.2.2 等离子体诱变取20 μL菌悬液涂布在无菌不锈钢载片上(ARTP仪专用配件),严格按照ARTP-M型诱变育种仪的操作流程,以氮气为工作气体,设定功率为120 W,处理温度为室温,通气量为10 SLPM (standard liters per minute),等离子体发射源与样品间的距离为5 mm,处理时间分别设置为20、25、30、35、40、50、60和70 s。处理液用生理盐水稀释10倍后涂布于斜面培养基上,未经ARTP诱变处理的菌悬液涂布平板作为对照,然后置于37 ℃培养箱中培养2 d,最后采用菌落计数法计算致死率。
1.2.3 紫外线诱变取3 mL出发菌株E. coli EC-16的菌悬液加入到直径60 mm带有磁力搅拌转子的无菌平皿中,在搅拌状态下用紫外灯(功率18 W,灯距30 cm)分别照射20、30、40、50、60、80、100和120 s。将经紫外线照射后的菌悬液用生理盐水稀释10倍后涂布于斜面培养基上,未经紫外线处理的菌悬液用生理盐水稀释10倍后涂布平板作为对照,然后置于37 ℃培养箱中避光培养2 d,最后采用菌落计数法计算致死率。
1.2.4 复合诱变出发菌株E. coli EC-16菌悬液经紫外灯诱变处理后,立即进行ARTP诱变处理。将经复合诱变处理后的菌悬液用生理盐水稀释10倍后涂布于斜面培养基上,未经复合诱变处理的菌悬液用生理盐水稀释10倍后涂布于斜面培养基上作为对照,然后置于37 ℃培养箱中避光培养2 d,最后采用菌落计数法计算致死率。
1.2.5 异戊烯焦磷酸的平板抗性筛选用无菌生理盐水将出发菌株E. coli EC-16的斜面菌苔洗下制成菌悬液,用无菌生理盐水将其稀释至10–5-10–7稀释度,分别取0.1 mL菌悬液依次涂布于含0、0.3、0.6、0.9、1.2、1.5、1.8和2.1 mg/L异戊烯焦磷酸的固体培养基上,然后置于37 ℃培养箱中培养2 d,最后观察菌株生长情况。
1.2.6 筛选方法(1) 平板初筛:将经过ARTP-紫外复合诱变处理的菌悬液用生理盐水稀释后涂布于含有一定量的异戊烯焦磷酸分离筛选培养基上,置于37 ℃培养箱中避光培养3 d。挑取平板上最先生长出的单菌落接种于斜面培养基上,37 ℃培养2 d。
(2) 摇瓶复筛:选取生长良好的斜面,用接种铲刮取1-2 cm2的菌苔接种于种子培养基中,37 ℃、220 r/min摇床培养12 h,取5 mL培养菌液接种于100 mL的发酵培养基中,37 ℃、220 r/min振荡培养至OD600为0.6-0.8时,加入终浓度为0.1 mmol/L的IPTG诱导表达。随后加入正十二烷作为β-法尼烯的萃取剂,萃取剂的用量要达到体积分数为20%。设定培养温度为30 ℃,发酵72 h后测定β-法尼烯的含量,然后挑选出发酵产物含量高的突变株接种于斜面培养基上,37 ℃培养2 d。
(3) 发酵罐验证:选取生长良好的斜面,用接种铲刮取1-2 cm2的菌苔接种于种子培养基,37 ℃、220 r/min摇床培养18 h,然后按照8%的接种量接种于15 L发酵罐中,设置发酵工艺参数分别为:发酵温度为30 ℃,初始转速250 r/min,根据溶氧变化逐步调整至500 r/min,通气量1:1,发酵96 h,最后测定β-法尼烯的含量。
1.2.7 分析方法(1) 诱变菌株的致死率(%)=(未诱变平板菌落数–诱变后平板菌落数)/未诱变平板菌落数×100。
(2) 以诱变菌株的发酵单位为标准计算突变率,以β-法尼烯的发酵产量提高20%以上的突变株定义为正突变株,正突变率(%)=正突变菌落数/分离培养基平板总菌落数×100。
(3) 分析样品的制备:发酵结束后,取一定体积的发酵液,用稀硫酸调节发酵液的pH,随后向发酵液中加入阳离子型高分子改性絮凝剂至终浓度为0.01 g/L,250 r/min搅拌3-5 min,于室温条件下静置1 h,静置分层,然后3 000 r/min离心5 min取上层有机相。
(4) β-法尼烯检测方法:取经过预处理后发酵液的有机相,采用GC外标法进行β-法尼烯的含量测定。气相色谱条件:起始柱温80 ℃,保留1 min,然后以10 ℃/min升至250 ℃,保留1 min,进样口温度250 ℃,压力0.1 MPa,设定恒流模式,进样量1 μL,柱流量1 mL/min,样品注入分流比25:1 (体积比),检测器(FID)温度260 ℃,以氮气作为载气。
2 结果与分析 2.1 等离子体诱变剂量的确定对出发菌株E. coli EC-16进行了ARTP诱变后,绘制了致死率和正突变率曲线,结果如图 1所示。诱变处理时间,即等离子体的诱变剂量和致死率之间存在正相关性,随着处理时间的延长,菌株的致死率明显升高。当诱变处理时间为30 s时,致死率为75.04%;当诱变处理时间达到40 s时,致死率为92.14%;当诱变处理时间延长至60 s以后,致死率接近100%。有研究表明,对于高产菌株诱变的处理剂量所导致的致死率控制在70%-90%时,正突变率最高[27-28],但是考虑到突变具有随机性和不确定性,其致死率和正突变率之间的作用机制尚有待研究,因此选取致死率在50%-95%之间的4个诱变时间点测定其正突变率。结果如图 1所示,当诱变处理时间为30 s时致死率为75.04%,此时正突变率最高为13.41%。根据致死率和正突变率曲线,综合考虑复合诱变后能够获得足够数量的单菌落数量,本实验复合诱变采用的ARTP诱变处理时间选取30 s。
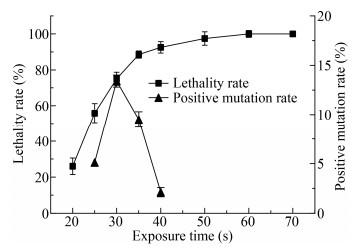
|
| 图 1 ARTP诱变对菌株致死率和正突变率的影响(n=3) Figure 1 Effects of ARTP treatment on lethality rate and positive mutagenesis rate (n=3) |
|
|
对出发菌株E. coli EC-16进行了紫外诱变后,绘制了致死率和正突变率曲线,结果如图 2所示。诱变处理时间,即紫外线的诱变剂量跟致死率之间也存在正相关性,随着处理时间的延长,菌株的致死率明显升高。当照射时间为40 s时,致死率为43.55%;当照射时间为50 s时,致死率为70.46%;当照射时间为60 s时,致死率为85.58%;当照射时间延长至100 s以后,致死率可达100%。研究表明,紫外线的处理剂量使微生物的致死率在70%-90%之间时正突变率较高[27-28]。因此选择致死率在40%-95%之间的4个时间点进行了正突变率测定,结果表明,当紫外线照射时间为50 s时致死率为70.46%,此时正突变率最高为11.88%。综合考虑复合诱变后获得足够的菌株数量,本实验复合诱变的紫外线照射时间选取50 s。
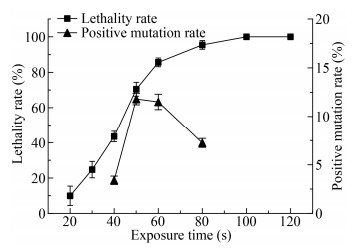
|
| 图 2 紫外诱变对菌株致死率和正突变率的影响(n=3) Figure 2 Effects of UV treatment on lethality rate and positive mutagenesis rate (n=3) |
|
|
对出发菌株E. coli EC-16的菌悬液进行紫外线照射50 s后,再进行ARTP诱变处理30 s,复合诱变处理后的致死率为94.71%。由于ARTP和紫外线对DNA分子进行诱变的作用原理不同,因此引起的突变位点也就不同,ARTP-紫外复合诱变不仅可以弥补单因子诱变出现的热点饱和[29],还可以弥补DNA分子对单因子诱变的不亲和性而产生无增变效应[30],进而大大提高诱变的效果。
2.4 异戊烯焦磷酸对菌株生长的影响虽然菌种通过ARTP-紫外复合诱变发生了突变,但是突变率相对于整体而言仍处于较低水平,并且突变体中大部分是负突变或无义突变,如果想得到产量提高的正突变菌种,就需要进行大量的筛选工作。为了解决筛选工作量大、正突变率低的问题,以β-法尼烯代谢合成途径中的前体物质异戊烯焦磷酸为筛选压力,对E. coli EC-16的突变菌株进行筛选,将不同剂量的异戊烯焦磷酸加入到分离培养基平板中,观察菌株对不同浓度异戊烯焦磷酸的耐受情况,平板中菌株的生长情况如图 3所示。根据图 3计算了不同质量浓度的异戊烯焦磷酸对菌株致死率的影响,结果如表 1所示。
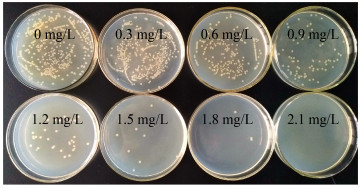
|
| 图 3 不同质量浓度的异戊烯焦磷酸对菌株生长的影响 Figure 3 Effects of different concentrations of IPP on the growth of strains |
|
|
| 异戊烯焦磷酸浓度 IPP (mg/L) |
致死率 Lethality rate (%) |
| 0.0 | 0.00 |
| 0.3 | 3.88 |
| 0.6 | 51.29 |
| 0.9 | 82.97 |
| 1.2 | 93.10 |
| 1.5 | 98.06 |
| 1.8 | 99.35 |
| 2.1 | 100.00 |
从图 3中可以看出,异戊烯焦磷酸能够抑制出发菌株E. coli EC-16的生长。在低质量浓度(0.3 mg/L)时,抑制作用不明显,此时致死率只有3.88% (表 1)。当异戊烯焦磷酸的质量浓度达到0.6 mg/L时,菌落数明显减少,生长受到明显的抑制,此时致死率为51.29%;当异戊烯焦磷酸的质量浓度达到1.5 mg/L时,此时致死率达到98.06%,菌落数大幅度减少;若继续增大异戊烯焦磷酸的浓度至2.1 mg/L时,菌株致死率达到100%,菌株全部停止生长。因此选取在分离培养基平板中添加0.9 mg/L的异戊烯焦磷酸作为分离培养基的筛选模型,根据表 1数据,在该浓度下菌株的致死率为82.97%,该致死剂量既保证了平板中菌株的生长量,又能够维持平板中一定的筛选压力,便于筛选。
2.5 等离子体-紫外复合诱变选育结果取紫外线照射50 s和ARTP诱变处理30 s的复合诱变后菌悬液,经0.9 mg/L的异戊烯焦磷酸平板初筛。经过5轮筛选,最终挑选30个突变菌株进行了摇瓶复筛,β-法尼烯的产量如图 4所示。结果表明:经过ARTP-紫外复合诱变,配合异戊烯焦磷酸分离平板的理性化初筛,突变菌株的正突变率达到了43.30%,分别筛选出3株高产菌株HVK-9、HVK-16和HVK-18,β-法尼烯的产量依次为2.46、1.84和2.11 g/L,相比出发菌株的β-法尼烯产量(0.98 g/L)分别提高了151.02%、87.76%和115.31%。
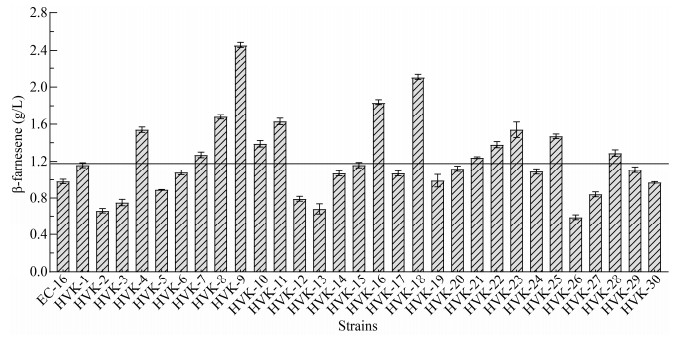
|
| 图 4 复合诱变突变株β-法尼烯产量(n=3) Figure 4 β-farnesene production of the mutants on ARTP-UV treatment (n=3) 注:图中横线标明的是β-法尼烯的产量相对于出发菌株E. coli EC-16提高20%的对应处. Note: The solid line indicated the position where β-farnesene production were increased by 20% compared to the original strain E. coli EC-16. |
|
|
将出发菌株E. coli EC-16和摇瓶筛选得到的3株突变菌株进行了发酵罐高密度发酵,设定发酵温度为30 ℃,初始转速250 r/min,通气量1:1,发酵过程中取样,稀释适当倍数后测定OD600,并对培养时间作图绘制生长曲线,对照菌为出发菌株E. coli EC-16。如图 5所示,3株突变菌株在对数期的菌体长势均比出发菌株E. coli EC-16要高,但最终菌体密度比较接近。3株突变菌株相比出发菌株更快地到达稳定期,从而更有利于菌体进行次级代谢反应。发酵96 h后采用GC测定β-法尼烯的含量,如图 6所示,最终突变株HVK-9的β-法尼烯最高产量达到22.1 g/L,相比出发菌株提高了168.74%。

|
| 图 5 高密度发酵过程中出发菌株E. coli EC-16和突变株HVK-9、HVK-16、HVK-18的生长曲线 Figure 5 The growth curve of original strain E. coli EC-16 and mutants strains HVK-9, HVK-16, HVK-18 during high density fermentation |
|
|
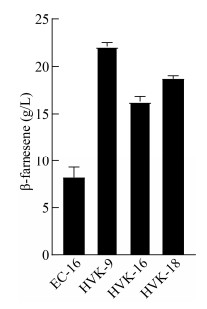
|
| 图 6 发酵96 h后出发菌株E. coli EC-16和突变株HVK-9、HVK-16、HVK-18的β-法尼烯产量 Figure 6 β-farnesene production in original strain E. coli EC-16 and mutant strains HVK-9, HVK-16, HVK-18 after 96 h fermentation |
|
|
为了检测突变株的遗传稳定性,将突变菌株HVK-9在LB斜面培养基中传代培养8代,并将各代斜面菌种经种子培养基活化后进行摇瓶发酵培养,37 ℃、220 r/min培养72 h,摇瓶发酵结束后检测β-法尼烯的产量,实验结果见表 2。结果表明,突变菌株HVK-9连续传代8代,β-法尼烯产量基本稳定,最高下降4.47%,说明复合诱变产生的突变菌株HVK-9具有良好的遗传稳定性。
| 传代培养次数 Generation |
β-法尼烯产量 β-farnesene production (g/L) |
β-法尼烯产量下降比率 Decline ratio of β-farnesene production (%) |
| 0 | 2.46±0.08 | - |
| 1 | 2.51±0.12 | - |
| 2 | 2.44±0.09 | 0.81 |
| 3 | 2.48±0.10 | - |
| 4 | 2.41±0.11 | 2.03 |
| 5 | 2.43±0.08 | 1.22 |
| 6 | 2.39±0.07 | 2.85 |
| 7 | 2.35±0.13 | 4.47 |
| 8 | 2.36±0.08 | 4.07 |
| 注:-:在传代过程中β-法尼烯的产量没有下降. Note: -: The production of β-farnene did not decrease during generation cultured. |
||
长期以来,诱变育种一直是提升发酵工程菌株产量最行之有效的方法之一,并且随着工业生物技术的进步正在不断地快速发展。ARTP诱变作为一种新兴的诱变方法,操作简单,安全性好,并且突变具有多样性,可以快速有效地获得细菌[31]、微藻[32]、真菌[33]、酵母[34]等典型微生物的高效突变株,尤其适用于代谢网络复杂的微生物[35-37],在一定程度上弥补了传统诱变方法的缺陷。本研究采用ARTP-UV复合诱变技术结合异戊烯焦磷酸抗性筛选模型,对β-法尼烯生产菌E. coli EC-16进行了诱变,降低了诱变选育的随机性,大大提高了筛选效率。研究结果表明,采用ARTP诱变30 s和紫外线照射50 s进行复合诱变,再结合异戊烯焦磷酸抗性筛选,最终突变菌株的正突变率可达43.30%。在该复合诱变筛选条件下,选育出了一株β-法尼烯高产突变菌株HVK-9,该突变株在发酵罐中放大培养后β-法尼烯的发酵单位达到22.1 g/L,比出发菌株提高了168.74%,并且通过8次连续传代仍具有良好的遗传稳定性。因此,突变株HVK-9有望成为工业化β-法尼烯发酵生产的优良菌种。
目前,国内外提高β-法尼烯产量的方法更多地关注于基因重组及基因的异源表达研究,鲜有使用诱变技术选育β-法尼烯高产菌株的报道。本研究采用的紫外诱变是最常用的传统诱变方法之一,其诱变原理是使DNA分子形成嘧啶二聚体,减弱双链间氢键的作用,引起双链结构扭曲变形,阻碍碱基间的正常配对;另外,二聚体还会妨碍双链的解开,因而影响DNA的复制和转录,引起生物体的突变或死亡[18]。ARTP诱变作为一种新兴的诱变方法具有明显的优越性,其诱变产生的等离子体富含各种化学活性粒子,能够对菌株细胞造成遗传物质的损伤、引起细胞膜通透性和蛋白质结构的改变等,细胞启动SOS修复机制,在修复过程中产生种类丰富的错配位点,最终获得大量稳定遗传的突变株[25-26]。所以,ARTP-UV复合诱变能够将紫外诱变和ARTP诱变两者优势互补,充分发挥各自的优点。因此,与基因工程育种相比,ARTP-UV复合诱变育种具有操作简单、突变率较高、突变谱广、遗传性状稳定等优势。然而,基于ARTP-UV复合诱变的技术平台,其配套的高通量筛选和检测方法才能真正体现出ARTP-UV复合诱变的核心优势。毫无疑问这将是我们下一步的重点研究方向。综上所述,本研究表明将ARTP-紫外复合诱变和异戊烯焦磷酸平板抗性筛选相结合,可以有效提高高产β-法尼烯突变株选育的效率,该复合诱变育种技术可为其他次级代谢产物的高产菌株选育提供良好的借鉴。
| [1] |
Liu SW. Technical Handbook of Synthetic Perfume Materials[M]. 2nd ed. Beijing: China Light Industry Press, 2009: 4-5. (in Chinese) 刘树文. 合成香料技术手册[M]. 2版. 北京: 中国轻工业出版社, 2009: 4-5. |
| [2] |
Zhou N, Zhu L, Lang ZH, et al. Effect of terpenoid in plants indirect defense[J]. China Biotechnology, 2010, 30(7): 101-107. (in Chinese) 周妮, 朱莉, 郎志宏, 等. 萜类化合物在植物间接防御中的作用[J]. 中国生物工程杂志, 2010, 30(7): 101-107. |
| [3] |
Zhu YK. The liquid farnesene rubber was first used in tires[J]. Rubber Science and Technology, 2017, 15(7): 41. (in Chinese) 朱永康. 液体金合欢烯橡胶首次用于轮胎[J]. 橡胶科技, 2017, 15(7): 41. |
| [4] |
George KW, Alonso-Gutierrez J, Keasling JD, et al. Isoprenoid drugs, biofuels, and chemicals — artemisinin, farnesene, and beyond[A]//Schrader J, Bohlmann J. Biotechnology of Isoprenoids[M]. Cham: Springer Cham, 2015: 355-389
|
| [5] |
Qing Y. Vitamin E imports intermediates, another new star or will rise?[J]. Chinese Feed Additives, 2017(4): 51-52. (in Chinese) 青易. 维生素E进口中间体另辟蹊径新星或将崛起?[J]. 中国饲料添加剂, 2017(4): 51-52. |
| [6] |
Susumu A, Takanao T, Sei O. Metal-assisted terpenoid synthesis Ⅱ. Catalytic conversion of isoprene into farnesene and its isomer, 2, 6-dimethyl-10-methylene-1, 6-trans, 11-dodecatriene[J]. Chemistry Letters, 1976, 5(5): 485-490. DOI:10.1246/cl.1976.485 |
| [7] |
Netscher T. Synthesis of vitamin E[J]. Vitamins & Hormones, 2007, 76: 155-202. |
| [8] |
Wang CL, Yoon SH, Jang HJ, et al. Metabolic engineering of Escherichia coli for α-farnesene production[J]. Metabolic Engineering, 2011, 13(6): 648-655. DOI:10.1016/j.ymben.2011.08.001 |
| [9] |
Zhu FY, Zhong XF, Hu MZ, et al. In vitro reconstitution of mevalonate pathway and targeted engineering of farnesene overproduction in Escherichia coli[J]. Biotechnology and Bioengineering, 2014, 111(7): 1396-1405. DOI:10.1002/bit.25198 |
| [10] |
You SP, Yin QD, Zhang JY, et al. Utilization of biodiesel by-product as substrate for high-production of β-farnesene via relatively balanced mevalonate pathway in Escherichia coli[J]. Bioresource Technology, 2017, 243: 228-236. DOI:10.1016/j.biortech.2017.06.058 |
| [11] |
Meadows AL, Hawkins KM, Tsegaye Y, et al. Rewriting yeast central carbon metabolism for industrial isoprenoid production[J]. Nature, 2016, 537(7622): 694-697. DOI:10.1038/nature19769 |
| [12] |
Sandoval CM, Ayson M, Moss N, et al. Use of pantothenate as a metabolic switch increases the genetic stability of farnesene producing Saccharomyces cerevisiae[J]. Metabolic Engineering, 2014, 25: 215-226. DOI:10.1016/j.ymben.2014.07.006 |
| [13] |
Dai QM, Zheng YH, Chen Q, et al. Method for synthesizing ketone compound by continuous cycle catalytic reaction: CN, CN105859534A[P]. 2016-08-17 (in Chinese) 代齐敏, 郑由浒, 陈强, 等.一种连续循环催化反应合成酮类化合物的方法: 中国, CN105859534A[P]. 2016-08-17 |
| [14] |
Cheng G, Xu JZ, Guo YF, et al. Breeding and fermentation optimization of L-arginine producing strains[J]. Microbiology China, 2016, 43(2): 360-369. (in Chinese) 程功, 徐建中, 郭燕风, 等. 常压室温等离子体诱变选育L-精氨酸生产菌及发酵条件优化[J]. 微生物学通报, 2016, 43(2): 360-369. |
| [15] |
Gong DF, Xiong YN, Sun JW, et al. Mutation breeding Schizochytrium strains producing high-yield DHA via atmospheric and room temperature plasmas[J]. China Oils and Fats, 2019, 44(3): 118-122. (in Chinese) 龚定芳, 熊祎楠, 孙佼文, 等. 常压室温等离子体诱变选育DHA高产菌株[J]. 中国油脂, 2019, 44(3): 118-122. |
| [16] |
Zhuang ZH. Molecular mechanism of mutation[J]. Chinese Science Bulletin, 1973(5): 205-212. (in Chinese) 庄增辉. 突变的分子机制[J]. 科学通报, 1973(5): 205-212. |
| [17] |
Wu J, Liu ZY, Zhu SM. Study on the astaxanthin-producing yeast Phaffia rhodozyma mutated by NTG[J]. Microbiology China, 2001, 28(2): 33-37. (in Chinese) 吴江, 刘子怡, 朱寿民. 烷化剂NTG诱变虾青素产生菌红法夫酵母的研究[J]. 微生物学通报, 2001, 28(2): 33-37. DOI:10.3969/j.issn.0253-2654.2001.02.010 |
| [18] |
Wang R, Guo ZY, Zeng CC. Repair of DNA lesions induced by ultraviolet irradiation[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2008, 12(2): 348-352. (in Chinese) 王睿, 郭周义, 曾常春. 紫外辐射引起DNA损伤的修复[J]. 中国组织工程研究与临床康复, 2008, 12(2): 348-352. DOI:10.3321/j.issn:1673-8225.2008.02.040 |
| [19] |
Wu MM, Liu HJ, Zhang JA, et al. Progress and prospective of high-yield strain mutagenesis[A]//China Bioindustry Convention[C]. Changsha: Chinese Society of Biotechnology, 2008: 104-105 (in Chinese) 武敏敏, 刘宏娟, 张建安, 等.高产菌种诱变的研究进展以及展望[A]//第二届中国生物产业大会论文集[C].长沙: 中国生物工程学会, 2008: 104-105 |
| [20] |
He XP. Research progress of molecular genetics and breeding of Saccharomyces cerevisiae in China in the past 40 years[J]. Microbiology China, 2014, 41(3): 450-458. (in Chinese) 何秀萍. 国内酿酒酵母分子遗传与育种研究40年[J]. 微生物学通报, 2014, 41(3): 450-458. |
| [21] |
Zhang X, Zhang C, Zhou QQ, et al. Quantitative evaluation of DNA damage and mutation rate by atmospheric and room-temperature plasma (ARTP) and conventional mutagenesis[J]. Applied Microbiology and Biotechnology, 2015, 99(13): 5639-5646. DOI:10.1007/s00253-015-6678-y |
| [22] |
Ren LY, Zhang ZL, Wang DS, et al. Screening of high-yield ascomycin-producing strain by UV combined with ARTP mutation[J]. Chinese Journal of Pharmaceuticals, 2018, 49(2): 181-185. (in Chinese) 任林英, 张祝兰, 王德森, 等. UV+ARTP复合诱变筛选子囊霉素高产菌株[J]. 中国医药工业杂志, 2018, 49(2): 181-185. |
| [23] |
Xu PF, Guo JL, Lü YC, et al. Screening of Trichosporon cutaneum with high-producing oil through atmospheric room temperature plasmas mutagenesis[J]. China Oils and Fats, 2019, 44(3): 123-127. (in Chinese) 许鹏飞, 郭金玲, 吕育财, 等. 常压室温等离子体诱变选育高产油脂皮状丝孢酵母的研究[J]. 中国油脂, 2019, 44(3): 123-127. |
| [24] |
Ban SD, Lin WT, Luo ZW, et al. Improving hydrogen production of Chlamydomonas reinhardtii by reducing chlorophyll content via atmospheric and room temperature plasma[J]. Bioresource Technology, 2019, 275: 425-429. DOI:10.1016/j.biortech.2018.12.062 |
| [25] |
Wu YN, Xing XH, Zhang C, et al. Recent progress on atmospheric and room temperature plasma (ARTP) biobreeding technology, instrumentation and its industrialization[J]. Biotechnology & Business, 2017(1): 37-45. (in Chinese) 吴亦楠, 邢新会, 张翀, 等. ARTP生物育种技术与装备研发及其产业化发展[J]. 生物产业技术, 2017(1): 37-45. DOI:10.3969/j.issn.1674-0319.2017.01.006 |
| [26] |
Morfill GE, Kong MG, Zimmermann JL. Focus on plasma medicine[J]. New Journal of Physics, 2009, 11(11): 115011. DOI:10.1088/1367-2630/11/11/115011 |
| [27] |
Zhuge J, Shen W. Industrial Microbial Breeding Science[M]. Beijing: Chemical Industry Press, 2006: 85-94. (in Chinese) 诸葛健, 沈微. 工业微生物育种学[M]. 北京: 化学工业出版社, 2006: 85-94. |
| [28] |
He GQ, Jia YM, Ding LX. Food Microbiology[M]. 2nd ed. Beijing: China Agricultural University Press, 2009: 95-120. (in Chinese) 何国庆, 贾英民, 丁立孝. 食品微生物学[M]. 2版. 北京: 中国农业大学出版社, 2009: 95-120. |
| [29] |
Xiao HQ, Li YZ, Lan LX. The combinated mutagesis of protoplast for screening highly-yield neutral proteinase strain[J]. China Brewing, 2008(15): 52-54. (in Chinese) 肖怀秋, 李玉珍, 兰立新. 复合诱变原生质体选育高产中性蛋白酶菌株[J]. 中国酿造, 2008(15): 52-54. |
| [30] |
Jiang YM. Microbial Breeding Experments[M]. Beijing: Science Press, 2012: 115-118. (in Chinese) 蒋咏梅. 微生物育种学实验[M]. 北京: 科学出版社, 2012: 115-118. |
| [31] |
Zheng MY, Cai YH, Lu ZQ, et al. Screening of high proline yield mutants by rapid mutation using atmospheric and room temperature plasmas[J]. Food and Fermentation Industries, 2013, 39(1): 36-40. (in Chinese) 郑明英, 蔡友华, 陆最青, 等. 常压室温等离子体快速诱变筛选高脯氨酸产率突变株[J]. 食品与发酵工业, 2013, 39(1): 36-40. |
| [32] |
Cao XP, Ai JN, Liu YN, et al. Mutagenic screening method of Isochrysis zhangjiangensis by atmospheric and room temperature plasmas[J]. China Biotechnology, 2014, 34(12): 84-90. (in Chinese) 曹旭鹏, 艾江宁, 刘亚男, 等. 基于常压室温等离子体技术的金藻诱变筛选方法[J]. 中国生物工程杂志, 2014, 34(12): 84-90. |
| [33] |
Wang YY, Zhu YY, Fu MH, et al. ARTP breeding of natamycin producing strain and optimization of the fermentation process[J]. Chinese Journal of Pharmaceuticals, 2016, 47(8): 999-1004. (in Chinese) 王耀耀, 朱研研, 付美红, 等. 那他霉素产生菌的ARTP诱变育种及发酵工艺优化[J]. 中国医药工业杂志, 2016, 47(8): 999-1004. |
| [34] |
Jin LH, Fang MY, Zhang C, et al. Operating conditions for the rapid mutation of the oleaginous yeast by atmospheric and room temperature plasmas and the characteristics of the mutants[J]. Chinese Journal of Biotechnology, 2011, 27(3): 461-467. (in Chinese) 金丽华, 方明月, 张翀, 等. 常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J]. 生物工程学报, 2011, 27(3): 461-467. |
| [35] |
Wang XB, Lu MS, Wang SJ, et al. The atmospheric and room-temperature plasma (ARTP) method on the dextranase activity and structure[J]. International Journal of Biological Macromolecules, 2014, 70: 284-291. DOI:10.1016/j.ijbiomac.2014.07.006 |
| [36] |
Wang SQ. Study on DHA fermentation technology by Schizochytrium limacinum SR21 and breeding of high-producing strain[D]. Wuxi: Master's Thesis of Jiangnan University, 2013 (in Chinese) 王申强.裂殖壶菌产DHA的发酵工艺研究及高产菌株选育[D].无锡: 江南大学硕士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10295-1013309195.htm |
| [37] |
Zhang J, Yan J, Dai M, et al. Composite mutagenesis and optimization on the fermentation medium of fusidic acid-producing strain[J]. Chemistry & Bioengineering, 2014, 31(6): 64-66. (in Chinese) 张佳, 闫敬, 戴梦, 等. 夫西地酸生产菌复合诱变育种及发酵培养基的优化研究[J]. 化学与生物工程, 2014, 31(6): 64-66. DOI:10.3969/j.issn.1672-5425.2014.06.016 |
 2020, Vol. 47
2020, Vol. 47




