扩展功能
文章信息
- 邓维琴, 陈功, 张其圣, 陈相杰, 范智义, 李洁芝, 李恒
- DENG Wei-Qin, CHEN Gong, ZHANG Qi-Sheng, CHEN Xiang-Jie, FAN Zhi-Yi, LI Jie-Zhi, LI Heng
- 传统郫县豆瓣酱中高产蛋白酶曲霉的筛选及应用
- Screening and application of high yield protease fungus from traditional fermented Pixian broad bean paste
- 微生物学通报, 2019, 46(9): 2272-2281
- Microbiology China, 2019, 46(9): 2272-2281
- DOI: 10.13344/j.microbiol.china.180693
-
文章历史
- 收稿日期: 2018-09-06
- 接受日期: 2018-12-07
- 网络首发日期: 2018-12-24
2. 四川东坡中国泡菜产业技术研究院 四川 眉山 620030
2. Sichuan Dongpo Chinese Paocai Industrial Technology Research Institute, Meishan, Sichuan 620030, China
米曲霉具有很强的蛋白酶合成能力[1-3],其蛋白酶在较广的pH范围内都具有活性,能耐受较高的温度[3-4],稳定性好;米曲霉还含有丰富的糖苷水解酶,可利用淀粉或纤维素等廉价原料高效生产蛋白酶[5-8],而且具有生产周期短、成本低廉等优势[9]。米曲霉通过蛋白酶作用将大分子蛋白质分解为蛋白胨、多肽及各种氨基酸(含有8种人体必需氨基酸),提高豆制品的营养价值、保健功效和消化率。米曲霉在豆瓣酱发酵过程中起着关键作用,但目前豆瓣酱行业大多采用的是酱油的酿造菌剂沪酿3.042,缺乏豆瓣酱的生产专用菌种。然而豆瓣酱发酵属于生料发酵,酱油发酵属于熟料发酵,二者发酵有较大区别,酱油发酵菌株用于豆瓣酱发酵无法取得最佳的发酵效果。
传统发酵食品中高产蛋白酶霉菌的筛选已有部分研究基础,其中康红霞等[10]从豆瓣酱中筛选出一株高产蛋白酶米曲霉,其在麸曲中培养后的干曲中蛋白酶达到4 351.68 U/g,王鹏昊等[11]从酒曲中筛选出一株产蛋白酶和淀粉酶能力都较强的米曲霉。王栋[12]研究证明高浓度氯化钠可以提高米曲霉F0899分泌蛋白酶的热稳定性,同时还可提高中性蛋白酶在酸性条件下的稳定性。在沪酿3.042酱醪发酵初期添加米曲霉F0899分泌的耐高盐蛋白酶可以明显提高氨基态氮和游离氨基酸的含量,发酵两个月氨基态氮分别提高5.05%和4.55%。刘颖等[13]通过优化米曲霉制作豆瓣曲的制曲时间、浸豆时间、蒸豆时间、接菌量、制曲温度等条件,成曲中干基蛋白酶酶活力可达到839.87 U/g。
目前关于豆瓣酱专用米曲霉筛选的研究还不够系统,而且尚未见真正用于豆瓣酱发酵菌株的详细报道。本研究以自然发酵得到的霉瓣子和郫县豆瓣酱为原料,筛选传统酿造郫县豆瓣酱中高产蛋白酶的霉菌,相对于从其他环境筛选的菌株更适合豆瓣酱发酵体系,以期获得一种产孢子能力强、产蛋白酶能力强、适用于豆瓣酱生产的霉菌,提高甜瓣子氨基态氮含量,从而提高豆瓣酱品质。
1 实验材料 1.1 原料自然发酵成曲、自然发酵豆瓣酱来自郫县各农家自制产品;蚕豆、面粉购自温江区德通桥菜市场(柳河路);曲种(市售沪酿3.042)购自济宁玉园生物科技有限公司。
1.2 主要试剂和仪器主要试剂为国产分析纯,成都科龙化工有限公司。气质联用仪,Agilent公司;固相微萃取头及手柄,北京八方世纪科技有限公司;全自动氨基酸分析仪,日立公司;紫外分光光度计,上海欣茂仪器有限公司。
1.3 培养基琼脂粉、孟加拉红培养基购自北京陆桥生物技术有限公司。
酪蛋白培养基(蛋白酶初筛培养基) (g/L):酪蛋白10.0,牛肉浸粉10.0,Na2HPO4 2.0,NaCl 5.0,琼脂粉15.0。1×105 Pa灭菌20 min。
麸皮培养基:麸皮500 g,蒸馏水500 mL混匀,分装至500 mL锥形瓶,1×105 Pa灭菌1 h。
2 实验方法 2.1 高产蛋白酶霉菌的筛选 2.1.1 初筛取25 g样品加入装有225 mL无菌生理盐水的锥形瓶中,配制得到10−1 g/mL的稀释液,用无菌生理盐水分别稀释得到10−2、10−3、10−4、10−5 g/mL的样品,依次取200 μL稀释液涂布于孟加拉红平板,28 ℃培养48 h,再依次划线接种进行纯培养,直至菌株形态一致。采用酪蛋白平板水解透明圈法,将分离纯化后的菌株点植于酪蛋白平板,28 ℃培养48 h;挑取培养后产生透明圈较大的菌落划线于PDA斜面,28 ℃培养48 h,4 ℃保存。
2.1.2 复筛将初筛得到酪蛋白透明圈较大的菌株接种于麸皮培养基,30 ℃培养24 h后扣瓶,继续培养72 h,测定麸曲中霉菌生长量和蛋白酶酶活。各试验组均设置3个平行。蛋白酶酶活的测定参考国标SB/T 10317-1999[14]。霉菌生长量采用倾注培养法测定。取25 g样品置于装有225 mL无菌生理盐水的锥形瓶中,配制成10−1 g/mL的稀释液,依次稀释,取合适梯度的稀释液1 mL于无菌平皿中,采用PDA培养基倾注混匀,28 ℃培养36–48 h,分别计数。
2.2 高产蛋白酶霉菌制作甜瓣子品质比较 2.2.1 甜瓣子的制备(1) 浸豆:脱壳的干蚕豆瓣,去杂,加入适量沸水漂烫约4 min,采用铁框过滤,冷水冷却后再次过滤。
(2) 接种制曲:加入17%的面粉(按干蚕豆质量计),接种适量曲粉使蚕豆混合物中霉菌量达106 CFU/g,湿度80%,30 ℃培养4 d,每12 h翻曲一次,每24 h取样测定霉菌生长量、蛋白酶酶活及黄曲霉毒素含量。试验设置3个平行组进行测定。其中蛋白酶酶活测定方法同2.1.2,黄曲霉毒素含量测定参照谢体波等[15]采用ELISA试剂盒进行测定。
(3) 甜瓣子制作:将豆瓣曲与盐水按1:1 (质量比,一次性加入盐、水,盐的终浓度为15%)混合,搅拌均匀,37 ℃发酵60 d。定期搅拌混匀,并测定其总酸和氨基态氮含量。总酸和氨基态氮分别参照国标GB/T 5009.39-2003[16]和GB/T 5009.40-2003[17]进行测定。
2.2.2 风味物质测定挥发性风味物质采用2010 Ultra GC-MS测定,分析不同菌种发酵制成甜瓣子挥发性风味物质的区别。
准确称取2 g粉碎的甜瓣子放入15 mL样品瓶中,置于60 ℃水浴中预热2 min,然后将萃取针头插入样品瓶中,60 ℃恒温顶空萃取50 min后,插入GC-MS进样口解析5 min,然后检测分析。
检测条件:DB-WAX毛细管柱(60 m×0.25 mm,0.25 μm);载气为氦气,流速1 mL/min;进样口温度250 ℃;不分流进样;升温程序:起始温度50 ℃,以10 ℃/min升温至85 ℃ (保留1.5 min),再以5 ℃/min升至100 ℃ (保留1 min),以2.5 ℃/min升至175 ℃ (保持1.5 min),以2.5 ℃/min升至200 ℃ (保持1 min)最后以10 ℃/min升至250 ℃/min。质谱条件:EI电离源,电子轰击能量70 eV;离子源温度230 ℃;接口250 ℃;质量扫描范围35−350 amu;检测器电压0.1 kV;调谐文件Stuneu;扫描模式Scan。
挥发性化合物的鉴定结果由NIST05谱库检索结果与人工图谱解析共同确定,化合物相对含量确定采用面积归一化法进行定量分析。
试验组均设置2个平行,各指标测定时也分别对平行样品进行测定。
2.3 数据分析采用Excel进行数据统计,实验结果中的数据均为3个平行样品均值,采用Origin 9.1作图分析。采用Minitab进行t检验分析,置信区间为95%。
3 结果与分析 3.1 高产蛋白酶菌株的筛选及鉴定 3.1.1 麸皮培养基中菌株产蛋白酶酶活能力从酪蛋白平板上筛选出17株能分解酪蛋白产生水解圈较大的霉菌,分别置于麸皮培养基进行培养,再依次测定蛋白酶酶活,以市售沪酿3.042为空白对照,比较霉菌产蛋白酶酶活能力。蛋白酶酶活测定结果见表 1。
| 菌株编号 Strain No. |
蛋白酶酶活 Protease activity (U/g) |
相对标准偏差 RSD |
| 3.042 | 1 055.12J | 3.45 |
| 21 | 1 127.68I | 83.07 |
| 15 | 461.83N | 14.79 |
| 17 | 829.51L | 5.17 |
| 23 | 1 238.05G | 8.45 |
| 22 | 614.88M | 23.17 |
| 14 | 1 574.63D | 6.90 |
| PCSM001 | 1 916.10B | 30.45 |
| DM-22 | 1 694.76C | 15.54 |
| 9 | 1 589.88D | 20.36 |
| 23 | 1 275.85F | 24.42 |
| 19 | 1 607.56D | 12.07 |
| PCSM002 | 2 202.68A | 8.62 |
| 16 | 1 952.68B | 6.90 |
| 13 | 1 525.85E | 10.00 |
| 7 | 964.88K | 10.35 |
| 11 | 1 597.80D | 10.72 |
| 24 | 1 170.98H | 12.72 |
| 注:t检验P < 0.05表示样品间差异显著,不同字母代表差异显著. Note: t test, P < 0.05 means there are significant differences between samples, different letters means there are significant differences between samples. | ||
所有菌株培养后麸曲中蛋白酶酶活均与沪酿3.042蛋白酶酶活差异显著。菌株PCSM002麸曲中蛋白酶酶活最高,达到2 202.68 U/g,远高于沪酿3.042麸曲的酶活1 055.12 U/g。此外,菌株16、PCSM001麸曲中蛋白酶酶活也较高,均大于1 900 U/g。选取蛋白酶酶活较高的菌株PCSM002、16、PCSM001、14、19、DM-22以及市售沪酿3.042及与其产蛋白酶能力相当的菌株24进行制曲,并进一步制作甜瓣子,比较菌株发酵甜瓣子风味的区别。
3.1.2 高产蛋白酶菌株的鉴定采用真菌基因组DNA提取试剂盒分别提取染色体DNA,并以此DNA为模板,以ITS1、ITS4为引物扩增霉菌ITS片段,送至北京擎科新业生物技术有限公司测序。测序结果提交GenBank进行BLAST同源性比对,并运用MEGA 5.0构建系统发育树,结果显示7株菌均属于曲霉属且其ITS序列相似度较高,而且均与黄曲霉和米曲霉相似度高(99%−100%)。根据白飞荣等[18]的报道,黄曲霉和米曲霉形态和基因相似度较高,要准确对其进行分类,还需同时进行传统形态学、产毒培养基、酶联免疫毒素检测、系统发育分析、产毒基因检测等鉴别方法进行综合验证。实验筛选菌株的详细鉴定还需进一步结合产毒培养基/产毒基因检测等方法进行系统研究。
3.2 筛选菌株的制曲效果 3.2.1 制曲过程菌株生长能力的测定各菌株于麸皮培养基发酵得曲粉接种于烫漂后的蚕豆瓣中,30 ℃培养96 h。图 1是用各菌株制曲96 h的形态,PCSM002和14号菌株第24 h时菌丝生长量明显高于其他菌株,制曲96 h成曲中PCSM002和14号菌丝生长量也最大。各时间点霉菌的生长量如图 2所示,菌株PCSM002和14制曲霉菌生长速度最快。采用Minitab进行t检验分析,两株菌制曲48 h和96 h后霉菌数量与沪酿3.042所制曲中霉菌数量差异显著,均明显高于沪酿3.042曲中霉菌数量。菌株PCSM002制曲48 h后生长量达7.1×108 CFU/g,霉菌活菌数达到最大,此后霉菌活菌数基本不再增加。菌株14制曲72 h,霉菌活菌数为1.16×107 CFU/g,96 h霉菌活菌数为5.3×108 CFU/g。市售沪酿3.042制曲48 h,霉菌数量仅为2.42×107 CFU/g,制曲72 h后霉菌活菌数为1.26×108 CFU/g,96 h霉菌活菌数为3×108 CFU/g。

|
| 图 1 制曲96 h霉菌生长情况 Figure 1 Growth situation of fungus after starter propagation for 96 h |
|
|

|
| 图 2 制曲过程中霉菌量动态变化 Figure 2 Dynamic change of fungus amount in starter propagation process |
|
|
不同菌株制曲蛋白酶酶活动态变化结果如图 3所示,PCSM002由于生长能力最强,产蛋白酶能力较强。PCSM002制曲24 h样品蛋白酶酶活达1 145.75 U/g,继续培养至96 h,蛋白酶酶活略有增加,96 h后蛋白酶酶活为1 450.25 U/g。而菌株PCSM001虽然生长能力较弱,制曲96 h霉菌总数仅为1.04×108 CFU/g,但是其产蛋白酶能力较强,发酵72 h时蛋白酶酶活为1 703.25 U/g。市售沪酿3.042发酵24 h豆瓣曲蛋白酶酶活为303.25 U/g,之后缓慢增加,48 h豆瓣曲中蛋白酶酶活为663.25 U/g,72 h豆瓣曲蛋白酶酶活为1 075.75 U/g,继续发酵24 h样品蛋白酶酶活基本维持稳定。菌株DM-22用于制曲生长速度相对缓慢,因此豆瓣曲中蛋白酶酶活较低,发酵96 h后蛋白酶酶活仅达813.25 U/g。其余菌株制曲产蛋白酶酶活能力相当,发酵96 h时麸曲中蛋白酶酶活达到1 100 U/g左右。菌株PCSM001和PCSM002制曲72 h蛋白酶酶活与沪酿3.042豆瓣曲中蛋白酶酶活差异显著,且均大于沪酿3.042蛋白酶酶活。菌株PCSM001和PCSM002制曲霉菌生长能力也远大于沪酿3.042,说明该菌株用于制作豆瓣曲时霉菌生长快,产蛋白酶能力强,明显优于沪酿3.042。

|
| 图 3 制曲过程中蛋白酶酶活动态变化 Figure 3 Dynamic change of protease activity in starter propagation process |
|
|
以筛选出的菌株制曲的样品中黄曲霉毒素含量均较低,随着制曲时间延长,黄曲霉毒素含量略有增加,但成曲中黄曲霉毒素含量均低于0.700 μg/kg,远低于国标规定的豆瓣酱中黄曲霉毒素限量(5 μg/kg)。对制曲96 h后豆瓣曲进行显著性分析,表 2结果显示,仅16和DM-22两株菌制作的豆瓣曲中黄曲霉毒素含量具有显著性差异,PCSM002发酵96 h后黄曲霉毒素含量为0.471 μg/kg,市售沪酿3.042制曲的成曲中黄曲霉毒素含量为0.471 μg/kg。实验筛选的菌株产黄曲霉毒素的能力极微弱,甚至不产黄曲霉毒素。菌株不产黄曲霉毒素,证明筛选的菌株是黄曲霉毒素阴性菌株。结合3.1.2中菌株鉴定结果分析,本实验筛选的菌株为米曲霉的可能性更大。
| 培养时间Cultivating time (h) | 16 | 24 | DM-22 | 3.042 | PCSM002 | 14 | PCSM001 | 19 |
| 0 | 0.200 | 0.218 | 0.112 | 0.189 | 0.073 | 0.101 | 0.126 | 0.178 |
| 24 | 0.366 | 0.571 | 0.427 | 0.326 | 0.369 | 0.298 | 0.379 | 0.290 |
| 48 | 0.634 | 0.645 | 0.380 | 0.499 | 0.368 | 0.343 | 0.390 | 0.301 |
| 72 | 0.436 | 0.442 | 0.366 | 0.593 | 0.426 | 0.341 | 0.398 | 0.305 |
| 96 | 0.536* | 0.440 | 0.277* | 0.471 | 0.471 | 0.375 | 0.411 | 0.421 |
| 注:*:差异显著,P < 0.05. Note: *: Significant difference, P < 0.05. | ||||||||
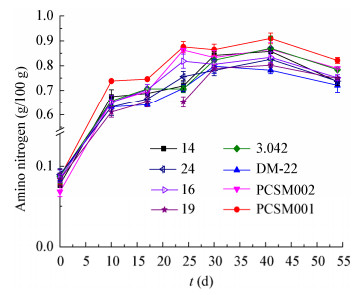
如图 4所示,甜瓣子中氨基酸态氮含量随其发酵时间延长逐渐增加。氨基酸态氮是蛋白质的分解产物,它能使郫县豆瓣酱鲜味柔和并改善色泽、调和香气,氨基酸态氮是评价郫县豆瓣酱品质的重要因素之一。原料中的蛋白质和蛋白酶含量对豆瓣酱产品中氨基酸态氮含量的影响极大。PCSM001和PCSM002菌株制得的甜瓣子中氨基态氮含量最高,发酵24 d氨基态氮含量分别达到0.88 g/100 g和0.86 g/100 g。而成曲中蛋白酶酶活最低的DM-22发酵甜瓣子中氨基态氮含量最高仅0.80 g/100 g。市售曲精发酵甜瓣子中氨基态氮增加相对缓慢,发酵41 d时甜瓣子氨基态氮含量最高,为0.87 g/100 g。对不同菌株发酵54 d时甜瓣子氨基态氮含量进行显著性差异分析,结果显示,菌株PCSM001发酵甜瓣子氨基态氮含量与沪酿3.042发酵甜瓣子氨基态氮含量差异显著,明显高于沪酿3.042发酵的甜瓣子。
|
| 图 4 甜瓣子发酵过程氨基态氮含量动态变化 Figure 4 Dynamic change of amino nitrogen content of the broad bean paste fermentation process |
|
|
如图 5所示,总酸含量随发酵时间的延长而增加,PCSM002发酵甜瓣子中总酸含量最高,发酵10 d甜瓣子样品总酸含量达0.94 g/100 g,到第41天时总酸含量达1.57 g/100 g。其他菌株和沪酿3.042发酵的甜瓣子中总酸含量变化趋势基本一致,发酵10 d时总酸含量为0.64 g/100 g,发酵54 d时总酸含量为1.09 g/100 g。甜瓣子发酵过程中可能产生各种有机酸,对豆瓣酱的风味有很大贡献。

|
| 图 5 甜瓣子发酵过程总酸动态变化 Figure 5 Dynamic change of total acid content of the broad bean sauce fermented process |
|
|
结合3.2.2结果可知,菌株PCSM001和PCSM002制曲蛋白酶酶活最高,发酵甜瓣子中总酸和氨基态氮提升速度也最快,说明蛋白酶含量与氨基态氮含量成正相关关系。
3.3.2 挥发性风味物质的分析由图 6分析可知醇、醛、酸类化合物是甜瓣子中主要风味成分,其中醇类物质是主要挥发性风味成分,各样品中醇类物质含量均较高,其中16号和24号菌株发酵甜瓣子中醇类物质相对含量达到57.44%和38.85%。PCSM002和沪酿3.042发酵甜瓣子中挥发性风味物质种类分布相对较为均匀,醇、醛、酸3种风味物质是主导风味物质,此外酯、烷、酮、烯等风味物质相对含量相对较低。

|
| 图 6 不同菌株发酵甜瓣子风味物质种类统计 Figure 6 Species statistics of flavor substances in broad bean sauce fermented by different strains |
|
|
筛选在所有样品中所占比重大于0.5%的风味成分进行主成分分析(Principal component analysis,PCA),结果如图 7所示。8个样品挥发性风味成分被分成了3组,包含在第二象限和第三象限;第2组包含第三象限的24号菌株制得的甜瓣子;第3组是第一象限PCSM001菌株制得的甜瓣子。第1组主成分中2-乙基己醇、3-甲基丁醇、3-辛醇、2-呋喃甲醇、柏木脑、苯乙醇是主要的醇类风味成分,其中苯乙醇相对含量最高。苯乙酮是主要的酮类风味成分,糠醛、苯甲醛、苯乙醛、α-亚乙基-苯乙醛是主要的醛类风味成分。酸类物质丰富,醋酸、2-甲基丙酸、3-甲基丁酸、己酸相对含量较高。酯类化合物中乙酸-2-苯乙酯、3-甲基丁酸-2-苯乙基酯、十六烷酸乙酯为主要成分,其他风味成分含量相对较低。菌株24制得甜瓣子风味单独为一组,其中庚醇、1-(2-呋喃基)-乙酮、3-甲基丁醛、2-乙酰吡咯、十九碳烯是其独特的挥发性香气成分。菌株PCSM001制得的甜瓣子风味单独为一组,其实际挥发性风味成分相对含量较低。醇类物质是样品的主要挥发性成分,但在样品PCSM001中检出很少。苯乙醇在样品PCSM001中未被检出,3-甲硫基丙醇(菠萝醇)、2-丙基戊醇在PCSM001中也未被检出。PCSM002烷类香气成分相对其他菌株发酵甜瓣子含量更高,2-甲基-癸烷、2, 2, 5-三甲基-己烷是其特有的香气成分,其中十二烷相较其他甜瓣子相对含量更高;苯乙醛、2, 6-二甲基-吡嗪相对其他甜瓣子含量更高。

|
| 图 7 甜瓣子风味物质主成分分析 Figure 7 Principal component analysis of broad bean sauce's volatile flavor compounds 注:(A):8种甜瓣子的主成分散点图;(B):挥发性风味物质的主成分散点图. A:醇类;B:烷烃类;C:酮类化合物;D:酯类化合物;E:醛类化合物;F:羧酸类化合物;G:含氮杂环类;H:芳香化合物;I:胺类化合物;J:酚类化合物;K:烯烃类化合物;L:腈类化合物;M:其他. Note: (A): PCA scatter diagram of 8 kinds of broad bean paste; (B): PCA scatter diagram of volatile flavor compounds. A: Alcohols; B: Alkanes; C: Ketones; D: Esters; E: Aldehydes; F: Carboxylic acids; G: Nitrogen-containing heterocycles; H: Aromatics; I: Amine compound; J: Phenolic compound; K: Olefin compound; L: Nitrogen compound; M: Others. |
|
|
结合甜瓣子发酵感官分析,沪酿3.042制曲后发酵的甜瓣子发酵速度慢,发酵55 d后瓣子形态完整,瓣子整体呈现黄褐色;PCSM001和PCSM002两株菌制得的甜瓣子发酵速度快,发酵55 d的甜瓣子呈现棕褐色,瓣子较软,酱香味最浓郁。
4 讨论与结论菌株PCSM002用于制曲其生长速度最快,PCSM001和PCSM002菌株产蛋白酶能力最强。PCSM002麸曲中蛋白酶酶活为2 202.68 U/g,远高于沪酿3.042麸曲的1 055.12 U/g。菌株PCSM001和PCSM002发酵甜瓣子氨基态氮增加速度最快,24 d氨基态氮含量达到0.86 μg/kg以上,两株菌发酵甜瓣子产氨基态氮的能力明显强于市售沪酿3.042,发酵得到的甜瓣子香气最浓郁、口感最丰富。
目前豆瓣酱的生产缺乏专用菌株,酱油发酵沪酿3.042是豆瓣酱企业目前广泛使用的曲精。而豆瓣酱和酱油工艺不同,豆瓣酱是生料发酵,其发酵原料是蚕豆瓣,仅经过漂烫3–4 min处理;而酱油原料是黄豆,黄豆经蒸煮成熟后再进行发酵。酱油发酵原料相对豆瓣酱发酵原料其水分含量更高,组织经蒸煮成熟后也较软。因此,酱油发酵体系中蛋白质更容易被蛋白酶利用。所以酱油发酵菌株不一定适合豆瓣酱的发酵。本实验筛选的高产蛋白酶菌株是从郫县传统发酵豆瓣酱中筛选出来的,相对于从其他环境筛选的菌株更适合豆瓣酱发酵体系。尤其是PCSM001和PCSM002两株菌株用于制曲,其霉菌的生长速度和产蛋白酶的量远高于市售沪酿3.042。两株菌株发酵的甜瓣子氨基态氮含量上升速度最快,挥发性风味物质最丰富,综合口感明显强于市售沪酿3.042发酵的甜瓣子。两株菌有望用于豆瓣酱的发酵,提升豆瓣酱发酵速度,改善豆瓣酱质量。
豆酱类发酵食品风味物质的产生不仅与霉菌蛋白酶相关,还需要其他微生物代谢的蛋白酶、淀粉酶、纤维素酶、果胶酶等综合作用将蛋白质、淀粉、多糖等大分子物质分解为氨基酸、有机酸以及其他醇、醛、酸、酮、酯等小分子挥发性风味物质[19-20]。非挥发性有机酸、氨基酸、挥发性风味物质等是郫县豆瓣酱风味物质的重要组成部分[21]。此外,豆瓣酱发酵体系中复杂的微生物体系的发酵作用对豆瓣酱风味的形成具有重要作用[22-23]。因此,仅通过筛选高产蛋白酶的霉菌,测定其发酵豆瓣酱甜瓣子的氨基态氮、挥发性风味物质而分析菌株发酵豆瓣酱的性能远远不够,还应加强对菌株发酵豆瓣酱的其他风味物质进行综合分析,获得菌株发酵豆瓣酱的优势。另外,通过研究豆瓣酱发酵体系中微生物和风味物质的相关性研究豆瓣酱发酵复合菌剂,将高产蛋白酶的霉菌和其他产香的酵母菌、乳酸菌、芽孢杆菌等复合使用,对豆瓣酱品质的提升有重要意义。
| [1] |
Zeng XB. A study on the proteinases and fermentation characteristics of two Aspergillus oryaze strains[D]. Guangzhou: Master's Thesis of South China University of Technology, 2016 (in Chinese) 曾小波.两株米曲霉蛋白酶及发酵特性研究[D].广州: 华南理工大学硕士学位论文, 2016 |
| [2] |
Kum SJ, Yang SO, Lee SM, et al. Effects of Aspergillus species inoculation and their enzymatic activities on the formation of volatile components in fermented soybean paste (doenjang)[J]. Journal of Agricultural and Food Chemistry, 2015, 63(5): 1401-1418. DOI:10.1021/jf5056002 |
| [3] |
Mizuno S, Nishimura S, Matsuura K, et al. Release of short and proline-rich antihypertensive peptides from casein hydrolysate with an Aspergillus oryzae protease[J]. Journal of Dairy Science, 2004, 87(10): 3183-3188. DOI:10.3168/jds.S0022-0302(04)73453-0 |
| [4] |
Hong SB, Kim DH, Samson RA, et al. Aspergillus associated with Meju, a fermented soybean starting material for traditional soy sauce and soybean paste in Korea[J]. Mycobiology, 2015, 43(3): 218-224. DOI:10.5941/MYCO.2015.43.3.218 |
| [5] |
Sahutoglu AS, Akgul C. Immobilisation of Aspergillus oryzae α-amylase and Aspergillus niger glucoamylase enzymes as cross-linked enzyme aggregates[J]. Chemical Papers, 2015, 69(3): 433-439. |
| [6] |
Robbins JM, Bommarius AS, Gadda G. Mechanistic studies of formate oxidase from Aspergillus oryzae: a novel member of the glucose-methanol-choline oxidoreductase enzyme superfamily that oxidizes carbon acids[J]. Archives of Biochemistry and Biophysics, 2018, 643: 24-31. DOI:10.1016/j.abb.2018.02.007 |
| [7] |
Suzuki K, Tanaka M, Konno Y, et al. Distinct mechanism of activation of two transcription factors, AmyR and MalR, involved in amylolytic enzyme production in Aspergillus oryzae[J]. Applied Microbiology and Biotechnology, 2015, 99(4): 1805-1815. DOI:10.1007/s00253-014-6264-8 |
| [8] |
Ma JY, Zhuge B, Fang HY, et al. Purification and characterization of proteases from Aspergillus oryzae[J]. Microbiology China, 2014, 41(1): 83-89. (in Chinese) 马俊阳, 诸葛斌, 方慧英, 等. 米曲霉蛋白酶的分离纯化及酶学性质研究[J]. 微生物学通报, 2014, 41(1): 83-89. |
| [9] |
Feng YJ, Zong H, Zhuge B, et al. Characterization of a protease from Aspergillus oryzae and application in casein phosphopeptides preparation[J]. Microbiology China, 2015, 42(11): 2073-2078. (in Chinese) 冯颖杰, 宗红, 诸葛斌, 等. 一种米曲霉蛋白酶的酶学性质及其在酪蛋白磷酸肽制备中的应用[J]. 微生物学通报, 2015, 42(11): 2073-2078. |
| [10] |
Kang HX, Yang FM, Jin YX, et al. Isolation and identification of high yield protease mold in traditional fermented soybean paste of Qingyang city[J]. Journal of Gansu Agricultural University, 2015, 50(2): 163-167. (in Chinese) 康红霞, 杨富民, 金彦先, 等. 庆阳市传统发酵豆瓣酱中高产蛋白酶霉菌的筛选与鉴定[J]. 甘肃农业大学学报, 2015, 50(2): 163-167. DOI:10.3969/j.issn.1003-4315.2015.02.027 |
| [11] |
Wang PH, Guan TW, Deng AY, et al. Screening and molecular identification of fungal strains with high-yield of protease and α-amylase[J]. Liquor-Making Science & Technology, 2016(6): 61-64, 71. (in Chinese) 王鹏昊, 关统伟, 邓奥宇, 等. 酒曲中高产蛋白酶和α-淀粉酶霉菌菌株的筛选与分子鉴定[J]. 酿酒科技, 2016(6): 61-64, 71. |
| [12] |
Wang D. Catalytic kinetics of Aspergillus oryzae protease in high-salt environment and its application in soy sauce fermentation[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2013 (in Chinese) 王栋.米曲霉蛋白酶在高盐环境的催化动力学及其在酱油酿造中的应用[D].无锡: 江南大学博士学位论文, 2013 |
| [13] |
Liu Y, Wang JR, Liu JM, et al. Preparation of Koji with high protease activity by Aspergillus oryzae[J]. Modern Food Science and Technology, 2009, 25(9): 1049-1051, 997. (in Chinese) 刘颖, 王佳瑞, 刘婧美, 等. 米曲霉制备高蛋白酶活力酱曲工艺探讨[J]. 现代食品科技, 2009, 25(9): 1049-1051, 997. |
| [14] |
State Bureau of Internal Trade. SB/T 10317-1999 Measurement of proteinase activity[S]. Beijing: State Bureau of Internal Trade, 1999: 230-234 (in Chinese) 国家国内贸易局. SB/T 10317-1999蛋白酶活力测定法[S].北京: 国家国内贸易局, 1999: 230-234 |
| [15] |
Xie TB, Liu H, Lu W, et al. Determination of aflatoxin B1 in cooking oil, peanut, and grain by using direct competitive ELISA kit[J]. Journal of Food Safety & Quality, 2015, 6(7): 2834-2839. (in Chinese) 谢体波, 刘红, 陆苇, 等. 间接竞争ELISA检测试剂盒测定粮油食品中的黄曲霉毒素B1[J]. 食品安全质量检测学报, 2015, 6(7): 2834-2839. |
| [16] |
China National Research Institute of Food and Fermentation Industries. GB/T 12456-2008 Determination of total acid in foods[S]. Beijing: Standards Press of China, 2009: 1-5 (in Chinese) 中国食品发酵工业研究院. GB/T 12456-2008食品中总酸的测定[S].北京: 中国标准出版社, 2009: 1-5 |
| [17] |
National Health and Family Planning Commission of PRC. GB 5009.235-2016 Determination of amino acid nitrogen of foods[S]. Beijing: Standards Press of China, 2017: 1-5 (in Chinese) 中华人民共和国国家卫生和计划生育委员会. GB 5009.235-2016食品安全国家标准食品中氨基酸态氮的测定[S].北京: 中国标准出版社, 2017: 1-5 |
| [18] |
Bai FR, Yao S, Ling K, et al. The polyphasic taxonomy for distinguishing Aspergillus flavus and A. oryzae[J]. Microbiology China, 2018, 45(1): 215-226. (in Chinese) 白飞荣, 姚粟, 凌空, 等. 黄曲霉和米曲霉的多相鉴定方法[J]. 微生物学通报, 2018, 45(1): 215-226. |
| [19] |
Yan B. Detection and analysis of the components of lytic enzymes of soy sauce Koji[D]. Baoding: Master's Thesis of Hebei University, 2010 (in Chinese) 闫博.酱油成曲分解酶系的组分检测及分析[D].保定: 河北大学硕士学位论文, 2010 |
| [20] |
Sun CY. The formation and function of mainly microbial enzymes in naturally fermented soybean paste[D]. Harbin: Master's Thesis of Northeast Agricultural University, 2007 (in Chinese) 孙常雁.自然发酵黄豆酱中主要微生物酶系的形成及作用[D].哈尔滨: 东北农业大学硕士学位论文, 2007 |
| [21] |
Lin HB, Yu XY, Fang JX, et al. Flavor compounds in Pixian broad-bean paste: non-volatile organic acids and amino acids[J]. Molecules, 2018, 23(6): 1299. DOI:10.3390/molecules23061299 |
| [22] |
Li XY, Zhao CS, Zheng C, et al. Characteristics of microbial community and aroma compounds in traditional fermentation of Pixian broad bean paste as compared to industrial fermentation[J]. International Journal of Food Properties, 2017, 20(S3): S2520-S2531. |
| [23] |
Li ZH, Dong L, Huang Q, et al. Bacterial communities and volatile compounds in Doubanjiang, a Chinese traditional red pepper paste[J]. Journal of Applied Microbiology, 2018, 120(6): 1585-1594. |
 2019, Vol. 46
2019, Vol. 46