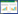扩展功能
文章信息
- 付汉清, 林茂, 翟少伟, 李忠琴, 王淑红, 程聪
- FU Han-Qing, LIN Mao, ZHAI Shao-Wei, LI Zhong-Qin, WANG Shu-Hong, CHENG Cong
- 一株宽谱裂解性溶藻弧菌噬菌体ФV170的分离鉴定及生物学特性
- Isolation and characterization of a wide-spectrum bacteriophage ФV170 lysing Vibrio alginolyticus
- 微生物学通报, 2019, 46(4): 819-828
- Microbiology China, 2019, 46(4): 819-828
- DOI: 10.13344/j.microbiol.china.180244
-
文章历史
- 收稿日期: 2018-03-28
- 接受日期: 2018-06-04
- 网络首发日期: 2018-06-25
2. 农业部东海海水健康养殖重点实验室 福建 厦门 361021
2. Key Laboratory of Healthy Mariculture for the East China Sea, Ministry of Agriculture, Xiamen, Fujian 361021, China
溶藻弧菌(Vibrio alginolyticus)是导致鱼[1]、虾[2]和贝[3]等海水养殖动物暴发严重疾病的重要条件病原体之一,对人也有致病性[4]。近年来,随着对虾养殖模式由粗放化向高密度集约化的快速转变,导致病害频发。使用抗生素及化学消毒剂等传统的治疗方法产生了诸多问题,例如细菌产生耐药性、病原菌传播引发安全问题、养殖水环境微生态失衡、人类生存环境遭受毒害等。这些问题导致由弧菌等引发的对虾细菌性病害难以有效治疗,成为制约凡纳滨对虾养殖可持续发展的一个关键性因素[5]。当前,随着人们生活水平的日益提高,绿色、健康的生物防治越来越受到人们的重视,这也敦促我们要寻找一种安全、有效的防控策略,以提高水产养殖效率、水产品质量和安全性。
噬菌体作为一种新兴的微生态抗菌剂,因其具有替代抗生素治疗疾病的潜在可能,已受到越来越多的关注[6]。许多研究表明,噬菌体用于治疗弧菌病取得了良好效果。Vinod等[7]研究结果表明,在哈维氏弧菌存在的条件下使用噬菌体治疗的幼虾组存活率相较于空白对照组由10%提高到了40%;Stalin等[8]研究证实了在水产养殖系统中应用噬菌体可以作为预防和治疗对虾副溶血弧菌病的有效方式;Li等[9]运用“鸡尾酒疗法”将3株噬菌体等比例混合后用于治疗海参灿烂弧菌病的效果优于单株;Sasikala等[10]研究的噬菌体可以裂解6株溶藻弧菌,能有效控制溶藻弧菌的数量;李男[11]的研究表明,分离的2株噬菌体只能裂解自身宿主,而不能裂解其他弧菌。
噬菌体用于治疗细菌疾病的潜在价值不言而喻,但因噬菌体具有高度的宿主特异性,裂解谱普遍较窄,极大限制了噬菌体治疗的发展,因此开展宽谱噬菌体的研究工作对于噬菌体抗菌剂的发展就显得尤为重要。本研究利用溶藻弧菌V170,从凡纳滨对虾养殖水中分离出一株宽谱裂解性噬菌体ФV170,进行了电镜观察噬菌体形态、最佳感染复数、一步生长曲线、裂解谱、热稳定性、氯仿敏感性等生物学特性的研究,以及基因组酶切分析,为新型噬菌体抗菌剂的开发奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株来源分离和噬菌谱检测用的宿主菌株均由本实验室保藏,其中溶藻弧菌菌株V170从养殖凡纳滨对虾肝胰腺中分离获得。
1.1.2 主要试剂和仪器TCBS、LB和NA培养基,青岛海博生物技术有限公司;SM缓冲液,北京诺博莱德科技有限公司;DL15000、DL2000、DNase I、RNase A和限制性内切酶EcoR I、EcoR V、BamH I、Hind Ⅲ,TaKaRa公司;TIANamp病毒基因组DNA/RNA提取试剂盒,天根生化科技有限公司。透射电子显微镜,FEI公司;PCR仪,Biometra公司。
1.2 方法 1.2.1 噬菌体的分离与鉴定取广东惠州平海地区5个凡纳滨对虾养殖场的养殖水样,混合均匀;将生长至对数期的溶藻弧菌宿主菌液倒入混合水样中,体积分数10%,30 ℃恒温培养24 h,不时搅动,对潜在的噬菌体进行富集。然后取2 mL水样10 000 r/min离心5 min,取上清液并用0.22 μm滤器过滤,采用斑点法[12]观察有无噬菌斑出现。如果有空斑出现,则采用双层平板法[13]进一步验证,观察有无单个噬菌斑出现。如果出现,即确定获得了以V170为宿主菌的溶藻弧菌噬菌体。
1.2.2 噬菌体的纯化采用双层平板法进行纯化。以生理盐水作为稀释液,将噬菌体原液按10倍梯度稀释至合适浓度,各取0.1 mL处于对数生长期的宿主菌液与噬菌体原液,沿管壁依次加到8 mL冷却至50 ℃左右的LB半固体培养基(琼脂浓度0.65%)中,混匀后迅速倒入准备好的NA固体培养基(琼脂浓度1.5%)上制成双层平板;待凝固后,将平板倒置于33 ℃恒温培养箱中培养6-24 h;用1 mL滤芯枪头从双层平板中挪取直径最大、中心通透的噬菌斑,吹打至1 mL SM缓冲液中,振荡15 s,4 ℃放置过夜[14]。继续用生理盐水稀释至10-3-10-5,重复上述步骤5-10次,直至获得大小一致的噬菌斑,即纯化完成。
1.2.3 噬菌体效价的测定噬菌体效价即噬菌体的滴度(Titer),是指每毫升样品中含有侵染活性的噬菌体数量,又称噬菌斑形成单位(Plaque-forming unit,PFU)[15],目前常用双层平板法进行检测。本研究采用生理盐水作为稀释液,将纯化后的噬菌体进行10倍比稀释,选取合适的梯度进行双层平板法检测。培养6-24 h至噬菌斑清晰可见为宜,观察记录噬菌斑的数量。上述每个稀释度做3个平板,每个平板上噬菌斑的数目在30-300之间为有效数据,取平均数并计算效价:
噬菌体的效价(PFU/mL)=稀释倍数×平均噬菌斑数/所取样品体积。
1.2.4 噬菌体的增殖利用双层平板法进行固体增殖。将纯化好的噬菌体制成双层板,使噬菌斑在24 h内铺满平板为宜;刮取双层板上层部分到装有5 mL SM缓冲液的离心管中,振荡30 s,4 ℃放置过夜;将离心管取出,再次振荡30 s,10 000 r/min离心1 min,重复1次;吸取2 mL上清液至无菌EP管中,10 000 r/min离心3 min,取上清液,用0.22 μm滤器过滤,得到噬菌体富集液(> 1010 PFU/mL),4 ℃保存备用。
1.2.5 噬菌体的电镜观察取1.2.4中的噬菌体增殖液20 μL (> 1010 PFU/mL)滴到300目碳膜铜网上沉淀吸附40 min,2%磷钨酸(PTA)负染30 s,室温干燥2 h,用透射电子显微镜(TEM)观察噬菌体的形态。
1.2.6 噬菌体ФV170基因组的提取和酶切分析取200 μL噬菌体增殖液,分别加入DNase I与RNase A至终浓度为8 U/mL和2 mg/mL,37 ℃消化1 h,80 ℃灭活15 min,目的是排除噬菌体悬液中宿主菌DNA/RNA的干扰。利用TIANamp病毒基因组DNA/RNA试剂盒提取噬菌体基因组(> 100 ng/μL)。
将噬菌体基因组分别用DNase I、RNase A和限制性内切酶EcoR I、EcoR V、BamH I及Hind Ⅲ于37 ℃酶解1 h。采用10 μL反应体系[16]:噬菌体核酸8 μL,酶1 μL,10×Loading buffer 1 μL。将酶切产物于1.5%琼脂糖凝胶中电泳(110 V) 22 min,使用凝胶成像系统观察电泳结果。
1.2.7 噬菌体ФV170对氯仿的敏感性[17]验证噬菌体对氯仿是否敏感,推断噬菌体是否含有脂类物质。室温下将噬菌体悬液(滴度为7.80×108 PFU/mL)与氯仿混合,体积比3:1,振荡5 min后10 000 r/min离心1 min,静置直至重新分层,测定噬菌体滴度。
1.2.8 噬菌体ФV170裂解谱检测参考赵俊杰[18]的方法,略有改动。从本实验菌种库选取15株溶藻弧菌,取1.2.4中得到的噬菌体增殖液与各菌株进行裂解试验,测定裂解谱。将受试菌培养过夜至对数期,进行斑点法试验。取200 μL菌液涂NA平板,25 ℃静置20 min;再吸取20 μL噬菌体富集液滴于NA板上,室温静置20 min,待噬菌体富集液被吸收后,倒置于33 ℃培养箱中于6-24 h观察有无噬菌斑产生。
1.2.9 噬菌体最佳感染复数测定感染复数(Multiplicity of infection,MOI)是感染初始噬菌体与细菌的数量比值。最佳感染复数是可使噬菌体获得最佳生长状态时的感染复数。本研究在邢少贞等[19]方法的基础上进一步改进。将噬菌体混合液和宿主菌液按照MOI为1 000、100、10、1、0.1、0.01、0.001、0.000 1、0.000 01的比例各取50 μL加入900 μL新鲜无菌的LB肉汤培养基中,总体积为1 mL,33 ℃、150 r/min振荡培养8 h;10 000 r/min离心3 min,取上清,0.22 μm滤器过滤,双层平板法测定噬菌体的滴度,其中噬菌体滴度最高的MOI即为最佳感染复数。
1.2.10 噬菌体一步生长曲线测定参考李男[11]的方法,略有改动。将浓度为4.0×107 CFU/mL的菌液,按照MOI为0.01的比例加入噬菌体ФV170,振荡15 s,33 ℃温育20 min,使噬菌体在宿主上充分吸附;10 000 r/min离心3 min,弃上清,LB液体培养基洗涤2次;加入1 mL LB液体培养基重悬,吸取100 μL到无菌50 mL LB肉汤培养基中,置于33 ℃培养箱中振荡培养,分别在0、10、20、30、40、50、60、70、80、90、100、110和120 min时间点取样,测定噬菌体滴度并绘制ФV170的一步生长曲线。
裂解量=裂解末期噬菌体效价/感染初期宿主菌浓度。
1.2.11 噬菌体ФV170的热稳定性首先将噬菌体裂解液分装1 mL于多个无菌EP管中。
(1) 测定短时间内(0.5 h和1 h)噬菌体及其宿主的耐受温度。将EP管分别置于不同温度(30、40、45、50、55、60、65、70、80 ℃)下作用0.5 h和1 h。取出冷却至室温,10倍梯度稀释,采用双层平板法计算噬菌体效价,裂解液中的宿主菌采用TCBS平板涂布法计数并计算其效价,每个梯度3个平行。
(2) 测定噬菌体在耐受高温作用下的衰减趋势。噬菌体放置在耐受高温(60 ℃)下,取0.5、1、1.5、2、2.5、3、4、8、12、24、36、48 h共12个时间点,采用双层平板法绘制噬菌体在高温下的衰减曲线,每个梯度3个平行。
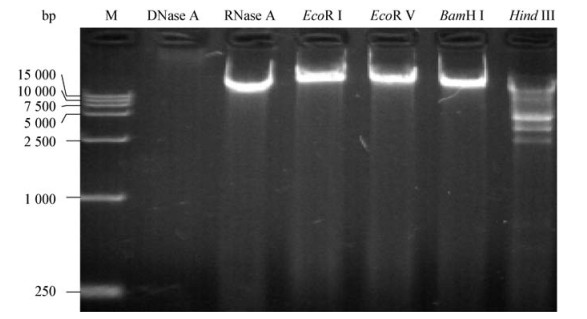
2 结果与分析 2.1 噬菌体ФV170的形态以溶藻弧菌V170为宿主菌,经5次纯化,分离到一株裂解性溶藻弧菌噬菌体ФV170。该噬菌体双层平板法培养12 h形成到直径约1.5 mm的噬菌斑(图 1A、B),噬菌斑清晰透亮,大小一致,无晕环。电镜观察,该噬菌体头部具有正廿面体结构(图 1C),头部直径60 nm-65 nm,尾长65 nm-75 nm,宽14 nm-18 nm。

|
| 图 1 噬菌体ФV170形成的噬菌斑(A、B)以及显微形态(C) Figure 1 The plaques (A, B) formed by ФV170 and the morphology (C) of phage ФV170 |
|
|
通过酶切分析结果可知,ФV170的基因组能被DNase I降解,不能被RNase A降解,说明噬菌体核酸类型为DNA。基因组中含有Hind Ⅲ酶切位点(被切开),不含有EcoR I、EcoR V、BamH I酶切位点(图 2)。据估算,基因组大小约为45 kb。
|
| 图 2 噬菌体ФV170基因组酶切图谱 Figure 2 DNA restriction endonuclease digestion of ФV170 |
|
|
经过氯仿处理后,噬菌体ФV170的滴度由最初的7.80×108 PFU/mL下降到6.85×108 PFU/mL,滴度没有发生明显变化(图 3),表明噬菌体对氯仿不敏感,即外壳无脂质包膜。
|
| 图 3 噬菌体ФV170对氯仿的敏感性 Figure 3 Sensitivity of phage ФV170 to chloroform 注:A:未加氯仿;B:加氯仿. Note: A: Without chloroform; B: Add chloroform. |
|
|
上述研究结果表明,溶藻弧菌噬菌体ФV170头部为正廿面体、直径60 nm-65 nm,尾部(14-18) nm× (65-75) nm,核酸类型dsDNA,基因组大小约为45 kb,外壳无囊膜。根据国际病毒分类委员会(ICTV)第九次报告的病毒分类系统[20],溶藻弧菌噬菌体ФV170在分类上属于有尾噬菌体目(Caudovirales)肌尾噬菌体科(Myoviridae)。
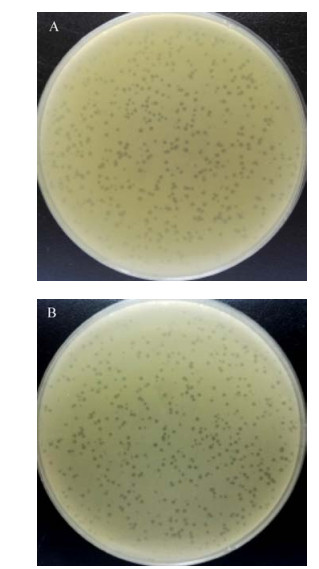
2.4 噬菌体ФV170对15株溶藻弧菌的裂解谱噬菌体ФV170采用斑点法对15株溶藻弧菌进行裂解试验(表 1)。结果显示噬菌体对7株溶藻弧菌有裂解能力,覆盖率为46.7%。其中对V114、V130、V173及宿主V170裂解效果好(图 4)。
| 菌株Strains | 菌株来源地Origin of the strain | 分离部位Separation site | 噬菌斑形成情况Plaque formation |
| V039 | 福建漳浦Zhangpu, Fujian | 养殖水体Aquaculture water | - |
| V067 | 福建长乐Changle, Fujian | 养殖水体Aquaculture water | - |
| V114 | 福建长乐Changle, Fujian | 养殖水体Aquaculture water | + |
| V130 | 福建长乐Changle, Fujian | 养殖水体Aquaculture water | + |
| V141 | 福建长乐Changle, Fujian | 养殖水体Aquaculture water | - |
| V154 | 福建长乐Changle, Fujian | 养殖水体Aquaculture water | + |
| V170 | 广东汕尾Shanwei, Guangdong | 虾体Shrimp | + |
| V172 | 广东汕尾Shanwei, Guangdong | 养殖水体Aquaculture water | + |
| V173 | 广东汕尾Shanwei, Guangdong | 虾体Shrimp | + |
| V177 | 广东汕尾Shanwei, Guangdong | 养殖水体Aquaculture water | + |
| V195 | 山东滨州Binzhou, Shandong | 养殖水体Aquaculture water | - |
| V201 | 山东滨州Binzhou, Shandong | 虾体Shrimp | - |
| V208 | 山东滨州Binzhou, Shandong | 养殖水体Aquaculture water | - |
| V213 | 山东滨州Binzhou, Shandong | 虾体Shrimp | - |
| V214 | 山东滨州Binzhou, Shandong | 虾体Shrimp | - |
| 注:+:有斑;-:无斑. Note: +: Plaque; -: No plaque. | |||
|
| 图 4 噬菌体ФV170裂解7株溶藻弧菌的噬菌斑(斑点法) Figure 4 Plaque of phage ФV170 formed by lysing 7 strains of Vibrio alginolyticus (speckling method) |
|
|
将噬菌体和宿主菌混合培养8 h,双层平板法测定各MOI的噬菌体滴度(表 2)。噬菌体与宿主菌的个数比为1:100时,即MOI=0.01,噬菌体滴度最高,达到1.10×1010 PFU/mL。所以噬菌体ФV170的最佳感染复数为0.01,此时产出率最高。
| 编号No. | 噬菌体浓度Phage (PFU/mL) | 细菌浓度Bacteria (CFU/mL) | 感染复数MOI | 8 h滴度8 h Titer (PFU/mL) |
| 1 | 109 | 106 | 1 000 | 9.30×107 |
| 2 | 109 | 107 | 100 | 1.54×108 |
| 3 | 109 | 108 | 10 | 1.43×109 |
| 4 | 108 | 108 | 1 | 4.60×109 |
| 5 | 107 | 108 | 0.1 | 9.80×109 |
| 6 | 106 | 108 | 0.01 | 1.10×1010 |
| 7 | 105 | 108 | 0.001 | 1.32×108 |
| 8 | 104 | 108 | 0.000 1 | 2.80×106 |
| 9 | 103 | 108 | 0.000 01 | 2.00×105 |
研究噬菌体的一步生长曲线规律可以了解噬菌体的裂解性能。由0开始,每隔10 min用双层平板法计数(图 5)。0-10 min为潜伏期,噬菌体数量基本没有变化;10-50 min时,噬菌体的滴度急剧增加,整个暴发期持续40 min。根据裂解量公式,即得出裂解量为101.3。
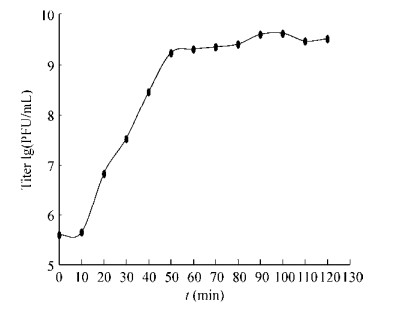
|
| 图 5 噬菌体ФV170的一步生长曲线 Figure 5 One-step growth curve of phage ФV170 |
|
|
研究噬菌体与宿主对高温耐受能力的差异,对噬菌体抗菌剂生产中灭活宿主菌具有重要指导意义。实验结果显示(图 6),噬菌体ФV170相对于宿主可耐受更高的温度。温育温度在30-60 ℃之间,作用时间为0.5 h和1 h时,噬菌体ФV170 (初始4.67×109 PFU/mL)能保持较高的效价。60 ℃时效价为3.61×109 PFU/mL (0.5 h)和3.18×109 PFU/mL (1 h),与30 ℃时基本在一个数量级。而65 ℃时迅速下降至1.74×108 PFU/mL (0.5 h)和1.50×108 PFU/mL (1 h),80 ℃时噬菌体效价均为0。而对于宿主菌(初始3.30×107 CFU/mL)而言,其效价在40 ℃时几乎没有变化,45 ℃时存活率急剧下降至1.80×106 CFU/mL (0.5 h)和2.50×105 CFU/mL (1 h),50 ℃全部失活。
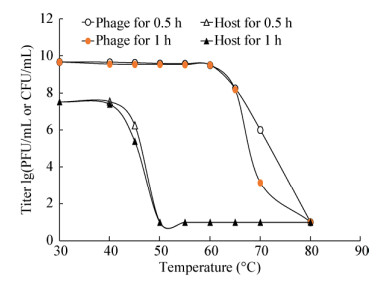
|
| 图 6 噬菌体ФV170及其宿主作用0.5 h和1 h的耐受温度 Figure 6 Tolerance temperatures of bacteriophage and host V170 during 0.5 h and 1 h |
|
|
噬菌体放置在耐受高温(60 ℃)下,随着时间的增加ФV170滴度逐渐降低。2 h时噬菌体存活数为1.53×109 PFU/mL;4 h时噬菌体滴度(4.52×108 PFU/mL)下降一个数量级;24 h时噬菌体滴度(2.05×107 PFU/mL)下降2个数量级,存活率约1%;48 h时仍有浓度为2.05×106 PFU/mL的噬菌体存活(图 7)。由研究结果可见,温度在60 ℃时作用0.5-1 h,既可灭活宿主菌的同时噬菌体又能保持较高的滴度。但该温度下作用时间不宜超过2 h,时间太长对噬菌体的活力有较大影响。
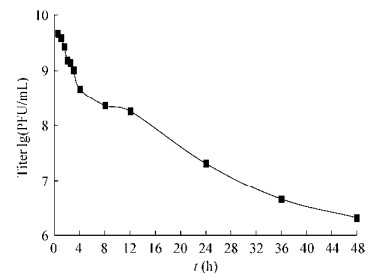
|
| 图 7 噬菌体ФV170在耐受高温(60 ℃)下的衰减曲线 Figure 7 The attenuation curve of bacteriophage V170 at high temperature of 60 ℃ |
|
|
随着细菌耐药性问题,特别是“超级细菌”的出现,运用抗生素进行抗菌治疗面临着巨大的挑战。然而噬菌体治疗具有其独特的优势:能自我扩增,消灭病原菌之后自我死亡;特异性强,只针对特定的病原菌,对人体、动植物和环境没有任何毒副作用等[21]。噬菌体治疗中噬菌体抗菌剂的研发及应用研究必不可少,已成为研究的热点,受到了广大专家学者的普遍关注。2016年第二届噬菌体国际学术研讨会指出噬菌体治疗是抵御抗药性的一种战略,是蒸蒸日上的朝阳产业。2017年10月,第五届针对传染病世界大会上也重申了这一点。
目前已报道的能够感染溶藻弧菌的噬菌体有多种形态,其中Kalatzis等[1]、Sasikala等[10]报道的能够感染溶藻弧菌的噬菌体与ФV170同属有尾噬菌体目(Caudovirales)肌尾噬菌体科(Myohoviridae)。肌尾噬菌体科有以下特征:头部呈廿面体或正廿面体,头部直径60 nm-145 nm,有尾,尾部为(16-20) nm×(80-455) nm,有尾鞘,核酸类型为dsDNA,大小为31-317 kb。根据这些特征可以判断噬菌体ФV170属于肌尾噬菌体科中个体较小且尾相对较短的一种。
噬菌体具有极强的宿主特异性,裂解谱窄的噬菌体通常不能满足治疗要求,所以宽谱噬菌体的研究更有意义。随着更多广谱噬菌体的发现,噬菌体抗菌剂的“鸡尾酒疗法”也会提高其裂解谱的覆盖率。Li等[9]报道的噬菌体可以裂解4株灿烂弧菌,不能裂解其他弧菌。Sasikala等[10]研究报道分离的噬菌体VP01可以裂解除溶藻弧菌以外的拟态弧菌、创伤弧菌和V. mediterreneii。本研究中噬菌体ФV170能够裂解7株溶藻弧菌,裂解谱较宽。从受试菌株的来源地来看,能够被裂解的7株溶藻弧菌来自福建长乐和广东汕尾,距离ФV170分离地的地理位置相对较近;而来自距离ФV170分离地相对较远的山东滨州地区的5株溶藻弧菌不能被裂解,这说明噬菌体的宿主特异性可能存在一定的地域关联。
研究最佳感染复数能够了解噬菌体的裂解效率,可对实际生产噬菌体抗菌剂起到指导作用。Kalatzis等[1]报道了噬菌体ФSt2和ФGrn1的最佳MOI分别为10和100;曾林等[22]的研究中最佳MOI为10;Li等[23]的研究中最佳感染复数为1;也有研究报道[24]最佳感染复数为0.000 1。在本研究中,ФV170的最佳感染复数为0.01,具有较高的裂解效率,即少量的噬菌体母液就可产生大量的噬菌体,在噬菌体抗菌剂生产中可降低生产成本,提高生产效率。
研究噬菌体的一步生长曲线能够掌握噬菌体增殖规律和确定最短生产周期,对噬菌体抗菌剂的生产及应用有重要意义。Ripabelli等[3]报道噬菌体的潜伏期为30 min,裂解期为30 min;Stalin等[8]报道的3株噬菌体的潜伏期分别为20、10和20 min,裂解期为50、50和60 min。由此可见,噬菌体ФV170潜伏期较短(10 min),暴发期适中(40 min),裂解量较高(101.3),具有较好的裂解性能,短时间内即可完成整个裂解过程。这对于生产而言,能够缩短生产周期并达到快速生产的效果。
研究裂解液中噬菌体及宿主菌的耐受高温并确定其温度耐受相反区间,是为了更好地灭活裂解液中的宿主,避免噬菌体抗菌剂在实际应用过程中对水环境造成二次危害,更好地指导噬菌体抗菌剂的生产及应用。曾林等[22]报道的溶藻弧菌噬菌体对60 ℃以下的温度耐受性较强,对65 ℃以上的高温敏感,与本研究结果基本一致。在此基础上我们研究了裂解液中宿主菌的耐受高温,发现噬菌体与宿主菌在50-60 ℃之间热稳定性截然相反,ФV170在50-60 ℃之间滴度几乎无变化,而宿主菌在50 ℃作用30 min即全部失活。由此可以推断,噬菌体裂解液可以通过控制温度完成对宿主菌的灭活,还能保证噬菌体的较高滴度。
综合分析噬菌体ФV170的各项生物学特性,可知该噬菌体有非常大的潜力,可以用于新型噬菌体抗菌剂的研发。随着大量的噬菌体被发现,噬菌体会像细菌一样,逐渐进入细化、优选、整合的阶段。而裂解谱广、裂解速度快、抗极端条件强、宿主菌无害的噬菌体会脱颖而出,随之噬菌体抗菌剂会大量涌现,细菌性疾病的治疗将由“后抗生素时代”转向“噬菌体时代”。
| [1] |
Kalatzis PG, Bastías R, Kokkari C, et al. Isolation and characterization of two lytic bacteriophages, φSt2 and φGrn1; phage therapy application for biological control of Vibrio alginolyticus in aquaculture live feeds[J]. PLoS One, 2016, 11(3): e0151101. DOI:10.1371/journal.pone.0151101 |
| [2] |
Luo CX, Huang XX, Li S, et al. Expressions of Toll receptor, IMD and lysozyme mRNA in the gills of the white shrimp (Litopenaeus vannamei) after acute challenge with Vibrio alginolyticus[J]. Journal of Fishery Sciences of China, 2014, 21(1): 189-196. (in Chinese) 罗词兴, 黄旭雄, 李桑, 等. 溶藻弧菌感染后凡纳滨对虾鳃组织免疫相关基因的表达[J]. 中国水产科学, 2014, 21(1): 189-196. |
| [3] |
Ripabelli G, Sammarco ML, Grasso GM, et al. Occurrence of Vibrio and other pathogenic bacteria in Mytilus galloprovincialis (mussels) harvested from Adriatic Sea, Italy[J]. International Journal of Food Microbiology, 1999, 49(1/2): 43-48. |
| [4] |
Lee DY, Moon SY, Lee SO, et al. Septic shock due to Vibrio alginolyticus in a cirrhotic patient: the first case in Korea[J]. Yonsei Medical Journal, 2008, 49(2): 329-332. DOI:10.3349/ymj.2008.49.2.329 |
| [5] |
Wang DH. A study on the problems and countermeasures of scale economy of marine aquaculture in China[D]. Qingdao: Doctoral Dissertation of Ocean University of China, 2014 (in Chinese) 王大海.海水养殖业发展规模经济及规模效率研究[D].青岛: 中国海洋大学博士学位论文, 2014 http://d.wanfangdata.com.cn/Thesis/D548497 |
| [6] |
Cao ZH. Isolation, identification and application of Pseudomonas aeruginosa lytic bacteriophages[D]. Dalian: Doctoral Dissertation of Dalian University of Technology, 2015 (in Chinese) 曹振辉.铜绿假单胞菌裂解性噬菌体的筛选、鉴定及应用[D].大连: 大连理工大学博士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10141-1015355442.htm |
| [7] |
Vinod MG, Shivu MM, Umesha KR, et al. Isolation of Vibrio harveyi bacteriophage with a potential for biocontrol of luminous vibriosis in hatchery environments[J]. Aquaculture, 2006, 255(1/4): 117-124. |
| [8] |
Stalin N, Srinivasan P. Efficacy of potential phage cocktails against Vibrio harveyi and closely related Vibrio species isolated from shrimp aquaculture environment in the south east coast of India[J]. Veterinary Microbiology, 2017, 207: 83-96. DOI:10.1016/j.vetmic.2017.06.006 |
| [9] |
Li Z, Li XY, Zhang JC, et al. Use of phages to control Vibrio splendidus infection in the juvenile sea cucumber Apostichopus japonicus[J]. Fish & Shellfish Immunology, 2016, 54: 302-311. |
| [10] |
Sasikala D, Srinivasan P. Characterization of potential lytic bacteriophage against Vibrio alginolyticus and its therapeutic implications on biofilm dispersal[J]. Microbial Pathogenesis, 2016, 101: 24-35. DOI:10.1016/j.micpath.2016.10.017 |
| [11] |
Li N. The separation and identification of bacteriophage of Vibrio harveyi, Vibro splendidus and study of the biological characteristic[D]. Dalian: Master's Thesis of Dalian Ocean University, 2016 (in Chinese) 李男.灿烂、哈维弧菌噬菌体的分离鉴定及其生物学特性的研究[D].大连: 大连海洋大学硕士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10158-1016757969.htm |
| [12] |
Lin YJ, Chen KC, Chen GL, et al. The isolation of Vibrio alginolyticus bacteriophage[J]. Acta Microbiologica Sinica, 1993, 33(4): 285-289. (in Chinese) 林业杰, 陈亢川, 陈拱立, 等. 溶藻弧菌噬菌体的分离[J]. 微生物学报, 1993, 33(4): 285-289. |
| [13] |
Gu JM, Xu W, Lei LC, et al. LysGH15, a novel bacteriophage lysin, protects a murine bacteremia model efficiently against lethal methicillin-resistant Staphylococcus aureus infection[J]. Journal of Clinical Microbiology, 2011, 49(1): 111-117. DOI:10.1128/JCM.01144-10 |
| [14] |
Su JF. Isolation, identification the phages of Ralstonia solanacearum and genomics of some phage[D]. Daqing: Master's Thesis of Heilongjiang Bayi Agricultural University, 2017 (in Chinese) 苏靖芳.烟草青枯病菌噬菌体分离鉴定及部分噬菌体基因组学研究[D].大庆: 黑龙江八一农垦大学硕士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10223-1017153519.htm |
| [15] |
Su JF, Sun JP, Gu G, et al. Isolation and biological characterization of virulent phage infecting Ralstonia solanacearum[J]. Tobacco Science & Technology, 2017, 50(10): 16-21. (in Chinese) 苏靖芳, 孙剑萍, 顾刚, 等. 烈性青枯雷尔氏菌噬菌体的分离与生物学特性分析[J]. 烟草科技, 2017, 50(10): 16-21. |
| [16] |
Zhang G, Huang DH, Jin J, et al. A preliminary study of the biological characteristics and genome of a lytic bacteriophage, LH-02, that infects Klebsiella pneumoniae[J]. Journal of Pathogen Biology, 2016, 11(1): 9-12. (in Chinese) 张改, 黄德海, 靳静, 等. 肺炎克雷伯菌噬菌体LH-02的生物学特性及基因组初步研究[J]. 中国病原生物学杂志, 2016, 11(1): 9-12. |
| [17] |
Hong W, Han J, Dai X, et al. Isolation and characterization of a Thermus lytic bacteriophage from Tengchong Rehai hot spring[J]. Acta Microbiologica Sinica, 2010, 50(3): 322-327. (in Chinese) 洪伟, 韩剑, 戴欣, 等. 腾冲热海一株栖热菌裂解性噬菌体的分离及其特征[J]. 微生物学报, 2010, 50(3): 322-327. |
| [18] |
Zhao JJ. E. coli phage LZZ-17 biochemical characteristics and genome-wide research[D]. Lanzhou: Master's Thesis of Gansu Agricultural University, 2016 (in Chinese) 赵俊杰.大肠杆菌噬菌体LZZ-17生化特性及全基因组学研究[D].兰州: 甘肃农业大学硕士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10733-1016902676.htm |
| [19] |
Xing SZ, Zhang XLL, Pei GQ, et al. Characterization and genome analysis of a novel bacteriophage vB_EfaP_IME195 infecting Enterococcus faecalis[J]. Microbiology China, 2017, 44(2): 305-313. (in Chinese) 邢少贞, 张湘莉兰, 裴广倩, 等. 粪肠球菌噬菌体vB_EfaP_ IME195的生物学特性及其全基因组分析[J]. 微生物学通报, 2017, 44(2): 305-313. |
| [20] |
Feng Y, Liu J, Sun Y, et al. An introduction to current classification and nomenclature of bacterial viruses[J]. Chinese Journal of Veterinary Science, 2013, 33(12): 1954-1958. (in Chinese) 冯烨, 刘军, 孙杨, 等. 噬菌体最新分类与命名[J]. 中国兽医学报, 2013, 33(12): 1954-1958. |
| [21] |
Liu FN. Practise medicine offers to benefit for society--the 2nd Bacteriophage meeting Wuhan, China[J]. China High-tech Zone, 2016(19): 27-30. (in Chinese) 刘芳男. 悬壶济世造福社会--第二届噬菌体国际学术研讨会在武汉成功召开[J]. 中国高新区, 2016(19): 27-30. |
| [22] |
Zeng L, Qiu DQ, Xie JH, et al. A study of the biochemical characteristics of the Vibrio alginolyticus bacteriophage[J]. Journal of Guangdong Ocean University, 2012, 32(1): 24-29. (in Chinese) 曾林, 邱德全, 谢警鸿, 等. 一株溶藻弧菌噬菌体的生理特性研究[J]. 广东海洋大学学报, 2012, 32(1): 24-29. DOI:10.3969/j.issn.1673-9159.2012.01.004 |
| [23] |
Li SF, Deng RL, Zhang SL, et al. Isolation and biological characteristics of bacteriophage of an antibiotic-resistant Escherchia coli strain[J]. Agricultural Science & Technology, 2016, 17(12): 2692-2695. |
| [24] |
Song ZF, Xu HD, Peng MF, et al. Isolation and identification of two lytic phages against Vibrio parahaemolyticus[J]. Acta Hydrobiologica Sinica, 2017, 41(4): 793-799. (in Chinese) 宋增福, 徐华东, 彭孟凡, 等. 两株副溶血弧菌烈性噬菌体的分离鉴定[J]. 水生生物学报, 2017, 41(4): 793-799. |
 2019, Vol. 46
2019, Vol. 46