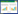扩展功能
文章信息
- 邢少贞, 张湘莉兰, 裴广倩, 方云, 程实, 米志强, 安小平, 童贻刚
- XING Shao-Zhen, ZHANG Xiang-Li-Lan, PEI Guang-Qian, FANG Yun, CHENG Shi, MI Zhi-Qiang, AN Xiao-Ping, TONG Yi-Gang
- 粪肠球菌噬菌体vB_EfaP_IME195 的生物学特性及其全基因组分析
- Characterization and genome analysis of a novel bacteriophage vB_EfaP_IME195 infecting Enterococcus faecalis
- 微生物学通报, 2017, 44(2): 305-313
- Microbiology China, 2017, 44(2): 305-313
- DOI: 10.13344/j.microbiol.china.160496
-
文章历史
- 收稿日期: 2016-07-07
- 接受日期: 2016-11-04
- 优先数字出版日期(www.cnki.net): 2016-11-09
2. 河北师范大学生命科学院 河北 石家庄 050024
2. Hebei Normal University, Shijiazhuang, Hebei 050024, China
粪肠球菌(Enterococcus faecalis)属于肠球菌科肠球菌属,是革兰氏阳性菌,过氧化氢阴性球菌,普遍存在于自然界,广泛分布在畜、禽养殖场所和生产加工的环境中,是人和动物肠道内主要菌群之一,属于条件致病菌。正常生长时,粪肠球菌能产生天然抗生素,改善肠道微环境,有利于人体健康;异位寄生时,肠球菌感染是新生儿败血症病因之一,是尿路感染、腹腔感染、盆腔感染的致病菌[1],是主要的医院内感染致病菌。
由于抗生素的持续过度使用以及滥用,同时肠球菌极易形成耐药性,使得耐药菌不断产生[2-3]。2014年世界卫生组织在全球监测报告中提出,细菌耐药性是各个国家所关注的健康问题中最严峻的问题,我们每个人都有受耐药菌感染的可能,是 21世纪最需要关注的健康问题之一[4]。随着新型抗生素的不断开发和使用,新的耐药菌也在不断增加。这使得寻找可替代抗生素的治疗方法刻不容缓。科学家把研究方向指向了由来已久的噬菌 体[5-6]。许多国家也开始重新审视噬菌体疗法[7-8]。噬菌体已经首先在农业和食品工业中使用[9-10]。噬菌体在美国开始应用于食品行业生物防控[11]。多重耐药肠球菌噬菌体的发现也为临床噬菌体治疗提供了很多资源[12]。
本研究中,我们利用一株从医院临床分离到的多重耐药肠球菌,从医院污水中分离出一株基因组较小的裂解性噬菌体vB_EfaP_IME195,并对其进行了生物学特性研究,包括电镜观察噬菌体形态、最佳感染复数、一步生长曲线、噬菌体IME195对紫外线的敏感度、对温度的耐受程度、对pH的耐受程度、对氯仿是否敏感。对全基因组进行测序后进行噬菌体全基因组序列组装,噬菌体IME195是少有的基因组较小的噬菌体。本研究进一步对该噬菌体基因组进行了注释,深入基因组功能分析,注释结果表明该噬菌体基因组只有27个开放阅读框,基因组基因密度高达94.6%,并对该噬菌体进行了比较分析及进化分析,为深入研究噬菌体机制及噬菌体治疗多重耐药细菌奠定了基础。
1 材料与方法 1.1 材料粪肠球菌(2003)来自于珠海迪尔公司所收集的医院妇产科女性患者分泌物和呕吐物,经过生化性质鉴定和药敏实验及16S rRNA基因序列测序鉴定,保存于本实验室细菌库。BHI (Brain Heart Infusion)培养基购自BD医疗器械有限公司。
1.2 噬菌体的分离与鉴定从307医院污水处理站取回的污水,10 000 r/min离心10 min。取上清,用0.22 μm微孔滤膜进行过滤;取上述滤液100 μL加入到5 mL培养至对数期的粪肠球菌液体培养物中,37 °C、220 r/min培养过夜,12 000 r/min离心2 min,收集上清,0.22 μm微孔滤膜进行过滤,所得滤液即为噬菌体原液。利用噬菌体原液点板实验检测是否分离到敏感性噬菌体。噬菌体的纯化按照文献[13]所描述的步骤进行。
1.3 噬菌体最佳感染复数测定参照李晓玉等[13]的方法,略有改动。
感染复数(multiplicity of infection,MOI),是感染时噬菌体与细菌的数量比值。而最佳感染复数,是可使噬菌体获得最佳生长状态时的感染复数。详细测定方法为:将噬菌体混合液和宿主菌液分别按照MOI为0.01、0.1、1、10、100的拷贝数比例混合各2 mL,加入新鲜的BHI培养基补足体积至10 mL,37 °C、220 r/min振荡培养6 h;12 000 r/min离心 1 min,分别用0.45 μm滤器过滤;梯度稀释后,双层平板法测定噬菌体的滴度,其中噬菌体滴度最高的MOI即为最佳感染复数。
1.4 噬菌体一步生长曲线测定参照李晓玉等[13]的方法,略有改动。
将粪肠球菌2003培养至OD600值为0.6左右,取100 μL菌液倍比稀释进行涂板,确定在此状态下每毫升菌液所含的细菌个数;将粪肠球菌2003接种至适量体积的新鲜BHI培养基,培养至对数期后12 000 r/min离心2 min后重悬于BHI培养基,使其浓度达到108 CFU/mL,以感染复数MOI为0.01加入噬菌体IME195,37 °C、220 r/min振荡培养;自加入噬菌体开始计时,分别在0、10、20、30、40、50、60、90和120 min时间点取样,并测定噬菌体滴度;以感染时间为横坐标,以各时间点噬菌体滴度为纵坐标绘制IME195的一步生长曲线。
1.5 噬菌体vB_EfaP_IME195 裂解谱测定通过点板试验,将受试菌(26株粪肠球菌、28株屎肠球菌、5株金黄色葡萄球菌和5株大肠杆菌)培养至OD600为0.6左右,取出400 μL铺双层平板,室温静置5 min,将2.5 μL噬菌体原液滴于双层平板上,室温静置20 min,待噬菌体原液被吸收后,倒置于37 °C温箱中9 h后观察有无噬菌斑产生。
1.6 噬菌体vB_EfaP_IME195对紫外线的敏感性取20 mL噬菌体原液(108 PFU/mL),倒入8 cm的无菌培养皿中,置于紫外灯下照射(20 W,30 cm),分别在处理0、15、30、45、60、75、90、105、120 min后,各取3个100 μL噬菌体进行10倍梯度稀释,采用双层平板法观察是否有噬菌斑并计算噬菌体的滴度,没有进行紫外灯照射的噬菌体设置为对照组。
1.7 噬菌体vB_EfaP_IME195对氯仿的敏感性将噬菌体原液(108 PFU/mL)与氯仿按照0、1%、2%、5%的比例进行混合,37 °C、220 r/min培养30 min。0、1%、2%、5%的分层液中各取3个上层噬菌体100 μL进行10倍的梯度稀释,利用双层平板法计算噬菌体滴度。
1.8 噬菌体vB_EfaP_IME195 的热稳定性用无菌1.5 mL离心管分别取900 μL的BHI液体培养基分别于40、50、60、70、80 °C水浴预热 60 min,设置3组平行实验;待温度稳定后,加入100 μL噬菌体原液(108 PFU/mL),分别在作用 30 min和60 min后取出样品管置于4 °C冷却至室温;用PBS缓冲液进行10倍梯度稀释后,分别取100 μL与400 μL对数期宿主菌2003混合,采用双层平板法计算噬菌体滴度,并记录。
1.9 噬菌体vB_EfaP_IME195 对 pH 的敏感性用1 mol/L HCl和1 mol/L NaOH将BHI培养基调至pH值为2.0-14.0;分别取900 μL的不同pH值的BHI培养基于无菌1.5 mL离心管中,每个pH值设置3个平行实验;置于37 °C温箱中预热60 min;每管加入100 μL噬菌体原液(108 PFU/mL);在37 °C温箱作用60 min后,用PBS进行10倍梯度稀释,每管取出100 μL与400 μL对数期宿主菌2003混合,利用双层平板法计算噬菌体滴度,并记录。
1.10 噬菌体 vB_EfaP_IME195 的电镜观察取已纯化的噬菌体样品20 μL滴入碳膜铜网上吸附20 min,使用2%磷钨酸(PTA)染色5 min,室温干燥后在Philips TECNAI-10型透射电子显微镜(TEM)下观察噬菌体的形态。
1.11 噬菌体 vB_EfaP_IME195 基因组 DNA 的提取噬菌体基因组利用蛋白酶K/SDS的方法提取按照李晓玉等[13]所述方法,略有改动。取600 μL已纯化过滤的噬菌体液体,加入DNaseⅠ和RNase A至终浓度1 mg/L,37 °C孵育16 h;80 °C灭活20 min,使酶充分失活;加入裂解缓冲液(终浓度,0.02 mol/L EDTA,50 g/L蛋白酶K,0.5% SDS) 56 °C水浴1 h。加入等体积平衡酚抽提核酸,12 000 r/min离心10 min,转移上层水相至新的1.5 mL离心管中;再加入等体积的酚-氯仿-异戊醇(25:24:1,体积比),温和混匀后12 000 r/min离心10 min,以去除蛋白质、糖类等污染物质,取上层水相至新的 1.5 mL离心管中;加入等体积的异丙醇,-20 °C静置4 h后12 000 r/min离心15 min,收集沉淀;用75%的乙醇(预冷)洗涤上述DNA沉淀,室温干燥后用适量去离子水重悬上述DNA沉淀。
1.12 噬菌体 vB_EfaP_IME195 高通量测序文库的构建与高通量测序噬菌体vB_EfaP_IME195的DNA全基因组测序是用的Life technologies公司第二代高通量测序仪(PGM)来完成。主要分为构建DNA文库和上机测序两大部分。DNA文库的构建是严格按照NEB公司的构建文库手册(NEBNext Fast DNA Library Prep Set for Ion Torrent protocol)来完成。主要流程为取100 ng的高质量噬菌体基因组DNA,超声打断约15 min,末端补平,两端加接头;加入1.8倍体积的AMPure XP Beads纯化DNA,使用E-Gel胶选择长约350 bp的DNA片段;PCR扩增上述DNA片段,加入1倍体积的AMPure XP Beads纯化PCR扩增产物。随后进行上机包括油包水PCR反应,碱法制备单链DNA测序模板;将带有模板的微磁珠离心到318C芯片微孔中,上机测序。
1.13 噬菌体 vB_EfaP_IME195 的全基因组序列分析噬菌体vB_EfaP_IME195全基因组序列组装使用Newbler v2.9软件和CLC软件。全基因组注释使用RAST (Rapid Annotation using Subsystem Technology)[14]和BASys (Bacterial Annotation System)在线注释。序列相似性比对分析使用BLAST在线工具[15]及mauve v. 2.3.1,使用MEGA 6.0建立进化树。
2 结果与分析 2.1 噬菌体 vB_EfaP_IME195 的形态以从医院临床患者分离出的粪肠球菌2003为指示菌,从医院污水中分离到一株裂解性粪肠球菌噬菌体,命名为IME195,IME195能在铺有400 μL指示菌和100 μL噬菌体混合的双层平板[13]上形成直径约1 mm清晰透亮的噬菌斑,见图 1A。电镜照片表明该噬菌体具有典型的二十面体结构和以收缩的尾部,头部直径约60 nm,尾部长约80 nm,归属于短尾噬菌体科(Podoviridae),见图 1B。根据国际委员会关于噬菌体命名的方法中,该噬菌体命名为vB_EfaP_IME195。
|
| 图 1 噬菌体 IME195 的形态 Figure 1 The morphology of phage IME195 注:A:噬菌体IME195所形成噬菌斑;B:透射电镜下噬菌体IME195的形态(10 000×). Note: A: The plaque formed by IME195; B: The morphology of phage IME195 in transmission electron microscopy (TEM×10 000). |
|
|
按表 1所示比例加入噬菌体和宿主菌培养 9 h,分别测定各MOI的噬菌体滴度。从表 1中看出当MOI为0.01时噬菌体滴度最高,该结果表明噬菌体的最佳感染复数为0.01。
| 编号 No. |
细菌浓度 Bacteria (CFU/mL) |
噬菌体浓度 Phage (PFU/mL) |
感染复数 MOI |
9 h滴度 9 h Titer (PFU/mL) |
| 1 | 108 | 109 | 0.01 | 5.8x109 |
| 2 | 108 | 108 | 0.10 | 1.2x109 |
| 3 | 108 | 107 | 1.00 | 2.3x108 |
| 4 | 108 | 106 | 10.00 | 2.1x107 |
| 5 | 108 | 105 | 100.00 | 3.1x107 |
通过研究噬菌体的一步生长曲线规律,来测定噬菌体的裂解能力。由图 2可知,在前30 min为噬菌体的潜伏期,噬菌体的裂解量约为噬菌体滴度/细菌的浓度=1.1×109/1×108=11。30 min后噬菌体呈指数增长趋势。

|
| 图 2 噬菌体 IME195 的一步生长曲线 Figure 2 one-step growth curve of phage IME195 |
|
|
噬菌体IME195只对2株粪肠球菌有裂解能力。IME195对其他粪肠球菌、屎肠球菌、金黄色葡萄球菌和大肠杆菌无裂解能力。
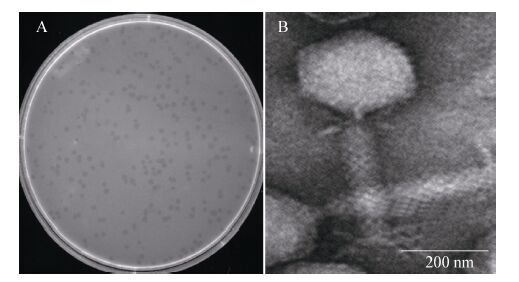
2.5 噬菌体 vB_EfaP_IME195 对紫外线的敏感性由图 3可以看出,噬菌体IME195经紫外线处理后,随着时间的增长,噬菌体的存活率急剧下降,当作用45 min后,噬菌体的存活率仅为6%,120 min后噬菌体基本全部失活,说明该噬菌体对紫外线比较敏感。
|
| 图 3 噬菌体 IME195 对紫外线的敏感性 Figure 3 Sensitivity of phage IME195 to ultraviolet |
|
|
由于氯仿具有脂溶性,所以将氯仿与噬菌体原液以0、1%、2%、5%的比例作用后,效价分别为5.0×108、7.0×108、6.8×108、7.0×108 PFU/mL,用氯仿处理后与未经处理的噬菌体滴度无明显差异,说明该噬菌体的活性并不受氯仿影响,暗示该噬菌体可能不含脂类物质[16]。
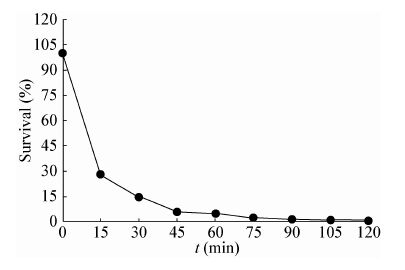
2.7 噬菌体 vB_EfaP_IME195 的热稳定性如图 4所示,噬菌体IME195随着温度的升高,噬菌体的滴度急剧下降,在40-80 °C作用 30 min和60 min后噬菌体滴度均急剧下降;80 °C作用下噬菌体基本全部失活;该结果表明噬菌体对高温比较敏感。
|
| 图 4 噬菌体 IME195 的热稳定性 Figure 4 Thermal stability of phage IME195 |
|
|
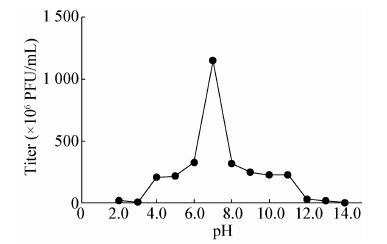
如图 5所示,噬菌体IME195在pH 6.0-8.0范围具有良好的裂解活性。随着pH值的升高,噬菌体的滴度急剧下降。pH为12.0时,噬菌体基本失去活性;随着pH值的降低,噬菌体的活性急剧下降,当pH为3.0时,噬菌体基本失活。
|
| 图 5 噬菌体 IME195 的 pH 稳定性 Figure 5 pH stability of phage IME195 |
|
|
约100 ng的噬菌体基因组用于构建DNA测序文库,测序约产生45 350条平均长度为296 bp的高质量测序片段(Reads),组装结果产生长约18 kb的单一CONTIG (重叠群),选取约环化后完整基因组长度为18 607 bp。平均覆盖倍数为721 (13 423 600÷18 607=721)倍。噬菌体IME195基因组组装结果产生长约18 kb的单一CONTIG (重叠群),运用末端高频序列方法分析[17],没有发现高频序列,即由测序数据分析可知该噬菌体基因组是环状存在。
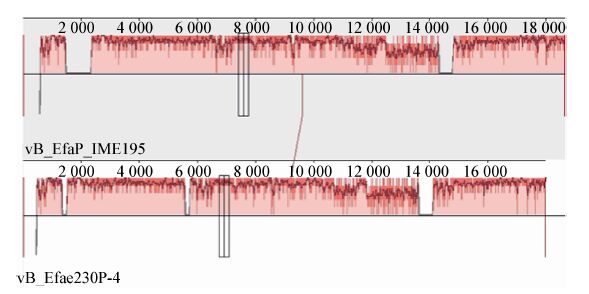
2.10 噬菌体 vB_EfaP_IME195 全基因组分析概述噬菌体vB_EfaP_IME195全基因组长度仅为 18 607 bp,是少有的小基因组噬菌体,其核酸序列NCBI登录号为KT932700。基因组A、C、G、T碱基含量分别为34%、16%、17%和33%,G+C含量仅为33%。Blastn比对表明与vB_EfaP_IME195具有同源性的序列仅有一条即粪肠球菌噬菌体vB_Efae230P-4 (GenBank登录号JQ309827,18 kb),二者的同源区仅为80%,最高同源性为82%。RAST注释结果表明只有27个开放阅读框(ORFs),27个ORF中起始密码均为ATG。CDS核酸序列长度在159-2 349 bp之间,对应的蛋白质序列长度在52-750 aa之间。全部的ORF共含17 604 bp的碱基,基因组基因密度高达94.6%。图 6为MAUVE v.2.3.1所作两株噬菌体之间的同源分析图,发现有很大的缺失,基因组间同源性有很大差异。
|
| 图 6 vB_EfaP_IME195 与其近源噬菌体 vB_Efae230P-4 的同源分析 Figure 6 The homology comparison between vB_EfaP_IME195 and vB_Efae230P-4 |
|
|
使用BLASTp对蛋白序列分析表明,ORF9 (噬菌体包装蛋白)在噬菌体包装时起重要作用。结构蛋白ORF25 (主要衣壳蛋白) 1 566 bp是噬菌体主要衣壳蛋白。ORF20-ORF22编码噬菌体尾部相关蛋白,ORF23-ORF26主要负责噬菌体尾部基底板,这两个基因簇在噬菌体感染、吸附宿主菌时发挥重要作用。
在噬菌体DNA复制及调控相关基因中只包括:ORF10 (DNA聚合酶)和ORF3 (单链DNA结合蛋白),由于基因组较小,没有发现复制过程中相关的DNA引物酶、DNA拓扑异构酶、DNA解旋酶和转录调控因子等。
ORF16 (噬菌体裂解酶)是噬菌体裂解相关基因。ORF19编码穿孔蛋白,使细菌细胞膜穿孔。该噬菌体可能是通过同时表达上述两种蛋白来介导宿主细胞裂解的。
已知功能的ORF的详细说明见表 2。
| ORF | Top BLAST hita | Identityb (%) (aa) | E value | Accession No. |
| 1 | No hits | |||
| 2 | hypothetical protein [Enterococcus phage vB_Efae230P-4] | 56 (54/97) | 1.00E-25 | YP_009103980.1 |
| 3 | putative single-stranded DNA binding protein [Enterococcus phage vB_Efae230P-4] | 95 (104/110) | 3.00E-69 | YP_009103979.1 |
| 4 | hypothetical protein [Lachnospiraceae bacterium C6A11] | 100 (59/59) | 5.00E-33 | YP_009191322.1 |
| 5 | Schlafen family member 13 [Chelonia mydas] | 35 (19/54) | 2.0 | EMP28893.1 |
| 6 | No hits | |||
| 7 | nitrite reductase large subunit [Salmonella enterica] | 31 (14/45) | 8.5 | WP_049292941.1 |
| 8 | hypothetical protein[Enterococcus phage vB_Efae230P-4] | 98 (137/140) | 3.00E-98 | YP_009103977.1 |
| 9 | putative encapsidation protein [Enterococcus phage vB_Efae230P-4] | 94 (390/413) | 0 | YP_009103976.1 |
| 10 | putative DNA polymerase [Enterococcus phage vB_Efae230P-4] | 96 (748/782) | 0 | YP_009103975.1 |
| 11 | hypothetical protein[Enterococcus phage vB_Efae230P-4] | 89 (50/56) | 2.00E-27 | YP_009103973.1 |
| 12 | hypothetical protein[Enterococcus phage vB_Efae230P-4] | 68 (46/68) | 1.00E-28 | YP_009103972.1 |
| 13 | hypothetical protein[Enterococcus phage vB_Efae230P-4] | 56 (32/57) | 1.00E-11 | YP_009103971.1 |
| 14 | hypothetical protein[Enterococcus phage vB_Efae230P-4] | 67 (51/76) | 9.00E-29 | YP_009103970.1 |
| 15 | putative HNH DNAse [Enterococcus phage vB_Efae230P-4] | 93 (156/167) | 1.00E-111 | YP_009103969.1 |
| 16 | phage lysin [Enterococcus phage vB_Efae230P-4] | 91 (429/472) | 0 | YP_009103968.1 |
| 17 | hypothetical protein[Enterococcus phage vB_Efae230P-4] | 66 (68/103) | 0 | YP_009103967.1 |
| 18 | putative N-acetylmuramoyl-L-alanine amidase [Enterococcus phage vB_Efae230P-4] | 90 (233/258) | 1.00E-168 | YP_009103966.1 |
| 19 | putative holin [Enterococcus phage vB_Efae230P-4] | 96 (125/130) | 2.00E-87 | YP_009103965.1 |
| 20 | putative tail structural protein [Enterococcus phage vB_Efae230P-4] | 72 (424/586) | 0 | YP_009103964.1 |
| 21 | No hits | |||
| 22 | putative calcineurin-like phosphoesterase [Enterococcus phage vB_Efae230P-4] | 49 (259/526) | 1.00E-161 | YP_009103962.1 |
| 23 | putative lower collar protein [Enterococcus phage vB_Efae230P-4] | 74 (131/178) | 8.00E-94 | YP_009103961.1 |
| 24 | putative head-tail connector protein [Enterococcus phage vB_Efae230P-4] | 92 (316/344) | 0 | YP_009103960.1 |
| 25 | putative major head protein [Enterococcus phage vB_Efae230P-4] | 94 (372/394) | 0 | YP_009103959.1 |
| 26 | No hits | |||
| 27 | No hits | |||
| 注:a:最相近的基因组的微生物物种的基因和名称. No hits:没有比对到相近的氨基酸序列. b:BLASTp搜索到比对百分比. | ||||
| Note: a: The most closely related genes and names of the organisms. No hits: indicates no significant homology detected for a particular amino acid sequence. b: Percent identity for top hits in BLASTp searches. | ||||
为了分析vB_EfaP_IME195与其他噬菌体之间的关系,采用噬菌体vB_EfaP_IME195主要衣壳蛋白(ORF25)序列构建了进化树。使用MEGA 6.0建立进化树分析,软件中ClustalW multiple alignments比对主要衣壳蛋白氨基酸序列,使用Neighbor-Joining建树,Bootstrap值>68。括号为用于比对的各噬菌体蛋白质序列登录号(图 7)。进化树反映,节点的数值代表可信度,支长代表遗传距离,vB_EfaP_IME195与粪肠球菌噬菌体vB_Efae230P-4亲缘关系最近,与其他的噬菌体亲缘关系较远。

|
| 图 7 使用噬菌体主要衣壳蛋白制作的进化树 Figure 7 Phylogenetic tree was formed by major capsid protein of phage 注:括号中的序号:代表噬菌体基因组序列号;分支点上的数字:代表可信度,数值越接近100,可信度越强;标尺:代表遗传距离,标尺越短代表亲缘关系越近;黑色圆点:vB_EfaP_IME195. Note: The number in the brackets: the genome sequence number in Genbank; the number at the branch point: the confidence level; scale: the genetic distance; Black ball: vB_EfaP_IME195 |
|
|
自抗生素投入临床以来,细菌耐药就一直是对研究者的很大挑战,目前世界卫生组织更是认为细菌耐药是21世纪以后的最大难题之一。为解决抗生素耐药性的问题,噬菌体成为最优的候选者,更是有些临床已经开始应用,甚至公司开始生产噬菌体制剂,由于噬菌体有宿主特异性,单一噬菌体制剂有可能不满足治疗要求,噬菌体混合制剂的“鸡尾酒”疗法以及个性化噬菌体治疗的方法可能是未来噬菌体治疗的研究选择方向之一。
本研究利用临床分离的多重耐药粪肠球菌筛选到一株新型裂解性噬菌体,通过电镜观察噬菌体,命名为vB_EfaP_IME195。基因测序表明,噬菌体IME195大小只有18 607 bp (GenBank登录号为KT932700),噬菌体基因组之小罕有见到,而且为裂解性噬菌体,目前没有文献报道。Blastn比对表明与vB_EfaP_IME195具有同源性的序列仅有一条,即粪肠球菌噬菌体vB_Efae230P-4 (GenBank登录号JQ309827,18 kb),二者的一致区仅为80%,最高相似性为82%。通过RAST基因组功能注释,结果表明,该噬菌体由于基因组较小,只有27个ORF,功能蛋白相较于其他噬菌体并未减少,后续可以用作模式噬菌体来研究噬菌体的其他功能,以及是如何进行复制、繁殖、组装、释放的。ORF16 (噬菌体裂解酶)是噬菌体裂解相关基因。ORF19编码穿孔蛋白,使细菌细胞膜穿孔。该噬菌体可能是通过同时表达上述两种蛋白来介导宿主细胞裂解的。穿孔蛋白和裂解酶基因相差距离较远,有待于研究;后续裂解酶的研究有利于未来利用酶来治疗细菌感染,酶的作用表现出比噬菌体更稳定的优势。对噬菌体感染宿主时受体机制的研究有待于深入[18]。
本研究中噬菌体vB_EfaP_IME195对氯仿不敏感,氯仿具有脂溶性,表明该噬菌体衣壳内可能不含有脂类物质,所以若在提取噬菌体全基因组时,将氯仿加入噬菌体培养液中,可以破坏宿主的细胞壁,进而释放出更多宿主细菌内的噬菌体,提高噬菌体滴度[18]。
| [1] | Anderson TF. Bacteriophages[J]. Annual Review of Microbiology 1950, 4(1) : 21–34. DOI:10.1146/annurev.mi.04.100150.000321 |
| [2] | Klare I, Witte W, Wendt C, et al. Vancomycin-resistant enterococci (VRE). Recent results and trends in development of antibiotic resistance[J]. Bundesge sund heitsblatt-Gesundheits for schung-Gesundheitsschutz 2012, 55(11/12) : 1387–1400. |
| [3] | Karki S, Houston L, Land G, et al. Prevalence and risk factors for VRE colonisation in a tertiary hospital in Melbourne, Australia: a cross sectional study[J]. Antimicrobial Resistance & Infection Control 2012, 1 : 31. |
| [4] | World Health Organization. Antimicrobial resistance: global report on surveillance[R]. Geneva: World Health Organization, 2014 |
| [5] | Sulakvelidze A, Morris JG. Bacteriophages as therapeutic agents[J]. Annals of Medicine 2001, 33(8) : 507–509. DOI:10.3109/07853890108995959 |
| [6] | Clark JR, March JB. Bacteriophages and biotechnology: vaccines, gene therapy and antibacterials[J]. Trends in Biotechnology 2006, 24(5) : 212–218. DOI:10.1016/j.tibtech.2006.03.003 |
| [7] | Matsuzaki S, Uchiyama J, Takemura-Uchiyama I, et al. Perspective: the age of the phage[J]. Nature 2014, 509(7498) : S9. DOI:10.1038/509S9a |
| [8] | Reardon S. Phage therapy gets revitalized[J]. Nature 2014, 510(7503) : 15–16. DOI:10.1038/510015a |
| [9] | Sulakvelidze A. Using lytic bacteriophages to eliminate or significantly reduce contamination of food by foodborne bacterial pathogens[J]. Journal of the Science of Food and Agriculture 2013, 93(13) : 3137–3146. DOI:10.1002/jsfa.2013.93.issue-13 |
| [10] | Guenther S, Huwyler D, Richard S, et al. Virulent bacteriophage for efficient biocontrol of Listeria monocytogenes in ready-to-eat foods[J]. Applied and Environmental Microbiology 2009, 75(1) : 93–100. DOI:10.1128/AEM.01711-08 |
| [11] | Flaherty JE, Harbaugh BK, Jones JB, et al. H-mutant bacteriophages as a potential biocontrol of bacterial blight of geranium[J]. HortScience 2001, 36(1) : 98–100. |
| [12] | Zhang WH, An XP, Fan H, et al. Isolation and characterization of an Enterococcus faecalis phage[J]. Letters in Biotechnology 2013, 24(4) : 484–487. (in Chinese) 张文惠, 安小平, 范航, 等. 一株粪肠球菌噬菌体的分离及其生物学特性研究[J]. 生物技术通讯 2013, 24(4) : 484–487. |
| [13] | Li XY, Ding P, Han CY, et al. Isolation of a novel Enterococcus faecalis phage IME-EF3 and its potential therapeutic advantages[J]. Biomedical Engineering and Clinical Medicine 2014, 18(2) : 113–118. (in Chinese) 李晓玉, 丁鹏, 韩传银, 等. 粪肠球菌噬菌体IME-EF3的分离及其治疗优势的发掘[J]. 生物医学工程与临床 2014, 18(2) : 113–118. |
| [14] | Aziz RK, Bartels D, Best AA, et al. The RAST server: rapid annotations using subsystems technology[J]. BMC Genomics 2008, 9(1) : 75. DOI:10.1186/1471-2164-9-75 |
| [15] | Altschul SF, Madden TL, Schffer AA, et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs[J]. Nucleic Acids Research 1997, 25(17) : 3389–3402. DOI:10.1093/nar/25.17.3389 |
| [16] | Khrstrm CT. With a little help from my phage friends[J]. Nature Reviews Microbiology 2013, 11(8) : 507. DOI:10.1038/nrmicro3070 |
| [17] | Fan H, Zhao QM, Guo XF, et al. Complete genome sequence of Xishuangbanna flavivirus, a novel mosquito-specific flavivirus from China[J]. Archives of Virology 2016, 161(6) : 1723–1727. DOI:10.1007/s00705-016-2827-6 |
| [18] | Alonso MDC, Rodríguez J, Borrego JJ. Characterization of marine bacteriophages isolated from the Alboran Sea (Western Mediterranean)[J]. Journal of Plankton Research 2002, 24(10) : 1079–1087. DOI:10.1093/plankt/24.10.1079 |
| [19] | Wootton L. A new barrier at mucosal surfaces[J]. Nature Reviews Microbiology 2013, 11(7) : 430–431. |
 2017, Vol. 44
2017, Vol. 44