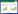扩展功能
文章信息
- 刘杰, 宋宇昊, 赵志鹏, 王莹莹
- LIU Jie, SONG Yu-hao, ZHAO Zhi-peng, WANG Ying-ying
- 3种淡水环境中低核酸含量细菌的滤过性
- Filterability of bacteria with low nucleic acid content in three freshwater environments
- 微生物学通报, 2016, 43(9): 1895-1901
- Microbiology China, 2016, 43(9): 1895-1901
- DOI: 10.13344/j.microbiol.china.150758
-
文章历史
- 收稿日期: 2015-10-08
- 接受日期: 2015-11-24
- 优先数字出版日期(www.cnki.net): 2016-01-06
微孔过滤(0.1 μm-0.45 μm)通常被用作热敏药物和实验溶剂的一种消毒方法,并在饮用水和废水处理中被作为物理法去除细菌等微生物[1-2]。自 20世纪30年代以来,能够通过微孔过滤膜的微生物已经引起了研究者的广泛关注[1],其中能够通过 0.45 μm膜的细菌被称之为“过滤性细菌(Filterable bacteria)”。有些研究者将其作为一类新微生物,然而一些研究者认为这是细菌生命周期中的一个生物阶段[3],尽管这些观点都是基于致病菌的悬浮培养,但是这种有趣的现象因缺乏成熟的实验条件和合适的培养方法而被人们所忽略[4]。0.22 μm膜过滤已被作为一种商业化的过滤消毒法,但是近来许多报道都指出在水环境中存在许多能够通过0.22 μm孔径膜的细菌,这又重新唤起了人们对过滤性细菌研究的热点[5-7]。目前关于过滤性细菌的研究大多基于异养菌平板技术(HPCs),包括计数、分离过滤性细菌以及标准过滤器性能的测试等,但是这种方法在检测自然环境中微生物时存在很多缺陷,由于平板技术是基于培养的方法,但特定的培养基并不能反映真实的环境条件,在自然环境中只有不到1%的浮游细菌能够在琼脂表面上长出菌落形态,而实际环境中存在许多具有代谢活性的细菌,基于HPCs方法测得的过滤性细菌丰度远远低于真 实值[8-10]。近来,流式细胞技术(FCM)的发展极大地促进了环境中过滤性细菌的研究。
在流式细胞技术中,水环境中的细菌普遍被分为低核酸含量(LNA)细菌和高核酸含量(HNA)细菌两大类。细菌DNA含量与细胞大小具有密切的关系,作为LNA细菌的重要特性之一,其细胞大小比普通细菌要小很多,有研究者将其归类于超微细菌[11-12]。LNA细菌在环境中普遍存在且具有重要的生态作用,然而由于分离纯菌株的有限,使得对LNA细菌的生理生长特性认识还很有限,因此如何将LNA细菌与其他(HNA)细菌分离开来是获得LNA纯菌的首要条件,而LNA细菌的微小特性为研究提供了一个很好的切入点,即通过一定孔径的生物滤膜来分离LNA菌群。本研究选取河水、湖泊水和地下水作为代表进行水环境微生物的滤过性研究,分析0.45 μm过滤对3种不同水源中LNA细菌的影响,为LNA细菌的分离提供依据;同时,通过DGGE技术探讨细菌DNA含量与微生物群落组织的关系。
1 材料与方法 1.1 样品的采集实验分别从地下水(湖南)、河流(海河)和湖泊(鄱阳湖) 3种典型淡水环境中采集水样,采样参照《水质采样技术指导(HJ 494-2009)》[13]。试验样品用1×105 Pa灭菌30 min的1 L Schott玻璃瓶收集,所有样品在常温下采集,4 ℃保藏,24 h内立即进行实验。
1.2 主要试剂和仪器SYBR Green I InvitrogenTM,ThermoFisher 公司;0.22 μm尼龙膜滤器,美国PALL公司; 0.45 μm Millex®-HV生物膜滤器,Millipore公司;Dneasy Blood&Tissue Kit,Qiagen公司;电泳染料6×blue/orange loading dye和PCR反应试剂 GoTaq Master Mix,Promega公司。
流式细胞仪CyFlow Space,德国Partec公司;DcodeTM基因突变检测系统和Molecular ImagerTM Gel Dox XR+紫外成相系统,Bio-Rad公司。
1.3 流式细胞术分析取1 mL水样,加10 μL SYBR Green I进行 荧光染色,染色标准工作溶液为:用0.22 μm尼龙膜过滤后的二甲基亚砜将SYBR Green I母液稀释100倍,室温条件下避光孵化15 min。同时用 0.45 μm Millex®-HV生物膜过滤水样,利用FCM分析过滤前后的细菌变化。
实验所用流式细胞仪CyFlow Space仪器参数为:光源功率50 mW、发射波长488 nm、线性范围2×102-1×105 cells/mL、检出限200 cells/mL、绝对计数误差小于5%。发射光信号收集软件为FlowMax,其中,绿色荧光收集波长520±20 nm。所有信号均被收集在绿色荧光(FL1)-侧向散色光(SSC)二维散点图上。仪器增益设置为地下水:SSC=300、FL1=320;鄱阳湖水:SSC=280、FL1=360;海河水SSC=280、FL1=380,均为lg4对数放大倍数。用Milli-Q无菌水稀释样品以保证测定过程中流式细胞仪计数小于500 cells/s,设置“门Gate”将目标细胞群与背景分离开,每个样品3个平行。
细菌的滤过性(Filtration efficiency,FE)采用如下公式评估:

|
其中,Cbefore和Cafter分别指过滤前后水样中的FCM细菌浓度,膜对细菌的去除效果(Removal efficiency,RE)采用如下公式:RE (%)=100-FE计算。
1.4 PCR-DGGE分析水样微生物总DNA使用Dneasy Blood&Tissue Kit提取。采用nested-PCR扩增细菌16S rRNA基因V3区[14],PCR反应体系及程序参照屠腾等[10]方法,其所用试剂为GoTaq Master Mix。DGGE分析(DcodeTM基因突变检测系统)电泳条件:丙烯酰胺凝胶溶液(丙烯酰胺与亚甲双丙烯酰胺的质量比为37.5:1)浓度8%、变性剂梯度35%至60% (100%变性剂为7 mol/L尿素和40%去离子甲酰胺)[15],16 mL凝胶溶液中加入15.5 mL 10%的过硫酸铵(氧化剂)和15.5 mL四甲基乙二胺(加速剂)。取20 mL PCR产物样品,加入5 mL 6×blue/orange loading dye,离心混匀上样。电泳点条件为:1×TAE缓冲溶液(40 mmol/L Tris,20 mmol/L HAc,50 mmol/L EDTA,pH 8.0),恒温60 ℃,恒定电压140 V,电泳4 h。电泳结束后用0.5 mg/mL EB染色20 min。染色完毕,用蒸馏水漂洗干净,在紫外成相系统(Molecular Imager TM Gel Dox XR+)下得到DGGE图谱。
1.5 数据分析与处理细菌群落组织用Quantity One 4.31软件(Bio-Rad公司)对DGGE图谱进行定量分析,经过泳道识别、条带识别和配对3个步骤后,群落组织(Community organization,Co)用条带分布的Gini系数百分比进行量化,即标准化的Pareto-Lorenz曲线与理想均匀度直线(Perfect evenness curve,PEC)之间面积[16-17]。使用SPSS16.0进行方差分析(One-way ANOVA)和相关性分析。
2 结果与分析 2.1 水源中过滤性细菌实验选取3种典型水源(河流、湖泊和地下水),结合FCM和0.45 μm膜过滤分析了水样中土著微生物及过滤性细菌的群落特征。水样过滤前后的群落特征如图 1所示,结果表明0.45 μm膜过滤对微生物群落具有显著影响;在数量上,过滤前地下水、海河水和鄱阳湖水中总细菌浓度分别为1.04×106、2.61×106、1.08×106 cells/mL,经0.45 μm生物膜过滤后,水样中的过滤性细菌浓度(图 2)分别为1.91×104 cells/mL (地下水)、6.75×105 cells/mL (海河)和7.46×105 cells/mL (鄱阳湖);在群落结构上,过滤前,地下水只有很明显的2团菌落(图 1A),其中HNA细菌属于绝对优势菌群,海河水样中可以看到微弱的3团菌落(图 1B),而鄱阳湖明显分为 4团菌落(图 1C),其中LNA细菌属于优势菌群,在0.45 μm生物膜过滤后,水中细菌群落结构发生了明显的变化,地下水中的绝大部分HNA细菌被过滤去除(图 1D),而海河(图 1E)和鄱阳湖(图 1F)水中的HNA细菌也几乎被去除。同时,过滤后的细菌分群更加明显,这一现象与前人研究相似。Wang等[2]发现,水样微生物经过过滤培养后,其群落分簇变得更多。
|
| 图 1 0.45 μm过滤对细菌群落影响的FCM分析 Figure 1 Bacterial community’s FCM analysis about the effect of 0.45 μm filtration 注:A、B和C分别为地下水、海河和鄱阳湖原水样;D、E和F分别为0.45 μm过滤后的地下水、海河和鄱阳湖水样;TD表示稀释倍数;虚线框内的细菌表示被膜过滤去除掉的(HNA细菌)部分. Note: Original water samples come from underground water (A),Haihe River (B) and Poyang Lake (C),and (D),(E) and (F) indicate those samples after filtration through a 0.45 μm-pore-size filter respectively. TD means the dilution ratio in FCM analysis,and bacteria in dash frame indicate the effect of filtration on HNA bacteria. |
|
|
|
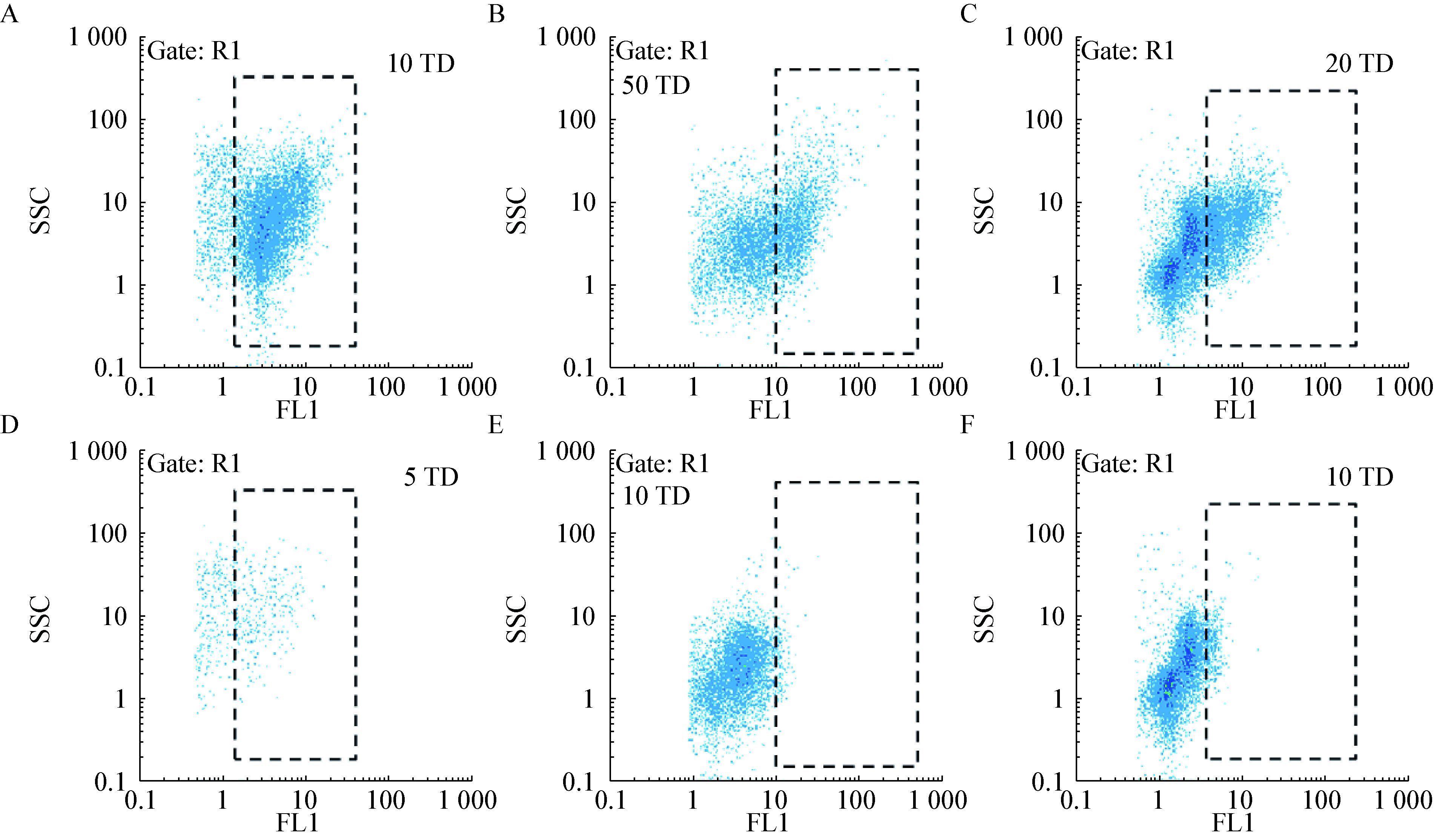
| 图 2 3种水源中过滤性细菌 Figure 2 The abundance of filterable bacteria in three water sources 注:UW:地下水;HR:海河;PL:鄱阳湖;不同字母表示相同柱状图中具有显著性差异(P<0.01). Note: UW,HR and PL indicate underground water,Haihe River and Poyang Lake respectively,and different letters in the same column mean significant difference at 0.01 level. |
|
|
方差分析显示(图 2):在过滤前,地下水和鄱阳湖水中总细菌浓度没有显著的差别(P>0.05),而海河水中细菌浓度最高(P<0.01),约为地下水和鄱阳湖中细菌浓度的2倍;在过滤后,鄱阳湖和海河水样中的过滤性细菌浓度要显著高于地下水中的过滤性细菌浓度(P<0.01),而此时鄱阳湖和海河水中的过滤性细菌浓度没有显著的差异(P>0.05)。实验结果表明,鄱阳湖水样中具有最高的0.45 μm过滤性细菌比重(69.1%),海河中为25.8%,而地下水中最低(1.8%) (图 2)。与海河水相比,尽管鄱阳湖水样原土著微生物数量较低,但其过滤性细菌比重却最高。
由于热敏性溶液不能用高压蒸汽法灭菌,因此在医学、工业和科学研究中,微孔过滤被广泛用于定性去除水中的细菌,其中0.22 μm孔径膜被一直作为标准的过滤消毒,而0.1 μm膜则被认为是绝对去除水环境细菌的界线(除了病毒)[18]。然而,在海洋、淡水以及饮用水等环境中存在着许多过滤性细菌,研究显示许多细菌可以通过0.22 μm甚至 0.1 μm孔径过滤器,而0.45 μm膜在提供微生物安全保障时作用很有限[1]。Chandler等[19]发现Treponema pallidum能够逃脱0.22 μm的滤器;Rubin等[20]从0.22 μm过滤后的去离子水中分离出一株Leptospira biflexa;Fedotova等[21]分析了Rybinsk (俄罗斯)水库中0.22 μm过滤性细菌的组成,通过16S rRNA基因鉴定分析发现,它们大部分都属于b-Proteobacteria;Wang等[1]从瑞士分离到一株能穿过0.1 μm滤器的Hylemonella gracilis。在海水环境中,0.22 μm过滤性细菌主要属于a和l-Proteobacteria变形菌门以及Cytophaga- Flavobacterium-Bacteroide分支[22-23],而在淡水环境中则主要是b-Proteobacteria变形菌门[1, 5, 21],这些过滤性细菌具有多种形状,如小球型、短螺旋状和棒杆状等[3],它们在寡营养的海洋、淡水以及饮用水中广泛存在,过滤性细菌在这种环境中因比表面积比其他细菌大而具有较高的营养物质转运速率,所以能成为优势菌。
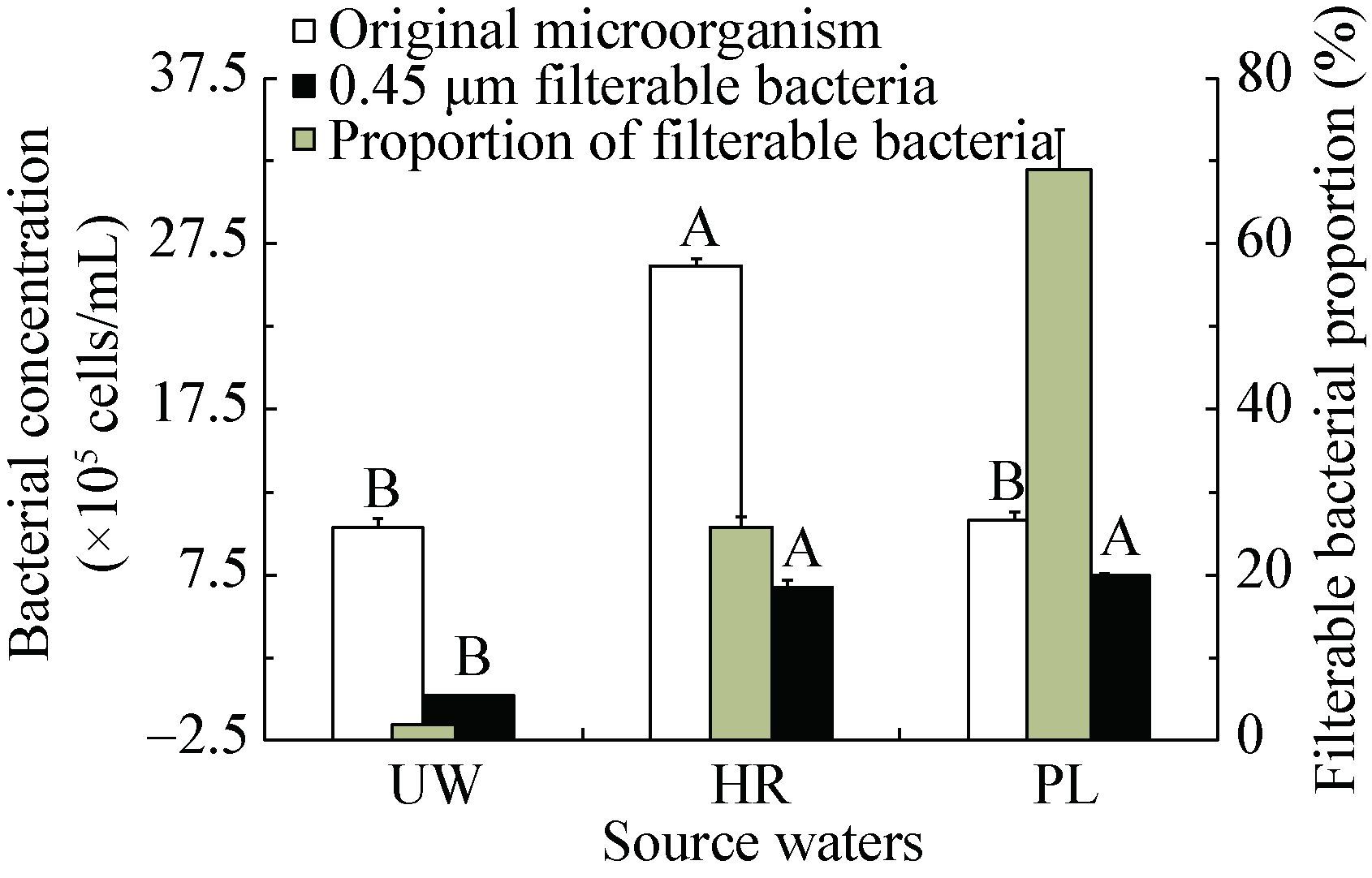
2.2 过滤性细菌与LNA细菌的相互关系实验结果显示,水样中过滤性细菌与LNA细菌具有极显著的正相关性(图 3,R2=0.984,P<0.01),这表明过滤性细菌与LNA细菌在FCM上具有很好的重合性,过滤对水样微生物群落组成(特别是LNA细菌)具有极强的筛选效果,通过膜过滤可以增加水样中LNA细菌的比重。尽管过滤能够增加水样中LNA细菌的比重,但是对比分析发现,原水样中过滤性细菌的比重与LNA细菌的比重仍有一定的差异,即过滤性细菌与LNA细菌的比重并非相等,这说明过滤虽然在一定程度上能够将HNA细菌和LNA细菌分开,LNA这类微小细菌也具有可滤过性,但是在过滤过程中细胞的大小并不是决定细菌可滤过性(过滤细菌占总菌浓度的比重)的唯一因素。
|
| 图 3 过滤性细菌比重和LNA细菌比重的相互关系 Figure 3 Correlation of filterable and LNA bacterial proportion in three water sources 注:UW:地下水;HR:海河;PL:鄱阳湖. Note: UW,HR and PL indicate underground water,Haihe River and Poyang Lake respectively. |
|
|
研究表明细菌的大小(生物体积)及形状(细胞的最小宽度和整体形状)共同决定了其可滤过性,Wang等[3]研究显示,具有较大体积的Hylemonella gracilis (体积0.12 μm3,0.45 μm滤过性46.51%)其滤过性反而要高于相对小体积的Brevundimonas diminuta (体积0.08 μm3,0.45 μm滤过性1.47%),这是因为Hylemonella gracilis属于螺旋状具有较小的最小细胞宽度,而Brevundimonas diminuta是短棒状,其最小细胞宽度要大于H. gracilis的最小细胞宽度,进而导致了滤过性的差异。当细菌在具有相似形状时,细胞的最小宽度越小越容易穿过膜;而当细胞的最小宽度与膜孔径相当时,细胞的整体形状则决定了其滤过性。此外,细菌的伸缩性对其滤过性也很重要,研究发现,在具有张力的甘油溶胶中,Spirillum属能够被拉伸至其原长度的3倍而不断裂;在外力消失时,细胞能够恢复到它们的原始大小和形状[24],因而在过滤过程中,细菌可能会由于外压或自身原因进行伸缩从而穿过滤膜。在本研究中,鄱阳湖水样可能含有一些细长或具有伸缩的HNA细菌,在过滤时也能通过滤膜,因而使得其过滤性细菌比重略高于LNA细菌比重。另一方面,细菌在膜孔中的堵塞也会在一定程度上影响细菌的滤过性,会导致细菌的滤过性降低,因而初始浓度不同时也可能会导致滤过性的差异,正是如此可能导致了在本研究中海河水和地下水中的过滤性细菌比重低于LNA细菌比重。另外,微生物的培养条件也会影响细菌的滤过性,细菌的大小会随所处的环境而改变,Anderson和Heffernan[25]研究发现一些分离的过滤性细菌在实验室条件培养后不再具有滤过性。
2.3 群落组织与LNA和HNA细菌的关系通过Quantity one软件对DGGE图谱进行定量计算得到水样中细菌群落的分布情况,通过绘制DGGE图谱Parelo-Lorenz曲线(图 4A),反映出物种的分布,即微生物群落组织功能。在地下水中具有最高的群落组织,这可能是在地下水中微生物的生存环境压力大导致了一些优势菌的形成[16]。同时,相关分析表明,水样细菌的群落组织与HNA细菌比重具有显著的正相关(图 4B,R2=0.843,P<0.05),而与LNA细菌比重呈负相关。
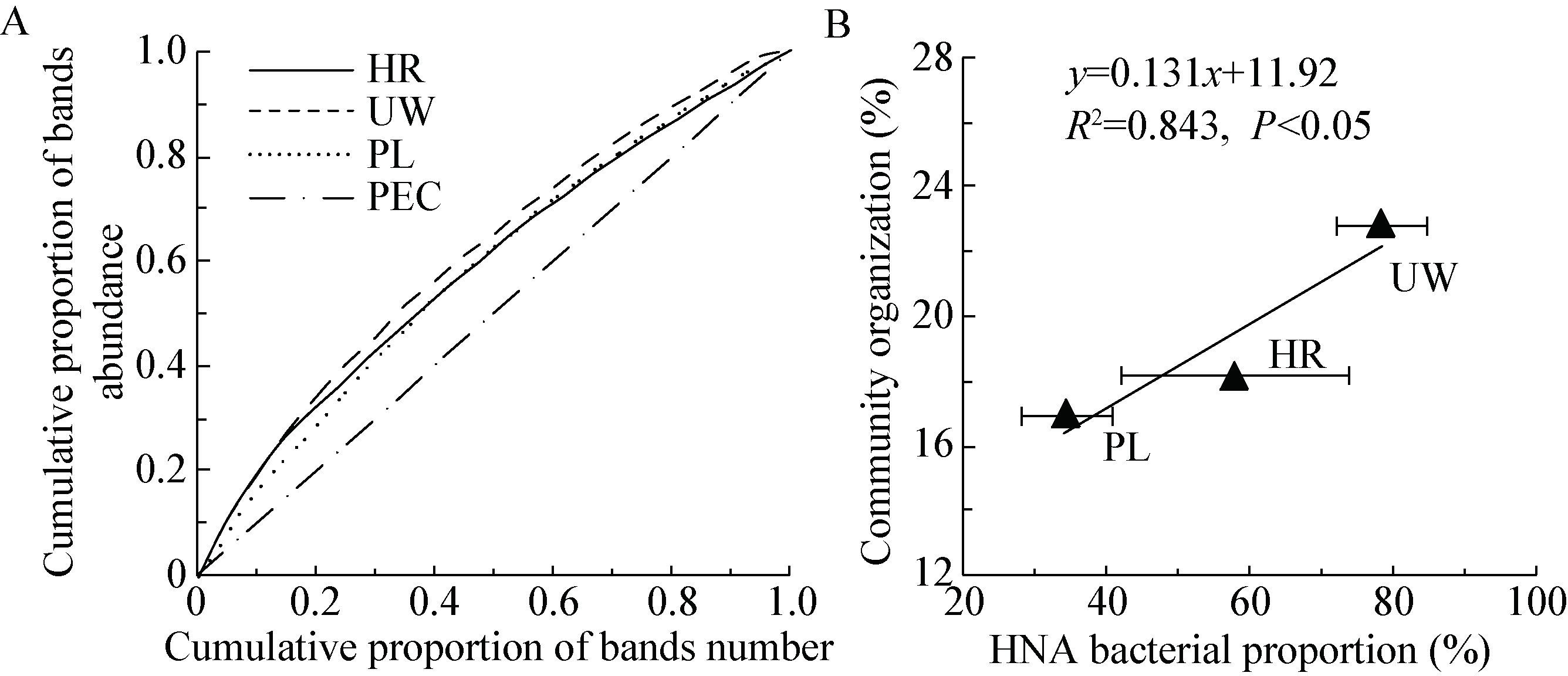
|
| 图 4 细菌群落Parelo-Lorenz曲线(A)和群落组织与HNA细菌相关性(B) Figure 4 Parelo-Lorenz curve of bacterial community (A) and Correlation of community organization and HNA bacteria (B) 注:UW:地下水;HR:海河;PL:鄱阳湖;PEC:理想均匀曲线. Note: UW,HR,PL and PEC indicate underground water,Haihe River,Poyang Lake and perfect evenness curve respectively. |
|
|
HNA细菌与微生物群落组织的正相关说明细菌基因含量与群落组织具有密切的联系。流式细胞技术中HNA和LNA细菌的分类主要是基于荧光信号FL1双峰模型,细菌DNA核酸染色后的荧光激发主要与其胞内核酸含量有关,微生物物种的基因大小和基因拷贝数共同影响细菌的荧光信号FL1[26]。由于HNA细菌中含有较高的核酸含量,即具有较大基因组,在HNA细菌比重高的水样中具有较高微生物群落组织。研究发现,在碳源等养分受限制时,LNA细菌会采取简化的代谢方式来适应这种环境,通过加强有限范围生物可利用基质的吸收机制来确保能够完成所有的代谢,这样就可以排除一些额外冗余基因(这些基因控制碳氮代谢)需要[27]。这种基因的简化,反映了细菌在应对环境变化时(如营养基质提高)改变代谢策略的能力,基因调控是高效开发竞争基质策略中不可缺少的部分,控制网络的最小化(基因最优化Streamlined genomes)是消极寡营养细菌的标志之一[28],这也解释了在寡营养环境中存在许多LNA细菌的原因。
3 结论(1) LNA细菌与过滤性细菌在FCM上具有很好的相关性(R2=0.984,P<0.01),膜过滤对水样微生物群落中LNA细菌具有极强的筛选效果,通过 0.45 μm膜过滤可以增加水样中LNA细菌的比重。
(2) LNA细菌比重与过滤性细菌比重之间的差异可能是因为:细菌的大小、整体形状及其可伸缩性导致过滤性细菌比重大于LNA细菌比重;而细菌自身的膜孔堵塞及培养条件的变化会导致过滤性细菌比重小于LNA细菌比重。
(3) 细菌的群落组织与其基因含量具有密切联系,具体地,群落组织与HNA细菌比重呈正相关性,而与LNA细菌呈负相关性。
| [1] | Wang YY, Hammes F, Boon N, et al. Quantification of the filterability of freshwater bacteria through 0.45, 0.22, and 0.1 μm pore size filters and shape-dependent enrichment of filterable bacterial communities[J]. Environmental Science & Technology , 2007, 41 (20) : 7080–7086. |
| [2] | Wang YY, Hammes F, Egli T. The impact of industrial-scale cartridge filtration on the native microbial communities from groundwater[J]. Water Research , 2008, 42 (16) : 4319–4326. DOI:10.1016/j.watres.2008.07.027 |
| [3] | Wang YY, Hammes F, Düggelin M, et al. Influence of size, shape, and flexibility on bacterial passage through micropore membrane filters[J]. Environmental Science & Technology , 2008, 42 (17) : 6749–6754. |
| [4] | Liu J, Li L, Wang YY. Distribution and ecological role of small bacteria in aquatic environments—a review[J]. Microbiology China , 2014, 41 (10) : 2100–2111. (in chinese) 刘杰, 李蕾, 王莹莹. 水环境中微小细菌的分布及生态作用研究进展[J]. 微生物学通报 , 2014, 41 (10) : 2100–2111. |
| [5] | Hahn MW. Broad diversity of viable bacteria in ‘sterile’ (0.2 μm) filtered water[J]. Research in Microbiology , 2004, 155 (8) : 688–691. DOI:10.1016/j.resmic.2004.05.003 |
| [6] | Hahn MW, Stadler P, Wu QL, et al. The filtration—acclimatization method for isolation of an important fraction of the not readily cultivable bacteria[J]. Journal of Microbiological Methods , 2004, 57 (3) : 379–390. DOI:10.1016/j.mimet.2004.02.004 |
| [7] | Young KD. The selective value of bacterial shape[J]. Microbiology and Molecular Biology Reviews , 2006, 70 (3) : 660–703. DOI:10.1128/MMBR.00001-06 |
| [8] | Wang YY, Hammes F, De Roy K, et al. Past, present and future applications of flow cytometry in aquatic microbiology[J]. Trends in Biotechnology , 2010, 28 (8) : 416–424. DOI:10.1016/j.tibtech.2010.04.006 |
| [9] | Yu H, Ma LL, Mao GN, et al. Fast and safety detection of drinking water in respect of microbial quality[J]. Microbiology China , 2012, 39 (8) : 1171–1178. (in chinese) 余辉, 马丽丽, 毛冠男, 等. 饮用水微生物的安全快速检测[J]. 微生物学通报 , 2012, 39 (8) : 1171–1178. |
| [10] | Tu T, Li L, Mao GN, et al. Analysis of bacterial diversity in the Songhua River based on nested PCR and DGGE[J]. Acta Ecologica Sinica , 2012, 32 (11) : 3505–3515. (in chinese) 屠腾, 李蕾, 毛冠男, 等. 利用细胞计数手段和DGGE技术分析松花江干流部分地区的细菌种群多样性[J]. 生态学报 , 2012, 32 (11) : 3505–3515. DOI:10.5846/stxb |
| [11] | Bouvier T, Del Giorgio PA, Gasol JM. A comparative study of the cytometric characteristics of High and Low nucleic-acid bacterioplankton cells from different aquatic ecosystems[J]. Environmental Microbiology , 2007, 9 (8) : 2050–2066. DOI:10.1111/emi.2007.9.issue-8 |
| [12] | La Ferla R, Lo Giudice A, Maimone G. Morphology and LPS content for the estimation of marine bacterioplankton biomass in the Ionian Sea[J]. Scientia Marina , 2004, 68 (1) : 23–31. DOI:10.3989/scimar.2004.68n1 |
| [13] | Ministry of Environmental Protection of the People’s Republic of China. HJ 494-2009 Water quality-Guidance on sampling techniques[S]. Beijing: China Environmental Science Press, 2009(in Chinese). 中华人民共和国环境保护部. HJ 494-2009水质采样技术指导[S]. 北京: 中国环境科学出版社, 2009 |
| [14] | Lautenschlager K, Boon N, Wang YY, et al. Overnight stagnation of drinking water in household taps induces microbial growth and changes in community composition[J]. Water Research , 2010, 44 (17) : 4868–4877. DOI:10.1016/j.watres.2010.07.032 |
| [15] | Liu J, Gao GH, Wang YY. Impact of different land practice on soil microbial community in Tianjin[J]. Acta Scientiarum Naturalium Universitatis Nankaiensis , 2014, 47 (6) : 45–52. (in chinese) 刘杰, 高广海, 王莹莹. 天津地区不同土地利用方式对土壤微生物群落的影响[J]. 南开大学学报: 自然科学版 , 2014, 47 (6) : 45–52. |
| [16] | Read S, Marzorati M, Guimarães BCM, et al. Microbial resource management revisited: successful parameters and new concepts[J]. Applied Microbiology and Biotechnology , 2011, 90 (3) : 861–871. DOI:10.1007/s00253-011-3223-5 |
| [17] | Marzorati M, Wittebolle L, Boon N, et al. How to get more out of molecular fingerprints: practical tools for microbial ecology[J]. Environmental Microbiology , 2008, 10 (6) : 1571–1581. DOI:10.1111/emi.2008.10.issue-6 |
| [18] | American Society for Testing and Materials. F838-05 Standard test method for determining bacterial retention of membrane filters utilized for liquid filtration[S]. West Conshohocken, PA: ASTM International, 2005 |
| [19] | Chandler FW Jr, Clark JW Jr. Passage of Treponema pallidium through membrane filters of various pore sizes[J]. Applied Microbiology , 1970, 19 (2) : 326–328. |
| [20] | Rubin SJ, Perlman S, Ellinghausen HC Jr. Isolation of Leptospira biflexa from commercially prepared deionized water labeled “sterile for tissue culture”[J]. Journal of Clinical Microbiology , 1980, 12 (1) : 121–123. |
| [21] | Fedotova AV, Serkebaeva YM, Sorokin VV, et al. Filterable microbial forms in the Rybinsk water reservoir[J]. Microbiology , 2013, 82 (6) : 728–734. DOI:10.1134/S0026261713060052 |
| [22] | Haller CM, Rölleke S, Vybiral D, et al. Investigation of 0.2 μm filterable bacteria from the Western Mediterranean Sea using a molecular approach: dominance of potential starvation forms[J]. FEMS Microbiology Ecology , 2000, 31 (2) : 153–161. |
| [23] | Vybiral D, Denner EBM, Haller CM, et al. Polyphasic classification of 0.2 μm filterable bacteria from the western Mediterranean Sea[J]. Systematic and Applied Microbiology , 1999, 22 (4) : 635–646. DOI:10.1016/S0723-2020(99)80017-4 |
| [24] | Isaac L, Ware GC. The flexibility of bacterial cell walls[J]. The Journal of Applied Bacteriology , 1974, 37 (3) : 335–339. DOI:10.1111/jam.1974.37.issue-3 |
| [25] | Anderson JIW, Heffernan WP. Isolation and characterization of filterable marine bacteria[J]. Journal of Bacteriology , 1965, 90 (6) : 1713–1718. |
| [26] | Button DK, Robertson BR, Lepp PW, et al. A small, dilute-cytoplasm, high-affinity, novel bacterium isolated by extinction culture and having kinetic constants compatible with growth at ambient concentrations of dissolved nutrients in seawater[J]. Applied and Environmental Microbiology , 1998, 64 (11) : 4467–4476. |
| [27] | Williams TJ, Ertan H, Ting L, et al. Carbon and nitrogen substrate utilization in the marine bacterium Sphingopyxis alaskensisstrain RB2256[J]. ISME Journal , 2009, 3 (9) : 1036–1052. DOI:10.1038/ismej.2009.52 |
| [28] | Giovannoni SJ, Tripp HJ, Givan S, et al. Genome streamlining in a cosmopolitan oceanic bacterium[J]. Science , 2005, 309 (5738) : 1242–1245. DOI:10.1126/science.1114057 |
 2016, Vol. 43
2016, Vol. 43