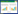中国科学院微生物研究所、中国微生物学会主办
文章信息
- 张玉玮, 李洁, 袁勇, 顾继娟, 陈鹏
- Zhang Yuwei, Li Jie, Yuan Yong, Gu Jijuan, Chen Peng
- 苦荞籽粒芦丁降解酶的纯化、酶学性质及部分一级结构分析
- Purification, characterization and partial primary structure analysis of rutin-degrading enzyme in tartary buckwheat seeds
- 生物工程学报, 2017, 33(5): 796-807
- Chinese Journal of Biotechnology, 2017, 33(5): 796-807
- 10.13345/j.cjb.160414
-
文章历史
- Received: November 1, 2016
- Accepted: January 20, 2017
荞麦,属于蓼科(Polygnaceae)荞麦属(Fagopyrum mill)。荞麦中,尤其是苦荞中含有芦丁、槲皮素和荞麦碱等重要的生理活性物质。苦荞中黄酮类化合物的含量比普通荞麦高10–100倍[1],芦丁是苦荞中重要的黄酮类化合物,具有降低毛细血管通透性和脆性、保持及恢复毛细血管的正常弹性等功能。在辅助治疗高血压、糖尿病、视网膜出血等疾病中发挥着重要作用。
荞麦中存在的芦丁降解酶极大限制了芦丁的提取和加工,并且高活性的芦丁降解酶成为高芦丁荞麦育种的重要障碍。目前对芦丁降解酶的研究主要集中于对其进行分离纯化和部分催化特性的分析。Yasuda等[2]首次从苦荞籽粒中分离纯化出分子量约为70 kDa的芦丁降解酶的两种同工酶,其Km值分别为0.12 mol/L和0.13 mol/L,后续研究发现20% (V/V)的水溶性溶剂如乙醇、DMSO可提高芦丁降解酶活性[3]。王改玲等[4]从苦荞子粒中分离出芦丁降解酶粗品,并证明是一种高活性天然β-糖甘酶,浓度高于40% (V/V)的乙醇对其有明显的抑制作用。唐宇等[5]从野生荞麦籽粒中纯化出约60 kDa的芦丁降解酶,其最适pH和最适温度分别为5.0和40 ℃。Cui等[6]从苦荞籽粒中纯化出70 kDa的芦丁降解酶,可特异性水解芦丁产生槲皮素,提出利用芦丁降解酶酶解制备槲皮素的思路。本实验室Li等[7]建立了一种利用聚丙烯酰胺凝胶电泳检测RDE同工酶的方法,并证明在苦荞种子中至少存在5种RDE同工酶。前人建立的芦丁降解酶纯化方法中,多采用在硫酸铵分级沉淀之后采用透析除盐再进行后续层析分离纯化的方式,造成蛋白透析中形成大量不可逆沉淀,影响目标蛋白的回收。因此纯化方法有待进一步优化。
作为苦荞芦丁分解代谢的关键酶,迄今为止未见芦丁降解酶一级结构研究的相关报道,因此优化芦丁降解酶的纯化方法、分析其催化特性及部分一级结构,将为克隆芦丁降解酶的基因以及揭示芦丁降解酶在次生代谢物积累过程中的生物学功能奠定重要的基础,同时为体外条件下利用芦丁降解酶的催化特性进行生物催化研究提供基础资料。本研究在引入疏水层析纯化芦丁降解酶并在分析其催化特性的基础上,利用N端测序和质谱技术,获得其成熟蛋白N端序列及内肽序列,以期为结合苦荞籽粒发育期转录组数据确定芦丁降解酶的候选基因、深入研究芦丁降解酶的生物学功能及培育高芦丁含量的苦荞品种奠定基础。
1 材料与方法 1.1 材料 1.1.1 苦荞苦荞粉,榆6-21,由陕西省榆林农业学校提供,储存于–20 ℃冰箱中。
1.1.2 主要试剂芦丁(国药集团化学试剂有限公司,BR);槲皮素(国药集团化学试剂有限公司,BR);硫酸铵(AR);无水乙酸钠(AR);冰乙酸(AR);甲醇(AR);MnCl2 (AR);AlCl3 (AR);ZnCl2 (AR);CuSO4 (AR);EDTA (AR);蔗糖(AR)。疏水层析介质(Phenyl Sepharose CL-4B)、CM-纤维素、Sephadex G-150均为GE公司产品。
1.2 芦丁降解酶的制备与纯化 1.2.1 制备芦丁降解酶粗酶液脱脂苦荞粉与15倍体积0.2 mol/L乙酸缓冲液(pH 4.0) 混匀,4 ℃提取过夜,11 500 r/min冷冻离心15 min,上清即为芦丁降解酶粗酶液,测定其蛋白质含量和芦丁降解酶活力。
1.2.2 硫酸铵分级沉淀分离粗酶液进行硫酸铵分级沉淀,收集60%–90%硫酸铵饱和度区段的沉淀蛋白,溶于含1.4 mol/L (NH4)2SO4的0.07 mol/L乙酸缓冲液(pH 4.0) 中,测定其蛋白质含量和芦丁降解酶活力。
1.2.3 疏水层析分离硫酸铵沉淀的溶解液上样于经平衡液Ⅰ (1.2 mol/L (NH4)2SO4的pH 4.0、0.06 mol/L乙酸缓冲液)平衡的Phenyl Sepharose CL-4B柱(1.8 cm×11.5 cm),用平衡液Ⅰ洗脱至A280 < 0.02,蒸馏水洗脱结合蛋白,收集芦丁降解酶活性洗脱峰,于透析液(pH 4.0,0.02 mol/L乙酸缓冲液)中透析过夜。测定其蛋白质含量和芦丁降解酶活力。
1.2.4 阳离子交换层析分离疏水层析活性峰收集液稀释2倍后上样经平衡液Ⅱ (pH 4.0,0.1 mol/L乙酸缓冲液)平衡过的CM-纤维素柱(1.8 cm×12 cm),平衡液Ⅱ洗脱至A280 < 0.02,线性梯度(NaCl浓度梯度为0.1–0.4 mol/L)洗脱结合蛋白,收集活性洗脱峰。用PEG 10 000浓缩收集液,测定其蛋白质含量和芦丁降解酶活力。
1.2.5 凝胶过滤层析分离平衡液Ⅲ (含0.4 mol/L NaCl的pH 4.0,0.2 mol/L乙酸缓冲液)充分平衡柱子,将经浓缩的蛋白样品上样于Sephadex G-150层析柱,用平衡液Ⅲ洗脱并收集活性洗脱峰,经PEG 10 000浓缩后获得纯化的芦丁降解酶,测定其蛋白质含量和酶活力,并于4 ℃保存备用。
1.3 蛋白质含量和酶活的测定粗酶液和每一次层析柱的洗脱液均进行蛋白含量和酶活性测定。蛋白质含量测定采用Bradford法[8],以牛血清白蛋白为标准蛋白。芦丁降解酶活性测定参照Chen等[9]的等吸收波长分光光度法,酶活测定体系为:160 μL 0.1%的芦丁溶液(含80 mmol/L、pH 4.0的乙酸缓冲液,20%甲醇)中加入40 μL酶液,迅速混匀,40 ℃准确保温3 min,立即加入800 μL甲醇终止反应,再加入4倍体积测定稀释液(含20 mol/L、pH 4.0的乙酸缓冲液,80%甲醇),混匀后测定372 nm和344.5 nm光吸收并计算差值ΔA。对照组以等体积乙酸缓冲液(pH 4.0、0.1 mol/L)代替酶液。以3 min光吸收的差值ΔA变化0.01定义为一个酶活力单位(1 U)。酶的总活力(Total activity)及比活力(Specific activity)的计算参考刘国琴等[10]的方法。
1.4 芦丁降解酶分子量的测定参照Laemmli UK[11]的方法,将纯化的芦丁降解酶进行SDS-PAGE。取纯化的酶液加入等体积2×SDS-PAGE上样缓冲液并沸水浴处理5 min,离心后取上清进行SDS-PAGE分析,浓缩胶浓度为3.3%,分离胶浓度为12%。经考马斯亮蓝R-250染色后于脱色液中脱色至条带清晰,拍照记录结果。
1.5 Native-PAGE分析芦丁降解酶参照Li等[7]的方法进行芦丁降解酶的Native-PAGE分析和活性染色。纯化的酶液中加入等体积含溴酚蓝的40%蔗糖溶液,上样于10%分离胶的Native-PAGE。电泳结束后分离胶置于0.1 mol/L乙酸缓冲液(pH 4.0) 中平衡40 min,然后置于30 mL、0.1%芦丁溶液(含80 mmol/L、pH 4.0的乙酸缓冲液,20%甲醇)中50 ℃反应至凝胶出现明显的黄色条带,倾去反应液用蒸馏水洗涤凝胶数次,置紫外灯下观察记录结果。
1.6 芦丁降解酶N端氨基酸测序转移SDS-PAGE凝胶中分离的芦丁降解酶条带于PVDF膜,送样至北京大学利用EDMAN降解法(Procise 491,Applied Biosystems)测定芦丁降解酶N端15个氨基酸序列。
1.7 芦丁降解酶质谱分析纯化的芦丁降解酶送至上海厚基生物科技有限公司进行质谱分析。蛋白质样品用胰蛋白酶水解后的产物通过MALDI-TOF/TOF质谱仪分析得到酶解多肽的肽指纹图谱(PMF)。选择15个强度较高的肽离子作为母离子进行MALDI-TOF-MS (基质辅助激光解吸电离飞行时间质谱)二级质谱分析,获得二级质谱图。
用ProFound (http://prowl.rockefeller.edu/prowl-cgi/profound.exe)提交PMF数据,与NCBI nr数据库比对,并将二级质谱图进行de novo解析获得内肽序列。
1.8 芦丁降解酶的催化特性分析 1.8.1 pH对芦丁降解酶活性和稳定性的影响pH对芦丁降解酶活性的影响:将纯化的芦丁降解酶分别用pH 3.0、pH 4.0、pH 5.0、pH 6.0、pH 7.0、pH 8.0的0.2 mol/L乙酸缓冲液4 ℃透析过夜,参照本文1.3的方法测定芦丁降解酶的活性。各测定样设置3次重复。
pH对芦丁降解酶稳定性的影响:将纯化的芦丁降解酶分别用pH 3.0、pH 4.0、pH 5.0、pH 6.0、pH 7.0和pH 8.0的0.2 mol/L乙酸缓冲液4 ℃透析过夜,于40 ℃水浴保温2 h,参照本文1.3的方法测定芦丁降解酶的活性。各测定样设置3次重复。
1.8.2 温度对芦丁降解酶活性和稳定性的影响温度对芦丁降解酶活性的影响:参照本文1.3的方法分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃和70 ℃温度条件下,测定芦丁降解酶的活性。各测定样设置3次重复。
温度对芦丁降解酶稳定性的影响:将纯化的芦丁降解酶分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃和70 ℃水浴中保温2 h后,参照本文1.3的方法测定芦丁降解酶的活性。各测定样设置3次重复。
1.8.3 测定芦丁降解酶的Km值和Vmax值采用双倒数作图法测定芦丁降解酶的Km值和Vmax值。分别在0.1%、0.2%、0.3%、0.4%、0.5%和0.6%的底物浓度条件下(底物溶于80 mmol/L、pH 4.0的乙酸缓冲液,20%甲醇)测定芦丁降解酶的活性。每测定设置3次重复。
1.8.4 金属离子及EDTA对芦丁降解酶活性的影响用pH 4.0、0.1 mol/L乙酸缓冲液分别配制1 mmol/L、10 mmol/L两种浓度的MnCl2、ZnCl2、CuSO4和EDTA溶液。取50 μL纯化的芦丁降解酶于1 mL各溶液中50 ℃保温2 h,参照本文1.3的方法测定处理前后各溶液中芦丁降解酶的活性。每种测定样设置3次重复。
1.8.5 甲醇对芦丁降解酶活性的影响向芦丁降解酶液中加入预冷的甲醇,使甲醇终浓度分别为10%、20%、30%、40%、50%、60%和70%。–20 ℃静置1 h,10 000 r/min冷冻离心20 min,取上清测定芦丁降解酶的活性。各测定样设置3次重复。
2 结果与分析 2.1 芦丁降解酶的纯化经过硫酸铵分级沉淀、疏水层析、阳离子交换层析和凝胶过滤层析纯化的芦丁降解酶在SDS-PAGE上显示单一条带,分子量约为66 kDa (图 1)。纯化过程中在硫酸铵分级沉淀之后引入疏水层析,有效克服了透析除盐步骤导致的沉淀对纯化的负面影响,酶的比活力由1.58 U/mg提高到20.84 U/mg,纯化倍数达到13.19倍,回收率达到7.39% (表 1)。比唐宇等[5]报道的纯化方法的纯化倍数(11.3倍)和回收率(3.5%)有所提高。纯化的芦丁降解酶经Native-PAGE分离及活性染色,借助于槲皮素的紫外吸收特性,可检测到凝胶上单一的槲皮素沉积的条带(图 2),证明纯化的蛋白为芦丁降解酶。
|
| 图 1 纯化芦丁降解酶的SDS-PAGE分析 Figure 1 SDS-PAGE analysis of purified RDE. 1: purified RDE; M: molecular weight marker. |
| |

|
| 图 2 Native-PAGE鉴定芦丁降解酶的活性(泳道1,2为重复样品) Figure 2 Identification of the activity of purified RDE by native-PAGE. Lane 1 and Lane 2 were duplicate samples. |
| |
| Step | Total protein (mg) | Total activity (U) | Specific activity (U/mg) | Recovery (%) | Purification fold |
| Crude extract of RDE | 1 072.00±53.60 a | 1 701.34±85.07 a | 1.58±0.08 a | 100.00±5.03 a | 1.00±0.05 a |
| Extract from 60%–90% (NH4)2SO4 | 510.23±25.51 b | 1 465.12±73.26 b | 2.83±0.14 b | 86.10±4.31 b | 1.79±0.09 b |
| Extract from phenyl Sepharose CL-4B | 102.51±5.13 c | 1 185.90±59.29 c | 11.50±0.58 c | 70.70±3.54 c | 7.26±0.36 c |
| Extract from CM-Sepharose | 31.47±1.57 d | 588.78±29.44 d | 18.67±0.93 d | 34.60±1.73 d | 11.79±0.59 d |
| Extract from Sephadex G-150 | 6.01±0.30 de | 125.69±6.28 e | 20.84±1.04 e | 7.39±0.37 e | 13.19±0.66 e |
| Different letters mean significant differences (P < 0.05) in each column. | |||||
将纯化的芦丁降解酶利用EDMAN降解法(Procise 491,Applied Biosystems)测定其N端15个氨基酸序列,测序结果为:N-Thr Val Ser Arg Ser Ser Phe Pro Asp Gly Phe Leu Phe Gly Leu(TVSRSSFPDGFLFGL)。利用http://www.ncbi.nm.nih.gov/BLAST/在线分析,未发现报道的相似序列。
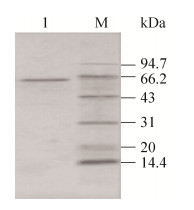
2.3 芦丁降解酶质谱分析 2.3.1 芦丁降解酶肽指纹图谱分析对芦丁降解酶进行MALDI-TOF/TOF质谱分析,得到其肽指纹图谱(PMF) (图 3)。用在线分析软件ProFound进行数据分析,未发现类似的蛋白质质谱数据。
|
| 图 3 芦丁降解酶肽指纹图谱 Figure 3 The peptide mapping fingerprint of RDE. |
| |
选择芦丁降解酶PMF质荷比分别为1 751.82、937.5、1 658.8、1 675.864、1 170.643 3、1 227.67、1 732.89、1 085.66、2 207.728 9、1 453.616、1 562.8、1 022.5、1 186.556、1 365.68和999.656 3的15个肽段作为母离子进行MALDI-TOF-MS (基质辅助激光解吸电离飞行时间质谱)二级质谱分析,并进行de novo测序,获得的15段芦丁降解酶内肽序列为:ETGL(I)NTFR,MTPVVYGEYPESMR,NGFTFVDYDNNL(I)TR,L(I)TYHSGHL(I)DK,GL(I)TYHSGHL(I)DK,L(I)SYTTDNHATTSFFK,L(I)SGGL(I)NQL(I)GVK,ETYNNPAVVL(I)TENG,AL(I)PVVYGEY,VADDFYHR,QYEGAAFTDGK,QSYEQLAEKNR和SL(I)GL(I)FPPL(I)R。芦丁降解酶一级结构的信息至今尚无报道,本研究获得的N端序列以及内肽序列为借助于转录组数据确定目标基因奠定了基础。
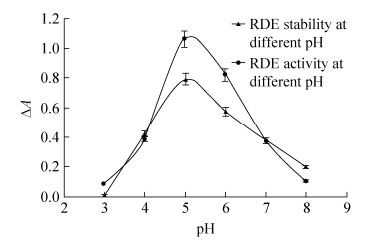
2.4 芦丁降解酶酶学性质研究 2.4.1 pH对芦丁降解酶活性和稳定性的影响如图 4所示,pH对芦丁降解酶活性有显著的影响。在pH 3.0–8.0范围内芦丁降解酶均有活性且活性呈先增高后降低的规律,在pH 5.0时酶活性最大。pH是影响酶储存稳定性的重要参数,将处于pH 3.0–8.0的缓冲液的芦丁降解酶40 ℃保温2 h后在最适催化条件下测定其残余活性,发现pH对芦丁降解酶稳定性的影响与对其活性影响的趋势一致。最适pH和最稳定pH为芦丁降解酶的分离纯化、催化反应及保存条件的选择提供了基础资料。本研究结果与唐宇等[5]和Bourbouze等[12]纯化的芦丁降解酶的最适pH值基本一致。
|
| 图 4 pH对芦丁降解酶活性和稳定性的影响 Figure 4 Effect of pH on the RDE activity and stability. |
| |
温度是影响酶活性的重要因素。如图 5所示,芦丁降解酶在20–70 ℃温度范围内均有活性,且活性呈先增高后降低的规律,在50 ℃时活性最高,高于50 ℃芦丁降解酶活性急剧下降。稳定性分析显示,预保温温度在20–50 ℃范围内芦丁降解酶的活性无明显的变化,但当温度超过60 ℃时酶的稳定性急剧下降,70 ℃预保温2 h酶的活性仅残留约45%。唐宇等[5]和Bourbouze等[12]从荞麦籽粒中纯化的芦丁降解酶的最适温度分别为40 ℃和30 ℃,与本实验结果存在较大的差异,很可能是由于研究对象属于不同的芦丁降解酶同工酶。
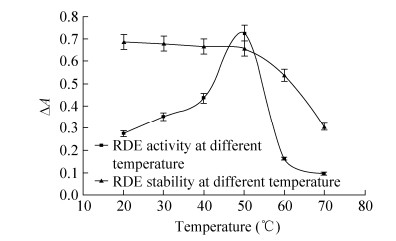
|
| 图 5 温度对芦丁降解酶活性和稳定性的影响 Figure 5 Effect of temperature on RDE activity and stability. |
| |
测定芦丁降解酶在梯度底物浓度条件下的反应速度,根据Lineweaver-Burk双倒数作图法计算其Km值和Vmax值分别为0.27 mmol/L和39.68 U/mg (图 6)。Baumgertel等[13]报道的芦丁降解酶的Km值和Vmax值分别为0.561 μmol/L和44.69 U/mg,Yasuda等[2]从苦荞籽粒中纯化的两种芦丁降解酶同工酶的Km值分别为0.12 mol/L和0.13 mol/L。该研究与前人报道的结果存在较大的差异,很可能是由于研究对象分别属于不同的芦丁降解酶同工酶。
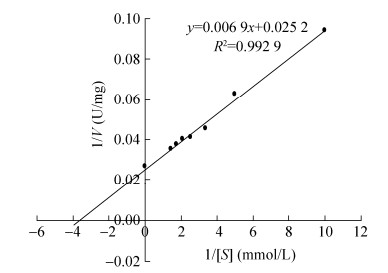
|
| 图 6 Lineweaver-Burk双倒数作图法测定芦丁降解酶的Km和Vmax Figure 6 Determination of the Km and Vmax of RDE by Lineweaver-Burk reciprocal plot graphic method. |
| |
金属离子对芦丁降解酶活性的影响与离子的种类和浓度有关(表 2)。低浓度的金属离子即可对芦丁降解酶活性产生抑制,其中10 mmol/L ZnCl2对芦丁降解酶的抑制作用最强,残余酶活仅为54.36%±2.70%;1 mmol/L CuSO4对芦丁降解酶的抑制作用最弱,残余酶活为89.47%±3.60%。此外,EDTA对芦丁降解酶也有抑制作用。
| Metal ion/ EDTA | Residual activity | |
| Concentration 1 (1 mmol/L) | Concentration 2 (10 mmol/L) | |
| MnCl2 | 74.01%±4.60%** | 73.68%±5.30%** |
| ZnCl2 | 69.23%±3.90%** | 54.36%±2.70%** |
| CuSO4 | 89.47%±3.60%* | 83.87%±4.50%** |
| EDTA | 76.32%±2.10%** | 69.54%±1.40%** |
| Analysis of significant difference between enzyme activity with T test. Control: the activity of untreated RDE. *: significant difference (P < 0.05); **: extremely significant difference (P < 0.01). | ||
如图 7所示,甲醇终浓度在10%–50% (V/V)范围内芦丁降解酶的活性几乎无明显变化,当甲醇终浓度大于50%时酶活性迅速下降,表明芦丁降解酶能够耐受50% (V/V)的甲醇,对甲醇有良好的耐受性。与陈芳霞[14]研究的芦丁降解酶对甲醇耐受性的结果相似。
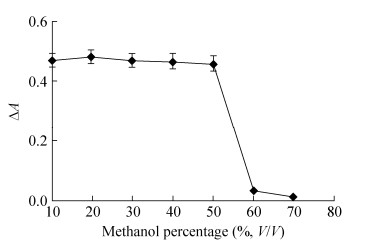
|
| 图 7 甲醇对芦丁降解酶活性的影响 Figure 7 Effect of methanol on the activity of RDE. |
| |
芦丁降解酶是荞麦中重要的内源性糖苷酶,其特异性水解芦丁,是苦荞苦味的重要来源之一。Yasuda等[15]首先报道苦荞中的芦丁降解酶主要分布在子叶和种皮中,苦荞中芦丁降解酶的活性较普通荞麦高680倍。与荞麦芦丁代谢相关的酶的表达调控已有少量的文献报道。Suzuki等对苦荞中的3-黄酮醇-葡萄糖苷酶活性及黄酮类化合物的含量进行了一系列研究,发现在苦荞和普通荞麦种子成熟过程中,3-芦丁-葡萄糖苷酶和3-异槲皮苷-葡萄糖苷酶活性增大,在完全成熟的种子中活性略有降低。芦丁和异槲皮苷浓度随种子成熟而增加,芦丁在完全成熟的种子中保持较高浓度[16]。UV-B辐射、干旱和低温胁迫的苦荞,其叶片中3-芦丁-葡萄糖苷酶活性分别增加了363%、158%和190%,芦丁含量变化分别为增加了122%、129%和无明显变化[17]。苦荞种子萌发后其子叶和种皮中的黄酮醇-3-葡萄糖苷酶活性下降,种子萌发12 d内芦丁含量逐渐增大,而槲皮素含量在种子萌发后立即增大,萌发后第4天达到峰值并在4–12 d基本保持不变[18]。国内王改玲[19]研究表明,苦荞籽粒萌发过程中芦丁含量增高,芦丁降解酶活性被抑制。陈鹏等[20]研究发现苦荞籽粒萌发过程中总黄酮含量增加,籽粒萌发3 d内种胚中的芦丁降解酶活性无明显变化,从第4天开始迅速下降,至胚被子叶完全吸收其活性消失,内种皮中的芦丁降解酶则在籽粒萌发过程中一直保持较高活性。周小理等[21]用磁场影响苦荞种子萌发,发现磁场处理3 d内芦丁降解酶的活性受磁场影响而增加,第4–7天其活性基本不受磁场影响,苦荞籽粒中类黄酮的含量也随磁场对芦丁降解酶(RDE)、苯丙氨酸解氨酶(PAL)和查尔酮异构酶(CHI)活性的影响而增加。以上研究显示,芦丁降解酶与苦荞次生代谢物的累积有着密切的关系。
Yasuda等[2]首次从苦荞种子中纯化了分子量为70 kDa的芦丁降解酶。国内唐宇等[5]和Cui等[6]从苦荞种子中纯化了分子量分别为60 kDa和70 kDa的芦丁降解酶。本实验室采用非变性电泳结合Western blotting的方法证明在苦荞种子中至少存在5种芦丁降解酶的同工酶[7]。Km和Vmax以及温度和pH是表征酶特征的重要参数。唐宇等[5]和Bourbouze等[12]纯化的芦丁降解酶最适pH值和最适温度分别为pH 5.0、40 ℃和pH 4.8、30 ℃,且Baumgertel等[13]纯化的芦丁降解酶的Km值和Vmax值分别为0.561 μmol/L和44.69 U/mg。Yasuda等分离的芦丁降解酶粗酶液在pH 3.0–7.0范围内有活性,并在温度高于70 ℃时失活[15],其纯化的两种芦丁降解酶Km值分别为0.12 mol/L和0.13 mol/L[2]。本研究纯化的66 kDa芦丁降解酶最适pH值和最适温度分别为pH 5.0、50 ℃,在pH 3.0–8.0和20–70 ℃有活性,Km值和Vmax值分别为0.27 mmol/L、39.68 U/mg。
已有的芦丁降解酶研究证明在苦荞中存在芦丁降解酶的同工酶形式,但研究并未获得芦丁降解酶的一级结构信息。本研究在纯化获得芦丁降解酶的基础上,通过N端测序和质谱分析获得了芦丁降解酶N端的氨基酸序列和15个内肽段的序列,为克隆芦丁降解酶的基因以及深入研究芦丁降解酶的生物学功能奠定了基础,也为通过分子手段培育高芦丁荞麦品种奠定了基础。
有机溶剂特别是极性有机溶剂是酶的强变性剂。不同酶对有机溶剂的敏感性存在较大的差异。Yasuda等[3]研究表明20% (V/V)的水溶性溶剂如乙醇、DMSO可提高芦丁降解酶活性。徐宝才等[22]研究发现芦丁降解酶在20%乙醇中活性最高。王改玲等[4]发现浓度高于40% (V/V)的乙醇对芦丁降解酶有明显的抑制作用。陈芳霞[14]研究发现芦丁降解酶在10%–40%的甲醇中活性变化不明显,50% (V/V)的甲醇使其活性降低。本研究纯化获得的芦丁降解酶可以耐受50%的甲醇,这种对有机溶剂的耐受性在酶学研究中鲜有报道,对从蛋白质结构的角度深入探讨芦丁降解酶对有机溶剂耐受性的内在机制有着重要的理论价值,同时为非水相体系中芦丁降解酶的催化活性的应用奠定基础。非水酶学是酶学发展的重要分支,在非水相条件下一些酶可以完成水相条件下不能实现的催化反应,并已展现出显著的生物催化优势。夏咏梅等[23]研究发现无溶剂非水相中脂肪酶能够高效催化葵酸偏甘油酯的合成,且操作性和经济性远高于其他类型的葵酸偏甘油酯合成反应。Kansal等[24]研究维斯假丝酵母Candida viswanathii全细胞参与的转化反应时,发现加入异丙醇可使底物溶解度和转化率增大,70 mmol/L底物反应1 h,转化率增加了81%。利用酶在微水有机溶剂、离子性液体和反胶束体系等非水相体系中催化生产食品添加剂,如酸酯、糖酯和维生素等,能够简化合成步骤,降低成本和分离纯化的复杂性,促进了食品添加剂的快速和可持续发展[25]。利用脂肪酶在有机溶剂中催化制备手性药物中间体,可以完成在水相化学合成中难以进行的反应,并且反应成本低、安全性好,产物收率高、有良好的化学性能[26]。非水相条件下生物催化剂的活性及稳定性下降是酶的非水酶学应用的最大障碍,筛选和提高耐有机溶剂的酶是非水相体系实践应用的重要前提[27]。本研究纯化获得的芦丁降解酶对极性有机溶剂表现出优异的耐受性,对其非水相条件下催化特性的深入分析,将有助于其在糖苷类次生代谢物转化中的应用,特别是用于自然界稀有次生代谢物的转化和合成。
本研究优化建立了苦荞籽粒66 kDa芦丁降解酶的纯化方法,其Km值和Vmax分别为0.27 mmol/L和39.68 U/mg,最适pH和最适温度分别为pH 5.0和50 ℃。Cu2+、Zn2+、Mn2+和EDTA对其有不同程度的抑制作用。纯化的芦丁降解酶可耐受50% (V/V)的甲醇。获得了芦丁降解酶N端15个氨基酸序列和15个内肽段序列。部分一级结构的获得为确定芦丁降解酶的候选基因以及深入研究芦丁降解酶的生物学功能奠定了基础。
| [1] | Fabjan N, Rode J, Košir IJ, et al. Tartary buckwheat (Fagopyrum tataricum Gaertn.) as a source of dietary rutin and quercitrin. J Agric Food Chem, 2003, 51(22): 6452–6455. DOI: 10.1021/jf034543e |
| [2] | Yasuda T, Nakagawa H. Purification and characterization of the rutin-degrading enzymes in tartary buckwheat seeds. Phytochemistry, 1994, 37(1): 133–136. DOI: 10.1016/0031-9422(94)85012-7 |
| [3] | Yasuda T, Shinoyama H. The activity of rutin-degrading enzyme in the presence of water-soluble organic solvents. Nipp. Shok. Kaga Koga Kaishi, 1995, 42(12): 1012–1018. DOI: 10.3136/nskkk.42.1012 |
| [4] |
Wang GL, Zhou L, Liang R, et al. Effect of different extraction conditions on rutin hydrolysis of fagopyrum tataricum seeds.
Acta Bot Boreal-Occident Sin, 2005, 25(5): 1035–1038.
(in Chinese). 王改玲, 周乐, 梁冉, 等. 不同提取条件对苦荞籽粒中芦丁降解的影响. 西北植物学报, 2005, 25(5): 1035-1038. |
| [5] |
Tang Y, Shao JR, Luo QL, et al. Purification of rutin degrading enzyme from wild buckwheat kernels.
J Sichuan Agric Univ, 2011, 29(3): 391–396.
(in Chinese). 唐宇, 邵继荣, 罗庆林, 等. 野生荞麦籽粒中芦丁降解酶的分离纯化. 四川农业大学学报, 2011, 29(3): 391-396. |
| [6] | Cui XD, Wang ZH. Preparation and properties of rutin-hydrolyzing enzyme from tartary buckwheat seeds. Food Chem, 2012, 132(1): 60–66. DOI: 10.1016/j.foodchem.2011.10.032 |
| [7] | Li YP, Deng DD, Zhang XB, et al. Direct detection of rutin-degrading isozymes with polyacrylamide gel electrophoresis. Anal Biochem, 2013, 443(2): 240–242. DOI: 10.1016/j.ab.2013.09.010 |
| [8] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 1976, 72(1/2): 248–254. |
| [9] | Chen P, Gu JJ. A rapid measurement of rutin-degrading enzyme activity in extract of tartary buckwheat seeds. Food Bioprod Process, 2011, 89(1): 81–85. DOI: 10.1016/j.fbp.2010.02.002 |
| [10] |
Liu GQ, Wu W, Chen P.
Current Experimental Techniques for Protein. Beijing: China Agricultural University Press, 2011: 138-142(in Chinese).
刘国琴, 吴玮, 陈鹏. 现代蛋白质实验技术. 北京: 中国农业大学出版社, 2011: 138-142. |
| [11] | Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970, 227(5259): 680–685. DOI: 10.1038/227680a0 |
| [12] | Bourbouze R, Pratviel-Sosa F, Percheron F. Purification, properities and specifity of heteroglycosidase from buckwheat granis. Biochimie, 1974, 56: 1305–1313. |
| [13] | Baumgertel A, Grimm R, Eisenbeiß W, et al. Purification and characterization of a flavonol 3-O-β-heterodisaccharidase from the dried herb of Fagopyrum esculentum Moench. Phytochemistry, 2003, 64(2): 411–418. DOI: 10.1016/S0031-9422(03)00418-7 |
| [14] |
Chen FX. Gene polymorphisms, expression and characterization of rutin degrading enzyme from tatary buckwheat[D]. Xianyang: Northwest A & F University, 2016 (in Chinese). 陈芳霞. 苦荞芦丁降解酶基因多态性分析和蛋白重组表达及催化特性分析[D]. 咸阳: 西北农林科技大学, 2016. |
| [15] | Yasuda T, Masaki K, Kashiwagi T. An enzyme degrading rutin in tartary buckwheat seeds. Nipp. Shok. Kaga Koga Kaishi, 1992, 39(11): 994–1000. |
| [16] | Suzuki T, Honda Y, Funatsuki W, et al. Purification and characterization of flavonol 3-glucosidase, and its activity during ripening in tartary buckwheat seeds. Plant Sci, 2002, 163(3): 417–423. DOI: 10.1016/S0168-9452(02)00158-9 |
| [17] | Suzuki T, Honda Y, Mukasa Y. Effects of UV-B radiation, cold and desiccation stress on rutin concentration and rutin glucosidase activity in tartary buckwheat (Fagopyrum tataricum) leaves. Plant Sci, 2005, 168(5): 1303–1307. DOI: 10.1016/j.plantsci.2005.01.007 |
| [18] | Suzuki T, Kim SJ, Takigawa KS, et al. Changes in rutin concentration and flavonol-3-glucosidase activity during seedling growth in tartary buckwheat (Fagopyrum tataricum Gaertn.). Can J Plant Sci, 2007, 87(1): 83–87. DOI: 10.4141/P05-151 |
| [19] |
Wang GL. Study on rutin and rutin-degrading enzymes in the seed of buckwheat[D]. Yangling: Northwest A & F University, 2005 (in Chinese). 王改玲. 苦荞籽粒中芦丁及芦丁降解酶的应用研究[D]. 杨凌: 西北农林科技大学, 2005. |
| [20] |
Chen P, Hou ZF. Metabolic profiles of rutin-degrading enzyme during seed germination process of tartary buckwheat.
Acta Agric Boreal-Occident Sin, 2010, 19(7): 48–52.
(in Chinese). 陈鹏, 侯智法. 苦荞种子萌发过程芦丁降解酶的代谢规律. 西北农业学报, 2010, 19(7): 48-52. |
| [21] |
Zhou XL, Fang X, Zhou YM, et al. Effect of magnetic field stimulation on flavonoid synthesis in tartary buckwheat (Fagopyrum tataricum Gaertn.) sprouts.
Food Sci, 2012, 33(21): 20–23.
(in Chinese). 周小理, 方向, 周一鸣, 等. 磁场对苦荞种子萌发过程中黄酮类物质的诱导效应. 食品科学, 2012, 33(21): 20-23. |
| [22] |
Xu BC, Ding XL. Study on the extraction process of flavonoids from tartary buckwheat shell.
Sci Technol Food Ind, 2002, 23(8): 40–43.
(in Chinese). 徐宝才, 丁霄霖. 苦荞壳中黄酮提取工艺的研究. 食品工业科技, 2002, 23(8): 40-43. |
| [23] |
Xia YM, Fang Y, Zhang KC, et al. Synthesis of partial glycerol caprates by using lipase in nonaqueous media.
Chin J Biotech, 2002, 18(6): 735–739.
(in Chinese). 夏咏梅, 方云, 章克昌, 等. 非水相酶促合成癸酸偏甘油酯的研究. 生物工程学报, 2002, 18(6): 735-739. |
| [24] | Kansal H, Banerjee UC. Enhancing the biocatalytic potential of carbonyl reductase of Candida viswanathii using aqueous-organic solvent system. Bioresour Technol, 2009, 100(3): 1041–1047. DOI: 10.1016/j.biortech.2008.08.042 |
| [25] | Yu SL, Yu L, Yu B, et al. Advances in application of non-aqueous phase enzymatic catalysis in food additive production. Agric Sci Technol, 2013, 14(1): 169–175. |
| [26] |
Zhao SX. Research progress of nonaqueous phase lipase in preparing chiral drug intermediates.
Chin Adhes, 2015, 24(10): 53–58.
(in Chinese). 赵世霞. 非水相中脂肪酶制备手性药物中间体的研究进展. 中国胶粘剂, 2015, 24(10): 53-58. |
| [27] |
Yang ZY, Ni Y, Sun ZH. Recent trend of nonaqueous enzymology and biocatalysis in nonaqueous media.
Chin J Biotech, 2009, 25(12): 1779–1783.
(in Chinese). 杨仲毅, 倪晔, 孙志浩. 非水酶学和非水相生物催化研究进展. 生物工程学报, 2009, 25(12): 1779-1783. DOI:10.3321/j.issn:1000-3061.2009.12.004 |
 2017, Vol. 33
2017, Vol. 33