中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 郑洁, 孟佑婷, 刘桂君. 2017
- Jie Zheng, Youting Meng, Guijun Liu. 2017
- 动物血红素过氧化物酶参与细菌氧化Mn(Ⅱ)的研究进展
- Advances in bacterial Mn(Ⅱ) oxidation by animal haem peroxidases
- 微生物学报, 57(7): 969-977
- Acta Microbiologica Sinica, 57(7): 969-977
-
文章历史
- 收稿日期:2016-12-09
- 修回日期:2017-02-23
- 网络出版日期:2017-05-11
锰(Mn)是地球上含量仅次于铁的第二大过渡金属元素,在自然界中常见的三种价态为Mn(Ⅱ)、Mn(Ⅲ)和Mn(Ⅳ)。Mn(Ⅱ)在酸性、微酸性和无氧化剂的条件下比较稳定,主要以可溶态存在,氧化剂存在时会被氧化;Mn(Ⅲ)是不稳定的中间态,易发生歧化反应生成Mn(Ⅱ)和Mn(Ⅳ),在磷酸、焦磷酸盐或某些有机配体(如草酸)存在时,可与其形成稳定的络合物;Mn(Ⅳ)多以不溶的氧化物形式存在,即锰氧化物(manganese oxides)[1]。锰氧化物广泛存在于自然界中,具有很高的化学反应活性和较强的吸附能力,可以参与多种氧化还原反应,决定着碳、氮和多种重金属元素的形态迁移及转化,在多种元素的生物地球化学循环中起着重要的作用[1-2]。
根据现有研究,自然界中锰氧化物的形成与微生物的作用密不可分,微生物氧化Mn(Ⅱ)的速率要远远高于非生物的氧化速率[3-4]。因此自20世纪起,研究者们就开始对微生物氧化Mn(Ⅱ)的过程和分子机理进行研究。截至目前,细菌中已鉴定出两类参与Mn(Ⅱ)氧化的蛋白酶,分别为多铜氧化酶(multicopper oxidases,MCOs)[5-6]和动物血红素过氧化物酶(animal haem peroxidases,AHPs)[7]。MCOs是一类含铜蛋白质,具有多种铜结合结构域,将2分子的O2还原过程与另一底物的氧化过程偶联在一起[5]。已知多种锰氧化模式菌,比如芽孢杆菌(Bacillus sp.) SG1[8]、恶臭假单胞菌(Pseudomonas putida) GB-1[6]、纤发盘丝菌(Leptothrix discophora) SS-1[9]都利用MCOs氧化Mn(Ⅱ)。2009年,研究者在细菌中发现了另一种Mn(Ⅱ)氧化蛋白酶,命名为MopA (manganese-oxidizing peroxidase)。在酶学分类上,MopA属于AHPs[10]。近些年,研究者从不同环境条件下分离出了利用AHPs氧化Mn(Ⅱ)的细菌[10-11],并对AHPs氧化Mn(Ⅱ)的机理进行了研究。结果表明,AHPs在蛋白结构和氧化方式上都与MCOs有较大的差异[10-12],对于揭示细菌氧化Mn(Ⅱ)的过程和机理具有独特意义。因此,本文重点关注细菌中的AHPs,从其蛋白家族入手,对酶的结构特征及基因、氧化方式及影响因素进行了综述。全面了解不同酶参与微生物氧化Mn(Ⅱ)的过程对于深入分析环境中锰氧化物的成因具有重要的意义,同时也可以为细菌氧化Mn(Ⅱ)内在驱动力的分析提供更多依据。
1 利用AHPs氧化Mn(Ⅱ)的细菌截至目前,利用AHPs氧化Mn(Ⅱ)的细菌主要集中于变形菌门的α亚纲和γ亚纲,分布于橙单胞菌属、赤杆菌属、玫瑰杆菌属及假单胞菌属(表 1)。研究人员认为,赤杆菌(Erythrobacter sp.) SD-21和橙单胞菌(Aurantimonas manganoxydans) SI85-9A1可以通过AHPs的酶学作用直接氧化Mn(Ⅱ)[10],而玫瑰杆菌(Roseobacter sp.) AzwK-3b则很有可能是通过AHPs产生超氧化物(Superxoide,O2−),再由O2−作为氧化剂对Mn(Ⅱ)进行氧化[7]。虽然玫瑰杆菌AzwK-3b氧化Mn(Ⅱ)的过程是通过产生O2−实现的,但是自然界中很多产生O2−的非自养菌并不具备氧化Mn(Ⅱ)的能力,比如玫瑰杆菌属的鲁杰氏菌(Ruegeria sp.) TM1040[13-14]。最新的研究结果表明,假单胞菌GB-1体内同时含有2类锰氧化酶。早先的研究表明,假单胞菌GB-1可以利用MCOs氧化Mn(Ⅱ)[6],最近研究人员在该菌的鞭毛调节因子FleQ (flagellar regulators Q)的敲除突变株中发现,假单胞菌GB-1同时含有MopA的同源蛋白。因此,研究人员推测在假单胞菌GB-1中,鞭毛调节因子FleQ和FleN (flagellar regulators N)很有可能通过某种暂不明确的路径调节Mn(Ⅱ)氧化酶的活性[11]。虽然目前仅有部分利用AHPs氧化Mn(Ⅱ)的菌株得以鉴定,且主要集中于变形菌门,但研究者推测自然环境中可以利用MopA或其同源蛋白氧化Mn(Ⅱ)的细菌比预想的更广泛[15]。
| Strains | Taxonomic status | Isolation | References |
| Aurantiwonas manganoxydans SI85-9A1 | Alpha proteobacteria | Water | [10] |
| Erythrobacter sp. SD-21 | Alpha proteobacteria | Sediments | [16] |
| Roseobacter sp. AzwK-3b | Alpha proteobacteria | Sediments and surface water | [14] |
| Pseudomonas putida GB-1 | Gamma proteobacteria | Freshwater | [11] |
2 细菌中的AHPs 2.1 AHPs蛋白家族
AHPs是一类以血红素作为辅因子的蛋白酶类,可以利用H2O2作为电子受体,催化一系列的氧化还原反应。在系统分类上,AHPs属于过氧化物酶蛋白家族的过氧化物酶-环氧酶超家族(cyclooxygenase-peroxidase superfamily)[17]。过氧化物酶-环氧酶超家族包含7个亚家族,其中以原核生物作为代表的3个亚家族分别为Peroxicins、Peroxidockerins和Primordial peroxidases[17]。AHPs属于Peroxicin亚家族[17],Peroxicin亚家族的蛋白在结构上具有2个主要特征,其一是具有1个或多个血红素结合位点,其二是在血红素结合位点的C末端具有多个repeat-in-toxin (RTX)结构域[17-18]。含有RTX结构域的蛋白也称为RTX型外分泌蛋白,这种类型的蛋白广泛分布于革兰氏阴性菌,可以通过细菌Ⅰ型分泌系统进行跨膜运输,通过甘氨酸和富天冬氨酸的重复序列结合钙离子。RTX型外分泌蛋白早先被认为是病原菌中的毒素蛋白因子,但越来越多的研究发现很多细菌都可以产生RTX蛋白,也有发现RTX蛋白具有抗菌等多样化的功能[19]。
2.2 细菌AHPs的蛋白结构及基因簇锰氧化细菌中的AHPs具有长短不一的氨基酸序列,长度1000-4000个氨基酸不等,但都预测具有1个或多个血红素催化结构域和多个RTX型钙离子结合位点(也称溶血型钙离子结合位点)。目前已知AHPs通过血红素催化结构域氧化Mn(Ⅱ),C末端的钙离子结合位点可能有助于提高AHPs对Mn(Ⅱ)的亲和性[16]。不同菌株的AHPs预测含有的血红素催化结构域和RTX型钙离子结合位点的数量并不相同,具体的预测结构如图 1所示,该图的绘制参考文献[7, 10-11, 16]及Uniprot数据库中相应信息。对于这种数量的差异与酶氧化Mn(Ⅱ)的能力是否具有相关性,目前尚无直接的实验证据,有待进一步研究。2012年,有研究者在细菌中发现了PERCAL钙离子结合模体,这种模体与RTX钙离子结合模体不同,它存在于血红素结构域的内部,赤杆菌SD-21、玫瑰杆菌AzwK-3b及假单胞菌GB-1等锰氧化细菌中都含有这种新发现的钙离子结合模体[20],但该模体与锰氧化功能是否具有某种联系同样需要进一步研究。
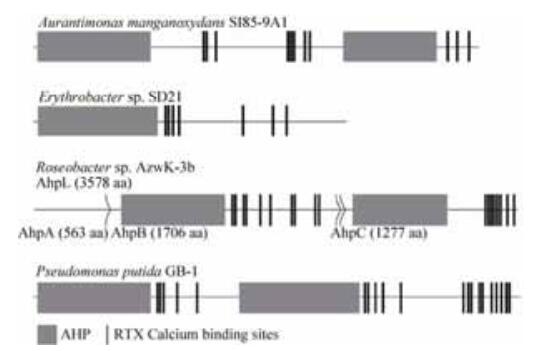
|
| 图 1 细菌AHPs结构示意图 Figure 1 Protein diagram of AHPs in bacteria. |
玫瑰杆菌AzwK-3b的AHPs由2个位点的DNA序列编码而成,其中1个位点编码全长3578个氨基酸的蛋白AhpL,另外一个位点编码AhpA (563 aa)、AhpB (1706 aa)和AhpC (1277 aa) 3个蛋白(图 1)。AhpA、AhpB和AhpC 3个蛋白与AhpL具有98%的序列相似度[7]。赤杆菌SD-21、橙单胞菌SI85-9A1以及假单胞菌GB-1都具有单拷贝的mopA基因[10-11],其中假单胞菌GB-1中mopA基因的表达可能受调节因子FleQ的影响[11]。
3 细菌AHPs对Mn(Ⅱ)的氧化根据目前的研究结果,细菌利用AHPs对Mn(Ⅱ)的氧化可能分为直接和间接2种方式,直接氧化即AHPs直接催化氧化Mn(Ⅱ),间接氧化则是AHPs通过产生O2−,再由O2−氧化Mn(Ⅱ)。不管是直接还是间接的氧化方式,都可能通过单电子的转移先将Mn(Ⅱ)氧化为Mn(Ⅲ),再进一步形成Mn(Ⅳ)。
3.1 直接氧化大肠杆菌异源表达MopA的体外实验证明了赤杆菌SD-21中的MopA具有Mn(Ⅱ)氧化能力,Leukoberbelin blue (LBB)显色实验可以检测到体系中锰氧化物的形成[16]。在橙单胞菌SI85-9A1和赤细菌SD-21的无细胞滤液中,检测到了焦磷酸钠-Mn(Ⅲ)络合物(258 nm),提示AHPs直接氧化Mn(Ⅱ)过程中产生了中间产物Mn(Ⅲ)[10] (图 2中绿色箭头所示)。在酶学分类上,AHPs属于血红素过氧化物酶家族,这个家族的酶在氧化反应过程中通常利用H2O2作为电子受体[17]。研究人员以大肠杆菌异源表达的AHPs为实验材料,通过向反应体系中添加过氧化氢酶考察H2O2含量对氧化反应的影响。结果显示,体系中添加过氧化氢酶后,氧化并没有受到较大的影响,因此研究者认为H2O2的含量对AHPs氧化Mn(Ⅱ)的影响较小,可能并不直接作为底物参与AHPs对Mn(Ⅱ)的氧化[16]。在直接氧化Mn(Ⅱ)的细菌中,锰氧化酶MopA的表达受Mn(Ⅱ)的诱导[10],因此在不外加Mn(Ⅱ)的培养基中,检测不到锰氧化物的生成。

|
| 图 2 AHPs氧化Mn(Ⅱ)的途径推测 Figure 2 Possible pathway of Mn(Ⅱ) oxidation by AHPs. During the direct oxidation process (green arrows), AHPs are presumed to oxidize Mn(Ⅱ) to Mn(Ⅲ), which is further oxidized to Mn(Ⅳ) or disproportionated to Mn(Ⅳ) and Mn(Ⅱ). In the indirect oxidation process (red arrows), it is presumed that AHPs produces O2− through an unknown mechanism, and then O2− oxidizes Mn(Ⅱ) to Mn(Ⅲ). Mn(Ⅲ) is further oxidized or disproportionated to Mn(Ⅳ). In indirect oxidation, H2O2 may be degraded by AHPs in order to prevent H2O2 from reducing Mn(Ⅲ) to Mn(Ⅱ) (red dotted arrows) and to prevent further progress of the reaction (red dotted arrow). |
3.2 间接氧化
与直接氧化的过程不同,玫瑰杆菌AzwK-3b的AHPs可能通过产生的O2−氧化Mn(Ⅱ)[7, 21] (推测的反应过程如图 2所示)。利用氯化硝基四氮唑蓝(Nitroblue tetrazolium,NBT)与O2−反应生成不溶蓝色产物的特性,可以对实验过程中产生的O2−做定性及定量检测。反应体系中,NBT显色反应表明有O2−产生,而添加超氧化物歧化酶(Superoxide dismutase,SOD)消耗掉O2−后,则几乎检测不到锰氧化物的生成[7, 21]。在间接氧化的实验体系中,同样可以利用焦磷酸钠法检测到焦磷酸钠-Mn(Ⅲ)的生成[7],因此在Mn(Ⅱ)氧化至Mn(Ⅳ)过程中,很有可能也形成了中间产物Mn(Ⅲ) (图 2,红色箭头所示)。假设AHPs对Mn(Ⅱ)的氧化按照以上的方式进行,那么O2−与Mn(Ⅱ)反应会生成H2O2 (反应式1),生成的H2O2作为一种还原剂可以将Mn(Ⅲ)再次还原为Mn(Ⅱ) (反应式2,图 2红色虚线箭头),从而阻止Mn(Ⅲ)继续氧化生成锰氧化物(反应式3、4和5)[22]。因此,研究者认为在玫瑰杆菌AzwK-3b中,除了需要具有生成O2−的酶,还必须要有消耗H2O2的酶,才可以保证反应的顺利进行[7]。基于以上推测,研究者以含有和不含有活性AHPs的细菌培养液和无细胞滤液为材料,添加了相同浓度的H2O2,并在一定时间内对反应液中H2O2的含量进行监测。结果表明,H2O2只在有活性AHPs的培养液中才会被迅速分解,因此推断其中的AHPs可以降解H2O2[7]。之前也曾有学者提出AHPs可能同时具有氧化酶和过氧化物酶活性的观点[23]。已有氧化酶产生活性氧的例子[24],因此AHPs并不属于个例。与直接氧化不同,在玫瑰杆菌AzwK-3b中,AHPs的表达不受Mn(Ⅱ)的诱导[14]。在间接氧化过程中涉及到6个反应式(反应式1-6)。

|
反应式(1) |

|
反应式(2) |

|
反应式(3) |

|
反应式(4) |
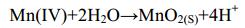
|
反应式(5) |
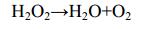
|
反应式(6) |
AHPs对Mn(Ⅱ)的氧化受多种因素的影响。根据氧化方式的不同,影响因素也不尽相同。大致可以分为以下几个类别。
(1) 辅因子类。AHPs是一种以血红素及Ca(Ⅱ)作为辅因子的过氧化物蛋白酶类,血红素和Ca(Ⅱ)都可以促进蛋白对Mn(Ⅱ)的氧化[10, 16, 21]。绿过氧化物酶(Myeloperoxidase,MPO)和乳过氧化物酶(Lactoperoxidase,LPO)同属于血红素过氧化物酶蛋白家族。目前对这2种酶结构的研究成果可以作为AHPs研究的参考。在MPO和LPO中,蛋白与血红素是通过共价键和氢键相连的[25-27],由于这段序列在MopA中保守,因此研究者推测MopA与血红素也同样通过氢键和共价键相连[16]。同样根据MPO和LPO的已有研究结果[28],研究人员推测在AHPs中,Ca(Ⅱ)通过协助蛋白确定末端组氨酸与血红素相互作用的方向提高酶的活性,因此Ca(Ⅱ)对酶活性的促进作用也有可能是通过调节蛋白与血红素之间的位置关系实现的[16]。吡咯并喹啉醌(Pyrroloquinoline quinone,PQQ)也是一种氧化还原酶的辅基,有研究者在部分纯化的锰氧化酶中发现了PQQ,认为它对蛋白具有重要的作用[29],但目前只发现PQQ对直接氧化反应的促进作用[16],尚未发现其对间接氧化反应的影响[21]。
(2) 超氧化物清除剂。AHPs对Mn(Ⅱ)的间接氧化主要是通过产生O2−实现的,因此超氧化物清除剂会抑制氧化反应的进行。SOD可以将O2−歧化为H2O2和O2,由于大量消耗掉反应中所需的O2−,因此氧化反应会受到显著的抑制[21]。Cu(Ⅱ)可以通过催化作用加速O2−的消耗,且Cu(Ⅱ)与O2−的反应活性比Mn(Ⅱ)高[30],因此Cu(Ⅱ)也可以抑制间接氧化反应[7, 21, 31]。
(3) 过氧化氢及过氧化氢酶。AHPs是过氧化物酶家族的一员,可以利用H2O2作为电子受体[17]。在理论上,额外加入H2O2可以促进氧化反应的进行,而添加降解H2O2的过氧化氢酶则氧化反应受到抑制。但是实验结果表明,外加一定浓度的H2O2和过氧化氢酶都不会对MopA催化的直接氧化反应产生明显的影响[16, 21]。在间接氧化反应中,向无细胞的滤液(滤液中含有AHPs)额外加入H2O2后,氧化反应也没有受到明显的影响[16]。考虑到H2O2可以将直接和间接氧化体系中生成的Mn(Ⅲ)还原为Mn(Ⅱ) (反应式2),抑制氧化反应的进行[22],而过氧化氢酶又可以将H2O2分解为H2O和O2 (反应式6),促进锰氧化物的生成[22],因此,在生物体系中H2O2和过氧化氢酶对氧化反应的影响远比非生物体系复杂,需要综合考虑多种因素并进一步进行验证。
(4) 还原剂。烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NADH)是氧化还原反应中常见的辅酶,对AHPs间接氧化Mn(Ⅱ)的反应具有促进作用[7]。大肠杆菌中,NADH可以促进生成O2− [32],因此研究者推测NADH对于间接氧化的促进很有可能是通过产生O2−实现的。由于直接氧化过程中不需要O2−,因此NADH对AHPs直接氧化Mn(Ⅱ)无明显的促进作用[16],这也从另一个角度验证了NADH对间接氧化反应的促进可能是通过产生O2−实现的。
(5) 氧化还原酶抑制剂。氧化还原酶抑制剂会明显抑制氧化还原酶的活性,因此不管是哪种氧化方式,氰化物、叠氮化钠、苯肼、二苯基氯化碘盐等过氧化物酶类抑制剂都会抑制氧化反应的发生[7, 31]。
5 研究展望细菌对Mn(Ⅱ)的氧化在锰与多种元素的生物地球化学循环中具有重要的作用,对于该机理和内在驱动力的揭示是研究者一直以来努力的方向。而且,通过微生物作用产生的锰氧化物在环境治理方面同样具有一定的潜力,其对水体中铅、镉等重金属具有良好的吸附性能[33],对某些有机污染物也同样具有一定程度的清除作用[34]。Mn(Ⅱ)氧化机理的深入研究可以为锰氧化酶的表达与分子改造、锰氧化菌及生物锰氧化物未来的工程应用提供基础数据。近些年,研究者发现了细菌中AHPs对Mn(Ⅱ)的氧化作用并对其作用方式展开研究,在已经取得一些进展的基础上,可以围绕以下问题继续展开研究。
(1) 从细菌氧化Mn(Ⅱ)生理意义的角度来研究细菌产生胞外O2−与O2−氧化Mn(Ⅱ)之间的关系。O2−是细菌间接锰氧化过程中有效的氧化剂,但并不是所有产生O2−的微生物都可以氧化Mn(Ⅱ),在这种间接的氧化机制中AHPs的表达并不受Mn(Ⅱ)诱导[14],因此氧化Mn(Ⅱ)对于锰氧化细菌来说生理意义未知。真菌中O2−与防御、蛋白转录后修饰、菌丝分化、信号转导等生理功能有关[35],这对细菌超氧化物的研究有一定的借鉴意义。
(2) 细菌体内锰氧化酶的复杂性。恶臭假单胞菌GB-1是一株同时具有MCOs和AHPs的锰氧化细菌,在其他细菌如纤毛菌属菌株(Leptothrix cholodnii)SP-6[6, 36]、橙单胞菌SI85-9A1[10, 37]中也可能同时含有这2种酶。本实验室筛选获得了几株芽孢杆菌类锰氧化细菌[38],我们对这几株菌进行了全基因组的测序,在这几株芽孢杆菌基因组中也同时发现了这2种蛋白酶的基因序列(结果待发表)。真菌中有2类锰氧化酶协同发挥作用的例子,如担子菌门的大球盖菇菌(Stropharia rugosoannulata) DSM 11372,锰过氧化物酶(manganese peroxidase,MnP)可以利用MCOs产生的H2O2氧化Mn(Ⅱ)[39]。因此,微生物体内的锰氧化系统可能比预期的要更为复杂。
随着分子生物学技术的发展,基因组学、宏基因组学以及蛋白质组学等技术的不断成熟都将成为深入探索Mn(Ⅱ)氧化机制的有力工具,为AHPs等锰氧化酶功能的深入研究提供技术支持,为阐明这些未知的机制提供更加确凿的证据。
| [1] | Tebo BM, Bargar JR, Clement BG, Dick GJ, Murray KJ, Parker D, Verity R, Webb SM. Biogenic manganese oxides:properties and mechanisms of formation. Annual Review of Earth and Planetary Sciences, 2004, 32(1): 287-328. DOI:10.1146/annurev.earth.32.101802.120213 |
| [2] | Tebo BM, Johnson HA, McCarthy JK, Templeton AS. Geomicrobiology of manganese(Ⅱ) oxidation. Trends in Microbiology, 2005, 13(9): 421-428. DOI:10.1016/j.tim.2005.07.009 |
| [3] | Morgan JJ. Kinetics of reaction between O2 and Mn(Ⅱ) species in aqueous solutions. Geochimica et Cosmochimica Acta, 2005, 69(1): 35-48. DOI:10.1016/j.gca.2004.06.013 |
| [4] | Zhang JH, Lion LW, Nelson YM, Shuler ML, Ghiorse WC. Kinetics of Mn(Ⅱ) oxidation by Leptothrix discophora SS1. Geochimica et Cosmochimica Acta, 2002, 66(5): 773-781. DOI:10.1016/S0016-7037(01)00808-0 |
| [5] | Butterfield CN, Soldatova AV, Lee SW, Spiro TG, Tebo BM. Mn(Ⅱ, Ⅲ) oxidation and MnO2 mineralization by an expressed bacterial multicopper oxidase. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(29): 11731-11735. DOI:10.1073/pnas.1303677110 |
| [6] | Geszvain K, McCarthy JK, Tebo BM. Elimination of manganese(Ⅱ, Ⅲ) oxidation in Pseudomonas putida GB-1 by a double knockout of two putative multicopper oxidase genes. Applied and Environmental Microbiology, 2013, 79(1): 357-366. DOI:10.1128/AEM.01850-12 |
| [7] | Andeer PF, Learman DR, McIlvin M, Dunn JA, Hansel CM. Extracellular haem peroxidases mediate Mn(Ⅱ) oxidation in a marine Roseobacter bacterium via superoxide production. Environmental Microbiology, 2015, 17(10): 3925-3936. DOI:10.1111/1462-2920.12893 |
| [8] | Francis CA, Tebo BM. Enzymatic manganese(Ⅱ) oxidation by metabolically dormant spores of diverse Bacillus Species. Applied and Environmental Microbiology, 2002, 68(2): 874-880. DOI:10.1128/AEM.68.2.874-880.2002 |
| [9] | Corstjens PLAM, de Vrind JPM, Goosen T, de Vrind-de Jong EW. Identification and molecular analysis of the Leptothrix discophora SS-1 mofA gene, a gene putatively encoding a manganese-oxidizing protein with copper domains. Geomicrobiology Journal, 1997, 14(2): 91-108. DOI:10.1080/01490459709378037 |
| [10] | Anderson CR, Johnson HA, Caputo N, Davis RE, Torpey JW, Tebo BM. Mn(Ⅱ) oxidation is catalyzed by heme peroxidases in "Aurantimonas manganoxydans" strain SI85-9A1 and Erythrobacter sp. strain SD-21. Applied and Environmental Microbiology, 2009, 75(12): 4130-4138. DOI:10.1128/AEM.02890-08 |
| [11] | Geszvain K, Smesrud L, Tebo BM. Identification of a third Mn(Ⅱ) oxidase enzyme in Pseudomonas putida GB-1. Applied and Environmental Microbiology, 2016, 82(13): 3774-3782. DOI:10.1128/AEM.00046-16 |
| [12] | Bello M, Correa-Basurto J, Rudiño-Piñera E. Simulation of the cavity-binding site of three bacterial multicopper oxidases upon complex stabilization:interactional profile and electron transference pathways. Journal of Biomolecular Structure and Dynamics, 2014, 32(8): 1303-1317. DOI:10.1080/07391102.2013.817954 |
| [13] | Diaz JM, Hansel CM, Voelker BM, Mendes CM, Andeer PF, Zhang T. Widespread production of extracellular superoxide by heterotrophic bacteria. Science, 2013, 340(6137): 1223-1226. DOI:10.1126/science.1237331 |
| [14] | Learman DR, Hansel CM. Comparative proteomics of Mn(Ⅱ)-oxidizing and non-oxidizing Roseobacter clade bacteria reveal an operative manganese transport system but minimal Mn(Ⅱ)-induced expression of manganese oxidation and antioxidant enzymes. Environmental Microbiology Reports, 2014, 6(5): 501-509. DOI:10.1111/emi4.2014.6.issue-5 |
| [15] | Anderson CR, Davis RE, Bandolin NS, Baptista AM, Tebo BM. Analysis of in situ manganese(Ⅱ) oxidation in the Columbia River and offshore plume:linking Aurantimonas and the associated microbial community to an active biogeochemical cycle. Environmental Microbiology, 2011, 13(6): 1561-1576. DOI:10.1111/j.1462-2920.2011.02462.x |
| [16] | Nakama K, Medina M, Lien A, Ruggieri J, Collins K, Johnson HA. Heterologous expression and characterization of the manganese-oxidizing protein from Erythrobacter sp. strain SD21. Applied and Environmental Microbiology, 2014, 80(21): 6837-6842. DOI:10.1128/AEM.01873-14 |
| [17] | Zamocky M, Obinger C. Molecular phylogeny of heme peroxidases.//Torres E, Ayala M. Biocatalysis based on heme peroxidases:peroxidases as potential industrial biocatalysts. Berlin Heidelberg:Springer-Verlag, 2010:7-35. |
| [18] | Zamocky M, Jakopitsch C, Furtmüeller PG, Dunand C, Obinger C. The peroxidase-cyclooxygenase superfamily:reconstructed evolution of critical enzymes of the innate immune system. Proteins:Structure, Function, and Bioinformatics, 2008, 72(2): 589-605. DOI:10.1002/prot.21950 |
| [19] | Linhartová I, Bumba L, Mašín J, Basler M, Osička R, Kamanová J, Procházková K, Adkins I, Hejnová-Holubová J, Sadílková L, Morová J, Šebo P. RTX proteins:a highly diverse family secreted by a common mechanism. FEMS Microbiology Reviews, 2010, 34(6): 1076-1112. DOI:10.1111/j.1574-6976.2010.00231.x |
| [20] | Santamaría-Hernando S, Krell T, Ramos-González MI. Identification of a novel calcium binding motif based on the detection of sequence insertions in the animal peroxidase domain of bacterial proteins. PLoS One, 2012, 7(7): e40698. DOI:10.1371/journal.pone.0040698 |
| [21] | Learman DR, Voelker BM, Vazquez-Rodriguez AI, Hansel CM. Formation of manganese oxides by bacterially generated superoxide. Nature Geoscience, 2011, 4(2): 95-98. DOI:10.1038/ngeo1055 |
| [22] | Learman DR, Voelker BM, Madden AS, Hansel CM. Constraints on superoxide mediated formation of manganese oxides. Frontiers in Microbiology, 2013, 4: 262. DOI:10.3389/fmicb.2013.00262 |
| [23] | Scheeline A, Olson DL, Williksen EP, Horras GA, Klein ML, Larter R. The peroxidase-oxidase oscillator and its constituent chemistries. Chemical Reviews, 1997, 97(3): 739-756. DOI:10.1021/cr960081a |
| [24] | Wariishi H, Gold MH. Lignin peroxidase compound Ⅲ:formation, inactivation, and conversion to the native enzyme. FEBS Letters, 1989, 243(2): 165-168. DOI:10.1016/0014-5793(89)80122-X |
| [25] | Carpena X, Vidossich P, Schroettner K, Calisto BM, Banerjee S, Stampler J, Soudi M, Furtmüller PG, Rovira C, Fita I, Obinger C. Essential role of proximal histidine-asparagine interaction in mammalian peroxidases. Journal of Biological Chemistry, 2009, 284(38): 25929-25937. DOI:10.1074/jbc.M109.002154 |
| [26] | Singh AK, Singh N, Sharma S, Singh SB, Kaur P, Bhushan A, Srinivasan A, Singh TP. Crystal structure of lactoperoxidase at 2.4Å resolution. Journal of Molecular Biology, 2008, 376(4): 1060-1075. DOI:10.1016/j.jmb.2007.12.012 |
| [27] | Zeng J, Fenna RE. X-ray crystal structure of canine myeloperoxidase at 3Å resolution. Journal of Molecular Biology, 1992, 226(1): 185-207. DOI:10.1016/0022-2836(92)90133-5 |
| [28] | Shin K, Hayasawa H, Lönnerdal B. Mutations affecting the calcium-binding site of myeloperoxidase and lactoperoxidase. Biochemical and Biophysical Research Communications, 2001, 281(4): 1024-1029. DOI:10.1006/bbrc.2001.4448 |
| [29] | Johnson HA, Tebo BM. In vitro studies indicate a quinone is involved in bacterial Mn(Ⅱ) oxidation. Archives of Microbiology, 2008, 189(1): 59-69. |
| [30] | Zafiriou OC, Voelker BM, Sedlak DL. Chemistry of the superoxide radical (O2-) in seawater:reactions with inorganic copper complexes. The Journal of Physical Chemistry A, 1998, 102(28): 5693-5700. DOI:10.1021/jp980709g |
| [31] | Tang YZ, Zeiner CA, Santelli CM, Hansel CM. Fungal oxidative dissolution of the Mn(Ⅱ)-bearing mineral rhodochrosite and the role of metabolites in manganese oxide formation. Environmental Microbiology, 2013, 15(4): 1063-1077. DOI:10.1111/emi.2013.15.issue-4 |
| [32] | Korshunov S, Imlay JA. Detection and quantification of superoxide formed within the periplasm of Escherichia coli. Journal of Bacteriology, 2006, 188(17): 6326-6334. DOI:10.1128/JB.00554-06 |
| [33] | Zhou DH, Kim DG, Ko SO. Heavy metal adsorption with biogenic manganese oxides generated by Pseudomonas putida strain MnB1. Journal of Industrial and Engineering Chemistry, 2015, 24: 132-139. DOI:10.1016/j.jiec.2014.09.020 |
| [34] | Furgal KM, Meyer RL, Bester K. Removing selected steroid hormones, biocides and pharmaceuticals from water by means of biogenic manganese oxide nanoparticles in situ at ppb levels. Chemosphere, 2015, 136: 321-326. DOI:10.1016/j.chemosphere.2014.11.059 |
| [35] | Aguirre J, Ríos-Momberg M, Hewitt D, Hansberg W. Reactive oxygen species and development in microbial eukaryotes. Trends in Microbiology, 2005, 13(3): 111-118. DOI:10.1016/j.tim.2005.01.007 |
| [36] | Markowitz VM, Chen IMA, Palaniappan K, Chu K, Szeto E, Grechkin Y, Ratner A, Jacob B, Huang JH, Williams P, Huntemann M, Anderson I, Mavromatis K, Ivanova NN, Kyrpides NC. IMG:the integrated microbial genomes database and comparative analysis system. Nucleic Acids Research, 2012, 40(D1): D115-D122. DOI:10.1093/nar/gkr1044 |
| [37] | Dick GJ, Podell S, Johnson HA, Rivera-Espinoza Y, Bernier-Latmani R, McCarthy JK, Torpey JW, Clement BG, Gaasterland T, Tebo BM. Genomic insights into Mn(Ⅱ) oxidation by the marine alphaproteobacterium Aurantimonas sp. strain SI85-9A1. Applied and Environmental Microbiology, 2008, 74(9): 2646-2658. DOI:10.1128/AEM.01656-07 |
| [38] |
Zheng J, Meng YT, Fang YY, Yang SL, Wang P. Isolation and characterization of a manganese-oxidizing bacterium from soils. Acta Microbiologica Sinica, 2016, 56(11): 1699-1708.
(in Chinese) 郑洁, 孟佑婷, 方瑶瑶, 杨素玲, 王平. 一株锰氧化细菌的分离、鉴定及其锰氧化特性. 微生物学报, 2016, 56(11): 1699-1708. |
| [39] | Schlosser D, Höfer C. Laccase-catalyzed oxidation of Mn2+ in the presence of natural Mn3+ chelators as a novel source of extracellular H2O2 production and its impact on manganese peroxidase. Applied and Environmental Microbiology, 2002, 68(7): 3514-3521. DOI:10.1128/AEM.68.7.3514-3521.2002 |
 2017, Vol. 57
2017, Vol. 57




