中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张亚南, 余凯凡, 朱伟云. 2017
- Yanan Zhang, Kaifan Yu, Weiyun Zhu. 2017
- 肠道微生物调控宿主食欲的研究进展
- Role of gut microbiota in host appetite control
- 微生物学报, 57(7): 951-960
- Acta Microbiologica Sinica, 57(7): 951-960
-
文章历史
- 收稿日期:2016-10-09
- 修回日期:2017-01-14
- 网络出版日期:2017-02-22
肠道微生物是一个极其庞大而复杂的系统,其在系统发育地位上基本分属于厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和梭杆菌门(Fusobacteria)等6大门类,这些微生物与宿主互利共生。近年来的研究表明,肠道微生物能够通过影响宿主中枢神经系统,调控宿主食欲[1]。未被消化道降解的营养素在微生物发酵作用下,能够产生短链脂肪酸(SCFAs)、生物胺、吲哚、硫醇和神经递质等多种代谢物,这些代谢物可作为信号分子影响宿主摄食神经中枢,调控食欲。其中,SCFAs能够刺激胃肠上皮内分泌细胞产生胃肠饱感激素,胃肠激素通过肠-脑轴传导系统将饱感信号传递给中枢系统,进而调控食欲;肠道微生物代谢色氨酸产生的吲哚,可能在维持肠道菌群平衡方面具有重要作用,间接调控宿主食欲;神经递质则能够通过肠道迷走神经或者进入外周循环系统影响中枢神经系统功能。肠道微生物影响宿主食欲的研究不断深入,可为从肠道微生物营养角度调控宿主能量摄入和体重平衡等提供新策略。
1 肠道微生物与中枢神经系统肠道微生物不仅在调节营养物质吸收代谢以及机体免疫等方面具有关键作用,而且对大脑神经中枢以及宿主行为也产生影响。肠道与大脑之间的信息交流称为肠-脑轴,它是一个双向信息交流系统。内外因素的刺激可以通过中枢神经元传出神经影响胃肠道的感应、分泌和运动等功能;而胃肠道感应也可以影响中枢神经系统的感知、情绪和行为。肠道微生物介导了肠-脑轴之间的信息交流,肠道微生物产生的信号可能通过迷走神经、外周循环系统和免疫系统传递给中枢神经系统,进而可能影响宿主的行为[1]。
迷走神经是机体内最长、分布最广的一对脑神经,具有支配呼吸、消化两个系统的绝大部分器官与心脏的感觉、运动以及腺体分泌的作用。迷走神经传入神经主要分布在十二指肠的固有层、空肠绒毛以及利贝昆氏腺(Lieberkuhn)隐窝中,但是其不能通过基底膜进而神经支配肠上皮层。迷走神经是肠神经与中枢神经之间的联系纽带,为胃肠道中的微生物信号肽传递到大脑提供了直接的神经化学途径[2]。研究表明,肠道微生物能够激活迷走神经,进而调节宿主的大脑和行为。给小鼠额外补充乳酸杆菌JB-1 28 d后,小鼠在高十字迷宫中的焦虑行为降低[3]。进一步研究发现,在迷走神经切断术和缺乏迷走神经作为肠神经和中枢神经之间联系的小鼠中,没有发现乳酸杆菌的抗焦虑作用,该研究提示肠道微生物产生的信号肽可能直接通过迷走神经影响中枢神经,同时微生物对介导神经生理功能具有激活作用[3]。
外周循环系统是由生物体的细胞外液(包括血浆、淋巴和组织液)及其借以循环流动的管道组成的系统。循环系统是生物体内的运输系统,能够将肠道内消化吸收的营养物质和氧气输送到大脑,同时也能将激素、神经递质、微生物代谢物和免疫信号肽等输送到中枢神经系统以调节其功能。微生物具有产生和识别神经化学物质的能力。微生物能够产生儿茶酚胺、乙酰胆碱、5-羟色胺、去肾上腺素、肾上腺素、γ-氨基丁酸和具有生物活性的神经肽等多种小分子物质[4]。肠道微生物的缺失会导致血清中神经递质水平下降。与正常小鼠相比,无菌小鼠血清中的多巴胺与γ-氨基丁酸水平降低,并且合成这类神经递质的前体和代谢产物在肠道中也发生了改变[5-6]。SCFAs是肠道微生物发酵的终产物,主要包括乙酸、丙酸和丁酸等,其具有调控宿主多项生理功能的作用。有研究指出,在血清中能够检测到肠道中产生的SCFAs,并且能够通过血脑屏障进入大脑组织[7]。Frost等研究发现,灌注的乙酸进入循环系统后能够通过血脑屏障进入脑组织,影响小鼠的摄食中枢神经,进而调控摄食行为[8]。丁酸可在小鼠维持血脑屏障的完整性方面发挥作用[9]。Heijtz等研究发现,与无菌小鼠相比,无特定病原菌小鼠的去甲肾上腺素、多巴胺以及纹状体中的五羟色胺含量显著降低,无特定病原且维持正常肠道菌群小鼠的肌肉活动量减少和焦虑性行为增加;无菌小鼠重新定殖正常的肠道菌群后,其肌肉活动量和焦虑性行为与无特定病原小鼠相一致[10]。上述研究表明,通常存在于血清中的代谢物可能在微生物的介导下通过血脑屏障进入脑组织,直接作用于中枢神经系统;一些微生物代谢物是神经递质的前体,能够通过肠道屏障和血脑屏障,随后影响大脑神经系统中神经递质的水平。
肠道微生物还可以间接地通过免疫系统影响中枢神经系统的功能和宿主行为。大量研究发现,肠道微生物代谢底物及产物,能够激活免疫系统,使血液中促炎症细胞因子和抗炎症细胞因子水平发生改变[11-12]。细胞因子可作为免疫信号分子调控神经性紊乱病变和心理学疾病,如焦虑、抑郁、认知行为等。肠道中脂多糖、微生物脂蛋白和鞭毛蛋白等可刺激巨噬细胞、中性粒细胞、树突状细胞等免疫细胞产生促炎症细胞因子(IL-1α、IL-2β、TNFα和IL-6),这些促炎症细胞因子经由自由扩散和细胞因子转运蛋白转运通过血脑屏障进入脑组织,与神经元上相应的受体作用,进而改变其活化状态发挥生理作用[13]。Zhu等(2006) 研究报道病态行为和抑郁紊乱都与5-羟色胺有关,静脉给予IL-2β或者TNF-α后,可通过上调血清素转运蛋白刺激5-羟色胺的吸收,降低5-羟色胺在突触中作为化学信号的可利用浓度[14]。
2 肠道微生物对宿主食欲的影响肠道微生物参与了宿主食欲的调控。其中,膳食纤维在肠道微生物调节单胃动物食欲过程中发挥了重要作用。膳食纤维主要由纤维素、半纤维素、果胶、β-葡聚糖、果聚糖、树胶和海藻多糖等非淀粉多糖组成,其主要分为可溶性和非可溶性两类。日粮纤维不仅调控单胃动物的食欲、刺激胃肠激素释放、影响饱腹感,而且对宿主的能量摄入、采食量、体重和血糖稳态等也产生一定的影响[15-18]。
日粮纤维能通过影响肠道激素的分泌以及血糖反应,进一步影响宿主饱腹感和血糖稳态。摄入的日粮纤维刺激小肠近端分泌胆囊收缩素,调节胰腺的分泌和胃的排空,也是宿主产生饱足感的主要原因。在啮齿动物日粮中添加果糖,可刺激胃肠道内分泌细胞分泌胰高血糖素样肽1 (GLP-1)、酪酪肽(PYY)等肠道肽类激素,降低胃饥饿素的水平,抑制能量的摄入,增强饱腹感抑制食欲,减轻体重[15-16]。日粮纤维能够抵抗胃和小肠消化酶的分解进入大肠,进入大肠的日粮纤维在微生物发酵作用下具有调节体重和维持血糖稳态的生物学功能。Kok等研究发现,在Wistar大鼠日粮中添加100 g的果糖,可降低摄食后的血糖浓度,提高胰岛素的敏感性,维持血糖平衡[19]。结肠发酵产生的SCFAs,如乙酸、丙酸和丁酸等能够进入门静脉循环,影响血糖稳态[20-22],也可降低肝脏的葡萄糖的输出和外周循环中SCFAs的浓度[22-23]。此外,SCFAs还可刺激肠道内分泌L细胞分泌肠激素。SCFAs的这些生物学作用可以改变胰岛素的敏感性,刺激胰岛素的分泌,进而调节食欲。Arora等研究发现,在高脂日粮中添加菊粉或β-葡聚糖可有效降低大鼠的体重和体脂,盲肠内容物和粪便中双歧杆菌属和乳酸杆菌-肠球菌属的数量也有所增加[24]。Rebello等研究表明,菊粉、β-葡聚糖和蓝莓花青素苷等可通过调节肠道微生物改善血糖耐受性和增强饱感,并且增加粪便中SCFAs的含量[25]。Keenan等认为,能量水平经日粮纤维稀释后能够降低大鼠腹部脂肪沉积,饲喂玉米抗性淀粉的大鼠其盲肠重量有所增加,盲肠内容物中SCFAs含量增加,血浆中PYY和GLP-1水平提高,并且增加了PYY和高血糖素原的基因转录水平[26]。因此,肠道微生物介导了日粮纤维调控宿主机体食欲,维持血糖稳态和能量摄入平衡等。
3 肠道微生物调控宿主食欲的可能途径宿主食欲由中枢神经系统调节,其中下丘脑是接受、整合与释放食欲调节信号的主要中枢神经系统。中枢食欲调节神经网络的核心是由促食欲神经元神经肽Y/刺鼠相关蛋白(NPY/AgRP)和抑食欲神经元阿片黑素皮质素原/可卡因-安菲他明调节转录物(POMC/CART)组成,该神经网络受外周和中枢各种信号刺激,进而调控宿主食欲。越来越多的研究提示,在单胃动物中,肠道微生物可能通过影响中枢神经系统参与了对宿主食欲的调控,肠道微生物的代谢物或者分泌物,如SCFAs、吲哚和神经递质等,与宿主食欲的调控密切相关(图 1)。
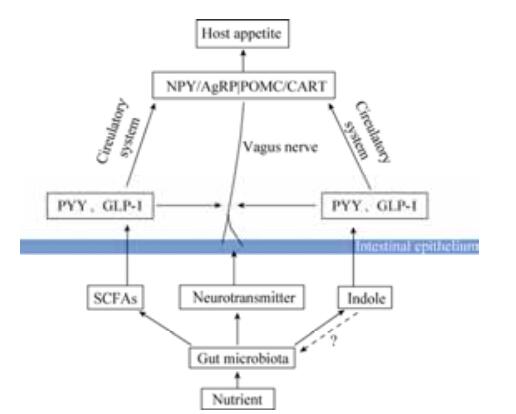
|
| 图 1 肠道微生物调控宿主食欲的可能途径 Figure 1 Possible pathways of intestinal microflora regulating host appetite. |
3.1 短链脂肪酸途径
肠道微生物发酵未被宿主消化的营养素产生的SCFAs主要包括乙酸、丙酸和丁酸,其约占总短链脂肪酸含量的95%。复杂的碳水化合物,如抗性淀粉和未降解日粮纤维,都可作为微生物发酵的底物。单胃动物中,盲肠和结肠是微生物发酵的主要场所。研究发现,盲肠和结肠中的拟杆菌、双歧杆菌和梭菌等大量的厌氧革兰氏阳性菌参与了SCFAs的生成;通过基因组分析发现,肠道中的某些拟杆菌群基因组中含有编码糖苷水解酶和多糖裂解酶的基因,编码的酶类参与了底物的代谢,进而生成SCFAs[27]。
SCFAs,尤其是丁酸,能够为结肠上皮细胞提供60%-70%的能量;丙酸主要作为糖异生和脂质合成的前体物质;乙酸通过外周循环系统进入外周组织进行代谢,也是合成胆固醇的底物。SCFAs不仅能够被机体利用,维持能量稳态,而且能够刺激胃肠激素的分泌,进而调控能量摄入和食欲。研究表明,SCFAs能够通过游离脂肪酸受体2 (FFAR2) 和游离脂肪酸受体3 (FFAR3) 刺激肠道内分泌L细胞释放PYY和GLP-1[28]。PYY和GLP-1均属于胃肠道饱感激素,具有短期抑制食欲的作用。其中,PYY主要以PYY3-36的形式存在于外周循环系统。PYY3-36能够与Y家族受体结合,其中与Y2受体的亲和性最高。有报道指出,通过添加Y2受体的拮抗物,PYY3-36的厌食作用被削弱[29];在Y2受体基因敲除的小鼠中,PYY3-36的抑制食欲作用消失[30]。因此,推测Y2受体可能介导了PYY3-36的厌食作用。Y2受体是一种突触前抑制受体,主要存在于下丘脑弓状核促食欲神经元NPY/AgRP上[31]。下丘脑弓状核神经元能够分泌促食欲因子神经肽Y (NPY)和抑食欲因子POMC,PYY3-36通过Y2受体抑制NPY的表达和增加POMC的分泌,进而调节宿主食欲[32]。GLP-1也具有类似的作用[33]。PYY和GLP-1胃肠激素还能够通过迷走神经直接作用于中枢神经系统,影响宿主食欲[34-35]。Frost等对乙酸影响食欲的研究表明,乙酸能够通过血脑屏障被大脑直接摄取,进而直接促进厌食神经肽的表达,影响宿主食欲[8]。
3.2 吲哚途径动物机体中,吲哚主要是由结肠微生物代谢产生。色氨酸是微生物代谢生成吲哚的必需前体物质。色氨酸在微生物的作用下,还可生成3-甲基吲哚(粪臭素)、吲哚乙酸和吲哚丙酸等吲哚衍生物[36]。有报道指出,革兰氏阳性菌和革兰氏阴性菌均能够代谢色氨酸产生吲哚,多达85种以上,包括多种病原菌[37]。埃希氏菌属大肠杆菌是主要的合成吲哚的菌株,该菌株染色体内具有编码色氨酸酶的基因,能够合成色氨酸酶,色氨酸在色氨酸酶的作用下转化成吲哚[37]。
随着研究的深入,对吲哚生理功能的了解也逐步加深。吲哚作为一种特殊的细菌信号分子,可能对肠道上皮细胞具有重要作用。吲哚能够减少致病性大肠杆菌的趋化性、能动性以及对肠道上皮细胞的附着,但其对肠道上皮细胞的影响并不清楚。Bansal等研究吲哚能够上调与黏膜屏障和黏蛋白产生相关基因的表达,降低NF-κB的活性以及促炎症因子IL-8的表达,同时上调抗炎症细胞因子IL-10的表达[38]。最新研究显示,吲哚能够通过刺激肠道内分泌L细胞,调节肠降血糖素GLP-1的分泌;吲哚短期内会增加GLP-1的分泌,长期则抑制其分泌[39],提示吲哚也可能通过影响胃肠肽的分泌调节宿主食欲。此外,吲哚可作为大肠杆菌胞外信号分子,增强其抗药性和质粒稳定性,调控致病大肠杆菌的毒性以及生物膜的形成等;吲哚还能够抑制真菌的生长,降低假单胞杆菌属的毒性,增强沙门氏菌属的抗药性[37]。据此推测,吲哚与肠道菌群平衡有关,肠道菌群的这种平衡是否也与食欲有关,尚有待进一步研究。
3.3 神经递质途径研究者以前普遍认为,神经递质只能由神经元合成,由突触前膜释放,与突触后膜上的受体结合,导致突触后膜神经元兴奋性提高或降低。它们是神经元之间传递信号,进行信息交流的最主要的化学性信号分子。神经递质主要包括四大类:生物原胺类,如多巴胺(DA)、去甲肾上腺素(NE)、肾上腺素(E)和5-羟色胺(5-HT);氨基酸类,如γ-氨基丁酸(GABA)、谷氨酸、组胺和乙酰胆碱(Ach);肽类,如内源性阿片肽、P物质、胆囊收缩素(CCK)、血管加压素、缩宫素和神经肽Y;其他类,如核苷酸类、花生酸碱和sigma受体(σ受体)。神经递质主要调节脑功能,对情绪、摄食等宿主行为有重要影响。近年来的研究表明,与宿主共生的肠道微生物菌群能够影响中枢神经系统功能,进而对宿主的情绪和行为产生影响。肠道微生物可能与大脑神经元共用同一种“语言”——神经递质,进行信息交流。无菌小鼠与正常小鼠的比较研究发现,能够从肠道微生物中分离出多种神经递质(表 1)[40-41]。
| Genus | Neurochemical |
| Lactobacillus, Bifidobacterium | GABA |
| Streptococcus, Escherichia, Enterococcus, Lactococcus, Lactobacillus | Serotonin |
| Escherichia, Bacillus Escherichia, Bacillus, Lactococcus, Lactobacillus, Streptococcus | Norepinephrine Dopamine |
| Lactobacillus, Bacillus | Acetylcholine |
| Lactococcus, Lactobacillus, Streptococcus, Enterococcus | Histamine |
| *: cited from reference [4]. | |
3.3.1 γ-氨基丁酸: γ-氨基丁酸(GABA)是主要的中枢神经系统抑制性神经递质,可调节焦虑、抑郁和食欲等多种心理和生理过程以及功能异常。谷氨酸在人类肠道中经过乳酸杆菌和双歧杆菌的代谢,在谷氨酸脱羧酶的作用下,经过一系列的转化可生成GABA[40]。但是,外周GABA能否通过血脑屏障还未见报道。因此,由肠道微生物代谢产生的神经信号分子可能局部作用于迷走神经或者进入外周循环系统。Bravo等(2011) 研究表明,乳酸菌的摄入可降低由压力引起的焦虑和抑郁等行为的发生,乳酸杆菌可下调额外叶皮质层与杏仁核中GABAAα2 mRNA的表达、上调海马区中GABAAα2受体表达[3]。这种影响可能是通过迷走神经传入中枢神经系统引起的。当前,GABA的释放被认为是NPY/AgRP神经元中调控促进食欲影响的主要因素[42]。有研究报道,外周或颅内增加GABAB受体激动剂巴氯芬可短期内增加已产生饱腹感大鼠的食物消耗,但不影响体重[43]。敲除AgRP神经元囊泡中GABA转运蛋白基因,可显著导致体型变瘦[44]。GABA可能通过以下两种机制促进宿主食欲:(1) GABA通过与大脑中GABAA和GABAB受体结合,进而抑制厌食神经元POMC的表达[45];(2) GABA协同NPY共同削弱了黑皮质素抵抗能力,并且通过与旁室核中GABAA受体的结合,增加宿主摄食[46]。 3.3.2 血清素: 血清素,又称5-羟色胺(5-HT),具有抑制宿主食欲的作用。宿主机体内约90%的血清素由肠道内肠嗜铬细胞分泌,但是外周系统中的血清素不能通过血脑屏障。然而,肠道微生物可通过改变血清素前体物水平进而调控大脑中血清素的更新[47-48]。色氨酸是血清素合成的最主要的前体物质,肠道微生物能够从头合成色氨酸,并且外周系统中的色氨酸能够通过血脑屏障,参与大脑血清素的合成。Desbonnet等研究表明,双歧杆菌能够提高大鼠血浆内色氨酸的浓度,影响色氨酸的代谢[49]。下丘脑是调控宿主食欲的主要中枢神经系统,下丘脑中弓状核和室旁核表达的多种不同受体被认为与血清素调控宿主摄食有关(表 2)。
后来的研究表明,黑皮质素与MC4R的结合是5-HT2CR调节食欲所必要的[52]。血清素与5-HT2CR结合后,激活厌食神经元POMC的表达,产生α-MSH,进而抑制食欲[53]。最新的研究显示,5-HT1BR能够抑制促食欲神经元NPY/AgRP的活性,降低食欲[54-55]。4 小结
肠道微生物菌群可通过直接或间接的方式与肠道表面营养素感应受体发生互作,经肠、脑之间的信息交流,将信号通过迷走神经、外周循环系统或免疫系统传递给中枢神经系统,进而参与宿主食欲的调控,形成“微生物-肠-脑”轴。肠道菌群调控食欲的信号主要是由微生物发酵日粮碳水化合物产生的SCFAs、吲哚、神经递质等代谢产物来传递。肠道微生物对宿主中枢神经系统的影响以及调控宿主食欲的深入机制还有待进一步挖掘,微生物菌群对摄食行为的调控作用可为从肠道菌群角度制定人与动物的营养调控策略提供新思路。
| [1] | Sampson TR, Mazmanian SK. Control of brain development, function, and behavior by the microbiome. Cell Host & Microbe, 2015, 17(5): 565-576. |
| [2] | Forsythe P, Bienenstock J, Kunze WA. Vagal pathways for microbiome-brain-gut axis communication//Lyte M, Cryan JF. Microbial Endocrinology:The Microbiota-Gut-Brain Axis in Health and Disease. New York:Springer, 2014, 817:115-133. |
| [3] | Bravo JA, Forsythe P, Chew MV, Escaravage E, Savignac HM, Dinan TG, Bienenstock J, Cryan JF. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(38): 16050-16055. DOI:10.1073/pnas.1102999108 |
| [4] | Wall R, Cryan JF, Ross RP, Fitzgerald GF, Dinan TG, Stanton C. Bacterial neuroactive compounds produced by psychobiotics//Lyte M, Cryan JF. Microbial Endocrinology:The Microbiota-Gut-Brain Axis in Health and Disease. New York:Springer, 2014, 817:221-239. |
| [5] | Matsumoto M, Kibe R, Ooga TS, Aiba Y, Kurihara S, Sawaki E, Koga Y, Benno Y. Impact of intestinal microbiota on intestinal luminal metabolome. Scientific Reports, 2012, 2: 233. |
| [6] | Velagapudi VR, Hezaveh R, Reigstad CS, Gopalacharyulu P, Yetukuri L, Islam S, Felin J, Perkins R, Borén J, Orešič M, Bäckhed F. The gut microbiota modulates host energy and lipid metabolism in mice. Journal of Lipid Research, 2010, 51(5): 1101-1112. DOI:10.1194/jlr.M002774 |
| [7] | Mitchell RW, On NH, del Bigio MR, Miller DW, Hatch GM. Fatty acid transport protein expression in human brain and potential role in fatty acid transport across human brain microvessel endothelial cells. Journal of Neurochemistry, 2011, 117(4): 735-746. |
| [8] | Frost G, Sleeth ML, Sahuri-Arisoylu M, Lizarbe B, Cerdan S, Brody L, Anastasovska J, Ghourab S, Hankir M, Zhang S, Carling D, Swann JR, Gibson G, Viardot A, Morrison D, Thomas EL, Bell JD. The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism. Nature Communications, 2014, 5: 3611. |
| [9] | Braniste V, Al-Asmakh M, Kowal C, Anuar F, Abbaspour A, Tóth M, Korecka A, Bakocevic N, Ng LG, Kundu P, Gulyas B, Halldin C, Hultenby K, Nilsson H, Hebert H, Volpe BT, Diamond B, Pettersson S. The gut microbiota influences blood-brain barrier permeability in mice. Science Translational Medicine, 2014, 6(263): 263r. |
| [10] | Heijtz RD, Wang SG, Anuar F, Qian Y, Björkholm B, Samuelsson A, Hibberd ML, Forssberg H, Pettersson S. Normal gut microbiota modulates brain development and behavior. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(7): 3047-3052. DOI:10.1073/pnas.1010529108 |
| [11] | Dantzer R, O'Connor JC, Freund GG, Johnson RW, Kelley KW. From inflammation to sickness and depression:when the immune system subjugates the brain. Nature Reviews Neuroscience, 2008, 9(1): 46-56. DOI:10.1038/nrn2297 |
| [12] | Mead J, Ashwood P. Evidence supporting an altered immune response in ASD. Immunology Letters, 2015, 163(1): 49-55. DOI:10.1016/j.imlet.2014.11.006 |
| [13] | Dantzer R, Konsman JP, Bluthé RM, Kelley KW. Neural and humoral pathways of communication from the immune system to the brain:parallel or convergent?. Autonomic Neuroscience, 2000, 85(1/3): 60-65. |
| [14] | Zhu CB, Blakely RD, Hewlett WA. The proinflammatory cytokines interleukin-1beta and tumor necrosis factor-alpha activate serotonin transporters. Neuropsychopharmacology, 2006, 31(10): 2121-2131. |
| [15] | Cani PD, Joly E, Horsmans Y, Delzenne NM. Oligofructose promotes satiety in healthy human:a pilot study. European Journal of Clinical Nutrition, 2006, 60(5): 567-572. DOI:10.1038/sj.ejcn.1602350 |
| [16] | Cani PD, Neyrinck AM, Maton N, Delzenne NM. Oligofructose promotes satiety in rats fed a high-fat diet:involvement of glucagon-like Peptide-1. Obesity Research, 2005, 13(6): 1000-1007. DOI:10.1038/oby.2005.117 |
| [17] | Davy BM, Melby CL. The effect of fiber-rich carbohydrates on features of Syndrome X. Journal of the American Dietetic Association, 2003, 103(1): 86-96. DOI:10.1053/jada.2003.50005 |
| [18] | Venn BJ, Mann JI. Cereal grains, legumes and diabetes. European Journal of Clinical Nutrition, 2004, 58(11): 1443-1461. DOI:10.1038/sj.ejcn.1601995 |
| [19] | Kok NN, Morgan LM, Williams CM, Roberfroid MB, Thissen JP, Delzenne NM. Insulin, glucagon-like peptide 1, glucose-dependent insulinotropic polypeptide and insulin-like growth factor I as putative mediators of the hypolipidemic effect of oligofructose in rats. The Journal of Nutrition, 1998, 128(7): 1099-1103. |
| [20] | Lu ZX, Gibson PR, Muir JG, Fielding M, O'Dea K. Arabinoxylan fiber from a by-product of wheat flour processing behaves physiologically like a soluble, fermentable fiber in the large bowel of rats. The Journal of Nutrition, 2000, 130(8): 1984-1990. |
| [21] | Slavin JL, Martini MC, Jacobs DR Jr, Marquart L. Plausible mechanisms for the protectiveness of whole grains. The American Journal of Clinical Nutrition, 1999, 70(3): 459S-463S. |
| [22] | Thorburn A, Muir J, Proietto J. Carbohydrate fermentation decreases hepatic glucose output in healthy subjects. Metabolism, 1993, 42(6): 780-785. DOI:10.1016/0026-0495(93)90249-N |
| [23] | Venter CS, Vorster HH, Cummings JH. Effects of dietary propionate on carbohydrate and lipid metabolism in healthy volunteers. The American Journal of Gastroenterology, 1990, 85(5): 549-553. |
| [24] | Arora T, Loo RL, Anastasovska J, Gibson GR, Tuohy KM, Sharma RK, Swann JR, Deaville ER, Sleeth ML, Thomas EL, Holmes E, Bell JD, Frost G. Differential effects of two fermentable carbohydrates on central appetite regulation and body composition. PLoS One, 2012, 7(8): e43263. DOI:10.1371/journal.pone.0043263 |
| [25] | Rebello CJ, Burton J, Heiman M, Greenway FL. Gastrointestinal microbiome modulator improves glucose tolerance in overweight and obese subjects:a randomized controlled pilot trial. Journal of Diabetes and Its Complications, 2015, 29(8): 1272-1276. DOI:10.1016/j.jdiacomp.2015.08.023 |
| [26] | Keenan MJ, Zhou J, Mccutcheon KL, Raggio AM, Bateman HG, Todd E, Jones CK, Tulley RT, Melton S, Martin RJ, Hegsted M. Effects of resistant starch, a non-digestible fermentable fiber, on reducing body fat. Obesity, 2006, 14(9): 1523-1534. DOI:10.1038/oby.2006.176 |
| [27] | El Kaoutari A, Armougom F, Gordon JI, Raoult D, Henrissat B. The abundance and variety of carbohydrate-active enzymes in the human gut microbiota. Nature Reviews Microbiology, 2013, 11(7): 497-504. DOI:10.1038/nrmicro3050 |
| [28] | Psichas A, Sleeth ML, Murphy KG, Brooks L, Bewick GA, Hanyaloglu AC, Ghatei MA, Bloom SR, Frost G. The short chain fatty acid propionate stimulates GLP-1 and PYY secretion via free fatty acid receptor 2 in rodents. International Journal of Obesity, 2015, 39(3): 424-429. DOI:10.1038/ijo.2014.153 |
| [29] | Mithieux G, Gautier-Stein A. Intestinal glucose metabolism revisited. Diabetes Research and Clinical Practice, 2014, 105(3): 295-301. DOI:10.1016/j.diabres.2014.04.008 |
| [30] | Sleeth ML, Thompson EL, Ford HE, Zac-Varghese SEK, Frost G. Free fatty acid receptor 2 and nutrient sensing:a proposed role for fibre, fermentable carbohydrates and short-chain fatty acids in appetite regulation. Nutrition Research Reviews, 2010, 23(1): 135-145. DOI:10.1017/S0954422410000089 |
| [31] | Broberger C, Landry M, Wong H, Walsh JN, Hokfelt T. Subtypes Y1 and Y2 of the neuropeptide Y receptor are respectively expressed in pro-opiomelanocortin- and neuropeptide-Y-containing neurons of the rat hypothalamic arcuate nucleus. Neuroendocrinology, 1997, 66(6): 393-408. |
| [32] | De Silva A, Bloom SR. Gut hormones and appetite control:a focus on PYY and GLP-1 as therapeutic targets in obesity. Gut and Liver, 2012, 6(1): 10-20. DOI:10.5009/gnl.2012.6.1.10 |
| [33] | Canfora EE, Jocken JW, Blaak EE. Short-chain fatty acids in control of body weight and insulin sensitivity. Nature Reviews Endocrinology, 2015, 11(10): 577-591. DOI:10.1038/nrendo.2015.128 |
| [34] | Abbott CR, Monteiro M, Small CJ, Sajedi A, Smith KL, Parkinson JRC, Ghatei MA, Bloom SR. The inhibitory effects of peripheral administration of peptide YY3-36 and glucagon-like peptide-1 on food intake are attenuated by ablation of the vagal-brainstem-hypothalamic pathway. Brain Research, 2005, 1044(1): 127-131. DOI:10.1016/j.brainres.2005.03.011 |
| [35] | Koda S, Date Y, Murakami N, Shimbara T, Hanada T, Toshinai K, Niijima A, Furuya M, Inomata N, Osuye K, Nakazato M. The role of the vagal nerve in peripheral PYY3-36-induced feeding reduction in rats. Endocrinology, 2005, 146(5): 2369-2375. DOI:10.1210/en.2004-1266 |
| [36] | Windey K, De Preter V, Verbeke K. Relevance of protein fermentation to gut health. Molecular Nutrition & Food Research, 2012, 56(1): 184-196. |
| [37] | Lee JH, Lee J. Indole as an intercellular signal in microbial communities. FEMS Microbiology Reviews, 2010, 34(4): 426-444. DOI:10.1111/j.1574-6976.2009.00204.x |
| [38] | Bansal T, Alaniz RC, Wood TK, Jayaraman A. The bacterial signal indole increases epithelial-cell tight-junction resistance and attenuates indicators of inflammation. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(1): 228-233. DOI:10.1073/pnas.0906112107 |
| [39] | Chimerel C, Emery E, Summers DK, Keyser U, Gribble FM, Reimann F. Bacterial metabolite indole modulates incretin secretion from intestinal enteroendocrine L cells. Cell Reports, 2014, 9(4): 1202-1208. DOI:10.1016/j.celrep.2014.10.032 |
| [40] | Barrett E, Ross RP, O'Toole PW, Fitzgerald GF, Stanton C. γ-aminobutyric acid production by culturable bacteria from the human intestine. Journal of Applied Microbiology, 2012, 113(2): 411-417. DOI:10.1111/jam.2012.113.issue-2 |
| [41] | Özogul F. Effects of specific lactic acid bacteria species on biogenic amine production by foodborne pathogen. International Journal of Food Science & Technology, 2011, 46(3): 478-484. |
| [42] | Sohn JW. Network of hypothalamic neurons that control appetite. BMB Reports, 2015, 48(4): 229-233. DOI:10.5483/BMBRep.2015.48.4.272 |
| [43] | Patel SM, Ebenezer IS. The effects of chronic intraperitoneal administration of the GABAB receptor agonist baclofen on food intake in rats. European Journal of Pharmacology, 2008, 593(1/3): 68-72. |
| [44] | Tong QC, Ye CP, Jones JE, Elmquist JK, Lowell BB. Synaptic release of GABA by AgRP neurons is required for normal regulation of energy balance. Nature Neuroscience, 2008, 11(9): 998-1000. DOI:10.1038/nn.2167 |
| [45] | Morton GJ, Cummings DE, Baskin DG, Barsh GS, Schwartz MW. Central nervous system control of food intake and body weight. Nature, 2006, 443(7109): 289-295. DOI:10.1038/nature05026 |
| [46] | Kalra SP, Kalra PS. NPY and cohorts in regulating appetite, obesity and metabolic syndrome:beneficial effects of gene therapy. Neuropeptides, 2004, 38(4): 201-211. DOI:10.1016/j.npep.2004.06.003 |
| [47] | O'Mahony SM, Clarke G, Borre YE, Dinan TG, Cryan JF. Serotonin, tryptophan metabolism and the brain-gut-microbiome axis. Behavioural Brain Research, 2015, 277: 32-48. DOI:10.1016/j.bbr.2014.07.027 |
| [48] | Sharon G, Garg N, Debelius J, Knight R, Dorrestein PC, Mazmanian SK. Specialized metabolites from the microbiome in health and disease. Cell Metabolism, 2014, 20(5): 719-730. DOI:10.1016/j.cmet.2014.10.016 |
| [49] | Desbonnet L, Garrett L, Clarke G, Bienenstock J, Dinan TG. The probiotic Bifidobacteria infantis:an assessment of potential antidepressant properties in the rat. Journal of Psychiatric Research, 2008, 43(2): 164-174. DOI:10.1016/j.jpsychires.2008.03.009 |
| [50] | Tecott LH, Sun LM, Akana SF, Strack AM, Lowenstein DH, Dallman MF, Julius D. Eating disorder and epilepsy in mice lacking 5-Ht2c serotonin receptors. Nature, 1995, 374(6522): 542-546. DOI:10.1038/374542a0 |
| [51] | Berthoud HR. Metabolic and hedonic drives in the neural control of appetite:who is the boss?. Current Opinion in Neurobiology, 2011, 21(6): 888-896. DOI:10.1016/j.conb.2011.09.004 |
| [52] | Lam DD, Przydzial MJ, Ridley SH, Yeo GSH, Rochford JJ, O'Rahilly S, Heisler LK. Serotonin 5-Ht2C receptor agonist promotes hypophagia via downstream activation of melanocortin 4 receptors. Endocrinology, 2008, 149(3): 1323-1328. DOI:10.1210/en.2007-1321 |
| [53] | Tiligada E, Wilson JF. Regulation of α-melanocyte-stimulating hormone release from superfused slices of rat hypothalamus by serotonin and the interaction of serotonin with the dopaminergic system inhibiting peptide release. Brain Research, 1989, 503(2): 225-228. DOI:10.1016/0006-8993(89)91668-5 |
| [54] | Heisler LK, Jobst EE, Sutton GM, Zhou LG, Borok E, Thornton-Jones Z, Liu HY, Zigman JM, Balthasar N, Kishi T, Lee CE, Aschkenasi CJ, Zhang CY, Yu J, Boss O, Mountjoy KG, Clifton PG, Lowell BB, Friedman JM, Horvath T, Butler AA, Elmquist JK, Cowley MA. Serotonin reciprocally regulates melanocortin neurons to modulate food intake. Neuron, 2006, 51(2): 239-249. DOI:10.1016/j.neuron.2006.06.004 |
| [55] | Sohn JW, Xu Y, Jones JE, Wickman K, Williams KW, Elmquist JK. Serotonin 2C receptor activates a distinct population of arcuate pro-opiomelanocortin neurons via TRPC channels. Neuron, 2011, 71(3): 488-497. DOI:10.1016/j.neuron.2011.06.012 |
 2017, Vol. 57
2017, Vol. 57




