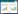扩展功能
文章信息
- 王帅, 刘根, 涂文姬, 曾成, 鲁红林, 信爱国, 高洪, 李珂
- WANG Shuai, LIU Gen, TU Wenji, ZENG Cheng, LU Honglin, XIN Aiguo, GAO Hong, LI Ke
- 一株肺炎克雷伯菌的分离鉴定及生物学特性分析
- Isolation, identification and biological characteristics analysis of a strain of Klebsiella pneumoniae
- 微生物学通报, 2024, 51(7): 2586-2598
- Microbiology China, 2024, 51(7): 2586-2598
- DOI: 10.13344/j.microbiol.china.230804
-
文章历史
- 收稿日期: 2023-10-07
- 接受日期: 2023-11-24
- 网络首发日期: 2024-03-05
2. 云南省畜牧兽医科学院养禽与禽病研究所, 云南 昆明 650224;
3. 云南省野生动植物救护繁育中心, 云南 昆明 650224;
4. 昆明市濒危动植物收容拯救中心, 云南 昆明 650224
2. Poultry Husbandry and Disease Research Institute, Yunnan Academy of Animal Husbandry and Veterinary Sciences, Kunming 650224, Yunnan, China;
3. Yunnan Wildlife Rescue and Breeding Center, Kunming 650224, Yunnan, China;
4. Kunming Endangered Animals and Plants Shelter and Rescue Center, Kunming 650224, Yunnan, China
肺炎克雷伯菌(Klebsiella pneumoniae)是在自然界中广泛存在的一种革兰氏阴性菌,为肠杆菌科(Enterobacteriaceae)克雷伯菌属(Klebsiella)[1],主要存在于机体肠道、呼吸道以及自然界(土壤、污水)中[2]。肺炎克雷伯菌作为一种人兽共患机会致病菌,多感染入侵免疫系统功能低下者或婴幼儿,引起肺炎、肠炎、脑膜炎、败血症等疾病[3-6],马红叶等[7]从西安交通大学第一附属医院2014—2020年的临床病料中共分离肺炎克雷伯菌4 932株(ICU中分离1 328株),主要感染部位为呼吸道、血液、泌尿系统,对常见抗菌药物耐药性严重,且耐药率呈现增长态势;诸多研究报道家养动物(猪、牛、羊和鸡)和水产养殖动物(大黄鱼和虾等),由于遭受感染且难以防治,继而给养殖业造成了严重影响[8-11]。另外,野生养殖动物(大熊猫和黑叶猴等)因有受到侵害的报道而备受人们关注[12-15]。因此,对肺炎克雷伯菌的生物学特性研究具有重要的公共卫生学意义。
随着野生动物驯养技术的现代化、系统化和成熟化,具有较高药用、毛皮用和观赏用价值的特种经济动物,如狐狸、梅花鹿等呈现规模化人工养殖态势[16],而人兽共患病原微生物对驯养动物及养殖人员健康存在一定的潜在威胁,因此养殖过程中病原微生物的情况调查显得尤为重要。本研究旨在调查犀牛驯养场病原菌存在情况,对采集的犀牛粪便进行细菌分离鉴定、药物敏感性与耐药基因检测、动物致病性试验与毒力基因检测等研究,以期为该驯养场预防潜在流行致病菌和保障人员健康提供参考依据。
1 材料与方法 1.1 样品六份犀牛粪便样品采集于某犀牛规模化驯养场,样品存放于自封袋中并做好标记后置于−50 ℃保藏。成年昆明小鼠(Kunming mice, KM)购自昆明医科大学实验动物中心(实验动物伦理审查受理编号为YNASVI01-2024001)。
1.2 培养基、主要试剂及仪器LB琼脂培养基、LB肉汤培养基、麦康凯琼脂培养基和SS琼脂培养基,广东环凯微生物科技有限公司;巧克力琼脂培养基:每100 mL含LB琼脂培养基90 mL,鸭全血10 mL。肠杆菌科细菌生化常规鉴定盒和革兰氏染色试剂盒,广东环凯微生物科技有限公司;抗生素药敏试纸,杭州滨和微生物试剂有限公司;2×San Taq PCR Mix,生工生物工程(上海)股份有限公司,细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司。PCR扩增仪,Applied Biosystems公司;凝胶成像紫外仪,上海天能科技有限公司;电泳仪,北京六一生物科技有限公司。
1.3 分离菌形态特征使用灭菌接种环分别挑取6份犀牛粪便样品划线接种于巧克力琼脂培养基,37 ℃恒温培养箱中倒置培养24 h。挑取疑似菌落于巧克力琼脂培养基纯化培养后,将纯培养单菌落分别划线接种于巧克力琼脂、麦康凯琼脂、SS琼脂和LB琼脂培养基,37 ℃恒温培养箱培养24 h后观察细菌生长状态,革兰氏染色后于显微镜下观察菌体形态特征。纯培养物置于50%甘油血清管中‒20 ℃保存备用。
1.4 分离菌的生化鉴定分离菌株纯培养物按照肠杆菌科细菌生化常规鉴定盒使用说明书进行生化鉴定。
1.5 分离菌16S rRNA基因鉴定采用细菌基因组DNA提取试剂盒提取分离菌株基因组DNA,按照李廷翠等[17]方法进行16S rRNA基因的PCR扩增、测序和拼接。获得16S rRNA基因序列通过BLAST进行比对,采用MEGA 11.0根据最大似然法(maximum likelihood method)构建系统发育树。
1.6 分离菌生长曲线的测定将分离菌株纯培养物接种于LB肉汤培养基,37 ℃、150 r/min进行扩增培养。取10 μL培养液接种至另一支LB肉汤管中,37 ℃、150 r/min培养,每间隔1 h取菌液混匀后加入酶标板中测量其OD600值。每次测量设置3个重复组并取平均值。利用GraphPad Prism 10.0软件以时间为横坐标,以OD600值为纵坐标,绘制细菌的生长曲线。
1.7 分离菌的药物敏感性检测采用K-B法测量分离菌株的药物敏感性。使用无菌生理盐水将培养基上纯培养物洗下制成菌悬液,使用灭菌玻璃珠均匀涂布于普通琼脂培养基,选用临床上常用的七大类19种抗生素药敏试纸贴于培养基表面,37 ℃恒温培养箱倒置培养过夜后对结果进行测读。按照美国临床和实验室标准协会药敏判定标准判定分离菌株对不同药物的敏感性[18]。
1.8 肺炎克雷伯菌特异性khe基因检测作为肺炎克雷伯菌的特异性基因,khe基因可用于疑似肺炎克雷伯菌的检测鉴定。根据王乐等[19]研究合成肺炎克雷伯菌特异性khe基因引物,并按照其方法对分离菌株进行PCR验证,产物经1.5%琼脂糖凝胶电泳检测。
1.9 肺炎克雷伯菌荚膜血清型检测合成解秀梅等[20]设计的7种肺炎克雷伯菌常见荚膜血清型引物,按照其扩增体系及条件用PCR方法对分离菌株进行荚膜血清型检测,产物经1.5%琼脂糖凝胶电泳检测。
1.10 分离菌耐药基因检测参照文献[21-23]及上述1.7节药敏试验选用七大类抗生素并合成其相对应的16种耐药基因引物(表 1),按照其PCR扩增条件对分离菌株进行耐药基因检测,产物经1.5%琼脂糖凝胶电泳检测。所有引物均由捷瑞生物工程(上海)有限公司合成。
| 耐药基因类别 Types of resistance gene |
基因 Gene |
引物序列 Sequence of primers (5′→3′) |
产物大小 Product size (bp) |
| β-内酰胺类 β-lactams |
ampC | F: TTCTATCAAMACTGGCARCC R: CCYTTTTATGTACCCAYGA |
550 |
| blaTEM | F: CATTTCCGTGTCGCCCTTATTC R: CGTTCATCCATAGTTGCCTGAC |
800 | |
| blaSHV | F: AGCCGCTTGAGCAAATTAAAC R: ATCCCGCAGATAAATCACCAC |
713 | |
| blaKPC | F: CGTCTAGTTCTGCTGTCTTG R: CTTGTCATCCTTGTTAGGCG |
798 | |
| 四环素类 Tetracyclines |
tetB | F: TTGGTTAGGGGCAAGTTTTG R: GTAATGGGCCAATAACACCG |
659 |
| 氯霉素类 Chloramphenicols |
cmlA | F: GAAAAGAGTACTCAACCAAATA R: AGTAACGGTACTTAAATTGTTTAC |
699 |
| cat1 | F: AGTTGCTCAATGTACCTATAACC R: TTGTAATTCATTAAGCATTCTGCC |
740 | |
| 多黏菌素类 Polymyxins |
phoQ | F: ATACCCACAGGACGTCATCA R: CAGGTGTCTGACAGGGATTA |
1 597 |
| pmrB | F: ACCTACGCGAAAAGATTGGC R: GATGAGGATAGCGCCCATGC |
1 274 | |
| mcr-1 | F: AGTCCGTTTGTTCTTGTGGC R: AGATCCTTGGTCTCGGCTTG |
320 | |
| 喹诺酮类 Quinolones |
qnrS | F: ATGGAAACCTACAATCATAC R: AAAAACACCTCGACTTAAGT |
492 |
| oqxA | F: CTCGGCGCGATGATGCT R: CCACTCTTCACGGGAGACGA |
393 | |
| 硝基呋喃类 Nitrofurans |
nfsB | F: CCCGCTAAATCTTCAACCTG R: AAAAGAGTGCGTCCAGGCTA |
913 |
| 大环内酯类 Macrolides |
ereA | F: GCCGGTGCTCATGAACTTGAG R: CGACTCTATTCGATCAGAGGC |
419 |
| ermA | F: TCTAAAAAGCATGTAAAAGAA R: CTTCGATAGTTTATTAATATTAGT |
645 | |
| ermB | F: ATTGGAACAGGTAAAGGGC R: GAACATCTGTGGTATGGCG |
442 |
参照文献[24]用PCR方法对分离菌株进行毒力基因检测,产物经1.5%琼脂糖凝胶电泳检测。上述所有引物(表 2)由捷瑞生物工程(上海)有限公司合成。
| 毒力基因名称 Types of virulence gene |
引物序列 Sequence of primers (5′→3′) |
产物大小 Product size (bp) |
| rmpA | F: ACTGGGCTACCTCTGCTTCA R: CTTGCATGAGCCATCTTTCA |
516 |
| allS | F: CCGTTAGGCAATCCAGAC R: TCTGATTTA(A/T)CCCACATT |
1 090 |
| kfuBC | F: GAAGTGACGCTGTTTCTGGC R: TTTCGTGTGGCCAGTGACTC |
797 |
| ybtA | F: ATGACGGAGTCACCGCAAAC R: TTACATCACGCGTTTAAAGG |
960 |
| iucB | F: ATGTCTAAGGCAAACATCGT R: TTACAGACCGACCTCCGTGA |
948 |
| iroNB | F: GGCTACTGATACTTGACTATTC R: CAGGATACAATAGCCCATAG |
992 |
| fimH | F: GCTCTGGCCGATAC(C/T)AC(C/G)ACGG R: GC(G/A)(A/T)A(G/A)TAACG(T/C)GCCTGGAACGG |
423 |
| ureA | F: GCTGACTTAAGAGAACGTTATG R: GATCATGGCGCTACCT(C/T)A |
337 |
| uge | F: GATCATCCGGTCTCCCTGTA R: TCTTCACGCCTTCCTTCACT |
534 |
| wabG | F: CGGACTGGCAGATCCATATC R: ACCATCGGCCATTTGATAGA |
683 |
| wcaG | F: GGTTGGKTCAGCAATCGTA R: ACTATTCCGCCAACTTTTGC |
169 |
将20只小鼠随机分为1个对照组和3个实验组,每组各5只。实验组小鼠分别腹腔注射1×108、1×109、1×1010 CFU/mL菌液,注射剂量为1 mL/只,对照组腹腔注射等剂量无菌生理盐水。各组标记后进行分笼饲养,每12 h观察小鼠精神状态和死亡情况,对死亡小鼠立即进行剖检观察并分离细菌进行鉴定,取肝脏、肺脏和肠组织固定于4%多聚甲醛中,以备制作病理组织切片。攻菌96 h后,采用颈椎脱臼法处死剩余小鼠并进行相同操作。
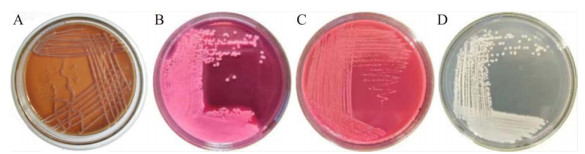
2 结果与分析 2.1 分离菌形态特征及镜检结果从6份粪便样品中分离到一株肺炎克雷伯菌疑似菌株,分离率为16.67%。该菌株在巧克力琼脂、SS、LB培养基上生长为表面光滑、边缘整齐、形态均一的灰白色圆形单菌落;麦康凯培养基上生长为表面光滑、边缘整齐、形态均一的乳白色奶油状圆形单菌落;麦康凯和LB培养基上圆形单菌落大于巧克力琼脂和SS培养基,均呈现为黏液状且大多聚集在一起(图 1)。革兰氏染色镜检菌体形态为红色短杆状(图 2)。
|
| 图 1 分离菌株形态特征 Figure 1 Morphological characteristics of the isolated strain. A: Chocolate agar. B: MacConkey agar. C: SS agar. D: LB agar. A:巧克力琼脂. B:麦康凯琼脂. C:SS琼脂. D:LB琼脂 |
|
|
|
| 图 2 分离菌株的革兰氏染色镜检结果(1 000×) Figure 2 Gram's stain microscopic results of isolated strain (1 000×). |
|
|
分离菌株生化鉴定结果显示,该菌能发酵葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖;蛋白胨水、MR试验、硫化氢、半固体琼脂试验呈阴性;VP试验、西檬氏柠檬酸盐、尿素试验呈阳性(表 3),与肺炎克雷伯菌生化特性一致,初步判定该分离菌株为肺炎克雷伯菌。
| 项目Item | 结果Result |
| 葡萄糖Glucose | + |
| 乳糖Lactose | + |
| 麦芽糖Maltose | + |
| 甘露醇Mannitol | + |
| 蔗糖Saccharose | + |
| 蛋白胨水Peptone water | ‒ |
| MR test | ‒ |
| VP test | + |
| 西檬氏柠檬酸盐Simon’s citrate | + |
| 硫化氢Hydrogen sulfide | ‒ |
| 尿素Urea | + |
| 半固体琼脂Semisolid agar | ‒ |
| +:阳性;−:阴性 +: Positive; −: Negative. |
|
分离菌16S rRNA基因分别扩增出500、560、750 bp这3条目的片段,与预期结果一致,测序结果拼接后得到一条全长为1 466 bp的基因。系统发育树显示(图 3),分离菌株与肺炎克雷伯菌(Klebsiella pneumoniae)亲缘关系较接近,处于同一分支;与产气克雷伯菌(Klebsiella aerogenes)、产酸克雷伯菌(Klebsiella oxytoca)处于不同分支,因此,分离菌株鉴定为肺炎克雷伯菌,命名为YN-KPP-2023 (GenBank登录号为OR674184)。

|
| 图 3 基于分离菌株16S rRNA基因序列构建的系统发育树 Figure 3 Phylogenetic tree constructed based on the 16S rRNA gene sequence of isolated strains. The serial number in parentheses is the GenBank accession number of the relevant strain; the number on the branching point is the support rate of bootstrap; Bar=0.10 is nucleotide divergence. 括号中的序号为相关菌株GenBank登录号;分支点上数字为bootstrap支持率;标尺0.10为序列差异的分支长度 |
|
|
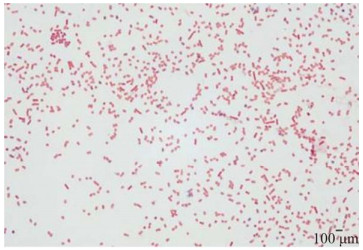
分离菌株特异性khe基因PCR扩增出一条大小为430 bp的目的条带,与肺炎克雷伯菌特异性khe基因条带大小一致(图 4)。
|
| 图 4 分离菌株khe基因PCR扩增结果 Figure 4 PCR amplification of the khe gene of the isolated strain. M: DL2000 DNA Marker; 1: Isolated strain; 2: Negative control. M:DL2000 DNA Marker;1:分离菌株;2:阴性对照 |
|
|
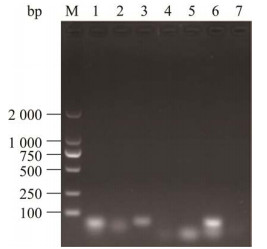
分离菌株未鉴定出肺炎克雷伯菌的7种常见荚膜血清型(图 5),可能分属其他荚膜血清型。
|
| 图 5 分离菌株荚膜K血清型PCR扩增结果 Figure 5 PCR amplification results of isolated strain capsule K serotype. M: DL2000 DNA Marker; 1‒6: K1, K2, K5, K20, K54 and K57; 7: Negative control. M:DL2000 DNA Marker;1‒6:K1、K2、K5、K20、K54、K57基因;7:阴性对照 |
|
|
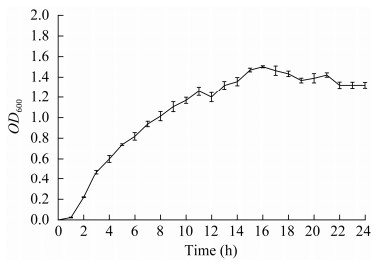
分离菌株生长曲线测定结果显示,0‒1 h该菌株处于生长迟缓期,约1 h后进入对数生长期,约16 h后进入生长稳定期(图 6)。
|
| 图 6 分离菌株的生长曲线 Figure 6 Growth curve of the isolated strain. |
|
|
药物敏感性结果显示,该菌株对头孢噻肟、头孢他啶、头孢氨苄、氨苄西林等9种抗生素敏感;对阿莫西林、四环素、土霉素和氟苯尼考4种抗生素中度敏感;对强力霉素、多黏菌素B和杆菌肽等6种抗生素耐药(表 4)。
| 抗菌药物种类 Types of antimicrobial agent |
药敏片 Susceptibility paper |
抑菌圈直径 Diameter of inhibition zone (mm) |
敏感性 Sensitivity |
| β-内酰胺类 β-lactams |
头孢噻肟Cefotaxime 头孢他啶Ceftazidime 头孢氨苄Cephalexin 阿莫西林Amoxicillin 氨苄西林Ampicillin |
28 24 22 17 15 |
S S S I S |
| 四环素类 Tetracyclines |
强力霉素Doxycycline 四环素Tetracycline 土霉素Oxytetracycline |
9 17 18 |
R I I |
| 氯霉素类 Chloramphenicols |
氟苯尼考Florfenicol 氯霉素Chloramphenicol |
14 20 |
I S |
| 多肽类 Polypeptides |
多黏菌素B Polymyxin B 杆菌肽Bacitracin |
0 0 |
R R |
| 喹诺酮类 Quinolones |
恩诺沙星Enrofloxacin 左氟沙星Levofloxacin 环丙沙星Ciprofloxacin |
24 27 24 |
S S S |
| 硝基呋喃类Nitrofurans | 呋喃唑酮Furazolidone | 21 | S |
| 大环内酯类 Macrolides |
阿奇霉素Azithromycin 红霉素Erythromycin 罗红霉素Roxithromycin |
0 0 0 |
R R R |
| R:耐药;I:中度敏感;S:敏感 R: Resistance; I: Intermediary; S: Sensitivity. |
|||
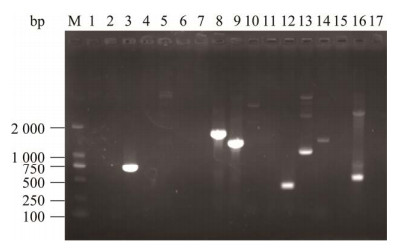
如图 7所示,16种耐药基因检测结果显示,该菌株携带blaSHV、phoQ、pmrB、oqxA、nfsB、ermB这6种耐药基因,不携带其余10种耐药基因。
|
| 图 7 分离菌株耐药基因PCR扩增结果 Figure 7 PCR amplification results of drug resistance genes of isolated strain. M: DL2000 DNA Marker; 1‒16: ampC, blaTEM, blaSHV, blaKPC, tetB, cmlA, cat1, phoQ, pmrB, mcr-1, qnrS, oqxA, nfsB, ereA, ermA and ermB; 17: Negative control. M:DL2000 DNA Marker;1‒16:ampC, blaTEM, blaSHV, blaKPC, tetB, cmlA, cat1, phoQ, pmrB, mcr-1, qnrS, oqxA, nfsB, ereA, ermA and ermB;17:阴性对照 |
|
|
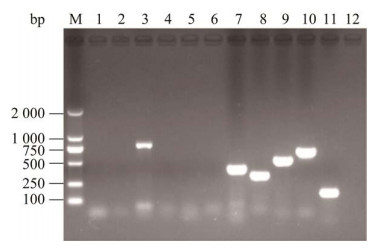
该菌株11种毒力基因PCR检测结果显示,共检出kfuBC、fimH、ureA、uge、wabG和wcaG这6种毒力基因,条带明亮单一且大小符合预期,未检测出其余5种毒力基因(图 8)。
|
| 图 8 分离菌株毒力基因PCR扩增结果 Figure 8 Results of PCR amplification of virulence genes of isolated strain. M: DL2000 DNA Marker. 1‒11: rmpA, allS, kfuBC, ybtA, iucB, iroNB, fimH, ureA, uge, wabG and wcaG; 12: Negative control. M:DL2000 DNA Marker;1‒11:rmpA、allS、kfuBC、ybtA、iucB、iroNB、fimH、ureA、uge、wabG和wcaG;12:阴性对照 |
|
|
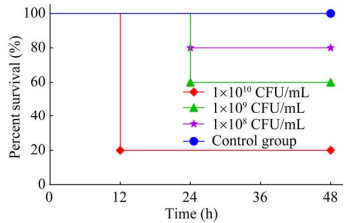
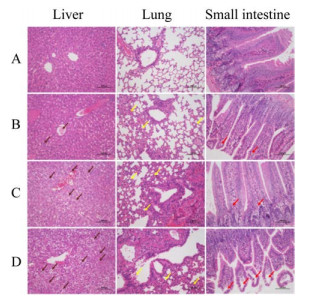
实验组小鼠攻菌4 h后表现为精神萎靡、被毛耸立、食欲不振,12 h开始发生死亡,不同剂量组各时间点小鼠存活情况见图 9。死亡小鼠剖检后均可见肝脏瘀血肿大,部分肝脏呈现为黄褐色,肺脏出血、萎缩,肠胃鼓气。组织病理切片结果(图 10)显示,肝细胞发生颗粒变性、水泡变性和脂肪变性,肝索结构不清晰,胞体肿胀变形,胞核居中,胞质疏松且空泡化,可见嗜酸性颗粒;肺泡壁轻度增厚,肺泡大小不一,肺泡间隔增宽,肺泡壁和血管周围可见粒细胞小灶性浸润,支气管内偶见嗜酸性絮状物,肺泡腔内有局灶性出血灶,可见少量红细胞;小肠少量肠绒毛上皮与固有层分离,间隙增大,肠腺数量丰富,排列密集,有少量粒细胞浸润;而对照组均正常。
|
| 图 9 不同浓度的分离菌株对小鼠致病性试验结果 Figure 9 Results of pathogenicity test of isolated strains with different concentrations in mice. |
|
|
|
| 图 10 小鼠肝脏、肺脏和小肠病理组织学观察(HE,200×) Figure 10 Histopathological observation of liver, lung and small intestine in mice (HE, 200×). A: Control group. B: 1×108 CFU/mL dose group. C: 1×109 CFU/mL dose group. D: 1×1010 CFU/mL dose group. A:对照组. B:1×108 CFU/mL剂量组. C:1×109 CFU/mL剂量组. D:1×1010 CFU/mL剂量组 |
|
|
肺炎克雷伯菌于1893年由Friendiander从患有大叶性肺炎患者肺脏组织中分离得到,分为肺炎、鼻炎和鼻硬结3个亚种[25]。近年来,养殖动物感染肺炎克雷伯菌问题随养殖规模化、集约化发展逐渐浮现[8, 15]。为调查某犀牛驯养场病原菌存在情况,本研究将随机采集到的6份犀牛粪便进行细菌分离培养,并从中得到一株肺炎克雷伯菌,分离率为16.67% (1/6)。相关研究表明,肺炎克雷伯菌在临床上感染养殖动物所引起的症状除肺炎外,还可能引起腹泻[26-27]。侯铭源等[26]从河北省某市患有呼吸道疾病的80份病牛肺脏、鼻拭子样本中分离得到10株肺炎克雷伯菌,分离率为12.5% (10/80);左伟等[27]从西藏不同地区采集的60份腹泻藏猪新鲜粪便样品中分离到3株肺炎克雷伯菌,分离率为5% (3/60);陈强等[28]从吉林省某水貂养殖场送检的6只患肺炎病死水貂病料样品中分离得到6株肺炎克雷伯菌,分离率为100%。不同养殖场肺炎克雷伯菌分离率不一样,可能与养殖场所处位置、动物的易感性和饲养管理方式不同有关。对本次分离的肺炎克雷伯菌进行实验室相关研究有利于预防和控制该疾病的发生及流行。
目前常用抗生素来治疗细菌性疾病,不合理使用经常导致菌株产生耐药性,从而降低临床治疗效果,所以了解菌株的药物敏感性有利于临床用药的选择。本研究从耐药基因鉴定和药物敏感性试验初步探讨分离菌株的耐药情况。分离菌株呈多重耐药,耐药表型对四环素类、多肽类、大环内酯类中的6种抗生素产生了耐药,其中,对实验中多肽类和大环内酯类抗生素耐药率高达100%。药敏试验结果提示β-内酰胺类和喹诺酮类抗生素可作为驯养场的治疗备选药,并应避免因抗生素的不合理使用而导致的耐药菌株的出现。王哲红等[29]从某规模化奶牛场分离得到的肺炎克雷伯菌对头孢菌素类抗菌药耐药,对大环内酯类和多肽类抗菌药敏感,与本研究相反,分析其原因可能是不同菌株之间的差异和不同地区用药差异所致。分离菌株检测出β-内酰胺类blaSHV、喹诺酮类oqxA、硝基呋喃类nfsB、大环内酯类ermB和多肽类phoQ、pmrB这6种耐药基因,四环素类和氯霉素类均未检测出,与多黏菌素B、阿奇霉素、红霉素及罗红霉素的耐药表型结果一致,与强力霉素的耐药表型以及β-内酰胺类、喹诺酮类和硝基呋喃类的敏感表型结果不一致,判断其可能存在除耐药基因外的其他机制介导的耐药表型,以及其他耐药基因介导的抗生素耐药性或存在部分基因不表现出耐药表型的情况。
毒力基因在病原菌入侵感染宿主的能力、感染的过程以及感染的程度中起重要作用。分离菌株毒力基因检测结果与范培超等[30]的报道基本一致,均检测出了铁摄取相关和促进菌毛黏附的fimH基因,影响尿素酶合成的ureA、uge基因,以及介导脂多糖合成的wabG基因,也符合相关研究中1型菌毛fimH是肺炎克雷伯菌中最常检测到的毒力因子的研究结果[31]。另外,分离株不排除携带除此之外的其他毒力基因,这些毒力基因或许协同增强了该菌株的致病力和侵袭力,这可能与小鼠接种感染致死以及组织器官损伤有关,也提示驯养场中可能存在肺炎克雷伯菌感染犀牛的风险,应引起高度重视。
本研究成功从犀牛驯养场粪便样品中分离到一株肺炎克雷伯菌,该菌株具有多重耐药性和一定的致病性,对犀牛构成潜在威胁,但其耐药和致病机制仍需深入研究。
| [1] |
LI S, HUANG FY, ZHANG YL, CAI DJ, ZUO ZC. Isolation, identification and drug resistance of extended spectrum β-lactamases (ESBLs) producing Klebsiella pneumoniae from beef cattle in Sichuan Province, China[J]. Acta Agriculturae Zhejiangensis, 2022, 34(5): 923-933. (in Chinese) 李姗, 黄方园, 张玉龙, 才冬杰, 左之才. 四川省部分地区肉牛源产超广谱β-内酰胺酶肺炎克雷伯菌的分离鉴定与耐药性分析[J]. 浙江农业学报, 2022, 34(5): 923-933. DOI:10.3969/j.issn.1004-1524.2022.05.06 |
| [2] |
MARTIN RM, BACHMAN MA. Colonization, infection, and the accessory genome of Klebsiella pneumoniae[J]. Frontiers in Cellular and Infection Microbiology, 2018, 8: 4. DOI:10.3389/fcimb.2018.00004 |
| [3] |
ARATO V, RASO MM, GASPERINI G, SCORZA FB, MICOLI F. Prophylaxis and treatment against Klebsiella pneumoniae: current insights on this emerging anti-microbial resistant global threat[J]. International Journal of Molecular Sciences, 2021, 22(8): 4042. DOI:10.3390/ijms22084042 |
| [4] |
WANG GQ, MU TJ. Multidrug-resistant Klebsiella pneumoniae causing enteritis in children[J]. Chinese Journal of Nosocomiology, 2013, 23(22): 5564-5566. (in Chinese) 王国庆, 穆廷杰. 多药耐药肺炎克雷伯菌致小儿肠炎调查[J]. 中华医院感染学杂志, 2013, 23(22): 5564-5566. |
| [5] |
ZHU TT, KUANG LH, WANG LY, YU F, ZHANG G, MAI J, JIANG YM. Clinical features and drug resistance of Klebsiella pneumoniae meningitis in 4 children[J]. Sichuan Medical Journal, 2022, 43(11): 1102-1107. (in Chinese) 竺婷婷, 旷凌寒, 王丽媛, 于凡, 张鸽, 麦佳, 江咏梅. 4例儿童肺炎克雷伯菌脑膜炎的临床特征及耐药性分析[J]. 四川医学, 2022, 43(11): 1102-1107. |
| [6] |
ZHAO RT, NA MH, CHAO B, DUAN L, Arigonggaowa. Analysis of clinical features and drug resistance of Klebsiella pneumoniae caused sepsis in neonates[J]. Chinese Journal of Woman and Child Health Research, 2022, 33(6): 96-102. (in Chinese) 赵容陶, 娜木罕, 朝宝, 段炼, 阿日贡高娃. 新生儿肺炎克雷伯菌败血症的临床特征及耐药性分析[J]. 中国妇幼健康研究, 2022, 33(6): 96-102. |
| [7] |
MA HY, LIU Z, ZHANG L, SUN JJ, LIU Y, LEI JE, GUO LT. Clinical distribution and drug resistance of Klebsiella pneumoniae in the hospital from 2014 to 2020[J]. China Medicine, 2022, 17(1): 88-92. (in Chinese) 马红叶, 刘哲, 张蕾, 孙婧婧, 刘昱, 雷金娥, 郭利涛. 医院2014–2020年肺炎克雷伯菌临床分布及耐药性研究[J]. 中国医药, 2022, 17(1): 88-92. |
| [8] |
WANG Y, DONG WL, WANG W, ZHANG XQ, LI XS, MA HX, GAO YH. Isolation, identification and drug resistance analysis of Klebsiella pneumoniae from swine[J]. Chinese Veterinary Science, 2017, 47(12): 1570-1576. (in Chinese) 王羽, 董文龙, 王巍, 张喜庆, 李雪嵩, 马红霞, 高云航. 猪源肺炎克雷伯菌的分离鉴定及其耐药性分析[J]. 中国兽医科学, 2017, 47(12): 1570-1576. |
| [9] |
MA SY. Molecular epidemiological investigation and drug resistance characteristics on Klebsiella pneumoniae of red Deer in southern Xinjiang[D]. Alar: Master's Thesis of Tarim University, 2022 (in Chinese) 马纾薏. 新疆南疆马鹿肺炎克雷伯菌分子流行病学调查及耐药特性研究[D]. 阿拉尔: 塔里木大学硕士学位论文, 2022. |
| [10] |
ZHAO JY, CHEN SJ, YANG HG, HAO G, WANG P, MA WG, XIA J. Isolation and identification of sheep Klebsiella pneumoniae in Xinjiang and the research of its partial biological characteristics[J]. Heilongjiang Agricultural Sciences, 2018(4): 57-60. (in Chinese) 赵洁雅, 陈世军, 杨会国, 郝耿, 汪萍, 马文戈, 夏俊. 新疆绵羊肺炎克雷伯菌分离鉴定及部分生物学特性研究[J]. 黑龙江农业科学, 2018(4): 57-60. |
| [11] |
YANG HJ, CHEN HH, SUN FQ, WANG HJ, PENG YY, ZHANG JM. Isolation and identification of Klebsiella pneumoniae in chickens[J]. Chinese Journal of Veterinary Medicine, 2009, 45(7): 44-45. (in Chinese) 杨红军, 陈海华, 孙凤青, 王豪举, 彭远义, 张建民. 鸡肺炎克雷伯菌的分离鉴定[J]. 中国兽医杂志, 2009, 45(7): 44-45. |
| [12] |
LI M, SU XY, LI XY, ZHANG HR. Isolation, identification, and biological characterization of Klebsiella pneumoniae from Ailuropoda melanoleuca[J]. Microbiology China, 2022, 49(12): 5206-5221. (in Chinese) 李敏, 苏小艳, 李学英, 张焕容. 大熊猫源肺炎克雷伯菌生物学特性[J]. 微生物学通报, 2022, 49(12): 5206-5221. |
| [13] |
CUI J, CHEN W, LI WP, PENG SM, LIAO RZ, SHAN F. Isolation and identification of Francois's langur-derived Klebsiella pneumoniae and drug sensitivity test[J]. Chinese Veterinary Science, 2020, 50(9): 1142-1146. (in Chinese) 崔瑾, 陈武, 李婉萍, 彭仕明, 廖锐章, 单芬. 黑叶猴源肺炎克雷伯菌的分离鉴定及药敏试验[J]. 中国兽医科学, 2020, 50(9): 1142-1146. |
| [14] |
PAN YX, WANG WJ, CHEN QT, HU GW. Isolation, identification, and pathogenic analysis of Klebsiella pneumoniae from large yellow croaker Larimichthys crocea[J]. Fisheries Science, 2023, 42(2): 268-278. (in Chinese) 潘苑霞, 王文基, 陈庆涛, 呼高伟. 1株大黄鱼源肺炎克雷伯菌的分离鉴定与致病性分析[J]. 水产科学, 2023, 42(2): 268-278. |
| [15] |
SINGH BR, KULSHRESHTHA SB. Preliminary examinations on the enterotoxigenicity of isolates of Klebsiella pneumoniae from seafoods[J]. International Journal of Food Microbiology, 1992, 16(4): 349-352. |
| [16] |
LI GY, BAO K, ZHANG X, SI FF, YAN S. Review on the development of special economic animal breeding industry in China[J]. Journal of Agriculture, 2018, 8(1): 140-144. (in Chinese) 李光玉, 鲍坤, 张旭, 司方方, 焉石. 中国特种经济动物养殖产业发展综述[J]. 农学学报, 2018, 8(1): 140-144. |
| [17] |
LI TC, LI K, YAN HY, ZHAO R, TANG YQ, CHANG ZS, ZOU FC, XIN AG. Isolation, identification and biological characteristics of a pathogon of Salmonella agona originated from pigeon[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(6): 1952-1960. (in Chinese) 李廷翠, 李珂, 严红亚, 赵蓉, 汤雅淇, 常志顺, 邹丰才, 信爱国. 鸽源阿哥纳沙门菌的分离鉴定和生物学特性研究[J]. 中国畜牧兽医, 2020, 47(6): 1952-1960. |
| [18] |
MA Y, LI JY, JIN SH. The American Committee for Clinical Laboratory Standards recommended the operation method and judgment standard of drug sensitivity test (revised in 2005)[J]. National Medical Journal of China, 2005, 85(17): 1182-1184. (in Chinese) 马越, 李景云, 金少鸿. 美国临床实验室标准委员会推荐药敏试验操作方法和判断标准(2005年修订版)[J]. 中华医学杂志, 2005, 85(17): 1182-1184. |
| [19] |
WANG L, WANG J, WANG LJ, FAN YT, WANG Y, LI QF. Isolation, identification and biological characteristics of 6 strains of Klebsiella pneumonia from bovine mastitis[J]. Chinese Journal of Veterinary Science, 2019, 39(6): 1202-1207. (in Chinese) 王乐, 王晶, 王丽娟, 范玉堂, 王妍, 李勤凡. 6株奶牛乳房炎肺炎克雷伯菌的分离、鉴定及生物学特性[J]. 中国兽医学报, 2019, 39(6): 1202-1207. |
| [20] |
XIE XM, TONG FZ. Serotype identification, pathogenicity and drug resistance of Klebsiella pneumoniae isolated from pet dogs in Xining[J]. Progress in Veterinary Medicine, 2021, 42(7): 131-134. (in Chinese) 解秀梅, 童富珍. 西宁地区宠物犬源肺炎克雷伯菌血清型鉴定、致病性及耐药性检测[J]. 动物医学进展, 2021, 42(7): 131-134. |
| [21] |
PENG JJ, BALASUBRAMANIAN B, MING YY, NIU JL, YI CM, MA Y, LIU WC. Identification of antimicrobial resistance genes and drug resistance analysis of Escherichia coli in the animal farm environment[J]. Journal of Infection and Public Health, 2021, 14(12): 1788-1795. |
| [22] |
WANG YX. Study on drug resistant phenotype and resistance genes of Klebsiella pneumoniae from wild animals in zoos in Fujian Province[D]. Fuzhou: Master's Thesis of Fujian Agriculture and Forestry University, 2020 (in Chinese). 王宇翔. 福建省内动物园圈养野生动物肺炎克雷伯菌的耐药表型及基因型研究[D]. 福州: 福建农林大学硕士学位论文, 2020. |
| [23] |
XU R, LAI HM, OU ZY, SU Y, SONG HH, REN ZN, LIU LL, SUN CL, YU DJ. Isolation and identification of pig-derived Klebsiella pneumoniae in Putian region, Fujian Province and detection of drug resistance[J]. Heilongjiang Animal Science and Veterinary Medicine, 2023(15): 72-77, 136. (in Chinese) 徐睿, 赖华敏, 欧正阳, 苏悦, 宋辉辉, 任子宁, 柳玲玲, 孙成龙, 俞道进. 福建省莆田地区猪源肺炎克雷伯菌的分离鉴定及耐药情况检测[J]. 黑龙江畜牧兽医, 2023(15): 72-77, 136. |
| [24] |
HE JY. Study on serotypes and distribution characteristic of virulence genes of Klebsiella pneumoniae[D]. Chongqing: Master's Thesis of Chongqing Medical University, 2012 (in Chinese). 和晋渝. 肺炎克雷伯菌的血清分型及毒力基因分布的研究[D]. 重庆: 重庆医科大学硕士学位论文, 2012. |
| [25] |
JIA Y, SUN CJ, HAN WY, HE LY, YANG Y. Progress in Klebsiella pneumoniae[J]. Journal of Microbiology, 2006, 26(5): 75-78. (in Chinese) 贾艳, 孙长江, 韩文瑜, 何礼洋, 杨洋. 肺炎克雷伯菌研究进展[J]. 微生物学杂志, 2006, 26(5): 75-78. |
| [26] |
HOU MY, LIN QY, LIANG YY, WANG X, JIA L, YANG XY, YUAN LN, LI LM, WU YH, MA YZ. Detection of virulence and drug resistance of Klebsiella pneumoniae in bovine respiratory diseases[J]. Chinese Journal of Veterinary Science, 2022, 42(9): 1810-1816. (in Chinese) 侯铭源, 林倩颖, 梁艳艳, 王星, 贾丽, 杨欣雨, 袁丽宁, 李连敏, 武英豪, 马玉忠. 牛呼吸道疾病克雷伯菌毒力及耐药性分析[J]. 中国兽医学报, 2022, 42(9): 1810-1816. |
| [27] |
ZUO W, WU Q, ZHANG Q, CHANG P, LU ZH, LOU YZ, BIAN B, LUO RB, SUO L, GONGGA. Study on isolation identification and biological characteristics of Klebsiella pneumoniae from Tibetan pigs[J]. Heilongjiang Animal Science and Veterinary Medicine, 2022(9): 72-79, 141. (in Chinese) 左伟, 武琦, 张千, 常攀, 卢姊豪, 娄永志, 边巴央拉, 罗润波, 索朗斯珠, 贡嘎. 藏猪源肺炎克雷伯菌的分离鉴定及生物学特性研究[J]. 黑龙江畜牧兽医, 2022(9): 72-79, 141. |
| [28] |
CHEN Q, CHENG YN, FENG QJ, GUO L, ZHANG SQ, TAN B, YI L, ZHAO Q, CHENG SP, SUN N. Isolation, identification and drug resistance analysis of Klebsiella pneumoniae from minks[J]. China Animal Husbandry & Veterinary Medicine, 2022, 49(2): 700-708. (in Chinese) 陈强, 程悦宁, 冯秋菊, 郭利, 张淑琴, 谭斌, 易立, 赵权, 程世鹏, 孙娜. 水貂肺炎克雷伯菌的分离鉴定及耐药性分析[J]. 中国畜牧兽医, 2022, 49(2): 700-708. |
| [29] |
WANG ZH, WU TZ, ZHAO YB, ZHANG XX, HAN ML, ZHONG FG, HU JJ, HUANG X. Isolation, identification and drug resistance analysis of Klebsiella pneumoniae in a large-scale dairy farm in Shihezi area[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(9): 3464-3472. (in Chinese) 王哲红, 吴桐忠, 赵玉宾, 张星星, 韩猛立, 钟发刚, 胡建军, 黄新. 石河子地区某规模化奶牛场肺炎克雷伯菌的分离鉴定及耐药性分析[J]. 中国畜牧兽医, 2021, 48(9): 3464-3472. |
| [30] |
FAN PC, SHI LQ, WEN SB, HUO XW, XUE JD, MA DH. Isolation, identification and virulence gene detection of Klebsiella pneumoniae from sheep[J]. Chinese Journal of Veterinary Science, 2021, 41(1): 96-101. (in Chinese) 范培超, 史量全, 温树波, 霍晓伟, 薛江东, 马德慧. 羊源肺炎克雷伯菌的分离鉴定及毒力基因检测[J]. 中国兽医学报, 2021, 41(1): 96-101. |
| [31] |
RANJBAR R, KELISHADROKHI AF, CHEHELGERDI M. Molecular characterization, serotypes and phenotypic and genotypic evaluation of antibiotic resistance of the Klebsiella pneumoniae strains isolated from different types of hospital-acquired infections[J]. Infection and Drug Resistance, 2019, 12: 603-611. |
 2024, Vol. 51
2024, Vol. 51