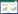扩展功能
文章信息
- 纪燕玲, 邹一萍, 王志伟
- JI Yanling, ZOU Yiping, WANG Zhiwei
- 禾本科植物Epichloë属内生真菌的宿主特异性研究及展望
- Advancements and prospects in host specificity of Epichloë endophytes
- 微生物学通报, 2024, 51(12): 4930-4948
- Microbiology China, 2024, 51(12): 4930-4948
- DOI: 10.13344/j.microbiol.china.240637
-
文章历史
- 收稿日期: 2024-07-31
- 接受日期: 2024-11-19
- 网络首发日期: 2024-12-03
植物体内普遍存在着多种多样的内生微生物,我们认为自然界的植物体其实就是植物学意义上的植物体和多样化内生菌的共生体[1]。植物内生真菌(endophytic fungi)与其宿主形成的共生系统,是生物间的共生关系在自然界中广泛存在的一类范例。在绝大多数情况下,内生真菌特指“在植物体内完成其生活史的部分或全部,但又不引起任何病症的微生物”[2]。20世纪70年代末,美国和新西兰分别报道了禾本科植物Epichloë属内生真菌产生具有生物活性的生物碱,对害虫、野生草食动物及食草家畜等有毒害作用[3],对宿主植物也具有明显的抗病、抗旱、促进生长和分蘖等作用[4]。宿主植物为Epichloë属内生真菌提供稳定的生活场所和营养,Epichloë属内生真菌为宿主植物带来抗生物侵害[5]、抗逆,以及促生长和分蘖等裨益,两者互利共生、协同进化。
着眼于与宿主植物之间的相互关系,内生真菌可分为广义内生真菌(endophyte senso-lato, ESL)和狭义内生真菌(endophyte senso-stricto, ESS)两类[6]。广义内生菌存在于各类植物的各种部位,甚至土壤、水等环境样品中;这类内生真菌种类繁多,很难与相应的土壤分离菌株区分开来;一些内生真菌会在植物生长发育过程中从土壤或水中感染进入植物,然后随着植物的营养器官的衰老脱落又回归土壤和水体;甚至包含一些潜在致病菌(latent infecting pathogens)或条件致病菌(opportunistic pathogens)。狭义内生菌与宿主植物之间存在严格的选择性,Epichloë属内生真菌是其典型的代表[7]。
在禾本科植物内生真菌中,一种Epichloë属内生真菌通常仅以一个或少数几个属的植物为宿主。宿主植物的单个植株中一般只含有一种Epichloë属内生真菌,但不同植株中可能存在不同的Epichloë属成员[7] (表 1)。模仿植物病理学中的宿主特异性(host specificity)概念,我们也称上述特征为Epichloë属内生真菌的宿主特异性[6]。禾本科植物内生真菌被关注已近50年,研究主要集中在资源探索、分类和进化研究、危害控制和有效利用[31-32]等方面,其他基础研究并不多。
| 内生真菌类群 Species |
宿主 Host |
原产地 Habitat |
中国境内分布 Distribution within China |
进化起源推测 Possible origin |
年份 Year |
|
| E. gansuensis | Achnatherum spp. | 中国甘肃 Gansu, China |
+ | 自然分布 Naturally distributed |
E. gansuensis | 2004[8] |
| E. yangzii | Roegneria kamoji | 中国几个省 Several provinces in China |
+ | 自然分布 Naturally distributed |
E. yangzii | 2006[9] |
| E. inebrians | Achnatherum inebrians | 中国新疆 Xinjiang, China |
+ | 自然分布 Naturally distributed |
E. inebrians | 2007[10] |
| E. sinica | Roegneria kamoji, R. ciliaris | 中国多个省 Several provinces in China |
+ | 自然分布 Naturally distributed |
EBY×ETC | 2009[11] |
| E. stromatolonga | Calamagrostis epigeios | 中国南京 Nanjing, China |
+ | 自然分布 Naturally distributed |
E. stromatolonga | 2009[12] |
| E. sinofestucae | Festuca parvigluma | 中国南京 Nanjing, China |
+ | 自然分布 Naturally distributed |
EBY×ETC | 2009[13] |
| E. sibirica | Achnatherum sibiricum | 中国内蒙古 Inner Mongolia, China |
+ | 自然分布 Naturally distributed |
E. gansuensis | 2009[14] |
| E. liyangensis | Poa pratensis ssp. pratensis | 中国溧阳 Liyang, China |
+ | 自然分布 Naturally distributed |
EBY×ETC | 2011[15] |
| Epichloë sp. | Bromus magnus | 中国 China |
+ | 自然分布 Naturally distributed |
EBY×ETC | 2013[16] |
| E. bromicola | Elymus dahuricus, Hordeum brevisubulatum, Leymus chinensis, Psathyrostachys lanuginosa | 中国多个省 Several provinces in China |
+ | 自然分布 Naturally distributed |
E. bromicola | 2016[17-18] |
| E. sinensis | F. sinensis | 中国青海、甘肃、四川 Qinghai, Gansu, and Sichuan in China |
+ | 自然分布 Naturally distributed |
E. poae× E. sibirica | 2020[19] |
| E. coenophiala | F. arundinaceum | 欧洲 Europe |
+ | 逃逸植株 Escape plants |
E. festucae× ETC×Lolium-associated clade | 1982[20] |
| E. festucae var. lolii | Lolium perenne | 新西兰,欧洲 New Zealand, Europe |
+ | 逃逸植株 Escape plants |
E. festucae | 1984[21] |
| E. uncinata | Festuca pratense | 欧洲 Europe |
+ | 逃逸植株 Escape plants |
E. bromicola× ETC | 1990[22] |
| E. sylvatica | Brachypodium sylvaticum | 欧洲 Europe |
+ | 自然分布 Naturally distributed |
E. sylvatica | 1998[23] |
| E. typhina | Festuca gigantean, F. glauca |
北美洲 North America |
+ | 逃逸植株 Escape plants |
E. typhina | 1992[24] |
| E. melicicola | Melica decumbens, M. racemosa |
南非 South Africa |
– | E. festucae× E. aotearoae | 2002[25] | |
| E. aotearoae | Echinopogon ovatus | 新西兰,澳大利亚 New Zealand, Australia |
– | E. aotearoae | 2002[25] | |
| E. australiense | Echinopogon ovatus | 澳大利亚 Australia |
– | E. festucae×ETC | 2002[25] | |
| E. elymi等12种(亚种) 12 (sub) species, like E. elymi |
Elymus virginicu | 北美洲 North America |
– | E. elymi | 2014[7] | |
| E. festucae等12种(亚种) 12 (sub) species, like E. festucae |
Festuca spp. | 欧洲 Europe |
– | E. festucae | 2014[7] | |
| E. pampeana等3种 3 species, like E. pampeana |
Bromus auleticus | 南美洲 South America |
– | E. typhina× E. festucae | 2014[7] | |
| E. alsodes | Poa alsodes | 美国 United States |
– | E. amarillans× E. typhina subsp. poae | 2017[26] | |
| E. schardlii var. pennsylvanica | Poa alsodes | 美国 United States |
– | E. typhina subsp. poae×E. typhina subsp. poae | 2017[26] | |
| E. hybrida | L. perenne | 法国 France |
– | E. festucae var. lolii×E. typhina | 2017[27] | |
| E. novae-zelandiae | Poa matthewsii | 新西兰 New Zealand |
– | E. amarillans× E. bromicola× E. typhina subsp. poae | 2019[28] | |
| E. calamagrostidis | Calamagrostis spp.等 | 瑞士,芬兰 Switzerland, Finland |
– | E. calamagrostidis | 2022[29] | |
| E. ftanensis | Calamagrostis arundinacea | 瑞士 Switzerland |
– | E. ftanensis | 2022[29] | |
| E. scottii | Melica uniflora | 德国 Germany |
– | E. scottii | 2022[30] | |
| 总计50个类群,包括属于不同大洲但被鉴定为同一个种的不同类群,所以选用“类群”而非“种”. +:中国有分布;–:国内尚无记载. ETC:E. typhina complex;EBY:E. bromicola/E. yangzii clade. “×”表示杂交 There are 50 taxa, including several taxa from different continents that have been identified as the same species. Therefore, “taxa” is used here instead of “species”. +: Distribute in China; –: No records within China. ×: Genetic cross. |
||||||
禾本科植物内生真菌的研究是1970年之后由欧美澳三地因生物碱导致的家畜中毒而联合兴起,至今主要以美欧中三地在推动内生真菌的资源调查、牧草及草坪草育种、生物碱毒理研究及药物研发等工作[7, 18]。目前,国内外共报道了80属280种以上的禾本科植物含有内生真菌(主要报道分布于北美大陆和欧洲),其中最主要的类群是Epichloë属[7]。2014年兼并了全部Neotyphodium属成员之后,Epichloë属真菌含有50个种(种群),全部是冷季型禾本科植物的宿主特异性内生真菌[7, 18],近年来增加了E. sinensis等种类(表 1)。少量暖季型禾本科植物中的内生真菌则属于枝顶孢霉(Acremonium)[33]、Epheris等属[34]。虽然一度被归入为Acremonium属的内冷季型禾本科植物生真菌在1997年被悉数移入Neotyphodium属[35],但是暖季型禾本科植物中的少数Acremonium属和Epichloë属内生真菌关系不明了,至今依然少见报道[33]。
1.2 与宿主植物之间存在严格的宿主特异性和稳定的种传性世界南北半球的温带至寒带区域内均存在冷季型禾本科植物,且不同程度地检测到了Epichloë属真菌。Epichloë属各成员与宿主植物营互利共生生活,某一种类的Epichloë仅生活在特定的宿主植物上,具有严格的宿主特异性(表 1)。它们通常存在于植物的地上部分,并经由种子较稳定地传代;一般与宿主植物和平共处,互为裨益;但有些种在植物抽穗期会在植物茎秆形成子座,完成有性生殖[7]。极个别的种偶尔能在叶表形成白色菌丝体,形成分生孢子进行水平传播。在种传性方面,除Epichloë typhina外,各个物种均确认到了比较稳定的种传特性。种传性在种子储存期相对稳定,但在高温高湿条件下,部分内生真菌或失去其生命力,导致宿主植物逐渐丢失内生真菌[36]。
1.3 Epichloë属真菌的其他特性现有研究结果显示,北美洲的Epichloë属真菌和欧洲、非洲的有一定相似性,与南美洲、大洋洲及亚洲的部分Epichloë属真菌有较大差别(表 1)。但是,在亚洲,除中国和日本外[37],Epichloë属真菌的报道很少。据我们的前期了解,东亚地区均存在大量的冷季型禾本科植物,俄罗斯远东地区、巴基斯坦和日本的冷季型禾本科植物中也存在内生真菌,其中日本产禾本科植物中存在Epichloë属真菌[38]。考虑到许多冷季型禾本科植物起源于中亚至东亚地区[39-40],我们推测亚洲依然存在大量的禾本科植物内生真菌资源尚未被探究。2004年以来,兰州大学[8, 10, 19]、南开大学[14]、南京农业大学[9, 11-13, 15]三个课题组发现9个新种。在被调查的至少21属77种植物中,除羊草[17]、新麦草[41]之外,宿主植物基本为待开发的野草[18],约占全球发现新种的30%[42],与其他各洲的菌株存在一定的差异(表 1)。
同工酶分析、tefA、tubB、actG以及微卫星等其他特定的基因序列的分析、AFLP分析、核型分析和全基因组大小[43]测定等证据表明,Epichloë属内生真菌存在丰富的遗传多样性。通过遗传多样性分析,特别是基于tefA、tubB片段序列的系统发育学分析,可以找出各个菌群之间的遗传关系[7]。至今,在禾本科植物内生真菌中,已被并入Epichloë属的大部分Neotyphodium属真菌被认为是由1–3个Epichloë属真菌之间的杂交而产生的失去有性繁殖能力的后代[7],少数能够进行有性生殖的Epichloë属也发现了杂交起源[7, 15] (表 1)。
现代科学认为,植物内生菌是微生物和植物在漫长的进化过程中形成的一种协作关系的产物。在国际范围内,植物的进化和分布有着明显的地域差异。因此,植物内生菌也可望同样具有较大的差异。广泛分布且极具经济价值的禾本科真菌新资源的发掘,也为从各种林木、药用植物中发现新的内生真菌带来启示[1],也带来了关于宿主特异性的诸多思考。宿主特异性意味着,宿主植物与真菌物种之间独特的一一对应,独特的真菌物种对应着独特的生物学特征、独特的化合物,以及在农业中独特的应用价值和科研中助力解析植物病害发生的特异性基础。因此,宿主特异性严格的内生真菌更值得关注。
2 宿主特异性是理解植物/微生物间关系的关键之一Epichloë属内生菌,起初是因部分种类阻碍苇状羊茅、多年生黑麦草、梯牧草等植物的植株抽穗(choke),导致牛、羊、马等家畜中毒(fescue toxicosis, ryegrass staggers, fescue foot等),被当作植物病原菌而记载和关注[1-2, 6];在后续的研究工作中,将其与其他植物病原菌进行生物学特性、分布等各个角度的对比——包括如何从宿主特异性的角度理解植物与微生物,尤其是植物与病原微生物之间的关系[44]。在此过程中,人们发现这类真菌虽然给特定的植物带来动物毒性和植物抽穗异常,但是也能给宿主植物带来促进生长和分蘖、提高抗病、抗昆虫、抗线虫、抗旱、抗寒、提高多年生草地的寿命等效果。特别是在对各种大动物(包括牛马羊等大型动物)和昆虫、线虫等小动物的毒性研究方面,麦角生物碱、lolitrems、lolines、波胺等多种生物碱被认为是主要毒性物质。进一步的研究发现,这些生物碱的生产与否、种类及产量,不仅和植物的生长条件有关,还和宿主植物与其内生真菌菌株的组合有密切关系[2]。因此,Epichloë属内生真菌的宿主特异性不仅和感染是否成立有关,也与共生体能够产生的生物碱类型等表型相关。
植物相关微生物的宿主特异性是关于微生物及其宿主植物之间特别的亲和关系(compatibility)的基本特点。在Epichloë属中,一个真菌类群(通常是种水平的类群,偶尔也有更高级别的类群)和一个或少量植物类群(通常是种或属)之间的比较严格的对应关系(表 1),和植物病理学领域中的宿主特异性极为相似。
在植物病理学研究中,从生理学和遗传学角度而言,病原菌只有在遇到特定的植物种类(species)或品种(variety)时,感染才有可能成立,病害才有可能发生——这就是植物病原微生物的宿主特异性。宿主特异性是决定植物抗病或感病的关键因素。事实上人们也通过测定某个病原菌对某个基因型的植物(species或variety)的致病性来了解这个菌的宿主特异性,然后根据植物的亲缘关系来进一步推测这个菌对其他植物的致病性,以此来评估某种植物病害发病区的种植风险,确定农业生产中哪些种类或品种需要回避,哪些可以种植。因此,宿主特异性在农业生产上十分重要,也是植物病理学研究的中心话题之一。
事实上,关于植物病原菌的宿主特异性的研究,反过来也直接关联到植物的抗性研究。1942年Flor发表的“基因对基因学说(gene for gene theory)”[45]所涉及的抗性反应(resistance reaction),植物对病原菌侵染行为的排斥性过敏反应(hypersensitive reaction, HR),实际上均与病原的宿主特异性有密切联系。病原菌的宿主特异性在很大程度上决定了植物的感染(infection)、病症(symptoms)的发生及进程。迄今为止,受人关注的植物抗病机制(mechanism of plant resistance)、植物信号传导机制(signal transduction within plant)、病原菌致病机理(mechanism of plant pathogenicity)、植物弹性机制(plant resilience)等基础研究,以及抗性育种(resistance breeding)、活体微生物农药(microbial pesticides)开发、农业生物安全(bio-safety in agriculture)等应用性研究,均回避不了对微生物宿主特异性的充分关注[46]。
在植物病理学基础研究方面,宿主特异性是病原菌感染寄主的基础,理解病原菌的宿主特异性是理解植物病害发生和发展的基础。而在植物内生真菌研究中,内生真菌的宿主有特异性也是内生真菌感染(infect)成立和稳定的共生体形成的基础,也是感染成立后形成的“植物/内生真菌共生体”的某些“生物学”性状的“遗传基础”。
1980年以来,全球多个研究团队都尝试Epichloë属内生真菌接种试验,试图扩大菌株的共生范围,创造一些新的共生体组合,但成功的案例极少。至今的少量成功案例基本局限于原始宿主植物-内生真菌的组合,即分离后的再接种[47-48]。新西兰Massey大学的Scott教授领导的团队利用黑麦草等植物及其E. festucae var. lolii、E. festucae等相关内生真菌菌株为材料,通过向幼苗生长点部位接种菌丝,人为地创制了自然界未存在的植物/Epichloë属内生真菌共生体组合,发现控制活性氧(reactive oxygen species, ROS)合成的noxA基因突变后,在“多年生黑麦草(L. perenne)/E. festucae”这一新组合中,E. festucae菌丝在宿主植物中分叉现象严重,植物成熟组织和分生组织中的真菌生物量增加、植物细胞弯曲的生物学变化;同时,植物丧失顶端优势,植株矮化甚至死亡。和“L. perenne/E. festucae var. lolii”这一自然界广泛存在的组合表现出显著的不同,noxA这个单基因突变可导致“L. perenne/E. festucae”这一组合的表型呈现出菌株的感染对宿主植物有害的明显特征。病理生化学研究结果显示,在菌丝和植物细胞的交界处没有ROS的积累[47]。在植物病害的感染生理学研究中,细胞从外向内迅速大量积累过氧化物,ROS被认为是早期响应病原菌的信号分子[49]。因此,H2O2等过氧化物可以被认为直接参与植物病原菌和植物内生菌共生的早期基础反应[47, 50]。
由此可见,宿主植物和Epichloë属内生真菌的基因型对接种试验有着很大的影响。类似的情况在植物病理学中也很常见。Flor根据亚麻受其锈病真菌感染的规律[45],提出了有名的基因对基因学说。我们认为在后来的植物病理学研究中,影响到真菌的“f. sp.” “var.”和“subsp.”,以及细菌的“pv.”和“race”等概念的建立。在宿主特异性严格的植物病害中,作物品种的基因型和病原菌的基因型对病害的发生和发展起着很大的作用[51]。与常见的纯系(pure line)品种(自花授粉的作物品种)不同,牧草和草坪的草种多为异花授粉,新品种培育主要用群体育种法(population breeding)。因此,异花授粉植物的品种各个体基因型的均匀度低,遗传多样性相对丰富,对微生物的反应也会较为多样化。这可能是Epichloë属内生真菌接种难度较大、接种后的生物学反应比较复杂的遗传学背景。同时,这可能也是将纯系品种及其病原物的研究成果(Arabidopsis thaliana/Pseudomonas syringae pv. tomato、Rice/Magnaporthe grisea、Potato/Phytophthpra infestans等)应用于综合品种(synthetic cultivar)时需要特别注意的问题[46]。
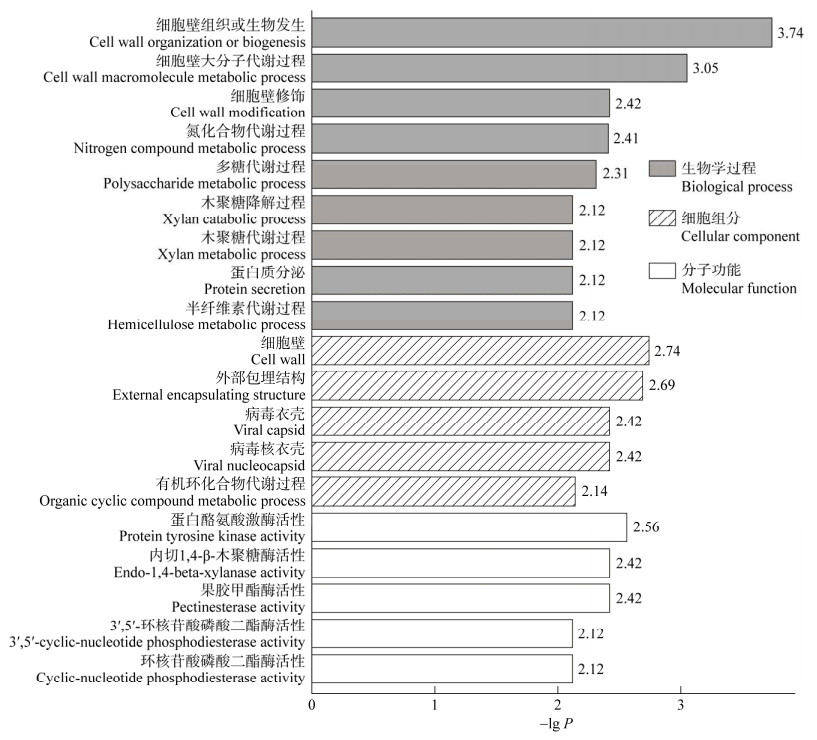
在组织学层面,植物内生真菌、植物菌根真菌和植物病原真菌的表现也有很大的差异。来自各种研究方法的信息显示,植物体内存在多种多样的真菌,有些是病原菌(pathogens),有些是条件致病菌,更多的则是对宿主植物没有明显作用的真菌(因此被称为“内生真菌”,即本文中的广义内生菌ESL),根部还有植物菌根菌。这些真菌在入侵植物体内之后,在组织学水平上呈现出完全不同的反应(图 1)。
|
| 图 1 植物体内的Epichloë属内生真菌的菌丝体(A)[11, 13]与植物菌根真菌(B)[52]及植物病原真菌(C)[53]的侵染模式比较 Figure 1 Comparison of the infection patterns of Epichloë endophytes (A)[11, 13], mycorrhizal fungi (B)[52] and plant pathogenic fungi (C)[53] within their host plants. A: Epichloë endophytes grow in the intercellular spaces of plants without penetrating into cells, and no cell necrosis was observed. B: Mycorrhizal fungi mainly grow in the intercellular spaces of plants, orderly invade plant cells, but do not cause cell necrosis. C: Pathogen grow vigorously and disorderly, invade plant cells frequently, resulting in extensive cell necrosis, ultimately leading to visible symptoms. A:植物内生真菌菌丝体在植物细胞间隙生长,未入侵植物细胞,未见植物细胞坏死;B:植物菌根真菌菌丝体在植物细胞间隙生长,有序入侵植物细胞,但不致植物细胞坏死;C:植物病原真菌菌丝体无序生长,频繁入侵植物细胞,导致植物细胞大量坏死,形成肉眼可见的病症 |
|
|
无论是在植物种子中还是植物营养组织中,Epichloë属内生真菌通常不穿透宿主植物的细胞或细胞层,不入侵到植物细胞内,更不引起植物细胞坏死和植物组织的异常[11, 13],也不在植物体外形成菌物组织(图 1A);只有在植物体表形成子座,试图进行有性生殖时,才会穿透植物细胞层,并在植物体表形成菌物组织[54]。植物菌根菌在植物体表附着,入侵少量细胞,形成丛枝或囊泡吸取营养,主要在植物细胞间隙延伸,扩大生态位[52]。同时将营养输送到菌丝体的体外部分,供应菌根菌在土壤中大量生长,帮助宿主植物获得水分和营养,并参与信息传递(图 1B)。植物病原菌在植物体表形成附着胞或其他结构,凭借机械力和化学作用入侵植物细胞,汲取营养,常常分泌毒素或者细胞壁分解酶,引起肉眼可见的植物组织异常(图 1C),并最终导致病症[53]。
植物菌根真菌虽然少量地入侵植物细胞,穿透细胞层,但一般不引起植物细胞坏死、导致肉眼可见的症状。菌根菌不仅不危害宿主植物的生长,还可通过留在土壤中的菌丝体给植物细胞提供水分、营养,与植物细胞之间形成互利关系。可见菌根真菌和宿主植物之间有着特定的信息交流机制,将植物细胞和菌丝体之间的关系控制在互利共生的状态[52, 55]。在和植物的相互作用方面,菌根真菌可以看成介于禾本科植物内生真菌和植物病原真菌之间的作用方式。由此,我们认为,病原菌/寄主植物的组合及共生菌/宿主植物的组合,两者宿主特异性的分子机制有一定的共通之处。就某一基因型的宿主植物而言,比较其内生真菌、菌根真菌和病原真菌之间的植物应答基因之间的差异,对研究植物和上述真菌之间的互作等机制,特别是宿主特异性的表达及其机制,将会有一定的促进作用。
截至目前,研究表明菌根真菌的宿主特异性最宽松,Epichloë属内生真菌次之(表 1),而植物病原真菌的宿主特异性则变化较大。丝核菌、镰刀菌等危害植物根部的病原真菌的宿主特异性一般偏宽松,而危害植物叶片的则往往非常严格[56-58]。但是,研究Epichloë属内生真菌和植物之间的互利共生关系,对研究植物菌根真菌、植物病原真菌与其宿主植物间的关系会有一定的互通和借鉴。Tanaka等[47]关于noxA基因的研究就是一个很好的例子。我们认为,类似的机制在今后的研究中还会出现。
在植物内生真菌研究中,只有在具有特定的遗传特性的组合之间,宿主特异性才能成立,共生体的纯度和稳定性才会有保障和维持。具有宿主特异性的植物内生真菌有可能赋予宿主植物稳定的性状,并有可能在农业、环保等各个领域得到应用[48, 59]。因此,研究内生真菌的宿主特异性不仅有助于宿主植物农业性状的稳定改良,而且对理解微生物-植物关系(甚至是对部分植物病害的理解及控制)也有一定的作用。
3 禾本科植物内生真菌的宿主特异性严格的宿主特异性是Epichloë属内生真菌的典型特征,也是它区别于其他内生真菌的一个很明显的特点,主要表现为:(1) 除了E. typhina (异质性较高),Epichloë属其他各物种与宿主分布息息相关,一类真菌对应特定的宿主植物,两者协同进化;(2) 宿主特异性受到宿主和真菌双方基因型的控制;(3) 宿主特异性关系到人工接种Epichloë属内生真菌的成败。此外,宿主特异性还与多种环境因素相关,例如(宿主植物)地理分布、海拔[60]。在内生真菌的分类中,(宿主植物)地理分布已然成为一项重要的标记,用于区分不同的类群[7, 29]。
3.1 协同进化截至目前,研究表明Epichloë属内生真菌的宿主植物均属禾本科。除E. typhina能感染比较多的宿主植物以外,其他种的宿主植物都有严格限制;其中少数种能感染2–3属宿主植物,绝大部分只能在1属宿主植物中发现,甚至有些种(如E. uncinata)仅感染某一属中的一种或几种(表 1)。
Epichloë属内生真菌和宿主长期协同进化,密不可分(图 2)。例如,姐妹族剪股颖族(Agrostideae)和早熟禾族(Poeae),大多与它们的内生菌类群相对应。在早熟禾族内部,L. multiflorum、L. arundinaceum、Lolium sp. P4074和P4078与LAE-clade中的内生真菌镜像排列[61] (图 2)。在漫长的进化历程中,影响内生真菌与宿主植物协同进化的因素很多。内生真菌可能更倾向于寻找一个与原宿主分类地位相近的植物作为新的栖身之所。
宿主特异性可以理解为植物对进入其体内的微生物是有选择的,这种选择及其机理历来是植物病理学研究的中心话题。从信号传导的角度看,宿主和微生物之间的相互识别过程对决定植物是否容纳这个微生物十分重要。
从宿主的基因型而言,能否接纳内生真菌并保持内生真菌的种传性在育种和生产中尤为关键。选取5个种群的500个基因型的多年生黑麦草种子,调查内生真菌E. festucae var. lolii商品菌株AR37的种传特性;发现多年生黑麦草的基因型、环境因素(种子的存储时间、地理来源)都显著地影响到AR37在子代植株中被检出的频率及单核苷酸多态性(single nucleotide polymorphisms, SNP)[62]。约70%的苇状羊茅种子含有内生真菌;将23个菌株接种到苇状羊茅中,发现接种成功率与其后代的种传性之间的关系难以预测[63]。
就内生真菌的基因型而言,识别的过程表现为植物防御反应的缺失、真菌在植物体内高度特化和规律的生长模式。宿主防御反应的缺失,可能是由于宿主无法感知任何表明内生菌存在的信号,例如完全缺乏激发子(可以触发植物防御的分子反应),或通过积极的保护机制向自身防御系统掩盖真菌的存在。也有人推测,内生菌可能会像植物病原菌那样,直接将效应因子分泌到质外体或者宿主细胞内,从而主动抑制宿主的防御反应。Scott研究小组揭示了ROS及MAPK的重要作用[47, 50]。菌丝体内部活性氧产生量的降低直接导致菌丝体的生长方式的变化和对宿主植物的危害,即从没有明显危害的内生真菌转变为明显对宿主植物生长不利的真菌[47]。
3.3 突破宿主特异性——内生真菌的人工接种纵然内生真菌能够为禾本科牧草带来抗寒、抗旱等诸多的益处,能够降低牧民的生产成本,但其中一些内生真菌所产生的生物碱对野生草食动物及食草家畜等有毒害作用,带来严重的经济损失[3]。除了将禾本科植物牧草与豆科牧草混播,以稀释毒性之外,研究人员试图从自然界筛选生物碱毒性低的内生真菌菌株,并将其人工接种到商品牧草品种中,期望获得产量高而毒性低的内生真菌——牧草组合[64]。
然而人工接种的实践举步维艰。由于禾本科植物内生真菌的宿主特异性,以及人工接种过程对操作的高要求,同时还需破坏植物组织而导致宿主死亡率高,导致人工接种的成功率较低[64]。试图将Epichloë属和与其自然宿主关系不密切的草之间进行人工接种,例如将鸭茅和多年生黑麦草的分离菌株交叉接种,通常是不成功的[65]。即便向近缘宿主接种,也通常是不稳定的[66];并可能引起宿主的防御反应,例如向7日龄的多年生黑麦草幼苗接种E. festucae Fl1菌株的野生型及ΔvelA突变株,接种4 d后野生型菌株的接种苗出现细胞死亡(图 3)[67]。一些新组合产生了不亲和反应,如早熟菌丝死亡,宿主茎尖细胞死亡,存活分蘖发育迟缓——内生真菌菌株表现出明显的宿主特异性。
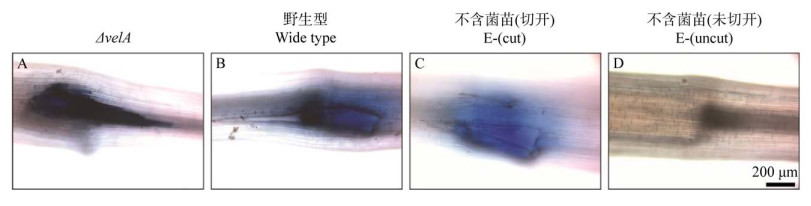
|
| 图 3 用E. festucae野生型和ΔvelA突变株接种7日龄幼苗 Figure 3 Cell death detection in the meristematic region of 7-d-old seedlings inoculated with wild type and ΔvelA mutant strains of E. festucae. Endophyte-free cut and uncut seedlings inoculated with agar block as a control; 4 DPI stained with lactophenol-Trypan Blue solution. Dead cells appear dark blue[67]. 琼脂块接种E-(不含菌)苗、未切开E-苗作为对照;检测分生组织区细胞死亡;4 DPI用乳酸酚-台盼蓝溶液染色. 死亡细胞呈深蓝色[67] |
|
|
目前已经有少数接种成功的案例。新西兰PGG Wrightson Seeds公司将来源于多年生黑麦草的商品菌株AR37接种到多花黑麦草(L. multiflorum)中,注册了2个品种,分别是二倍体的Asset-AR37和四倍体的Lush-AR37 (https://www.ar37endophyte.com/products/nz-products)。兰州大学李春杰等[68]将野大麦(Hordeum brevisubulatum)中的内生真菌(E. bromicola)人工接种至近缘的栽培大麦(H. vulgare)的2个品种,创制出了野大麦内生真菌E. bromicola-大麦新种质。
这些成功的案例,也从另外一个角度成为突破和应用宿主特异性的素材。
3.4 基因水平转移在内生真菌与其宿主植物长期共生生活、共同进化中,自然发生了基因水平转移,真菌向宿主植物转移有益基因的工作零星发表,包括β-1, 6-葡聚糖酶基因等[69]。最受关注的例证是,2020年山东农业大学的工作,提示了从Epichloë属内生真菌向偃麦草属植物转移Fhb7 (小麦赤霉病抗性)基因的可能性[70]。虽然关于Fhb7基因的功能研究有争议[71-72],但是,从序列特征来看,从真菌到植物的基因水平转移是毋庸置疑的。
4 多组学研究时代的禾本科植物Epichloë属内生真菌宿主特异性研究及展望信息技术的发展,助力系统生物学研究进入高通量、定量化的高速发展时代。基因组学(genomics)是蓝本,其研究“What could occur”;转录组学(transcriptomics)研究“What may occur”;蛋白组学(proteomics)研究“What is occurring”;代谢组学(metabolomics)和表型组学(phenomics)研究“What has occurred” [73]。多组学(multi-omics)研究是对多个组学数据进行整合分析。
截至2024年6月初,我们汇总Epichloë属内生真菌基因组的相关研究:(1) 引领Epichloë属真菌测序工作的美国Kentucky大学Schardl教授管理的http://csbio-l.csr.uky.edu/endophyte/中收录了20个以欧美原产菌株为主的Epichloë真菌菌株的基因组数据。(2) 在NCBI数据库(https://www.ncbi.nlm.nih.gov/assembly/?term=Epichloë)中收录的41个菌株记录中,中国本土菌株仅有E. gansuensis E7080、E. inebrians E818、E. bromicola E7626和E. sibirica T71这4个;41个菌株中组装到染色体水平的菌株仅为14个,不足一半。我们估计,随着组学研究水平的提高,越来越多的Epichloë属成员基因组将被测序或解析。
基因组数据助力研究人员进行进化起源探索、品种改良、遗传资源保护等等。例如,2013年发表对11个Epichloë属菌株基因组中4类生物碱合成基因簇的调查,发现合成基因簇多数有特定的结构和重复片段,并期望挖掘更多的生物碱合成基因[74]。2021年,Treindl等[43]组装了E. typhina和E. clarkii染色体水平的基因组,由AT-rich区域分隔出的富含基因的区域块分辨近缘物种。该研究揭示了重复结构的快速进化如何驱动密切相关分类群之间的分化,从基因组结构的基础上理解Epichloë真菌基因组的大小。2022年报道了用前期序列重新组装从端粒到端粒的15个菌株基因组,发现Epichloë成员染色体基数为7,且菌株之间存在着复杂的基因重排[75]。比较基因组分析Hypocreales泛基因组,也用于解析植物内生真菌、虫生真菌等不同类群真菌的生态学特征[44]。此外,Epichloë真菌的基因组结构也提供了关于基因组演化、组织和大小的信息。这些研究为进一步理解Epichloë真菌宿主特异性提供了重要的蓝图背景。
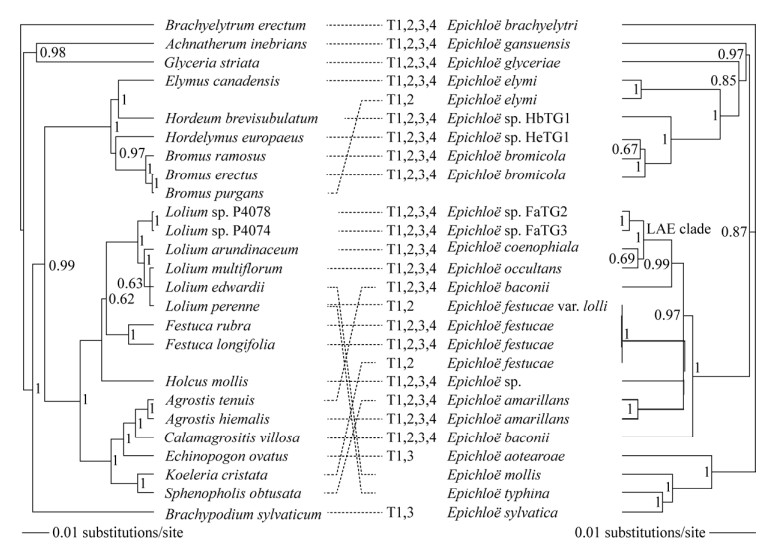
从基因组层面,瑞士的Leuchtmann教授团队对宿主特异性的分子机制展开了一系列研究。(1) 通过比较基因组学揭示了Epichloë真菌不同种群之间的宿主特异性区别[76]。2018年,Schirrmann等[76]将2个宿主植物不同但能够人工杂交的亚种E. typhina subsp. typhina (宿主特异性不明显)和E. typhina subsp. clarkii (宿主特异性很明显)进行比较,勾选出57个候选基因,挑选5个编码分泌蛋白的基因进行多菌株检测。我们认为,E. typhina subsp. typhina本身是多样性特别丰富、异质性很强的类群,该亚种下面包括来源于很多宿主的不同菌株。文章选出的57个候选基因中,还需要继续明确真正宿主特异性的关键基因(图 4,http://www.bioinformatics.com.cn/plot_basic_horizontal_bar_062);目前未检索到后续验证这些候选基因的研究。(2) 发现宿主特异性与真菌的遗传多样性和种群结构相关。例如,Treindl等[77]2023年对E. typhina和E. clarkii遗传多样性和种群结构进行了分析,发现不同宿主植物中的Epichloë属真菌种群存在显著的遗传差异。E. typhina异质性高且存在着较多的基因流动,揭示了Epichloë真菌在自然生态系统中的遗传多样性和种群结构。这进一步支持了宿主特异性与真菌的选择和适应能力相关。(3) 发现宿主特异性与真菌的选择性标记有关。2024年,通过比较7个自然生境中共存的E. typhina和E. clarkii基因组中的SNP标记,发现选择性清除(selective sweeps)在较大的种群中更为频繁;基因组中的sweep区域经常与AT-rich区域重叠,说明这些区域在发生着适应性进化;各种群间共同的sweep区域基因编码具有真菌效应子和细胞壁降解酶特征的小分泌蛋白;通过对比不同物种和不同种群基因组之间的选择性标记,有助于揭示真菌(病原物)与植物之间的相互识别-宿主特异性[78]。
从基因组角度研究Epichloë属真菌的宿主特异性揭示了基因组水平的变化与宿主特异性之间的关联。基因组水平的差异可能导致Epichloë真菌的不同物种和种群之间的宿主特异性。基因组水平的研究为我们深入理解Epichloë真菌与草类植物共生的分子机制和进化历程提供了重要线索。进一步的研究可以从基因组结构和选择的角度深入探究Epichloë真菌宿主特异性的机制。
随后,关于内生真菌的转录组等工作相继展开。其中,多数研究有助于理解宿主特异性,着重分析内生真菌与宿主的共生关系:主要涉及细胞壁相关基因,胁迫与防御反应等。其中,细胞壁作为内生真菌与植物直接发生接触的相面(interfaces),参与各种识别过程(表 2)。
| 植物 Plant |
真菌 Fungi |
简述 Description |
文献 Reference |
| L. perenne | Epichloë sp. LpTG-3 | 种传效率,受到真菌的细胞壁相关基因、植物的类受体激酶、抗性基因等影响 The transmission efficiency is effected by fungal cell wall-related genes, plant receptor-like kinases, resistance genes, etc. |
[79] |
| L. perenne | Epichloë sp. LpTG-1, LpTG-2, LpTG-3 | 在植物发芽阶段,真菌差异表达基因多为应对胁迫与防御反应 During the germination stage, fungal differentially expressed genes (DEGs) are mainly involved in stress response and defense |
[80] |
| F. rubra subsp. rubra | E. festucae | 在植物花期,真菌形成子座,差异表达基因为糖类、脂类代谢相关及效应因子蛋白相关 During the inflorence stage, fungi form stromata, and DEGs are related to sugar, lipid metabolism, and effector protein |
[81] |
| L. arundinaceum | E. coenophiala | 比较植物营养生长、繁殖阶段,真菌差异表达基因为生物碱合成,糖、蛋白转移,分子伴侣等 Comparing with vegetative and reproduction stage, fungal DEGs are involved in alkaloid synthesis, sugar, protein transfer, molecular chaperones, etc. |
[82] |
| Elymus virginicus Schedonorus pratensis L. perenne |
E. elymi E. festucae E. typhina |
鉴定内生真菌在植物体内从无性到有性转换过程中的差异表达基因,包括宿主抑制,消化,适应外部环境,生物合成,各类转录因子 During the transition from asexual to sexual reproduction in plants, fungal DEGs includes host inhibition, digestion, adaptation to external environment, biosynthesis, and various transcription factors |
[83] |
这些研究表明,以禾本科植物内生真菌为材料的植物/微生物关系的研究已经进入了多组学时代。但是,迄今的这些组学研究中,对内生真菌的进化及宿主特异性,缺少足够的重视。
另一方面,目前所能做的人工接种只能在少数有天然组合的宿主/内生真菌菌株之间进行,至今国内新的组合的创制仅有个别成功案例[68]。即使是天然组合的宿主/内生真菌菌株之间的人工接种,接种过程比较烦琐,成功率也普遍比较低[48, 59]。禾本科植物内生真菌新的接种技术的开发,将对其宿主特异性研究有重要的促进作用。
进入21世纪以来,我国已经先后发表了大量中国原产的Epichloë属内生真菌资源,其中大部分为我国特有的新种(表 1),极大地丰富了我国的Epichloë属内生真菌研究的材料。利用这些材料,结合菌根真菌、病原真菌等类群的宿主特异性的相关研究,特别是我国科学家团队出色的菌根菌相关研究(图 2),以及新西兰/日本研究团队提出的noxA案例,以及近年来日新月异的组学研究技术,期待Epichloë属内生真菌的宿主特异性研究在不远的将来实现大的突破。这将有助于植物病原真菌的宿主特异性研究,以及抗性育种、活体微生物农药开发、农业生物安全评估等农业上至关重要的领域的进步和发展。
| [1] |
WANG ZW, JI YL, CHEN YG. Studies and biological significances of plant endophytes[J]. Microbiology China, 2015, 42(2): 349-363. (in Chinese) 王志伟, 纪燕玲, 陈永敢. 植物内生菌研究及其科学意义[J]. 微生物学通报, 2015, 42(2): 349-363. DOI:10.13344/j.microbiol.china.130815 |
| [2] |
SCHARDL CL, SCOTT B, FLOREA S, ZHANG DX. Epichloë endophytes: clavicipitaceous symbionts of grasses[M]//The Mycota. Berlin, Heidelberg: Springer Berlin Heidelberg, 2009: 276-306.
|
| [3] |
HOVELAND CS. Importance and economic significance of the Acremonium endophytes to performance of animals and grass plant[J]. Agriculture, Ecosystems & Environment, 1993, 44(1/2/3/4): 3-12. |
| [4] |
NAGABHYRU P, DINKINS RD, SCHARDL CL. Transcriptome analysis of Epichloë strains in tall fescue in response to drought stress[J]. Mycologia, 2022, 114(4): 697-712. DOI:10.1080/00275514.2022.2060008 |
| [5] |
XIA C, LI NN, ZHANG YW, LI CJ, ZHANG XX, NAN ZB. Role of Epichloë endophytes in defense responses of cool-season grasses to pathogens: a review[J]. Plant Disease, 2018, 102(11): 2061-2073. DOI:10.1094/PDIS-05-18-0762-FE |
| [6] |
WANG ZW, JI YL, CHEN YG. Grass endophytes and their potential applications in agriculture[J]. Journal of Nanjing Agricultural University, 2011, 34(5): 144-154. (in Chinese) 王志伟, 纪燕玲, 陈永敢. 禾本科植物内生真菌及其在农业上的应用潜力[J]. 南京农业大学学报, 2011, 34(5): 144-154. |
| [7] |
LEUCHTMANN A, BACON CW, SCHARDL CL, WHITE JR JF, TADYCH M. Nomenclatural realignment of Neotyphodium species with genus Epichloë[J]. Mycologia, 2014, 106(2): 202-215. DOI:10.3852/13-251 |
| [8] |
LI CJ, NAN ZB, PAUL VH, DAPPRICH PD, LIU Y. A new Neotyphodium species symbiotic with drunken horse grass (Achnatherum inebrians) in China[J]. Mycotaxon, 2004, 90(1): 141-147. |
| [9] |
LI W, JI YL, YU HS, WANG ZW. A new species of Epichloë symbiotic with Chinese grasses[J]. Mycologia, 2006, 98(4): 560-570. |
| [10] |
MOON CD, GUILLAUMIN JJ, RAVEL C, LI CJ, CRAVEN KD, SCHARDL CL. New Neotyphodium endophyte species from the grass tribes Stipeae and Meliceae[J]. Mycologia, 2007, 99(6): 895-905. DOI:10.1080/15572536.2007.11832521 |
| [11] |
KANG Y, JI YL, SUN XH, ZHAN LH, LI W, YU HS, WANG ZW. Taxonomy of Neotyphodium endophytes of Chinese native Roegneria plants[J]. Mycologia, 2009, 101(2): 211-219. DOI:10.3852/08-018 |
| [12] |
JI YL, ZHAN LH, KANG Y, SUN XH, YU HS, WANG ZW. A new stromata-producing Neotyphodium species symbiotic with clonal grass Calamagrostis epigeios (L.) Roth. grown in China[J]. Mycologia, 2009, 101(2): 200-205. DOI:10.3852/08-044 |
| [13] |
CHEN YG, JI YL, YU HS, WANG ZW. A new Neotyphodium species from Festuca parvigluma Steud. grown in China[J]. Mycologia, 2009, 101(5): 681-685. DOI:10.3852/08-181 |
| [14] |
ZHANG X, REN AZ, WEI YK, LIN F, LI C, LIU ZJ, GAO YB. Taxonomy, diversity and origins of symbiotic endophytes of Achnatherum sibiricum in the Inner Mongolia Steppe of China[J]. FEMS Microbiology Letters, 2009, 301(1): 12-20. DOI:10.1111/j.1574-6968.2009.01789.x |
| [15] |
KANG Y, JI YL, ZHU KR, WANG H, MIAO HM, WANG ZW. A new Epichloë species with interspecific hybrid origins from Poa pratensis ssp. pratensis in Liyang, China[J]. Mycologia, 2011, 103(6): 1341-1350. DOI:10.3852/10-352 |
| [16] |
ZHANG HX, JI YL, XING ZQ, WANG ZW. Grass endophyte researches 17: biological properties of Bromus magnus-epichloid endophyte symbiosis grown in Huangshan[J]. Journal of Nanjing Agricultural University, 2013, 36(5): 59-64. (in Chinese) 张红侠, 纪燕玲, 邢转青, 王志伟. 禾本科植物内生真菌研究17: 黄山大雀麦-内生真菌新共生体的生物学特征[J]. 南京农业大学学报, 2013, 36(5): 59-64. |
| [17] |
ZHU MJ, REN AZ, WEN W, GAO YB. Diversity and taxonomy of endophytes from Leymus chinensis in the Inner Mongolia steppe of China[J]. FEMS Microbiology Letters, 2013, 340(2): 135-145. DOI:10.1111/1574-6968.12083 |
| [18] |
SONG H, NAN ZB, SONG QY, XIA C, LI XZ, YAO X, XU WB, KUANG Y, TIAN P, ZHANG QP. Advances in research on Epichloë endophytes in Chinese native grasses[J]. Frontiers in Microbiology, 2016, 7: 1399. |
| [19] |
TIAN P, XU WB, LI CJ, SONG H, WANG MN, SCHARDL CL, NAN ZB. Phylogenetic relationship and taxonomy of a hybrid Epichloë species symbiotic with Festuca sinensis[J]. Mycological Progress, 2020, 19: 1069-1081. DOI:10.1007/s11557-020-01618-z |
| [20] |
MORGAN-JONES G, GAMS W. Notes on Hyphomycetes. XLI. An endophyte of Festuca arundinacea and the anamorph of Epichloë typhina, new taxa in one of two new sections of Acremonium[J]. Mycotaxon, 1982, 15(2/3): 113-117. |
| [21] |
LATCH GCM, CHRISTENSEN MJ, SAMUELS GJ. Five endophytes of Lolium and Festuca in New Zealand[J]. Mycotaxon, 1984, 20(2): 535-550. |
| [22] |
GAMS W, PETRINI O, SCHMIDT D. Acremonium uncinatum, a new endophyte in Festuca pratensis[J]. Mycotaxon, 1990, 37: 67-71. |
| [23] |
LEUCHTMANN A, SCHARDL CL. Mating compatibility and phylogenetic relationships among two new species of Epichloë and other congeneric European species[J]. Mycological Research, 1998, 102: 1169-1182. DOI:10.1017/S0953756298006236 |
| [24] |
WHITE JR JF. Endophyte-host associations in grasses. XVII. Ecological and physiological features characterizing Epichloë typhina and some anamorphic varieties in England[J]. Mycologia, 1992, 84(3): 431-441. DOI:10.1080/00275514.1992.12026157 |
| [25] |
MOON CD, MILES CO, JÄRLFORS U, SCHARDL CL. The evolutionary origins of three new Neotyphodium endophyte species from grasses indigenous to the Southern Hemisphere[J]. Mycologia, 2002, 94(4): 694-711. DOI:10.1080/15572536.2003.11833197 |
| [26] |
SHYMANOVICH T, CHARLTON ND, MUSSO AM, SCHEERER J, CECH NB, FAETH SH, YOUNG CA. Interspecific and intraspecific hybrid Epichloë species symbiotic with the North American native grass Poa alsodes[J]. Mycologia, 2017, 109(3): 459-474. DOI:10.1080/00275514.2017.1340779 |
| [27] |
CAMPBELL MA, TAPPER BA, SIMPSON WR, JOHNSON RD, MACE W, RAM A, LUKITO Y, DUPONT PY, JOHNSON LJ, SCOTT DB, GANLEY ARD, COX MP. Epichloë hybrida sp. nov., an emerging model system for investigating fungal allopolyploidy[J]. Mycologia, 2017, 109(5): 715-729. |
| [28] |
LEUCHTMANN A, YOUNG CA, STEWART AV, SIMPSON WR, HUME DE, SCOTT B. Epichloë novae-zelandiae, a new endophyte from the endemic New Zealand grass Poa matthewsii[J]. New Zealand Journal of Botany, 2019, 57(4): 271-288. DOI:10.1080/0028825X.2019.1651344 |
| [29] |
LEUCHTMANN A, SCHARDL CL. Genetic diversity of Epichloë endophytes associated with Brachypodium and Calamagrostis host grass genera including two new species[J]. Journal of Fungi, 2022, 8(10): 1086. DOI:10.3390/jof8101086 |
| [30] |
THUNEN T, BECKER Y, COX MP, ASHRAFI S. Epichloë scottii sp. nov., a new endophyte isolated from Melica uniflora is the missing ancestor of Epichloë disjuncta[J]. IMA Fungus, 2022, 13(1): 2. DOI:10.1186/s43008-022-00088-0 |
| [31] |
BERRY D, MACE WD, GRAGE K, WESCHE F, GORE S, SCHARDL CL, YOUNG CA, DIJKWEL PP, LEUCHTMANN A, BODE HB, SCOTT B. Efficient nonenzymatic cyclization and domain shuffling drive pyrrolopyrazine diversity from truncated variants of a fungal NRPS[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(51): 25614-25623. |
| [32] |
POPAY AJ, JENSEN JG, SIMPSON WR, MACE WJ, SOMCHIT C. Translocation of loline alkaloids in Epichloë-infected cereal and pasture grasses: what the insects tell us[J]. Journal of Fungi, 2023, 9(1): 96. DOI:10.3390/jof9010096 |
| [33] |
HUANG DY, KELEMU S. Acremonium implicatum, a seed-transmitted endophytic fungus in Brachiaria grasses[J]. Plant Disease, 2004, 88(11): 1252-1254. DOI:10.1094/PDIS.2004.88.11.1252 |
| [34] |
ROBERTS EL, WHITE JR JF. Black choke disease caused by an Ephelis sp. on purple fountain grass in Maryland[J]. Plant Disease, 2006, 90(1): 112. |
| [35] |
GLENN AE, BACON CW, PRICE R, HANLIN RT. Molecular phylogeny of Acremonium and its taxonomic implications[J]. Mycologia, 1996, 88(3): 369. DOI:10.1080/00275514.1996.12026664 |
| [36] |
LI CJ, LANG MX, CHEN ZJ, CHEN TX, LIU J, JIN YY, WEI XK. Effects of Epichloë endophytic fungi on the germination of grass seeds[J]. Acta Prataculturae Sinica, 2022, 31(3): 192-206. (in Chinese) 李春杰, 郎鸣晓, 陈振江, 陈泰祥, 刘静, 金媛媛, 魏学凯. Epichloë内生真菌对禾草种子萌发影响研究进展[J]. 草业学报, 2022, 31(3): 192-206. |
| [37] |
WANG ZW, YOSHIDA S, SHIMANUKI T, TAJIMI A. Japanese grass endophyte researches 2, endophytic fungi was observed within Agropyron spp.[J]. Annuals of Japan Turf Science, 1997, 43(Suppl.): 150. |
| [38] |
MIWA E, OKANE I, ISHIGA Y, SUGAWARA K, YAMAOKA Y. Confirmation of taxonomic status of an Epichloë species on Brachypodium sylvaticum in Japan[J]. Mycoscience, 2017, 58(3): 147-153. |
| [39] |
CAI LB. Geographical distribution of Roegneria C. Koch (Poaceae)[J]. Acta Botanica Boreali-occidentalia Sinica, 2002, 22(4): 189-199. (in Chinese) 蔡联炳. 鹅观草属的地理分布[J]. 西北植物学报, 2002, 22(4): 189-199. |
| [40] |
LIU L. Flora Reipublicae Popularis Sinicae[M]. Beijing: Science Press, 2002.
|
| [41] |
Discovery of Epichloë as novel endophytes of Psathyrostachys lanuginosa in China and their alkaloid profiling[J]. Frontiers in Microbiology, 2024, 15: 1383923. |
| [42] |
Advances in the taxonomy of the genus Epichloё endophytic fungi in grasses[J]. Acta Agrestia Sinica, 2023, 31(12): 3575-3586. (in Chinese) 杜明祥, 王添, 李春杰, 陈泰祥. 禾草Epichloё属内生真菌分类学研究进展[J]. 草地学报, 2023, 31(12): 3575-3586. |
| [43] |
Chromosome-level genomes provide insights into genome evolution, organization and size in Epichloe fungi[J]. Genomics, 2021, 113(6): 4267-4275. |
| [44] |
Comparative genomics reveals a core gene toolbox for lifestyle transitions in Hypocreales fungi[J]. Environmental Microbiology, 2021, 23(6): 3251-3264. |
| [45] |
Inheritance of pathogenicity in Melampsora lini[J]. Phytopathology, 1942, 32: 653-669. |
| [46] |
AGRIOS GN. Plant pathology fifth edition[M]. Amsterdam, Boston, Heidelberg, London, New York: Elsevier Academic Press, 2005.
|
| [47] |
NoxA activation by the small GTPase RacA is required to maintain a mutualistic symbiotic association between Epichloë festucae and perennial ryegrass[J]. Molecular Microbiology, 2008, 68(5): 1165-1178. |
| [48] |
Impact of endophyte inoculation on the morphological identity of cultivars of Lolium perenne (L.) and Festuca arundinacea (Schreb.)[J]. Scientific Reports, 2020, 10: 7729. |
| [49] |
DONG HS, CHEN L, ZOU SS. Plant Molecular Immunology[M]. Beijing: Science Press, 2020. (in Chinese) 董汉松, 陈蕾, 邹珅珅. 植物分子免疫学[M]. 北京: 科学出版社, 2020. |
| [50] |
Fungal endophytes of grasses[J]. Current Opinion in Plant Biology, 2012, 15(4): 462-468. |
| [51] |
Discriminating symbiosis and immunity signals by receptor competition in rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(16): e2023738118. |
| [52] |
Innovation and appropriation in mycorrhizal and rhizobial symbioses[J]. The Plant Cell, 2022, 34(5): 1573-1599. |
| [53] |
Fungal effectors, the double edge sword of phytopathogens[J]. Current Genetics, 2021, 67(1): 27-40. |
| [54] |
Influences of stroma development on vegetative growth of Roegneria kamoji[J]. Mycology, 2012, 3(4): 226-233. |
| [55] |
Mycorrhizal symbiosis in plant growth and stress adaptation: from genes to ecosystems[J]. Annual Review of Plant Biology, 2023, 74: 569-607. |
| [56] |
Taxonomy of Rhizoctonia fungi: status quo and problems[J]. Microbiology China, 2022, 49(8): 3469-3491. (in Chinese) 丝核菌的分类系统: 现状及存在问题[J]. 微生物学通报, 2022, 49(8): 3469-3491. DOI:10.13344/j.microbiol.china.211125 |
| [57] |
Host adaptation and virulence in heteroecious rust fungi[J]. Annual Review of Phytopathology, 2021, 59: 403-422. |
| [58] |
Molecular dialogue during host manipulation by the vascular wilt fungus Fusarium oxysporum[J]. Annual Review of Phytopathology, 2024, 62(1): 97-126. |
| [59] |
Molecular mechanisms in grass-Epichloë interactions: towards endophyte driven farming to improve plant fitness and immunity[J]. World Journal of Microbiology & Biotechnology, 2020, 36(7): 92. |
| [60] |
Plant-microbe specificity varies as a function of elevation[J]. The ISME Journal, 2019, 13(11): 2778-2788. |
| [61] |
A novel test for host-symbiont codivergence indicates ancient origin of fungal endophytes in grasses[J]. Systematic Biology, 2008, 57(3): 483-498. |
| [62] |
Seed transmission of Epichloë endophytes in Lolium perenne is heavily influenced by host genetics[J]. Frontiers in Plant Science, 2018, 9: 1580. |
| [63] |
Host genetic background effect on vertical seed transmission of Epichloë endophyte strains in tall fescue[J]. Microbial Ecology, 2023, 86(4): 2618-2626. |
| [64] |
Advances in artificial inoculation technology for grass-endophytic fungi[J]. Acta Prataculturae Sinica, 2021, 30(7): 179-189. (in Chinese) 禾草-内生真菌人工接种技术研究进展[J]. 草业学报, 2021, 30(7): 179-189. |
| [65] |
Genetics of host specificity in Epichloë typhina[J]. Phytopathology, 1997, 87(6): 599-605. |
| [66] |
The role of host-specificity in the reproductive isolation of Epichloë endophytes revealed by reciprocal infections[J]. Fungal Ecology, 2015, 15: 29-38. |
| [67] |
Histological methods to detect early-stage plant defense responses during artificial inoculation of Lolium perenne with Epichloë festucae[J]. Bio-protocol, 2021, 11(9): e4013. |
| [68] |
Creation of novel barley germplasm using an Epichloë endophyte[J]. Chinese Science Bulletin, 2021, 66(20): 2608-2617. (in Chinese) 利用禾草内生真菌创制大麦新种质[J]. 科学通报, 2021, 66(20): 2608-2617. |
| [69] |
Horizontal transfer of a β-1, 6-glucanase gene from an ancestral species of fungal endophyte to a cool-season grass host[J]. Scientific Reports, 2017, 7(1): 9024. |
| [70] |
Horizontal gene transfer of Fhb7 from fungus underlies Fusarium head blight resistance in wheat[J]. Science, 2020, 368(6493): eaba5435. |
| [71] |
Distribution, polymorphism and function characteristics of the GST-encoding Fhb7 in Triticeae[J]. Plants, 2022, 11(16): 2074. |
| [72] |
Engineered Phomopsis liquidambaris with Fhb1 and Fhb7 enhances resistance to Fusarium graminearum in wheat[J]. Journal of Agricultural and Food Chemistry, 2023, 71(3): 1391-1404. |
| [73] |
Getting to the edge: protein dynamical networks as a new frontier in plant-microbe interactions[J]. Frontiers in Plant Science, 2014, 5: 312. |
| [74] |
Plant-symbiotic fungi as chemical engineers: multi-genome analysis of the Clavicipitaceae reveals dynamics of alkaloid loci[J]. PLoS Genetics, 2013, 9(2): e1003323. |
| [75] |
Telomere-to-telomere genome sequences across a single genus reveal highly variable chromosome rearrangement rates but absolute stasis of chromosome number[J]. Journal of Fungi, 2022, 8(7): 670. |
| [76] |
Genomewide signatures of selection in Epichloë reveal candidate genes for host specialization[J]. Molecular Ecology, 2018, 27(15): 3070-3086. |
| [77] |
Genetic diversity and population structure of Epichloë fungal pathogens of plants in natural ecosystems[J]. Frontiers in Ecology and Evolution, 2023, 11: 1129867. |
| [78] |
Two-speed genomes of Epichloe fungal pathogens show contrasting signatures of selection between species and across populations[J]. Molecular Ecology, 2024, 33(4): e17242. |
| [79] |
Epichloë seed transmission efficiency is influenced by plant defense response mechanisms[J]. Frontiers in Plant Science, 2022, 13: 1025698. |
| [80] |
Global changes in asexual Epichloë transcriptomes during the early stages, from seed to seedling, of symbiotum establishment[J]. Microorganisms, 2021, 9(5): 991. |
| [81] |
Transcriptome analysis of choke stroma and asymptomatic inflorescence tissues reveals changes in gene expression in both Epichloë festucae and its host plant Festuca rubra subsp. rubra[J]. Microorganisms, 2019, 7(11): 567. |
| [82] |
Transcriptomics of Epichloë-grass symbioses in host vegetative and reproductive stages[J]. Molecular Plant-Microbe Interactions, 2019, 32(2): 194-207. |
| [83] |
Cross-species transcriptomics identifies core regulatory changes differentiating the asymptomatic asexual and virulent sexual life cycles of grass-symbiotic Epichloë fungi[J]. G3, 2022, 12(4): jkac043. |
 2024, Vol. 51
2024, Vol. 51