扩展功能
文章信息
- 罗成莹, 何秀, 徐美余, 林连兵
- LUO Chengying, HE Xiu, XU Meiyu, LIN Lianbing
- 五株乳酸菌和三株芽孢杆菌的生物学特性和功能
- Biological properties and functions of five strains of lactic acid bacteria and three strains of Bacillus
- 微生物学通报, 2024, 51(1): 172-188
- Microbiology China, 2024, 51(1): 172-188
- DOI: 10.13344/j.microbiol.china.230518
-
文章历史
- 收稿日期: 2023-06-28
- 接受日期: 2023-09-04
- 网络首发日期: 2023-09-20
2. 云南省高校饲用抗生素替代技术工程研究中心, 云南 昆明 650500
2. Engineering Research Center for Replacement Technology of Feed Antibiotics of Yunnan College, Kunming 650500, Yunnan, China
抗生素能治疗动物疾病和提高牲畜的生长性能,但由于长期的使用或滥用,使得抗生素在动物体内残留超标,导致耐药细菌的不断出现,已严重威胁人类健康[1]。自2020年7月1日起,畜禽饲料行业开启全面禁抗时代[2],而寻找抗生素替代产品成为了亟待解决的问题。益生菌是一类活的有益微生物[3],代谢产生的抗菌类化合物能杀灭胃肠道内的病原菌,具有维持肠道菌群平衡的功能[4]。其中乳酸菌具有较强的产酸能力[5],芽孢杆菌具有较好的产酶性能[6],因此被广泛用于发酵各类畜牧产品[7],也常被当作饲料添加剂直接使用。益生菌在维持动物健康方面可发挥出优于抗生素的效果,越来越受到人们的重视。
乳酸菌(lactic acid bacteria, LAB)是一类能利用碳水化合物产生大量乳酸的革兰氏阳性菌,是维持动物机体健康的重要菌群[8]。乳酸菌参与体内免疫调节,维护肠道上皮屏障的完整性,具有较强的抗氧化能力[9];此外,还具有较高的自聚集能力、共聚集能力和疏水性[10]。在益生性评价方面,乳酸菌对pH、NaCl和胆汁酸盐均表现出良好的耐受性,对病原菌也有明显的抑制作用[11]。因此,在畜牧生产行业中,乳酸菌常被用于青贮饲料的发酵,不仅能提高饲料的蛋白质含量,还能调节青贮过程中菌群结构以提高饲料品质,饲喂后还能调控肠道菌群保证动物的健康[12]。
芽孢杆菌(Bacillus sp.)是一类能产生抗力内生孢子的革兰氏阳性菌,广泛存在于生物体和环境中。曹树威等[13]研究表明芽孢杆菌具有抑菌、抗病毒活性;还具有促生长消化、维持肠道菌群平衡、抑制病原菌和提高机体免疫力等功能[14-15]。He等[16]在饲粮中添加枯草芽孢杆菌降低了仔猪腹泻率,同时减轻机体炎症反应和改善肠道吸收功能。Zou等[17]的研究表明在饲粮中添加枯草芽孢杆菌能调节蛋鸡肠道菌群,改善十二指肠的抗氧化状态和屏障完整性,降低促炎细胞因子的表达,并减少肠道致病菌。此外,芽孢杆菌还是一种重要的工业细菌,在食品工业、制药、医疗、洗涤和纺织工业等方面都有应用[18]。
益生菌能发挥出优于抗生素的使用效果且不会对人体产生危害,但菌株的生物学活性和功能影响着实际生产效率,因此筛选优势菌株是应用的重要前提。本研究从植物酵素和鸡肠道中分离获得5株乳酸菌和3株芽孢杆菌,初步探究了8株菌的形态特征、生长曲线和产酸能力等生物学特性,为后期用于青贮饲料和中药的发酵提供理论基础。
1 材料与方法 1.1 材料 1.1.1 菌株试验所用8株菌株由本实验室保存;金黄色葡萄球菌ATCC 6538、大肠杆菌CMCC (B) 44102、沙门氏菌CMCC (B) 50094,广东环凯微生物科技有限公司;志贺氏菌DS8分离于鸡肠道[19]。
1.1.2 培养基和主要试剂、仪器哥伦比亚血琼脂培养基,青岛海博生物有限公司;LB培养基和乳酸细菌培养基(de Man, Rogosa and Sharp, MRS)培养基,广东环凯微生物科技有限公司;卢戈氏碘液:碘(I) 1 g,碘化钾(KI) 2 g,蒸馏水300 mL;产蛋白酶筛选培养基参照石水琴等[20]的方法配制;产淀粉酶筛选培养基参照杜东晓等[21]的方法配制;产纤维素酶筛选培养基参照陈诗瑶等[22]的方法配制;人工肠液参照徐义刚等[23]的方法配制;人工胃液参照辛羚等[24]的方法配制。
0.22 µm滤膜,天津市津腾实验设备有限公司;细菌基因组提取试剂盒,天根生化科技(北京)有限公司;10种抗生素药敏纸片,比克曼生物科技有限公司。
恒温培养箱,上海一恒科学仪器有限公司;光学显微镜,Zeiss公司;电泳仪,北京市六一仪器厂;PCR仪和紫外凝胶成像分析系统,Bio-Rad公司。
1.2 菌株的鉴定及生物学特性 1.2.1 菌株的鉴定取分离保存于实验室的5株乳酸菌和3株芽孢杆菌,在MRS和LB固体培养基表面划线,倒置于37.0 ℃下过夜培养12 h。选取菌落较大的芽孢杆菌和溶钙圈较大的乳酸菌,分别接种于对应的5 mL液体培养基中,37.0 ℃、150 r/min振荡培养24 h,根据细菌基因组提取试剂盒的说明书分别提取细菌DNA。
使用通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGYTACCTTGTTACGACTT-3′)对分离的菌株进行16S rRNA基因扩增。PCR反应体系(20 μL):2×Taq Master Mix 10 μL,模板1 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 7 μL。PCR条件:94 ℃ 1 min;94 ℃ 50 s,56 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min;4 ℃保存[19]。取5 μL的PCR产物在1.5%的琼脂糖凝胶电泳下检测条带,并将PCR产物送至生工生物工程(上海)股份有限公司测定基因序列,测序结果在GenBank中进行BLAST比对分析。
1.2.2 菌株的形态学观察接种环蘸取乳酸菌和芽孢杆菌菌液,分别在MRS和LB固体培养基表面划线,倒置于37.0 ℃培养箱中培养24 h。记录菌落在平板上生长的形状、颜色和大小。此外,取20 μL菌液进行涂片,固定后用结晶紫染料染色约1 min,用蒸馏水冲洗,晾干后用光学显微镜(100×)进行形态观察并拍照记录。
1.2.3 菌株间的拮抗性测定将8株菌分别进行活化,以其中一株菌作为指示菌,取100 μL菌液涂布于对应的固体培养基表面,放置10 min,用无菌圆形滤纸片(直径8 mm)分别用菌液浸湿,逐一放置涂布好指示菌的固体培养基表面,记录编号。置于37.0 ℃恒温培养箱中培养24 h,观察菌株间是否具有相溶性,以待测菌周围无指示菌生长为拮抗,有指示菌生长为相溶。
1.2.4 菌株的生长曲线测定将乳酸菌和芽孢杆菌分别接种于MRS和LB液体培养基中,37.0 ℃、150 r/min培养24 h,每2 h取发酵液,以液体培养基作为对照,测定OD600的吸光值,每组3个重复,绘制菌株生长曲线。
1.2.5 菌株的产酸能力测定按1%接种量将已活化的菌株液分别接种于对应的MRS和LB液体培养基,37.0 ℃、150 r/min培养24 h,每2 h取发酵液,测定pH值。每组3个重复。
1.2.6 菌株的最适生长温度测定按1%接种量将已活化的菌株液分别接种于对应的MRS和LB液体培养基中,置于不同温度下(25.0、30.0、35.0、37.0和40.0 ℃)、150 r/min培养24 h,测定OD600的吸光值,每组3个重复。
1.3 菌株的生物学功能测定 1.3.1 抑菌性能的测定采用牛津杯法[25]测定8株菌对致病性大肠杆菌、沙门氏菌、金黄色葡萄球菌和志贺氏菌的抑制作用,以氨苄青霉素作为阳性对照,无菌蒸馏水作为阴性对照。
1.3.2 产酶性能的测定产蛋白酶试验:待测菌分别点接至产蛋白酶筛选固体培养基表面,倒置于37.0 ℃培养24 h,待长出菌落,观察是否出现透明圈,用卡尺测量菌落和透明圈的大小,以评估产蛋白酶活性。
产淀粉酶试验:待测菌分别点接至产淀粉酶筛选固体培养基表面,倒置于37.0 ℃培养24 h,待长出菌落,加入卢氏碘液使之覆盖整个平板,观察是否出现透明圈,用卡尺测量菌落和透明圈的大小,以评估产淀粉酶活性。
产纤维素酶试验:待测菌株分别点接至产纤维素酶筛选固体培养基表面,倒置于37.0 ℃培养24 h,待长出菌落,加入10 mg/mL刚果红溶液,染色10−15 min后倒弃,加入1 mol/L NaCl溶液,15 min后倒弃,观察菌落周围是否出现透明圈,用卡尺测量菌落和透明圈的大小,以评估产纤维素酶活性。
1.3.3 菌株体外益生性测定根据试验需要,将活化好的菌液单独和混合培养(5株乳酸菌和3株芽孢杆菌分别混合培养)后的菌液以5%的接种量接入人工肠胃液中,于37.0 ℃静置培养3 h和4 h。培养结束后,取100 μL液体进行梯度稀释,在MRS和LB固体培养基上均匀涂布,倒置于37.0 ℃培养24 h,利用平板菌落计数法计数各菌的活菌数,并计算存活率。
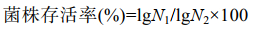
|
式中:N1为在人工肠胃液中培养后的活菌数;N2为未经肠胃液处理时的活菌数(CFU/mL)。
1.4 菌株体外安全性测定 1.4.1 溶血活性将待测菌的菌悬液分别划线接种于哥伦比亚血琼脂培养基表面,置于37.0 ℃下培养过夜,观察菌落周围是否有透明的溶血圈,以强溶血性金黄色葡萄球菌ATCC 6538为阳性对照。
1.4.2 药敏试验将待测菌进行活化,取100 μL细菌富集液与5 mL半固体琼脂培养基(乳酸菌用MRS培养基,芽孢杆菌用LB培养基)混匀,倒入固体培养基表面。夹取药敏纸片贴于培养基表面,置于37.0 ℃下培养24 h后观察药敏纸片周围有无抑菌圈,并测量抑菌圈直径(d)大小。按美国临床实验室标准化研究所(Clinical and Laboratory Standards Institude, CLSI) CLSI M100-S26版的标准判定为敏感(S)、中敏(I)和耐药(R)[26]。
1.4.3 耐药基因和毒力基因的表达耐药基因和毒力基因的引物信息见表 1。引物由生工生物工程(上海)股份有限公司合成。以各菌株DNA作为模板,在耐药基因和毒力基因的引物作用下,对其基因片段进行PCR扩增,扩增体系参照1.2.1,PCR产物经1.2%琼脂糖凝胶电泳检测结果。扩增的耐药基因分别为qnrA (喹诺酮类)、tetM (四环素类)、strA (链霉素)、Aac(6′)-aph(2″) (庆大霉素类)、sul Ⅱ (磺胺甲基异恶唑)和vanB (万古霉素)。毒力基因分别为gelE (产胞外酶)、hyl (产胞外酶)、asa1 (黏附作用)、esp (产表面蛋白)、cylA (溶血作用)和ace (黏附作用)。
| 引物名称Primers name | 引物序列Primer sequence (5′→3′) | 产物长度Product length (bp) |
| qnrA | TCAGCAAGAGGATTTCTCA GGCAGCACTATTACTCCCA |
627 |
| tetM | GTGGACAAAGGTACAACGAG CGGTAAAGTTCGTCACACAC |
406 |
| strA | CTTGGTGATAACGGCAATTC CCAATCGCAGATAGAAGGC |
548 |
| Aac(6′)-aph(2″) | CCAAGAGCAATAAGGGCATACC ACCCTCAAAAACTGTTGTTGC |
675 |
| SulⅡ | CCTGTTTCGTCCGACACAGA GAAGCGCAGCCGCAATTCAT |
435 |
| vanB | ACCCTGTCTTTGTGAAGCCGGCAC CAAAAAAAGATCAACACGAGCAAGCCC |
457 |
| gelE | TATGACAATGCTTTTTGGGAT AGATGCACCCGAAATAATATA |
234 |
| hyl | ACAGAAGAGCTGCAGGAAATG GACTGACGTCCAAGTTTCCAA |
276 |
| asa1 | CCAGCCAACTATGGCGGAATC CCTGTCGCAAGATCGACTGTA |
529 |
| esp | TTGCTAATGCCTAGTCCACGACC GCGTCAACACTTGCATTGCCGAA |
933 |
| cylA | TGGA TGATAGTGATAGGAAGT TCTACAGTAAATCTTTCGTCA |
517 |
| ace | AAAGTAGAATTAGATCCACAC TCTATCACATTCGGTTGCG |
320 |
所有测得的数据均包含3次生物学重复,以平均值±标准差呈现,选择SPSS 25.0[27]软件进行数据统计分析,采用GraphPad Prism 8[28]制图。
2 结果与分析 2.1 菌株的分离鉴定结果将测序结果在GenBank数据库中利用BLAST对细菌的16S rRNA基因序列进行相似性比对,结果如表 2所示。五株乳酸菌,将其分别命名为R1−R5,分别鉴定为干酪乳杆菌、副干酪乳杆菌、香肠乳杆菌、福莱乳杆菌和唾液乳杆菌;3株芽孢杆菌分别命名为Y1−Y3,鉴定为贝莱斯芽孢杆菌、枯草芽孢杆菌和地衣芽孢杆菌。
| 菌株 Strains |
分子鉴定 Molecular identification |
相似性 Similarity (%) |
GenBank登录号 GenBank accession No. |
| R1 | 干酪乳杆菌Lacticaseibacillus casei | 99.11 | NR113333.1 |
| R2 | 副干酪乳杆菌Lacticaseibacillus paracasei | 98.26 | NR113337.1 |
| R3 | 香肠乳杆菌Companilactobacillus farciminis | 98.93 | NR114398.1 |
| R4 | 福莱乳杆菌Companilactobacillus futsaii | 98.27 | NR117937.1 |
| R5 | 唾液乳杆菌Ligilactobacillus salivarius | 99.23 | MT611902.1 |
| Y1 | 贝莱斯芽孢杆菌Bacillus velezensis | 99.71 | MT271915.1 |
| Y2 | 枯草芽孢杆菌Bacillus subtilis | 98.85 | NR112116.2 |
| Y3 | 地衣芽孢杆菌Bacillus licheniformis | 99.22 | NR118996.1 |
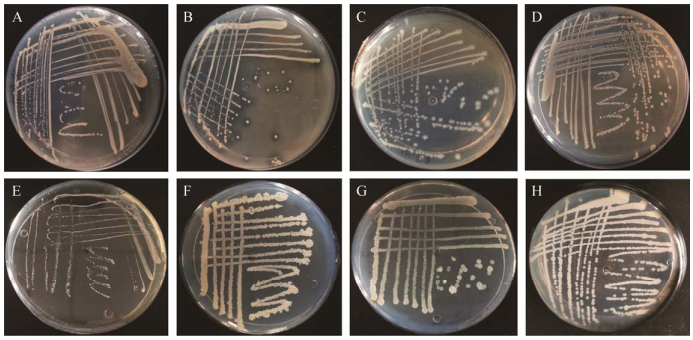
根据菌落在培养基上的生长情况及显微结构,如图 1和图 2所示,菌株间的形态特征各不相同。R1−R2、R4−R5:白色菌落、边缘光滑,凸起于培养基表面生长,显微镜下成群聚集,微观形态为长杆状。其中R1在平板上菌落直径为(0.8±0.15) mm,R2菌落直径为(1.0±0.06) mm,R4菌落直径为(1.3±0.15) mm,R5菌落直径为(0.5±0.06) mm。R3:花纹状的白色菌落,在培养基表面不凸起,显微镜下呈短杆状,大多两个或多个聚集在一起,其菌落直径为(1.1±0.15) mm。Y1−Y2:乳白色菌落,边缘有褶皱,挑取时菌落呈黏液状,显微镜下成群聚集,Y1为短杆状,菌落直径为(2.3±0.30) mm;Y2为长杆状,菌落直径为(2.0±0.06) mm。Y3:菌落为白色、表面粗糙、边缘不规则、贴于培养基上生长,显微镜下成群聚集,为细长杆状,菌落直径为(1.8±0.15) mm。
|
| 图 1 菌株的平板划线图 Figure 1 Plate scribing diagram of strain. A−H:菌株R1、R2、R3、R4、R5、Y1、Y2和Y3 A−H: Strain R1, R2, R3, R4, R5, Y1, Y2 and Y3, respectively. |
|
|
|
| 图 2 菌株的显微结构图 Figure 2 Microstructure of strain. A−H:菌株R1、R2、R3、R4、R5、Y1、Y2和Y3 A−H: Strain R1, R2, R3, R4, R5, Y1, Y2 and Y3, respectively. |
|
|
菌株间的拮抗性如图 3所示,待测菌滤纸片周围长指示菌视为待测菌对指示菌无拮抗作用,能融合生长视为相容。图 3中A−G图分别以R1、R2、R3、R4、R5、Y1和Y2作为指示菌。当以R1作为指示菌时(图 3A),其余7株菌则作为待测菌,由图 3A可观察到待测菌滤纸片周围有指示菌R1生长,说明R1与其余7株菌无拮抗作用。同上,从图 3B−3G中可观察到菌株之间均能融合生长,无拮抗作用。结果表明,8株菌之间具有较好的相溶性,可以共同培养。

|
| 图 3 菌株间的拮抗作用 Figure 3 Antagonism between strains. A:以R1为指示菌,其余为待测菌. B:以R2为指示菌,其余为待测菌. C:以R3为指示菌,其余为待测菌. D:以R4为指示菌,其余为待测菌. E:以R5为指示菌,其余为待测菌. F:以Y1为指示菌,其余为待测菌. G:以Y2为指示菌,Y3为待测菌 A: R1 as the indicator and the rest as the bacteria to be tested. B: R2 as the indicator and the rest as the bacteria to be tested. C: R3 as the indicator and the rest as the bacteria to be tested. D: R4 as the indicator and the rest as the bacteria to be tested. E: R5 as the indicator and the rest as the bacteria to be tested. F: Y1 as the indicator and the rest as the bacteria to be tested. G: Y2 as the indicator and Y3 as the bacteria to be tested. |
|
|
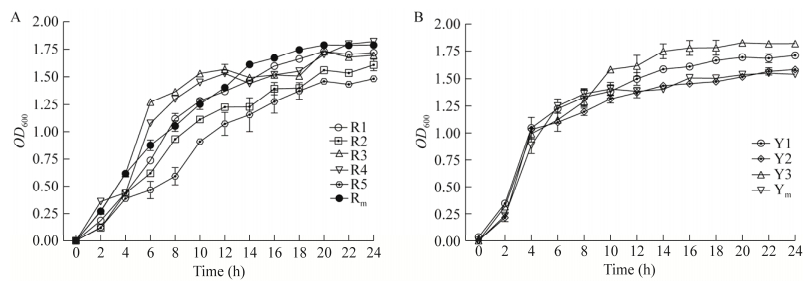
八株菌在生长过程中的OD600值见图 4,8株菌均在2−10 h为对数生长期,18−24 h为稳定期,菌体浓度逐渐趋于平稳(乳酸菌活菌数在109 CFU/mL,芽孢杆菌活菌数均保持在108 CFU/mL)。两种类型的菌株在混合培养时,生长速度不及菌株单独培养,并且芽孢杆菌进入稳定期后的活菌数低于乳酸菌,相较之下乳酸菌的对数生长周期长、活菌数高。培养24 h后各菌株的OD600值和所对应的活菌数详见表 3。
|
| 图 4 菌株的生长曲线 Figure 4 Strain growth curve. A:乳酸菌生长曲线. B:芽孢杆菌生长曲线. Rm:5株乳酸菌混合培养后的菌液;Ym:3株芽孢杆菌混合培养后的菌液 A: LAB growth curve. B: Bacillus growth curve. Rm: The bacterial solution after mixed cultivation of 5 strains of LAB; Ym: The bacterial solution after mixed cultivation of 3 strains of Bacillus. |
|
|
| 菌株 Strains |
OD600 | 活菌数 Number of viable bacteria (CFU/mL) |
| R1 | 1.642±0.860 | 2.18×109 |
| R2 | 1.569±0.540 | 2.49×109 |
| R3 | 1.629±0.670 | 2.61×109 |
| R4 | 1.731±0.790 | 2.58×109 |
| R5 | 1.478±0.630 | 2.50×109 |
| Y1 | 1.708±0.840 | 1.79×108 |
| Y2 | 1.599±0.950 | 1.45×108 |
| Y3 | 1.788±0.340 | 1.20×108 |
八株菌在生长过程中的pH值变化趋势如图 5所示。五株乳酸菌随着菌体的生长,pH值逐渐降低,18 h后基本趋于稳定,与生长曲线的趋势相一致。五株乳酸菌最终的pH在3.5−3.8之间,产酸能力较强的是R5和Rm。芽孢杆菌不产乳酸,其pH有上升的趋势,Y1生长过程中pH未明显增加。
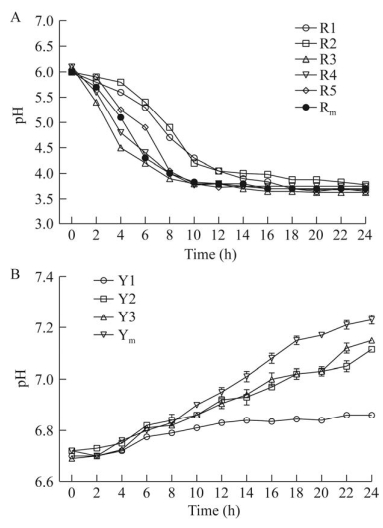
|
| 图 5 菌株的产酸能力 Figure 5 Acid-producing capacity of the strain. Rm:5株乳酸菌混合培养后的菌液;Ym:3株芽孢杆菌混合培养后的菌液 Rm: The bacterial solution after mixed cultivation of 5 strains of LAB; Ym: The bacterial solution after mixed cultivation of 3 strains of Bacillus. |
|
|
不同温度下菌株的生长情况如图 6所示,在不同温度下,菌株间的生长情况各不相同,在37.0 ℃下培养时,8株菌的OD600值达到最高。因此,确定37.0 ℃是8株菌的最适生长温度。
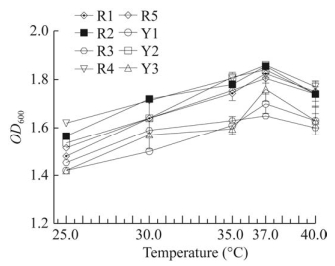
|
| 图 6 不同温度下菌株的OD600值 Figure 6 OD600 values of strains at different temperatures. |
|
|
由表 4和图 7可知,5株乳酸菌对金黄色葡萄球菌、沙门氏菌、大肠杆菌和志贺氏菌的抑制作用效果较好,抑菌圈直径均不低于16 mm,其中菌株R4抑制金黄色葡萄球菌时的抑菌圈最大为26 mm,3株芽孢杆菌都无明显的抑菌效果。五株乳酸菌混合培养后的抑菌不及单独培养后再混合的效果。
| 菌株编号 Strains No. |
抑菌圈的直径Diameter of bacteriostatic ring (mm) | |||
| Staphylococcus aureus ATCC 6538 | Salmonella paratyphi B CMCC (B) 50094 | Escherichia coli CMCC (B) 44102 | Shigella castellani DS8 | |
| R1 | 22±0.0 | 16±2.8 | 18±0.4 | 18±0.4 |
| R2 | 23±0.4 | 17±0.4 | 19±1.4 | 20±0.7 |
| R3 | 22±0.4 | 16±0.7 | 18±2.8 | 16±1.4 |
| R4 | 26±0.0 | 19±0.7 | 20±0.4 | 21±0.7 |
| R5 | 22±0.7 | 16±1.4 | 19±0.7 | 18±0.4 |
| Rs | 24±0.7 | 22±0.0 | 22±0.4 | 23±0.0 |
| Rm | 21±0.4 | 14±0.7 | 15±0.0 | 15±0.7 |
| PC | 66±1.2 | 59±0.4 | 55±1.0 | 56±0.0 |
| NC | 0 | 0 | 0 | 0 |
| Ys | 0 | 0 | 0 | 0 |
| Ym | 0 | 0 | 0 | 0 |
| Rs:5株乳酸菌分别培养后按1:1:1:1:1混合的菌液;Rm:5株乳酸菌混合培养后的菌液;PC:阳性对照;NC:阴性对照;Ys:3株芽孢杆菌分别培养后再按1:1:1混合的菌液;Ym:3株芽孢杆菌混合培养后的菌液. 下同 Rs: 5 strains of LAB were cultured separately and mixed in a 1:1:1:1:1 mixture of bacterial solution; Rm: The bacterial liquid after mixed cultivation of 5 strains of LAB; PC: Positive control; NC: Negative control. Ys: The mixture of 3 strains of Bacillus cultured separately in a 1:1:1 ratio; Ym: The bacterial liquid after mixed cultivation of 3 strains of Bacillus. The same below. |
||||
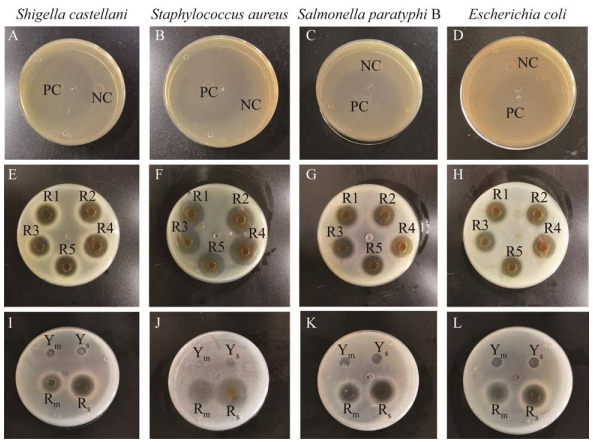
|
| 图 7 菌株的抑菌效果 Figure 7 Bacteriostatic effect of strain. A、E、I为志贺氏菌DS8;B、F、J为金黄色葡萄球菌ATCC 6538;C、G、K为沙门氏菌B CMCC (B) 50094;D、H、L为大肠杆菌Escherichia coli CMCC (B) 44102 A, E and I are Shigella castellani DS8; B, F and J are Staphylococcus aureus ATCC 6538; C, G and K are Salmonella paratyphi B CMCC (B) 50094; D, H and L are Escherichia coli CMCC (B) 44102. |
|
|
以透明圈直径/菌落直径的值表示产酶性能[29],从表 5和图 8可知,5株乳酸菌产酶效果不明显;3株芽孢杆菌虽然无抑菌效果,但却有很强的产淀粉酶、蛋白酶和纤维素酶的能力。三种产酶能力均表现为Y1>Y2>Y3,并且3个菌株产淀粉酶能力最强,其次是产蛋白酶和纤维素酶。
| 菌株编号 Strains No. |
淀粉酶活 Amylase activity |
蛋白酶活 Protease activity |
纤维素酶活 Cellulase activity |
| Y1 | 5.0±0.2 | 2.2±0.3 | 5.0±0.5 |
| Y2 | 4.2±0.1 | 2.0±0.3 | 1.4±0.3 |
| Y3 | 3.3±0.4 | 1.3±0.3 | 3.3±0.5 |
| R1−R5 | − | − | − |
| 产酶活性以透明圈平均直径和菌体平均直径的比值表示;−:无酶活性 Enzyme-producing activity is expressed as the ratio of the average diameter of the transparent circle to the average diameter of the bacterium; −: No enzymatic activity. |
|||
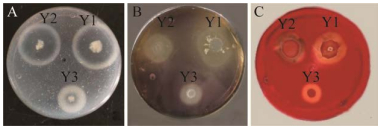
|
| 图 8 三株芽孢杆菌产酶的水解圈 Figure 8 Hydrolysis circle of enzyme produced by 3 Bacillus strains. A:淀粉酶溶解圈. B:蛋白酶溶解圈. C:纤维素酶溶解圈 A: Amylase dissolving circle. B: Protease dissolving circle. C: Cellulase dissolving circle. |
|
|
能在消化道中定殖的益生菌需经受住胃液中的胃蛋白酶和低pH的环境。八株菌在不同pH模拟肠胃液中的存活情况见表 6。八株菌在肠液中具有较强的耐受能力,存活率都在98%以上,乳酸菌混合时比单菌株存活率高,达104%,而芽孢杆菌混合后却比单菌株的存活率低。在不同pH的胃液中,8株菌在pH为4.0时存活率最高,其次为pH 3.0,pH 2.0时存活率最低,其中在pH为2.0时的胃液中,菌株R1、R2和Y1的存活率依然高达80%以上;在pH 3.0和pH 4.0的胃液中,无论是单菌还是复合菌都表现出极强的耐受能力。
| 菌株 Strains |
3 h模拟胃液(存活率) 3 h simulated gastric juice (survival rate) |
4 h模拟肠液(存活率) 4 h simulated intestinal fluid (survival rate) |
|||
| pH 2.0 | pH 3.0 | pH 4.0 | pH 6.8 | ||
| R1 | 87.90 | 91.38 | 98.67 | 100.00 | |
| R2 | 80.48 | 90.90 | 98.76 | 99.37 | |
| R4 | 43.34 | 85.37 | 97.56 | 99.86 | |
| R3 | 42.56 | 86.78 | 98.81 | 99.79 | |
| R5 | 49.34 | 87.70 | 99.77 | 100.00 | |
| Y1 | 83.78 | 99.38 | 99.52 | 100.00 | |
| Y2 | 58.03 | 84.48 | 96.51 | 98.52 | |
| Y3 | 61.54 | 94.50 | 97.77 | 99.38 | |
| Rm | 61.86 | 97.21 | 99.11 | 104.80 | |
| Ym | 55.84 | 93.05 | 99.48 | 95.36 | |
| Rm:5株乳酸菌混合培养后的菌液;Ym:3株芽孢杆菌混合培养后的菌液 Rm: The bacterial solution after mixed cultivation of 5 strains of lactic acid bacteria; Ym: The bacterial solution after mixed cultivation of 3 strains of Bacillus. |
|||||
八株菌的溶血检测如图 9所示,以N (金黄色葡萄球菌ATCC 6538)作为溶血活性检测的阳性对照,8株菌都无溶血作用。R1−R4菌落在哥伦比亚血琼脂培养基平板上生长形态较为细小,而菌株R5、Y1−Y3的菌落在血琼脂培养基上生长迅速,菌落较大且结构明显。八株菌落周围的培养基无变化,无溶血作用。
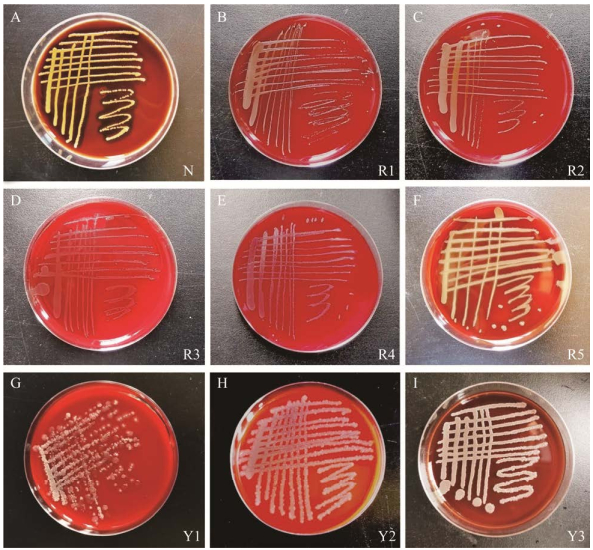
|
| 图 9 不同菌株的溶血性检测板 Figure 9 Hemolysis test plate of different strains. A−I:分别为阳性对照、菌株R1、R2、R3、R4、R5、Y1、Y2和Y3 A−H: Postive control, strain R1, R2, R3, R4, R5, Y1, Y2 and Y3, respectively. |
|
|
研究菌株对抗生素的敏感程度是评价菌株安全性的重要指标。八株菌分别对10种抗生素的敏感性均在质控范围内,对10种抗生素都在中度敏感以上(抑菌圈直径都在10 mm以上)。每个菌株对不同抗生素的敏感程度均有所不同,而8株菌对抗生素都有敏感性。药敏结果详见表 7。
| 抗生素Antibiotic | R1 | R2 | R3 | R4 | R5 | Y1 | Y2 | Y3 |
| 四环素Tetracycline | S | S | S | S | I | I | I | S |
| 诺氟沙星Norfloxacin | I | I | I | I | S | S | S | S |
| 链霉素Streptomycin | I | I | I | I | I | S | S | S |
| 庆大霉素Gentamicin | I | I | I | I | I | S | S | S |
| 万古霉素Vancomycin | I | I | I | I | S | S | S | S |
| 复方新诺明 Paediatric compound sulfamethoxazole tablets |
S | I | S | S | S | S | S | S |
| 头孢他啶Ceftazidime | I | I | I | I | I | I | S | I |
| 呋喃唑酮Furazolidone | I | I | I | I | I | I | I | I |
| 磺胺异恶唑Sulfafurazole | S | S | I | I | I | S | S | S |
| 阿莫西林Amoxicillin | S | S | S | S | S | S | S | S |
| S:敏感;I:中度敏感 S: Sensitive; I: Intermediary sensitivity. |
||||||||
对8株菌进行相关的毒力基因和耐药基因以及对抗生素药物敏感性的测定,了解菌株毒力基因携带和耐药特性,如图 10所示,除菌株R5具有耐四环素基因tetM (406 bp)外,其他菌株均未检测到相关的耐药和毒力基因。抗生素药物敏感性检测结果与耐药基因检测结果基本一致。
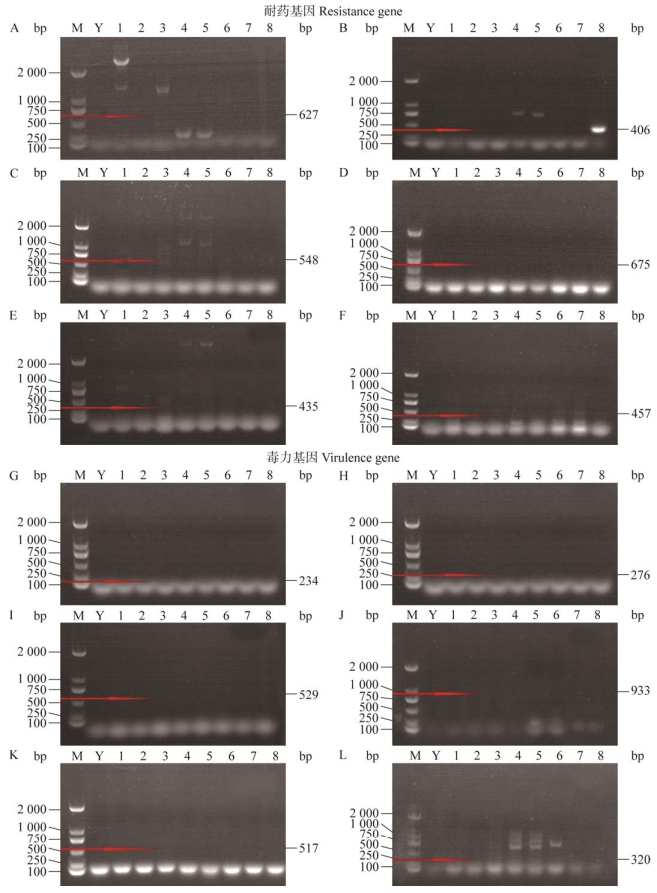
|
| 图 10 耐药基因和毒力基因的PCR扩增结果 Figure 10 PCR amplification results of drug resistance gene and virulence gene. M: DL2000 DNA Marker, Y: Negative control, 1‒8 represent Y1, Y2, Y3, R1, R2, R3, R4, and R5, respectively. A−F: PCR amplification results for qnrA, tetM, strA, Aac(6′)-aph(2″), Sul Ⅱ, and vanB, respectively. G−L: PCR amplification results for gelE, hyl, asa1, esp, cylA, and ace. M:DL2000 DNA Marker,Y:阴性对照,1‒8分别代表Y1、Y2、Y3、R1、R2、R3、R4和R5. A−F:qnrA、tetM、strA、Aac(6′)-aph(2″)、Sul Ⅱ和vanB的PCR扩增结果. G−L:gelE、hyl、asa1、esp、cylA和ace的PCR扩增结果 |
|
|
益生菌可通过调节动物肠道内的微生态平衡预防疾病的发生,从而被作为优良的替代品而得到广泛的开发利用[30]。为了筛选出性状良好的益生菌种需全面考虑菌株的生物学特性[31]。通过平板划线法选择融钙圈较大的乳酸菌菌落和菌落较大的芽孢杆菌菌落培养,可保证菌株生长繁殖的速度和其特有的功效。生长曲线能够反映细菌的数量变化、生长与代谢状况[32],8株菌均在2−10 h为对数生长期,最终的菌液浓度较高,比张在等[33]研究中的乳酸菌(8 h进入对数生长期)和芽孢杆菌(6 h进入对数生长期)能更快速定殖于肠道,遏制有害菌群的增长。乳酸菌和芽孢杆菌在培养24 h时活菌数大于109 CFU/mL和108 CFU/mL,具有足够的活菌数量,为发挥其作用创造了良好的先决条件。五株乳酸菌生长的最终pH值为3.5−3.8,产酸能力优于张玉琳等[34]研究分离的乳酸菌。本研究中的芽孢杆菌生长过程中pH值逐渐上升,说明3株芽孢杆菌无产酸能力,可能与代谢产酶性能有关。不同细菌对生长条件的要求不同,8株菌在20.0−40.0 ℃下均能生长,37.0 ℃下培养时OD600值最高。表明8株菌具有较强的生长繁殖能力,生物学特性较强。
金黄色葡萄球菌、沙门氏菌、大肠杆菌和志贺氏菌是较为常见的致病菌,菌株的抑菌特性能以达到抗生素类似的效果,可避免因耐药性引发的一系列安全问题[35]。乳酸菌能分泌乳酸等抑菌物质来抑制病原菌的生长[36],5株乳酸菌的抑菌效果较好,抑菌圈直径均不低于16 mm,其中R4抑制金黄色葡萄球菌时的抑菌圈最大为26 mm,组合菌较单一菌株而言具备更好的抑菌效果。芽孢杆菌是具有产高蛋白酶和高淀粉酶活性的菌株[29],3株芽孢杆菌具有较强的产淀粉酶、蛋白酶和纤维素酶的能力。其中,菌株Y1的产酶能力最强,但生长时的终pH最低,维持在6.8左右,表明菌株的产酶性能与生长的pH值相关。益生菌间的生物拮抗作用是制备复合微生态制剂的前提[37],8株菌之间无拮抗作用,可以单独或混合搭配为微生态制剂使用。
耐受胃肠液能力是益生菌筛选的一个重要指标[38]。八株菌在pH 6.8的人工肠液中存活率都在98%以上,在不同pH的胃液中,pH 4.0时存活率最高,其次为pH 3.0,pH 2.0时存活率最低,其中在pH 2.0时的胃液中,菌株R1、R2和Y1的存活率依然高达80%以上,表明8株菌在人工肠胃液中都具有较高的存活率和耐受能力。溶血素的产生[39]、对抗生素的敏感性[40]及有无耐药基因和毒力基因都是评估潜在益生菌安全性的重要指标。溶血素的产生与毒力基因cylA相关,8株菌均无溶血作用,也无溶血基因和其他毒力基因的表达,可初步认定8株菌具有一定的安全性。每个菌株对不同抗生素均有敏感性,除菌株R5外无相对应的耐药基因表达,抗生素药物敏感性检测结果与耐药基因检测结果基本一致。其中,菌株R5中有耐四环素基因tetM的表达,但在对四环素的耐药程度却是中度敏感,说明此菌株存在四环素耐药基因,却未在实际应用中表达出来,而菌株R5在先前的研究中对防治玉米的霉变具有良好的效果[41]。虽然耐药基因的存在会转移至其他菌株,但耐药基因存在于益生菌中可避免抗生素的杀灭作用[42]。表明8株菌都具备一定的益生性和安全性,可用于生产实践。
本研究分析了酵素源和鸡肠道源的5株乳酸菌和3株芽孢杆菌的生物学特性,验证了乳酸菌的抑菌特性和芽孢杆菌的产酶效果,证实了8株菌有具有较强的耐受能力,也具有一定的益生性和安全性,为之后用于治疗家禽疾病及饲料和中药的发酵提供基础数据。
| [1] |
BISHT R, SAXENA P. Antibiotic abuse: post-antibiotic apocalypse, superbugs and superfoods[J]. Current Science, 2019, 116(7): 1055-1056. |
| [2] |
WANG LL, XU JX. Challenges and countermeasures faced by aquaculture after the implementation of feed "anti-resistance order"[J]. China Animal Health, 2021, 23(9): 3-3, 5. (in Chinese) 王蕾蕾, 许金新. 饲料"禁抗令"施行后养殖业面临的挑战及对策[J]. 中国动物保健, 2021, 23(9): 3-3, 5. DOI:10.3969/j.issn.1008-4754.2021.09.002 |
| [3] |
HILL C, GUARNER F, REID G, GIBSON GR, MERENSTEIN DJ, POT B, MORELLI L, CANANI RB, FLINT HJ, SALMINEN S, CALDER PC, SANDERS ME. The International Scientific Association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic[J]. Nature Reviews Gastroenterology & Hepatology, 2014, 11(8): 506-514. |
| [4] |
JIAN ZH, SUN S, DOU TF, GE CR, JIA JJ. Advances in the application of probiotics in chicken production[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(11): 129-134. (in Chinese) 简宗辉, 孙帅, 豆腾飞, 葛长荣, 贾俊静. 益生菌在养鸡生产中应用的研究进展[J]. 畜牧与兽医, 2021, 53(11): 129-134. |
| [5] |
WEI QX, ZHANG JP, LIANG YC, TANG LQ, WANG P. Isolation, identification and biological characteristics evaluation of lactic acid bacteria for silage[J]. Chinese Journal of Animal Nutrition, 2022, 34(7): 4737-4749. (in Chinese) 韦庆旭, 张建鹏, 梁煜晨, 唐连群, 王平. 青贮用乳酸菌的分离鉴定及生物学特性评价[J]. 动物营养学报, 2022, 34(7): 4737-4749. |
| [6] |
GALANO M, VAN DEN DUNGEN MW, VAN RIJ T, ABBAS HE. Safety evaluation of food enzymes produced by a safe strain lineage of Bacillus subtilis[J]. Regulatory Toxicology and Pharmacology, 2021, 126: 105030. DOI:10.1016/j.yrtph.2021.105030 |
| [7] |
YANG L. Study on the application of probiotics in animal husbandry[J]. Livestock and Poultry Industry, 2022, 33(1): 41-42. (in Chinese) 杨莉. 益生菌在畜牧养殖中的应用研究[J]. 畜禽业, 2022, 33(1): 41-42. |
| [8] |
TIAN XJ, CHEN H, LIU H, CHEN JH. Recent advances in lactic acid production by lactic acid bacteria[J]. Applied Biochemistry and Biotechnology, 2021, 193(12): 4151-4171. DOI:10.1007/s12010-021-03672-z |
| [9] |
PETER SB, QIAO ZN, GODSPOWER HN, AJEJE SB, XU MJ, ZHANG X, YANG TW, RAO ZM. Biotechnological innovations and therapeutic application of Pediococcus and lactic acid bacteria: the next-generation microorganism[J]. Frontiers in Bioengineering and Biotechnology, 2022, 9: 802031. DOI:10.3389/fbioe.2021.802031 |
| [10] |
JAVED GA, ARSHAD N, MUNIR A, KHAN SY, RASHEED S, HUSSAIN I. Signature probiotic and pharmacological attributes of lactic acid bacteria isolated from human breast milk[J]. International Dairy Journal, 2022, 127: 105297. DOI:10.1016/j.idairyj.2021.105297 |
| [11] |
PRABHURAJESHWAR C, CHANDRAKANTH RK. Probiotic potential of Lactobacilli with antagonistic activity against pathogenic strains: an in vitro validation for the production of inhibitory substances[J]. Biomedical Journal, 2017, 40(5): 270-283. DOI:10.1016/j.bj.2017.06.008 |
| [12] |
LÜBECK M, LÜBECK PS. Application of lactic acid bacteria in green biorefineries[J]. FEMS Microbiology Letters, 2019, 366(3): fnz024. |
| [13] |
CAO SW, YU CH, LUO XQ, WEI S, JIANG SQ, DENG ZX, WANG YQ, HUANG LX, TANG CM, LI MZ, LI FF, WANG GL. Research progress on characteristics of Bacillus and its application in animal ecological breeding[J]. Chinese Journal of Veterinary Drug, 2021, 55(11): 77-85. (in Chinese) 曹树威, 余昌花, 罗鲜青, 魏莎, 蒋世强, 邓祝新, 王英群, 黄丽霞, 唐承明, 李美珍, 李芳芳, 王国利. 芽孢杆菌特性及其在畜牧生态养殖中应用研究进展[J]. 中国兽药杂志, 2021, 55(11): 77-85. |
| [14] |
ZHANG YR, CHEN YK, YU MN, LEI XY, WANG JJ, GAO YS, WANG QJ, MAHMOUD M, ZHANG DM. Research progress on effect of probiotic Bacillus on fish growth and disease resistance[J]. Fisheries Science, 2022, 41(2): 325-335. (in Chinese) 张宇柔, 陈玉珂, 于梦楠, 雷新雨, 王嘉婧, 高永生, 王秋举, MAHMOUD M, 张东鸣. 益生芽孢杆菌对鱼类生长与抗病力影响的研究进展[J]. 水产科学, 2022, 41(2): 325-335. |
| [15] |
YANG JJ, ZHAN K, ZHANG MH. Effects of the use of a combination of two Bacillus species on performance, egg quality, small intestinal mucosal morphology, and cecal microbiota profile in aging laying hens[J]. Probiotics and Antimicrobial Proteins, 2020, 12(1): 204-213. DOI:10.1007/s12602-019-09532-x |
| [16] |
HE YY, MAO CX, WEN H, CHEN ZY, LAI T, LI LY, LU W, WU HD. Influence of ad libitum feeding of piglets with Bacillus subtilis fermented liquid feed on gut flora, luminal contents and health[J]. Scientific Reports, 2017, 7: 44553. DOI:10.1038/srep44553 |
| [17] |
ZOU XY, ZHANG M, TU WJ, ZHANG Q, JIN ML, FANG RD, JIANG S. Bacillus subtilis inhibits intestinal inflammation and oxidative stress by regulating gut flora and related metabolites in laying hens[J]. Animal: an International Journal of Animal Bioscience, 2022, 16(3): 100474. DOI:10.1016/j.animal.2022.100474 |
| [18] |
CONTESINI FJ, MELO RR, SATO HH. An overview of Bacillus proteases: from production to application[J]. Critical Reviews in Biotechnology, 2018, 38(3): 321-334. DOI:10.1080/07388551.2017.1354354 |
| [19] |
HE X, DENG ZY, WANG F, ZHANG QL, LIN LB, DENG XY. Isolation and biological characterization of a bacteriophage infecting Shigella flexneri[J]. Microbiology China, 2021, 48(9): 3165-3175. (in Chinese) 何秀, 邓征宇, 王峰, 张棋麟, 林连兵, 邓先余. 一株福氏志贺氏菌噬菌体的分离鉴定及其生物学特性[J]. 微生物学通报, 2021, 48(9): 3165-3175. DOI:10.13344/j.microbiol.china.201179 |
| [20] |
SHI SQ, JIANG W, YUAN L, QI KZ, TU J, SONG XJ. Isolation, identification and biological characteristics analysis of four Bacillus strains[J]. Jiangsu Agricultural Sciences, 2018, 46(2): 112-115. (in Chinese) 石水琴, 蒋雯, 袁林, 祁克宗, 涂健, 宋祥军. 4株芽孢杆菌的分离鉴定与生物学特性分析[J]. 江苏农业科学, 2018, 46(2): 112-115. |
| [21] |
DU DX, ZHAO LM, JIA SX, DONG HX, LI W, LI YX, HE WL, CAO PH. Screening and identification of the amylase producing strain and research on its enzymatic characterization[J]. Feed Research, 2021, 44(19): 80-84. (in Chinese) 杜东晓, 赵龙妹, 贾少轩, 董惠心, 李旺, 李元晓, 何万领, 曹平华. 产淀粉酶菌株的筛选鉴定及酶学特性研究[J]. 饲料研究, 2021, 44(19): 80-84. |
| [22] |
CHEN SY, LAO YT, XIE M. Screening of cellulose degrading bacteria and optimization of culture conditions[J]. Wuyi Science Journal, 2021, 37(2): 127-136. (in Chinese) 陈诗瑶, 劳艳婷, 谢苗. 纤维素降解菌的筛选和培养条件的优化[J]. 武夷科学, 2021, 37(2): 127-136. |
| [23] |
XU YG, CUI LC, ZHAO LL, TANG LJ, XIA CL, LI YJ. Studies on the survival properties of recombinant Lactobacillus casei 393 in imitative gastrointestinal environments[J]. Chinese Journal of Microecology, 2006, 18(6): 424-426. (in Chinese) 徐义刚, 崔丽春, 赵丽丽, 唐丽杰, 夏春丽, 李一经. 重组干酪乳杆菌在模拟消化环境中生存性能的研究[J]. 中国微生态学杂志, 2006, 18(6): 424-426. |
| [24] |
XIN L, GUO BH, WU ZJ. Studies on the survival properties of three lactobacillus strains in imitative gastroenteric environments[J]. China Dairy Industry, 2005, 33(5): 15-17. (in Chinese) 辛羚, 郭本恒, 吴正钧. 3株乳杆菌在模拟消化环境中存活性能的研究[J]. 中国乳品工业, 2005, 33(5): 15-17. |
| [25] |
LIU DM, LI L, YANG XQ, LIANG SZ. Determination of the antimicrobial activity of probiotic by Oxford plate assay system[J]. Food Research and Development, 2006, 27(3): 110-111. (in Chinese) 刘冬梅, 李理, 杨晓泉, 梁世中. 用牛津杯法测定益生菌的抑菌活力[J]. 食品研究与开发, 2006, 27(3): 110-111. |
| [26] |
Performance Standards for Antimicrobial Susceptibility Testing, 26th edition: CLSI M100-S26[S]. Clinical And Laboratory Standards Institute.
|
| [27] |
BEZZAOUHA A, BOUAMRA A, AMMIMER A, BEN ABDELAZIZ A. Non-parametric tests on SPSS to compare two or more means on matched samples[J]. La Tunisie Medicale, 2020, 98(12): 932-941. |
| [28] |
MITTEER DR, GREER BD, RANDALL KR, BRIGGS AM. Further evaluation of teaching behavior technicians to input data and graph using GraphPad Prism[J]. Behavior Analysis: Research and Practice, 2020, 20(2): 81-93. DOI:10.1037/bar0000172 |
| [29] |
TIAN ZH, XU SG, DONG Y, HU HX, WANG W, DONG T, SUN A. Isolation, identification and biological characteristics of six Bacillus strains[J]. Jiangsu Agricultural Sciences, 2021, 49(13): 157-161. (in Chinese) 田照辉, 徐绍刚, 董颖, 胡红霞, 王巍, 东天, 孙爱. 6株芽孢杆菌的分离鉴定和生物学特性[J]. 江苏农业科学, 2021, 49(13): 157-161. |
| [30] |
LILLY DM, STILLWELL RH. Probiotics: growth- promoting factors produced by microorganisms[J]. Science, 1965, 147(3659): 747-748. |
| [31] |
MARTEAU P, MINEKUS M, HAVENAAR R, HUIS IN'T VELD JHJ. Survival of lactic acid bacteria in a dynamic model of the stomach and small intestine: validation and the effects of bile[J]. Journal of Dairy Science, 1997, 80(6): 1031-1037. |
| [32] |
WANG QL. Screening, characterization and application of Lactobacillus reuteri from pigs[D]. Lanzhou: Master's Thesis of Gansu Agricultural University, 2016 (in Chinese). 王巧丽. 猪源罗伊氏乳杆菌的筛选、特性研究及应用[D]. 兰州: 甘肃农业大学硕士学位论文, 2016. |
| [33] |
ZHANG Z, ZHENG RC, FANG QL, HUANG WJ. Isolation, identification and biological characteristics of probiotics from swine origin in Guangxi[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(6): 1921-1933. (in Chinese) 张在, 郑瑞程, 方庆励, 黄伟坚. 广西猪源益生菌的分离鉴定与生物学特性研究[J]. 中国畜牧兽医, 2020, 47(6): 1921-1933. |
| [34] |
ZHANG YL, YANG HJ, LI CC, ZHANG FF, MA CH. Isolation and identification of lactic acid bacterium strain from Broussonetia papyrifera silage[J]. Acta Agrestia Sinica, 2022, 30(1): 38-45. (in Chinese) 张玉琳, 杨寒珺, 李超程, 张凡凡, 马春晖. 杂交构树青贮饲料中优良乳酸菌的分离与鉴定[J]. 草地学报, 2022, 30(1): 38-45. |
| [35] |
WANG WL, GÄNZLE M. Toward rational selection criteria for selection of probiotics in pigs[J]. Advances in Applied Microbiology, 2019, 83-112. |
| [36] |
VÁZQUEZ JA, GONZÁLEZ MP, MURADO MA. Effects of lactic acid bacteria cultures on pathogenic microbiota from fish[J]. Aquaculture, 2005, 245(1/2/3/4): 149-161. |
| [37] |
CHEN GF, LIU Y, SHAN CQ, FENG LL, SONG F, JIANG GT. Biological characteristics of Propionibacterium freudenreichii and antagonism tests of five probiotics[J]. China Brewing, 2018, 37(1): 69-73. (in Chinese) 陈桂芳, 刘艳, 单春乔, 冯柳柳, 宋凡, 江国托. 费氏丙酸杆菌生物学特性及与5株益生菌拮抗性试验研究[J]. 中国酿造, 2018, 37(1): 69-73. |
| [38] |
RAMOS CL, THORSEN L, SCHWAN RF, JESPERSEN L. Strain-specific probiotics properties of Lactobacillus fermentum, Lactobacillus plantarum and Lactobacillus brevis isolates from Brazilian food products[J]. Food Microbiology, 2013, 36(1): 22-29. |
| [39] |
HUANG ZS, REN H, HUANG WJ, LIU SY, XIE ZS, ZHONG XF, HUANG GD. In vitro safety evaluation of Bacillus velezensis from glutinous rice wine[J]. Food and Fermentation Industries, 2022, 48(18): 95-100. (in Chinese) 黄芷珊, 任红, 黄炜健, 刘少韵, 谢卓珊, 钟先锋, 黄桂东. 糯米酒源贝莱斯芽孢杆菌的体外安全性评价[J]. 食品与发酵工业, 2022, 48(18): 95-100. |
| [40] |
SANDERS ME, AKKERMANS LMA, HALLER D, HAMMERMAN C, HEIMBACH JT, HÖRMANNSPERGER G, HUYS G. Safety assessment of probiotics for human use[J]. Gut Microbes, 2010, 1(3): 164-185. |
| [41] |
JIANG YH, XIN WG, ZHANG QL, DENG XY, WANG F, LIN LB. Isolation and identification of fungi from mildewed feed corn and study on anti-mildew and antifungal effects of lactobacillin[J]. Acta Agriculturae Zhejiangensis, 2021, 33(7): 1283-1291. (in Chinese) 江宇航, 辛维岗, 张棋麟, 邓先余, 王峰, 林连兵. 霉变饲用玉米真菌的分离、鉴定与乳酸菌素对其的防霉抑菌效果[J]. 浙江农业学报, 2021, 33(7): 1283-1291. |
| [42] |
LUO Q, ZHANG M, LIU Q, LUO F. Evaluation of in vitro probiotic and safety properties of Enterococcus faecium SC-Y112 producing bacteriocin[J]. Food Science, 2021, 42(11): 154-160. (in Chinese) 罗强, 张明, 刘巧, 罗璠. 产细菌素屎肠球菌SC-Y112的体外益生性及安全性评价[J]. 食品科学, 2021, 42(11): 154-160. |
 2024, Vol. 51
2024, Vol. 51




