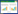扩展功能
文章信息
- 胡冉, 刘梦娇, 许小含, 何晓青, 金一
- HU Ran, LIU Mengjiao, XU Xiaohan, HE Xiaoqing, JIN Yi
- 噬菌体鸡尾酒对猕猴桃溃疡病的田间防治效果及叶际细菌群落结构的影响
- Phage cocktail inhibits bacterial canker of kiwifruit in the field and affects the phyllospheric bacterial community
- 微生物学通报, 2023, 50(9): 3866-3880
- Microbiology China, 2023, 50(9): 3866-3880
- DOI: 10.13344/j.microbiol.china.221241
-
文章历史
- 收稿日期: 2022-12-21
- 接受日期: 2023-03-03
- 网络首发日期: 2023-04-10
猕猴桃细菌性溃疡病由病原菌丁香假单胞菌猕猴桃致病变种(Pseudomonas syringae pv. actinidiae, Psa)引起[1],具有发病迅猛、致病性强、难以根除等特点,在全球范围内严重威胁猕猴桃种植产业;Psa主要危害植株的枝干及叶片等,导致果实畸形、果味酸涩甚至使植株死亡;目前国外防治该疫病主要使用铜制剂农药及抗生素[2],但是铜制剂在杀灭病原菌的过程中也直接作用于植株的根际与叶际微生物,对生物群落的结构造成影响[3]。铜制剂和抗生素的过度使用会导致病菌产生耐药性[4],残留的铜制剂也会影响产品品质并威胁人类健康[5]。
噬菌体是一类细菌病毒的总称,可特异性裂解宿主菌,但对非靶向的细菌和动植物无毒[6],不会破坏微生物的多样性,可以满足绿色无公害农业要求。利用这一特性筛选出专性侵染病原菌的烈性噬菌体制成生物制剂可以控制相应的细菌疾病[7]。大多数噬菌体的宿主谱较为狭窄,只能感染一个或者几个菌株,所以单一噬菌体制剂的使用会限制防治效果,且容易导致抗性菌的产生,而使用多种不同的噬菌体混合配制成噬菌体鸡尾酒可以有效解决细菌的抗性突变及噬菌体宿主谱范围窄的问题[8]。
研究表明,合适的噬菌体鸡尾酒相较于单独噬菌体,可以更好地减少细菌性植物病的发生,并且可以减少病原菌对植物根际微生物群落的破坏,使微生物群落基本恢复到病原菌侵染前的水平[9]。目前已有一些使用噬菌体防治Psa的报道,如短尾病毒科的4株噬菌体在温室条件下均对Psa表现出良好的抑制效果[10];肌病毒科的噬菌体PPPL-1也可以有效控制猕猴桃细菌溃疡病的发展[11]。植物体内体外试验表明phi6噬菌体可以有效抑制猕猴桃溃疡病的发生[12]。噬菌体对病原菌的作用可以间接改变根际微环境中菌群的组成和多样性,丰富对病原菌具有高度拮抗作用的细菌类群,从而抑制病原菌的生长[9]。然而关于噬菌体对叶际微生物群影响的研究相对较少。
为探究噬菌体鸡尾酒对猕猴桃溃疡病的田间防治效果和对植株叶际微生物群落结构的影响,本研究以两种专性侵染Psa的烈性噬菌体组成噬菌体鸡尾酒,比较其与传统铜制剂对猕猴桃溃疡病的田间防治效果,结合高通量测序分析噬菌体鸡尾酒对猕猴桃叶际微生态的影响,以期有助于推动基于噬菌体鸡尾酒的猕猴桃溃疡病生物防治技术研发,为噬菌体疗法在植物细菌性病害中的应用提供重要理论基础与技术支撑。
1 材料与方法 1.1 材料所用病原菌为本试验室前期分离到的丁香假单胞菌猕猴桃致病变种PsaBJ530[13],噬菌体为实验室分离到的专性侵染Psa的烈性噬菌体PHB09 (图 1A)[13]和PHR 10a (图 1B)[14]。PHB09为Caudoviricetes的dsDNA噬菌体,PHR 10a是Siphoviridae的phi6噬菌体。两株噬菌体均在前期试验中表现出良好的Psa抑制效果。供试猕猴桃品种为美味猕猴桃,均为近2年内未发病的5年以上成年植株。所用铜制剂为氢铜王铜悬浮剂(氢氧化铜含量16.5%,王铜含量17.5%)。
|
| 图 1 噬菌体电镜照片及猕猴桃溃疡病生物防治田间试验 Figure 1 Morphology characteristics of bacteriophages and biocontrol experiment against kiwi canker disease in field. A:Psa噬菌体PHB09的电镜照片. B:Psa噬菌体PHR 10a的电镜照片. C:喷洒噬菌体鸡尾酒防治猕猴桃溃疡病. D:感染Psa后猕猴桃枝条发生溃烂 A: The morphology characteristics of phages PHB09. B: The morphology characteristics of phages PHR 10a. C: Spray phage cocktail to prevent Psa-induced bacterial canker of kiwifruit. D: Cankers with exudates on Psa-infected kiwifruit branches. |
|
|
TSB培养基参考文献[13]配制;琼脂糖,Biowest公司;50×TAE,福州飞净生物科技有限公司;植物多糖多酚基因组DNA抽提试剂盒,天根生化科技(北京)有限公司;其余试剂均为国产分析纯。0.22 μm滤器,Thermo Fisher Scientific公司;全温振荡培养箱,苏州培英实验设备有限公司;电泳仪,北京六一生物科技有限公司;Illumina MiSeq测序平台,北京诺禾致源科技股份有限公司。
1.2 方法 1.2.1 菌悬液与噬菌体鸡尾酒的制备将菌株PsaBJ530接种于胰蛋白胨大豆肉汤液体培养基中,25 ℃、180 r/min培养过夜至OD600约为0.4,用平板菌落计数法计数并调整菌悬液浓度为107 CFU/mL。将噬菌体PHB09、PHR10a接种于对数期(OD600约为0.4)的指示菌PsaBJ530菌液中,25 ℃、200 r/min振荡培养12 h后于10 000 r/min离心1 min,取上清经过0.22 μm的滤器过滤除菌后即得噬菌体原液,使用无菌TSB对噬菌体原液进行10倍倍比梯度稀释后采用双层平板法纯化并测定噬菌体效价。两种噬菌体稀释至109 PFU/mL,以1:1 (体积比)混合均匀制成噬菌体鸡尾酒。
1.2.2 田间试验设计猕猴桃果园内设置4个试验分组:健康组、Psa感染对照组(以下简称Psa组)、噬菌体鸡尾酒治疗组(以下简称噬菌体组)、铜制剂治疗组(以下简称铜制剂组)。每组20株猕猴桃,各组间隔100 m以上。除健康组外,其他组在11月初进行人工感染,于猕猴桃主干使用毛刷涂抹Psa (107 CFU/mL),每株约涂抹50 mL。人工感染3 d后按组喷洒一次噬菌体鸡尾酒(蒸馏水稀释至108 PFU/mL,每株约500 mL) (图 1C)或铜制剂农药(0.5 mL/株,稀释后喷洒500 mL/株),Psa组和健康组喷施相同体积蒸馏水;12月下旬剪枝后再重复喷药一次。于次年4月统计出现发病溃烂植株(图 1D)数量,计算发病率与有效率。植株发病率(%)=(发病株数/试验总株数)×100;有效率(%)=(对照组发病数–处理组发病)/对照组发病数×100。
1.2.3 猕猴桃叶际内生菌DNA提取每组选取5株猕猴桃取样提取茎内叶际细菌DNA,Psa组选择发病溃烂植株剪枝,另外3组均选择未发现溃疡症状的植株剪枝。采集到的枝条使用无菌塑封袋封装运输到实验室,于–80 ℃保存,等待后续处理。枝条样品经75%酒精对表面消毒后使用无菌水冲洗2–3次。刮去枝条表皮后切成小段放入研钵中,添加液氮研磨破碎并用植物多糖多酚基因组DNA抽提试剂盒提取茎内叶际细菌总基因组DNA。使用1%的琼脂糖凝胶进行电泳检验DNA质量。
1.2.4 16S rRNA基因序列扩增及测序提取的基因组通过Illumina MiSeq平台扩增16S rRNA基因V3–V4区,扩增引物为338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)。PCR反应体系(25 μL):DNA样品(15 ng/μL) 2 μL,Forward primer (5 μmol/L) 1 μL,Reverse primer 5 (μmol/L) 1 μL,BSA (2 ng/μL) 3 μL,2×Taq Plus Master Mix 12.5 μL,ddH2O补足25 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 60 s,30次循环;72 ℃ 7 min;4 ℃保存。使用LimA软件依据barcode序列区分数据并使用cutadapt识别去除引物及嵌合体,得到Clean Data。利用UPARSE将得到的序列以97%的一致性标准聚类成OTU,并和相应的细菌物种注释结合,得到每个样品中细菌OTU和物种注释等数据用作后续分析。
1.2.5 数据分析所有的数据处理与分析都在R语言或QIIME中运行。α多样性从QIIME计算得出。使用R语言“Vegan”包进行基于样本间距离指数的主坐标分析(principal coordinates analysis, PCoA)计算β多样性。使用R语言的“ggplot2”包绘制科水平下不同物种的分类水平可视化图。LEfSe分析可识别不同分组的生物标记物种(biomarker)。使用R语言“picante”包计算各组的Spearman相关系数,并在Gephi0.9.7上进行共现网络可视化[15],同时计算相关网络特征值。将网络图中紧密中心性的值(closeness centrality)和度(degree)都较高的节点(closeness centrality > 0.55, degree > 32)视为中心节点微生物[16]。基于16S rRNA基因序列于联川生物云平台(https://www.omicstudio.cn/tool)预测样品内生菌群的代谢功能并使用“ggplot2”包于R语言中可视化。
2 结果与分析 2.1 噬菌体鸡尾酒防控猕猴桃溃疡病的田间效果为了探究噬菌体鸡尾酒防控猕猴桃溃疡病的实际应用效果,本研究进行了田间试验,于次年4月统计出现发病溃烂的株数。Psa组16株出现溃烂发病症状,噬菌体组为4株,铜制剂组为8株。发病率结果表明,相较于Psa组(80%),噬菌体组(20%)和铜制剂组(40%)都有效降低了疾病发病率,而噬菌体组的发病率相对铜制剂组更低。计算2个试验组的有效率,发现噬菌体组(75%)高于铜制剂组(50%) (表 1)。两组数据都说明噬菌体鸡尾酒能显著降低猕猴桃溃疡病的发病程度,并且效果优于铜制剂。
| 分组 Groups |
总株数 Total number |
发病株数 Diseased number |
发病率 Disease incidence (%) |
有效率 Effective rate (%) |
| 健康组Healthy | 20 | 0 | 0 | – |
| Psa组Psa | 20 | 16 | 80 | – |
| 噬菌体组Phage cocktail | 20 | 4 | 20 | 75 |
| 铜制剂组Copper compound | 20 | 8 | 40 | 50 |
| –:无法计算有效率 –: No effective rate can be calculated. |
||||
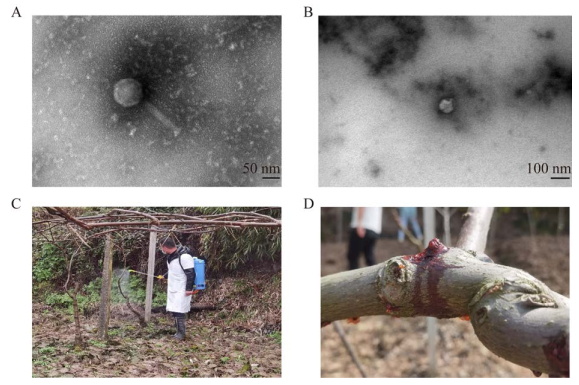
为探究噬菌体鸡尾酒防控猕猴桃溃疡病的微生态机制及对猕猴桃叶际细菌群落结构的影响,本研究利用高通量测序技术分析比较了不同分组处理对猕猴桃叶际细菌群落的影响。经过质控并去除嵌合体序列后,共获得用于后续分析的优质16S rRNA基因序列834 857条。样品文库覆盖率均大于98%,表明测序深度足够,能较好地反映样本真实情况。各分组的Shannon指数表明健康组的微生物多样性最高,噬菌体组次之,铜制剂组仅高于多样性最低的Psa组。ACE指数的结果表明健康组与噬菌体组的物种总数大于Psa组与铜制剂组。通过Wilcoxon秩和检验发现健康组与噬菌体组的Shannon指数无明显差异(P > 0.05),而健康组与铜制剂组的Shannon指数差异显著(P=0.001) (图 2A)。健康组的ACE指数显著高于噬菌体组(P=0.029)与铜制剂组(P=0.017) (图 2B)。通过Shannon指数与ACE指数分析可以确认,健康组的细菌群落丰富度最高,噬菌体组次之,铜制剂组低于噬菌体组,Psa组群落丰富度最低。
|
| 图 2 猕猴桃叶际内生菌群的微生物多样性与微生物群落结构 Figure 2 Community structure and microbial diversity of kiwifruit phyllosphere endophytic microbiome. A:猕猴桃叶际内生细菌群落的Shannon指数. B:猕猴桃叶际内生细菌群落的ACE指数. C:猕猴桃叶际内生细菌群落的β多样性. D:猕猴桃叶际内生细菌群落在科水平的分布组成. 星号表示显著差异(*P < 0.05;**P < 0.01),NS表示无统计学意义 A: Shannon index of kiwifruit phyllosphere endophytic microbiome. B: ACE index of kiwifruit phyllosphere endophytic microbiome. C: Beta diversity of kiwifruit phyllosphere endophytic microbiome. D: Community composition of kiwifruit phyllosphere endophytic microbiome in the family level. Asterisks denote significant differences (*P < 0.05; **P < 0.01) and NS denotes no statistical significance. |
|
|
PCoA可以比较不同分组在物种组成之间的差异。一般情况下,同组的样品聚集在一起,说明这些样品相似性较高,细菌群落结构有一定的相似性。结果表明,Psa组与铜制剂组在PCoA图中相对聚集,群落组成更为相似;而噬菌体组的分布远离铜制剂组和Psa组,更为接近健康组,说明噬菌体组相比铜制剂组及Psa组群落组成差距较大,猕猴桃叶际内生细菌群落结构受噬菌体鸡尾酒治疗的影响显著。噬菌体鸡尾酒处理可显著改变猕猴桃叶际细菌群落的β多样性,使其相对于铜制剂组更为接近健康组的群落组成(图 2C)。
在4个分组的样品中共发现15个主要菌科(图 2D),健康组的优势菌科为小单胞菌科(Promicromonosporaceae, 13.30%)、糖霉菌科(Glycomycetaceae, 13.20%)和unidentified_ Chloroplast (12.09%);噬菌体组的优势菌科为肠杆菌科(Enterobacteriaceae, 22.33%)、unidentified_ Chloroplast (15.90%)和紫单胞菌科(Dysgonomonadaceae, 8.52%);铜制剂组的优势菌科为肠杆菌科(54.51%)、鞘氨醇杆菌科(Sphingobacteriaceae, 8.32%)和溶果胶杆菌科(Pectobacteriaceae, 5.44%);而Psa组的优势菌科依然有肠杆菌科(41.44%)、紫单胞菌科(19.88%)和假单胞菌科(Pseudomonadaceae, 8.41%)。肠杆菌科的相对丰度在不同分组中差别较为明显,健康组的肠杆菌科相对丰度较低,只有5.37%,噬菌体组的肠杆菌科相对丰度为22.33%,而Psa组和铜制剂组的肠杆菌科相对丰度均较高(41.44%和54.51%)。猕猴桃溃疡病的病原菌所在的假单胞菌科在健康组、噬菌体组、铜制剂组和Psa组中的相对丰度分别为1.12%、3.16%、4.58%和8.41% (表 2)。与Psa组相比,噬菌体鸡尾酒和铜制剂的施用显著降低了假单胞菌科的相对丰度(P < 0.05)。
| 科Family | 健康组 Healthy (%) |
Psa组 Psa (%) |
噬菌体组 Phage cocktail (%) |
铜制剂组 Copper compound (%) |
平均相对丰度 Mean relative abundance (%) |
| 肠杆菌科 Enterobacteriaceae |
5.37±0.91d | 41.44±8.34b | 22.33±5.45c | 54.51±14.01a | 30.91 |
| 紫单胞菌科 Dysgonomonadaceae |
0.67±0.05c | 19.88±3.28a | 8.52±2.52b | 5.38±1.61bc | 8.61 |
| 鞘氨醇杆菌科 Sphingobacteriaceae |
0.41±0.14c | 5.89±1.16ab | 3.47±0.24b | 8.32±1.23a | 4.52 |
| 假单胞菌科 Pseudomonadaceae |
1.12±0.28b | 8.41±1.15a | 3.16±0.28b | 4.58±0.19ab | 4.32 |
| 糖霉菌科 Glycomycetaceae |
13.20±4.16a | 0.22±0.09b | 2.08±0.37b | 0.22±0.04b | 3.93 |
| 小单胞菌科 Promicromonosporaceae |
13.30±4.04a | 0.23±0.10b | 1.26±0.08b | 0.30±0.03b | 3.77 |
| 数据表示形式均为平均值±标准误差. 不同小写字母代表同一科在不同处理组间差异显著(P < 0.05) The data representations are mean±standard deviation. Different lowercase letters represent significant difference in same family between 4 groups (P < 0.05). |
|||||
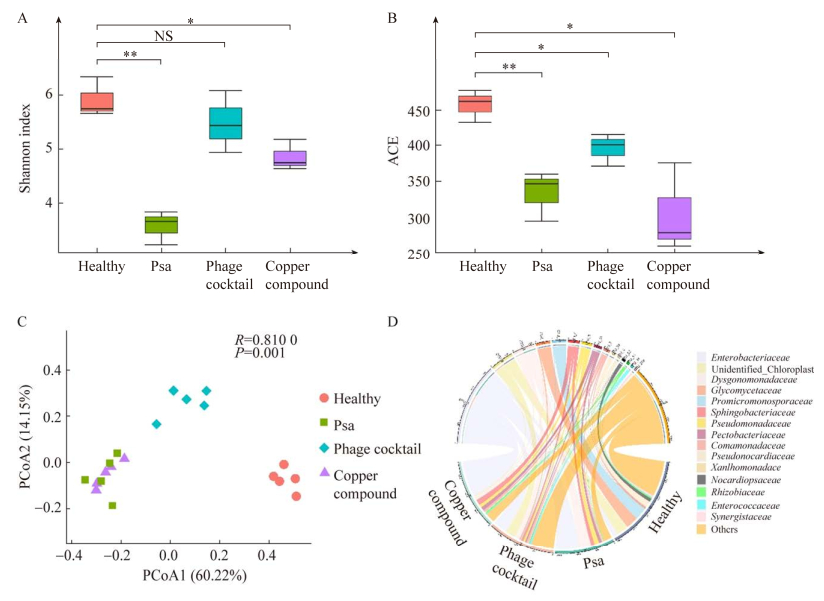
LEfSe分析中发现Psa组分别与噬菌体组和铜制剂组两两对比时,在Kruskal-Wallis秩和检验的P < 0.05条件下未发现有显著差异物种。而Psa组与健康组、铜制剂组与噬菌体组两两对比时,发现有较多LDA score (log10) > 3的显著差异物种。结果显示(图 3),噬菌体组和铜制剂组在细菌科水平上有显著差异的菌共36种。其中噬菌体组的显著差异物种为糖霉菌科、小单胞菌科、unidentified_Chloroplast、假诺卡氏菌科(Pseudonocardiaceae)、链霉菌科(Streptomycetaceae)和根瘤菌科(Rhizobiaceae)等;铜制剂组的显著差异物种为肠杆菌科、紫单胞菌科、毛螺菌科(Lachnospiraceae)、溶果胶杆菌科、红杆菌科(Rhodobacteraceae)、耶尔森氏菌科(Yersiniaceae)、假单胞菌科和黄杆菌科(Xanthobacteraceae)。健康组与Psa组在细菌科水平上有显著差异的菌共20种。健康组的显著差异物种为小单胞菌科、unidentified_Chloroplast、糖霉菌科、假诺卡氏菌科、根瘤菌科等;Psa组的显著差异物种为假单胞菌科、肠杆菌科、毛螺菌科、黄杆菌科、拜叶林克氏菌科(Beijerinckiaceae)、类诺卡氏菌科(Nocardioidaceae)等。
|
| 图 3 猕猴桃叶际内生细菌群落的LEfSe分析 Figure 3 LEfSe of kiwifruit phyllosphere endophytic microbiome. A:噬菌体组与铜制剂组的LEfSe分析. B:健康组与Psa组的LEfSe分析. LEfSe分析中只保留了LDA score > 3的物种,LEfSe分析柱状图按照分组着色 A: LEfSe between phage cocktail and copper compound. B: LEfSe between Healthy and Psa. Only bacterial groups with a liner discriminant analysis (LDA) score > 3 were displayed. The bars are colored by group. |
|
|
由于施用的药剂不同,各分组处理的微生物群落存在明显的非随机共存模式。使用共现网络来探索猕猴桃枝条中共存的微生物之间直接或间接的相互作用可以更好地表现微生物群落中的分类学特征,有助于确定特定微生物所占据的功能角色或环境生态位。对4个分组分别绘制OTU水平的共现网络图,计算网络特征值并进行比较。健康分组的共现网络图中71个节点间有609条强相互作用连接(r > 0.7, P < 0.05),Psa组则有70个节点与579条强相互作用连接。噬菌体组则由562条相互作用将69个节点连接起来。铜制剂组的强相互作用有534条,节点有68个。Psa组的平均路径长度(average path length, APL)最长,为2.526,健康组则最短为2.387;平均聚类系数(clustering coefficient, CC)健康组与噬菌体组较高,分别为0.69与0.674,Psa组与铜制剂组的较低,分别为0.657与0.621。模块化值(modularity, MD)分别为健康组0.478、噬菌体组0.442、铜制剂组0.441、Psa组0.427,均大于0.4,说明4组共现网络均有明显模块结构。健康组网络图的平均度(average degree, AD)依然最高,为17.155,噬菌体组为16.543,而铜制剂组则最低,为16.106 (表 3)。通过网络特征值结果中的模块化值、平均聚类系数与平均度等网络特征值可以了解相应群落的结构稳定性与复杂性等[17]。结果表明,健康组猕猴桃的叶际内生细菌群落的共现网络的结构稳定性最高,噬菌体组次之。噬菌体组的平均聚类系数与平均度相比铜制剂组更高,说明相较于铜制剂组,噬菌体组群落间的联系更加紧密,网络结构相对更加复杂。
| 分组 Groups |
平均路径长度 Average path length |
平均聚类系数 Clustering coefficient |
模块化值 Modularity |
图密度 Graph density |
直径 Diameter |
平均度 Average degree |
| 健康组Healthy | 2.387 | 0.690 | 0.478 | 0.245 | 6 | 17.155 |
| Psa组Psa | 2.526 | 0.657 | 0.427 | 0.240 | 7 | 16.290 |
| 噬菌体组 Phage cocktail |
2.465 | 0.674 | 0.442 | 0.240 | 6 | 16.543 |
| 铜制剂组 Copper compound |
2.484 | 0.621 | 0.441 | 0.234 | 6 | 16.106 |
将4个分组的节点进行模块化分析,网络节点之间相互作用明显强于其他的则可归为相同模块,所有节点可以分为5个模块(图 4)。模块Ⅰ的节点主要包括微杆菌科、假诺卡氏菌科和小单胞菌科;模块Ⅱ的节点主要有丛毛单胞菌科(Comamonadaceae)、微杆菌科和拜叶林克氏菌科(Beijerinckiaceae);模块Ⅲ的节点主要有固氮螺菌科(Azospirillaceae)、伯克霍尔德菌科(Burkholderiaceae)和根瘤菌科(Rhizobiaceae);模块Ⅳ的节点为乳酸杆菌科(Lactobacillaceae)和葡萄球菌科(Staphylococcaceae)。模块V的节点主要为肠杆菌科和鞘氨醇单胞菌科(Sphingomonas)。根据共现网络中的紧密中心性的值(closeness centrality)与节点的度(degree)对节点进行统计分类,发现有4个OTU为4个分组中共同的中心节点微生物(closeness centrality > 0.55, degree > 32)。
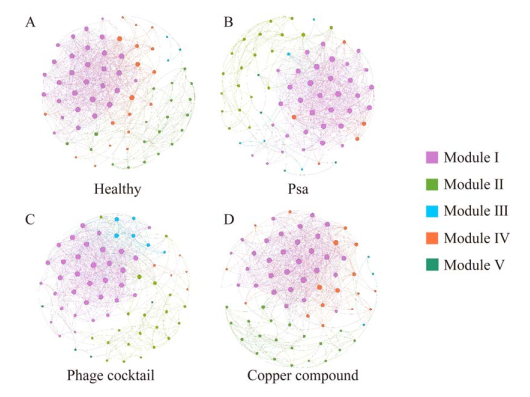
|
| 图 4 猕猴桃枝条内生细菌群落的模块化共现网络 Figure 4 Co-occurrence network of kiwifruit phyllosphere endophytic microbiome. A:健康组. B:Psa组. C:噬菌体组. D:铜制剂组. 模块化共现网络的节点按照模块分类着色 A: Healthy. B: Psa. C: Phage cocktail. D: Copper compound. The nodes of the co-occurrence network are colored by modularity class. |
|
|
四个分组中共同的中心节点微生物分别为胺杆菌属(Amnibacterium)、假诺卡氏菌属(Pseudonocardia)、甲基杆菌属(Methylobacterium)和小单胞菌属(Promicromonospora)。不同分组中也有各自的特异中心节点微生物,如健康组中的互养菌科为该分组特有的中心节点微生物。鞘氨醇单胞菌属为噬菌体组的特有中心节点微生物,铜制剂组和Psa组的特有中心节点微生物分别为链霉菌属(Streptomyces)和肠杆菌科(表 4)。中心节点微生物的生命活动与代谢产物会对其他微生物产生较强的影响[18],在维持网络结构与互作功能中,这些微生物会发挥更加重要的作用[19]。
| OTU_ID | Phylum | Class | Order | Family | Genus | Groups |
| OTU_33 | Actinobacteria | Unidentified | Micrococcales | Microbacteriaceae | Amnibacterium | All |
| OTU_35 | Actinobacteria | Unidentified | Pseudonocardiales | Pseudonocardiaceae | Pseudonocardia | All |
| OTU_106 | Proteobacteria | Alphaproteobacteria | Rhizobiales | Beijerinckiaceae | Methylobacterium | All |
| OTU_12 | Actinobacteria | Unidentified | Micrococcales | Promicromonosporaceae | Promicromonospora | All |
| OTU_372 | Synergistota | Synergistia | Synergistales | Synergistaceae | Healthy | |
| OTU_42 | Proteobacteria | Alphaproteobacteria | Sphingomonadales | Sphingomonadaceae | Sphingomonas | Phage cocktail |
| OTU_102 | Actinobacteria | Unidentified | Streptomycetales | Streptomycetaceae | Streptomyces | Copper compound |
| OTU_604 | Proteobacteria | Gammaproteobacteria | Enterobacterales | Enterobacteriaceae | Psa |
Tax4Fun方法可以根据与某个功能过程相关的基因丰度情况预测出不同层次的KEGG Pathways的基因富集结果[20]。对猕猴桃枝条样本的菌群进行KEGG功能预测,结果发现,在KEGG数据库通路注释level 1水平上,主要功能基因家族与代谢(metabolism)、遗传信息加工处理(genetic information processing)、人类疾病(human diseases)、有机系统(organismal systems)、环境信息处理(environmental information processing)和细胞过程(cellular processes)这6个方面有关(图 5)。在level 2水平上共得到30个预测功能。各组样本中预测功能相对丰度排名前10的有膜转运(membrane transport)、氨基酸代谢(amino acid metabolism)、复制和修复(replication and repair)、能量代谢(energy metabolism)、翻译(translation)、辅助因子和维生素代谢(metabolism of cofactors and vitamins)、细胞过程和信号(cellular processes and signaling)、核酸代谢(nucleotide metabolism)、细胞运动(cell motility)、脂质代谢(lipid metabolism)。在健康组和噬菌体组中,氨基酸代谢、能量代谢、脂质代谢、异源生物降解和代谢等基因功能丰度显著高于Psa组和铜制剂组(P < 0.05)。聚糖生物合成与代谢(glycan biosynthesis and metabolism)、膜转运、细胞过程和信号等基因丰度显著低于Psa组与铜制剂组(P < 0.05)。
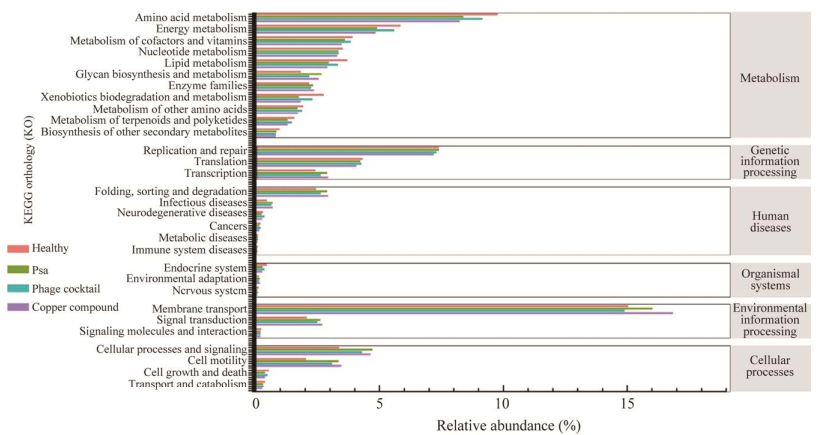
|
| 图 5 Level 2水平的Tax4Fun基因功能预测 Figure 5 The Tax4Fun gene function prediction (level 2). |
|
|
由Psa引起的细菌性溃疡病对猕猴桃的生产造成了严重的经济损失。本实验室在前期工作中分离到了多株特异性裂解Psa的噬菌体,这些噬菌体在体内外均表现出良好的Psa防治效果。但关于噬菌体鸡尾酒在环境更加复杂的田间防治Psa的研究相对欠缺。本研究使用了实验室前期分离到的2株Psa噬菌体PHB09与PHR 10a,这2株噬菌体在体外与组培苗试验中对Psa的控制效果较为优良[21]。使用这2株噬菌体制成噬菌体鸡尾酒防治猕猴桃溃疡病,进一步比较了田间条件下噬菌体鸡尾酒和传统铜制剂对猕猴桃溃疡病的防控效果,及其对猕猴桃枝条内生细菌微生态的影响。结果表明,噬菌体鸡尾酒制剂与铜制剂都可以有效降低田间条件下猕猴桃溃疡病的发病率,并且噬菌体鸡尾酒的防治效果优于铜制剂。噬菌体鸡尾酒在田间防控猕猴桃溃疡病的综合效果优于传统铜制剂,与已有报道结果吻合[9, 11]。噬菌体鸡尾酒具有优秀的应用潜力,满足当代提倡的绿色可持续农业需求,丰富了防控猕猴桃溃疡病的生防策略,有助于相关应用产品的开发优化和产业升级。
3.2 噬菌体鸡尾酒对叶际细菌群落组成和结构的影响微生物多样性在维持环境生态系统的稳定性和生态过程中起着至关重要的作用[9]。研究发现感染猕猴桃溃疡病后,猕猴桃枝条内生细菌的α多样性显著低于健康枝条。溃疡病菌的侵入或者与其他细菌的相互作用可能会影响原本健康的内生群落组成,降低微环境中的群落多样性[22]。噬菌体组的α多样性指数高于铜制剂组,并且Shannon指数与健康组无显著差异。噬菌体组的β多样性分布远离Psa组和铜制剂组,均说明噬菌体鸡尾酒处理可显著改变猕猴桃叶际细菌群落的α与β多样性,一定程度上增加了微环境群落丰富度,恢复群落多样性,使微生物群落组成相较于铜制剂处理更为接近未感病的健康状态。假单胞菌科在Psa组、铜制剂组、噬菌体组和健康组中的相对丰度依次递减,分别为8.41%、4.58%、3.16%和1.12%。可以发现噬菌体与铜制剂均显著降低了假单胞菌科的相对丰度,且噬菌体抑制假单胞菌科的效果相较铜制剂更好。假单胞菌科包含许多植物条件致病菌,如报道较多的丁香假单胞菌(P. syringae)及其多种致病变种可对多种寄主作物造成危害。丁香假单胞菌番茄致病变种(P. syringae pv. Tomato, Pst)作为番茄细菌性叶斑病的病原菌,严重影响番茄植株的生长发育和果实形成,导致番茄减产[23]。导致猕猴桃细菌性溃疡病的Psa同样为假单胞菌科的细菌,Psa主要通过Ⅲ型分泌系统将多种效应蛋白转入植物细胞,导致病菌侵染和致病[24],引起猕猴桃减产甚至整株死亡。Psa组和铜制剂组的肠杆菌科相对丰度均明显高于健康组与噬菌体组,肠杆菌科的细菌作为植物条件致病菌已有较多报道,例如:阴沟肠杆菌(Enterobacter cloacae)会与青枯雷尔氏菌(Ralstonia solanacearum)共同引发姜枯萎病[25];产ACC脱氨酶的重氮营养型肠杆菌株EN-21会显著降低甘蔗脯氨酸、丙二醛和钠离子的积累,还会抑制乙烯的释放[26]等,从而抑制宿主植物的某些代谢过程。这可能说明某些肠杆菌科物种的富集与猕猴桃溃疡病的病程发展有所联系。放线菌小单胞菌科作为健康组的相对丰度优势菌科,次级代谢产物丰富,小单胞菌MM18可产生植物激素IAA和赤霉素促进植物的萌发生长,增强植物对水分的吸收[27],部分小单孢菌科放线菌能够通过激活系统获得性抗药性或茉莉酸或乙烯中的关键基因,作为生物防治剂在植物体外和体内抑制多种病原体[28],因此,一些小单胞菌科放线菌既可产生植物激素促进宿主生长,又能分泌活性次级代谢产物抵御植物病原菌,可能在猕猴桃保持健康状态的过程中发挥了作用。铜制剂组的相对丰度优势菌科鞘氨醇杆菌科含有相对高浓度的鞘脂类,对各种微生物来源的抗生素具有抗药性,这是鞘氨醇杆菌适应极端环境的重要保障[29],某些鞘氨醇杆菌可在重金属离子浓度较高的环境中存在,并吸附螯合土壤中的重金属,降低重金属的生物有效性、移动性以阻止重金属进入食物链从而达成微生物修复的作用[30],而鞘氨醇杆菌在铜制剂组中的富集可能为高浓度铜离子筛选导致,鞘氨醇杆菌的微生物修复作用也可能在铜制剂治疗猕猴桃溃疡病过程中产生影响。LEfSe分析中发现虽然Psa组与噬菌体组、铜制剂组对比的差异物种不显著,但是噬菌体组与铜制剂组对比分析发现显著差异物种较多。结合田间防控结果与多样性分析,噬菌体鸡尾酒在田间防控猕猴桃溃疡病的综合效果优于铜制剂,还可以避免铜制剂中重金属离子的污染,符合绿色无公害农业要求。噬菌体鸡尾酒处理后微环境群落丰富度增加,群落多样性恢复,微生物群落组成相较于铜制剂处理更为接近未感染的健康状态。
3.3 猕猴桃叶际细菌群落共现网络分析物种共现性网络主要反映物种在环境中的共存关系,在探索一定环境中物种之间的互作关系发挥重要作用[31]。对细菌群落网络的研究可以确定环境内微生物的生态位及相互作用[32-33]。4个分组的共现网络主要分为5个模块,将模块节点的度和紧密中心值都相对较高的节点作为中心节点,中心节点微生物的丰度变化会影响微生物群落的结构组成与多样性,丰度较低时可影响群落的联络与传递功能[34]。鞘氨醇单胞菌科作为噬菌体组的特有中心节点微生物,可以降解常用农药中的氯乙酰苯胺类成分,减少农药残留物的影响[35]。另外,该科微生物合成的鞘氨醇脂是植物细胞膜中的重要成分之一[36],噬菌体组中该科微生物的富集可能参与了被病原菌破坏的细胞组织修复,进而改善猕猴桃叶际群落微生态,提高群落多样性与稳定性。噬菌体直接杀死了病原体的同时筛选了具有抗性但生长缓慢的病原菌,还丰富了对病原菌具有拮抗作用的细菌类群。噬菌体对病原菌的作用间接改变了微环境下细菌菌群的组成和多样性,从而增强植株抵抗病原菌的能力[37]。
3.4 Tax4Fun细菌群落功能预测分析利用Tax4fun对物种进行功能基因预测,在噬菌体组中,代谢通路下的氨基酸代谢、能量代谢、脂质代谢、异源生物降解和代谢等基因功能丰度显著高于Psa组与铜制剂组。铜制剂对参与氮循环的基因丰度均有不同程度的短期抑制效果[38],从而影响植物环境土壤的氮转化。氨氧化代谢相关的基因丰度变化也会影响菌群的硝化过程,造成硝化与反硝化过程不平衡[39]。噬菌体组的代谢基因丰度更接近健康组的状态,说明噬菌体疗法具有良好的微生态调节功能,对微生物群落及代谢相关基因丰度的影响较小,从而达到“环境友好型”治疗的作用。然而铜制剂组中关于膜转运、信号转导的基因丰度显著高于健康组与噬菌体组,与Psa组的基因丰度更为接近。铜制剂组中较为丰富的放线菌纲和γ-变形菌纲的某些微生物类群具有重金属耐受能力,可通过胞内胞外隔离、孢子形成、产生氧自由基来帮助自身和植物减轻重金属胁迫作用[40],某些假单胞菌属也可以通过合成胞外多糖使其免受重金属铜的毒害[41]。这可能是铜制剂影响猕猴桃叶际微生态的表现之一。铜制剂组中膜转运、信号转导等基因丰度的增加也可能与铜制剂影响猕猴桃叶际微生态的过程密切相关。
4 结论本试验在田间环境中比较了噬菌体鸡尾酒与传统铜制剂对猕猴桃溃疡病的生物防治效果,深入分析了噬菌体疗法对猕猴桃叶际微生态的影响。结果表明,与铜制剂相比,噬菌体鸡尾酒不仅可以进一步降低猕猴桃细菌性溃疡病的发病率,还能够调整感病后的叶际内生细菌群落结构,增加微环境细菌群落丰富度,增强群落结构的稳定性,改善群落物种功能基因丰度情况,使猕猴桃叶际微生态更接近于正常健康植株。综上所述,噬菌体疗法在田间试验中表现出优秀的生物防治潜力,不仅有效地减少猕猴桃溃疡病发生,更具有良好的微生态调节功能。本研究成果为噬菌体制剂应用于植物细菌病的生物防治提供了重要基础数据。
| [1] |
SERIZAWA S, ICHIKAWA T, TAKIKAWA Y, TSUYUMU S, GOTO M. Occurrence of bacterial canker of kiwifruit in Japan: description of symptoms, isolation of the pathogen and screening of bactericides[J]. Japanese Journal of Phytopathology, 1989, 55(4): 427-436. DOI:10.3186/jjphytopath.55.427 |
| [2] |
LEE JH, KIM JH, KIM GH, JUNG JS, HUR JS, KOH YJ. Comparative analysis of Korean and Japanese strains of Pseudomonas syringae pv. actinidiae causing bacterial canker of kiwifruit[J]. The Plant Pathology Journal, 2005, 21(2): 119-126. DOI:10.5423/PPJ.2005.21.2.119 |
| [3] |
LIU N, LEWIS C, ZHENG W, FU ZQ. Phage cocktail therapy: multiple ways to suppress pathogenicity[J]. Trends in Plant Science, 2020, 25(4): 315-317. DOI:10.1016/j.tplants.2020.01.013 |
| [4] |
HAN H, NAM H, KOH Y, HUR J, JUNG J. Molecular bases of high-level streptomycin resistance in Pseudomonas marginalis and Pseudomonas syringae pv. actinidiae[J]. Journal of Microbiology, 2003, 41: 16-21. |
| [5] |
HOLMES A, JEYAKUMAR P, MILLER S, ANDERSON C, DEAN F. Zespri Innovation Project VI1469 Copper Sprays on Kiwifruit: Bactericidal Effectiveness, Bioavailability and Phytotoxic Effects-literature Review[M]. Palmerston North, New Zealand: Zespri Innov Proj VI 469, 2014: 1-31.
|
| [6] |
ZHANG JC, LI Z, CAO ZH, WANG LL, LI XY, LI SY, XU YP. Bacteriophages as antimicrobial agents against major pathogens in swine: a review[J]. Journal of Animal Science and Biotechnology, 2015, 6(1): 39. DOI:10.1186/s40104-015-0039-7 |
| [7] |
LEVIN BR, BULL JJ. Population and evolutionary dynamics of phage therapy[J]. Nature Reviews Microbiology, 2004, 2(2): 166-173. DOI:10.1038/nrmicro822 |
| [8] |
QIAO XY, SUN Y, QIAO J, Di SANZO F, MINDICH L. Characterization of Phi2954, a newly isolated bacteriophage containing three dsRNA genomic segments[J]. BMC Microbiology, 2010, 10: 55. DOI:10.1186/1471-2180-10-55 |
| [9] |
WANG XF, WEI Z, YANG KM, WANG JN, JOUSSET A, XU YC, SHEN QR, FRIMAN VP. Phage combination therapies for bacterial wilt disease in tomato[J]. Nature Biotechnology, 2019, 37(12): 1513-1520. DOI:10.1038/s41587-019-0328-3 |
| [10] |
FLORES O, RETAMALES J, NÚÑEZ M, LEÓN M, SALINAS P, BESOAIN X, YAÑEZ C, BASTÍAS R. Characterization of bacteriophages against Pseudomonas syringae pv. Actinidiae with potential use as natural antimicrobials in kiwifruit plants[J]. Microorganisms, 2020, 8(7): 974. DOI:10.3390/microorganisms8070974 |
| [11] |
SONG YR, VU NT, PARK J, HWANG IS, JEONG HJ, CHO YS, OH CS. Phage PPPL-1, A new biological agent to control bacterial canker caused by Pseudomonas syringae pv. actinidiae in kiwifruit[J]. Antibiotics (Basel, Switzerland), 2021, 10(5): 554. |
| [12] |
PINHEIRO LAM, PEREIRA C, ESTHER BARREAL M, GALLEGO PP, BALCÃO VM, ALMEIDA A. Use of phage ϕ6 to inactivate Pseudomonas syringae pv. actinidiae in kiwifruit plants: in vitro and ex vivo experiments[J]. Applied Microbiology and Biotechnology, 2020, 104(3): 1319-1330. DOI:10.1007/s00253-019-10301-7 |
| [13] |
LIU YX, LIU MJ, HU R, BAI J, HE XQ, JIN Y. Isolation of the novel phage PHB09 and its potential use against the plant pathogen Pseudomonas syringae pv. actinidiae[J]. Viruses, 2021, 13(11): 2275. DOI:10.3390/v13112275 |
| [14] |
BAI J, LIU Y, LIU M, LUO S, CHENG Y, LI G, LIU C, WEN S, XIA M, HE X, JIN Y. Application of phage therapy against red-fleshed kiwifruit canker[J]. Biological Control, 2022, 169: 104893. DOI:10.1016/j.biocontrol.2022.104893 |
| [15] |
ZHANG L, TU DM, LI XC, LU WX, LI J. Impact of long-term industrial contamination on the bacterial communities in urban river sediments[J]. BMC Microbiology, 2020, 20(1): 254. DOI:10.1186/s12866-020-01937-x |
| [16] |
XIONG C, ZHU YG, WANG JT, SINGH B, HAN LL, SHEN JP, LI PP, WANG GB, WU CF, GE AH, ZHANG LM, HE JZ. Host selection shapes crop microbiome assembly and network complexity[J]. The New Phytologist, 2021, 229(2): 1091-1104. DOI:10.1111/nph.16890 |
| [17] |
YAO H, SUN X, HE C, MAITRA P, LI XC, GUO LD. Phyllosphere epiphytic and endophytic fungal community and network structures differ in a tropical mangrove ecosystem[J]. Microbiome, 2019, 7(1): 57. DOI:10.1186/s40168-019-0671-0 |
| [18] |
CHAFFRON S, REHRAUER H, PERNTHALER J, von MERING C. A global network of coexisting microbes from environmental and whole-genome sequence data[J]. Genome Research, 2010, 20(7): 947-959. DOI:10.1101/gr.104521.109 |
| [19] |
BANERJEE S, SCHLAEPPI K, van der HEIJDEN MGA. Keystone taxa as drivers of microbiome structure and functioning[J]. Nature Reviews Microbiology, 2018, 16(9): 567-576. DOI:10.1038/s41579-018-0024-1 |
| [20] |
HUANG MR. Study on species diversity of marine bacterial community in Xiamen coast and predict their function[D]. Xiamen: Master's Thesis of Xiamen University, 2018 (in Chinese). 黄明荣. 厦门近岸细菌群落的物种多样性研究及其功能预测[D]. 厦门: 厦门大学硕士学位论文, 2018. |
| [21] |
BAI J. The isolation of pathogen and application of phage therapy against red-fleshed kiwifruit canker[D]. Beijing: Master's Thesis of Beijing Forestry University, 2021 (in Chinese). 白珺. 猕猴桃溃疡病的病原分离及噬菌体疗法的应用研究[D]. 北京: 北京林业大学硕士学位论文, 2021. |
| [22] |
ZHONG MZ, SUN YH, ZHANG XZ, LIANG H, XIONG LN, HAN QX. Complete genome sequence of the kiwifruit bacterial canker pathogenPseudomonas savastanoi strain MHT1[J]. BMC Microbiology, 2022, 22(1): 44. DOI:10.1186/s12866-022-02459-4 |
| [23] |
SANTAMARÍA-HERNANDO S, LÓPEZ-MAROTO Á, GALVEZ-ROLDÁN C, MUNAR-PALMER M, MONTEAGUDO-CASCALES E, RODRÍGUEZ-HERVA JJ, KRELL T, LÓPEZ-SOLANILLA E. Pseudomonas syringae pv. tomato infection of tomato plants is mediated by GABA and L-Pro chemoperception[J]. Molecular Plant Pathology, 2022, 23(10): 1433-1445. DOI:10.1111/mpp.13238 |
| [24] |
ZHANG JL, ZHAO ZB, LIU W, HUANG LL. The function of key T3SS effectors in Pseudomonas syringae pv.actinidiae[J]. Scientia Agricultura Sinica, 2022, 55(3): 503-513. (in Chinese) 张晋龙, 赵志博, 刘巍, 黄丽丽. 猕猴桃细菌性溃疡病菌T3SS关键效应蛋白基因致病功能[J]. 中国农业科学, 2022, 55(3): 503-513. |
| [25] |
WANG GF, XIE GL, ZHU B, HUANG JS, LIU B, KAWICHA P, BENYON L, DUAN YP. Identification and characterization of theEnterobacter complex causing mulberry (Morus alba) wilt disease in China[J]. European Journal of Plant Pathology, 2010, 126(4): 465-478. DOI:10.1007/s10658-009-9552-x |
| [26] |
KRUASUWAN W, THAMCHAIPENET A. 1-aminocyclopropane-1-carboxylate (ACC) deaminase- producing endophytic diazotrophicEnterobacter sp. EN-21 modulates salt-stress response in sugarcane[J]. Journal of Plant Growth Regulation, 2018, 37(3): 849-858. DOI:10.1007/s00344-018-9780-4 |
| [27] |
HIRSCH AM, VALDéS M. Micromonospora: an important microbe for biomedicine and potentially for biocontrol and biofuels[J]. Soil Biology and Biochemistry, 2010, 42(4): 536-542. DOI:10.1016/j.soilbio.2009.11.023 |
| [28] |
CONN VM, WALKER AR, FRANCO CM. Endophytic Actinobacteria induce defense pathways inArabidopsis thaliana[J]. Molecular Plant-Microbe Interactions: MPMI, 2008, 21(2): 208-218. DOI:10.1094/MPMI-21-2-0208 |
| [29] |
STEINBERG JP, BURD EM. Other gram-negative and gram-variable bacilli[M]//Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. Amsterdam: Elsevier, 2010: 3015-3033.
|
| [30] |
LIU Q. Effects of combination of earthworms and Sphingobacterium on soil carbon, nitrogen and microbial characteristics[D]. Guangzhou: Master's Thesis of South China Agricultural University, 2017 (in Chinese). 刘青. 蚯蚓和鞘氨醇杆菌联合对土壤碳氮及微生物特征的影响[D]. 广州: 华南农业大学硕士学位论文, 2017. |
| [31] |
DUNNE JR, GANNON CJ, OSBORN TM, TAYLOR MD, MALONE DL, NAPOLITANO LM. Preoperative anemia in colon cancer: assessment of risk factors[J]. The American Surgeon, 2002, 68(6): 582-587. DOI:10.1177/000313480206800614 |
| [32] |
TOMÉ-CARNEIRO J, GONZÁLVEZ M, LARROSA M, YÁÑEZ-GASCÓN MJ, GARCÍA-ALMAGRO FJ, RUIZ-ROS JA, GARCÍA-CONESA MT, TOMÁS-BARBERÁN FA, ESPÍN JC. One-year consumption of a grape nutraceutical containing resveratrol improves the inflammatory and fibrinolytic status of patients in primary prevention of cardiovascular disease[J]. The American Journal of Cardiology, 2012, 110(3): 356-363. DOI:10.1016/j.amjcard.2012.03.030 |
| [33] |
LEAÑO JL JR, LIN SY, LAZAROWSKA A, MAHLIK S, GRINBERG M, LIANG CL, ZHOU WZ, MOLOKEEV MS, ATUCHIN VV, TSAI YT, LIN chun che, SHEU HS, LIU RS. Green light-excitable Ce-doped nitridomagnesoaluminate Sr[Mg2Al2N4]phosphor for white light-emitting diodes[J]. Chemistry of Materials, 2016, 28(19): 6822-6825. DOI:10.1021/acs.chemmater.6b03442 |
| [34] |
XIONG W, JOUSSET A, GUO S, KARLSSON I, ZHAO QY, WU HS, KOWALCHUK GA, SHEN QR, LI R, GEISEN S. Soil protist communities form a dynamic hub in the soil microbiome[J]. The ISME Journal, 2018, 12(2): 634-638. DOI:10.1038/ismej.2017.171 |
| [35] |
LIANG QF, LLOYD-JONES G. Sphingobium scionense sp. nov., an aromatic hydrocarbon-degrading bacterium isolated from contaminated sawmill soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(Pt 2): 413-416. |
| [36] |
ZHANG Y, YANG Y, WEI QH, ZHAO M. Research progress in characteristic and application of Sphingomonas[J]. Chemistry & Bioengineering, 2021, 38(3): 6-13. (in Chinese) 张颖, 杨悦, 韦庆慧, 赵敏. 鞘氨醇单胞菌的特性及应用研究进展[J]. 化学与生物工程, 2021, 38(3): 6-13. |
| [37] |
LI PD, ZHU ZR, ZHANG YZ, XU JP, WANG HK, WANG ZY, LI HY. The phyllosphere microbiome shifts toward combating melanose pathogen[J]. Microbiome, 2022, 10(1): 56. DOI:10.1186/s40168-022-01234-x |
| [38] |
JU C, XU J, WU X, DONG F, LIU X, ZHENG Y. Effects of myclobutanil on soil microbial biomass, respiration, and soil nitrogen transformations[J]. Environmental Pollution, 2016, 208: 811-820. DOI:10.1016/j.envpol.2015.11.003 |
| [39] |
JU C, XU J, WU X, DONG F, LIU X, TIAN C, ZHENG Y. Effects of hexaconazole application on soil microbes community and nitrogen transformations in paddy soils[J]. Science of the Total Environment, 2017, 609: 655-663. DOI:10.1016/j.scitotenv.2017.07.146 |
| [40] |
RIZVI A, ZAIDI A, AMEEN F, AHMED B, AlKAHTANI MDF, KHAN MS. Heavy metal induced stress on wheat: phytotoxicity and microbiological management[J]. RSC Advances, 2020, 10(63): 38379-38403. DOI:10.1039/D0RA05610C |
| [41] |
CHEN MC, WANG JP, ZHU YJ, LIU B, YANG WJ, RUAN CQ. Antibacterial activity against Ralstonia solanacearum of the lipopeptides secreted from the Bacillus amyloliquefaciens strain FJAT-2349[J]. Journal of Applied Microbiology, 2019, 126(5): 1519-1529. DOI:10.1111/jam.14213 |
 2023, Vol. 50
2023, Vol. 50