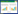扩展功能
文章信息
- 孙一享, 常洪军, 杨行鑫, 吴明伟, 黎洁
- SUN Yixiang, CHANG Hongjun, YANG Xingxin, WU Mingwei, LI Jie
- 水产动物副溶血弧菌病及其噬菌体防治研究进展
- Vibriosis caused by Vibrio parahaemolyticus in aquatic animals and bacteriophage therapy: a review
- 微生物学通报, 2023, 50(8): 3620-3634
- Microbiology China, 2023, 50(8): 3620-3634
- DOI: 10.13344/j.microbiol.china.221017
-
文章历史
- 收稿日期: 2022-10-17
- 接受日期: 2023-03-09
- 网络首发日期: 2023-04-17
2. 正大水产(湖北)有限公司, 湖北 蕲春 435300;
3. 池塘健康养殖湖北省工程实验室, 湖北 武汉 430070
2. Chia Tai Aquaculture (Hubei) Limited Company, Qichun 435300, Hubei, China;
3. Hubei Provincial Engineering Laboratory for Pond Aquaculture, Wuhan 430070, Hubei, China
副溶血弧菌(Vibrio parahaemolyticus, VP)是一种普遍存在于河口和海洋环境中的嗜盐性革兰氏阴性(Gram-negative, G−)细菌,是目前报道除霍乱弧菌外能引起人类感染的最常见的致病性弧菌,食用被VP污染的食品可导致胃肠道感染[1]。随着水产养殖规模及海鲜消费市场的发展,VP已成为世界范围内食源性腹泻的主要原因[2]。美国每年由VP引起的食源性疾病约为4.5万例[3],而在中国则高达495.1万例[4]。此外,VP还是一种非常重要的水产动物致病菌。在水产养殖集约化不断发展的背景下,由VP引起的虾类急性肝胰腺坏死病(acute hepatopancreatic necrosis disease, AHPND)造成养殖虾类大量死亡[5-7]。该菌还能导致海参腐皮病、贝类和大黄鱼的弧菌病[4],给水产养殖业带来巨大的经济损失。
以往的水产动物细菌性病害的防治主要依赖抗生素,然而抗生素的大量使用不可避免地会导致环境药物残留,此外,细菌耐药性问题还会催生多重耐药的“超级细菌”出现[8]。2020年,农业农村部等10部委联合发布《关于加快推进水产养殖业绿色发展的若干意见》,其中明确指出开展水产养殖用药减量行动[9]。2021年以来,抗生素替代产品的开发逐渐成为水产养殖行业关注的焦点。目前的抗生素替代产品中,寡聚糖[10]的主要作用是提高养殖动物自身的免疫力,而天然植物提取物[11]的治疗疗程相对较长且较缓慢,益生菌则主要是通过拮抗作用来抑制病原菌,所以仍然存在诸多问题待解决[12]。噬菌体区别于寡聚糖、益生菌和天然植物提取物,是唯一具有直接杀菌效果的抗生素替代产品。噬菌体与宿主菌结合后,在宿主体内快速增殖并将其裂解[13],势必成为未来替抗产品的发展趋势和研究热点。裂解性能优良的VP专性噬菌体将在VP的生物防控中具有广泛的应用前景。本文重点概述了水产动物的副溶血弧菌病及其噬菌体防控的研究进展。
1 水产动物的副溶血弧菌病弧菌病是影响全球河口和海洋环境中水产动物最严重的传染病之一。VP广泛分布于海洋环境中,是弧菌病的主要病原菌,常从对虾、贝类和海水养殖鱼类中分离出来,对水产养殖业带来严重危害。
1.1 虾类的副溶血弧菌病副溶血弧菌可引起对虾生长缓慢、身体发红、黄色鳃、断须、空肠空胃、肝胰腺坏死等症状,常导致全球对虾养殖业严重的经济损失。
1.1.1 红体病红体病在我国虾类主养区流行较广,常在气温骤升或骤降时出现。患病虾出现附肢发红、活动能力减弱、漫游于水面、减少或停止摄食、肝胰腺肿大和肠道能见到因未摄食引起的断节现象,死亡率较高。2001年,由VP引起的红体病导致我国辽宁大连地区养殖凡纳滨对虾(Litopenaeus vanname)大量死亡,死亡率高达80%;2007年,该菌引起的红体病又在我国广东地区大面积暴发[14]。
1.1.2 急性肝胰腺坏死病急性肝胰腺坏死病是近几年出现的一种对虾致命性疾病,又称早期死亡综合征(early mortality syndrome, EMS)[6, 14-15],导致对虾急性肝胰腺坏死病的VP简称为VPAHPND。该病常发生于虾苗期,易感种群主要有凡纳滨对虾、斑节对虾(Penaeus monodon)和中国对虾(Penaeus chinensis)等;虾患病后表现为肠胃空虚,肝胰腺萎缩和颜色变浅等症状,病发突然且死亡率极高,一旦确诊,死亡率可达100%,给全世界范围的对虾养殖产业造成了巨大影响[15]。2009年,中国天津暴发对虾急性肝胰腺坏死病,导致对虾大量死亡,是VP引起最为严重的新型虾类疾病[6]。该病害随后在越南(2011年)、马来西亚(2011年)、泰国(2012年)、墨西哥(2013年)、菲律宾(2015年)和南美洲(2016年)等地暴发;近年来,急性肝胰腺坏死病影响区域内的虾产量下降60%,仅在亚洲就造成超过200亿美元的经济损失[16]。
1.1.3 其他副溶血弧菌病2020年3月,广东、广西南美白对虾孵化场发生大量“玻璃苗”病例,并通过虾苗传播至其他虾类养殖区,是对虾养殖又一个新的威胁;对虾“玻璃苗”病由VP引发,主要影响4−7 d的虾苗(PL4−PL7),传染率可达90%−100%,患病虾的临床体征为肠道空虚,通体透明或半透明,肝胰腺颜色变浅或发灰,一旦患病,只能排塘处理[17]。VP还能引起对虾红腿病、烂鳃病、白便综合征等[18-19],是对虾养殖中最重要的致病菌。然而,Dong等[20]从湖北养殖的克氏原螯虾(Procambarus clarkii)中分离得到96株VP,多位点序列分型结果表明,这批VP分属于53个ST型,表明克氏原螯虾可能是淡水中VP的载体。
1.2 鱼类的副溶血弧菌病副溶血弧菌也是一种鱼类致病菌,能对大黄鱼(Larimichthys crocea)[21]、大菱鲆(Scophthalmus maximus)[22]、石斑鱼(Epinephelus sp.)[23]等养殖鱼类和黑双带小丑(Amphiprion sebae)[24]等观赏鱼类致病,主要症状有体表出血和溃疡、烂尾、体色变黑等,最终死亡。胡亮等[22]从患出血病的大菱鲆中分离到的VP在1.0×109 CFU/mL浓度下可导致大菱鲆全部死亡。被VP感染的黑双带小丑尾鳍腐烂,肝脏和脾脏组织出现明显损伤,分离的致病菌对黑双带小丑的LD50为1×105 CFU/尾[24]。
此外,海洋鱼类也是VP的主要携带者。2017年,韩国首尔发生一起因食用鱿鱼而导致的大规模VP感染事件[25]。孟加拉国海鲜市场上采集的80份海鱼样本中,感染VP的海鱼比例约为63.75% (51/80)[26]。虽然在淡水养殖业中VP的报道相对较少,但中国淡水鱼中VP的检出率已超过10%,2014年4‒12月,从浙江省421份淡水鱼标本中共分离出68株VP[27]。VP在全球范围内的流行传播已严重威胁到世界公共卫生安全。
1.3 其他水产动物的副溶血弧菌病除了虾类和鱼类,VP也能对棘皮动物和贝类等水产动物致病。VP可导致仿刺参(Apostichopus japonicus)烂胃病、化板症、腐皮综合症等疾病,生食感染VP的仿刺参也会导致食物中毒。Jiang等[28]于2009年和2010年秋季从山东省和辽宁省养殖仿刺参体内分离出87株VP,其中56.2%的分离株对至少3种抗菌药物表现出多重耐药。贝类的滤食食性使其富集和捕获病原体的概率较高,一旦水体被污染,致病菌将大量滋生并在贝类中富集。养殖区颗粒物有机质水平较高,不仅促进VP的生长和种群混合,还驱动基因水平转移和环境适应[29]。患上弧菌病后,无论是贝类幼体还是成体,都将在较短时间内大规模死亡,对贝类养殖业造成重大的经济损失。2019−2020年,张瑞卿[14]在山东青岛、日照等6个贝类养殖区共分离出弧菌359株,其中VP占8.9% (32株),仅次于哈维氏弧菌(V. harveyi)和溶藻弧菌(V. alginolyticus),是导致山东省养殖贝类弧菌病的主要病原之一。在海洋环境中,VP的分布与水温密切相关,夏季是贝类弧菌病的高发季节;新罕布什尔州大湾河口的VP的生态学研究发现,冷水月份(10月至次年5月)的牡蛎(Ostrea)中VP检出率为55%,而温水月(6‒9月)的检出率为72%[30]。2016年的全国食品安全监测中,淡水鱼和贝类的VP检出率最高,为19.0% (613/3226),其中检测出tdh和trh基因的VP分别为19株(2.6%)和24株(3.3%)[31]。
2 烈性噬菌体对水产动物副溶血弧菌的防控 2.1 噬菌体概述噬菌体是一类感染细菌的病毒。1915年和1917年,Frederick Twort和Felix d’Hérelle先后发现噬菌体,此后,人们开始使用噬菌体治疗痢疾。随着青霉素的发现和广泛应用,20世纪40年代,噬菌体的裂菌效果逐渐被高效广谱的抗生素所掩盖[32-33],关于噬菌体的研究也逐渐被冷落,但人类对噬菌体的探索一直未停止。1958年,我国出现首个针对铜绿假单胞菌(Pseudomonas aeruginosa)感染的噬菌体治疗案例[34]。21世纪初,随着抗生素耐药性问题日趋严重,噬菌体研究重新受到关注。
噬菌体根据生活周期不同,可分为温和性噬菌体和烈性噬菌体。烈性噬菌体与宿主菌结合后,在宿主体内快速增殖并将其裂解;而温和性噬菌体的基因组能整合到宿主菌的染色体上,随宿主菌增殖而增殖,这种状态可持续多代,直到抗生素、DNA损伤等压力因素存在的情况下裂解循环被诱导激活。近年来的研究表明,噬菌体感染细菌还存在假溶原性循环[33, 35],即宿主菌营养缺乏时,噬菌体基因组作为非整合的前噬菌体存在于宿主细胞内,在宿主细胞的分裂中保留在任意一个子代细胞内(图 1)。当宿主营养状况恢复后,噬菌体随即进入溶原性或裂解性循环。温和性噬菌体能参与细菌间的基因水平转移,其中也包括毒力因子或抗性基因,在实际应用中要筛选能够直接裂解细菌的烈性噬菌体[32]。
目前水产动物病原菌的噬菌体防控技术多集中于实验室特定条件下的研究,很少有生产实践中的应用数据。在大多数噬菌体治疗案例中,噬菌体是通过添加至饲料中进行口服、添加至水体中浸浴或直接进行腹腔和肌肉注射应用于水产动物的(表 1)。
| Aquatic animal | Source | Characterization method | Phage strains name | Delivery method | References | |
| Shrimp | P. vanmamei | Farming wastewater | TEM, DNA sequencing | VPP1 | Bath immersion feeding |
[36] |
| P. vanmamei | Sea water | TEM, DNA sequencing | PG07 | Feeding | [37] | |
| P. vanmamei | Shrimp pond water | TEM, DNA sequencing | V5 | Spray | [38] | |
| P. monodon | Shrimp pond water | TEM | VP1 VP7 VP9 |
Feeding | [39] | |
| P. monodon larvae | Shrimp pond water | TEM | VVP1 | Bath immersion | [40] | |
| Whiteleg shrimp larvae | Shrimp and clams | Unknown | A3S Vpms1 |
Bath immersion | [41] | |
| Other aquatic animals | Oyster | Sea water | TEM, DNA sequencing | pVp-1 | Bath immersion; Distribution droplets |
[42] |
| Oyster | Sea water | TEM | vB_VpaS_OMN | Distribution droplets | [43] | |
| Mussel | Sea water | DNA sequencing | VP10 cocktail | Bath immersion | [44] | |
| A. japonicus | A. japonicus pond water | TEM | PVP1 PVP2 |
Feeding | [45] | |
| Aquatic products | Brine shrimp; Ready-to-eat fillet | Oyster tissues | TEM, DNA sequencing | VPT02 | Bath immersion | [46] |
| Ready-to-eat crayfish meat | Shrimp pond water | TEM, DNA sequencing (unpublished) | LPVP16 LPVP19 LPVP28 |
Distribution droplets | [47] | |
| Shrimp meat | Farming wastewater | TEM, DNA sequencing | F23s1 | Distribution droplets | [48] | |
副溶血弧菌主要侵袭甲壳动物,因此VP噬菌体在对虾中的应用研究较多。噬菌体是活体粒子,从给药初期到繁殖至一定浓度最终控制宿主种群的生长所需的时间随宿主细菌和噬菌体的种类不同而存在差异。有学者研究了给药时间和给药剂量对噬菌体治疗效果的影响。Lomelí-Ortega等[41]用人工感染AHPND的凡纳滨对虾评估不同给药剂量时噬菌体的治疗效果,发现VP噬菌体A3S和Vpms1的感染复数(multiplicity of infection, MOI)分别为0.1、1和10时,治疗组患病对虾的存活率在各组间无显著差异,且低剂量组(MOI=0.1)存活率最高。然而,Ding等[37]对VP噬菌体PG07治疗人工感染AHPND凡纳滨对虾的研究结果则截然相反,感染VPAHPND后1 h分别使用7.6×109、7.6×108和7.6×107 PFU/mL这3种剂量的PG07进行拌料口服给药治疗,发现未治疗组死亡率高达93.3%,而高剂量治疗组的存活率近50%,且各试验组对虾的存活率与噬菌体剂量成正相关。Guo等[49]认为,高滴度噬菌体的应用将增加噬菌体与靶细菌的结合概率,因此,噬菌体的MOI值越高,目的致病菌的减少量就越大。以上研究表明噬菌体的给药剂量并不是越大越好,最适的MOI跟病原体、动物和噬菌体的种类都是相关的。
然而,已有研究表明给药时间对治疗效果的影响比较一致,越早给药效果越好。Lomelí-Ortega等[41]的研究发现,与未感染的对照组相比,感染后1−12 h后进行VP噬菌体Vpms1给药的凡纳滨对虾的存活率并无显著下降,24−36 h后给药则存活率显著降低;噬菌体A3S在感染后6 h及更长时间给药,存活率随给药时间的推迟依次降低。Jun等[36]评价了噬菌体pVp-1对凡纳滨对虾的免疫保护效果,结果显示感染AHPND后用噬菌体浸浴和拌料口服均不能降低虾的死亡率(100%),而当在人工感染前24 h分别对不同组对虾进行3次噬菌体预防处理,则浸浴组和拌料口服组均能将死亡率从100%降至50%;人工感染前24 h同时对对虾采取浸浴和拌料口服的方式进行预防,试验组的虾全部存活,表明在人工感染前,不管是浸浴还是拌料口服,噬菌体均能显著保护凡纳滨对虾免受AHPND的攻击。
上述研究中,浸浴和口服两种给药方式的免疫保护作用相当。Alagappan等[39]的研究则认为不同给药方式也会导致差异化的保护效果,他们发现浸浴给药时,噬菌体混合给药的试验组凡纳滨对虾96 h的累积死亡率最低(20%),而单一噬菌体给药的组别死亡率介于30%−40%之间;拌料后口服给药时,噬菌体混合给药的试验192 h的累积存活率最高(70%),略优于单一噬菌体给药组(60%和65%);结果表明浸浴给药的试验组存活率略高于口服给药组。这可能与对虾肠道的屏障功能有关,从而影响了口服给药时噬菌体在其他器官中的有效递送[50]。相反地,噬菌体在水体中的存活时间可以高达7 d,大大延长了有机体暴露于噬菌体的有效时间[51],此外,液体系统中提供的细菌自由运动有助于噬菌体与细菌的结合[49]。当然,浸浴和口服给药方式下,无论是混合给药还是单一给药,噬菌体均能显著保护凡纳滨对虾免受VP的攻击,然而不可否认的是,噬菌体混合给药的治疗效果始终优于单一噬菌体给药。此外,与单一噬菌体组相比,混合噬菌体对VP的裂解率也具有明显的优势。乔欣等[52]从海水及发病凡纳滨对虾中分离获得3株VP烈性噬菌体,与单一噬菌体相比,3株噬菌体的混合物对VPAHPND和非VPAHPND菌株的裂解率分别高达91.5%和92.3%,明显优于裂解能力最强的单一噬菌体(84.6%)。
也有研究表明,在虾类中应用单一噬菌体取得了较好的治疗效果。Dubey等[38]将虾源VP特异性噬菌体V5应用于人为感染VP的对虾中,发现处理1 h后对虾肝胰腺中的细菌数量下降78.1%。Stalin等[40]从斑节对虾养殖污水中分离得到VP烈性噬菌体VVP1,在实验室条件下将其应用于VP感染的幼虾中,每隔24 h加入0.1 mL滴度为2.3×1010 PFU/mL的噬菌体,72 h后细菌数量从105 CFU/mL下降至102 CFU/mL,幼虾存活率约为90%。
2.2.2 其他水产动物副溶血弧菌病的噬菌体防控研究副溶血弧菌噬菌体在其他水产动物的弧菌病防控中应用较少。Ren等[45]评价了不同剂量下PVP1、PVP1混合噬菌体冻干粉末拌料口服对VP引起的仿刺参腐皮病的治疗效果,发现中高剂量(MOI=10, MOI=100)下噬菌体治疗组存活率均高于抗生素治疗组,低剂量组存活率(50%)也显著优于未治疗组(30%)。该结果与虾类应用中的规律一致,即混合噬菌体对VP的治疗效果与抗生素治疗组相当甚至更优。Jun等[42]用多药耐药VP菌株CRS 09-17感染太平洋牡蛎(Crassostrea gigas)后将其置于噬菌体pVp-1中浸泡处理,72 h后细菌数由8.9×106 CFU/mL减少至1.4×10 CFU/mL。这是首次在牡蛎中应用噬菌体控制多药耐药的VP案例。Onarinde等[44]发现滴度为1.3×103 PFU/mL的10株噬菌体混合物VP10能在实验室条件下同时将海水、沉积物和青口贝(Mytilus edulus)表面的VP降至检测线以下。也有研究表明,VP噬菌体能显著提高人工感染VPAHPND的卤虫存活率[46, 53]。
Wong等[54]从牡蛎中分离到的烈性噬菌体VP06能裂解28.1%的测试弧菌,包括VP、溶藻弧菌和哈维氏弧菌。Cao等[3]从文蛤(Meretrix meretrix)中分离到的VP烈性噬菌体vB_VpaP_MGD2能裂解90% (27/30)的受试VP耐药菌株,其中17株为多药耐药VP菌株。然而这些研究并未做动物的体内应用试验。
2.2.3 副溶血弧菌噬菌体在水产品加工中的应用除了应用于养殖虾类的VP防控和贝类净化中,噬菌体还被广泛应用于VP污染的水产品的处理中。Zhang等[43]分离到一株VP特异性噬菌体OMN,对测试的VP裂解率为87.1% (27/31);将噬菌体OMN应用于人工污染VP的牡蛎肉,48 h后牡蛎肉表面的VP浓度降低至其初始浓度的10%,72 h后杀菌效率达到99%,表明噬菌体OMN可显著减少牡蛎肉表面VP的数量。Jun等[42]在VP污染后的牡蛎肉表面施用VP噬菌体pVp-1则在更短的时间内表现出优良的杀菌效果,仅12 h即能将牡蛎肉表面的细菌数由1.44×106 CFU/mL下降至1.94 CFU/mL。郑小双等[55]在60份海产品污水样品中分离出5株广谱烈性噬菌体,Vpp MIX (5株噬菌体的混合物)对测试VP菌株(共42株)的裂解率为100%。应用Vpp MIX处理VP污染的黄鱼片,在25 ℃恒温处理6 h后,黄鱼样品中菌落数比对照组降低了2.2 log10 (CFU/mL)。Teng等[47]将VP噬菌体鸡尾酒应用于即食小龙虾肉表面,使虾肉表面的VP负荷显著降低2.36 log10 (CFU/mL)。Xia等[48]发现VP噬菌体F23s1只有当MOI=1 000时,才能在12 h内有效抑制对虾肉表面VP F23的生长(25 ℃)。You等[46]从牡蛎中分离到VP裂性噬菌体VPT02,可裂解VP耐药菌株FORC_023;当MOI=10时,VPT02能将感染VP的丰年虾的存活率从16.7%提高至46.7%,并能将即食生鱼片上的VP减少3.9 log10 (CFU/mL),表明VPT02是一种潜在的抗菌产品。
2.2.4 副溶血弧菌噬菌体在水产动物中应用的特点综上所述,副溶血弧菌噬菌体在水产动物中的应用具有如下特点:(1) 噬菌体治疗效果呈剂量依赖性。有效的噬菌体治疗所需的噬菌体与细菌浓度的比率差异很大,并不是剂量越高疗效越好,而是取决于病原体、水产动物和噬菌体,因此选择适合的噬菌体剂量对噬菌体治疗效果非常重要。(2) 噬菌体鸡尾酒疗法比单噬菌体疗法效果好。水产动物可能同时感染多种病原菌,噬菌体混合物能同时针对多种细菌或一种细菌的多个菌株,宿主谱更广且能降低耐药性的产生。(3) 噬菌体制剂越早使用效果越好,如果作为病害预防则效果更好。这可能与噬菌体繁殖到足够浓度导致宿主种群崩溃所需的时间有关,当然还需要进一步研究时间和噬菌体数量对噬菌体治疗成功的影响,因为更集中的给药有可能会补偿延迟治疗。(4) 噬菌体制剂效果能媲美抗生素。噬菌体疗法的有效性可能不仅能与抗生素相抗衡,甚至可能更有效,还需要进一步研究来比较二者的功效,并研究噬菌体耐药的程度和速率。
3 烈性噬菌体生物防控的优势和挑战 3.1 优势近年来,细菌性病害的暴发使得水产养殖业遭受重大损失,开发更安全、有效、经济的病原菌防控手段成为水产养殖业的重中之重。随着人们对抗生素耐药性及药物残留的认识不断提高及抗生素的使用逐渐受到限制,噬菌体疗法作为一种非常有前景的抗生素替代疗法,逐渐成为了水产养殖业中细菌性病害防控的新宠。跟抗生素相比,噬菌体在水产动物细菌性病害防控中具有较大优势:(1) 噬菌体具有高度的宿主特异性,能在不影响非目标天然微生物群的情况下,针对性地杀灭特定种属的病原菌。而抗生素多具广谱性,治疗时也会破坏机体的正常菌群[32]。(2) 近年来新型抗生素的发现显著减少,而噬菌体由于其丰富的生物多样性,可从环境中源源不断地分离得到,生产成本也更低。(3) 噬菌体可在环境中进行指数式自我复制,单次投放的有效时间更长。(4) 噬菌体可以直接裂菌,复制过程中阻断了核酸复制、转录和翻译等重要的细菌生命活动,相较而言不易产生耐受性,而抗生素通常是对细菌产生抑制作用,使得耐药性更容易进化。(5) 噬菌体只能依赖于宿主细菌才能生存,不会残留在动物体内。(6) 噬菌体的给药方式有浸浴、涂抹、注射、口服等,既可单独用药,也可多种噬菌体联合用药。还有研究表明,噬菌体与抗生素的联合使用可以在对抗细菌时取得更好的效果[56-57]。总而言之,噬菌体疗法跟抗生素疗法相比,具有诸多优势,在防控水产动物细菌性病害方面有着巨大潜力。
3.2 挑战 3.2.1 宿主谱狭窄烈性噬菌体的宿主特异性强就像一把“双刃剑”,既能让其在使用中针对性地杀灭特定种属病原菌,也使得噬菌体的宿主谱非常窄,只能裂解一种或一类细菌,从而限制了其应用范围。在使用噬菌体治疗前需确认所感染的病原菌种类,且单一噬菌体不能有效控制多发性细菌疾病。实践中通常将多种噬菌体混用来扩大噬菌体宿主范围,对抗不同菌株或种类的细菌以达到防治的作用,该方法又称“鸡尾酒疗法”。不过噬菌体混合物的合理配伍以及感染部位噬菌体与细菌的相对比例对噬菌体鸡尾酒疗法的治疗效果具有直接的影响[58]。此外,噬菌体与抗生素或益生菌等联用也可以达到协同抗菌的效果,能够有效解决宿主谱窄的问题。研究表明[59],亚致死浓度的抗生素可促进子代噬菌体从宿主细胞中释放,从而提高噬菌体的杀菌效率,降低细菌耐药性的产生。Rasmussen等[60]的试验表明,与单独使用宽谱噬菌体KVP40和益生菌Phaeobacter inhibens DSM17395相比,将两者联合使用能够降低水体中的弧菌数量和卤虫死亡率。
3.2.2 噬菌体抗性虽然相较于抗生素耐药性,细菌产生噬菌体抗性的几率较小,但在细菌和噬菌体相互竞争和共同进化过程中,细菌产生了抵御噬菌体感染的天然免疫。如通过下调噬菌体受体、构象变化、点突变等修饰或阻断识别位点,导致噬菌体吸附减少、感染率降低[24]。研究显示铜绿假单胞菌暴露于烈性噬菌体后,30%的抗噬菌体细菌表现出galU基因缺失(galU基因参与噬菌体受体脂多糖合成)[61]。然而在这场长达上亿年的“军备赛”中,噬菌体也进化了相应的免疫逃逸机制,如对新受体的适应、特定基因的突变、对限制性位点进行修饰、抗CRISPR蛋白等[24]。适应性代价的观点认为,当生物进化出一种性状提高环境适应性时,其另一性状就会随之下调;由于噬菌体与抗生素的杀菌机制不同,在噬菌体与抗生素联用的情况下,当细菌进化出噬菌体抗性时,其毒力会随之减弱或对抗生素的敏感性增加[58]。细菌为了逃逸以LPS组分为受体的噬菌体吸附,会通过点突变甚至是大段染色体缺失来改变LPS的表达,这些突变的细菌在对抗噬菌体的同时,其适应性和毒力通常都会降低;当噬菌体以细菌的粘附素、菌毛毒力因子为受体时,细菌同样会通过相关基因的改变产生噬菌体抗性,同时导致毒力的降低[62]。Chan等[63]的研究表明,噬菌体OMKO1与铜绿假单胞菌MexAB-和Mex-XY-OprM外排泵的外膜蛋白M (OprM)相互作用产生的噬菌体抗性突变体对包括头孢他啶在内的抗生素更敏感。此外,噬菌体鸡尾酒疗法将具有不同宿主特异性的噬菌体进行组合,通过相互间的协同合作来减缓噬菌体抗性的出现[62]。由此可见,噬菌体和抗生素的混合疗法及噬菌体的鸡尾酒疗法可能是未来噬菌体治疗的理想选择。
3.2.3 药代动力学不明确实际生产中,噬菌体疗法的剂量、给药时间、给药方式均难以确定,可能导致噬菌体治疗效果无法达到最佳。噬菌体与其他噬菌体或其他抗生素联用时,其药效学和药代动力学问题更加复杂。药物合用可能表现出协同作用,也可能产生拮抗作用,用药顺序也可能会影响治疗结果。研究显示,在使用万古霉素、双氯西林、头孢唑林、四环素或利奈唑胺后,应用噬菌体SATA-8505处理金黄色葡萄球菌(Staphylococcus aureus)会消除其抗菌作用[64]。因此,随着时间的推移,噬菌体疗法应重点关注给药途径和给药剂量的研究,并通过动物模型估计最佳的感染复数以及与抗菌药物的最佳配比[58]。
3.2.4 体内递送效率较低噬菌体在水产动物体内的递送效率直接关系到抗菌剂的有效作用浓度。有研究[21]评估了口服噬菌体后大黄鱼肠道、肾脏、脾脏和脑中噬菌体的递送效率,发现肠道中噬菌体的滴度最高,然而在穿过肠屏障的过程中噬菌体大量损失,导致脑中的噬菌体滴度最低。如何跨越肠道等生理屏障促进噬菌体的吸收和递送,将更高浓度的噬菌体递送至感染部位,从而增加生物利用度以提高疗效,是后期噬菌体在水产动物应用研究中需要关注的问题。当然,对于饲料添加的口服制剂来说,建立饲料中噬菌体剂量与递送后器官中噬菌体浓度之间的关系是开发和优化饲料递送的关键。
4 展望全球化贸易和大规模集约化养殖推动着鱼、虾及贝类等水产品产量的快速增长,全球鱼类和海产品贸易价值估计约为1 520亿美元,我国的水产养殖产量约占世界总产量的67%[65]。然而,水产养殖产量的快速提升难免引发人们对水产品质量安全的担忧,集约和半集约养殖模式下,水产动物细菌性病害频频发生。近年来,VP等致病性弧菌引起的急性肝胰腺坏死病、红体病、玻璃苗病等弧菌病更是给对虾养殖业造成了极为惨重的损失。截至目前,实验室研究数据表明烈性噬菌体疗法确实在VP的抗感染方面具有显著的治疗效果,有望替代抗生素成为水产动物弧菌病生物防控的新选择。然而,噬菌体要像抗生素一样大规模地应用于水产养殖业,仍有诸多问题需要解决,本文对此提出一些建议和可能的解决办法。
4.1 解决噬菌体宿主谱窄的局限噬菌体的宿主谱较窄,很大程度上限制了噬菌体制剂的广泛应用。在病原菌的生物防控研究中,应尽量筛选宿主谱较宽的噬菌体,有研究表明已筛选到能以VP为宿主的嗜水气单胞菌(Aeromonas hydrophila)噬菌体,该噬菌体甚至能以厚壁菌门的金黄色葡萄球菌为宿主[66]。鉴于噬菌体与抗生素或益生菌混合使用均能达到协同抗菌的效果,噬菌体与抗生素或噬菌体与益生菌的混合疗法可能是未来噬菌体治疗的理想选择。另外,噬菌体的“鸡尾酒疗法”可以有效拓宽噬菌体制剂的宿主谱,并减缓细菌耐药性的产生,是目前噬菌体临床治疗的主要发展方向之一。噬菌体相关的研发机构或企业可以共建弧菌的噬菌体资源库,基于人工智能算法对特定的致病性弧菌进行噬菌体“鸡尾酒”的精准匹配,能够大大提高噬菌体制剂的应用效率。
4.2 利用基因编辑技术改造噬菌体随着基因编辑技术的飞速发展,CRISPR-Cas等技术在噬菌体改造中得到越来越多的应用[67]。可以通过基因编辑,扩展或改变噬菌体的宿主谱,或者精准控制宿主菌的裂解速度,避免内毒素的大量释放导致机体发生剧烈的炎症反应。当然,如何对基因编辑后的噬菌体进行有效监管以及如何将其应用于生产实际又将成为新的挑战。
4.3 高效烈性噬菌体如何成为商业化制剂一种高效烈性噬菌体的商业化,首先需制定一套标准化的增殖、浓缩和纯化的方法,以满足噬菌体制剂大规模应用的需要,同时有效去除宿主菌产生的内毒素。其次,还需对噬菌体制剂进行合理配伍,并保证其加工和储存过程的稳定性。目前市场上的兽(渔)用噬菌体制剂通常为液体制剂,为确保其稳定性,常需进行低温保存或添加保护剂。噬菌体还可经脂质体、壳聚糖或海藻酸盐等材料包埋后制成微米和纳米颗粒,既能实现噬菌体的有效传递,又能提高其高热稳定性,其缺点是工艺较为烦琐。如果对成本控制要求不高的话,使用冷冻干燥或低温喷雾干燥技术将噬菌体制成粉剂也是不错的选择。
4.4 提高噬菌体制剂口服给药的递送效率弧菌主要攻击水产动物的内脏器官,尤其是虾类的肝胰腺,前期研究也表明噬菌体制剂的口服效果优于浸泡效果。然而肠道屏障等生理屏障的存在往往导致到达靶器官的噬菌体有效浓度偏低,因此,如何提高噬菌体制剂在口服给药途径中的药物递送效率也是亟须解决的难题。
虽然噬菌体疗法是防控细菌感染的有效手段,但是高效裂菌的噬菌体制剂从实验室筛选到应用还有很多工作要做。由于噬菌体具有宿主特异性,如果按照传统的流程进行药品开发和兽药审批,顺利获取批文后噬菌体制剂很可能已对当时的流行性致病菌无效。因此,建议相关部门针对噬菌体产品发布专门的注册管理办法,严格其审批标准,并组织噬菌体研究专家从生产环境、生产工艺、设备和材料,以及质量保证和质量控制规范和质保期等方面形成噬菌体产品的质量和安全监管规范,确保噬菌体产品的有效性和用户权益。此外,还应尽快形成噬菌体行业使用标准,制定相应的法律法规。阐明噬菌体在不同水产动物体内的药代动力学特征,科学确定噬菌体的给药时间、频率和剂量,并在真实的养殖环境条件下进行试验研究,更好地了解噬菌体的治疗效果。当然,还应该在综合考虑成本效益、环境影响等因素的前提下,针对不同区域和物种进行标准化指导。
虽然噬菌体的大规模应用还存在诸多问题亟须解决,但不可否认的是,噬菌体具有直接裂解病原菌、特异高效、易获得、成本低、绿色环保、给药方式灵活多样等优点,是解决目前水产动物病原菌耐药问题日益突出的有效策略。相信在渔业产业转型升级的关键时期,随着科学研究的不断深入,噬菌体生物防控技术将有力推动水产养殖业的绿色、健康、可持续发展。
| [1] |
GARCÍA K, BASTÍAS R, HIGUERA G, TORRES R, MELLADO A, URIBE P, ESPEJO RT. Rise and fall of pandemic Vibrio parahaemolyticus serotype O3: K6 in southern Chile[J]. Environmental Microbiology, 2013, 15(2): 527-534. DOI:10.1111/j.1462-2920.2012.02883.x |
| [2] |
LI LZ, MENG HM, GU D, LI Y, JIA MD. Molecular mechanisms of Vibrio parahaemolyticus pathogenesis[J]. Microbiological Research, 2019, 222: 43-51. DOI:10.1016/j.micres.2019.03.003 |
| [3] |
CAO YZ, ZHANG YJ, LAN WQ, SUN XH. Characterization of vB_VpaP_MGD2, a newly isolated bacteriophage with biocontrol potential against multidrug-resistant Vibrio parahaemolyticus[J]. Archives of Virology, 2021, 166(2): 413-426. DOI:10.1007/s00705-020-04887-x |
| [4] |
HAN XL, ZHANG HY, CAO MX, SHEN XS. Analysis on current pollution of Vibrio parahemolyticus in seafood in China and its controlling strategy[J]. Food and Fermentation Industries, 2015, 41(7): 263-267. (in Chinese) 韩小龙, 张海燕, 曹明秀, 沈晓盛. 我国海产品中副溶血性弧菌的污染现状与控制策略分析[J]. 食品与发酵工业, 2015, 41(7): 263-267. |
| [5] |
CECCARELLI D, HASAN NA, HUQ A, COLWELL RR. Distribution and dynamics of epidemic and pandemic Vibrio parahaemolyticus virulence factors[J]. Frontiers in Cellular and Infection Microbiology, 2013, 3: 97. |
| [6] |
TRAN L, NUNAN LD, REDMAN RM, MOHNEY LL, PANTOJA CR, FITZSIMMONS K, LIGHTNER DV. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp[J]. Diseases of Aquatic Organisms, 2013, 105(1): 45-55. DOI:10.3354/dao02621 |
| [7] |
WU CG, FU JY, LI Y, HE ZG. Isolation, identification, and characterization of Vibrio parahaemolyticus phage Vpas_PP24[J]. Microbiology China, 2022, 49(11): 4644-4658. (in Chinese) 吴春光, 付静芸, 李映, 何增国. 副溶血弧菌噬菌体Vpas_PP24的分离鉴定及生物学特性[J]. 微生物学通报, 2022, 49(11): 4644-4658. |
| [8] |
WEI WJ, ZHAO S, WANG Y, ZHOU JF, LI XC, FANG WH. Detection of antibiotics resistance and distribution of resistance genes in Vibrio parahaemolyticus from cultured shrimp[J]. South China Fisheries Science, 2020, 16(1): 9-16. (in Chinese) 魏文娟, 赵姝, 王元, 周俊芳, 李新苍, 房文红. 副溶血弧菌养殖对虾分离株耐药性及耐药基因分析[J]. 南方水产科学, 2020, 16(1): 9-16. |
| [9] |
Ten ministries and commissions jointly issued "Several Opinions on Accelerating the Green Development of Aquaculture"[J]. China Fisheries, 2019(3): 3-6 (in Chinese). 十部委联合发布《关于加快推进水产养殖业绿色发展的若干意见》[J]. 中国水产, 2019(3): 3-6. |
| [10] |
LU ZY, FENG L, JIANG WD, WU P, LIU Y, JIANG J, KUANG SY, TANG L, LI SW, ZHONG CB, ZHOU XQ. Dietary mannan oligosaccharides strengthens intestinal immune barrier function via multipath cooperation during Aeromonas hydrophila infection in grass carp (Ctenopharyngodon idella)[J]. Frontiers in Immunology, 2022, 13: 1010221. DOI:10.3389/fimmu.2022.1010221 |
| [11] |
FIRMINO JP, GALINDO-VILLEGAS J, REYES-LÓPEZ FE, GISBERT E. Phytogenic bioactive compounds shape fish mucosal immunity[J]. Frontiers in Immunology, 2021, 12: 695973. DOI:10.3389/fimmu.2021.695973 |
| [12] |
DOAN HV, HOSEINIFAR SH, RINGØ E, ESTEBAN MÁ, DADAR M, DAWOOD MAO, FAGGIO C. Host-associated probiotics: a key factor in sustainable aquaculture[J]. Reviews in Fisheries Science & Aquaculture, 2020, 28(1): 16-42. |
| [13] |
CHEN Y, ZHANG YA, ZHOU Y. Research progress of bacteriophage in aquaculture[J]. Journal of Fisheries of China, 2021, 45(9): 1605-1615. (in Chinese) 陈愿, 张永安, 周洋. 噬菌体在水产养殖业中的研究进展[J]. 水产学报, 2021, 45(9): 1605-1615. |
| [14] |
ZHANG RQ. Epidemiological investigation of Vibrio from shellfish in Shandong Province and detection of virulence genes[D]. Tai'an: Master's Thesis of Shandong Agricultural University, 2021 (in Chinese). 张瑞卿. 山东省贝源弧菌流行病学调查及其毒力基因检测[D]. 泰安: 山东农业大学硕士学位论文, 2021. |
| [15] |
HAN JE, TANG KFJ, TRAN LH, LIGHTNER DV. Photorhabdus insect-related (Pir) toxin-like genes in a plasmid of Vibrio parahaemolyticus, the causative agent of acute hepatopancreatic necrosis disease (AHPND) of shrimp[J]. Diseases of Aquatic Organisms, 2015, 113(1): 33-40. DOI:10.3354/dao02830 |
| [16] |
LI P, KINCH LN, RAY A, DALIA AB, CONG Q, NUNAN LM, CAMILLI A, GRISHIN NV, SALOMON D, ORTH K. Acute hepatopancreatic necrosis disease-causing Vibrio parahaemolyticus strains maintain an antibacterial type VI secretion system with versatile effector repertoires[J]. Applied and Environmental Microbiology, 2017, 83(13): e00737-e00717. |
| [17] |
WANG YG, YU YX, LIU X, ZHANG YG, ZHANG Z, LIAO MJ, LI B, CAI XX, RONG XJ, LUO K. Pathogens and histopathological characteristics of shrimp postlarvae bacterial vitrified syndrome (BVS) in the Litopenaeus vannamei[J]. Journal of Fisheries of China, 2021, 45(9): 1563-1573. (in Chinese) 王印庚, 于永翔, 刘潇, 张永刚, 张正, 廖梅杰, 李彬, 蔡欣欣, 荣小军, 罗坤. 凡纳滨对虾虾苗细菌性玻化症(BVS)的病原、病理分析[J]. 水产学报, 2021, 45(9): 1563-1573. |
| [18] |
WANG JJ, FANG P, CHEN J, YUAN R, LIU XH. Monitoring and analysis of shrimp and crab breeding in Jiangsu Province in 2020[J]. Journal of Aquaculture, 2021, 42(7): 70-73, 76. (in Chinese) 王晶晶, 方苹, 陈静, 袁锐, 刘肖汉. 2020年江苏省虾蟹类养殖病情监测分析[J]. 水产养殖, 2021, 42(7): 70-73, 76. DOI:10.3969/j.issn.1004-2091.2021.07.020 |
| [19] |
ARANGUREN CARO LF, MAI HN, CRUZ-FLOREZ R, MARCOS FLA, ALENTON RRR, DHAR AK. Experimental reproduction of white feces syndrome in whiteleg shrimp, Penaeus vannamei[J]. PLoS One, 2021, 16(12): e0261289. DOI:10.1371/journal.pone.0261289 |
| [20] |
DONG XX, LI Z, WANG XH, ZHOU M, LIN L, ZHOU Y, LI JQ. Characteristics of Vibrio parahaemolyticus isolates obtained from crayfish (Procambarus clarkii) in freshwater[J]. International Journal of Food Microbiology, 2016, 238: 132-138. DOI:10.1016/j.ijfoodmicro.2016.09.004 |
| [21] |
WANG LP, JIANG LH, LIU G, WU CW, LIU BJ, LIU LQ, LV ZM, GONG L, SONG XJ. Molecular characterization and expression of TAK-binding proteins (TAB1-3) in Larimichthys crocea infected by Vibrio parahemolyticus and LPS[J]. Developmental and Comparative Immunology, 2019, 98: 108-118. DOI:10.1016/j.dci.2019.04.009 |
| [22] |
HU L, ZHAO FM, YU LP, LI Y, WANG B. Identification of pathogenic bacteria in turbot Scophthalmus maximus[J]. Fisheries Science, 2008, 27(7): 340-343. (in Chinese) 胡亮, 赵凤梅, 于兰萍, 李艳, 王斌. 副溶血弧菌对养殖大菱鲆致病性研究[J]. 水产科学, 2008, 27(7): 340-343. DOI:10.3969/j.issn.1003-1111.2008.07.004 |
| [23] |
AMALINA NZ, SANTHA S, ZULPERI D, AMAL MNA, YUSOF MT, ZAMRI-SAAD M, INA-SALWANY MY. Prevalence, antimicrobial susceptibility and plasmid profiling of Vibrio spp. isolated from cultured groupers in Peninsular Malaysia[J]. BMC Microbiology, 2019, 19(1): 251. DOI:10.1186/s12866-019-1624-2 |
| [24] |
HAMPTON HG, WATSON BNJ, FINERAN PC. The arms race between bacteria and their phage foes[J]. Nature, 2020, 577(7790): 327-336. DOI:10.1038/s41586-019-1894-8 |
| [25] |
JEONG HW, KIM JA, JEON SJ, CHOI SS, KIM MK, YI HJ, CHO SJ, KIM IY, CHON JW, KIM DH, BAE D, KIM H, SEO KH. Prevalence, antibiotic-resistance, and virulence characteristics of Vibrio parahaemolyticus in restaurant fish tanks in Seoul, Korea[J]. Foodborne Pathogens and Disease, 2020, 17(3): 209-214. DOI:10.1089/fpd.2019.2691 |
| [26] |
ALI S, HOSSAIN M, AZAD AB, SIDDIQUE AB, MONIRUZZAMAN M, AHMED MA, AMIN MB, ISLAM MS, RAHMAN MM, MONDAL D, MAHMUD ZH. Diversity of Vibrio parahaemolyticus in marine fishes of Bangladesh[J]. Journal of Applied Microbiology, 2021, 131(5): 2539-2551. DOI:10.1111/jam.15093 |
| [27] |
CHEN HH, DONG SL, YAN Y, ZHAN L, ZHANG JY, CHEN JC, ZHANG Z, ZHANG YY, MEI LL. Prevalence and population analysis of Vibrio parahaemolyticus isolated from freshwater fish in Zhejiang Province, China[J]. Foodborne Pathogens and Disease, 2021, 18(2): 139-146. DOI:10.1089/fpd.2020.2798 |
| [28] |
JIANG Y, YAO L, LI F, TAN Z, ZHAI Y, WANG L. Characterization of antimicrobial resistance of Vibrio parahaemolyticus from cultured sea cucumbers (Apostichopus japonicas)[J]. Letters in Applied Microbiology, 2014, 59(2): 147-154. DOI:10.1111/lam.12258 |
| [29] |
le ROUX F, BLOKESCH M. Eco-evolutionary dynamics linked to horizontal gene transfer in vibrios[J]. Annual Review of Microbiology, 2018, 72: 89-110. DOI:10.1146/annurev-micro-090817-062148 |
| [30] |
URQUHART EA, JONES SH, YU JW, SCHUSTER BM, MARCINKIEWICZ AL, WHISTLER CA, COOPER VS. Environmental conditions associated with elevated Vibrio parahaemolyticus concentrations in great bay estuary, new Hampshire[J]. PLoS One, 2016, 11(5): e0155018. DOI:10.1371/journal.pone.0155018 |
| [31] |
LI Y, PEI XY, YAN J, LIU DR, ZHANG HN, YU B, LI N, YANG DJ. Prevalence of foodborne pathogens isolated from retail freshwater fish and shellfish in China[J]. Food Control, 2019, 99: 131-136. DOI:10.1016/j.foodcont.2018.12.024 |
| [32] |
GORDILLO ALTAMIRANO FL, BARR JJ. Phage therapy in the postantibiotic era[J]. Clinical Microbiology Reviews, 2019, 32(2): e00066-e00018. |
| [33] |
VENTURINI C, PETROVIC FABIJAN A, FAJARDO LUBIAN A, BARBIRZ S, IREDELL J. Biological foundations of successful bacteriophage therapy[J]. EMBO Molecular Medicine, 2022, 14(7): e12435. DOI:10.15252/emmm.202012435 |
| [34] |
AN R. Past, present and future of phage therapy—dialogue with phage experts in microbiology[J]. Chinese Science Bulletin, 2017, 62(23): 2577-2580. (in Chinese) 安瑞. 噬菌体治疗的前世、今生与未来: 对话微生物学界噬菌体专家[J]. 科学通报, 2017, 62(23): 2577-2580. |
| [35] |
FEINER R, ARGOV T, RABINOVICH L, SIGAL N, BOROVOK I, HERSKOVITS AA. A new perspective on lysogeny: prophages as active regulatory switches of bacteria[J]. Nature Reviews Microbiology, 2015, 13(10): 641-650. DOI:10.1038/nrmicro3527 |
| [36] |
JUN JW, HAN JE, GIRI SS, TANG KFJ, ZHOU XH, ARANGUREN LF, KIM HJ, YUN S, CHI C, KIM SG, PARK SC. Phage application for the protection from acute hepatopancreatic necrosis disease (AHPND) in Penaeus vannamei[J]. Indian Journal of Microbiology, 2018, 58(1): 114-117. DOI:10.1007/s12088-017-0694-9 |
| [37] |
DING TY, SUN HZ, PAN Q, ZHAO FY, ZHANG ZZ, REN HY. Isolation and characterization of Vibrio parahaemolyticus bacteriophage vB_VpaS_PG07[J]. Virus Research, 2020, 286: 198080. DOI:10.1016/j.virusres.2020.198080 |
| [38] |
DUBEY S, SINGH A, NAVEEN KUMAR BT, SINGH NK, TYAGI A. Isolation and characterization of bacteriophages from inland saline aquaculture environments to control Vibrio parahaemolyticus contamination in shrimp[J]. Indian Journal of Microbiology, 2021, 61(2): 212-217. DOI:10.1007/s12088-021-00934-6 |
| [39] |
ALAGAPPAN K, KARUPPIAH V, DEIVASIGAMANI B. Protective effect of phages on experimental V. parahaemolyticus infection and immune response in shrimp (Fabricius, 1798)[J]. Aquaculture, 2016, 453: 86-92. |
| [40] |
STALIN N, SRINIVASAN P. Characterization of Vibrio parahaemolyticus and its specific phage from shrimp pond in Palk Strait, South East coast of India[J]. Biologicals, 2016, 44(6): 526-533. |
| [41] |
LOMELÍ-ORTEGA CO, MARTÍNEZ-DÍAZ SF. Phage therapy against Vibrio parahaemolyticus infection in the whiteleg shrimp (Litopenaeus vannamei) larvae[J]. Aquaculture, 2014, 434: 208-211. DOI:10.1016/j.aquaculture.2014.08.018 |
| [42] |
JUN JW, KIM HJ, YUN SK, CHAI JY, PARK SC. Eating oysters without risk of vibriosis: application of a bacteriophage against Vibrio parahaemolyticus in oysters[J]. International Journal of Food Microbiology, 2014, 188: 31-35. |
| [43] |
ZHANG H, YANG ZQ, ZHOU Y, BAO HD, WANG R, LI TW, PANG MD, SUN LC, ZHOU XH. Application of a phage in decontaminating Vibrio parahaemolyticus in oysters[J]. International Journal of Food Microbiology, 2018, 275: 24-31. |
| [44] |
ONARINDE BA, DIXON RA. Prospects for biocontrol of Vibrio parahaemolyticus contamination in blue mussels (Mytilus edulus): a year-long study[J]. Frontiers in Microbiology, 2018, 9: 1043. |
| [45] |
REN HY, LI Z, XU YP, WANG LL, LI XY. Protective effectiveness of feeding phage cocktails in controlling Vibrio parahaemolyticus infection of sea cucumber Apostichopus japonicus[J]. Aquaculture, 2019, 503: 322-329. |
| [46] |
YOU HJ, LEE JH, OH MJ, Hong SY, KIM D, NOH J, KIM M, KIM BS. Tackling Vibrio parahaemolyticus in ready-to-eat raw fish flesh slices using lytic phage VPT02 isolated from market oyster[J]. Food Research International, 2021, 150: 110779. |
| [47] |
TENG L, ZOU G, ZHOU Y, LI J, SONG ZY, DONG XX, MA ZX, ZHENG ZJ, CHEN HC, LI JQ. Phage controlling method against novel freshwater-derived Vibrio parahaemolyticus in ready-to-eat crayfish (Procambarus clarkii)[J]. Food Research International (Ottawa, Ont), 2022, 162(Pt A): 111986.
|
| [48] |
XIA H, YANG HJ, YAN N, HOU WF, WANG HJ, WANG XH, WANG HX, ZHOU M. Bacteriostatic effects of phage F23s1 and its endolysin on Vibrio parahaemolyticus[J]. Journal of Basic Microbiology, 2022, 62(8): 963-974. |
| [49] |
GUO YT, LI J, ISLAM MS, YAN T, ZHOU Y, LIANG L, CONNERTON IF, DENG K, LI JQ. Application of a novel phage vB_SalS-LPSTLL for the biological control of Salmonella in foods[J]. Food Research International (Ottawa, Ont), 2021, 147: 110492. |
| [50] |
DONATI VL, DALSGAARD I, SUNDELL K, CASTILLO D, ER-RAFIK M, CLARK J, WIKLUND T, MIDDELBOE M, MADSEN L. Phage-mediated control of Flavobacterium psychrophilum in aquaculture: in vivo experiments to compare delivery methods[J]. Frontiers in Microbiology, 2021, 12: 628309. |
| [51] |
ALMEIDA GMF, MÄKELÄ K, LAANTO E, PULKKINEN J, VIELMA J, SUNDBERG LR. The fate of bacteriophages in recirculating aquaculture systems (RAS)-towards developing phage therapy for RAS[J]. Antibiotics (Basel, Switzerland), 2019, 8(4): 192. |
| [52] |
QIAO H, XU XL, FEI WB, HUANG J, CHEN H, HU YL, CONG Y. Isolation, identification and biological properties of 3 lytic bacterio phages against AHPND-associated Vibrio parahaemolyticus[J]. Journal of Fisheries of China, 2019, 43(5): 1378-1396. (in Chinese) 乔欢, 徐旭凌, 费文斌, 黄杰, 陈海, 胡怿林, 丛郁. 三株AHPND致病型副溶血性弧菌烈性噬菌体的分离鉴定及其生物学特性[J]. 水产学报, 2019, 43(5): 1378-1396. |
| [53] |
MAKAROV R, LOMELÍ-ORTEGA CO, ZERMEÑO-CERVANTES LA, GARCÍA-ÁLVAREZ E, GUTIÉRREZ-RIVERA JN, CARDONA-FÉLIX CS, MARTÍNEZ-DÍAZ SF. Evaluation of a cocktail of phages for the control of presumptive Vibrio parahaemolyticus strains associated to acute hepatopancreatic necrosis disease[J]. Aquaculture Research, 2019, 50(11): 3107-3116. |
| [54] |
WONG HC, WANG TY, YANG CW, TANG CT, YING C, WANG CH, CHANG WH. Characterization of a lytic vibriophage VP06 of Vibrio parahaemolyticus[J]. Research in Microbiology, 2019, 170(1): 13-23. |
| [55] |
ZHENG XS, GAO L, ZHANG H, RAO SQ, YANG ZQ. Screening for broad-spectrum lytic phage against Vibrio parahaemolyticus and its application to marine products[J]. Food Science, 2019, 40(10): 141-148. (in Chinese) 郑小双, 高璐, 张辉, 饶胜其, 杨振泉. 副溶血性弧菌广谱裂解性噬菌体的筛选及其在海产品安全控制中的应用[J]. 食品科学, 2019, 40(10): 141-148. |
| [56] |
ROYER S, MORAIS AP, Da FONSECA BATISTÃO DW. Phage therapy as strategy to face post-antibiotic era: a guide to beginners and experts[J]. Archives of Microbiology, 2021, 203(4): 1271-1279. |
| [57] |
LI XH, HU TX, WEI JC, HE YH, ABDALLA AE, WANG GY, LI YZ, TENG TS. Characterization of a novel bacteriophage Henu2 and evaluation of the synergistic antibacterial activity of phage-antibiotics[J]. Antibiotics (Basel, Switzerland), 2021, 10(2): 174. |
| [58] |
KORTRIGHT KE, CHAN BK, KOFF JL, TURNER PE. Phage therapy: a renewed approach to combat antibiotic-resistant bacteria[J]. Cell Host & Microbe, 2019, 25(2): 219-232. |
| [59] |
LI XH, HE YH, WANG ZL, WEI JC, HU TX, SI JZ, TAO GZ, ZHANG L, XIE LX, ABDALLA AE, WANG GY, LI YZ, TENG TS. A combination therapy of phages and antibiotics: two is better than one[J]. International Journal of Biological Sciences, 2021, 17(13): 3573-3582. |
| [60] |
RASMUSSEN BB, KALATZIS PG, MIDDELBOE M, GRAM L. Combining probiotic Phaeobacter inhibens DSM17395 and broad-host-range vibriophage KVP40 against fish pathogenic vibrios[J]. Aquaculture, 2019, 513: 734415. |
| [61] |
LE S, YAO XY, LU SG, TAN YL, RAO XC, LI M, JIN XL, WANG J, ZHAO Y, WU NC, LUX R, HE XS, SHI WY, HU FQ. Chromosomal DNA deletion confers phage resistance to Pseudomonas aeruginosa[J]. Scientific Reports, 2014, 4(1): 4738. |
| [62] |
LEÓN M, BASTÍAS R. Virulence reduction in bacteriophage resistant bacteria[J]. Frontiers in Microbiology, 2015, 6: 343. |
| [63] |
CHAN BK, SISTROM M, WERTZ JE, KORTRIGHT KE, NARAYAN D, TURNER PE. Phage selection restores antibiotic sensitivity in MDR Pseudomonas aeruginosa[J]. Scientific Reports, 2016, 6: 26717. |
| [64] |
KUMARAN D, TAHA M, YI QL, RAMIREZ-ARCOS S, DIALLO JS, CARLI A, ABDELBARY H. Does treatment order matter? Investigating the ability of bacteriophage to augment antibiotic activity against Staphylococcus aureus biofilms[J]. Frontiers in Microbiology, 2018, 9: 127. |
| [65] |
Food and Agriculture Organization of the United Nations. The state of world fisheries and aquaculture 2020[R]. Sustainability in action, Rome, 2020. DOI: 10.18356/8d6ea4b6-en.
|
| [66] |
HASSAN SWM, ALI SM, AlMISHERFI MM. Isolation and molecular characterization of some marine Aeromonas phages: protective effects for Nile Tilapia infected with Aeromonas hydrophila[J]. Journal of Pure and Applied Microbiology, 2018, 12(3): 1175-1185. |
| [67] |
ADLER BA, HESSLER T, CRESS BF, LAHIRI A, MUTALIK VK, BARRANGOU R, BANFIELD J, DOUDNA JA. Broad-spectrum CRISPR-Cas13a enables efficient phage genome editing[J]. Nature Microbiology, 2022, 7(12): 1967-1979. |
 2023, Vol. 50
2023, Vol. 50