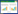扩展功能
文章信息
- 梁静盈, 梁俊峰, 陈言柳, 何茜
- LIANG Jingying, LIANG Junfeng, CHEN Yanliu, HE Qian
- 撕裂蜡孔菌(Emmia lacerata) SR5抑菌特性及生防潜力评价
- Antifungal characteristics and biocontrol potential of Emmia lacerata SR5
- 微生物学通报, 2023, 50(7): 2923-2936
- Microbiology China, 2023, 50(7): 2923-2936
- DOI: 10.13344/j.microbiol.china.220995
-
文章历史
- 收稿日期: 2022-10-11
- 接受日期: 2023-01-05
- 网络首发日期: 2023-02-14
2. 中国林业科学研究院热带林业研究所, 广东 广州 510520
2. Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou 510520, Guangdong, China
由病原真菌引起的植物病害对农产品的产量、品质及安全方面都构成了极大威胁,造成严重的经济损失。目前以菌治菌的生物防治方法,因其安全有效、抗药性低和促进农业可持续发展等特点,成为一种新型可靠的植物病害防治方法[1-2]。其中,真菌是生防微生物中的关键组成部分,目前研究较为广泛和深入的类群有木霉(Trichoderma spp.)、盾壳霉(Coniothyrium spp.)和粘帚霉(Gliocladium spp.)等。生防真菌发挥抑菌能力与其生长方式和生长过程中产生的代谢物质相关,主要以营养和空间竞争、重寄生、产生具有抑菌活性的代谢产物、诱导寄主抗性等方式直接或间接发挥生防作用[3-5]。其中,竞争和重寄生是真菌抑菌最直接的方式,生防真菌以快速生长的方式与病原微生物竞争营养和生存空间,抢占生长位点,有利于生防真菌在环境中成功定殖[3]。具重寄生作用的生防真菌能通过识别病原真菌细胞表面的凝集素分泌细胞壁降解酶及抗菌物质,穿透、溶解病原菌菌丝[4],还能产生铁载体、抗生素等抑菌活性物质来发挥抗菌作用[5]。
生防微生物是以菌治菌的关键因素,目前从环境微生物和植物内生菌中筛选生防菌较为普遍。吕佳等[6]从不同龄肉桂的叶、枝和根等器官筛选出对肉桂枯枝病抑菌率高于52%的9株内生真菌,为肉桂枝枯病生物防治提供了菌种资源;薛鸣等[7]从橡胶园根围土壤中分离获得6株有效拮抗橡胶树两种叶部病害的木霉菌株;黄婷等[8]对烟草根围土壤筛选出55株具有拮抗烟草疫霉(Phytophthora nicotianae)的枝穗霉(Closnostachys spp.)菌株,丰富了拮抗疫霉的枝穗霉生防种质资源。然而,能否适应复杂环境是目前生防微生物应用的重要制约因素,能够适应复杂环境的微生物具有广泛的应用前景和开发价值。撕裂蜡孔菌(Emmia lacerata)是一种白腐真菌[9],在腐木、活树、植物凋落物和土壤中广泛存在[10-11],环境适应性强,具有合成多酚、黄酮、胞外多糖等抗氧化物能力,常用于医学研究[12];该菌还能分泌木质素酶、漆酶、纤维素酶等水解酶,兼具吸附重金属的能力等,能分解木质素、纤维素、多环芳烃等,可用于造纸、环境毒物降解、废水处理等领域研究[13-14];又因其具有分泌有机酸、铁载体、磷酸酶等特点,能有效活化土壤养分,促进植物营养吸收利用,从而提高作物产量和品质,同时还能有效防治田间真菌病害,近年来在农业生产领域开始广泛研究[15-19]。最新研究发现,撕裂蜡孔菌产生的挥发性有机物具有抑制青霉生长的特点,能有效延长柑橘采后储存期,表明撕裂蜡孔菌具有重要的抑菌潜力[20]。因此,本研究通过平板对峙法和发酵液抑菌法测定撕裂蜡孔菌SR5对9种病原真菌的抑菌效果,结合CAS检测法检测其产铁载体的能力,以期挖掘撕裂蜡孔菌SR5作为生防菌的潜力,为其在农业方面的开发利用提供理论依据。
1 材料与方法 1.1 材料 1.1.1 菌株供试撕裂蜡孔菌(Emmia lacerata) SR5保存于中国林业科学研究院热带林业研究所(广州)森林微生物资源及应用实验室;供试阳性对照钩状木霉(Trichoderma hamatum) T16来自中国农业科学院蔬菜花卉研究所蔬菜病害研究课题组。
供试病原真菌间座壳(Diaporthe sp.)、香港丽赤壳(Calonectria hongkongensis)、尖孢镰孢(Fusarium oxysporum)、腐皮镰孢(Fusarium solani)、果生刺盘孢(Colletotrichum fructicola)、可可毛色二孢(Lasiodiplodia theobromae)、小孢拟盘多毛孢(Pestalotiopsis microspore)、黑孢霉(Nigrospora sp.)和球座菌(Guignardia sp.)均由中国林业科学研究院热带林业研究所(广州)森林微生物资源及应用实验室提供。
1.1.2 培养基微生物活化培养及抑菌实验均用马铃薯葡萄糖琼脂/液体培养基(PDA/PDB)[21];CAS固体/液体培养基(g/L)[22]用于铁载体定性/定量测定,将其中PIPES缓冲液更换为pH 6.8的磷酸盐缓冲液(g/L:NaH2PO4·2H2O 5.9,Na2HPO4·12H2O 24.3,NH4Cl 2.5,KH2PO4 0.8,NaCl 1.3),根据菌株生长所需添加必要的葡萄糖(10.0 g/L)和蛋白胨(10.0 g/L)为营养源,改良CAS液体培养基为不加琼脂和CAS检测液的基础培养基。
1.1.3 主要试剂和仪器铬天青S、蛋白胨,生工生物工程(上海)股份有限公司。高速冷冻离心机,贝克曼库尔特商贸(中国)有限公司;超净工作台,广州市正一科技有限公司;生化培养箱,常州普天仪器制造有限公司;恒温振荡器,上海一恒科学仪器有限公司;Varioskan LUX多功能酶标仪,赛默飞世尔科技(中国)有限公司;光学显微镜,卡尔·蔡司公司。
1.2 SR5菌株对9种病原真菌的拮抗能力测定 1.2.1 平板对峙与拮抗能力测定采用平板对峙培养法测定抑菌活性,将待测9种病原真菌和SR5菌饼(Φ=10 mm)分别接种于同一个PDA平板两侧对称的位置,以T16替换SR5作为对峙阳性对照,仅接种病原真菌的平板为阴性对照,置25 ℃恒温培养,每个处理重复5次,并于第2天开始每天用十字交叉法测量并记录病原真菌单独培养的菌落半径(R)和对峙培养的趋向半径(r),计算抑菌率:抑菌率(%)=(R–r)/R×100。根据真菌拮抗分级方法[23]评价拮抗菌SR5、T16与病原真菌对峙生长抑制情况。Ⅰ:拮抗菌丝完全占领平板;Ⅱ:拮抗菌丝占领平板面≥2/3;Ⅲ:拮抗菌丝占领平板面 < 2/3,但≥1/3;Ⅳ:拮抗菌丝占领平板面 < 1/3;Ⅴ:病原菌菌丝完全占领平板。挑取SR5与病原真菌接触面及阴性对照组菌丝,用光学显微镜观察菌丝分布及形态变化。
1.2.2 SR5发酵液对常见病原真菌的拮抗能力测定依照白如霞等[16]的方法制备含25%和50% SR5发酵液的平板。将5个SR5菌饼(Φ=10 mm)打入装有150 mL PDB的250 mL锥形瓶中,25 ℃、150 r/min连续培养14 d。制好的发酵液于10 000 r/min离心10 min除去菌丝,先后用0.45 μm、0.22 μm滤膜各真空抽滤1次,备用。配制PDA,121 ℃灭菌25 min,冷却至50 ℃左右后,加入真空抽滤后的发酵液,按PDA: 发酵液为1:4和1:2 (体积比)混合,分别制作成25%和50%的发酵液平板,以灭菌PDB代替发酵滤液作为空白对照(CK),将待测9种病原真菌菌饼(Φ=10 mm)接种于平板中央,25 ℃恒温培养,每个处理重复5次,并于第3天开始每天用十字交叉法测量并记录对照组菌落直径(D)和处理组直径(d),计算抑菌率:抑菌率(%)=(D–d)/D×100。分别挑取对照组和处理组的菌丝,用光学显微镜观察菌丝形态变化。
1.3 SR5菌株产铁载体能力测定 1.3.1 定性测定CAS检测法[22]测定SR5产生铁载体的能力。将SR5转接到CAS固体检测培养基,25 ℃、黑暗条件下培养,若菌落周围出现橙黄色晕圈,则表明菌株产生铁载体,每天观察并测量晕圈直径(D)和菌落直径(d),计算可溶性指数D/d [24]。
1.3.2 铁载体分泌曲线测定依照Schwyn等[22]的方法定量检测铁载体,检测波长改为680 nm。将SR5菌饼(Φ=10 mm)打入装有150 mL改良CAS液体培养基的250 mL锥形瓶中,每个锥形瓶接5个菌饼,25 ℃、150 r/min连续培养,每个处理重复5次。从培养的第2–7天每天取培养菌液,10 000 r/min离心10 min后取上清,在96孔板孔中加入100 μL CAS检测液,再加入等量上清发酵液混匀,另取100 μL未接菌的空白PDB作对照参比,与等量CAS检测液混匀,静置30 min,用多功能酶标仪在680 nm处测定发酵液吸光值(As)和参比值(Ar),并取去离子水作为对照调零,计算产铁载体活性单位(siderophore unit, SU)[25]:SU=[(Ar‒As)/Ar]×100。以As/Ar[24]表示铁载体的相对含量,划分产铁载体能力等级,比值越低,相对铁载体含量越高,从1.0–0.0之间以0.2为间隔,每减小0.2增加1个+。
1.4 数据处理及分析所有数据使用Microsoft Excel 2010和SPSS 25.0软件进行整理和分析。采用Duncan法作多重比较(P <0.05),采用GraphPad Prism V8.0制图。
2 结果与分析 2.1 SR5菌株广谱抑菌结果 2.1.1 平板对峙抑菌结果及其病原真菌形态特征对峙培养7 d后SR5对9种病原真菌的抑菌率在23.7%–62.7%之间(表 1),其中SR5对香港丽赤壳和间座壳的抑菌能力最强,抑菌率分别达62.7%和61.6%,显著高于其他病原真菌对峙结果(P < 0.05);而对可可毛色二孢的抑菌效果最差,抑菌率仅为23.7%。与阳性对照钩状木霉T16相比,SR5对香港丽赤壳和间座壳的抑菌率更高,对小孢拟盘多毛孢的抑菌率相似,但SR5对尖孢镰孢、腐皮镰孢、果生刺盘孢、黑孢霉、球座菌、可可毛色二孢的抑菌效果要低于T16。SR5对除可可毛色二孢的拮抗等级为IV外,对另外8种病原真菌的拮抗等级均为Ⅲ级;而T16对球座菌的拮抗等级为II级,对其他病原真菌的拮抗等级均为III级(表 1)。
| 菌株 Strain |
SR5 | T16 | |||
| 抑菌率 Inhibition rate (%) |
拮抗等级 Antagonistic degree |
抑菌率 Inhibition rate (%) |
拮抗等级 Antagonistic degree |
||
| 尖孢镰孢 Fusarium oxysporum |
41.7±5.7b | Ⅲ | 51.8±0.0cde | Ⅲ | |
| 间座壳Diaporthe sp. | 61.6±2.2a | Ⅲ | 55.7±0.0bcd | Ⅲ | |
| 香港丽赤壳 Calonectria hongkongensis |
62.7±2.3a | Ⅲ | 50.5±0.0de | Ⅲ | |
| 腐皮镰孢 Fusarium solani |
35.5±3.8bc | Ⅲ | 50.0±0.0de | Ⅲ | |
| 果生刺盘孢 Colletotrichum fructicola |
38.7±5.4b | Ⅲ | 61.2±0.0b | Ⅲ | |
| 小孢拟盘多毛孢 Pestalotiopsis microspora |
46.9±7.0b | Ⅲ | 46.3±0.0e | Ⅲ | |
| 黑孢霉 Nigrospora sp. |
39.1±2.2b | Ⅲ | 47.6±0.0e | Ⅲ | |
| 球座菌 Guignardia sp. |
47.4±1.3b | Ⅲ | 71.5±0.0a | Ⅱ | |
| 可可毛色二孢 Lasiodiplodia theobromae |
23.7±4.0c | Ⅳ | 58.7±0.0bc | Ⅲ | |
| 同列不同小写字母表示经邓肯法检验在P < 0.05水平差异显著. 下同 Different lowercase letters in the same column indicate significant difference at P < 0.05 level by Duncan’ s test. The same below. |
|||||
两株拮抗菌与病原真菌接触后,病原真菌均停止生长。区别是,SR5继续生长,菌丝逐渐覆盖病原真菌菌落,12 d后对除了果生刺盘孢和可可毛色二孢外的其他7种病原真菌菌落覆盖率达100% (图 1A11–1I11),而T16仅对病原真菌形成包围圈(图 1A22–1I22)。T16拮抗香港丽赤壳时出现抑菌圈,而SR5未出现这种情况,表明这2种拮抗菌对病原真菌的抑菌方式存在差异。尖孢镰孢、球座菌和可可毛色二孢被SR5菌丝接触覆盖后,菌丝色素随对峙时间增加出现降解白化,菌体逐渐死亡(图 1A1、1H1、1I1),而T16处理未出现褪色现象。

|
| 图 1 SR5与不同病原真菌对峙培养及病原真菌菌丝形态特征 Figure 1 The dual culture of SR5 with different pathogenic fungi and observation of mycelium morphology. A:尖孢镰孢. B:间座壳. C:香港丽赤壳. D:腐皮镰孢. E:果生刺盘孢. F:小孢拟盘多毛孢. G:黑孢霉. H:可可毛色二孢. I:球座菌. 小写字母为显微镜下菌丝观察结果,与大写字母所代表病原真菌一一对应 A: Fusarium oxysporum. B: Diaporthe sp.. C: Calonectria hongkongensis. D: Fusarium solani. E: Colletotrichum fructicola. F: Pestalotiopsis microspora. G: Nigrospora sp.. H: Lasiodiplodia theobromae. I: Guignardia sp.. The lowercase letters are the hyphal observation results under the microscope, and correspond to the pathogenic bacteria represented by the uppercase letters one by one. |
|
|
挑取SR5对峙组病原真菌菌落边缘和接触界面菌丝进行显微镜观察,两者菌丝平行交错生长,对照的病原真菌菌丝粗细均匀,表面光滑。当SR5接触并覆盖病原真菌菌落后,SR5菌丝仍保持正常形态继续生长;而被覆盖或被侵占部分的对峙病原真菌菌丝均出现不同程度的变形,并带有扭曲、空泡化、断裂、消融、膨大和畸形(图 1a1–1i1)等情况。显微镜观察发现香港丽赤壳顶端菌丝空泡、膨胀(图 1c1),黑孢霉和可可毛色二孢出现菌丝扭曲、溢裂、内容物质流出(图 1g1、1h1),球座菌的菌丝断裂(图 1i1)。
2.1.2 SR5发酵液抑菌活性及病原真菌菌丝形态特征不同浓度发酵液抑菌效果见图 2和图 3。菌株发酵液对尖孢镰孢和间座壳的抑菌效果最佳,不同发酵液浓度处理下抑菌率分别保持在21.1%–40.7%和28.3%–42.3%。在25%和50%发酵液处理下,各病原真菌在培养第3天时抑菌效果最明显,对香港丽赤壳生长的抑制效果最好,抑菌率分别为46.3%和79.0% (图 2)。随着培养时间延长,总体抑菌率逐渐降低,而尖孢镰孢、间座壳和腐皮镰孢抑菌率随时间延长无明显变化。
|
| 图 2 不同浓度SR5发酵液对9种病原真菌的抑菌率 Figure 2 Inhibition rate of deferent concentration SR5 fermentation supernatant to 9 pathogenic fungi. A:尖孢镰孢. B:间座壳. C:香港丽赤壳. D:腐皮镰孢. E:果生刺盘孢. F:小孢拟盘多毛孢. G:黑孢霉. H:球座菌. I:可可毛色二孢 A: Fusarium oxysporum. B: Diaporthe sp.. C: Calonectria hongkongensis. D: Fusarium. solani. E: Colletotrichum fructicola. F: Pestalotiopsis microspora. G: Nigrospora sp.. H: Guignardia sp.. I: Lasiodiplodia theobromae. |
|
|
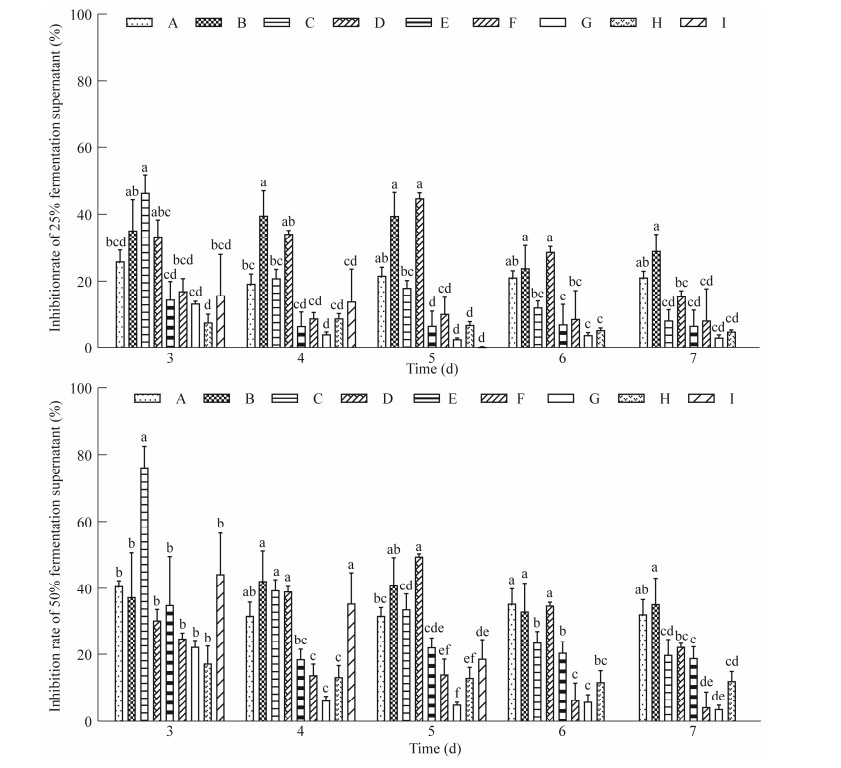
|
| 图 3 不同SR5发酵液浓度对9种病原真菌的抑菌率 Figure 3 Situation of inhibition rate of SR5 fermentation supernatant against 9 pathogenic fungi in different concentration. A:尖孢镰孢. B:间座壳. C:黑孢霉. D:小孢拟盘多毛孢. E:果生刺盘孢. F:球座菌. G:可可毛色二孢. H:香港丽赤壳. I:腐皮镰孢 A: Fusarium oxysporum. B: Diaporthe sp.. C: Nigrospora sp.. D: Lasiodiplodia theobromae. E: Colletotrichum fructicola. F: Guignardia sp.. G: Lasiodiplodia theobromae. H: Calonectria hongkongensis. I: Fusarium solani. |
|
|
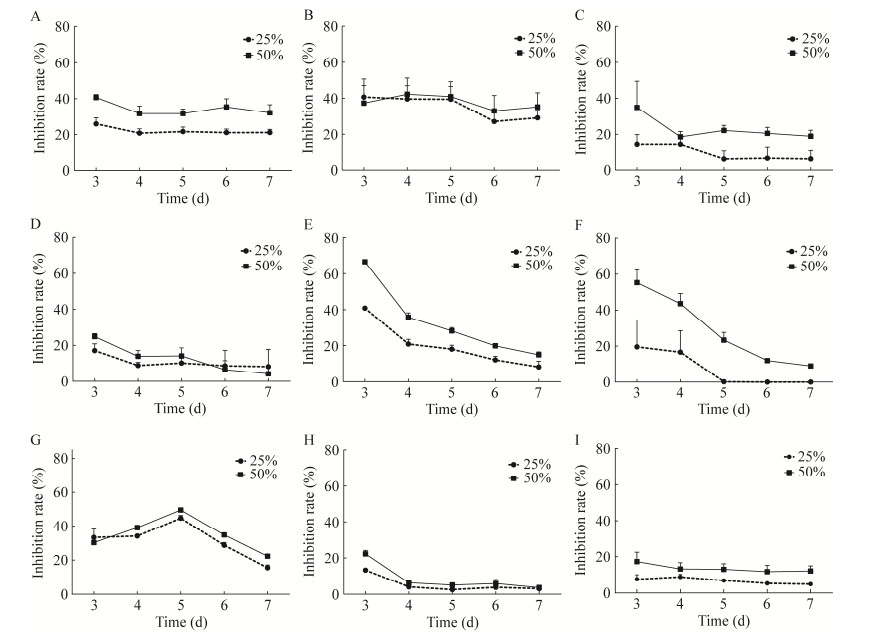
不同发酵液浓度对病原真菌抑菌率的影响不同,尖孢镰孢、腐皮镰孢、果生刺盘孢和球座菌随发酵浓度升高,抑菌效果增加;发酵液浓度对间座壳、小孢拟盘多毛孢、可可毛色二孢和香港丽赤壳的抑菌效果不明显(图 3)。挑取不同处理病原真菌菌丝进行显微镜观察发现,接种发酵液平板的真菌菌丝形态异常(图 4),尖孢镰孢和间座壳的菌丝出现老化和破碎(图 4A、4B),黑孢霉菌丝细胞肿胀(图 4D),可可毛色二孢(图 4E)菌丝形态变异。
|
| 图 4 SR5发酵液对不同病原真菌的抑制作用及病原真菌菌丝形态观察 Figure 4 Inhibition effect of SR5 fermentation supernatant on different pathogenic fungi and observation of mycelium morphology. A:尖孢镰孢. B:间座壳. C:腐皮镰孢. D:黑孢霉. E:可可毛色二孢 A: Fusarium oxysporum. B: Diaporthe sp.. C: Fusarium solani. D: Nigrospora sp.. E: Lasiodiplodia theobromae. |
|
|
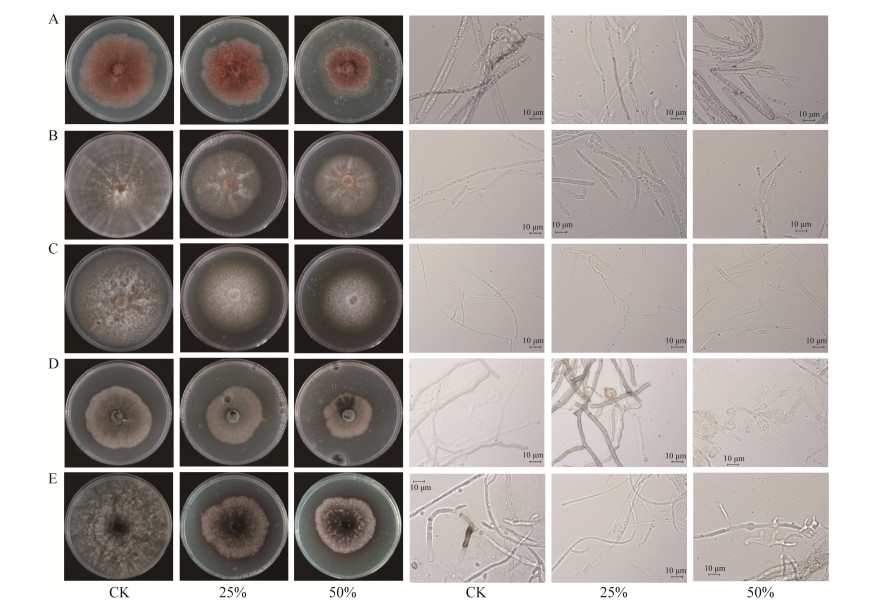
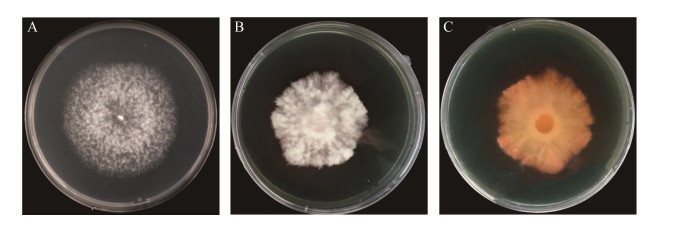
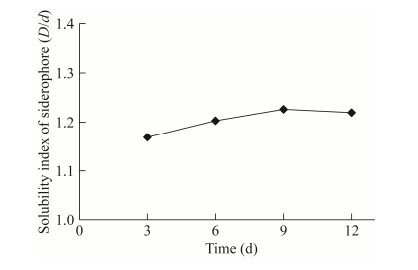
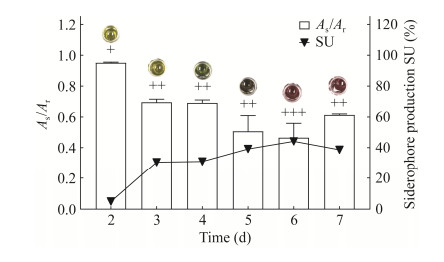
图 5为SR5在PDA和CAS培养基上的菌落形态,在CAS培养基上能产生橘黄色晕圈,表示SR5能产生铁载体。从培养第2天开始出现晕圈,培养第9天可溶性指数最高,D/d为1.2 (图 6)。SR5在改良CAS液体培养基中培养7 d,期间每天对所产铁载体进行相对定量测定(图 7),结果表明,SR5产铁载体活力在2–5 d不断提升,培养第3天发酵上清液加入检测液后开始变色,铁载体分泌活性增长最明显,同比第2天增长25.7%;培养第6天显色反应最明显,铁载体分泌活性最大,SU=44.1%,As/Ar为0.6,菌株分泌铁载体的能力为++ (图 7)。
|
| 图 5 SR5在不同培养基上的菌落形态 Figure 5 Colony of SR5 strains on different medium. A:PDA培养基. B:CAS培养基正面. C:CAS培养基背面 A: PDA medium. B: CAS front medium. C: CAS medium back. |
|
|
|
| 图 6 SR5产铁载体可溶性指数随培养时间的变化 Figure 6 Change of solubility index of siderophore produced by SR5 with time. |
|
|
|
图 7 SR5产铁载体量随培养时间的变化规律
Figure 7 Variation of siderophores production by strain SR5 with time.
+代表产铁载体能力等级; 代表与检测液反应变色情况
+ indicates CAS coloration positive; 代表与检测液反应变色情况
+ indicates CAS coloration positive;  indicates the discoloration caused by reaction with the test solution. indicates the discoloration caused by reaction with the test solution.
|
|
|
依据菌株间存在共生或竞争的菌落互作关系,可将菌落互作关系划分为距离抑制(distance-inhibition)、区域线抑制(zone-line)、接触抑制(contact-inhibition)和过度生长(overgrowth)这4种类型[26]。本研究中,撕裂蜡孔菌SR5与钩状木霉T16拮抗方式不同,T16以接触抑制方式拮抗病原真菌,SR5则是以过度生长的方式快速拮抗病原真菌,而快速生长和覆盖病原菌菌落是拮抗真菌重寄生的基础和条件[27]。值得注意的是,对峙拮抗效果与拮抗菌的生长速率、病原菌生长抑制率和菌落覆盖程度等多个因素有关[28]。李思等[29]从蓝莓根部分离了木霉属内生真菌,其中5株绿色木霉(Trichoderma viride)对尖孢镰孢的抑菌率介于39.6%–50.4%,对间座壳抑菌率介于58.4%–69.0%。本研究中SR5对峙7 d时抑菌率介于23.7%–62.7%,对间座壳抑菌率为62.6%,抑菌能力介于已报道生防菌之间[30-32],能有效抑制病原真菌生长,而且对不同的病原真菌有不同的抑菌能力,说明该菌株具有作为生防菌的潜力,为病原真菌生物防治提供了更多的选择。
进一步观察发现,对峙12 d后SR5对除果生刺盘孢和可可毛色二孢外的其他7种病原真菌菌落覆盖率达100%,产紫红色素的尖孢镰孢、产黑色素的球座菌和可可毛色二孢菌丝被SR5覆盖后,自身色素随抑菌时间延长被完全降解,直至菌体死亡。真菌色素能增强真菌抵抗外界不良环境的能力,一些病原真菌可通过产生色素参与致病过程,如黑色素被认为是植物病原菌的致病因子之一[33]。研究表明撕裂蜡孔菌能通过吸附和产酶2种降解方式对环境中的难降解有机物发挥一定的降解和脱毒作用[13-14]。在本实验中撕裂蜡孔菌SR5能降解真菌色素,从而减少病原真菌毒力,发挥抑菌作用。显微观察发现接触区和覆盖区中SR5与病原真菌菌丝平行或交错生长,未发现菌丝穿孔的重寄生现象,但观察到断裂SR5菌丝内容物丰富,推测胞内产物或许是SR5抑菌关键因素之一,暗示生防真菌接触病原菌后刺激胞内拮抗物质释放[34]。
代谢物是生防菌发挥抗菌作用的主要因素之一,真菌产生胞外代谢物的种类和发挥作用的条件是代谢物发挥抗菌作用的关键[35]。相关研究表明白腐真菌(Hypocrea lixii) SCSIO 41520的主要次级代谢产物rugulosin能有效发挥抑菌作用[36]。白如霞等[16]发现撕裂蜡孔菌HG2011发酵液对甜瓜球腔菌的抑菌率为25.9%–32.4%,与本研究中SR5发酵液抑菌率相似。SR5发酵液对尖孢镰孢和间座壳有显著的抑菌活性,但对黑孢霉和球座菌无明显的抑制作用,说明产生的代谢物对不同病原真菌的抑菌作用有所不同。
铁载体是一类能螯合环境中游离Fe3+离子的小分子化合物,常以补铁剂的形式在环境中发挥作用,在生态环境、植物营养和植物保护等方面有重要影响[37]。一般而言,干扰病原菌对环境铁元素的吸收是真菌铁载体抑制病原菌生长的主要方式[38]。Fgaier等[39]的研究也表明能够产生铁载体的菌种比非产铁载体菌种在调控植物病原微生物群落结构和组成上更具有竞争优势。本研究发现菌株SR5具有产生铁载体的能力,产铁载体活性呈先增后减的趋势,推测其分泌能力与培养基营养成分消耗或真菌生长代谢过程中次生代谢物互作有关,此结果与许佳露等[40]的研究相似。然而真菌产铁载体活性及其抑菌效果与其产铁载体类型、培养条件和其他强螯合物存在与否等因素有关。赵江源等[41]发现产异羟肟酸盐型铁载体的云南木霉(Trichoderma yunnanense) 2-14F2对青枯雷尔氏菌(Ralstonia solanacearum)具有抑菌活性;彭雯杰等[42]优化产异肟羟酸型铁载体的阿斯青霉菌(Penicilium asturianum) XK-12产铁载体条件后对葡萄座腔菌(Neofusicoccum kwambonambiense) XKD-1的抑制率达100%。本研究中,SR5对9种病原真菌的抑菌作用可能与其产生的铁载体相关,但具体的相关性需要进一步的实验来证明。
已有研究表明,撕裂蜡孔菌制成菌剂能提高黄瓜、辣椒、番茄等作物对土壤养分的吸收和转化,从而实现增产增效的目的[16-17, 19];同时对黄瓜蔓枯病、茄子绵疫病、烟草黑胫病大田防效均在60%以上[16, 18, 43],且预防效果优于治疗效果,为撕裂蜡孔菌发挥生防效应奠定了基础。本课题组在前期研究中发现,SR5对火力楠的生长具有促生效果[44]。然而本研究发现,病原真菌与SR5菌丝接触后停止生长,表明SR5在前期定殖中能优先发挥竞争优势,预防大于治疗,为后续撕裂蜡孔菌的开发利用提供了理论基础。
4 结论(1) SR5对不同病原真菌的抑制效果不同,对峙7 d后,SR5对香港丽赤壳和间座壳的抑制效果最好,抑菌率分别达到61.6%和62.8%,高于阳性对照;对尖孢镰孢、腐皮镰孢、间座壳香港丽赤壳、果生刺盘孢、小孢拟盘多毛孢、黑孢霉和球座菌的拮抗等级为III级;对峙12 d后对除了果生刺盘孢和可可毛色二孢外其他7种病原真菌菌落覆盖度为100%。
(2) SR5发酵液对病原真菌的抑制效果不同,生长初期对病原真菌的抑菌效果最佳,随培养时间延长,总体抑菌效果逐渐下降。发酵液浓度增大,对尖孢镰孢、黑孢霉、果生刺盘孢和球座菌的抑制效果明显。
(3) SR5能产生铁载体,产铁载体活力随培养时间呈现先上升后下降趋势,在第6天达到最大(SU=44.1%,As/Ar为0.6)。
| [1] |
GUPTA S, BANSAL S, KAUR U, SINGH J, KACHWAYA DS, KUMAR R, SINGH V. Functional characterization of novel phosphate solubilizing bacteria, Chryseomicrobium imtechense, for enhanced strawberry growth and yield parameters[J]. Arabian Journal of Geosciences, 2022, 15(12): 1119. DOI:10.1007/s12517-022-10102-9 |
| [2] |
SAVARY S, WILLOCQUET L, PETHYBRIDGE SJ, ESKER P, MCROBERTS N, NELSON A. The global burden of pathogens and pests on major food crops[J]. Nature Ecology & Evolution, 2019, 3(3): 430-439. |
| [3] |
BLACKBURN D, SHAPIRO-ILAN DI, ADAMS BJ. Biological control and nutrition: food for thought[J]. Biological Control, 2016, 97: 131-138. DOI:10.1016/j.biocontrol.2016.03.007 |
| [4] |
MUKHERJEE PK, MENDOZA-MENDOZA A, ZEILINGER S, HORWITZ BA. Mycoparasitism as a mechanism of Trichoderma-mediated suppression of plant diseases[J]. Fungal Biology Reviews, 2022, 39: 15-33. DOI:10.1016/j.fbr.2021.11.004 |
| [5] |
VICENTE I, BARONCELLI R, HERMOSA R, MONTE E, VANNACCI G, SARROCCO S. Role and genetic basis of specialised secondary metabolites in Trichoderma ecophysiology[J]. Fungal Biology Reviews, 2022, 39: 83-99. DOI:10.1016/j.fbr.2021.12.004 |
| [6] |
LÜ J, LUO B, QIAN JP, ZHANG JW, GAO YT, YANG Q. Diversity of endophytic fungi from Cinnamomum cassia and their antagonism to the pathogen of C. cassia branch blight in Guangdong, South China[J]. Mycosystema, 2022, 41(3): 435-449. (in Chinese) 吕佳, 罗碧, 钱家萍, 张嘉雯, 高育婷, 杨全. 广东肉桂内生真菌多样性及其抗肉桂枝枯病菌初步研究[J]. 菌物学报, 2022, 41(3): 435-449. DOI:10.13346/j.mycosystema.210368 |
| [7] |
XUE M, ZHAN X, WANG R, XING MY, LIU T, HOU JM. Screening and identification of antagonistic Trichoderma T008 for two leaf diseases of rubber tree and evaluation of indoor control efficacy[J]. Chinese Journal of Biological Control, 2022, 38(1): 125-132. (in Chinese) 薛鸣, 战鑫, 王睿, 邢梦玉, 刘铜, 侯巨梅. 橡胶树两种叶部病害拮抗木霉T008的筛选、鉴定及室内防效评价[J]. 中国生物防治学报, 2022, 38(1): 125-132. |
| [8] |
HUANG T, XIANG LG, ZHUANG WY, ZENG ZQ, YU ZH. Screening of Closnostachys strains against Phytophthora nicotianae[J]. Microbiology China, 2022, 49(9): 3860-3872. (in Chinese) 黄婷, 向立刚, 庄文颖, 曾昭清, 余知和. 拮抗烟草疫霉的枝穗霉菌株筛选[J]. 微生物学通报, 2022, 49(9): 3860-3872. DOI:10.13344/j.microbiol.china.220118 |
| [9] |
WU F, CHEN JJ, JI XH, VLASÁK J, DAI YC. Phylogeny and diversity of the morphologically similar polypore Genera Rigidoporus, Physisporinus, Oxyporus, and Leucophellinus[J]. Mycologia, 2017, 109(5): 749-765. |
| [10] |
SUHARA H, MAEKAWA N, KANEKO S, HATTORI T, SAKAI K, KONDO R. A new species, Ceriporia lacerata, isolated from white-rotted wood[J]. Mycotaxon, 2003, 86(41): 335-347. |
| [11] |
WU F, YUAN HS, ZHOU LW, YUN Y, CUI BK, DAI YC. Polypore diversity in South China[J]. Mycosystema, 2020, 39(4): 653-682. (in Chinese) 吴芳, 袁海生, 周丽伟, 员瑗, 崔宝凯, 戴玉成. 中国华南地区多孔菌多样性研究[J]. 菌物学报, 2020, 39(4): 653-682. DOI:10.13346/j.mycosystema.200087 |
| [12] |
KIM JE, KIM HJ, LEE SP. Hyperglycemic effect of submerged culture extract of Ceriporia lacerata in streptozotocin-induced diabetic rats[J]. Food Science and Biotechnology, 2012, 21(6): 1685-1693. DOI:10.1007/s10068-012-0224-9 |
| [13] |
AL-HAWASH AB, AL-QURNAWI WS, ABBOOD HA, HILLO NA, GHALIB HB, ZHANG XY, MA FY. Pyrene-degrading fungus Ceriporia lacerata RF-7 from contaminated soil in Iraq[J]. Polycyclic Aromatic Compounds, 2022, 42(1): 40-48. DOI:10.1080/10406638.2020.1713183 |
| [14] |
WANG N, YU S, CHU YL, XU XY, LIN CQ. Decolorization of methyl orange dye by Ceriporia lacerata under statically air-opened condition[J]. Mycosystema, 2015, 34(6): 1196-1204. (in Chinese) 王娜, 于圣, 褚衍亮, 徐翔宇, 林陈强. 撕裂蜡孔菌在开放体系中对甲基橙染料的静态脱色研究[J]. 菌物学报, 2015, 34(6): 1196-1204. DOI:10.13346/j.mycosystema.140152 |
| [15] |
HUANG JG, YIN J, YUAN L. Ceriporia lacerata and application thereof in preventing and treating crop fungus diseases: CN107201317A[P]. 2020-06-05 (in Chinese). 黄建国, 殷洁, 袁玲. 一株撕裂蜡孔菌及其防治作物真菌病害的应用: CN107201317A[P]. 2020-06-05. |
| [16] |
BAI RX, ZENG HW, FAN Q, YIN J, SUI ZM, YUAN L. Effects of Ceriporia lacerata on gummy stem blight control, growth promotion and yield increase of cucumbers[J]. Scientia Agricultura Sinica, 2019, 52(15): 2604-2615. (in Chinese) 白如霞, 曾汇文, 范倩, 殷洁, 隋宗明, 袁玲. 撕裂蜡孔菌对黄瓜蔓枯病的防治作用及促生增产效果[J]. 中国农业科学, 2019, 52(15): 2604-2615. |
| [17] |
YIN J, YUAN L, SUI ZM, HUANG JG. Mobilization of organic nitrogen and phosphorus and reduction of synthetic fertilizer usage by Ceriporia lacerata HG2011 in pepper cultivation[J]. Scientia Horticulturae, 2022, 293: 110721. DOI:10.1016/j.scienta.2021.110721 |
| [18] |
SUI ZM, YUAN L. Effects of Ceriporia lacerata on the control of black shank and growth promotion of flue-cured tobacco[J]. Journal of Plant Protection, 2019, 46(5): 1138-1146. (in Chinese) 隋宗明, 袁玲. 撕裂蜡孔菌对烟草黑胫病的防治效果及对烤烟生长的影响[J]. 植物保护学报, 2019, 46(5): 1138-1146. |
| [19] |
YIN J, YUAN L, HUANG JG. New functions of Ceriporia lacerata HG2011: mobilization of soil nitrogen and phosphorus and enhancement of yield and quality of ketchup-processing tomato[J]. Journal of Agricultural and Food Chemistry, 2021, 69(14): 4056-4063. DOI:10.1021/acs.jafc.0c06783 |
| [20] |
ZHANG RX, YIN J, SUI ZM, HAN L, LI Y, HUANG JG. Biocontrol of antifungal volatiles produced by Ceriporia lacerata HG2011 against citrus fruit rot incited by Penicillium spp.[J]. Postharvest Biology and Technology, 2022, 194: 112094. DOI:10.1016/j.postharvbio.2022.112094 |
| [21] |
ADESEMOYE AO, ADEDIRE CO. Use of cereals as basal medium for the formulation of alternative culture media for fungi[J]. World Journal of Microbiology and Biotechnology, 2005, 21(3): 329-336. DOI:10.1007/s11274-004-3907-4 |
| [22] |
SCHWYN B, NEILANDS JB. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987, 160(1): 47-56. DOI:10.1016/0003-2697(87)90612-9 |
| [23] |
BELL DK. In vitro antagonism of Trichodermas species against six fungal plant pathogens[J]. Phytopathology, 1982, 72(4): 379. DOI:10.1094/Phyto-72-379 |
| [24] |
ZHAO X, CHEN SX, XIE ZX, SHEN P. Isolation-identification and over-siderophores production of Pseudomonas fluorescens sp-f[J]. Acta Microbiologica Sinica, 2006(5): 691-695. (in Chinese) 赵翔, 陈绍兴, 谢志雄, 沈萍. 高产铁载体荧光假单胞菌Pseudomonas fluorescens sp-f的筛选鉴定及其铁载体特性研究[J]. 微生物学报, 2006(5): 691-695. DOI:10.3321/j.issn:0001-6209.2006.05.002 |
| [25] |
MACHUCA A, MILAGRES AMF. Use of CAS-agar plate modified to study the effect of different variables on the siderophore production by Aspergillus[J]. Letters in Applied Microbiology, 2003, 36(3): 177-181. DOI:10.1046/j.1472-765X.2003.01290.x |
| [26] |
BERTRAND S, SCHUMPP O, BOHNI N, BUJARD A, AZZOLLINI A, MONOD M, GINDRO K, WOLFENDER JL. Detection of metabolite induction in fungal co-cultures on solid media by high-throughput differential ultra-high pressure liquid chromatography-time-of-flight mass spectrometry fingerprinting[J]. Journal of Chromatography A, 2013, 1292: 219-228. DOI:10.1016/j.chroma.2013.01.098 |
| [27] |
YOU JQ, DU R, GU WH, LI CH, LI GQ, SONG RH. Biological characteristics and biological control potential of endophytic fungus Trichoderma koningiopsis strain T-51[J]. Journal of Plant Protection, 2022, 49(3): 946-955. (in Chinese) 尤佳琪, 杜然, 顾卫红, 李超汉, 李国庆, 宋荣浩. 拟康宁木霉T-51菌株生物学特性及其生物防治潜力[J]. 植物保护学报, 2022, 49(3): 946-955. |
| [28] |
CHEN JN, DU FL, ZHOU SY, QIU JY, LIU XY. Method for evaluation of strain quality of Trichoderma biocontrol agent: CN102660627A[P]. 2012-09-12 (in Chinese). 陈建爱, 杜方岭, 周善跃, 裘纪莹, 刘孝永. 一种木霉生防菌种质评价方法: CN102660627A[P]. 2012-09-12. |
| [29] |
LI S, SHANG XJ, ZHANG FM, HOU R. Diversity of endophytic Trichoderma in the roots of blueberries and its antagonistic effects[J]. Journal of Nuclear Agricultural Sciences, 2022, 36(8): 1569-1578. (in Chinese) 李思, 尚晓静, 张富美, 侯瑞. 蓝莓根部内生木霉分离鉴定及其拮抗作用[J]. 核农学报, 2022, 36(8): 1569-1578. |
| [30] |
BEDINE MAB, TAÏEB N, AGRIOPOULOU S, MICHÉ L, MOUSSANGO D, LAMBERT SAMEZA M, DUPUY N, ROUSSOS S, FEKAM BOYOM F. Identification of native soil-derived Trichoderma spp. isolates and analysis of their antagonist traits against Lasiodiplodia theobromae causing stem-end rot in papaya[J]. Archives of Phytopathology and Plant Protection, 2022, 55(15): 1766-1794. |
| [31] |
ZHOU AT, WANG F, YIN JB, PENG RQ, DENG J, SHEN DZ, WU JR, LIU XY, MA HC. Antifungal action and induction of resistance by Bacillus sp. strain YYC 155 against Colletotrichum fructicola for control of anthracnose disease in Camellia oleifera[J]. Frontiers in Microbiology, 2022, 13: 956642. |
| [32] |
LI LL, DAI LM, JIANG GZ, LIU YX, SHI YP, CAI ZY. Isolation, identification and bacteriostasis study of endophytic bacteria to control Colletotrichum leaf disease on rubber tree[J]. Chinese Journal of Tropical Crops, 2021, 42(10): 2958-2965. (in Chinese) 李岚岚, 戴利铭, 蒋桂芝, 刘一贤, 施玉萍, 蔡志英. 橡胶树炭疽病生防内生菌的分离鉴定及抑菌作用研究[J]. 热带作物学报, 2021, 42(10): 2958-2965. |
| [33] |
VANESA TOLEDO A, FRANCO MEE, YANIL LOPEZ SM, TRONCOZO MI, SAPARRAT MCN, ALBERTO BALATTI P. Melanins in fungi: types, localization and putative biological roles[J]. Physiological and Molecular Plant Pathology, 2017, 99: 2-6. |
| [34] |
ZHANG H, CHENG JL, ZHU XF, ZHANG SL, YAN LW, LIN JS. Identification and biocontrol evaluation of Streptomyces sp. strain ZH-356 antagonistic to plant pathogenic fungi[J]. Acta Microbiologica Sinica, 2022, 62(9): 3421-3436. (in Chinese) 张恒, 成娟丽, 朱旭飞, 张嵩林, 闫靓文, 林金水. 拮抗植物病原真菌链霉菌菌株ZH-356的鉴定及其生防评价[J]. 微生物学报, 2022, 62(9): 3421-3436. |
| [35] |
NZABANITA C, ZHANG LH, ZHAO HR, WANG YF, WANG YF, SUN MH, WANG SC, GUO LH. Fungal endophyte Epicoccum nigrum 38L1 inhibits in vitro and in vivo the pathogenic fungus Fusarium graminearum[J]. Biological Control, 2022, 174: 105010. |
| [36] |
WANG XH, XU XY, LI Y, YAO FH, CHENG X, QI SH, TAO SH. Secondary metabolites and antimicrobial activities of Hypocrea lixii SCSIO 41520[J]. Natural Product Research and Development, 2020, 32(9): 1522-1528. (in Chinese) 王雪花, 徐新亚, 李易, 姚飞华, 程霞, 漆淑华, 陶曙红. 白腐真菌Hypocrea lixii SCSIO 41520次级代谢产物及抗菌活性研究[J]. 天然产物研究与开发, 2020, 32(9): 1522-1528. |
| [37] |
PECORARO L, WANG X, SHAH D, SONG XX, KUMAR V, SHAKOOR A, TRIPATHI K, RAMTEKE PW, RANI R. Biosynthesis pathways, transport mechanisms and biotechnological applications of fungal siderophores[J]. Journal of Fungi, 2021, 8(1): 21. |
| [38] |
MASSIP C, BRANCHU P, BOSSUET-GREIF N, CHAGNEAU CV, GAILLARD D, MARTIN P, BOURY M, SÉCHER T, DUBOIS D, NOUGAYRÈDE JP, OSWALD E. Deciphering the interplay between the genotoxic and probiotic activities of Escherichia coli Nissle 1917[J]. PLoS Pathogens, 2019, 15(9): e1008029. |
| [39] |
FGAIER H, EBERL HJ. Antagonistic control of microbial pathogens under iron limitations by siderophore producing bacteria in a chemostat setup[J]. Journal of Theoretical Biology, 2011, 273(1): 103-114. |
| [40] |
XU JL, ZHANG P, LI MF, LIAO BH, PENG PQ, LI J, MEI JX. Isolation, culture condition optimization, and preliminary application of siderophore-producing strains[J]. Microbiology China, 2022, 49(3): 1004-1016. (in Chinese) 许佳露, 张平, 李美芳, 廖柏寒, 彭佩钦, 李靖, 梅金星. 产铁载体菌株的分离、培养条件优化及初步应用[J]. 微生物学通报, 2022, 49(3): 1004-1016. |
| [41] |
ZHAO JY, ZOU XF, HE X, ZHANG Q, YANG JD, ZHU HY, YANG PW, LI MG. Control effects of two siderophore-producing fungi against tomato bacterial wilt[J]. Plant Protection, 2022, 48(4): 123-130. (in Chinese) 赵江源, 邹雪峰, 何翔, 张庆, 杨济达, 朱红业, 杨佩文, 李铭刚. 2株分泌型铁载体真菌对番茄青枯病的防效[J]. 植物保护, 2022, 48(4): 123-130. |
| [42] |
PENG WJ, ZHAN YJ, LEI P, SUN T, QIAN JY, XU H. Characteristics of siderophores production by Penicilium asturianum XK-12 and its effect on antibacterial activity[J]. Jiangsu Journal of Agricultural Sciences, 2022, 38(1): 73-80. (in Chinese) 彭雯杰, 詹伊婧, 雷鹏, 孙涛, 钱家熠, 徐虹. 阿斯青霉菌XK-12产铁载体特性及其抑菌活性[J]. 江苏农业学报, 2022, 38(1): 73-80. |
| [43] |
YIN J, FAN Q, HUANG JG. New functions of Ceriporia lacerata in Phytophthora blight control and growth promotion of eggplants[J]. Scientia Agricultura Sinica, 2018, 51(12): 2300-2310. (in Chinese) 殷洁, 范倩, 黄建国. 撕裂蜡孔菌的新功能——防治茄子绵疫病及促生效应[J]. 中国农业科学, 2018, 51(12): 2300-2310. |
| [44] |
PAN XY, LIANG JY, ZHANG JH, LIU Y, LIANG JF, SONG J, CHEN YL. Emmia lacerata SR5 promotes Michelia macclurei growth by enhancing nutrient uptake and regulating morphology[J]. Journal of Soil Science and Plant Nutrition, 2022, 22(1): 985-999. |
 2023, Vol. 50
2023, Vol. 50