扩展功能
文章信息
- 曾祥伟, 邹瑶, 周玉萍, 田长恩
- ZENG Xiangwei, ZOU Yao, ZHOU Yuping, TIAN Chang'en
- 丝状真菌表面展示技术研究进展
- Research progress in surface display technology of filamentous fungi
- 微生物学通报, 2023, 50(12): 5574-5587
- Microbiology China, 2023, 50(12): 5574-5587
- DOI: 10.13344/j.microbiol.china.230386
-
文章历史
- 收稿日期: 2023-05-11
- 接受日期: 2023-07-29
- 网络首发日期: 2023-08-25
表面展示技术(surface display technology)在基因工程的基础上发展起来,其原理是通过将目的蛋白的基因序列(外源蛋白)与特定的载体蛋白基因序列(又叫定位序列)融合后导入特定的宿主细胞,从而使目的蛋白以融合蛋白的形式定位于宿主细胞表面。目的蛋白与载体蛋白的融合方式主要有3种,即C端融合、N端融合和插入融合,根据目的蛋白和载体蛋白不同的特性选择合适的融合方式可提高表面展示效率[1]。目前,丝状真菌表面展示技术融合蛋白的融合方式均采用插入融合,融合蛋白需要有翻译后经糖基磷脂酰肌醇(glycosylphosphatidylinositol, GPI)修饰的锚定蛋白锚定在细胞表面。融合蛋白可展示在噬菌体以及细菌、真菌、昆虫和动物等细胞的表面[2],甚至哺乳动物细胞也可进行表面展示[3]。表面展示的蛋白除了用于功能、结构和生化研究外,还可应用于药物开发[4]、生物电池[5]、生物传感器[6]和生物修复[7]等领域。
表面展示技术首次公开发表于1985年,当时Smith[8]以噬菌体为载体,成功地在其表面展示了EcoR I内切酶抗原。此后的30多年间,噬菌体表面展示技术得到不断完善,尤其在新型冠状病毒感染(corona virus disease 2019, COVID-19)期间,还被用于宿主和病原体相互作用的研究、COVID-19的表位定位研究和中和抗体筛选[9]等。然而,由于噬菌体表面展示系统无法展示大分子蛋白和体积小导致的与荧光激活细胞分选技术(fluorescence activated cell sorting, FACS)不兼容等缺陷,限制了噬菌体表面展示技术的进一步发展[10]。细菌表面展示系统虽经过大力发展,但部分细菌仍存在转化率低、大量分泌蛋白酶等问题,严重影响其进一步发展[11]。表面展示技术也在酵母上获得成功,该平台被广泛应用于蛋白质相互作用的研究、抗体设计和蛋白质工程,因此,酵母表面展示被称作是一种用于蛋白质和多肽研发的尖端技术[12]。但是酵母表面展示技术也存在文库大小多样性数量级比较低、表达产物过度糖基化、多数流式细胞仪的低流速严重影响大蛋白质分选等问题[13-14]。丝状真菌表面展示系统因丝状真菌的蛋白分泌能力强、易培养等受到关注,与噬菌体、细菌等表面展示系统相比,其翻译后加工能力更强,更接近于高等真核生物[15-16]。同时,丝状真菌更容易生产哺乳动物糖型,所产生的核心糖链结构与人类更为接近[17],其高效的同源和异源蛋白的表达能力及高效的木质纤维降解活性也是酵母无法比拟的,这也预示着丝状真菌表面展示系统可以作为全细胞生物催化剂[18]。此外,丝状真菌在液体发酵中很容易形成菌丝球,丝状真菌表面展示系统可弥补单细胞生物在溶液中反复利用需要离心、过滤或固定化等不足。与常规的丝状真菌表达异源蛋白相比,两者均能成功表达异源蛋白,但常规的丝状真菌异源蛋白表达是在细胞体内表达,而丝状真菌表面展示系统是将蛋白表达于细胞表面。蛋白质通过表面展示技术表达在丝状真菌细胞表面,简化了蛋白质纯化流程,移除了制备生物催化剂时需要固定化的步骤[19],也为丝状真菌异源蛋白的表达提供了更广阔的应用领域。然而与发展成熟的常规的丝状真菌表达异源蛋白相比,丝状真菌表面展示技术尚处在初级阶段,已知的丝状真菌GPI锚定蛋白有限,应用也受限。
尽管酵母菌也是真菌,所建立的酵母表面展示系统已经相当成熟,但其大多数锚定蛋白在丝状真菌中缺乏同源性,限制了这些蛋白在丝状真菌表面展示系统的应用[18]。随着丝状真菌基因组、转录组和蛋白质组研究的深入,构建丝状真菌表面展示系统的锚定蛋白得以由酵母源向丝状真菌源过渡,降低丝状真菌酶解外源蛋白的风险。人们根据不同研发目的,选择合适的丝状真菌进行表面展示,目前已经在米曲霉(Aspergillus oryzae)、烟曲霉(Aspergillus fumigatus)、里氏木霉(Trichoderma reesei)和黑曲霉(Aspergillus niger)等丝状真菌中成功地进行了表面展示,并在生物催化剂和构建疾病监测模型等领域有初步应用[20-23]。本文将就丝状真菌的表面展示系统的研发进展及其应用进行综述,并介绍与该系统构建密切相关的丝状真菌的细胞壁组成、锚定蛋白和遗传转化方法。
1 丝状真菌表面展示系统的开发与应用 1.1 丝状真菌表面展示系统的开发 1.1.1 米曲霉表面展示系统米曲霉(Aspergillus oryzae)是对传统发酵食品和饮料生产至关重要的真菌,在中国和日本等国家被广泛用于酱油、大豆酱和米酒等发酵食品的生产已有数百年历史,被认为是安全的(generally recognized as safe, GRAS)[24]。由于其具有完整的翻译后修饰系统、强大的蛋白生产能力和分泌能力,因而被用作生产同源或异源蛋白质的宿主。随着曲霉属分子生物学的广泛研究,米曲霉的基因工程已被应用于蛋白质生产[25]和使用支持基质固定化方法的生物转化[26]。2008年,Adachi等[20]首次成功构建米曲霉表面展示系统,该系统以来自米曲霉的sodM启动子和glaB终止子的pISI载体构建了米曲霉表达载体,大肠杆菌NovaBlue作为重组DNA的克隆宿主,野生型米曲霉OSI1031作为表面展示系统的表达宿主。首先,通过对米曲霉基因组的分析,选择了MP1、CWP、648、090和279共5个可能定位于细胞壁的内源蛋白作为候选锚定蛋白,以绿色荧光蛋白(green fluorescent protein, GFP)为检测目的蛋白,构建了5个分别命名为pISI-GFP-MP1、pISI-GFP-CWP、pISI-GFP-648、pISI-GFP-090和pISI-GFP-279的载体;随后采用原生质体-聚乙二醇转化法将上述载体转入米曲霉,在完成遗传转化的米曲霉表面对候选锚定蛋白的锚定效果分别进行了GFP的荧光检测,结果显示,当MP1和CWP作为锚定蛋白时可在米曲霉表面观察到较强的GFP荧光;当用MP1和CWP作为锚定蛋白进行β-葡萄糖苷酶的表面展示时,可明显检测到MP1的活性高于CWP。这些研究结果表明MP1蛋白在米曲霉中可以作为GPI锚定蛋白表面展示异源和内源蛋白。该研究是表面展示技术在丝状真菌上的首次成功应用。
1.1.2 烟曲霉表面展示系统烟曲霉(Aspergillus fumigatus)是一种机会致病真菌,可在易感、免疫系统功能低下的群体中引发多种疾病,特别是高致死率的侵袭性疾病和一些不太常见的皮肤型曲霉菌病,而对曲霉病发病机制的研究和药物测试严格依赖合适的疾病模型[21]。2012年,Donat等[21]成功构建烟曲霉表面展示系统并用作疾病模型,该研究以烟曲霉野生型菌株ATCC 46645为宿主细胞,以pSK478为质粒,经改造获得由构巢曲霉gpdA为启动子驱动、以his2A为标记基因、MP1为锚定蛋白和高斯荧光素酶(Gaussia princeps luciferase, Gluc)为目的蛋白的pSK481表达载体,经原生质体-聚乙二醇转化法将载体导入宿主细胞后,成功选育出一株将生物发光报告基因Gluc的表达产物展示在细胞表面的烟曲霉菌株。Gluc在烟曲霉表面的展示标志着丝状真菌表面展示系统已经具有初步的实际应用。
1.1.3 里氏木霉表面展示系统里氏木霉(Trichoderma reesei)是一种非常高效的纤维素酶工业生产菌株,其具有很高的蛋白质合成和分泌能力,随着对里氏木霉的深入研究,在促进其内源蛋白(如纤维素酶)的基因工程表达领域取得了长足进步。尽管分子生物学的发展十分迅速,也有越来越多的外源蛋白在丝状真菌得到表达,但远远达不到工业化生产的要求。里氏木霉具有丝状真菌易培养、成本低、生长快以及易工业化的特点,因而成为工业化表达外源蛋白的理想宿主[27],表达的蛋白均在细胞内或分泌细胞外,在里氏木霉细胞表面展示蛋白鲜有报道。2013年,苏建臣等[22]首次将表面展示技术应用于里氏木霉而成功构建了里氏木霉表面展示系统,该研究是以里氏木霉尿苷合成缺陷型菌株Tu-6 (pyr4‒)为宿主,以含有pyr4基因的TA kulox pyr4为质粒,以组成型启动子GPDA和构巢曲霉TrpC终止子构建了表达载体GPDA-Pro:chiB-N-signal-GFP-MP1-C;与传统的选用一个锚定蛋白来锚定目的蛋白的方法不同,该载体N端的分泌信号肽和C端的糖基磷脂酰肌醇(glycosylphosphatidylinositol, GPI)锚定信号分别来自两个蛋白,分泌信号肽来自烟曲霉几丁质酶AfChiB的N端分泌信号肽,C端的GPI锚定信号来自烟曲霉AfMp1p的C端GPI锚定信号;通过原生质体-聚乙二醇转化法将载体导入成功里氏木霉后,通过实时荧光定量(real time quantitative PCR, RT-qPCR)和蛋白定量、Western blotting和荧光观察分别对转基因后GFP的表达和GFP的定位进行了研究,结果表明,GFP基因表达高峰发生在里氏木霉生长平台期的中后期,GFP蛋白定位在里氏木霉细胞壁。里氏木霉表面展示系统的成功构建为外源蛋白在丝状真菌中的表达提供了方向,同时也指出分泌信号肽和GPI锚定信号是表面展示技术的两个关键点,二者可来自不同蛋白但缺一不可。
1.1.4 黑曲霉表面展示系统黑曲霉(Aspergillus niger)因为其独特的食品安全特性和优良的蛋白质分泌能力而成为最重要的食用酶生产宿主之一。经改良,黑曲霉已成功商业化生产糖淀粉酶等19种食用酶和柠檬酸、葡萄糖酸等多种可食用有机酸[28]。2014年,Pan等[23]首次成功构建黑曲霉表面展示系统,该研究所用的菌株是黑曲霉SH-1,质粒是pUC19,经改造,成功构建成由黑曲霉内源糖化酶启动子Pgla和米曲霉α-葡萄糖苷酶终止子TagdA、以Flag为标签、以CwpA为锚定蛋白的pCaLB-C表达载体,目的蛋白为南极假丝酵母脂肪酶B (Candida antarctica lipase B, CaLB);经原生质体-聚乙二醇转化法将载体导入黑曲霉,对转化后代进行表型观察发现,在转化了CaLB-Flag-CwpA表达载体的黑曲霉菌丝表面能明显观察到绿色荧光信号,表明黑曲霉表面展示系统已经成功构建。CwpA作为锚定蛋白可在黑曲霉表面展示酶蛋白,该系统也可用于其他目的蛋白在黑曲霉细胞的表面展示,同时也为CwpA可能用于其他丝状真菌表面展示系统的构建提供了新思路。
1.2 丝状真菌表面展示系统的应用 1.2.1 作为全细胞生物催化剂近年来,随着绿色化学原则的逐渐普及,由经济和绿色技术分离或合成的安全食品的需求得到提升,使用自然可用的底物和食品级催化剂成为生产工艺的共识。与传统的化学催化剂相比,酶不仅更安全,而且反应条件更温和、更环保。微生物表面展示食品级酶不仅保障了产品的安全,更是开发了绿色的生产工艺。
2014年,Pan等[23]首次使用经GRAS认证的丝状真菌黑曲霉为宿主细胞,其内源性细胞壁蛋白CwpA为GPI锚定蛋白,表面展示了南极假丝酵母脂肪酶B (CaLB),成功构建黑曲霉全细胞催化剂;该系统经45 h的麦芽糖诱导后,水解活性和合成活性分别达到400 U/g-干细胞和240 U/g-干细胞,作为全细胞催化剂,该系统可用于一系列不同链长的脂肪酸和乙醇,经酶促反应后合成乙酯,其中己酸乙酯2 h转化率高达87%,月桂酸乙酯2 h转化率高达89%,硬脂酸乙酯3 h转化率高达84%。这些结果表明,该系统作为全细胞催化剂表面展示的食品级CaLB可完全替代商业脂肪酶。2016年,Pan等[29]对上述试验进行了改进,采用酿酒酵母的内源GPI锚定蛋白Sed1在黑曲霉表面展示CaLB,并对该新型黑曲霉全细胞生物催化剂在合成绿色生物溶剂异丙酯(isopropyl ester, IPE)的催化特性方面进行了研究;新型全细胞生物催化剂在65 ℃条件下表现出极大的操作稳定性,反应6 h后,月桂酸异丙酯、肉豆蔻酸异丙酯和棕榈酸异丙酯的产率最高,分别达到79.21%、81.62%和81.41%。表明全细胞生物催化剂在化妆品、制药、食品和其他工业中应用潜力巨大。
1.2.2 对疾病感染进行监测烟曲霉为侵袭性曲霉病最常见的分离菌,可引起人类特别是免疫缺陷患者的肺、鼻、眼睛、脑和骨骼的感染。侵袭性曲霉病死亡率极高,因其一般确诊晚,并且治疗方法不多。因此亟须构建曲霉病的感染模型,为高通量药物筛选提供途径。2012年,Donat等[21]以烟曲霉为表面展示宿主,以米曲霉细胞壁蛋白MP1的烟曲霉同源基因为GPI锚定蛋白, 在烟曲霉表面展示了高斯荧光素酶(GLuc);该监测技术是以非侵入性成像技术作为跟踪真菌感染的方法,并允许高通量地筛查,所需要的实验动物较少;高斯荧光素酶的表面表达使人们能够灵敏和快速的检测到该菌株在添加底物后产生的荧光,并且荧光强度与烟曲霉的数量密切相关,该菌株可以在皮肤曲霉病模型中对感染进行实时监测,更能利用该菌株进行抗真菌治疗的观察。该应用的出现不仅为疾病模型的研究提供了新思路,更将丝状真菌表面展示技术的应用带到了一个新领域,相信丝状真菌表面展示系统未来会应用于更多的领域。
2 丝状真菌表面展示系统的技术基础 2.1 外源蛋白在丝状真菌细胞壁锚定的机制 2.1.1 GPI锚定蛋白GPI锚定蛋白是经过一种保守的翻译后修饰——GPI修饰后具有锚定能力从而在细胞表面发挥生物学功能的一种蛋白。其可以根据蛋白锚定的位置不同细分为GPI细胞膜蛋白(glycosylphosphatidylinositol cell membrane protein, GPI-CMP)和GPI细胞壁蛋白(glycosylphosphatidylinositol cell wall protein, GPI-CWP),细胞壁蛋白50%以上是GPI锚定蛋白[30-31]。最终无论锚定到质膜还是细胞壁,GPI锚定蛋白在丝状真菌和其他真菌的细胞结构和功能中都起着重要的作用。研究表明,完全阻断烟曲霉GPI锚(GPI-anchors)的合成会导致细胞壁缺陷、菌丝生长异常、分生孢子快速萌发和异常分生,可见合成GPI锚并将其连接到GPI锚定蛋白是烟曲霉细胞壁完整性、形态发生和毒力所必需的[32]。
GPI锚定蛋白是目前真菌表面展示系统构建中使用最多的锚定蛋白,一个可用的GPI锚定蛋白应该具备4个特征:(1) N端含有一个分泌信号肽,可以保证融合蛋白穿过内膜[33];(2) C端含有一个可以与GPI锚结合的锚定信号肽,保证融合蛋白在细胞表面而不会脱落[33];(3) 靶蛋白插入GPI锚定蛋白应该能保持持续稳定[1];(4) 不被周围空间或介质中的蛋白酶降解[1]。其中,确定靶蛋白在载体蛋白上的插入位点很重要。3种方法可以对载体蛋白的插入位点进行预测:(1) 将载体蛋白与已知结构的同源变体进行比较,可以找到可能插入的位置,这是最简单、最有效的方法;(2) 通过预测算法或计算机程序来计算出载体蛋白的亲水氨基酸分布来判断可能的插入位置;(3) 将靶蛋白随机插入载体蛋白的主要序列中,多次试验以检测细胞表面是否存在靶蛋白。总而言之,靶蛋白在载体蛋白上的插入位点介于载体蛋白N端信号肽和C端GPI结合位点ω位点之间。此外,GPI锚定信号由ω位点、5−10个氨基酸组成的间隔区域和10−15个氨基酸组成的疏水区域3部分组成,在GPI锚点添加的过程中,GPI锚定蛋白在ω位点被切割,剩下的蛋白质与GPI锚中的乙醇胺残基结合从而具备锚定功能[30, 34-35]。通过对酿酒酵母的GPI锚定蛋白进行电子分析,发现二碱基基序对锚定位点的重要性,即在“ω-”上游4个氨基酸中若存在2个碱性氨基酸,则GPI锚定蛋白最终定位于细胞膜,如果无碱性残基或者被疏水氨基酸取代,则最终定位于细胞壁,但二碱基基序并不起决定性因素。例如,富含丝氨酸和苏氨酸的氨基酸长链的存在也可形成细胞壁锚定[36-38]。由于丝状真菌与酵母细胞壁的差异性,酵母的GPI锚定蛋白不一定适用于丝状真菌。最新的烟曲霉GPI锚定蛋白研究[39]表明,ω-1或ω-2位的单一碱性氨基酸即可使蛋白定位在细胞膜,这与对酿酒酵母的锚定认知有所不同。表 1总结了目前丝状真菌表面展示系统所使用过的GPI锚定蛋白。
| 生物 Organism |
锚定蛋白 Anchor protein |
蛋白ID Protein ID |
长度 Length (aa) |
功能 Function |
定位 Localization |
| 黑曲霉 Aspergillus niger |
CwpA | AAT09020 | 288 | GPI锚定细胞壁甘露蛋白 GPI anchored cell wall mannoprotein |
细胞壁 Cell wall |
| 烟曲霉 Aspergillus fumigatus |
MP1 | KAH1574349 |
284 | 细胞壁甘露蛋白 Cell wall mannoprotein |
细胞壁 Cell wall |
| 酿酒酵母 Saccharomyces cerevisiae |
Sed1p | Q01589 | 338 | 抗氧化应激,维持线粒体基因组 Resistance to oxidative stress, maintenance of mitochondrial genome |
细胞壁;内质网;线粒体 Cell wall; ER; mitochondria |
真菌细胞壁是一个由蛋白质复合体合成、多糖组成、复杂而动态的实体,对真菌的发育至关重要,其中,构建丝状真菌表面展示系统的关键性锚定蛋白——GPI锚定蛋白也参与了细胞壁的合成,特别是多糖的重塑[40]。真菌细胞壁主要由葡聚糖、甲壳素、壳聚糖、甘露聚糖/半乳甘露聚糖和糖蛋白组成[30, 41]。但酵母和丝状真菌的细胞壁,甚至是同类型不同的物种在蛋白种类和含量上均有所不同,详情可参考表 2。
| 细胞壁组成 Cell wall component |
酿酒酵母 Saccharomyces cerevisiae |
白色念珠菌 Candida albicans |
烟曲霉 Aspergillus fumigatus |
粗糙脉孢霉 Neurospora crassa |
| 甲壳素 Chitin (%) |
1−2 | 2−6 | 7−15 | 4 |
| β-1, 3-葡聚糖 β-1, 3-glucan (%) |
50−55 | 30−39 | 20−35 | 87 |
| 混合β-1, 3/1, 4-葡聚糖 Mixed β-1, 3/1, 4-glucan |
‒ | ‒ | + | + |
| β-1, 6-葡聚糖 β-1, 6-glucan (%) |
10−15 | 43−53 | ‒ | ‒ |
| α-1, 3-葡聚糖 α-1, 3-glucan (%) |
‒ | ‒ | 35−46 | 仅分生孢子含有 Contained only in conidia |
| 外链甘露聚糖 Outer chain mannan (%) |
10−20 | 38−40 | ‒ | ‒ |
| 半乳甘露聚糖 Galactomannan (%) |
‒ | ‒ | 20−25 | 12 |
| 黑色素 Melanin |
‒ | 感染期菌丝 Infected hyphae |
分生孢子 Conidia |
子囊孢子和子囊壳 Ascospore and perithecium |
|
+:含有;‒:不含此类物质 +: Contained; ‒: No such substances. |
||||
葡聚糖是部分真菌GPI锚定蛋白锚定到细胞壁所必需的。β-1, 3-葡聚糖是所有特征性真菌细胞壁的主要成分,大概能占到细胞壁质量的30%−80%。在酿酒酵母细胞壁中,β-1, 3-葡聚糖是一种支化聚合物,通过β-1, 6-支链与核心聚合物相连[42]。β-1, 6-葡聚糖是酿酒酵母和白色念珠菌细胞壁的重要成分。在酿酒酵母中,β-1, 6-葡聚糖与β-1, 3-葡聚糖、甲壳素及GPI锚低聚糖形成交联[43-46]。GPI锚与细胞壁基质交联则将GPI锚定的细胞壁蛋白共价连接到细胞壁,可见,β-1, 6-葡聚糖在酿酒酵母细胞壁基质的形成过程中不可或缺[30, 42]。但是在其他真菌诸如烟曲霉、粗糙脉孢霉等丝状真菌细胞壁并未发现β-1, 6-葡聚糖,也并未发现影响β-1, 6-葡聚糖产生的蛋白的编码基因,这表明丝状真菌是使用其他聚合物将细胞壁成分交联在一起[30]。这也是致使酵母表面展示系统中绝大多数GPI锚定蛋白无法在丝状真菌表面展示系统成功锚定的原因之一。
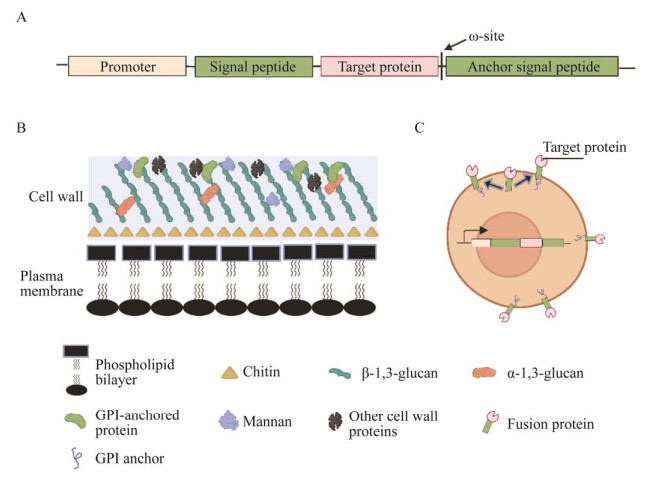
甘露聚糖和半乳甘露聚糖也是GPI锚定蛋白锚定到细胞壁的重要成分。甘露聚糖和半乳甘露聚糖以O-连接的糖基化和N-连接的低聚糖的形式存在,突变分析表明,影响O-连接的低聚糖合成的突变可以对白色念珠菌、烟曲霉和粗糙脉孢霉产生巨大影响[47-50]。N-连接的半乳聚糖是将细胞壁蛋白整合到丝状真菌粗糙脉孢霉细胞壁基质中所必需的,缺少OCH-1的突变体不能将GPI锚定和非GPI锚定的细胞壁蛋白锚定到细胞壁中[51]。然而烟曲霉OCH-1突变体仍然具有正常形态[52]。表明不同丝状真菌GPI锚定蛋白锚定到细胞壁的方式可能不同。图 1为丝状真菌表面展示系统示意图。
|
| 图 1 丝状真菌表面展示系统示意图 Figure 1 Diagram of surface display system in filamentous fungi. A:表达载体的核心元件. B:细胞壁结构. C:目的蛋白的展示 A: The core elements of expression vector. B: Cell wall structure. C: Display of target protein. |
|
|
丝状真菌表面展示技术的发展依托基因工程,将外源基因导入丝状真菌是关键。尽管大量丝状真菌的基因组序列被陆续公布,但是丝状真菌与酿酒酵母等单细胞生物相比,其具有遗传背景复杂、形态比较特殊、细胞壁较厚等特点,导致导入外源基因较为困难,因此高效稳定的转化体系是发展丝状表面展示技术的前提。表 3总结了目前已有的丝状真菌遗传转化方法。
| 方法 Methods |
原理 Principle |
优点 Advantages |
缺点 Disadvantages |
应用 Application |
| 原生质体-聚乙二醇转化法 Polyethylene glycol (PEG) mediated protoplast transformation |
PEG和CaCl2促进外源DNA和原生质体的融合 PEG and CaCl2 promote the fusion of exogenous DNA and protoplasts |
转化率较高;设备要求低;适合于多数真菌 High transformation rate; unsophisticated equipments; suitable for most fungi |
试剂质量要求高;变异率高;对原生质体有毒 High quality requirements for reagents; high mutation rate; toxic to protoplasts |
粗糙脉孢霉[53]; Neurospora crassa[53] 构巢曲霉[54] Aspergillus nidulans[54] |
| 农杆菌转化法 Agrobacterium tumefaciens mediated transformation (ATMT) |
整合外源DNA的T-载体通过农杆菌进行转化 T-vector integrating exogenous DNA was transformed by Agrobacterium tumefaciens |
更稳定高效;受体多样化 More stable and efficient; recipients diversification |
需要双元载体;步骤多;部分真菌对乙酰丁香酮敏感 Binary vectors required; multiple steps; some fungi are sensitive to acetosyringone |
韦伯灵芝[55] Ganoderma weberianum[55] |
| 限制性内切酶介导转化法 Restriction enzyme mediated integration (REMI) |
质粒DNA通过限制性内切酶的作用插入基因组 Plasmid DNA was inserted into the genome through the action of restriction endonuclease |
操作简单;转化率高; 单拷贝插入概率大 Easy to operate; high transformation rate; high probability of single copy insertion |
可能产生非标记转化子 Possibly produce unlabeled transformants |
红曲霉[56] Monascus anka[56] |
| 基因枪法 Biolistics transformation |
用基因枪将吸附DNA的金粒或钨粒高速射入受体细胞 The gold or tungsten particles adsorbed DNA was rapidly inject into recipient cells by using a gene gun |
操作简便;受体多样化 Handy operation; recipients diversification |
转化率低;仪器昂贵 Low tansformation rate; expensive equipment |
构巢曲霉[57] Aspergillus nidulans[57] 里氏木霉[58] Trichoderma reesei[58] |
| 电穿孔转化法 Electroporation transformation |
DNA借助高压电脉冲导致的细胞膜裂缝进入细胞 DNA enters cells through membrane cracks caused by high-voltage electrical pulses |
简单、快速、高效; 受体多样化 Simple, fast and efficient; recipients diversification |
设备特殊; 部分细胞死亡 Special equipment; some cell death |
米根霉[59] Rhizopus oryzae[59] 黑曲霉[60] Aspergillus niger[60] |
| 醋酸锂转化法 Lithium acetate transformation |
Li+增强细胞渗透性 Li+ enhances cell permeability |
转化率高;设备要求低 High efficiency; unsophisticated equipments |
受体有限 Limited recipients |
白绒鬼伞[61] Coprinus cinereus[61] |
| 冲击波法 Shock-wave-mediated transformation (SWMT) |
冲击波使细胞短暂透化 Shock wave makes the cells permeate briefly |
转化率高;参数容易控制 High conversion efficiency; the parameters are easy to control |
受体有限;仪器昂贵 Limited recipients; expensive instruments |
黄孢原毛平革菌[62] Phanerochaete chrysosporium[62] |
尽管丝状真菌遗传转化方法被陆续开发,但在丝状真菌表面展示系统的构建中目前只应用了原生质体-聚乙二醇转化法,其他方法目前尚未见到相关研究报道。
原生质体-聚乙二醇转化法因其仪器设备简单、成本低、操作方便而在丝状真菌转化中得到广泛应用。1978年,Hinnen等[63]使用聚乙二醇法(polyethylene glycol, PEG)完成酵母原生质体的转化,该方法的原理是PEG可以和一些多聚物、Ca2+等二价阳离子以及外源DNA在原生质体表面形成颗粒沉淀,同时PEG通过干扰细胞膜表面的电荷平衡影响细胞间的相互识别,从而使DNA进入原生质体。2008年,Adachi等[20]首次在米曲霉表面展示系统的构建中应用原生质体-聚乙二醇转化法来进行转化,具体方法是将原生质体悬浮在5% NaCl、10 mmol/L CaCl2、10 mmol/L Tris-HCl (pH 7.5)溶液中,浓度为2.5×108/mL,取200 μL原生质体悬浮液加入10 μL质粒DNA,充分混匀后冰上静置30 min,然后加入1 mL 25% (质量体积分数) PEG4000、50 mmol/L CaCl2、10 mmol/L Tris-HCl (pH 7.5),轻轻混匀,室温下静置15 min后用6 mL 5% NaCl、10 mmol/L CaCl2、10 mmol/L Tris-HCl (pH 7.5)稀释,700×g离心5 min,用相同的缓冲液清洗后接种在察式培养基上进行筛选,继代培养了3次获得稳定转化子,将转化子在液体培养基培养后清洗两次置于BZ-8000荧光显微镜下检测GFP荧光,表明米曲霉原生质体转化成功。由于原生质体-聚乙二醇转化法发展时间较早,技术相对成熟,且相较于其他转化方法具有一定优势,其他丝状真菌表面展示系统的构建也均使用此方法,操作步骤略有不同,但最终都成功转化。美中不足的是,该方法的受体只能是原生质体,原生质体难制备、培养难度大、PEG对原生质体有一定的毒性并且变异率高[64],使其近年来在丝状真菌转化中使用次数越来越少。
农杆菌转化法也逐渐成为丝状真菌转化的重要方法,随着对其转化机制的深入了解,该方法将越来越完善[65]。
3 展望丝状真菌表面展示技术的发展进一步扩大了表面展示技术的应用领域,是表面展示技术的重要组成部分。从2008年表面展示技术首次在丝状真菌米曲霉上应用至今,丝状真菌表面展示技术的发展较为缓慢,主要原因是丝状真菌内源GPI锚定蛋白开发有限和丝状真菌基因工程困难较大。但随着转化方法和遗传工具的发展,丝状真菌表面展示系统可能迎来新的突破。在转化方法上,丝状真菌的转化越来越依赖农杆菌转化法,该方法转化效率高、受体多样化,并且对受体无毒害作用,本实验室从事丝状真菌韦伯灵芝的基因工程研究,经Zhou等[55]对农杆菌转化法的改进,丝状真菌的转化变得更加简单、高效,有希望进一步发展成为丝状真菌表面展示系统转化的热门方法。在遗传工具上,特别是成簇规律间隔的短回文重复序列及其相关系统(clustered regularly interspaced short palindromic repeats-related nuclease 9, CRISPR/Cas9)技术的出现,使得在丝状真菌中自由建立表面展示蛋白质的系统成为可能,如若能成功编辑GPI锚定蛋白的氨基酸,就有可能实现GPI锚定蛋白在细胞膜和细胞壁之间的自由锚定。同时,随着越来越多可用的丝状真菌基因组、转录组和蛋白质数据的相继公布,新的丝状真菌内源GPI蛋白将会被陆续发现,这将大大增加展示蛋白与锚定蛋白的匹配度,越来越多样化的丝状真菌表面展示系统将被发掘。
虽然目前丝状真菌表面展示技术应用范围相对有限,但是从其他已经成熟的表面展示技术可以发现,环保、染料脱色等领域依旧是未来丝状真菌表面展示技术发展的主题。特别是环保领域,丝状真菌有着得天独厚的优势。丝状真菌经过液体培养形成的菌丝球具有表面积大、生长速度快、沉降性能好、适应性强、能在废水环境中生长的优点,是微生物治理环境的友好型材料[66]。相较于传统微生物治污,丝状真菌表面展示系统治污具有可重复使用、抗逆性好和菌丝球个体大易回收等优点,菌丝球表面表达的金属结合肽特异性结合的重金属污染物可以在不破坏细胞的情况下除去,从而实现重复使用。本实验室长期从事灵芝菌丝球发酵工程的研究,已经实现了灵芝菌丝球的大型发酵罐培养[67],同时,灵芝对人体无害,如果能在灵芝菌丝球表面展示金属结合肽,该丝状真菌表面展示系统将在环境治理上具有重要作用。在染料废水脱色领域,酶表达在细胞内,存在需要有毒诱导剂诱导、纯化难度大和无法大规模提取等问题[68]。本实验室从野外筛选到一株高产漆酶的菌株“韦伯灵芝TZC” (专利号为200810198678.X)且已完成该菌株漆酶的分离与纯化[69],漆酶具有染料脱色脱毒的功能,如果将漆酶表达在丝状真菌菌丝球表面,以上问题都能迎刃而解,一种安全、廉价的漆酶就可实现工业化生产,只需要将表面表达漆酶等可脱色酶的菌丝球放入废水池即可实现脱色。当然,丝状真菌表面展示技术也有一定的风险,也有一部分丝状真菌如烟曲霉等具有一定的感染性,如何做到在造福人类的同时还能保证该系统的安全性,是一个值得思考的问题。
| [1] |
LEE SY, CHOI JH, XU ZH. Microbial cell-surface display[J]. Trends in Biotechnology, 2003, 21(1): 45-52. DOI:10.1016/S0167-7799(02)00006-9 |
| [2] |
XIANG HY, WANG JF, YANG YF, LÜ YC. The research progress of bacterial surface display technology[J]. Progress in Biochemistry and Biophysics, 2019, 46(2): 162-168. (in Chinese) 向红英, 王菊芳, 杨愈丰, 吕延成. 细菌表面展示技术研究新进展[J]. 生物化学与生物物理进展, 2019, 46(2): 162-168. DOI:10.16476/j.pibb.2018.0181 |
| [3] |
CHEN ZR, LI CZ, HE W, ZHOU Y, ZHANG ZH, LIU SW, TAN WL, ZHOU C. Construction of human full-length renal cell carcinoma patient-specific antibody library by mammalian cell surface display[J]. Journal of Southern Medical University, 2010, 30(5): 1059-1062, 1065. (in Chinese) 陈振瑞, 李长征, 贺微, 周烨, 张哲欢, 刘淑文, 谭万龙, 周辰. 采用哺乳动物细胞表面展示技术构建全长人源抗肾癌抗体基因库[J]. 南方医科大学学报, 2010, 30(5): 1059-1062, 1065. |
| [4] |
OMIDFAR K, DANESHPOUR M. Advances in phage display technology for drug discovery[J]. Expert Opinion on Drug Discovery, 2015, 10(6): 651-669. DOI:10.1517/17460441.2015.1037738 |
| [5] |
SLATE AJ, WHITEHEAD KA, BROWNSON DAC, BANKS CE. Microbial fuel cells: an overview of current technology[J]. Renewable and Sustainable Energy Reviews, 2019, 101: 60-81. DOI:10.1016/j.rser.2018.09.044 |
| [6] |
LI L, LIANG B, LI F, SHI JG, MASCINI M, LANG QL, LIU AH. Co-immobilization of glucose oxidase and xylose dehydrogenase displayed whole cell on multiwalled carbon nanotube nanocomposite films modified electrode for simultaneous voltammetric detection of d-glucose and d-xylose[J]. Biosensors and Bioelectronics, 2013, 42: 156-162. DOI:10.1016/j.bios.2012.10.062 |
| [7] |
MAY SW. Applications of oxidoreductases[J]. Current Opinion in Biotechnology, 1999, 10(4): 370-375. DOI:10.1016/S0958-1669(99)80067-6 |
| [8] |
SMITH GP. Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface[J]. Science, 1985, 228(4705): 1315-1317. DOI:10.1126/science.4001944 |
| [9] |
ANAND T, VIRMANI N, BERA BC, VAID RK, VASHISTH M, BARDAJATYA P, KUMAR A, TRIPATHI BN. Phage display technique as a tool for diagnosis and antibody selection for coronaviruses[J]. Current Microbiology, 2021, 78(4): 1124-1134. DOI:10.1007/s00284-021-02398-9 |
| [10] |
JAHNS AC, REHM BHA. Relevant uses of surface proteins-display on self-organized biological structures[J]. Microbial Biotechnology, 2012, 5(2): 188-202. DOI:10.1111/j.1751-7915.2011.00293.x |
| [11] |
LIU XX, ZHAN DW, ZHANG ZS. Application research progress of bacterial surface display technology[J]. Progress in Microbiology and Immunology, 2005, 33(2): 70-74. (in Chinese) 刘向昕, 展德文, 张兆山. 细菌表面展示技术的应用研究进展[J]. 微生物学免疫学进展, 2005, 33(2): 70-74. DOI:10.13309/j.cnki.pmi.2005.02.016 |
| [12] |
TEYMENNET-RAMÍREZ KV, MARTÍNEZ-MORALES F, TREJO-HERNÁNDEZ MR. Yeast surface display system: strategies for improvement and biotechnological applications[J]. Frontiers in Bioengineering and Biotechnology, 2022, 9: 794742. DOI:10.3389/fbioe.2021.794742 |
| [13] |
HAMILTON SR, BOBROWICZ P, BOBROWICZ B, DAVIDSON RC, LI HJ, MITCHELL T, NETT JH, RAUSCH S, STADHEIM TA, WISCHNEWSKI H, WILDT S, GERNGROSS TU. Production of complex human glycoproteins in yeast[J]. Science, 2003, 301(5637): 1244-1246. DOI:10.1126/science.1088166 |
| [14] |
LINCIANO S, PLUDA S, BACCHIN A, ANGELINI A. Molecular evolution of peptides by yeast surface display technology[J]. MedChemComm, 2019, 10(9): 1569-1580. DOI:10.1039/C9MD00252A |
| [15] |
KWON MJ, JØRGENSEN TR, NITSCHE BM, ARENTSHORST M, PARK J, RAM AF, MEYER V. The transcriptomic fingerprint of glucoamylase over-expression in Aspergillus niger[J]. BMC Genomics, 2012, 13(1): 701. DOI:10.1186/1471-2164-13-701 |
| [16] |
PUNT PJ, van BIEZEN N, CONESA A, ALBERS A, MANGNUS J, van den HONDEL C. Filamentous fungi as cell factories for heterologous protein production[J]. Trends in Biotechnology, 2002, 20(5): 200-206. DOI:10.1016/S0167-7799(02)01933-9 |
| [17] |
LUBERTOZZI D, KEASLING JD. Developing Aspergillus as a host for heterologous expression[J]. Biotechnology Advances, 2009, 27(1): 53-75. DOI:10.1016/j.biotechadv.2008.09.001 |
| [18] |
URBAR-ULLOA J, MONTAÑO-SILVA P, RAMÍREZ-PELAYO AS, FERNÁNDEZ-CASTILLO E, AMAYA-DELGADO L, RODRÍGUEZ-GARAY B, VERDÍN J. Cell surface display of proteins on filamentous fungi[J]. Applied Microbiology and Biotechnology, 2019, 103(17): 6949-6972. DOI:10.1007/s00253-019-10026-7 |
| [19] |
LIU Y, ZHANG R, LIAN ZS, WANG SH, WRIGHT AT. Yeast cell surface display for lipase whole cell catalyst and its applications[J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 106: 17-25. DOI:10.1016/j.molcatb.2014.04.011 |
| [20] |
ADACHI T, ITO J, KAWATA K, KAYA M, ISHIDA H, SAHARA H, HATA Y, OGINO C, FUKUDA H, KONDO A. Construction of an Aspergillus oryzae cell-surface display system using a putative GPI-anchored protein[J]. Applied Microbiology and Biotechnology, 2008, 81(4): 711-719. DOI:10.1007/s00253-008-1687-8 |
| [21] |
DONAT S, HASENBERG M, SCHÄFER T, OHLSEN K, GUNZER M, EINSELE H, LÖFFLER J, BEILHACK A, KRAPPMANN S. Surface display ofGaussia princepsluciferase allows sensitive fungal pathogen detection during cutaneous aspergillosis[J]. Virulence, 2012, 3(1): 51-61. DOI:10.4161/viru.3.1.18799 |
| [22] |
SU JC, OUYANG HM, ZHAO W, DONG ZY, JIN C. Construction of a cell-surface expression system in Trichoderma reesei[J]. Acta Microbiologica Sinica, 2013, 53(1): 38-46. (in Chinese) 苏建臣, 欧阳浩淼, 赵婉, 董志扬, 金城. 里氏木霉细胞表面表达系统的构建[J]. 微生物学报, 2013, 53(1): 38-46. DOI:10.13343/j.cnki.wsxb.2013.01.013 |
| [23] |
PAN ZY, YANG ZM, PAN L, ZHENG SP, HAN SY, LIN Y. Displaying Candida antarctica lipase B on the cell surface of Aspergillus niger as a potential food-grade whole-cell catalyst[J]. Journal of Industrial Microbiology and Biotechnology, 2014, 41(4): 711-720. DOI:10.1007/s10295-014-1410-y |
| [24] |
ZHONG YY, LU X, XING L, HO SWA, KWAN HS. Genomic and transcriptomic comparison of Aspergillus oryzae strains: a case study in soy sauce koji fermentation[J]. Journal of Industrial Microbiology & Biotechnology, 2018, 45(9): 839-853. |
| [25] |
HISADA H, SANO M, ISHIDA H, HATA Y, ABE Y, MACHIDA M. Deletion analysis of the superoxide dismutase (sodM) promoter from Aspergillus oryzae[J]. Applied Microbiology and Biotechnology, 2006, 72(5): 1048-1053. DOI:10.1007/s00253-006-0388-4 |
| [26] |
TAMALAMPUDI S, HAMA S, TANINO T, TALUKDER MR, KONDO A, FUKUDA H. Immobilized recombinant Aspergillus oryzae expressing heterologous lipase: an efficient whole-cell biocatalyst for enantioselective transesterification in non-aqueous medium[J]. Journal of Molecular Catalysis B: Enzymatic, 2007, 48(1/2): 33-37. |
| [27] |
YU XY, ZHONG ZM, HUANG YM, TAN BM, JIANG ZQ. Construction of secretory expression vector of Trichoderma reesei and expression of enhanced GFP[J]. Microbiology China, 2014, 41(5): 849-856. (in Chinese) 余希尧, 钟泽民, 黄毓茂, 谭博敏, 蒋志琼. 里氏木霉分泌型表达载体的构建及绿色荧光蛋白的表达[J]. 微生物学通报, 2014, 41(5): 849-856. DOI:10.13344/j.microbiol.china.130414 |
| [28] |
LI C, ZHOU JW, DU GC, CHEN J, TAKAHASHI S, LIU S. Developing Aspergillus niger as a cell factory for food enzyme production[J]. Biotechnology Advances, 2020, 44: 107630. DOI:10.1016/j.biotechadv.2020.107630 |
| [29] |
PAN ZY, JIN S, ZHANG X, ZHENG SP, HAN SY, PAN L, LIU Y. Biocatalytic behavior of a new Aspergillus niger whole-cell biocatalyst with high operational stability during the synthesis of green biosolvent isopropyl esters[J]. Journal of Molecular Catalysis B: Enzymatic, 2016, 131: 10-17. DOI:10.1016/j.molcatb.2016.05.012 |
| [30] |
FREE SJ. Fungal cell wall organization and biosynthesis[J]. Advances in Genetics, 2013, 81: 33-82. |
| [31] |
OUYANG HM, JIN C. Cell wall and GPI structure in Aspergillus fumigatus[J]. Guangxi Sciences, 2014, 21(2): 99-102. (in Chinese) 欧阳浩淼, 金城. 烟曲霉细胞壁及其GPI锚定结构研究进展[J]. 广西科学, 2014, 21(2): 99-102. DOI:10.13656/j.cnki.gxkx.20140319.002 |
| [32] |
LI H, ZHOU H, LUO YM, OUYANG HM, HU HY, JIN C. Glycosylphosphatidylinositol (GPI) anchor is required in Aspergillus fumigatus for morphogenesis and virulence[J]. Molecular Microbiology, 2007, 64(4): 1014-1027. DOI:10.1111/j.1365-2958.2007.05709.x |
| [33] |
HAMADA K, TERASHIMA H, ARISAWA M, YABUKI N, KITADA K. Amino acid residues in the omega-minus region participate in cellular localization of yeast glycosylphosphatidylinositol-attached proteins[J]. Journal of Bacteriology, 1999, 181(13): 3886-3889. DOI:10.1128/JB.181.13.3886-3889.1999 |
| [34] |
NUOFFER C, HORVATH A, RIEZMAN H. Analysis of the sequence requirements for glycosylphosphatidylinositol anchoring of Saccharomyces cerevisiae Gas1 protein[J]. Journal of Biological Chemistry, 1993, 268(14): 10558-10563. DOI:10.1016/S0021-9258(18)82235-9 |
| [35] |
UDENFRIEND S, KODUKULA K. How glycosyl-phosphatidylinositol-anchored membrane proteins are made[J]. Annual Review of Biochemistry, 1995, 64(1): 563-591. DOI:10.1146/annurev.bi.64.070195.003023 |
| [36] |
FRIEMAN MB, CORMACK BP. The ω-site sequence of glycosylphosphatidylinositol-anchored proteins in Saccharomyces cerevisiae can determine distribution between the membrane and the cell wall[J]. Molecular Microbiology, 2003, 50(3): 883-896. DOI:10.1046/j.1365-2958.2003.03722.x |
| [37] |
FRIEMAN MB, CORMACK BP. Multiple sequence signals determine the distribution of glycosylphosphatidylinositol proteins between the plasma membrane and cell wall in Saccharomyces cerevisiae[J]. Microbiology, 2004, 150(10): 3105-3114. DOI:10.1099/mic.0.27420-0 |
| [38] |
PETER O, MENON AK. Thematic review series: lipid posttranslational modifications. GPI anchoring of protein in yeast and mammalian cells, or: how we learned to stop worrying and love glycophospholipids[J]. Journal of Lipid Research, 2007, 48(5): 993-1011. DOI:10.1194/jlr.R700002-JLR200 |
| [39] |
OUYANG HM, CHEN XM, LÜ Y, WILSON IBH, TANG GM, WANG AQ, JIN C. One single basic amino acid at the ω-1 or ω-2 site is a signal that retains glycosylphosphatidylinositol-anchored protein in the plasma membrane of Aspergillus fumigatus[J]. Eukaryotic Cell, 2013, 12(6): 889-899. DOI:10.1128/EC.00351-12 |
| [40] |
MUSZKIETA L, FONTAINE T, BEAU R, MOUYNA I, VOGT MS, TROW J, CORMACK BP, ESSEN LO, JOUVION G, LATGÉ JP. The glycosylphosphatidylinositol-anchored DFG family is essential for the insertion of galactomannan into the β-(1, 3)-glucan-chitin core of the cell wall of Aspergillus fumigatus[J]. mSphere, 2019, 4(4): e00397-19. |
| [41] |
BOWMAN SM, FREE SJ. The structure and synthesis of the fungal cell wall[J]. BioEssays: News and Reviews in Molecular, Cellular and Developmental Biology, 2006, 28(8): 799-808. DOI:10.1002/bies.20441 |
| [42] |
KLIS FM, BOORSMA A, de GROOT PWJ. Cell wall construction in Saccharomyces cerevisiae[J]. Yeast (Chichester, England), 2006, 23(3): 185-202. DOI:10.1002/yea.1349 |
| [43] |
KAPTEYN JC, MONTIJIN RC, VINK E, de LA CRUZ J, LLOBELL A, DOUWES JE, SHIMOI H, LIPKE PN, KLIS FM. Retention of Saccharomyces cerevisiae cell wall proteins through a phosphodiester-linked β-1, 3-/β-l, 6-glucan heteropolymer[J]. Glycobiology, 1996, 6(3): 337-345. DOI:10.1093/glycob/6.3.337 |
| [44] |
KOLLÁR R, PETRÁKOVÁ E, ASHWELL G, ROBBINS PW, CABIB E. Architecture of the yeast cell wall[J]. Journal of Biological Chemistry, 1995, 270(3): 1170-1178. DOI:10.1074/jbc.270.3.1170 |
| [45] |
KOLLÁR R, REINHOLD BB, PETRÁKOVÁ E, YEH HJC, ASHWELL G, DRGONOVÁ J, KAPTEYN JC, KLIS FM, CABIB E. Architecture of the yeast cell wall: β(1-6)-glucan interconnects mannoprotein, β(1-3)-glucan, and chitin[J]. Journal of Biological Chemistry, 1997, 272(28): 17762-17775. DOI:10.1074/jbc.272.28.17762 |
| [46] |
LU CF, MONTIJN RC, BROWN JL, KLIS F, KURJAN J, BUSSEY H, LIPKE PN. Glycosyl phosphatidylinositol-dependent cross-linking of alpha-agglutinin and beta 1, 6-glucan in the Saccharomyces cerevisiae cell wall[J]. The Journal of Cell Biology, 1995, 128(3): 333-340. DOI:10.1083/jcb.128.3.333 |
| [47] |
BOWMAN SM, PIWOWAR A, CIOCCA M, FREE SJ. Mannosyltransferase is required for cell wall biosynthesis, morphology and control of asexual development in Neurospora crassa[J]. Mycologia, 2005, 97(4): 872-879. DOI:10.1080/15572536.2006.11832778 |
| [48] |
BUURMAN ET, WESTWATER C, HUBE B, BROWN AJ, ODDS FC, GOW NA. Molecular analysis of CaMnt1p, a mannosyl transferase important for adhesion and virulence of Candida albicans[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(13): 7670-7675. |
| [49] |
WAGENER J, ECHTENACHER B, ROHDE M, KOTZ A, KRAPPMANN S, HEESEMANN J, EBEL F. The putative α-1, 2-mannosyltransferase AfMnt1 of the opportunistic fungal pathogen Aspergillus fumigatus is required for cell wall stability and full virulence[J]. Eukaryotic Cell, 2008, 7(10): 1661-1673. DOI:10.1128/EC.00221-08 |
| [50] |
ZHOU H, HU HY, ZHANG LJ, LI RY, OUYANG HM, MING J, JIN C. O-mannosyltransferase 1 in Aspergillus fumigatus (AfPmt1p) is crucial for cell wall integrity and conidium morphology, especially at an elevated temperature[J]. Eukaryotic Cell, 2007, 6(12): 2260-2268. DOI:10.1128/EC.00261-07 |
| [51] |
MADDI A, FREE SJ. α-1, 6-mannosylation of N-linked oligosaccharide present on cell wall proteins is required for their incorporation into the cell wall in the filamentous fungus Neurospora crassa[J]. Eukaryotic Cell, 2010, 9(11): 1766-1775. DOI:10.1128/EC.00134-10 |
| [52] |
KOTZ A, WAGENER J, ENGEL J, ROUTIER FH, ECHTENACHER B, JACOBSEN I, HEESEMANN J, EBEL F. Approaching the secrets of N-glycosylation in Aspergillus fumigatus: characterization of the AfOch1 protein[J]. PLoS One, 2010, 5(12): e15729. DOI:10.1371/journal.pone.0015729 |
| [53] |
CASE ME, SCHWEIZER M, KUSHNER SR, GILES NH. Efficient transformation of Neurospora crassa by utilizing hybrid plasmid DNA[J]. Proceedings of the National Academy of Sciences of the United States of America, 1979, 76(10): 5259-5263. |
| [54] |
TILBURN J, SCAZZOCCHIO C, TAYLOR GG, ZABICKY-ZISSMAN JH, LOCKINGTON RA, DAVIES RW. Transformation by integration in Aspergillus nidulans[J]. Gene, 1983, 26(2/3): 205-221. |
| [55] |
ZHOU YP, CHEN MH, LU JJ, KANG X, CHEN QH, HUANG XL, TIAN CE. A simple and efficient genetic transformation method of Ganoderma weberianum[J]. Folia Microbiologica, 2015, 60(5): 417-423. |
| [56] |
ZHOU LH, CHEN P, ZHAO YX, JING WW, LI Z, GE YY. Optimizing of genetic transformation conditions from Monascus anka by restriction enzyme-mediated DNA integration (REMI)[J]. Hubei Agricultural Sciences, 2012, 51(18): 4129-4133. (in Chinese) 周礼红, 陈平, 赵永霞, 荆雯雯, 李祝, 葛永仪. REMI介导红曲霉遗传转化条件的优化[J]. 湖北农业科学, 2012, 51(18): 4129-4133. |
| [57] |
BARCELLOS FG, FUNGARO MHP, FURLANETO MC, LEJEUNE B, PIZZIRANI-KLEINER AA, LÚCIO de AZEVEDO J. Genetic analysis of Aspergillus nidulans unstable transformants obtained by the biolistic process[J]. Canadian Journal of Microbiology, 1998, 44(12): 1137-1141. |
| [58] |
HERZOG RW, DANIELL H, SINGH NK, LEMKE PA. A comparative study on the transformation of Aspergillus nidulans by microprojectile bombardment of conidia and a more conventional procedure using protoplasts treated with polyethyleneglycol[J]. Applied Microbiology and Biotechnology, 1996, 45(3): 333-337. |
| [59] |
ZHANG BX, SUN QX, LI HF. Advances in genetic modification technologies[J]. Chinese Journal of Biotechnology, 2015, 31(8): 1162-1174. |
| [60] |
OZEKI K, KYOYA (FUJII) F, HIZUME K, KANDA A, HAMACHI M, NUNOKAWA Y. Transformation of Intact Aspergillus niger by electroporation[J]. Bioscience, Biotechnology, and Biochemistry, 1994, 58(12): 2224-2227. |
| [61] |
BINNINGER DM, SKRZYNIA C, PUKKILA PJ, CASSELTON LA. DNA-mediated transformation of the basidiomycete Coprinus cinereus[J]. The EMBO Journal, 1987, 6(4): 835-840. |
| [62] |
MAGAÑA-ORTÍZ D, COCONI-LINARES N, ORTIZ-VAZQUEZ E, FERNÁNDEZ F, LOSKE AM, GÓMEZ-LIM MA. A novel and highly efficient method for genetic transformation of fungi employing shock waves[J]. Fungal Genetics and Biology, 2013, 56: 9-16. |
| [63] |
HINNEN A, HICKS JB, FINK GR. Transformation of yeast[J]. Proceedings of the National Academy of Sciences of the United States of America, 1978, 75(4): 1929-1933. |
| [64] |
MAO Y, WANG D, HUANG ZB, XING JM. Technology and application of microbial protoplast fusion breeding[J]. China Biotechnology, 2010, 30(1): 93-97. (in Chinese) 毛雨, 王丹, 黄占斌, 邢建民. 微生物原生质体融合育种技术及其应用[J]. 中国生物工程杂志, 2010, 30(1): 93-97. |
| [65] |
LI DD, TANG Y, LIN J, CAI WW. Methods for genetic transformation of filamentous fungi[J]. Microbial Cell Factories, 2017, 16: 1-13. |
| [66] |
LI LX, ZHANG S, WANG D, MA F. Recent progress on mycelial pellet[J]. CIESC Journal, 2018, 69(6): 2364-2372. (in Chinese) 李立欣, 张斯, 王冬, 马放. 真菌菌丝球研究进展[J]. 化工学报, 2018, 69(6): 2364-2372. |
| [67] |
CHEN QH, ZHOU YP, GUI L, SUN LL, TIAN CE. Study on pilot-scale fermentation of Ganoderma weberianum for laccase production[J]. Food and Fermentation Industries, 2016, 42(5): 44-49. (in Chinese) 陈琼华, 周玉萍, 桂林, 孙莉丽, 田长恩. 韦伯灵芝漆酶生产中试研究[J]. 食品与发酵工业, 2016, 42(5): 44-49. |
| [68] |
CHEN QH, ZHOU YP, JIANG GJ, LI GY, CHENG HZ, TIAN CE. Laccase production by Ganoderma weberianum fermentation and its decolorization effect on indigo dye[J]. Food and Fermentation Industries, 2010, 36(3): 25-30. (in Chinese) 陈琼华, 周玉萍, 江桂杰, 李广宇, 程惠贞, 田长恩. 韦伯灵芝发酵产漆酶及其对靛蓝脱色作用的研究[J]. 食品与发酵工业, 2010, 36(3): 25-30. |
| [69] |
CHEN QH, ZHOU YP, CHEN X, KE DS, CHENG HZ, TIAN CE. Purification and characterization of laccase from Ganoderma weberianum[J]. Food Science, 2010, 31(5): 201-205. (in Chinese) 陈琼华, 周玉萍, 陈晓, 柯德森, 程惠贞, 田长恩. 韦伯灵芝漆酶的分离纯化及其性质[J]. 食品科学, 2010, 31(5): 201-205. |
 2023, Vol. 50
2023, Vol. 50