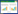扩展功能
文章信息
- 陈见兴, 王豪杰, 潘喻, 刘弘毅, 林欢, 朱良全, 陈洪岩, 谢金鑫, 夏长友, 张贺, 王玉娥
- CHEN Jianxing, WANG Haojie, PAN Yu, LIU Hongyi, LIN Huan, ZHU Liangquan, CHEN Hongyan, XIE Jinxin, XIA Changyou, ZHANG He, WANG Yu'e
- PDCoV、SADS-CoV与SVA三重RT-PCR检测方法的建立与应用
- Establishment and application of a triplex RT-PCR method for detection of PDCoV, SADS-CoV, and SVA
- 微生物学通报, 2023, 50(12): 5439-5448
- Microbiology China, 2023, 50(12): 5439-5448
- DOI: 10.13344/j.microbiol.china.230585
-
文章历史
- 收稿日期: 2023-07-17
- 接受日期: 2023-09-06
- 网络首发日期: 2023-10-07
2. 中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室, 黑龙江 哈尔滨 150069;
3. 中国兽医药品监察所, 北京 102600
2. State Key Laboratory of Veterinary Biotechnology, Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150069, Heilongjiang, China;
3. China Institute of Veterinary Drug Control, Beijing 102600, China
猪丁型冠状病毒(porcine deltacoronavirus, PDCoV)和新型猪急性腹泻综合征冠状病毒(swine acute diarrhea syndrome coronavirus, SADS-CoV)均属于冠状病毒科,作为近年来猪的新发病原,可引起仔猪腹泻、呕吐甚至严重脱水死亡,临床症状与猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)和猪传染性胃肠炎病毒(transmissible gastroenteritis virus, TGEV)相似,难以根据临床症状进行快速诊断[1-2]。塞内卡病毒A型(seneca virus A, SVA)属于小RNA病毒科塞内卡病毒属唯一的成员,可引起患病猪嗜睡、厌食、跛行及某些器官产生水疱样病变甚至死亡,临床症状与口蹄疫、猪水疱病和水疱性口炎等引起水疱症状的病原相似,难以通过临床症状进行区分[3-4]。PDCoV、SADS-CoV和SVA均为猪的新发病原,无季节特异性和年龄特异性,但具有较高的感染率和死亡率,这3种新发病原均为RNA病毒,结构简单,具有较高的突变率[5]。有研究表明PDCoV和SADS-CoV分别可能由鸟类和蝙蝠突变而来[6-7],SVA可感染牛、苍蝇和老鼠[8],说明这些新发病原具有跨物种传播的风险和广泛流行的可能。目前,一些国家均有相关病例的报道[9-10],每次暴发均对各国的生猪健康和经济造成很大的影响。
目前国内外已报道的方法中仅有少数几个相关病原的单重或双重反转录-聚合酶链式反应(reverse transcription-polymerase chain reaction, RT-PCR)方法的建立,尚未见可同时检测PDCoV、SADS-CoV与SVA这3种新发病原的多重RT-PCR方法,其中曾秀秀等[11]建立的多重RT-PCR方法中虽然包含PDCoV和SADS-CoV的检测,但最低检测拷贝数分别仅为1×106 copies/μL和1×104 copies/μL,灵敏性不高。其他单重RT-PCR的检测方法虽然灵敏性高,但仅能检测单一病原,操作烦琐且极易漏检,存在一定的局限性。因此,本研究通过序列比对分析确定PDCoV、SADS-CoV和SVA的特异性检测靶基因,设计3对特异性引物并建立一种能够同时快速检测此3种病毒的RT-PCR方法,以期为新发病原的流行病学调查和临床诊断提供灵敏和可靠的技术手段。
1 材料与方法 1.1 病毒基因组和病料新型猪急性腹泻综合征冠状病毒(swine acute diarrhea syndrome coronavirus, SADS-CoV)、猪丁型冠状病毒(porcine deltacoronavirus, PDCoV)、塞内卡病毒A型(seneca virus A, SVA)、猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)、猪传染性胃肠炎病毒(transmissible gastroenteritis virus, TGEV)、猪伪狂犬病毒(pseudorabies virus, PRV)、猪流感病毒(swine influenza virus, SIV)、猪圆环病毒2型(porcine circovirus type 2, PCV2)、猪瘟病毒(classical swine fever virus, CSFV)和猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)的基因组均由中国兽医药品监察所惠赠;从不同猪场采集273份腹泻病料。
1.2 主要试剂和仪器2×Taq PCR StarMix with Loading Dye,北京依珊汇通科技有限公司;TIANamp Virus DNA/RNA Kit、EndoFree Maxi Plasmid Kit和TIANprep Mini Plasmid Kit,黑龙江泰康生物科技有限公司;Gel Extraction Kit,北京索莱宝科技有限公司;Escherichia coli DH5α感受态细胞,北京睿博兴科生物技术有限公司;pMD18-T载体和PrimeScript™ RT reagent Kit,宝生物工程(大连)有限公司。梯度PCR仪,北京佰鸥创投生物科技有限公司;电泳仪,北京市六一仪器厂;凝胶成像仪,上海天能科技有限公司。
1.3 引物合成和设计参照GenBank中登录的PDCoV N基因(MN942260)、SADS-CoV N基因(MN368598)和SVA L/P1基因(MN700930)序列,利用Primer 5.0软件设计3对特异性引物序列(表 1),由北京睿博兴科生物技术有限公司合成,合成后的引物稀释至10 μmol/L,并保存于−20 ℃备用。
| Primer name | Primer sequence (5'→3') | Product size (bp) |
| SVA-F | TAGTCGTGTCGGTTCTATAGGTAGC | 663 |
| SVA-R | TGGCAGTAAAAGTGGTGGTGGGTTG | |
| PDCoV-F | AACCCCAACAATCCTAAACATCAGC | 501 |
| PDCoV-R | GAGCGCATCCTTAAGTCTCTCATAG | |
| SADS-CoV-F | CACTCCAGATCAACAGATTGGTTAT | 312 |
| SADS-CoV-R | CGAGACTGTGAACGTGAAGC |
根据反转录试剂盒说明书将SADS-COV、PDCoV、SVA、PEDV、TGEV、CSFV和PRRSV的RNA反转录为cDNA,于−80 ℃保存备用。
1.5 重组质粒的制备利用胶回收试剂盒分别回收SVA的L/P1基因、PDCoV和SADS-CoV的N基因的部分保守序列,与pMD18-T载体连接,构建重组质粒PMD-PDCoV、PMD-SADS-CoV和PMD-SVA,分别转化至E. coli DH5α感受态细胞,选取阳性克隆菌测序。将测序正确的样品扩大培养后采用质粒提取试剂盒分别提取PMD-PDCoV、PMD-SADS-CoV和PMD-SVA,用超微量核酸蛋白分析仪测定其浓度并换算为拷贝数,分别作为三重RT-PCR的重组质粒标准品。
1.6 三重RT-PCR方法的建立及优化分别以PDCoV、SADS-CoV和SVA的cDNA为模板,利用设计的3对特异性引物分别进行单一和三重RT-PCR扩增。反应体系:2×Taq PCR StarMix 10 μL,3对引物分别为SVA F/R 0.5 μmol/L、PDCoV F/R 0.25 μmol/L和SADS-CoV F/R 0.25 μmol/L,模板1 μL,ddH2O补足20 μL。进一步对退火温度(50−60 ℃)和3种引物浓度比例进行优化,优化的方法是控制变量法,在其他因素保持不变的条件下,对某一因素的反应条件进行优化,最终确定三重RT-PCR的最佳反应条件。反应条件:95 ℃ 3 min;95 ℃ 30 s,58.3 ℃ 40 s,72 ℃ 35 s,35个循环;72 ℃ 5 min。
1.7 特异性试验应用优化后的三重RT-PCR方法,以SADS-CoV、PDCoV、SVA、TGEV、PEDV、PRRSV、SIV、CSFV、PCV2和PRV的DNA/cDNA为模板,分别以三重RT-PCR方法的引物,以及PEDV、TGEV、PRRSV、SIV、CSFV、PCV2和PRV的单独引物进行PCR/RT-PCR扩增,并使用1%琼脂糖凝胶电泳检测该方法的特异性。
1.8 灵敏性试验将1×1011 copies/μL的重组质粒PMD- PDCoV、1×1011 copies/μL的重组质粒PMD-SVA分别稀释为1×1010 copies/μL后,与1×1010 copies/μL的重组质粒PMD-SADS-CoV等体积混合,用ddH2O进行10倍倍比稀释作为模板,利用优化后的三重RT-PCR方法进行检测,验证该方法的灵敏性。
1.9 重复性试验应用建立的三重RT-PCR方法进行重复性试验。批内试验:以PMD-PDCoV、PMD-SADS- CoV和PMD-SVA为模板进行PCR扩增,每次试验做3次重复;批间试验:分批提取质粒PMD-PDCoV、PMD-SADS-CoV和PMD-SVA,等体积混合后,在相同条件下分别进行3次PCR扩增,以评估该方法的重复性和可靠性。
1.10 临床样品检测从猪场采集粪便样品273份,每份样品取1−2 g于2 mL离心管中,加入PBS将样品浸没并使用漩涡振荡器充分振荡混匀,12 000 r/min离心3−5 min取上清,将上清分别使用0.22 μm的滤膜过滤获得病毒原液。根据TIANamp Virus DNA/RNA Kit说明书分别提取病毒原液中的基因组,并利用反转录试剂盒进行反转录,获得反转录产物。用本研究建立的三重RT-PCR方法与此类病原已报道的单重或多重RT-PCR检测方法进行比较[12-14],以确定该方法的准确性。
2 结果与分析 2.1 重组质粒标准品的鉴定结果构建重组质粒PMD-PDCoV、PMD- SADS-CoV和PMD-SVA,利用紫外分光光度计检测3种重组质粒浓度分别为670、719和113 μg/mL。经换算分别为1.82×1011、2.05×1011和3.43×1010 copies/μL,将质粒分别存放于−20 ℃备用。
2.2 单一及三重RT-PCR检测的建立分别以PDCoV、SADS-CoV和SVA的cDNA为模板,利用设计的3对特异性引物,分别进行单一和三重RT-PCR扩增。结果显示,能够特异性扩增出PDCoV、SADS-CoV和SVA的目的片段,阴性对照组无扩增条带(图 1)。将目的条带切胶回收后测序,结果与预期结果一致。
|
| 图 1 单重RT-PCR和三重RT-PCR扩增结果 Figure 1 Amplification results of single RT-PCR and triple RT-PCR. 1‒4: RT-PCR products of SVA L/P1, PDCoV and SADS-CoV N gene, respectively; 5: Negative control; M: DL2000 DNA Marker. 1‒4:SVA L/P1基因、PDCoV的N基因、SADS-CoV的N基因和多重RT-PCR阳性条带;5:阴性对照;M:DL2000 DNA Marker |
|
|
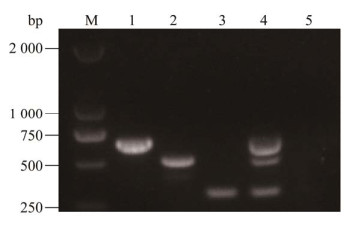
通过对退火温度和引物浓度进行优化,确定三重RT-PCR的最适反应体系:2×Taq PCR Mix 10 μL,引物PDCoV-F/PDCoV-R、SADS- CoV-F/SADS-CoV-R和SVA-F/SVA-R分别为0.50、0.25和0.25 μmol/L,模板1 μL,ddH2O补足20 μL。最适反应条件:95 ℃ 3 min;95 ℃ 30 s,58.3 ℃ 40 s,72 ℃ 35 s,35个循环;72 ℃ 5 min。结果表明优化后的退火温度及引物浓度能特异性地扩增出目的片段(图 2)。
|
| 图 2 三重RT-PCR退火温度及引物浓度的选择 Figure 2 Selection of annealing temperature and primer concentration for the triple PCR. A: 1‒8: The annealing temperature were 60.0, 59.4, 58.3, 56.3, 53.9, 52.0, 50.7 and 50.0 ℃; M: DL2000 DNA Marker. B: 1‒3: Concentrations of PDCoV primer was 0.250 μmol/L, concentrations of SADS-CoV and SVA primers were 0.250, 0.325 and 0.500 μmol/L; 4‒6: Concentrations of PDCoV primer was 0.325 μmol/L, concentrations of SADS-CoV and SVA primers were 0.250, 0.325 and 0.500 μmol/L; 7‒9: Concentrations of PDCoV primer was 0.500 μmol/L, concentrations of SADS-CoV and SVA primers were 0.250, 0.325 and 0.500 μmol/L; M: DL2000 DNA Marker. A:1‒8:退火温度分别为60.0、59.4、58.3、56.3、53.9、52.0、50.7和50.0 ℃;M:DL2000 DNA Marker. B:1‒3:PDCoV引物为0.250 μmol/L,SADS-COV和SVA引物分别为0.250、0.325和0.500 μmol/L;4‒6:PDCoV引物为0.325 μmol/L,SADS-COV和SVA引物为0.250、0.325和0.500 μmol/L;7‒9:PDCoV引物为0.500 μmol/L,SADS-COV和SVA引物为0.250、0.325和0.500 μmol/L;M:DL2000 DNA Marker |
|
|
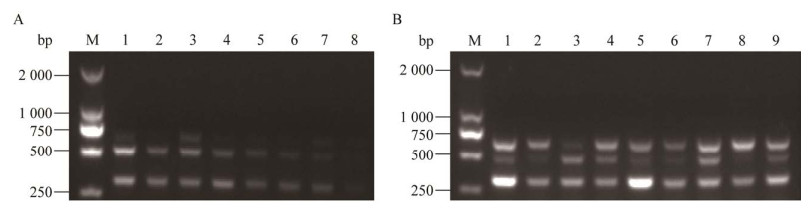
以建立的三重RT-PCR方法对SADS-CoV、PDCoV、SVA、PEDV、TGEV、PRRSV、SIV、CSFV、PCV2和PRV的DNA/cDNA进行PCR扩增。图 3结果显示,用三重RT-PCR引物扩增含SVA等10种病原基因组cDNA只能扩增出3种目的病原的基因,其他病原基因未获得扩增产物。目前扩增出的PEDV等病原条带作为阳性对照,阴性对照无特异性条带,表明该方法具有良好的特异性。

|
| 图 3 三重RT-PCR的特异性试验 Figure 3 Specificity test of the triple RT-PCR. 1: Amplification results of SVA, PDCoV, SADS-CoV, PEDV, TGEV, PRRSV, SIV, CSFV, PCV2, and PRV mixture with primers of SADS-CoV, PDCoV and SVA; 2, 4, 6, 8, 10, 12, and 14: Positive control of PEDV, TGEV, PRRSV, SIV, CSFV, PCV2, and PRV; 3, 5, 7, 9, 11, 13, and 15: Amplification results of PEDV, TGEV, PRRSV, SIV, CSFV, and PCV2 with primers of SADS-CoV, PDCoV and SVA respectively; 16: Negative control; M: DL2000 DNA Marker. 1:采用SADS-CoV、PDCoV和SVA的引物对SADS-CoV、PDCoV、SVA、PEDV、TGEV、PRRSV、SIV、CSFV、PCV2和PRV的DNA/cDNA混合物进行RT-PCR的扩增结果;2、4、6、8、10、12和14:PEDV、TGEV、PRRSV、SIV、CSFV、PCV2和PRV阳性对照;3、5、7、9、11、13和15:采用SADS-CoV、PDCoV和SVA的引物分别对PEDV、TGEV、PRRSV、SIV、CSFV、PCV2和PRV的DNA/cDNA进行RT-PCR的扩增结果;16:阴性对照组;M:DL2000 DNA Marker |
|
|
将拷贝数1×1011 copies/μL的重组质粒PMD-PDCoV、1×1011 copies/μL的重组质粒PMD-SVA分别稀释为1×1010 copies/μL后,与1×1010 copies/μL的重组质粒PMD-SADS-CoV等体积混合,然后进行10倍倍比稀释作为模板。结果显示,PMD-PDCoV的检测下限是1 copies/μL,PMD-SADS-CoV的检测下限是1 copies/μL、PMD-SVA检测下限是10 copies/μL (图 4),表明该方法敏感性较高。
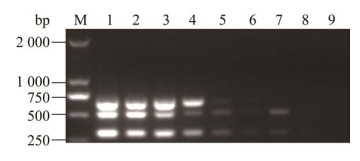
|
| 图 4 三重RT-PCR敏感性试验 Figure 4 Sensitivity test of the triple RT-PCR. 1‒8: The mixed plasmid concentrations were 1×107‒1×100 copies/μL, respectively; 9: Negative control; M: DL2000 DNA Marker. 1‒8:重组混合质粒浓度分别为1×107‒1×100 copies/μL;9:阴性对照;M:DL2000 DNA Marker |
|
|
利用建立的三重RT-PCR检测方法进行批内和批间重性试验,结果显示该方法扩增条带均一致(图 5),表明该方法具有良好的重复性。
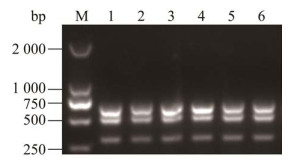
|
| 图 5 三重RT-PCR重复性试验 Figure 5 Repeatability test of the triple RT-PCR. 1‒3: Intra batch repetition; 4‒6: Inter batch repetition; M: DL2000 DNA Marker. 1‒3:批内重复;4‒6:批间重复;M:DL2000 DNA Marker |
|
|
利用本试验建立的三重RT-PCR方法与已报道文献中所使用的引物分别对273份临床样品进行检测,结果显示,PDCoV、SADS-CoV和SVA的阳性率分别为4.4%、0%和0.73%。PDCoV与SVA混合感染、PDCoV与SADS-CoV混合感染、SVA和SADS-CoV的阳性率均为0%,PDCoV、SADS-CoV和SVA混合感染阳性率为0%,与这3种病原已报道的单重或多重RT-PCR检测方法的检测结果复合率为100%。表明本研究建立的三重PCR方法准确性高,临床应用性好(表 2)。
| Virus | Positive rate (%) | Agreement rate (%) | |
| Triple PCR methods | Reported PCR detection methods | ||
| PDCoV | 4.4 (12/273) | 4.4 (12/273) | 100 |
| SADS-CoV | 0 (0/273) | 0 (0/273) | 100 |
| SVA | 0.73 (2/273) | 0.73 (2/273) | 100 |
| PDCoV+SVA | 0 (0/273) | 0 (0/273) | 100 |
| PDCoV+ SADS-CoV | 0 (0/273) | 0 (0/273) | 100 |
| SVA+SADS-CoV | 0 (0/273) | 0 (0/273) | 100 |
| PDCoV+ SADS-CoV+SVA | 0 (0/273) | 0 (0/273) | 100 |
随着我国养猪业养殖密度的日益加大,猪的疫病呈现出多种病原混合感染的态势,这极大地加快了疫病的传播和变异的速度,提高了防疫的难度,是目前养猪业面临的重大挑战。近年来,PDCoV、SADS-CoV和SVA均为猪的新发病原,具有较强的重组能力和较高的突变率,导致这些新发病原不具有宿主特异性,可实现跨宿主传播,对人类的健康存在潜在的威胁[15-16]。针对这些新发病原,很难做到仅通过临床症状进行快速诊断,还需借助实验室手段才能确诊。
PCR作为分子生物学常用的检测方法之一,因其灵敏性高、特异性强、操作简便等优点而被广泛应用。张帆帆等[17]根据PDCoV N基因设计引物,建立了单重RT-PCR检测方法;司广斌等[12]根据SADS-CoV N基因设计引物,建立了单重RT-PCR检测方法;范慧等[14]根据SVA保守基因设计引物,建立了单重RT-PCR检测方法。与以上方法相比,本研究建立的方法具有可同时检测多种病原且省时等优点。秦秋英等[18]根据PDCoV N基因设计引物和探针,建立了荧光定量PCR检测方法;张记宇等[19]根据SADS-CoV N基因设计引物,建立了SYBR Green荧光定量PCR检测方法;郭振华等[20]根据SVA保守基因VP1设计引物,建立了Taqman荧光定量PCR检测方法。相较以上方法,本研究建立的方法具有操作简便、省时、检测成本低等优点。目前国内外鲜见可同时检测这三种病原的多重RT-PCR方法的文献报道。因此亟须建立一种准确性高、敏感性强、重复性好的多重RT-PCR方法检测方法,实现对这3种新发病原的高效快速诊断,以防止其流行和暴发,并为实验室确诊此类与其他病原临床症状相似的病原提供有效手段。
本研究针对SVA的L/P1基因和PDCoV、SADS-CoV的N基因的保守区域,分别设计了3对特异性引物,扩增的目的片段大小分别为663、501和313 bp,相邻片段大小在100 bp以上,可在凝胶电泳时比较直观地区分。本研究进一步优化了退火温度和引物浓度等条件,获得了最佳反应条件,建立了一种能同时检测出PDCoV、SADS-CoV和SVA的多重RT-PCR方法,实现了对这3种新发病原同时快速诊断的目的。同时,本试验建立的方法具有灵敏性高、重复性好和特异性强等特点,能为此类新发病原检测提供准确和可靠的检测结果。利用本研究建立完成的三重PCR的方法,对来自不同猪场采集的273份临床样品进行了检测,分别检出PDCoV阳性率为4.4%、SADS-CoV阳性率为0%、SVA阳性率为0.73%,3种病毒混合感染检出率为0%,与文献中已报道的引物检测结果一致,表明该方法具有较好的临床应用效果。由于检测样品数目有限,并未有混合阳性样品检出,还需进一步对临床样品进行收集和检测,以进一步丰富临床检测数据并为流行病学调查提供有效资料。
| [1] |
LI RF, LU XH, JIANG JQ, WANG ZL. Research advances on porcine emerging coronaviruses[J]. Chinese Journal of Animal and Veterinary Sciences, 2020, 51(10): 2359-2366. (in Chinese) 李任峰, 卢晓辉, 姜金庆, 王自良. 猪新发冠状病毒研究进展[J]. 畜牧兽医学报, 2020, 51(10): 2359-2366. |
| [2] |
WANG QH, VLASOVA AN, KENNEY SP, SAIF LJ. Emerging and re-emerging coronaviruses in pigs[J]. Current Opinion in Virology, 2019, 34: 39-49. DOI:10.1016/j.coviro.2018.12.001 |
| [3] |
ZHANG XL, ZHU ZX, YANG F, CAO WJ, TIAN H, ZHANG KS, ZHENG HX, LIU XT. Review of Seneca valley virus: a call for increased surveillance and research[J]. Frontiers in Microbiology, 2018, 9: 940. DOI:10.3389/fmicb.2018.00940 |
| [4] |
JOSHI LR, FERNANDES MHV, CLEMENT T, LAWSON S, PILLATZKI A, RESENDE TP, VANNUCCI FA, KUTISH GF, NELSON EA, DIEL DG. Pathogenesis of Senecavirus A infection in finishing pigs[J]. Journal of General Virology, 2016, 97(12): 3267-3279. DOI:10.1099/jgv.0.000631 |
| [5] |
SABIR JSM, LAM TTY, AHMED MMM, LI LF, SHEN YY, ABO-ABA SEM, QURESHI MI, ABU-ZEID M, ZHANG Y, KHIYAMI MA, ALHARBI NS, HAJRAH NH, SABIR MJ, MUTWAKIL MHZ, KABLI SA, ALSULAIMANY FAS, OBAID AY, ZHOU BP, SMITH DK, HOLMES EC, et al. Co-circulation of three camel coronavirus species and recombination of MERS-CoVs in Saudi Arabia[J]. Science, 2016, 351(6268): 81-84. DOI:10.1126/science.aac8608 |
| [6] |
LAU SKP, WONG EYM, TSANG CC, AHMED SS, AU-YEUNG RKH, YUEN KY, WERNERY U, WOO PCY. Discovery and sequence analysis of four deltacoronaviruses from birds in the middle east reveal interspecies jumping with recombination as a potential mechanism for avian-to-avian and avian-to-mammalian transmission[J]. Journal of Virology, 2018, 92(15): e00265-e00218. |
| [7] |
ZHOU P, FAN H, LAN T, YANG XL, SHI WF, ZHANG W, ZHU Y, ZHANG YW, XIE QM, MANI S, ZHENG XS, LI B, LI JM, GUO H, PEI GQ, AN XP, CHEN JW, ZHOU L, MAI KJ, WU ZX, LI D, et al. Fatal swine acute diarrhoea syndrome caused by an HKU2-related coronavirus of bat origin[J]. Nature, 2018, 556(7700): 255-258. DOI:10.1038/s41586-018-0010-9 |
| [8] |
HUANG JQ, WU JB. Progress on porcine senecavirus[J]. Progress in Veterinary Medicine, 2019, 40(3): 82-88. (in Chinese) 黄健强, 吴静波. 猪塞内卡病毒研究进展[J]. 动物医学进展, 2019, 40(3): 82-88. |
| [9] |
DONG JG, RAO D, QIN YL, WANG YW, ZHANG N, YI BC, HUANG L, LIU JC, DENG KW. Research progress on porcine deltacoronavirus[J]. Guangdong Agricultural Sciences, 2019, 46(3): 113-118. (in Chinese) 董建国, 饶丹, 覃燕灵, 王艳午, 张宁, 易本驰, 黄立, 刘纪成, 邓凯伟. 猪德尔塔冠状病毒研究进展[J]. 广东农业科学, 2019, 46(3): 113-118. |
| [10] |
LIAO YX, FAN JD, ZHANG MR, LIU CC, ZHANG YY, SUN XY, CHEN JD, ZHAO MQ. Research progress of senecavirus A[J]. Chinese Journal of Veterinary Science, 2021, 41(8): 1645-1650, 1657. (in Chinese) 廖迎新, 范锦戴, 张梦茹, 刘晨晨, 章洋溢, 孙显月, 陈金顶, 赵明秋. A型塞内卡病毒研究进展[J]. 中国兽医学报, 2021, 41(8): 1645-1650, 1657. |
| [11] |
ZENG XX, SONG DP, ZHANG FF, LI K, YE Y, DING Z, WU Q, XIAO Q, YU ZX, GU J, CHEN J, ZHANG YH, ZENG X, HE HJ, TANG Y. Establishment and application of triple RT-PCR method for detection of enterodiarrhea coronavirus in three pigs[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(15): 105-109. (in Chinese) 曾秀秀, 宋德平, 张帆帆, 李凯, 叶昱, 丁珍, 吴琼, 肖琦, 于振兴, 顾俊, 陈君, 张誉瀚, 曾秀, 何后军, 唐玉新. 三种猪的肠道腹泻冠状病毒三重RT-PCR检测方法的建立与应用[J]. 黑龙江畜牧兽医, 2020(15): 105-109. |
| [12] |
SI GB, CHEN ZF, LIANG WQ, CHEN YB, HE DS. Establishment and application of a RT-PCR assay for detection of porcine acute diarrhea syndrome coronavirus[J]. China Animal Health Inspection, 2020, 37(11): 76-81. (in Chinese) 司广斌, 陈志飞, 梁文清, 陈一波, 贺东生. 猪急性腹泻综合征病毒RT-PCR检测方法的建立及应用[J]. 中国动物检疫, 2020, 37(11): 76-81. |
| [13] |
LI SS, JI LK, WANG ZH, CHEN G, YAN YX. Establishment and application of the multiplex PCR method for detection of PDCoV, PEDV, TGEV and PRoV[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(9): 74-79. (in Chinese) 李莎莎, 纪立凯, 王中华, 陈冈, 严亚贤. 猪Delta冠状病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪轮状病毒多重PCR检测方法的建立和应用[J]. 畜牧与兽医, 2020, 52(9): 74-79. |
| [14] |
FAN H, LI L, JIANG P, WANG XW, LI YF, BAI J. Establishment and application of a RT-PCR assay for detection of senecavirus A (SVA)[J]. Chinese Journal of Animal and Veterinary Sciences, 2019, 50(6): 1312-1318. (in Chinese) 范慧, 李亮, 姜平, 王先炜, 李玉峰, 白娟. 塞内卡病毒A的RT-PCR检测方法的建立和应用[J]. 畜牧兽医学报, 2019, 50(6): 1312-1318. |
| [15] |
LIU FX, WANG QQ, HUANG YL, WANG N, SHAN H. A 5-year review of senecavirus A in China since its emergence in 2015[J]. Frontiers in Veterinary Science, 2020, 7: 567792. |
| [16] |
LIU Q, WANG HY. Porcine enteric coronaviruses: an updated overview of the pathogenesis, prevalence, and diagnosis[J]. Veterinary Research Communications, 2021, 45(2/3): 75-86. |
| [17] |
ZHANG FF, SONG DP, ZHOU XR, HUANG DY, LI AQ, PENG Q, CHEN YJ, WU Q, HE HJ, TANG YX. Establishment and application of a RT-PCR assay for detection of newly emerged porcine deltacoronavirus[J]. Scientia Agricultura Sinica, 2016, 49(7): 1408-1416. (in Chinese) 张帆帆, 宋德平, 周信荣, 黄冬艳, 李安琪, 彭棋, 陈燕君, 吴琼, 何后军, 唐玉新. 新现猪Delta冠状病毒RT-PCR检测方法的建立及其应用[J]. 中国农业科学, 2016, 49(7): 1408-1416. |
| [18] |
QIN QY, SU XL, HUANG ST, QIN YB, HE Y, LU BX, CHEN Y, WEI ZZ, HUANG WJ, OUYANG K. Establishment and preliminary application of fluorescence quantitative PCR for detection of porcine deltacoronavirus[J]. Chinese Veterinary Science, 2022, 52(11): 1373-1378. (in Chinese) 秦秋英, 速雪丽, 黄诗婷, 秦毅斌, 何颖, 卢冰霞, 陈樱, 韦祖樟, 黄伟坚, 欧阳康. 猪德尔塔冠状病毒荧光定量PCR检测方法的建立与初步应用[J]. 中国兽医科学, 2022, 52(11): 1373-1378. |
| [19] |
ZHANG JY, HAN YR, SHI HY, CHEN JF, ZHANG X, LIU JB, ZHANG LY, FENG SF, FENG TS, JI ZY, SHI D, FENG L. Establishment and application of SYBR green real-time PCR for swine acute diarrhea syndrome coronavirus[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(10): 2887-2894. (in Chinese) 张记宇, 韩郁茹, 时洪艳, 陈建飞, 张鑫, 刘建波, 张燎原, 冯书风, 冯廷帅, 季朝阳, 石达, 冯力. 猪急性腹泻综合征冠状病毒SYBR Green荧光定量PCR检测方法的建立及应用[J]. 畜牧兽医学报, 2021, 52(10): 2887-2894. |
| [20] |
GUO ZH, RUAN HY, QIAO SL, DENG RG, ZHANG GP. Establishment and application of A TaqMan-based RT-qPCR assay for detection of senecavirus A[J]. Progress in Veterinary Medicine, 2020, 41(5): 6-12. (in Chinese) 郭振华, 阮海宇, 乔松林, 邓瑞广, 张改平. 基于TaqMan探针的A型塞尼卡病毒荧光定量RT-PCR方法的建立及应用[J]. 动物医学进展, 2020, 41(5): 6-12. |
 2023, Vol. 50
2023, Vol. 50