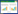扩展功能
文章信息
- 邹昕熠, 杜彦妮, 陈姝汐, 周文笛, 王文秀, 张馨月, 刘文涛, 蔡春雨, 罗启慧
- ZOU Xinyi, DU Yanni, CHEN Shuxi, ZHOU Wendi, WANG Wenxiu, ZHANG Xinyue, LIU Wentao, CAI Chunyu, LUO Qihui
- 新型鸭细小病毒样颗粒的制备及鉴定
- Preparation and identification of novel duck parvovirus virus-like particles
- 微生物学通报, 2023, 50(12): 5404-5412
- Microbiology China, 2023, 50(12): 5404-5412
- DOI: 10.13344/j.microbiol.china.230363
-
文章历史
- 收稿日期: 2023-05-04
- 接受日期: 2023-07-07
- 网络首发日期: 2023-08-29
2. 山东滨州畜牧兽医研究院, 山东 滨州 256600
2. Institute of Animal Husbandry and Veterinary Medicine in Binzhou of Shandong Province, Binzhou 256600, Shandong, China
鸭短喙侏儒综合征(beak atrophy and dwarfism syndrome, BADS)是由新型鸭细小病毒(novel duck parvovirus, NDPV)感染,导致雏鸭生长发育缓慢、上下喙萎缩、舌头外伸肿胀为特征的疾病,俗称“鸭长舌病”或“鸭大舌病”[1]。该病易感染10−30日龄的樱桃谷北京鸭雏鸭[2]。自2015年以来,BADS在中国广泛传播,可导致10%−100%的发病率和0−10%的死亡率[3]。患病鸭表现出不愿行走、进食减少甚至无法进食等症状;3周龄后,鸭体矮小、生长不良现象更加明显;在屠宰时,患病鸭的腿骨和翅膀易折断,对我国肉鸭养殖业造成严重的经济损失[4]。
水禽细小病毒(waterfowl parvovirus)属于细小病毒科(Parvoviridae)细小病毒亚科(Parvovirinae)依赖病毒属(Dependovirus)成员,被人熟知的是鹅细小病毒(goose parvovirus, GPV)[5]。新型鸭细小病毒包含一个小的无包膜、线性单链DNA基因组,长度约为5.1 kb,其复制不需要宿主细胞中的辅助病毒,病毒呈正二十面体对称,直径20−25 nm,无囊膜,与鹅细小病毒具有相似的基因组成与结构[6]。全基因组主要由中间2个开放阅读框(open reading frame, ORF)和两侧末端倒置重复序列(inverted terminal repeat, ITR)区构成,左侧ORF编码非结构蛋白NS1和NS2,右侧ORF编码结构蛋白VP1、VP2和VP3[7]。研究表明结构蛋白VP2 (1 764 bp)含有丰富的抗原表位,能刺激机体产生免疫反应,是常用的疫苗候选抗原[8]。
病毒样颗粒(virus-like particles, VLPs)是由病毒的一个或多个结构蛋白自发组成与天然病毒粒子结构相似的中空蛋白粒子,是非感染性病毒结构蛋白,因为它们不含病毒遗传物质,同时又保留了天然病毒的生物学活性,能有效诱导机体产生免疫应答反应,在疫苗开发中发挥着重要作用[9-10]。已有研究表明细小病毒家族能通过不同表达系统表达这3种结构蛋白,并在体外组装形成病毒样颗粒。相关文献报道VP2、VP3形成的VLPs比VP1形成的VLPs能使机体产生更高水平的中和抗体[11]。细菌是用于生产重组蛋白时最广泛使用的表达系统之一。大肠杆菌表达系统具有操作简单、生产成本低、细胞生长快和蛋白表达水平高等优点。目前未见大肠杆菌表达系统表达NDPV形成VLPs的相关研究报道,因此本研究通过应用大肠杆菌表达系统表达NDPV VP2蛋白制备病毒样颗粒,并进行纯化和组装鉴定,以期为研制NDPV亚单位疫苗及相关生物制品提供基础。
1 材料与方法 1.1 材料pColdTF表达载体、T4 DNA连接酶和EcoR I、Xho I限制性内切酶,TaKaRa公司;2×Phanta Max Master Mix高保真酶,南京诺唯赞生物科技股份有限公司;大肠杆菌DH5α和BL21(DE3)感受态细胞,生工生物工程(上海)股份有限公司;质粒提取试剂盒,Omega Bio-Tek公司;His-Tagged Protein Purification Kit (Soluble Protein),康为世纪生物科技股份有限公司;NDPV鸭阳性血清、阴性血清由本实验室保存;辣根过氧化物酶(horseradish peroxidase, HRP)标记兔抗鸭单克隆抗体,AB Box公司;预染蛋白标记,赛默飞世尔科技(中国)有限公司;过氧化物酶显色底物AEC (3-amino-9-ethylcarbazole)试剂盒和凝血酶(thrombin),北京索莱宝科技有限公司。PCR热循环仪、核酸蛋白电泳仪、凝胶成像系统,Bio-Rad公司;高速低温离心机、恒温制冷摇床,赛默飞世尔科技公司;超声波细胞破碎仪,宁波新芝生物科技股份有限公司;纳米粒度仪,马尔文帕纳科公司。
1.2 NDPV VP2基因的合成NDPV毒株使用由本实验室分离鉴定的QH-L01株,已测得VP2蛋白的基因序列(1 764 bp)。根据大肠杆菌密码子偏好性将基因序列进行优化,由南京金斯瑞生物科技有限公司合成pUC57-NDPV-VP2重组质粒和携带酶切位点的上、下游引物VP2F [5′-GAATTC(EcoR I)ACAG CTCCCGTAAAAAAG-3′]和VP2R [5′-CTCGAG(Xho I)TTAGAGATTCTGGGTCAG-3′]。
1.3 重组质粒pColdTF-NDPV-VP2的构建及鉴定以pUC57-NDPV-VP2为模板,通过PCR扩增VP2基因。PCR反应体系:上、下游引物(10 μmol/L)各2 μL,2×Phanta Max Master Mix 25 μL,模板1 μL,ddH2O 20 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 60 s,30个循环;72 ℃ 10 min。将反应产物经琼脂糖凝胶电泳鉴定,胶回收目的基因片段。用EcoR I和Xho I限制性内切酶分别与目的基因片段和pColdTF载体进行双酶切反应,反应完成后进行DNA纯化回收,随后用T4 DNA连接酶在16 ℃环境下反应30 min,获得重组表达质粒pColdTF-NDPV-VP2。将构建好的重组质粒转化大肠杆菌DH5α感受态细胞后涂布LB固体培养基培养过夜,然后挑取单菌落进行扩大培养;收集菌液并使用质粒提取试剂盒(Omega)提取重组质粒,对重组质粒进行双酶切鉴定后测序鉴定。
1.4 重组蛋白的诱导表达及可溶性分析将鉴定正确的pColdTF-NDPV-VP2重组质粒转化到大肠杆菌BL21(DE3)感受态细胞中,涂布至含有100 μg/mL氨苄青霉素的LB平板培养过夜,次日挑取单菌落接种至含有氨苄青霉素(100 μg/mL)的LB液体培养基培养为种子菌液,再以1:50的比例接种至同样的培养基中37 ℃、220 r/min振荡培养至OD600约为0.6−0.8时,加入终浓度为0.2 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl β-D-thiogalactopyranoside, IPTG),分别在16、24和37 ℃下诱导16 h以探索最佳诱导温度。在最佳诱导温度下按照上述方法分别加入终浓度为0.2、0.4、0.6、0.8和1.0 mmol/L的IPTG,探索最佳IPTG诱导浓度。诱导完成后,收集菌液至离心管中,7 000 r/min离心15 min弃上清收集菌体沉淀,加入1/10体积的磷酸缓冲盐溶液(phosphate buffer saline, PBS)重悬菌体,放置冰上进行超声破碎(功率设定300 W,工作5 s,间隔5 s),超声10 min后将破碎液转移至离心管中,4 ℃、12 000 r/min离心20 min,分别收集上清和沉淀,并各取90 μL进行SDS-PAGE分析重组蛋白的可溶性表达。
1.5 重组VP2蛋白的纯化和TF标签的切除按照优化后的最佳诱导条件表达重组蛋白,收集菌体并进行超声裂解,详细操作参照1.4中的步骤,收集超声破碎后的蛋白于4 ℃、12 000 r/min离心20 min后收集上清溶液。使用Ni-NTA亲和层析的方法对表达的重组蛋白进行纯化。将Ni-NTA填料吸至层析柱中,洗涤后使用5倍柱体积的结合缓冲液(binding buffer) (20 mmol/L Tris-HCl、10 mmol/L咪唑(imidazole)、500 mmol/L NaCl)平衡层析柱;将超声破碎后得到的上清液过滤后转移至平衡后的层析柱,放置摇床,设置转速90 r/min,4 ℃环境下相互作用30 min,用15倍柱体积的binding buffer洗涤,最后使用1倍柱体积的洗脱缓冲液(elution buffer) (20 mmol/L Tris-HCl、500 mmol/L咪唑、500 mmol/L NaCl)洗脱目的蛋白,收集洗脱液。纯化后的重组蛋白由于带有较大的促溶标签TF (trigger factor)-Tag (49 kDa),因此使用thrombin切除标签蛋白,4 ℃酶切过夜后将样品再次用Ni-NTA树脂纯化,收集洗脱液,得到纯化后的VP2蛋白。
1.6 重组蛋白的Western blotting鉴定取纯化的蛋白样品进行SDS-PAGE,以NDPV感染鸭阳性血清作为一抗,4 ℃孵育过夜,等渗缓冲盐溶液(Tris-HCl buffer solution Tween, TBST)洗膜3次,每次5 min;以HRP标记的兔抗鸭IgG为二抗,在摇床上低速振摇,室温孵育1 h,TBST洗膜3次,每次5 min,最后加入化学发光显色液避光进行显色处理,观察结果。
1.7 NDPV VLPs的组装和鉴定将纯化的VP2蛋白进行体外组装,配制组装缓冲液(50 mmol/L Tris-HCl、250 mmol/L NaCl、pH 8.0),将样品转移至14 kDa透析袋中密封后放入缓冲液中,在4 ℃低温环境下透析过夜。取透析组装后的蛋白样品20 μL滴于200目铜网上,室温下作用2 min,用磷钨酸染液负染,等待自然干燥后使用透射电镜(transmission electron microscope, TEM)观察样品的形态。另外,通过纳米粒度仪检测VLPs的粒径分布。
2 结果与分析 2.1 重组表达质粒pColdTF-NDPV-VP2的构建与鉴定结果选择pColdTF作为表达载体,该载体自带促溶标签TF-Tag以及Thrombin酶切位点方便后续切除,将VP2基因片段插入载体pColdTF中构建重组质粒pColdTF-NDPV-VP2,将构建好的pColdTF-NDPV-VP2质粒经双酶切后用0.8%琼脂糖凝胶电泳检测,结果显示约在1 700 bp和5 700 bp处可见两条特异性条带(图 1),经比对符合目的基因条带大小(1 764 bp)。将双酶切鉴定正确的质粒送检测序,结果与密码子优化后的序列相同,表明重组表达质粒pColdTF-NDPV-VP2构建成功。
|
| 图 1 重组质粒pColdTF-NDPV-VP2的双酶切鉴定 Figure 1 Identification of pColdTF-NDPV-VP2 plasmid digested by EcoR I and Xho I. M: DNA molecular Marker; 1: pColdTF-NDPV-VP2 plasmid digested by EcoR I and Xho I; 2: pColdTF-NDPV-VP2 plasmid. |
|
|
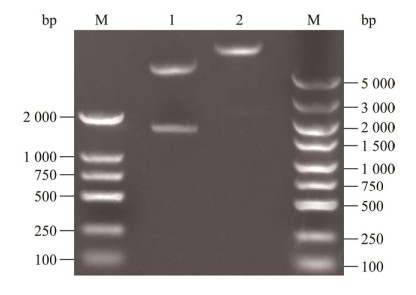
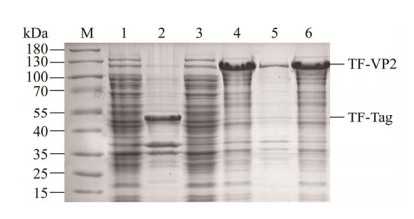
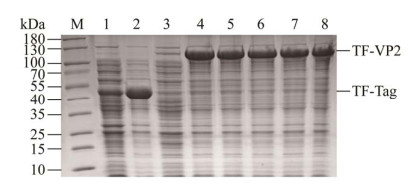
将重组表达质粒pColdTF-NDPV-VP2转化至大肠杆菌BL21(DE3)中,分别收集诱导前后的菌体,超声破碎后离心分离获得上清和沉淀进行SDS-PAGE鉴定。结果显示,空载质粒pColdTF经诱导后在48 kDa处出现明显条带,符合TF标签大小;重组表达质粒pColdTF-NDPV-VP2经诱导后在115 kDa处出现明显条带,符合重组蛋白TF-VP2的大小(67 kDa+48 kDa),表明成功诱导了重组蛋白的表达;表达的重组蛋白大部分是可溶的,主要存在于上清中(图 2)。对重组蛋白的最佳诱导温度和IPTG诱导浓度进行优化,结果显示重组蛋白在16 ℃和25 ℃条件下诱导主要以可溶性表达为主(图 3A),采用Image J软件检测蛋白条带光密度值,计算目的蛋白可溶性相对表达量,结果显示在16 ℃条件下目的蛋白可溶性相对表达量高于25 ℃ (图 3B),因此该蛋白表达的最佳诱导温度为16 ℃;考虑到IPTG具有一定毒性以及使用成本的问题,最终选取最低的0.2 mmol/L为诱导浓度(图 4)。
|
| 图 2 重组蛋白表达可溶性分析 Figure 2 Soluble analysis of recombinant protein. M:蛋白质Marker;1:pColdTF空载诱导前对照;2:pColdTF IPTG诱导后对照;3:pColdTF-NDPV-VP2 IPTG诱导前全菌;4:pColdTF-NDPV-VP2 IPTG诱导后全菌;5:pColdTF-NDPV-VP2 IPTG诱导后沉淀;6:pColdTF-NDPV-VP2 IPTG诱导后上清 M: Protein molecular weight Marker; 1: pColdTF without induced; 2: pColdTF induced by IPTG; 3: Total bacteria of pColdTF-NDPV-VP2 before induction by IPTG; 4: Total bacteria of pColdTF-NDPV-VP2 after induction by IPTG; 5: Sediment of pColdTF-NDPV-VP2 after induction by IPTG; 6: Supernatant of pColdTF-NDPV-VP2 after induction by IPTG. |
|
|
|
| 图 3 重组蛋白表达最佳温度条件优化 Figure 3 Optimization of recombinant protein expression temperature. M:蛋白质Marker;A:不同温度诱导下重组蛋白表达量. 1、2、3:分别为16 ℃诱导全菌、沉淀、上清;4、5、6:分别为25 ℃诱导全菌、沉淀、上清;7、8、9:分别为37 ℃诱导全菌、沉淀、上清. B:可溶性目的蛋白相对表达量 A: Expression of recombinant protein induced by different temperatures. M: Protein molecular weight (MW) Markers; 1, 2, 3: Total bacteria, sediment, supernatant of pColdTF-NDPV-VP2 after induction at 16 ℃; 4, 5, 6: Total bacteria, sediment, supernatant of pColdTF-NDPV-VP2 after induction at 25 ℃; 7, 8, 9: Total bacteria, sediment, supernatant of pColdTF-NDPV-VP2 after induction at 37 ℃. B: Relative expression of soluble protein. |
|
|
|
| 图 4 重组蛋白表达最佳IPTG浓度条件优化 Figure 4 Optimization of IPTG concentration. M:蛋白质分子质量标准;1:pColdTF空载未诱导;2:pColdTF空载诱导;3:pColdTF-NDPV-VP2未诱导;4‒8:IPTG终浓度分别为0.2、0.4、0.6、0.8和1.0 mmol/L M: Protein molecular weight (MW) Markers; 1: pColdTF without induced; 2: pColdTF induced by 0.2 mmol/L IPTG; 3: pColdTF-NDPV-VP2 without induced; 4‒8: Final concentration of IPTG was 0.2, 0.4, 0.6, 0.8 and 1.0 mmol/L, respectively. |
|
|
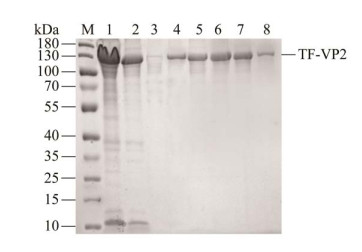
将诱导后得到的重组蛋白经Ni-NTA柱亲和层析纯化后进行SDS-PAGE分析,如图 5所示,得到了纯度较高、单一的目的蛋白,且洗脱峰集中在泳道5−7样品中。
|
| 图 5 重组蛋白TF-VP2的纯化 Figure 5 Purification of TF-VP2 protein. M:蛋白质分子质量标准;1:诱导后菌体上清;2:流穿液;3:洗涤液;4‒8:洗脱液 M: Protein molecular weight (MW) Markers; 1: Supernatant of pColdTF-NDPV-VP2 after induction; 2: Flow buffer; 3: Wash buffer; 4‒8: Purified TF-VP2 protein. |
|
|
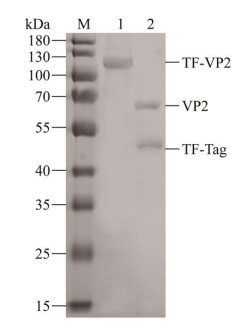
将纯化得到的TF-VP2重组蛋白使用Thrombin酶切标签蛋白TF,酶切后的产物采用SDS-PAGE鉴定。结果显示,分别在约67 kDa和48 kDa处出现两条特异性条带,符合VP2蛋白和TF标签蛋白的大小,表示Thrombin酶酶切成功,得到单一的VP2蛋白(图 6)。通过Ni-NTA亲和层析纯化酶切后的蛋白,即得到单一的不含TF标签的VP2蛋白,使用二辛可宁酸蛋白浓度测定试剂盒(bicinchoninic acid, BCA)进行浓度测定,得到重组蛋白VP2浓度为1.023 mg/mL。
|
| 图 6 Thrombin酶处理后的TF-VP2蛋白 Figure 6 TF-VP2 protein after thrombin digestion. M:蛋白质分子质量标准;1:纯化后的TF-VP2蛋白;2:Thrombin酶处理后的TF-VP2蛋白 M: Protein molecular weight (MW) Markers; 1: Purified TF-VP2 protein; 2: Protein after Thrombin digestion. |
|
|
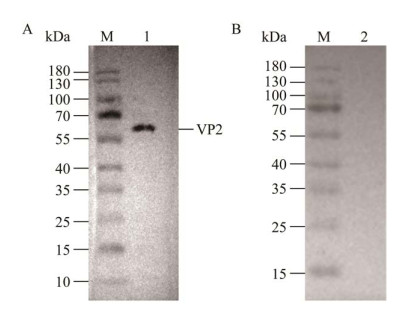
将纯化后的蛋白进行Western blotting鉴定,一抗分别为NDPV鸭阳性血清、鸭阴性血清,二抗为HRP标记的兔抗鸭IgG抗体。结果如图 7A所示,在67 kDa处出现一条特异性条带,与目标条带大小相符,而与鸭阴性血清反应未出现目的条带(图 7B),表明纯化后的VP2蛋白能与NDPV鸭阳性血清中特异性抗体结合,具有良好的反应原性。
|
| 图 7 纯化后的VP2蛋白Western blotting分析 Figure 7 Western blotting analysis of purified VP2 protein. A:纯化后的VP2蛋白与NDPV鸭阳性血清反应(泳道1). B:纯化后的VP2蛋白与鸭阴性血清反应(泳道2). M:蛋白质分子质量标准 A: Purified VP2 protein with NDPV duck-positive serum (lane 1). B: Purified VP2 protein with NDPV duck-negative serum (lane 2). M: Protein molecular weight Marker. |
|
|
取组装后的重组蛋白样品经3%的磷钨酸负染后进行透射电镜观察,图 8A结果显示可观察到大小均一、直径为20 nm左右的病毒样颗粒;图 8B动态光散射结果显示组装液中形成了直径为20 nm左右的颗粒,符合NDPV颗粒大小。以上结果表明重组VP2蛋白成功在体外自组装成VLPs。
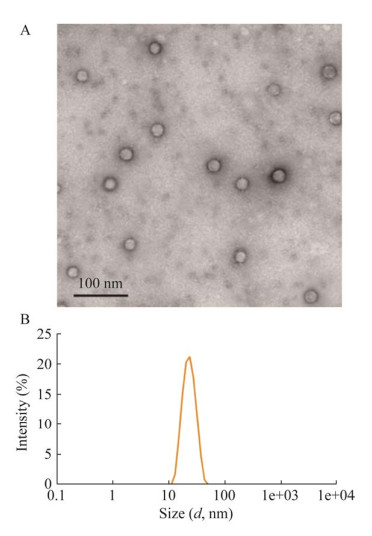
|
| 图 8 重组蛋白的透射电镜(A)与动态光散射(B) 鉴定 Figure 8 The identification of recombinant proteins by TEM (A) and DLC (B). |
|
|
1971‒1972年间法国首次报道了由NDPV引起骡鸭的短喙侏儒综合征(BADS)[12],随后在1989‒1990年间在中国台湾报道。1995年波兰出现相关病例报道,2009年在匈牙利暴发此病[13]。2015年,我国山东、江苏、河南、安徽和河北等省份的商品樱桃谷鸭突发慢性传染病疫情,一年后四川省报道了该病[14]。目前未见商品化疫苗,一些农户仍使用病原特征相似的小鹅瘟卵黄抗体以获得交叉保护作用,但研发出安全高效的以预防为主的疫苗是防控本病的重点[15]。
传统的灭活疫苗和弱毒疫苗虽然技术成熟,但存在一些局限性,而基于单一病毒蛋白的重组亚单位疫苗存在免疫原性较弱和高成本等缺点。相比之下,病毒样颗粒(VLPs)作为一种高效、安全的亚单位疫苗,能以更真实的构象呈现病毒抗原,具有良好的反应原性,较低剂量便能刺激机体产生体液和细胞免疫。
截至目前,研究者们已经通过不同的表达系统为30多种感染人类和其他动物的不同病毒生产了VLPs,其中较常见的大肠杆菌表达系统具有操作简单、生长速度快和相对较低的成本,已广泛用于实验室和工业规模的重组蛋白生产。但是大肠杆菌表达系统缺乏转录后剪切、翻译后修饰能力的缺点,意味着表达一些复杂蛋白质时表达产物常容易相互结合形成不溶性聚集体[16]。为了解决这些问题,通常采用优化表达条件、选择合适的宿主菌和共表达伴侣分子来解决。本研究选择pColdTF载体进行重组蛋白表达,该载体是一种冷休克载体,载体上带有cspA (冷休克蛋白A)启动子,可以在低温环境(15 ℃)下培养。本试验经过表达条件优化,成功表达了可溶性的TF-VP2重组蛋白,通过Thrombin酶切位点去除TF标签,再通过Ni-NTA树脂纯化得到不含标签的单一VP2蛋白。经Western blotting分析,纯化后的VP2蛋白能与NDPV鸭阳性血清特异性结合,表明NDPV VP2蛋白具有良好的反应原性。透射电镜和动态光散射结果显示,NGPV VP2蛋白在体外形成了与天然病毒颗粒形态相似、直径约为20−25 nm的VLPs。综上所述,本研究利用大肠杆菌表达系统成功制备了NDPV-VP2 VLPs,为后续研究NDPV相关疫苗奠定了基础。
| [1] |
SOLIMAN MA, ERFAN AM, SAMY M, MAHANA O, NASEF SA. Detection of novel goose parvovirus disease associated with short beak and dwarfism syndrome in commercial ducks[J]. Animals, 2020, 10(10): 1833. DOI:10.3390/ani10101833 |
| [2] |
CHEN H, DOU YG, TANG Y, ZHENG XQ, NIU XY, YANG J, YU XL, DIAO YX. Experimental reproduction of beak atrophy and dwarfism syndrome by infection in cherry valley ducklings with a novel goose parvovirus-related parvovirus[J]. Veterinary Microbiology, 2016, 183: 16-20. DOI:10.1016/j.vetmic.2015.11.034 |
| [3] |
HAO XP, WANG LY, LEI BS, ZHANG WC, MIAO TZ, PANG HZ, ZHAO K, YUAN WZ. Genomic analysis of different-passage strains of the novel goose parvovirus causing short beak and dwarfism syndrome in ducks[J]. Chinese Journal of Virology, 2022, 38(2): 394-401. (in Chinese) 郝雪飘, 王璐瑶, 雷白时, 张武超, 苗天姿, 庞洪泽, 赵款, 袁万哲. 致鸭短喙与侏儒综合征的新型鹅细小病毒不同传代毒株基因组分析[J]. 病毒学报, 2022, 38(2): 394-401. |
| [4] |
WANG LY, HAO XP, LEI BS, ZHAO K, ZHANG WC, YUAN WZ. Differential expression of transcriptome in liver, thymus and ileum of ducks infected with novel goose parvovirus[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(2): 654-657. (in Chinese) 王璐瑶, 郝雪飘, 雷白时, 赵款, 张武超, 袁万哲. 新型鹅细小病毒感染鸭的肝、胸腺、回肠转录组差异表达分析[J]. 畜牧兽医学报, 2022, 53(2): 654-657. |
| [5] |
CHEN YH, AFUMBA R, PANG FS, YUAN RX, DONG H. Advances in research on genetic relationships of waterfowl parvoviruses[J]. Journal of Veterinary Research, 2021, 65(4): 391-399. DOI:10.2478/jvetres-2021-0063 |
| [6] |
FAN WT, SUN ZY, SHEN TT, XU DN, HUANG KH, ZHOU JY, SONG SQ, YAN LP. Analysis of evolutionary processes of species jump in waterfowl parvovirus[J]. Frontiers in Microbiology, 2017, 8: 421. |
| [7] |
ZHANG JY, LIU P, WU YY, WANG MS, JIA RY, ZHU DK, LIU MF, YANG Q, WU Y, ZHAO XX, ZHANG SQ, LIU YY, ZHANG L, YU YL, YOU Y, CHEN S, CHENG AC. Growth characteristics of the novel goose parvovirus SD15 strain in vitro[J]. BMC Veterinary Research, 2019, 15(1): 1-8. DOI:10.1186/s12917-018-1758-8 |
| [8] |
WANG CY, SHIEH HK, SHIEN JH, KO CY, CHANG PC. Expression of capsid proteins and non-structural proteins of waterfowl parvoviruses in Escherichia coli and their use in serological assays[J]. Avian Pathology, 2005, 34(5): 376-382. DOI:10.1080/03079450500268591 |
| [9] |
BHAT T, CAO A, YIN J. Virus-like particles: measures and biological functions[J]. Viruses, 2022, 14(2): 383. DOI:10.3390/v14020383 |
| [10] |
NOORAEI S, BAHRULOLUM H, HOSEINI ZS, KATALANI C, HAJIZADE A, EASTON AJ, AHMADIAN G. Virus-like particles: preparation, immunogenicity and their roles as nanovaccines and drug nanocarriers[J]. Journal of Nanobiotechnology, 2021, 19(1): 59. DOI:10.1186/s12951-021-00806-7 |
| [11] |
ZHANG L, XU W, MA X, SUN XJ, FAN JB, WANG Y. Virus-like particles as antiviral vaccine: mechanism, design, and application[J]. Biotechnology and Bioprocess Engineering: BBE, 2023, 28(1): 1-16. |
| [12] |
PALYA V, ZOLNAI A, BENYEDA Z, KOVÁCS E, KARDI V, MATÓ T. Short beak and dwarfism syndrome of mule duck is caused by a distinct lineage of goose parvovirus[J]. Avian Pathology, 2009, 38(2): 175-180. DOI:10.1080/03079450902737839 |
| [13] |
COTMORE SF, AGBANDJE-MCKENNA M, CHIORINI JA, MUKHA DV, PINTEL DJ, QIU JM, SODERLUND-VENERMO M, TATTERSALL P, TIJSSEN P, GATHERER D, DAVISON AJ. The family Parvoviridae[J]. Archives of Virology, 2014, 159(5): 1239-1247. |
| [14] |
LIU HM, WANG H, TIAN XJ, ZHANG S, ZHOU XH, QI KZ, PAN L. Complete genome sequence of goose parvovirus Y strain isolated from Muscovy ducks in China[J]. Virus Genes, 2014, 48(1): 199-202. |
| [15] |
GONG XH. Biological characters of the novel duck parvovirus DS-15 strain and establishment of an indirect ELISA for the detection of antibodies[D]. Hefei: Master's Thesis of Anhui Agricultural University, 2017 (in Chinese). 宫晓华. 新型鸭细小病毒DS-15株生物学特性研究及间接ELISA方法的建立[D]. 合肥: 安徽农业大学硕士学位论文, 2017. |
| [16] |
CHOU YX, LEI Q. Virus-like particles and their applications in vaccine development[J]. Progress in Microbiology and Immunlogy, 2022(6): 1-8. (in Chinese) 仇宇星, 雷清. 病毒样颗粒的研究及其在疫苗中的应用[J]. 微生物学免疫学进展, 2022(6): 1-8. |
 2023, Vol. 50
2023, Vol. 50