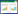扩展功能
文章信息
- 霞雨, 蒋文灿, 王亮, 程平
- XIA Yu, JIANG Wencan, WANG Liang, CHENG Ping
- pUC18-CpG重组质粒对鸭疫里默氏菌灭活疫苗的免疫增强效应
- Immune enhancement of Riemerella anatipestifer inactivated vaccine by the recombinant plasmid pUC18-CpG
- 微生物学通报, 2023, 50(10): 4557-4567
- Microbiology China, 2023, 50(10): 4557-4567
- DOI: 10.13344/j.microbiol.china.230105
-
文章历史
- 收稿日期: 2023-02-16
- 接受日期: 2023-04-02
- 网络首发日期: 2023-05-08
2. 动物疫病与人类健康四川省重点实验室, 四川 成都 611130
2. Key Laboratory of Animal Diseases and Human Health of Sichuan Province, Chengdu 611130, Sichuan, China
鸭疫里默氏菌(Riemerella anatipestifer, RA)是危害世界水禽业的重要致病菌之一[1]。感染RA后的鸭以败血症为特征,死亡率可高达75%,RA对多种抗生素耐药[2-5],通过疫苗预防RA感染是目前的重要手段。灭活疫苗主要是通过人工培养野毒菌株并灭活后加入适当佐剂制成,主要包括油乳剂灭活苗、氢氧化铝胶灭活苗和蜂胶灭活苗等。邓舜洲等[6]通过培养血清2型鸭疫里默氏菌研制氢氧化铝胶灭活苗,于5日龄进行免疫,免疫后5、10和15 d攻毒,保护率在50%−60%。杨灵芝等[7]以血清10型鸭疫里默氏菌为菌株制备油乳剂灭活疫苗免疫3日龄雏鸭,免疫后7 d攻毒,保护率为70%。马光强等[8]以血清2型鸭疫里默氏菌为菌株制备蜂胶灭活苗,二免后7 d攻毒,保护率为70%。
CpG基序(CpG motif)是指以非甲基化的CpG二核苷酸为核心,左右各有2个碱基构成的六核苷酸。未甲基化寡聚脱氧核苷酸(cytosine-phosphate-guanine oligodeoxynucleotide, CpG ODN)是体外人工合成的含有CpG基序的寡聚脱氧核苷酸链。CpG ODN的免疫增强作用能够用于防控多种动物疾病[9],但是在家禽疫病防控方面的报道较少。CpG ODN对禽类TLR-21识别并结合,提高促炎因子分泌和固有免疫细胞募集,从而激活固有免疫应答[10-11]。
为研究核酸佐剂CpG ODN增强鸭疫里默氏菌RA-GH5灭活疫苗的免疫原性,本研究通过筛选不同结构类型的CpG ODN,构建了重组质粒pUC18-CpG,在鸭体内评估其增强RA免疫原性,以期为RA佐剂研究提供科学参考数据。
1 材料与方法 1.1 菌株和血清大肠杆菌DH5α购自天根生化科技有限公司;鸭疫里默氏菌GH5 (RA-GH5,血清二型)、RA-GH5阳性血清为四川农业大学动物微生物与免疫研究室保存。
1.2 实验动物一日龄健康北京鸭购自成都克里莫育种有限公司。所有鸭子都被安置在四川农业大学的动物设施中。本研究由四川农业大学实验操作规程和动物福利委员会批准(批准文号为XF2014-18)。
1.3 主要试剂、仪器和培养基2×Taq PCR Master Mix、琼脂糖凝胶回收试剂盒、质粒小提试剂盒、细胞RNA提取试剂盒和增强型HRP-DAB底物显色试剂盒,北京天根生化科技有限公司;IPTG,Sigma公司;DNA分子量标准Marker、氨苄青霉素和BCA蛋白定量试剂盒,上海碧云天生物技术公司;琼脂、甘氨酸、Tris-HCl (pH 8.0)和鸭外周血单个核细胞(peripheral blood mononuclear cell, PBMC)分离试剂盒,北京索莱宝科技有限公司;IL-2和IL-4 ELISA试剂盒,江苏酶免实业有限公司。
常规离心机、CO2细胞培养箱、大容量冷冻离心机,赛默飞世尔科技公司;酶标仪,Bio-Rad公司。
胰蛋白胨肉汤培养基和LB肉汤培养基,生工生物工程(上海)股份有限公司。
1.4 序列的设计与合成由于目前对鸭敏感基序方面的报道较少,所以本研究主要参考了已经证实对鸭敏感的CpG ODN (B2006)为模板和阳性对照[12-13]设计了5条CpG ODN (表 1)。此外还设计了一条阴性对照序列GC。序列由生工生物工程(上海)股份有限公司合成。
| 名称 Name |
序列 Sequence (5′→3′) |
| GC | TGCTGCTTTTGTGCTTTTGTGCTT |
| 1 | TCGTCGAACGTTCGAGATGAT |
| 2 | TCGTCGTCGAACGTTCGAACGTT |
| 3 | TCGTCGGTCGTTTTGTCGTTGAT |
| 4 | TCGTCGTTGTCGTTTTGTCGTT |
| 5 | TCGTCGTTTTGTCGTTGGCGCGCGCCG |
| 6 (Control) | TCGTCGTTTTGTCGTTTTGTCGTT |
使用Oligo 6.0设计实时荧光定量PCR扩增引物(表 2),由生工生物工程(上海)股份有限公司合成。
| 引物名称 Primer name |
序列 Sequence (5′→3′) |
| IFN-α-F | CACGACATCCTTCAGCACCTCTT |
| IFN-α-R | GTTGAGGAGGCTTTGGCGTTGG |
| IL-2-F | GCCAAGAGCTGACCAACTTC |
| IL-2-R | ATCGCCCACACTAAGAGCAT |
| IL-6-F | TTCGACGAGGAGAAATGCTT |
| IL-6-R | CCTTATCGTCGTTGCCAGAT |
| IL-10-F | ACCTGCTGCTGAGCCTGAAG |
| IL-10-R | ATCGCCTTGTAGATGCCGTTCT |
| GAPDH-F | ATGTTCGTGATGGGTGTGAA |
| GAPDH-R | CTGTCTTCGTGTGTGGCTGT |
| TLR-21-F | CAACCTCAGCCTCCTCCACCTC |
| TLR-21 R | CCTTCAGCTTCTGGCACACCTTC |
根据鸭PBMC分离试剂盒说明书对北京鸭的抗凝全血进行分离获得鸭外周血单个核细胞(PBMC),用含10%胎牛血清的RPMI-1640细胞培养液将其重悬。试验组:RPMI-1640将各CpG ODN稀释成20 μg/mL,加100 μL淋巴细胞悬液;阳性对照组:刀豆蛋白A (ConA, 20 μg/mL),加100 μL淋巴细胞悬液;阴性对照组:RPMI-1640,加淋巴细胞悬液;空白对照组:RPMI-1640。试验组和对照组均于490 nm处读数。刺激指数(stimilation index, SI)CpG ODN=(ODCpG ODN‒OD空白对照)/ (OD阴性对照‒OD空白对照)[13]。
1.5.2 实时荧光定量PCR检测在不同CpG ODN刺激下IL-2、IL-6、IL-10及TLR-21的mRNA水平相对表达量。外周血淋巴细胞在CpG ODN刺激24 h后,根据细胞RNA提取试剂盒说明书提取RNA,再反转录成cDNA进行实时荧光定量PCR。反应体系(25 μL):TB Green Premix Ex Taq Ⅱ 12.5 μL,上、下游引物(10 μmol/L)各1.0 μL,cDNA溶液2.0 μL,灭菌水8.5 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环;熔化曲线65−95 ℃,增量0.5 ℃/5 s。每个基因做3个平行。采用2−ΔΔCq法计算相对表达量[14]。
1.6 CpG ODN重组质粒的构建与鉴定以1.5筛选出对鸭PBMC具有较好刺激性的CpG序列为核心,设计含5次重复的CpG序列,并在其两侧加入Hind Ⅲ和EcoR Ⅰ酶切位点,由有康有限生物公司合成并克隆入pUC18载体中,对获得的重组质粒进行酶切鉴定和测序鉴定。
1.7 pUC18-CpG定量与内毒素检测含pUC18-CpG质粒的E. coli DH5α在LB肉汤(含100 μg/mL Amp)中于37 ℃、160 r/min摇床中振荡培养过夜。3 000 r/min离心10 min收集菌体,使用无内毒素质粒大提试剂盒抽提质粒。将提取的pUC18-CpG质粒通过NanoDrop微量分光光度计进行定量。根据定量结果,使用鲎试剂测定pUC18-CpG质粒的内毒素。
1.8 pUC18-CpG与CpG ODN的免疫刺激作用比较 1.8.1 鸭PBMC增殖能力检测参照1.5.1,检测CpG ODN以及pUC18-CpG重组质粒刺激鸭外周血淋巴细胞后细胞增殖情况,计算两者的刺激指数,对其免疫刺激效果进行比较分析。
1.8.2 细胞因子的相对表达量参照1.5.2,通过实时荧光定量PCR检测CpG ODN以及pUC18-CpG重组质粒刺激鸭外周血淋巴细胞后各细胞因子在mRNA水平上的相对表达量。
1.9 动物免疫保护试验 1.9.1 动物免疫试验将1日龄北京鸭饲养至4日龄,并随机分为6组,每组各10只。于4日龄首次免疫,疫苗组分别注射0.5 mL疫苗。在14日龄,用相同剂量的疫苗加强免疫。对照组和空白组同时注射无菌PBS 0.5 mL。在第1、14、21和28天收集血清。详细试验设计见表 3。
| 组别 Names |
抗原 Antigens |
免疫佐剂添加量 Dose of adjuvants |
免疫剂量 Immunizing dose (mL) |
动物数量 Animal numbers |
| A | RA-GH5 | 4.5 mL inactivated vaccine and 0.5 mL pUC18-CpG (0.4 mg/mL) mixed emulsification | 0.5 | 10 |
| B | RA-GH5 | 4.5 mL inactivated vaccine and 0.5 mL pUC18-CpG (0.8 mg/mL) mixed emulsification | 0.5 | 10 |
| C | RA-GH5 | 4.5 mL inactivated vaccine and 0.5 mL pUC18-CpG (1.2 mg/mL) mixed emulsification | 0.5 | 10 |
| D | RA-GH5 | 4.5 mL inactivated vaccine and PBS mixed emulsification | 0.5 | 10 |
| Control | PBS | None | 0.5 | 10 |
| Blank | PBS | None | 0.5 | 10 |
间接ELISA检测血清抗体水平。RA抗原以8 μg/mL于4 ℃包被过夜。依次经5%脱脂奶粉封闭,待检测血清和HRP山羊抗鸭IgG按体积比1:3 000作用后,避光加入50 μL TMB底物溶液,15 min后加入2 mol/L H2SO4终止反应,酶标仪检测OD450。检测雏鸭免疫前(0 d)血清RA抗体,呈阴性,将其作为阴性血清。当待测血清OD450 (P)与阴性血清OD450 (N)比值(P/N)≥2.1,判定为阳性[15]。
1.9.3 细胞因子检测按照ELISA试剂盒说明书检测血清IL-2和IL-4水平。根据标准曲线计算各组鸭血清中的IL-2和IL-4含量[16]。
1.9.4 攻毒试验加强免疫两周后,对免疫组和对照组的雏鸭进行10 LD50 (1×107 CFU)肌肉注射攻毒,空白组肌肉注射等剂量的PBS。观察并记录7 d内雏鸭的临床症状和死亡情况。
1.9.5 组织病理学检查各试验组鸭的心、肝脏、脑组织样品用4%多聚甲醛(pH 7.4)固定,通过石蜡包埋制成病理切片,再利用苏木精-伊红(hematoxylin-eosin, HE)染色,使用数字扫描仪分析组织病理变化[17]。
1.10 统计学分析使用SPSS27.0进行统计学分析,利用独立样本t检验(student’s two-tailed unpaired t test)和单因素方差分析(one-way ANOVA)分别比较两组及多组之间的统计学差异,P<0.05具有统计学意义。
2 结果与分析 2.1 不同序列CpG ODN刺激鸭PBMC增殖能力检测结果如图 1所示,与对照组GC相比,CpG-3 (SI=2.80)和CpG-6 (SI=2.58)免疫刺激活性显著性增强(P<0.01)。

|
| 图 1 淋巴细胞增殖试验测定各CpG ODN刺激指数 Figure 1 The stimulation index of CpG ODN measured by lymphocyte proliferation experiment. *: P < 0.05; **: P < 0.01. |
|
|
IL-2、IL-6、IL-10、IFN-α和TLR-21的mRNA表达水平在CpG-3序列刺激下作用最高,且与GC组差异显著(图 2)。

|
| 图 2 CpG ODN作用下各基因的相对表达量 Figure 2 The relative expression of genes stimulated by CpG ODN. **: P < 0.01; ***: P < 0.001. |
|
|
以筛选出对鸭PBMC具有良好刺激性的CpG序列为核心,经5次重复,在两端加入Hind Ⅲ和EcoR Ⅰ酶切位点,合成并构建获得重组质粒pUC18-CpG。对重组质粒进行酶切鉴定,结果获得约100 bp的目的片段,符合预期大小,进一步测序鉴定证明构建成功(图 3)。

|
| 图 3 酶切鉴定 Figure 3 Enzyme digestion identification. M:DNA分子量标准Marker (100−5 000 bp);1:pUC18-CpG;2:pUC18-CpG EcoR Ⅰ单酶切;3:pUC18-CpG EcoR Ⅰ和Hind Ⅲ双酶切 M: DNA marker (100−5 000 bp); 1: pUC18-CpG; 2: pUC18-CpG identification with EcoR Ⅰ; 3: pUC18-CpG identification with EcoR Ⅰ and Hind Ⅲ. |
|
|
pUC18-CpG质粒经NanoDrop微量分光光度计定量为1.77 mg/mL。经检测内毒素含量低于50 EU/mg,符合标准。
2.5 pUC18-CpG质粒和CpG-3的淋巴刺激指数如图 4所示,将pUC18-CpG质粒和CpG-3分别刺激鸭外周血淋巴细胞,结果显示SIpUC18-CpG=2.79,SICpG-3=2.88,但差异不显著。

|
| 图 4 淋巴细胞增殖试验测定的各CpG ODN刺激指数 Figure 4 The stimulation index of CpG ODN measured by lymphocyte proliferation experiment. ns: P > 0.05. |
|
|
如图 5所示,与对照组相比,pUC18-CpG和CpG-3的相对表达量有显著差异(P<0.001),但是pUC18-CpG和CpG-3两者之间差异不显著。
|
| 图 5 CPG ODN作用下各基因的相对表达量 Figure 5 The relative expression of genes stimulated by CpG ODN. *: P < 0.05; **: P < 0.01; ***: P < 0.001; ****: P < 0.000 1. |
|
|
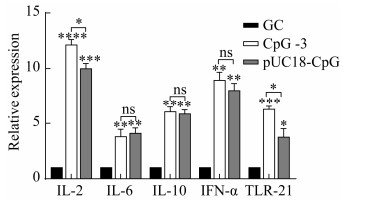
如图 6所示,在整个试验期内,对照组鸭血清始终未检测到抗体。在第21天和第28天,与A、B和D组相比,C组血清中IgG滴度更高且差异性显著(P<0.05)。在第28天,A、B、C和D组平均抗体滴度分别是9.98、11.31、12.98和9.64。

|
| 图 6 免疫鸭组鸭抗体滴度(抗体滴度表示最高稀释比log2值) Figure 6 Duck antibody titer of immunized groups. *: P < 0.05; **: P < 0.01. |
|
|
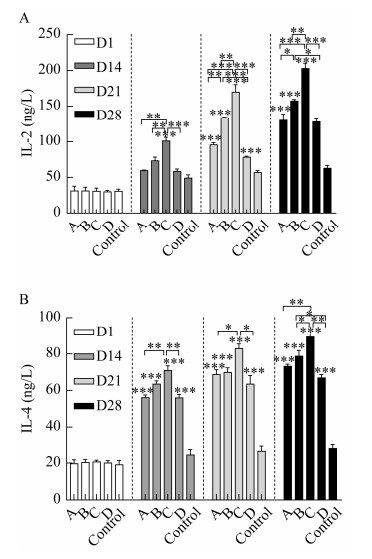
如图 7所示,与对照组相比,所有疫苗组血清中细胞因子IL-2和IL-4水平显著升高,并且C组免疫产生的IL-2和IL-4显著高于A、B和D组。
|
| 图 7 细胞因子水平 Figure 7 Detection of the cytokine level in the serum of ducks. A: IL-2. B: IL-4. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
|
|
如图 8所示,C组的存活率为70%,A、B和D组的存活率分别为60%、60%和50%。对照组鸭均表现食欲减退、无法站立、共济失调等病症,最后全部死亡。在7 d的观察期内空白组未发现临床症状,存活率100%。

|
| 图 8 RA-GH5攻击各组鸭的存活率 Figure 8 The survival rate of ducks challenged with RA-GH5. |
|
|
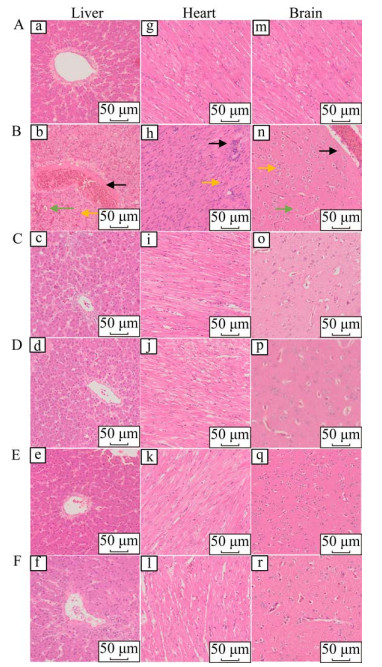
如图 9所示,对照组经RA-GH5感染后出现明显的病理变化。肝细胞出现广泛性变性,肝索结构不清晰,肝细胞细胞核溶解裂解、坏死、皱缩,血管和窦状隙内充满红细胞。脑部嗜酸性粒细胞增多,血管扩张充满红细胞,神经细胞肿大变性。部分心肌细胞坏死,部分大量中性粒细胞浸润。疫苗免疫组鸭感染后虽然出现病理变化,但较对照组损伤明显变轻。
|
| 图 9 组织病理学分析 Figure 9 Histopathologic analysis of ducks. A:空白组. B:对照组. C:RA-GH5+20 μg pUC18-CpG组. D:RA-GH5+ 40 μg pUC18-CpG组. E:RA-GH5+80 μg pUC18-CpG组. F:RA-GH5组. b:细胞核溶解(黄色箭头),肝窦状隙充满红细胞(绿色箭头),血管扩张充血(黑色箭头);h:淋巴细胞浸润(黑色箭头),心肌纤维溶解(黄色箭头);n:血管扩张充血(黑色箭头),嗜碱性粒细胞增多(黄色箭头),神经细胞变性(绿色箭头) A: The blank group. B: The control group. C: The RA-GH5+ 20 μg pUC18-CpG group. D: The RA-GH5+40 μg pUC18-CpG group. E: The RA-GH5+80 μg pUC18-CpG group. F: The RA-GH5 group. b: Nuclear lysis (yellow arrow), sinusoid space is filled with red blood cells (green arrow), vasodilation and hyperemia (black arrow); h: Lymphocytic infiltration (black arrow), myocardial fibrinolysis (yellow arrow); n: Vasodilation and hyperemia (black arrow), strongly basophilic chief cells (black arrow), enlargement of nerve cells (green arrow). |
|
|
鸭传染性浆膜炎对我国禽类养殖业造成了巨大的经济损失[18]。CpG ODN能够增强多种疫苗的免疫原性已被证实,其作用机理主要为与细胞中TLR-21结合刺激机体固有免疫应答,从而增强疫苗的保护效果[11]。CpG ODN的免疫刺激活性具有种属特异性,影响其免疫刺激活性的关键结构是CpG基序和结构类型[19]。由于目前对鸭敏感基序方面的报道较少,本研究主要参考了已经证实对鸭敏感的CpG ODN (B2006)设计了5条序列。经鸭外周血淋巴细胞增殖试验首先筛选出具有较好刺激性的CpG-2、CpG-3和CpG-6,再通过实时荧光定量PCR最终筛选出免疫刺激活性最佳的CpG-3。CpG-3的基序为GTCGTT,和已报到有免疫作用的基序相同[20]。可以通过改变CpG ODN的分子结构形成有序结构相互作用来提高CpG ODN的免疫原性。未来能以此为参考设计更强的鸭特异性CpG ODN。
CpG ODN生产条件苛刻,需要高精度的DNA合成仪和纯度高的核苷酸,合成成本高,难以在实际生产中应用,只能用于研究。有研究证明在pUC-18载体中插入CpG基序仍具有免疫刺激活性[21]。鉴于此,本研究选择pUC-18质粒作为载体,将筛选对鸭具有较高免疫刺激活性的CpG-3序列与载体连接,构建了pUC18-CpG重组质粒。pUC18-CpG重组质粒的作用形式不同于CpG ODN,以质粒的形式通过细胞吞噬进入胞内,然后与内质网上的TLR-21结合,刺激机体的固有免疫应答[11],所以在研究时需要考虑这些因素,为证明pUC18-CpG重组质粒也具有较强的免疫原性,通过检测pUC18-CpG重组质粒和CpG-3对鸭外周血淋巴细胞的刺激指数,以及Th1型、Th2型细胞因子和TLR-21的相对表达量。张进进等[21]报道,CpG ODN重组质粒对猪外周血淋巴细胞具有较好的刺激活性。本研究也观察到了类似现象,pUC18-CpG重组质粒和CpG-3对鸭外周血淋巴细胞都有显著性刺激作用,并且两者之间无差异。同时对细胞因子IL-2、IL-6、IL-10、IFN-α和TLR-21的相对表达量也有显著的提高作用。但pUC18-CpG重组质粒免疫原性略低于CpG-3,可能原因是两者进入胞内与TLR-21的结合通路有区别,或者两者在体内的降解方式不同,还需要进一步的研究去证实。
以pUC18-CpG重组质粒作为佐剂,与RA-GH5灭活疫苗联用免疫北京鸭进行动物体内免疫试验。本研究结果显示,与单独使用RA-GH5灭活疫苗相比,pUC18-CpG佐剂能够有效提升RA-GH5灭活疫苗诱导产生的血清抗体水平以及IL-2、IL-4水平,提示其对于RA-GH5灭活疫苗产生的体液免疫及细胞免疫具有不同程度的促进作用。之前有研究显示,CpG ODN和Al(OH)3联合佐剂与猪轮状病毒亚蛋白初免后,能够有效提高体液免疫应答和细胞免疫应答[22]。本研究中pUC18-CpG同样也能促进体液以及细胞免疫应答,我们的结果与之相符。王长丽等[23]报道,CpG ODN可显著增强血清中IL-2和IL-4的水平。在本研究中也观察到了类似现象,3种不同浓度的CpG ODN免疫鸭的IL-2和IL-4水平均显著增加,但相较于A组或B组免疫而言,C组可诱导更高的IL-2和IL-4水平。
体内免疫保护结果显示,单独使用RA-GH5灭活疫苗的存活率为50%,添加pUC18-CpG佐剂的A、B和C组分别为60%、60%和70%的存活率。任肖[24]报道免疫全剂量和1/2剂量pUC18-CpG疫苗可为鸭坦布苏病毒提供100%的保护,表明pUC18-CpG佐剂可以提高疫苗保护率。本研究中疫苗组的存活率最高仅为70%。经分析,在本研究中存活率的原因可能有:(1) 甲醛浓度。在对鸭疫里默氏菌灭活时,本文选择甲醛浓度为0.03%,甲醛浓度低,固化能力弱,导致部分菌体蛋白损失使疫苗免疫原性降低。吕文君[25]报道甲醛浓度可能会影响鸭疫里默氏菌的免疫原性,当甲醛浓度低于0.1%时其保护效力会降低。(2) 攻毒菌株毒力和攻毒剂量存在差异。本文攻毒菌株RA-GH5的LD50为1.0×106 CFU,攻毒剂量为10 LD50 (1.0×107 CFU/只),保护率为50%。嵇辛勤等[26]研究的攻毒菌株LD50为5.893×107 CFU,攻毒剂量低于2LD50 (1.10×108 CFU/只),保护率为87.5%。本文和嵇辛勤等的研究都使用血清2型鸭疫里默氏菌攻毒,而本文攻毒菌株LD50更低、攻毒剂量更大,可能导致疫苗保护率下降。(3) 疫苗抗原含量。本文雏鸭接种的灭活疫苗抗原含量为1.0×109 CFU/mL,马光强等[8]研究的灭活疫苗抗原含量为3.8×109 CFU/mL,保护率为70%。疫苗抗原含量较低可能是本文保护率不高的原因之一。(4) 重组质粒被降解。本文使用生理盐水溶解重组质粒pUC18-CpG注入体内,并未对质粒进行保护,重组质粒进入体内容易被各种酶降解,影响其免疫活性。(5) pUC18-CpG佐剂剂量。本文pUC18-CpG最高免疫剂量为80 μg。Chu等[27]应用rOmpA+100 μg CpG ODN免疫雏鸭,与对照组相比,雏鸭病理损伤减轻了90%,推测添加更高剂量pUC18-CpG可能会有更好的免疫效果。因此pUC18-CpG佐剂的最佳剂量还需要进一步研究。
通过探究pUC18-CpG佐剂对RA-GH5灭活疫苗免疫效果以及抗感染保护作用的影响,发现不同浓度的pUC18-CpG均能有效增强RA-GH5灭活疫苗产生的体液与细胞免疫应答,高浓度的pUC18-CpG具有更高的免疫原性且具有显著性差异。
4 结论pUC18-CpG佐剂与RA-GH5灭活疫苗联用能够引起更强的体液免疫和细胞免疫应答。pUC18-CpG可用于增强疫苗的免疫原性,为RA疫苗研究提供了新的视角。
| [1] |
FULTON RM, RIMLER RB. Epidemiologic investigation of Riemerella anatipestifer in a commercial duck company by serotyping and DNA fingerprinting[J]. Avian Diseases, 2010, 54(2): 969-972. DOI:10.1637/9087-092409-Case.1 |
| [2] |
GUO YP, CHENG DW, FAN GX, LIU RP. Investigation and study on infectious serositis of Beijing ducklings[J]. Acta Veterinaria et Zootechnica Sinica, 1982, 13(2): 35-41. (in Chinese) 郭玉璞, 陈德威, 范国雄, 刘瑞萍. 北京鸭小鸭传染性浆膜炎的调查研究[J]. 畜牧兽医学报, 1982, 13(2): 35-41. |
| [3] |
LEAVITT S, AYROUD M. Riemerella anatipestifer infection of domestic ducklings[J]. The Canadian Veterinary Journal = La Revue Veterinaire Canadienne, 1997, 38(2): 113. |
| [4] |
CHEN YP, TSAO MY, LEE SH, CHOU CH, TSAI HJ. Prevalence and molecular characterization of chloramphenicol resistance in Riemerella anatipestifer isolated from ducks and geese in Taiwan[J]. Avian Pathology, 2010, 39(5): 333-338. DOI:10.1080/03079457.2010.507761 |
| [5] |
ZHU DK, ZHENG MY, XU JG, WANG MS, JIA RY, CHEN S, LIU MF, ZHAO XX, YANG Q, WU Y, ZHANG SQ, HUANG J, LIU YY, ZHANG L, YU YL, PAN LC, CHEN XY, CHENG AC. Prevalence of fluoroquinolone resistance and mutations in the gyrA, parC and parE genes of Riemerella anatipestifer isolated from ducks in China[J]. BMC Microbiology, 2019, 19(1): 271. DOI:10.1186/s12866-019-1659-4 |
| [6] |
DENG SZ, HE HJ, WEN QQ, DAI ZZ, ZHANG WB. Development of an inactivated vaccine against Riemannia anatipestifer (type 2)[J]. Acta Agriculturae Universitis Jiangxiensis, 2002, 24(5): 569-573. (in Chinese) 邓舜洲, 何后军, 温庆琪, 戴朝洲, 张文波. 鸭疫里氏杆菌(2型)灭活疫苗的研制[J]. 江西农业大学学报(自然科学), 2002, 24(5): 569-573. |
| [7] |
YANG LZ, JIANG SJ, MA JX, LI BK. Development of an inactivated vaccine against Riemerella anatipestifer (type 10)[J]. Shanghai Animal Husbandry and Veterinary Communication, 2011(4): 2-5. (in Chinese) 杨灵芝, 姜世金, 马景霞, 李本科. 鸭疫里默氏杆菌(10型)灭活疫苗的研制[J]. 上海畜牧兽医通讯, 2011(4): 2-5. |
| [8] |
MA GQ, LIU LJ, CHEN GQ, WU LT, YANG J, LIU JZ, LI XM, PAN CW, ZHOU BJ. Preparation of propolis inactivated vaccine against Riemerella anatipestifer Guizhou epidemic strain[J]. China Animal Husbandry and Veterinary Medicine, 2022, 49(8): 3163-3170. (in Chinese) 马光强, 刘丽娟, 陈国权, 吴良涛, 杨均, 刘军泽, 李潇蒙, 潘成文, 周碧君. 鸭疫里默氏杆菌贵州流行株蜂胶灭活疫苗制备[J]. 中国畜牧兽医, 2022, 49(8): 3163-3170. |
| [9] |
MA C, SPIES NP, GONG T, JONES CX, CHU WM. Involvement of DNA-PKcs in the type Ⅰ IFN response to CpG-ODNs in conventional dendritic cells in TLR9-dependent or-independent manners[J]. PLoS One, 2015, 10(3): e0121371. DOI:10.1371/journal.pone.0121371 |
| [10] |
LAI CY, YU GY, LUO YP, XIANG R, CHUANG TH. Immunostimulatory activities of CpG-oligodeoxynucleotides in teleosts: toll-like receptors 9 and 21[J]. Frontiers in Immunology, 2019, 10: 179. |
| [11] |
CHRZĄSTEK K, BOROWSKA D, KAISER P, VERVELDE L. Class B CpG ODN stimulation upregulates expression of TLR21 and IFN-γ in chicken Harderian gland cells[J]. Veterinary Immunology and Immunopathology, 2014, 160(3/4): 293-299. |
| [12] |
QI YL, YAN B, CHEN S, CHEN HJ, WANG MS, JIA RY, ZHU DK, LIU MF, LIU F, YANG Q, SUN KF, WU Y, CHEN XY, JING B, CHENG AC. CpG oligodeoxynucleotide-specific goose TLR21 initiates an anti-viral immune response against NGVEV but not AIV strain H9N2 infection[J]. Immunobiology, 2016, 221(3): 454-461. |
| [13] |
BOEGLIN E, SMULSKI CR, BRUN S, MILOSEVIC S, SCHNEIDER P, FOURNEL S. Toll-like receptor agonists synergize with CD40L to induce either proliferation or plasma cell differentiation of mouse B cells[J]. PLoS One, 2011, 6(10): e25542. |
| [14] |
DOORN R, SZEMES M, BONANTS P, KOWALCHUK G, SALLES J, ORTENBERG E, SCHOEN C. Quantitative multiplex detection of plant pathogens using a novel ligation probe-based system coupled with universal, high-throughput real-time PCR on OpenArraysTM[J]. BMC Genomics, 2007, 8(1): 276. |
| [15] |
LU FY, MIAO S, TU J, NI XT, XING LL, YU H, PAN L, HU QH. The role of TonB-dependent receptor TbdR1 in Riemerella anatipestifer in iron acquisition and virulence[J]. Veterinary Microbiology, 2013, 167(3/4): 713-718. |
| [16] |
ZHAO XX, LIU Q, ZHANG J, LUO YL, LUO Y, LIU Q, LI P, KONG QK. Identification of a gene in Riemerella anatipestifer CH-1 (B739-2187) that contributes to resistance to polymyxin B and evaluation of its mutant as a live attenuated vaccine[J]. Microbial Pathogenesis, 2016, 91: 99-106. |
| [17] |
KANG M, SEO HS, SOH SH, JANG HK. Immunogenicity and safety of a live Riemerella anatipestifer vaccine and the contribution of IgA to protective efficacy in Pekin ducks[J]. Veterinary Microbiology, 2018, 222: 132-138. |
| [18] |
PATHANASOPHON P, PHUEKTES P, TANTICHAROENYOS T, NARONGSAK W, SAWADA T. A potential new serotype of Riemerella anatipestifer isolated from ducks in Thailand[J]. Avian Pathology: Journal of the W. V. P. A, 2002, 31(3): 267-270. |
| [19] |
CHENG Q. Study on the immune enhancement effect of recombinant plasmid containing CpG motif on pigs[D]. Guangzhou: Master's Thesis of South China Agricultural University, 2011 (in Chinese). 程庆. 含CpG基序重组质粒对猪免疫增强作用的研究[D]. 广州: 华南农业大学硕士学位论文, 2011. |
| [20] |
LEE JW, LIN YM, YEN TY, YANG WJ, CHU CY. CpG oligodeoxynucleotides containing GACGTT motifs enhance the immune responses elicited by a goose parvovirus vaccine in ducks[J]. Vaccine, 2010, 28(50): 7956-7962. |
| [21] |
ZHANG JJ, XIAN T, XIA H, SHENG CY, MA BY, MA QX, LIU YX, GAO SS, DU R, LENG X, ZHOU Y. Study on immune stimulation of CpG ODN recombinant plasmid on peripheral blood lymphocytes in pigs[J]. Chinese Journal of Veterinary Drug, 2020, 54(2): 59-64. (in Chinese) 张进进, 伭婷, 夏辉, 盛陈艳, 麻宝艺, 马青霞, 刘雅馨, 高沙沙, 杜锐, 冷雪, 周宇. CpG ODN重组质粒对猪外周血淋巴细胞免疫刺激作用的研究[J]. 中国兽药杂志, 2020, 54(2): 59-64. |
| [22] |
RAN XH, WEI XM, WEN XB, CAO S, ZHANG Y, CUI YD. Influence of CpG ODN, aluminum hydroxide and avirulent E. coli heat-labile enterotoxin mutant combined adjuvant on immune effect of porcine rotavirus △VP8* subunit vaccine[J]. Chinese Journal of Biologicals, 2015, 28(8): 780-785, 790. (in Chinese) 冉旭华, 魏晓曼, 闻晓波, 曹思, 张峣, 崔玉东. CpG ODN、氢氧化铝和大肠埃希菌不耐热肠毒素无毒突变体联合佐剂对猪轮状病毒△VP8*亚蛋白免疫效果的影响[J]. 中国生物制品学杂志, 2015, 28(8): 780-785, 790. |
| [23] |
WANG CL, HUANG ZX, WANG SQ, LYU J, BIN XY, YANG RR, TANG HY. Immune enhancement of CpG ODN B on recombinant baculovirus vaccine against Newcastle disease in chickens[J]. Letters in Biotechnology, 2020, 31(4): 409-415. (in Chinese) 王长丽, 黄祯雄, 王胜秋, 吕进, 宾晓芸, 杨睿睿, 唐华英. CpG ODN B对鸡新城疫重组杆状病毒疫苗的免疫增强效应[J]. 生物技术通讯, 2020, 31(4): 409-415. |
| [24] |
REN X. Study on CpG adjuvant to enhance the immune effect of inactivated duck tamsulu virus disease vaccine[D]. Beijing: Master's Thesis of Chinese Academy of Agricultural Sciences, 2020 (in Chinese). 任肖. CpG佐剂增强鸭坦布苏病毒病灭活疫苗免疫效果研究[D]. 北京: 中国农业科学院硕士学位论文, 2020. |
| [25] |
LÜ WJ. Effects of different inactivation methods on immunogenicity of Riemerella anatipestifer[D]. Chongqing: Master's Thesis of Southwest University, 2020 (in Chinese). 吕文君. 不同灭活方法对鸭疫里默氏杆菌免疫原性的影响[D]. 重庆: 西南大学硕士学位论文, 2020. |
| [26] |
JI XQ, FU XL, RUAN Y, DUAN ZQ, ZHANG RJ, ZHU X, CHEN JQ, LEI Y, HU Y. Preparation and immunological study of inactivated vaccine of Riemerella anatipestifer serotype 2 in Guizhou Province[J]. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(2): 151-154. (in Chinese) 嵇辛勤, 傅心亮, 阮涌, 段志强, 张人俊, 主性, 陈佳琪, 雷云, 胡炎. 贵州省鸭疫里默氏杆菌血清2型灭活疫苗制备及免疫研究[J]. 中国预防兽医学报, 2016, 38(2): 151-154. |
| [27] |
CHU CY, LIU CH, LIOU JJ, CHENG LT. Development of a subunit vaccine containing recombinant Riemerella anatipestifer outer membrane protein A and CpG ODN adjuvant[J]. Vaccine, 2015, 33(1): 92-99. |
 2023, Vol. 50
2023, Vol. 50