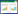扩展功能
文章信息
- 姚婷, 刘扬, 梁允刚, 许芳芳, 唐凯, 冯福应
- YAO Ting, LIU Yang, LIANG Yungang, XU Fangfang, TANG Kai, FENG Fuying
- 盐碱胁迫对小麦幼苗生长和根际细菌群落结构的影响
- Saline-alkaline stress affects wheat seedling growth and rhizobacterial community structure
- 微生物学通报, 2023, 50(10): 4472-4484
- Microbiology China, 2023, 50(10): 4472-4484
- DOI: 10.13344/j.microbiol.china.230133
-
文章历史
- 收稿日期: 2023-02-21
- 接受日期: 2023-04-12
- 网络首发日期: 2023-05-26
土壤盐碱化严重破坏土壤结构、降低生物可利用有效营养水平等导致土地退化,从而造成对植物的离子毒害严重,显著阻碍植物生长,降低作物生产力,威胁粮食安全,是全球特别是干旱和半干旱地区最严重的环境问题之一[1-3]。目前全球约大于1×109 hm2土地受盐的影响,其中约60%被归类为具有高pH值土壤区,以碳酸氢钠和碳酸钠为主[4]。高盐碱不利于植物种子的萌发和幼苗的生长,以及营养元素的吸收和利用,破坏植物根部细胞结构与功能,从而导致农作物的产量和质量降低[5-7]。中性盐(主要是NaCl和Na2SO4)可引起盐胁迫,而碱性盐(主要是NaHCO3和Na2CO3)除可引起盐胁迫外,还会导致pH值升高从而引起碱胁迫[8]。中性盐胁迫会导致植物体缺水、离子毒害、营养吸收和运输降低,以及毒害细胞的活性氧(reactive oxygen species, ROS)积累[9];而碱性盐胁迫除具有中性盐胁迫危害外,还会因高pH值进一步加剧土壤养分失衡和植物光合系统损伤[3]。盐碱胁迫比盐胁迫对植物生长的伤害更严重,在相同的钠离子浓度下,高pH值严重抑制了植物对大多数离子的吸收,对植物生长的抑制更为严重[10]。在盐碱胁迫下,植物会合成小分子物质(主要有脯氨酸、糖和蛋白质等)维持渗透平衡,提高一些抗氧化酶(主要有过氧化氢酶等)活性来淬灭ROS,从而保护核酸和膜脂等重要生物大分子[11]。但在盐碱等非生物胁迫下,植物通过召集根际特定微生物、强化与微生物的互作而增强对逆境的抵抗[12]。已有许多研究表明,接种植物根际促生微生物(plant growth-promoting rhizobacteria, PGPR)可减轻盐胁迫,促进植物生长和提高作物生产力[13]。解析根际微生物群落结构变化,可为寻找有效减轻盐碱胁迫PGPR提供理论依据和实践指导[12, 14-15]。盐碱常常伴生(同时存在中性盐和碱性盐而形成盐碱胁迫),但现有模拟盐碱胁迫相关研究中,多数是采用中性盐,利用碱性盐进行盐碱胁迫模拟的研究很少[16]。
小麦是最重要的粮食作物之一,增加其产量对于稳定全球粮食安全极为关键[17]。世界上三分之一的人以小麦为主食[18-20],中国是世界上最大的小麦生产国,占全球总产约18%[21]。然而,土壤盐碱化致使小麦产量损失高达60%,严重阻碍了小麦生产[22]。盐胁迫会显著影响包括小麦等根际微生物的群落结构和功能,基于微生物群落结构变化选择耐盐PGPR可有效减轻盐胁迫,促进植物生长和提高作物产量[12-14, 23-24]。内蒙古河套地区是我国优质高筋小麦的重要生产基地,但当地小麦生长受盐碱胁迫严重[25]。本实验室前期的工作表明,对该地区小麦主要种植品种永良4号接种PGPR显著减轻了盐胁迫,促进了幼苗生长[26-27]。然而,目前尚缺乏因中性盐和碱性盐而导致的盐碱胁迫下小麦根际微生物群落结构特征和变化的相关研究,以致对盐碱胁迫下根际微生物-小麦互作的认识还不足,也限制了利用根际微生物提升盐碱地小麦产能的实践和应用。
本研究以中性盐NaCl和碱性盐Na2CO3模拟盐碱胁迫,观测盐碱胁迫对小麦幼苗生长的影响,对细菌16S rRNA基因进行高通量扩增子测序,以解析根际细菌群落结构,揭示可能减轻小麦幼苗盐碱胁迫的细菌类群,为利用微生物促进盐碱土壤农业可持续发展提供基础数据以及理论和实践支持。
1 材料与方法 1.1 材料供试小麦品种为市售永良4号,该品种广泛种植于内蒙古自治区河套地区,具有一定的耐盐碱性;浇灌添加了100 mmol/L NaCl、pH值约为7.0的Hoagland营养液即可显著抑制在河套地区广泛种植的永良4号小麦生长[3]。
土壤酶活试剂盒和PowerSoil DNA Isolation Kit,苏州格瑞思生物科技有限公司。PCR仪,Biometra公司;全自动高温高压灭菌锅,Tomy Kogyo公司;恒温光照培养箱,上海精宏实验设备有限公司;pH计,Hanna公司;酶标仪,伯腾仪器有限公司;生物安全柜,苏州安泰空气技术有限公司。
1.2 盐碱胁迫处理和小麦种植设置盆栽浇灌Hoagland营养液的4个处理,添加NaCl和Na2CO3调节Hoagland营养液Na+浓度和pH:不添加、pH 7.0的无胁迫对照,编号S0P7;其余3个处理pH值分别为7.0、8.0和9.0,Na+浓度均为100 mmol/L,它们的编号分别为S1P7、S1P8和S1P9;每个处理盆栽20盆,随机排列。
小麦盆栽种植:挑取饱满、大小基本一致的健康小麦种子,置于4 ℃春化10 d;播种所用土按照甜土: 石英砂=3:1 (体积比),再加微量(“甜土”重量的千分之一)盐碱地“种源土”(“甜土”采集自呼和浩特市近郊的无盐碱胁迫农田表层20 cm土壤,pH值约7.1、含盐量约0.08%、有机质含量约4.51 g/kg;“种源土”采集自位于河套灌区五原县小麦种植盐碱地表层20 cm土壤,pH值约8.9、含盐量约0.42%、有机质含量约5.33 g/kg),混合均匀后装入16 cm×14 cm的黑色塑料花盆,装土高度距离花盆上沿5 cm;在花盆已装土壤表面均匀播撒已春化的小麦种子40粒/盆,之后以相同的混合土进行覆盖,厚度约1 cm;最后置于室内培养架,于室温25−30 ℃、光照强度4 500 lx,光暗周期为14 h/10 h条件下进行培养;播种完成后置于培养架,立即分别浇灌4种处理的Hoagland营养液250 mL/盆,从花盆底部渗出液至少50 mL,保证土壤离子达到平衡。隔夜清洗托盘,弃除清洗液。此后,以相同的方式每隔一周浇灌一次Hoagland营养液,共浇3次(包含第1次),最后一次的一周之后采集样品。每种处理分别各种植20盆,随机排列并定时轮换摆放位置。来自小麦种植区的盐碱地“种源土”可为盐碱胁迫下小麦和微生物互作提供所需适应盐碱胁迫并与小麦可形成良好互作的微生物[3]。
1.3 小麦生长指标测定小麦出苗生长30 d后,观察和测定小麦幼苗形态、株高、根长、叶绿素、地上部和地下部干重等生物量指标:选择各处理的每个重复中地上部长势各自较均匀一致的植株,将整株小麦挖出,轻缓用水冲洗干净,滤纸吸干,平置于试验台上,用刻度尺测量株高和根长;冲洗干净其根系部位,滤纸吸干其水分,用剪刀将植株的地上与地下部切开,分别放入65 ℃恒温烘箱干燥5 d,用天平称量植株地上部和地下部干重。叶绿素含量测定采用乙醇丙酮溶剂萃取法[28]:选取每株小麦倒二叶(旗叶向下的第一片新鲜叶片)的中间部分,擦洗干净后剪碎成2 mm左右的碎小片并混匀,称取0.05 g样品,放入容量瓶中,加入5 mL提取液,低温和避光放置26 h,分别测定波长为665、649和652 nm处的光吸收值。
1.4 小麦根际土采集和理化性质分析根际土采集:仔细挖出小麦苗,将根部周围的大量土抖落,再用无菌毛刷将附着在根表面的根际土刷下,随后过1 mm筛,分别将不同处理样品置于无菌无酶50 mL离心管中,储存于−80 ℃备用。
根际土理化性质测定:土壤主要营养物质有机质、速效磷、速效氮含量测定方法参考陈鑫[29]方法进行;过氧化氢酶、碱性磷酸酶、碱性蛋白酶、脱氢酶、蔗糖酶和脲酶酶活等土壤酶活测定采用试剂盒说明书进行。
1.5 小麦幼苗根际细菌群落结构和多样性分析按照PowerSoil DNA Isolation Kit说明书提取土壤微生物基因组DNA,以根际土基因组DNA为模板,采用引物对799F (5'-AACMG GATTAGATACCCKG-3')和1193R (5'-ACGTCA TCCCCACCTTCC-3')进行细菌16S rRNA基因片段扩增。PCR反应体系:2×EasyTaq PCR SuperMix 10 µL,正、反向引物(20 µmol/L)各0.5 µL,模板DNA (20 ng/µL) 1 µL,ddH2O 8 µL。PCR反应条件:94 ℃ 3 min;94 ℃ 35 s,55 ℃ 45 s,72 ℃ 1.5 min,30个循环;72 ℃ 8 min;4 ℃保存。基于美吉生物测序公司Illumina MiSeq平台对扩增产物进行测序,测序结果提交NCBI保存(登录号为SRP423565)。
基于OTU (阈值97%)分析细菌群落组OTU结构和多样性。
α多样性分析:参考胡方伟[30]方法分别计算反映物种多样性和丰富度的Shannon指数和Chao1指数。
β多样性分析:参考杨波等[31]方法对不同处理样品组进行主坐标分析(principal coordinate analysis, PCoA),揭示不同处理样品微生物群落组成的相似性和差异性。
1.6 RDA分析通过美吉生物云平台冗余分析(redundancy analysis, RDA)研究土壤理化性质对根际细菌群落结构的影响,x轴和y轴的值以及相应箭头的长度代表了每种土壤的理化性质在解释不同群落间分类单元分布中的重要性[32]。
1.7 统计分析数据统计分析用Excel进行,方法选用单因素方差分析(one-way, ANOVA)和显著极差法(significant difference, SD),显著差异水平0.05用小写字母表示。
2 结果与分析 2.1 盐碱胁迫对小麦幼苗生长的影响与无胁迫对照相比,单纯盐胁迫显著降低小麦幼苗地上部、地下部干重和功能叶片叶绿素含量、根际土壤速效氮含量,分别降低了25.0%、57.1%和21.2%、42.9%;而在盐胁迫存在时(Na+浓度为100 mmol/L),小麦幼苗株高、根长、生物量(地上和地下部干重)和功能叶片叶绿素含量随碱度增加而降低(P < 0.05),如S1P9较S1P8的根长、地下部干重和叶片叶绿素含量分别降低了30.9%、28.8%和30.1% (图 1,表 1)。可见,盐碱胁迫明显改变了小麦幼苗植株形态,显著抑制了其生长。

|
| 图 1 盐碱胁迫对小麦幼苗形态的影响 Figure 1 Effects of saline-alkaline stress on the morphology of wheat seedlings. A:一簇. B:单株 A: A cluster. B: A single plant. |
|
|
| 生长指标Growth index | S0P7 | S1P7 | S1P8 | S1P9 |
| 株高Plant height (cm) | 24.05±1.08a | 19.6±0.85b | 17.52±1.64bc | 16.73±1.00c |
| 根长Root length (cm) | 10.55±1.70a | 9.08±1.15ab | 7.89±0.21b | 5.45±0.55c |
| 地上部干重Aboveground dry weight (g/plant) | 0.035±0.003a | 0.028±0.002b | 0.025±0.001bc | 0.021±0.003c |
| 地下部干重Underground dry weight (g/plant) | 0.011±0.002a | 0.007±0.001b | 0.007±0.001b | 0.005±0.001c |
| 叶绿素含量Chlorophyll content (mg/g-dry leaf) | 2.92±0.07a | 2.30±0.25b | 2.16±0.26bc | 1.51±0.14d |
| 不同小写字母代表 0.05差异显著性水平 Different lowercase letters representing the significant difference at the level of 0.05. |
||||
与无胁迫对照相比,单纯盐胁迫降低了根际土壤速效氮(available nitrogen, AN)、速效磷(available phosphorus, AP)和有机质(organic matter, OM)含量以及碱性蛋白酶(alkaline protease, ALPT)、碱性磷酸酶(alkaline phosphatase, ALP)、蔗糖酶(sucrase, SC)、脲酶(urease, UE)和脱氢酶(dehydrogenase, DHA)的酶活,但提高了过氧化氢酶(catalase, CAT)的酶活,其中AN含量和脲酶活性分别显著降低42.9%和26.8% (P < 0.05);而在盐胁迫存在时,这些土壤指标随碱度增加而进一步继续降低或升高,如碱度最高的S1P9其AN较无胁迫的S0P7甚至呈现极显著降低、降幅高达80.32% (P < 0.01),ALPT、ALP、DHA、SC和UE酶活分别显著降低59.30%、35.90%、16.77%、20.25%和40.62% (P < 0.05) (表 2)。可见,根际土壤营养组分AN和UE酶活受盐碱胁迫影响最大;以含Na+浓度为100 mmol/L的Hoagland营养液处理时,pH值达到9.0即可引起根际土理化性质的显著改变。
| 理化性质 Physical and chemical properties |
S0P7 | S1P7 | S1P8 | S1P9 |
| 速效氮 Available nitrogen (AN) (mg/kg) |
6.25±1.00a | 3.57±0.12b | 2.62±0.53c | 1.23±0.18d |
| 速效磷 Available phosphorus (AP) (mg/kg) |
6.55±0.85a | 6.16±1.10a | 6.09±0.40a | 5.32±0.18b |
| 有机质 Organic matter (OM) (g/kg) |
5.79±0.20a | 5.68±0.30a | 5.59±0.40a | 3.85±0.15b |
| 过氧化氢酶 Catalase (CAT) (µmoL/(L·h)) |
470.47±39.16a | 481.68±79.55a | 484.60±5.43a | 512.28±15.54a |
| 碱性蛋白酶 Alcalase protease (ALPT) (µg/(h·g)) |
1.72±0.37a | 1.35±0.47ab | 0.93±0.16b | 0.70±0.25b |
| 碱性磷酸酶 Alkaline phosphatase (ALP) (nmol/(h·g)) |
592.28±22.57a | 510.81±61.28ab | 418.41±68.46bc | 379.67±67.41c |
| 脱氢酶 Dehydrogenase (DHA) (µg/(d·g)) |
3.27±0.33a | 3.07±0.16ab | 2.94±0.08ab | 2.82±0.17b |
| 蔗糖酶 Sucrase (SC) (mg/(d·g)) |
38.10±2.62a | 35.30±2.76ab | 34.78±1.47ab | 31.79±3.03b |
| 脲酶 Urease (UE) (µg/(d·g)) |
1792.65±48.45a | 1313.25±59.08b | 1284.32±49.65b | 1220.95±43.02b |
| 不同小写字母代表 0.05差异显著性水平 Different lowercase letters in the table representing the significant difference at the level of 0.05. |
||||
经质控和数据抽平分析共获得可用根际细菌16S rRNA基因片段序列821 562条,序列的平均长度为376 bp,在阈值97%下进行OTU分类获得511个OTU。各样品的测序覆盖度均超过了98% (表 3),表明测序深度可良好反映细菌群落结构。随盐碱胁迫程度增加,丰富度指数(Chao1指数)和香农指数(Shannon指数)分别出现降低和升高的趋势,但差异不显著。基于PCoA的β多样性结果表明,盐碱胁迫对根际细菌群落结构有明显的影响:盐碱处理样品相较于无盐碱处理的组间距离大于其各分组样品的组内距离,分别分布于2个不同的相内(图 2A);而盐胁迫存在时,碱胁迫增加对细菌结构也有一定的影响,但相对盐胁迫的影响略弱(图 2A、2B)。
| Group | Shannon | Chao1 | Coverage (%) |
| sS0P7 | 5.37±0.23a | 1 692.11±102.54a | 0.983±0.001 |
| sS1P7 | 5.22±0.37a | 1 708.24±105.29a | 0.983±0.001 |
| sS1P8 | 5.37±0.37a | 1 743.14±66.55a | 0.983±0.001 |
| sS1P9 | 5.29±0.04a | 1 744.14±38.12a | 0.982±0.000 |
| 不同小写字母代表 0.05差异显著性水平 Different lowercase letters in the table representing the significant difference at the level of 0.05. |
|||

|
| 图 2 盐碱胁迫小麦幼苗根际细菌PCoA分析图 Figure 2 PCoA plot of rhizosphere bacterial community of wheat seedling under saline-alkaline stress. A:所有处理的分析. B:盐胁迫存在时,不同碱胁迫处理的分析 A: All treatments. B: Saline-alkaline stresses treatments. |
|
|
不同盐碱胁迫处理的根际细菌分为8个门,其中优势菌门(相对丰度 > 10%)均为变形菌门(71.5%−65.9%)、放线菌门(8.4%−10.8%)和厚壁菌门(7.1%−11.0%),此外相对丰度较低的门有拟杆菌门(Bacteroidota) (2.0%−3.7%)、粘球菌门(Myxococcota) (3.4%−4.3%)、芽单胞菌门(Gemmatimonadota) (0.9%−1.3%)、脱硫杆菌门(Desulfobacterota) (0.8%−1.3%)和酸杆菌门(Acidobacteriota) (0.7%−1.1%);拟杆菌门相对丰度随着盐碱胁迫程度加重而增加(如胁迫最严重的S1P9较无胁迫的S0P7增加79.9%),而其他菌门则无类似规律性变化(图 3A)。属水平的结构(图 3B)分析表明,相对丰度超过0.1%的共有30个属;随着盐碱胁迫的加重,肠杆菌属(Enterobacter)的相对丰度逐渐增加,在受盐碱胁迫最严重S1P9中的相对丰度达到了2.6%,较S0P7的相对丰度极显著增加了2.53倍(P < 0.01);产碱菌科(Alcaligenace)中的未分类属和新草螺菌属(Noviherbaspirillum)有相似变化,推测这些属可能主要响应碱胁迫而相对丰度增加;异根瘤菌属(Allorhizobium)-新根瘤菌属(Neorhizobium)-类根瘤菌属(Pararhizobium)-根瘤菌属(Rhizobium)相关属、黄单胞菌科(Xanthomonadaceae)和磁螺菌科(Magetospinrillaceae)的未分类属、黄杆菌属(Flavobacterium)、假单胞菌属(Pseudomonas)、嗜多甲基菌属(Methyloversatilis)和固氮菌属(Azotobacter)的相对丰度在盐胁迫出现时(S1P7)就显著增加(P < 0.05),但这些属随着碱胁迫增加相对丰度变化不明显,甚至假单胞菌属、嗜多甲基菌属、固氮菌属呈现较弱的下降趋势,推测这些属可能主要响应盐胁迫而相对丰度增加;固氮嗜氢单胞菌属(Azohydromonas)和微枝杆菌(Microvirga)等一些属随胁迫程度增加而相对丰度降低;芽孢杆菌属(Bacillus)和鞘氨醇单胞菌属(Sphingomonas)等一些属相对丰度在不同盐碱胁迫下无明显变化;比较特别的是,固氮螺菌属(Azospirillum)在无胁迫的S0P7中相对丰度较高(3.6%),伴随盐胁迫出现但碱胁迫不高的S1P7和S1P8中明显降低,但在盐碱胁迫最严重的S1P9中又出现明显升高,达到3.6%,这预示此属可能存在有响应高盐碱胁迫的特殊菌株。

|
| 图 3 盐碱胁迫对根际细菌群落结构的影响 Figure 3 Effects of saline-alkaline stress on the rhizosphere bacterial community structure of wheat seedling. A:门水平. B:属水平 A: Phylum level. B: Genus level. |
|
|
相较于S0P7 (无盐碱胁迫),中性盐及高盐碱胁迫下根际细菌群落结构与AN、AP、OM以及ALPT、ALP、DHA、SC和UE的活性均呈负相关,而与CAT活性和pH呈正相关;UE、AN、AP、OM、ALP和DHA均达到了显著差异水平(P < 0.05);影响的关键环境因子大小依次是UE > pH > OM > AN > DHA > OM > ALP (图 4)。

|
| 图 4 根际细菌群落结构环境影响因子的RDA分析 Figure 4 Environmental impactors on rhizosphere bacterial community structure based on RDA analysis. |
|
|
土壤盐碱化是世界上最重要的生态环境问题,也是全球关注的热点问题。盐碱胁迫对植物构成了巨大的威胁,严重影响农作物的生长而降低产量[33-34]。植物生长早期(如幼苗期)遭遇高盐碱度特别是高碱度(高pH值)会显著抑制植物生长和降低产量[35]。盐碱也是影响根际微生物群落结构的主要环境因子,但盐碱胁迫对小麦幼苗生长及根际细菌群落结构的影响目前尚不清楚。本研究以中性盐NaCl和碱性盐Na2CO3模拟盐碱胁迫,发现盐和碱胁迫对小麦生长和根际细菌群落结构的影响存在明显不同。
形态、生理生化特征响应环境胁迫而发生改变,常可作为植物健康和生长的指征[36]。本研究结果表明,仅盐胁迫存在时,小麦幼苗的生物量等就出现显著降低,其直观形态表现出植株变矮、根量变少和一些叶片叶尖略变黄,表明其生长明显受到盐胁迫抑制(图 1)。这与盐胁迫或盐碱胁迫明显抑制其他植物生长的结果相似[34, 37]。根系的形态影响和决定植物的健康生长发育,也影响根相关微生物群落的互作、结构和功能[38]。然而本研究发现,仅盐胁迫对根长抑制不显著,但当盐碱胁迫同时存在且随着pH值升高碱胁迫增加时,对根系发育抑制越来越显著和突出。可见根形态和发育可作为指征小麦受盐碱胁迫危害的重要参考指标之一。盐胁迫常常会引起光合系统损伤(如叶绿素含量降低等)从而影响植物光合性能[39],但在本研究中盐碱胁迫降低小麦幼苗叶片的叶绿素含量更加显著。这些结果也部分支持了Chen等[12]提出的高碱度对植物危害可能更加严重的观点。同时,本研究还发现盐碱胁迫提高了根际土抗氧化酶过氧化氢酶活性,降低了脲酶、蛋白酶和磷酸酶等物质循环相关酶以及与产能代谢相关的脱氢酶活性,也降低了土壤主要营养物速效氮、速效磷和有机质的含量,这与盐胁迫下土壤抗氧化酶和有效营养物质含量降低[26, 39-40]相符。这表明可利用主要营养物质含量降低可能是盐碱胁迫限制植物生长的重要原因。
盐碱度及盐碱类型是影响盐碱土中存在的微生物群落结构的主要生态因子[41]。本研究中盐碱胁迫对小麦幼苗根际细菌α多样性影响不明显,但对β多样性影响显著,后者变化与不同胁迫下群落结构明显变化相符,土壤脲酶和pH是引起群落结构变化的两个最关键环境因子。这与影响土壤微生物群落结构的关键环境因子常包括土壤酶[42]和pH[43]相符。土壤酶主要来自土壤微生物,环境因子如pH和微生物互作影响着土壤结构和功能[34]。变形菌门(> 10%)、放线菌门(> 5%)和厚壁菌门(> 1%)常是盐胁迫下根际土壤中的优势细菌门[44-46],而这3个门在本研究中的相对丰度更是高达7.1%−71.5%。本研究还发现,盐碱胁迫使得肠杆菌属、假单胞菌属、新草螺菌属和固氮菌属等类群的丰度提高,它们可能减轻盐碱胁迫、促进小麦生长。肠杆菌属、假单胞菌属和固氮菌属通过产生ACC脱氨酶减少抑制植物生长的乙烯合成、产IAA等激素促进根系等发育,以生物固氮和解磷等增加土壤有效养分含量、产胞外多糖等提高土壤水分、激活植物体抗氧化酶系统降低活性氧对细胞的伤害,是可减轻盐胁迫和促进玉米及小麦等作物生长的常见植物促生菌[47]。本实验室从荒漠和盐碱土壤等环境中分离培养获得了较多肠杆菌属、假单胞菌属和固氮菌属菌株,并表现出较好的干旱或盐碱胁迫下作物促生能力[27]。特别是研究发现肠杆菌属成员常具有多种较强植物促生能力(如固氮、解磷、产IAA、产ACC脱氨酶、产铁载体、产胞外多糖等),可提高根际可利用营养物水平、增强叶片活性氧清除系统活力等促进盐碱胁迫下小麦的生长[1, 26-27]。盐碱胁迫会导致体内活性氧的积累从而对植物造成伤害,植物会提高活性氧清除酶系的活力以降低活性氧的危害[11],但植物自身的这些应急保护往往不足,而接种根际微生物可进一步提升叶片抗氧化酶活性,充分显著降低ROS伤害[3]类似地,最新研究指出基于微生物群落结构分析可设计生态友好的植物-微生物互作体系[15]。可见,通过群落结构解析来确定响应胁迫进而确定丰度明显增加的根际细菌类群,可作为用于指导提高植物抗逆性靶向菌株筛选的重要策略。除了肠杆菌属和假单胞菌属等常见PGPR外,本研究发现较高比例的响应盐碱胁迫而相对丰度增加的未分类属,表明存在较多未知的菌种资源。这也支持了杨劲松等[48]的观点,他们认为盐渍土是高效减轻盐碱胁迫、提高作物产能微生物的宝库。本研究所设计的处理梯度仅有4个,但单纯盐胁迫和盐碱胁迫对小麦生长和根际细菌群落明显不同,而仅碱胁迫(碱性盐引起的盐胁迫较弱而碱胁迫可能较强)或不同盐和碱复合胁迫程度又会产生何种影响有待进一步研究;而且盐碱胁迫下相对丰度明显增加的一些科中的未知属对减轻胁迫可能有重要贡献,可根据近缘类群设计针对性培养基和培养方式等进行深入挖掘。
4 结论盐碱胁迫显著抑制小麦幼苗生长并明显改变根际细菌群落结构,相对丰度随胁迫显著提高的Enterobacter等类群可能是促进盐碱胁迫下小麦生长和提高其盐碱地产能的重要微生物资源。
| [1] |
LI HY, LUO NY, JI CL, LI J, ZHANG L, XIAO L, SHE XL, LIU Z, LI YL, LIU CS, GUO Q, LAI HX. Liquid organic fertilizer amendment alters rhizosphere microbial community structure and Co-occurrence patterns and improves sunflower yield under salinity-alkalinity stress[J]. Microbial Ecology, 2022, 84(2): 423-438. DOI:10.1007/s00248-021-01870-0 |
| [2] |
CHO KH, BEON MS, JEONG JC. Dynamics of soil salinity and vegetation in a reclaimed area in Saemangeum, Republic of Korea[J]. Geoderma, 2018, 321: 42-51. DOI:10.1016/j.geoderma.2018.01.031 |
| [3] |
XU FF, LIANG YG, WANG XB, GUO YZ, TANG K, FENG FY. Synergic mitigation of saline-alkaline stress in wheat plant by silicon and Enterobacter sp. FN0603[J]. Frontiers in Microbiology, 2023, 13: 1100232. DOI:10.3389/fmicb.2022.1100232 |
| [4] |
ZHANG HL, YU FF, XIE P, SUN SY, QIAO XH, TANG SY, CHEN CX, YANG S, MEI C, YANG DK, WU YR, XIA R, LI X, LU J, LIU YX, XIE XW, MA DM, XU X, LIANG ZW, FENG ZH, et al. A Gγ protein regulates alkaline sensitivity in crops[J]. Science, 2023, 379(6638): eade8416. DOI:10.1126/science.ade8416 |
| [5] |
TANG RJ, YANG Y, YANG L, LIU H, WANG CT, YU MM, GAO XS, ZHANG HX. Poplar calcineurin B-like proteins PtCBL10A and PtCBL10B regulate shoot salt tolerance through interaction with PtSOS2 in the vacuolar membrane[J]. Plant, Cell & Environment, 2014, 37(3): 573-588. |
| [6] |
ZHOU C, GUO JS, ZHU L, XIAO X, XIE Y, ZHU J, MA ZY WANG JF. Paenibacillus polymyxa BFKC01 enhances plant iron absorption via improved root systems and activated iron acquisition mechanisms[J]. Plant Physiology and Biochemistry, 2016, 105: 162-173. DOI:10.1016/j.plaphy.2016.04.025 |
| [7] |
ZHU JK. Abiotic stress signaling and responses in plants[J]. Cell, 2016, 167(2): 313-324. DOI:10.1016/j.cell.2016.08.029 |
| [8] |
WANG ZY, TAN WJ, YANG DQ, ZHANG KQ, ZHAO LW, XIE ZG, XU T, ZHAO YW, WANG XN, PAN XL, ZHANG DY. Mitigation of soil salinization and alkalization by bacterium-induced inhibition of evaporation and salt crystallization[J]. Science of the Total Environment, 2021, 755(Pt 1): 142511. |
| [9] |
KERBAB S, SILINI A, CHENARI BOUKET A, CHERIF-SILINI H, ESHELLI M, EL HOUDA RABHI N, BELBAHRI L. Mitigation of NaCl stress in wheat by rhizosphere engineering using salt habitat adapted PGPR halotolerant bacteria[J]. Applied Sciences, 2021, 11(3): 1034. DOI:10.3390/app11031034 |
| [10] |
CUI MH, CHEN XY, YIN FX, XIA GM, YI Y, ZHANG YB, LIU SW. Hybridization affects the structure and function of root microbiome by altering gene expression in roots of wheat introgression line under saline-alkali stress[J]. Science of the Total Environment, 2022, 835: 155467. DOI:10.1016/j.scitotenv.2022.155467 |
| [11] |
HAO SH, WANG YR, YAN YX, LIU YH, WANG JY, CHEN S. A review on plant responses to salt stress and their mechanisms of salt resistance[J]. Horticulturae, 2021, 7(6): 132. DOI:10.3390/horticulturae7060132 |
| [12] |
CHEN J, SHARIFI R, KHAN MSS, ISLAM F, BHAT JA, KUI L, MAJEED A. Wheat microbiome: structure, dynamics, and role in improving performance under stress environments[J]. Frontiers in Microbiology, 2022, 12: 821546. DOI:10.3389/fmicb.2021.821546 |
| [13] |
KUMAWAT KC, NAGPAL S, SHARMA P. Potential of plant growth-promoting rhizobacteria-plant interactions in mitigating salt stress for sustainable agriculture: a review[J]. Pedosphere, 2022, 32(2): 223-245. DOI:10.1016/S1002-0160(21)60070-X |
| [14] |
WANG G, WENG LY, HUANG YX, LING Y, ZHEN Z, LIN Z, HU HQ, LI CY, GUO JF, ZHOU JL, CHEN S, JIA Y, REN L. Microbiome-metabolome analysis directed isolation of rhizobacteria capable of enhancing salt tolerance of Sea Rice 86[J]. Science of the Total Environment, 2022, 843: 156817. DOI:10.1016/j.scitotenv.2022.156817 |
| [15] |
BERIHU M, SOMERA TS, MALIK A, MEDINA S, PIOMBO E, TAL O, COHEN M, GINATT A, OFEK-LALZAR M, DORON-FAIGENBOIM A, MAZZOLA M, FREILICH S. A framework for the targeted recruitment of crop-beneficial soil taxa based on network analysis of metagenomics data[J]. Microbiome, 2023, 11(1): 8. DOI:10.1186/s40168-022-01438-1 |
| [16] |
LU XP, MIN WF, SHI YF, TIAN L, LI PF, MA TL, ZHANG YX, LUO CK. Exogenous melatonin alleviates alkaline stress by removing reactive oxygen species and promoting antioxidant defence in rice seedlings[J]. Frontiers in Plant Science, 2022, 13: 849553. DOI:10.3389/fpls.2022.849553 |
| [17] |
YUE TJ, ZHANG PY, SHANG YR. The potential global distribution and dynamics of wheat under multiple climate change scenarios[J]. Science of the Total Environment, 2019, 688: 1308-1318. DOI:10.1016/j.scitotenv.2019.06.153 |
| [18] |
YANG SS, LI GG, ZHANG SN, LU XP, DING Y, GUO QW, TIAN ZM, FENG FY. Isolation and identification of Pseudomonas sp. BP16 and its plant growth-promoting traits and effects[J]. Microbiology China, 2018, 45(10): 2121-2130. (in Chinese) 杨杉杉, 李国光, 张胜男, 路晓培, 丁悦, 国情文, 田再民, 冯福应. 假单胞菌BP16的分离鉴定及其植物促生性状和效应[J]. 微生物学通报, 2018, 45(10): 2121-2130. DOI:10.13344/j.microbiol.china.180115 |
| [19] |
HAJIHASHEMI S, KAZEMI S. The potential of foliar application of nano-chitosan-encapsulated nano-silicon donor in amelioration the adverse effect of salinity in the wheat plant[J]. BMC Plant Biology, 2022, 22(1): 148. DOI:10.1186/s12870-022-03531-x |
| [20] |
KADAM PM, PRAJAPATI D, KUMARASWAMY RV, KUMARI S, DEVI KA, PAL A, HAEISH, SHARMA SK, SAHARAN V. Physio-biochemical responses of wheat plant towards salicylic acid−chitosan nanoparticles[J]. Plant Physiology and Biochemistry: PPB, 2021, 162: 699-705. DOI:10.1016/j.plaphy.2021.03.021 |
| [21] |
ZHU BY. Evaluation of the output and market trend of major agricultural products under the epidemic situation released by FAO Food Outlook[J]. World Agriculture, 2021, 501(1): 120. (in Chinese) 朱宝颖. 《FAO粮食展望》发布疫情下主要农产品产量和市场趋势评估[J]. 世界农业, 2021, 501(1): 120. |
| [22] |
WANG SB, GAO PL, ZHANG QW, SHI YL, GUO XL, LV QX, WU W, ZHANG X, LI MZ, MENG QM. Biochar improves soil quality and wheat yield in saline-alkali soils beyond organic fertilizer in a 3-year field trial[J]. Environmental Science and Pollution Research, 2023, 30(7): 19097-19110. |
| [23] |
HAJIABADI A, ARANI AM, ETESAMI H. Salt-tolerant genotypes and halotolerant rhizobacteria: a potential synergistic alliance to endure high salinity conditions in wheat[J]. Environmental and Experimental Botany, 2022, 202: 105033. DOI:10.1016/j.envexpbot.2022.105033 |
| [24] |
AHMAD BHAT M, MISHRA AK, JAN S, BHAT MA, KAMAL MA, RAHMAN S, SHAH AA, JAN AT. Plant growth promoting rhizobacteria in plant health: a perspective study of the underground interaction[J]. Plants, 2023, 12(3): 629. DOI:10.3390/plants12030629 |
| [25] |
HAO YY. Hydrological process simulation and crop water productivity evaluation in Hetao irrigation area of Inner Mongolia[D]. Beijing: Doctoral Dissertation of China Agricultural University, 2015 (in Chinese). 郝远远. 内蒙古河套灌区水文过程模拟与作物水分生产率评估[D]. 北京: 中国农业大学博士学位论文, 2015. |
| [26] |
XU FF, YUAN LM, SHAO YF, FAN GH, ZHOU XA, ZHENG WL, LI DM, FENG FY. Effect of Enterobacter sp. FYP1101 on wheat seedling growth under salt stress[J]. Microbiology China, 2018, 45(1): 102-110. (in Chinese) 许芳芳, 袁立敏, 邵玉芳, 范国花, 周心爱, 郑文玲, 李冬梅, 冯福应. 肠杆菌FYP1101对盐胁迫下小麦幼苗的促生效应[J]. 微生物学通报, 2018, 45(1): 102-110. |
| [27] |
XU FF. Isolation of saline-alkaline tolerant PGPR of desert plant and their effect of growth promotion and mechanism on three plants under salt stress[D]. Hohhot: Masterʼs Thesis of Inner Mongolia Agricultural University, 2017 (in Chinese). 许芳芳. 荒漠植物耐盐碱PGPR的分离筛选及其对盐胁迫下三种植物的促生效应和机理[D]. 呼和浩特: 内蒙古农业大学硕士学位论文, 2017. |
| [28] |
WANG HL. Correlation analysis of chlorophyll content and quality in different growth stages of onion[D]. Nanjing: Masterʼs Thesis of Nanjing Agricultural University, 2017 (in Chinese). 王海林. 洋葱不同生育期的叶绿素含量及与品质相关性分析[D]. 南京: 南京农业大学硕士学位论文, 2017. |
| [29] |
CHEN X. Application of extreme environmental microorganisms in soil hardening control[J]. Agriculture & Technology, 2018, 38(19): 22-24. (in Chinese) 陈鑫. 极端环境微生物在土壤板结治理中的应用[J]. 农业与技术, 2018, 38(19): 22-24. |
| [30] |
HU FW. Research on community structure and soil microbial diversity during recovery process of degraded masson pine (Pinus massoniana) forest[D]. Hefei: Masterʼs Thesis of Anhui Agricultural University, 2020 (in Chinese). 胡方伟. 退化马尾松森林恢复过程中群落结构与土壤微生物多样性研究[D]. 合肥: 安徽农业大学硕士学位论文, 2020. |
| [31] |
YANG B, JIANG CG, SONG S, ZHANG HP, ZHANG Y. Field efficacy of different pesticides on downy mildew of Ningxia grape and their effects on microbial community of grape fruit surface[J]. Jiangsu Agricultural Sciences, 2022, 50(9): 103-110. (in Chinese) 杨波, 姜彩鸽, 宋双, 张华普, 张怡. 不同药剂对宁夏葡萄霜霉病田间药效及对葡萄果面微生物群落的影响[J]. 江苏农业科学, 2022, 50(9): 103-110. |
| [32] |
LIU X, LU X, ZHAO WQ, YANG S, WANG JW, XIA HT, WEI X, ZHANG JB, CHEN L, CHEN QX. The rhizosphere effect of native legume Albizzia julibrissin on coastal saline soil nutrient availability, microbial modulation, and aggregate formation[J]. Science of the Total Environment, 2022, 806(Pt 2): 150705. |
| [33] |
MAJEED A, MUHAMMAD Z, AHMAD H. Plant growth promoting bacteria: role in soil improvement, abiotic and biotic stress management of crops[J]. Plant Cell Reports, 2018, 37(12): 1599-1609. DOI:10.1007/s00299-018-2341-2 |
| [34] |
BELMECHERI-CHERIFI H, ALBACETE A, MARTÍNEZ-ANDÚJAR C, PÉREZ-ALFOCEA F, ABROUS-BELBACHIR O. The growth impairment of salinized fenugreek (Trigonella foenum-graecum L.) plants is associated to changes in the hormonal balance[J]. Journal of Plant Physiology, 2019, 232: 311-319. |
| [35] |
LIU D, MA Y, RUI MM, LV XC, CHEN RJ, CHEN XY, WANG YZ. Is high pH the key factor of alkali stress on plant growth and physiology? A case study with wheat (Triticum aestivum L.) seedlings[J]. Agronomy, 2022, 12(8): 1820. DOI:10.3390/agronomy12081820 |
| [36] |
AN Y, GAO Y, TONG SZ, LIU B. Morphological and physiological traits related to the response and adaption of Bolboschoenus planiculmis seedlings grown under salt-alkaline stress conditions[J]. Frontiers in Plant Science, 2021, 12: 567782. |
| [37] |
SONG TT, SUN N, DONG L, CAI H. Enhanced alkali tolerance of rhizobia-inoculated alfalfa correlates with altered proteins and metabolic processes as well as decreased oxidative damage[J]. Plant Physiology and Biochemistry, 2021, 159: 301-311. |
| [38] |
HERMS CH, HENNESSY RC, BAK F, DRESBØLL DB, NICOLAISEN MH. Back to our roots: exploring the role of root morphology as a mediator of beneficial plant-microbe interactions[J]. Environmental Microbiology, 2022, 24(8): 3264-3272. |
| [39] |
FU J. Trichoderma asperellum to improve the saline−alkaline tolerance mechanisms of maize and its influence on soil microbial diversity[D]. Daqing: Doctoral Dissertation of Heilongjiang Bayi Agricultural University, 2017 (in Chinese). 付健. 木霉菌提高玉米耐盐碱机理及其对根际土壤微生物多样性的影响[D]. 大庆: 黑龙江八一农垦大学博士学位论文, 2017. |
| [40] |
TIAN ZJ. Phosphorus accumulation, utilization and translocation characteristics in rice under saline-alkaline stress[D]. Changchun: Doctoral Dissertation of University of Chinese Academy of Sciences (Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences), 2017 (in Chinese). 田志杰. 盐碱胁迫下水稻磷素吸收利用转运特征的研究[D]. 长春: 中国科学院大学(中国科学院东北地理与农业生态研究所)博士学位论文, 2017. |
| [41] |
ZHANG HM, GUO HJ, HOU ZA. Effects of saline and alkaline stress on soil bacterial community structure[J]. Xinjiang Agricultural Sciences, 2018, 55(6): 1074-1084. (in Chinese) 张慧敏, 郭慧娟, 侯振安. 不同盐碱胁迫对土壤细菌群落结构的影响[J]. 新疆农业科学, 2018, 55(6): 1074-1084. |
| [42] |
ZHAO ZQ. Dynamic changes of soil bacterial community structure and diversity in eucalyptus grandis plantation [D]. Changsha: Masterʼs Thesis of Central South University of Forestry and Technology, 2021 (in Chinese). 赵子麒. 尾巨桉人工林土壤细菌群落结构和多样性的动态变化[D]. 长沙: 中南林业科技大学硕士学位论文, 2021. |
| [43] |
WU BH, LUO HY, WANG XT, LIU HK, PENG H, SHENG MP, XU F, XU H. Effects of environmental factors on soil bacterial community structure and diversity in different contaminated districts of Southwest China Mine tailings[J]. Science of the Total Environment, 2022, 802: 149899. |
| [44] |
LIANG S, WANG SN, ZHOU LL, SUN S, ZHANG J, ZHUANG LL. Combination of biochar and functional bacteria drives the ecological improvement of saline-alkali soil[J]. Plants (Basel, Switzerland), 2023, 12(2): 284. |
| [45] |
ZHANG YG, LIU X, CONG J, LU H, SHENG YY, WANG XL, LI DQ, LIU XD, YIN HQ, ZHOU JZ, DENG Y. The microbially mediated soil organic carbon loss under degenerative succession in an alpine meadow[J]. Molecular Ecology, 2017, 26(14): 3676-3686. |
| [46] |
LI Y, YANG XD, QIN L, LÜ GH, HE XM, ZHANG XN. The bacterial diversity and community structures in rhizosphere soil of two halophytes, Lycium ruthenicum and Kalidium capsicum[J]. Acta Ecologica Sinica, 2018, 38(9): 3118-3131. |
| [47] |
KHAN N, ALI S, SHAHID MA, MUSTAFA A, SAYYED RZ, ALFREDO CURÁ J. Insights into the interactions among roots, rhizosphere, and rhizobacteria for improving plant growth and tolerance to abiotic stresses: a review[J]. Cells, 2021, 10(6): 1551. |
| [48] |
YANG JS, YAO RJ, WANG XP, XIE WP, ZHANG X, ZHU W, ZHANG L, SUN RJ. Research on salt-affected soils in China: history, status quo and prospect[J]. Acta Pedologica Sinica, 2022, 59(1): 10-27. (in Chinese) 杨劲松, 姚荣江, 王相平, 谢文萍, 张新, 朱伟, 张璐, 孙瑞娟. 中国盐渍土研究: 历程、现状与展望[J]. 土壤学报, 2022, 59(1): 10-27. |
 2023, Vol. 50
2023, Vol. 50