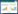扩展功能
文章信息
- 英高飞, 张爽, 王伟东, 晏磊
- YING Gaofei, ZHANG Shuang, WANG Weidong, YAN Lei
- 甘肃白银铜矿矿坑土壤细菌和古菌的多样性及坡度分布特征
- Diversity and slope distribution of bacteria and archaea in the soil of Baiyin Copper Mine pit from Gansu Province
- 微生物学通报, 2023, 50(1): 35-47
- Microbiology China, 2023, 50(1): 35-47
- DOI: 10.13344/j.microbiol.china.220328
-
文章历史
- 收稿日期: 2022-04-02
- 接受日期: 2022-07-17
- 网络首发日期: 2022-08-30
白银矿田是中部火山岩带中酸性火山岩出露面积最大的区域,约为40 km2 [1]。白银铜矿位于北祁连加里东褶皱带东段,属于祁连山多金属成矿带的重要组成部分,早古生代是本区地槽发展的重要时期[2]。白银铜矿是在1953−1956年勘探成功的,其中含有黄铁矿、黄铜矿和赤铁矿等,含铜金属量高达5.54×105 t[3]。白银的气候特点为欧亚大陆温暖带和中温带过度区域,降雨较少,日照充足且蒸发量大,年平均最低温度为−8 ℃,年平均最高温度为20 ℃[4]。白银矿区作为我国西部地区最大的有色矿藏之一,为我国的工业生产提供了大量且充足的矿藏资源。铜矿山的不断开采会产生多种废弃金属、硅酸盐、碳酸盐、硫化物和氧化物等物质,从而形成酸性水坑污染环境[5]。因此,对白银铜矿进行理化参数分析能够为改善土壤环境奠定基础。
土壤细菌和古菌在调节土壤肥力、营养元素的矿化、调节植物生长发育、抑制病原微生物及净化环境等方面具有极其重要的作用[6-7]。土壤水分、pH、容重、植被和生物量是影响微生物群落变化的因素[8-9]。细菌和古菌构成的土壤微生物组可以作为土壤研究的关键性评价指标,从而揭示微生物群落结构对环境因素的影响[10-13]。对紫金山铜矿矿坑水样微生物进行研究发现,Leptospirillum为优势菌,A-plasma和Ferroplasma在土壤样品古菌中丰度较高[14]。目前在白银铜矿中发现了Acidithiobacillus ferrooxidans AS2、Leptospirillum ferriphilum YSK和Leptospirillum ferrooxidans L15,这些细菌对铜矿中铜和锌的回收起到关键性作用[15]。土壤微生物的群落结构和多样性与环境因素、土壤质地、海拔分布等空间分布有关[16]。
本研究采用土壤理化因子的测定和土壤多样性的分析,探讨白银铜矿矿坑不同坡度采样点的细菌和古菌的群落结构、多样性与环境因子之间的联系,以期为进一步探究白银铜矿群落特征提供参考,并获得具有应用前景的微生物资源。
1 材料与方法 1.1 材料 1.1.1 主要试剂和仪器硫化物测定试剂盒和铜测定试剂盒,杭州陆恒生物科技有限公司;总铁测定试剂盒,广东环凯微生物科技有限公司;土壤氮磷钾快速检测试剂盒,郑州和顺电子科技有限公司;MN NucleoSpin 96 Soi试剂盒,Macherey-Nagel公司。
pH计,上海仪电科学仪器股份有限公司;紫外可见分光光度计,中国上海菁华科技仪器公司;超低温冰箱,上海旦鼎国际贸易有限公司;电热鼓风干燥箱,上海博迅实业有限公司医疗设备厂;振荡培养箱,上海旻泉仪器有限公司;定时双向磁力加热搅拌器,郑州宏朗仪器设备有限公司;真空泵,杭州米欧仪器有限公司;酶标仪,基因有限公司(Gene Company Limited);高速离心机,上海珂淮仪器有限公司。
1.1.2 样品采集甘肃白银矿田是中国铜矿富集区之一,主要由折腰山、火焰山、铜厂沟、小铁山和4个圈等矿床构成[2]。白银铜矿坐落于甘肃省白银市北15 km处,地理位置为N36°40′00″−36°36′00″,E104°11′00″−104°19′00″[2](图 1)。
|
| 图 1 甘肃白银铜矿矿坑采样区概况图 Figure 1 Sampling area profile of Baiyin Copper Mine pit in Gansu Province. |
|
|
土壤样品采集:土壤样品沿着坑内的道路采集,矿坑垂直深度为284 m,从坑顶到坑底共6层,矿体厚度20−70 m,在每层取样5个样品并等量混合一起为一个样品,除去表面5 cm的浮土,土壤的取样深度约为5 cm。采样完毕,将土样中的植物根系和砾石除去,然后将采取的土壤样品混合均匀,做好标记放入无菌采样袋中,低温保存带到实验室[17]。从坑底到坑顶土样依次编号为BY1、BY2、BY3、BY4、BY5和BY6。
1.2 方法 1.2.1 土壤理化性质测定使用pH计测定pH值,其中液体土壤比为5:1[18];使用总铁试剂盒测定样品总铁含量;使用硫化物含量测定试剂盒测定样品硫化物含量;使用铜含量测定试剂盒测定样品铜含量;使用土壤氮磷钾快速检测试剂盒测定样品中速效氮磷钾的含量。
1.2.2 DNA的提取及电泳检测采用MN NucleoSpin 96 Soi试剂盒对土壤样品微生物进行DNA提取。细菌上游引物为5′-ACTCCTACGGGAGGCAGCA-3′,下游引物为5′-GGACTACHVGGGTWTCTAAT-3′。PCR反应体系:基因组DNA 50 ng,上、下游引物(10 μmol/L)各0.3 μL,KOD FX Neo Buffer 5 μL,dNTPs (2 mmol/L) 2 μL,KOD FX Neo 0.2 μL,ddH2O补足10 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 40 s,25个循环;72 ℃ 7 min;4 ℃结束。古菌上游引物为5′-GYGCASCAGKCGMGAAW-3′,下游引物为5′-GGACTACVSGGGTATCTAAT-3′。PCR反应体系:基因组DNA 50 ng,上、下游引物(10 μmol/L)各0.3 μL,KOD FX Neo Buffer 5 μL,dNTPs (2 mmol/L) 2 μL,KOD FX Neo 0.2 μL,ddH2O补足10 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 40 s,25个循环;72 ℃ 7 min;4 ℃结束。PCR产物进行琼脂糖凝胶电泳检测。
1.2.3 生物信息学分析及统计分析白银铜矿细菌和古菌微生物多样性基于百迈客云平台进行测序分析(www.biocloud.net)。微生物多样性是基于Illumina HiSeq测序平台,利用双末端测序的方法,构建小片段文库进行测序。PE reads拼接使用FLASH V1.2.7软件,通过重叠(overlap)对每个样品的reads进行拼接,得到的拼接序列即原始tags数据(raw tags);tags过滤使用Trimmomatic V0.33软件,对拼接得到的raw tags进行过滤,得到高质量的tags数据(clean tags);去除嵌合体使用UCHIME V4.2软件,鉴定并去除嵌合体序列,得到最终有效数据(effective tags)。使用Mothur V1.30软件对样品α多样性指数进行评估。利用Mothur软件和R语言工具绘制Shannon多样性指数稀释曲线。使用QIIME软件和R语言工具进行β多样性分析。通过R语言工具绘制样品热图,用Canoco5进行RDA分析。
2 结果与分析 2.1 不同坡度白银矿区土壤理化参数白银矿区6处采样点土壤的pH、铜离子、总铁、硫化物、铵态氮、速效磷和速效钾含量如表 1所示。其中,土壤的pH值在2.18−4.75之间,呈强酸性。土壤的铜离子含量在20−150 mg/kg之间,其中BY1和BY6铜离子含量最低,BY4和BY5含量最高,从坑顶到坑底呈现先升高再降低的趋势。土壤总铁测定中,BY1含量最少,为2.5 mg/kg,BY4和BY5含量最高,为50 mg/kg,从坑顶到坑底呈现先升高再降低的趋势。土壤硫化物呈现平稳趋势,均为1 mg/kg。土壤样品铵态氮的含量在3.61−44.90 mg/kg之间,其中BY6含量最低,BY4含量最高;土壤速效磷的含量在0−56.79 mg/kg之间,其中BY1和BY4中速效磷含量为0,而BY2中速效磷含量最高;土壤速效钾的含量在9.07−35.65 mg/kg之间,其中BY2含量最低,BY4含量最高。从坑顶到坑底,铵态氮和速效磷呈现先升高再降低再升高再降低的趋势,速效钾呈现先升高再降低再升高的趋势。
| Sample | pH | Cu (mg/kg) | Fe (mg/kg) | S (mg/kg) | N (mg/kg) | P (mg/kg) | K (mg/kg) |
| BY1 | 4.60±0.02 | 20.00±0.00 | 2.50±0.00 | 1.00±0.00 | 10.97±0.00 | 0.00±0.00 | 14.81±0.00 |
| BY2 | 4.06±0.02 | 100.00±0.00 | 10.00±0.00 | 1.00±0.00 | 22.13±0.00 | 56.79±0.03 | 9.07±0.05 |
| BY3 | 4.75±0.01 | 100.00±0.00 | 10.00±0.00 | 1.00±0.00 | 17.74±0.00 | 32.15±2.13 | 14.96±0.38 |
| BY4 | 2.18±0.01 | 150.00±0.00 | 50.00±0.00 | 1.00±0.00 | 44.90±0.42 | 0.00±0.00 | 35.65±0.00 |
| BY5 | 2.21±0.01 | 150.00±0.00 | 50.00±0.00 | 1.00±0.00 | 25.63±0.00 | 41.64±2.29 | 25.36±1.59 |
| BY6 | 3.24±0.00 | 20.00±0.00 | 5.00±0.00 | 1.00±0.00 | 3.61±0.18 | 4.94±0.45 | 11.42±0.56 |
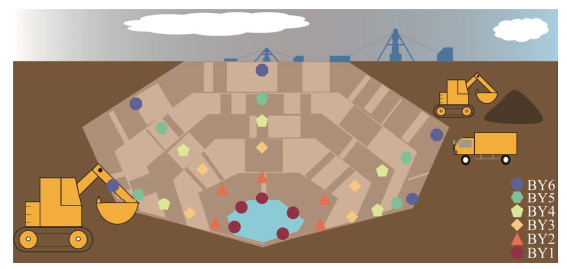
白银铜矿矿坑6处采样点的细菌和古菌α多样性指数如表 2和表 3所示。在6处细菌样品中,其中BY4的ACE指数和Chao1指数最高,分别为437.967 7和391.500 0,表明BY4的细菌丰富度最高。从坑顶到坑底,ACE指数呈现先降低再升高再降低再升高再降低的趋势,Chao1指数呈现出先升高再降低再升高再降低的趋势,表明白银铜矿细菌丰富度呈现波动式变化。BY5的Shannon指数最高为6.904 5,这表明BY5样品的物种多样性最高。Shannon指数和Simpson指数表明,从坑顶到坑底物种多样性呈现先升高后逐渐降低的趋势。根据等级丰度曲线所示,随着分类操作单元(operational taxonomic unit, OTU)丰度序号的增加,6种样品呈现不同的曲线。其中,BY4的曲线是最宽的,表明其物种组成最丰富,而且其曲线越平坦,表示物种组成的均匀程度越高(图 2A)。
| Sample | ACE | Chao1 | Simpson | Shannon | Coverage |
| BY1 | 328.480 2 | 302.000 0 | 0.586 7 | 2.830 2 | 0.999 8 |
| BY2 | 391.323 0 | 358.000 0 | 0.729 7 | 3.249 4 | 0.999 8 |
| BY3 | 358.648 1 | 319.000 0 | 0.863 9 | 4.229 0 | 0.999 8 |
| BY4 | 437.967 7 | 391.500 0 | 0.894 1 | 5.712 0 | 0.999 5 |
| BY5 | 320.939 6 | 370.333 3 | 0.982 7 | 6.904 5 | 0.999 2 |
| BY6 | 326.688 5 | 269.000 0 | 0.934 2 | 5.359 8 | 0.999 6 |
| Sample | ACE | Chao1 | Simpson | Shannon | Coverage |
| BY1 | 9.872 0 | 8.000 0 | 0.072 1 | 0.312 4 | 0.999 8 |
| BY2 | 12.456 3 | 11.500 0 | 0.443 5 | 1.357 6 | 0.993 6 |
| BY3 | 13.222 2 | 11.500 0 | 0.390 0 | 0.961 0 | 1.000 0 |
| BY4 | 11.218 2 | 11.000 0 | 0.410 0 | 1.358 6 | 0.996 0 |
| BY5 | 11.090 9 | 10.333 3 | 0.499 7 | 1.567 1 | 0.994 8 |
| BY6 | 13.000 0 | 13.000 0 | 0.379 4 | 1.231 2 | 1.000 0 |
|
| 图 2 等级丰度曲线 Figure 2 Grade abundance curves. A:细菌. B:古菌 A: Bacteria. B: Archaea. |
|
|
在6处古菌样品的α多样性中,其中BY3的ACE指数最高为13.222 2,BY6的Chao1指数最高为13.000 0,这表明BY3和BY6的古菌的丰富度较高。从坑顶到坑底,ACE指数和Chao1指数呈现先降低再升高再降低的趋势,表明白银铜矿矿坑土壤古菌的丰富度呈现波动式变化。BY5的Shannon指数最高,为1.567 1,这表明BY5的物种多样性最高。Shannon指数和Simpson指数表明,从坑顶到坑底物种多样性先升高再降低再升高再降低。根据等级丰度曲线所示,BY6的曲线是最宽的,表明其物种组成最丰富(图 2B)。
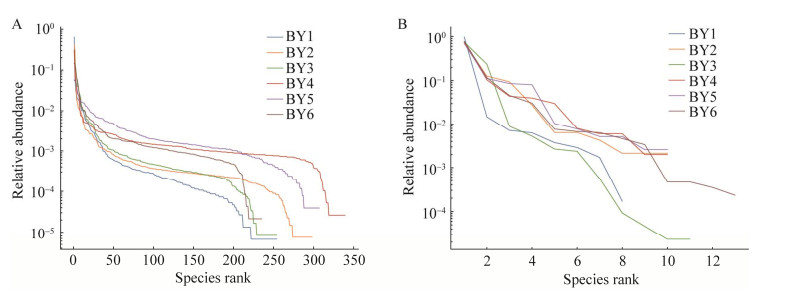
2.2.2 土壤样品的细菌和古菌群落组成白银铜矿矿坑土壤细菌的群落组成如图 3A和3B所示。门水平上,白银铜矿细菌主要分布在Proteobacteria、Cyanobacteria、Actinobacteria、Bacteroidetes、Firmicutes、Nitrospirae、Tenericutes、Chloroflexi、Acidobacteria和Patescibacteria。统计白银铜矿矿坑土壤细菌中排名前10的纲,6处样品分布依次为Gammaproteobacteria、Oxyphotobacteria、Alphaproteobacteria、Bacteroidia、Actinobacteria、Clostridia、Nitrospira、Bacilli、Mollicutes和Acidimicrobiia。在6处样品中,BY1、BY2、BY3和BY6主要分布在Gammaproteobacteria中,分别占68.8%、45.0%、64.7%和25.0%。在属水平分布中,统计白银铜矿矿坑土壤样品中丰度比例高于1%的属。其中,BY1、BY2、BY3和BY6中含量最高的属均为Acidithiobacillus,其丰度分别为66.2%、42.5%、31.3%和20.9%。BY4中含量最高的属为Nicotiana_otophora,其丰度为30.5%。BY5中含量最高的属为hgcI_clade,其丰度为10.6%。
|
| 图 3 群落组成 Figure 3 Community composition. A: 细菌纲水平. B: 细菌属水平. C: 古菌纲水平. D: 古菌属水平 A: Bacteria class level. B: Bacteria genus level. C: Archaea class level. D: Archaea genus level. |
|
|
白银铜矿矿坑土壤古菌的群落组成如图 3C和3D所示。门水平上,白银铜矿古菌分布在Euryarchaeota、Thaumarchaeota和Crenarchaeota。在纲水平分布中,6处样品分布于Thermoplasmata、Nitrososphaeria、Methanomicrobia、Halobacteria、Methanobacteria、Group_1.1c和Bathyarchaeia。在6处样品中,BY1、BY3和BY6主要分布在Thermoplasmata中,占比分别为98.9%、99.7%和93.4%。在属水平分布中,统计白银铜矿矿坑土壤样品中丰度比例高于1%的属。BY1和BY6含量最高的属为uncultured_bacterium_f_Ferroplasmaceae,其丰度分别为96.3%和77.7%。BY2中含量最高的属为Methanosaeta,其丰度为72.9%。BY3中含量最高的属为Ferroplasma,其丰度为74.5%。BY4和BY5中含量最高的属为uncultured_ bacterium_f_Nitrososphaeraceae,其丰度分别为76.4%和70.1%。
2.2.3 土壤样品细菌和古菌β多样性分析通过分析不同样品OTU组成可以反映样品的差异和距离,主坐标分析(principal co-ordinates analysis, PCoA)则是两个样品距离越近表示这两个样品的组成越相似。对白银铜矿矿坑土壤细菌进行PcoA可知,PCoA第一轴解释量为25.62%,第二轴解释量为23.02%。BY1和BY2之间距离最近,表明BY1和BY2的细菌组成相似;BY4和BY5距离其他样品最远,表明BY4和BY5与其他细菌样品之间差异较大(图 4A)。对白银铜矿矿坑土壤中6处古菌样品进行PCoA分析,PCoA第一轴解释量为46.19%,第二轴解释量为23.09%。BY2与其他样品之间距离较大,表明BY2的样品具有显著差异;BY1和BY3距离较近,表明BY1和BY3样品组成相似;BY4、BY5和BY6之间距离较近,表明三者之间组成相似(图 4B)。
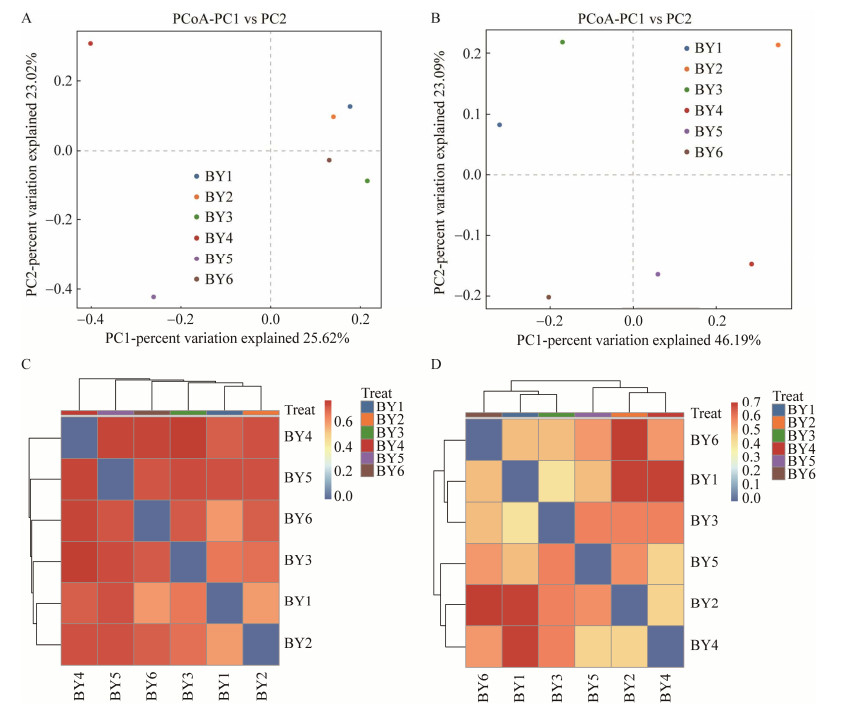
|
| 图 4 PCoA分析和样品间距离热图 Figure 4 PCoA analysis and heatmap. A:细菌PCoA分析. B:古菌PCoA分析. C:细菌样品间距离热图. D:古菌样品间距离热图 A: PCoA analysis of bacteria. B: PCoA analysis of archaea. C: Heatmap between bacteria. D: Heatmap between archaea. |
|
|
利用OTU分类水平,采用binary-jaccard距离算法对白银铜矿矿坑土壤中6处细菌样品进行样品间距离热图分析,发现BY1和BY2之间差异最小,而BY3和BY4之间差异最大(图 4C),结果表明白银铜矿矿坑土壤细菌样品BY1和BY2组成相似,BY4与其他样品差异显著。通过白银铜矿矿坑古菌的样品间距离热图分析发现,BY1和BY3之间差异最小,BY2和BY6之间差异最大(图 4D),结果表明白银铜矿矿坑土壤古菌样品BY1和BY3组成相似。
2.2.4 土壤样品细菌和古菌多样性及其与环境因子的关系白银铜矿矿坑土壤细菌样品与环境因子的RDA分析如图 5A所示。在第一象限中,Bacteroides、Acidiphilium和Acidithiobacillus与pH呈正相关,与铜离子、铵态氮、速效磷和速效钾呈负相关。第二象限中,Nicotiana_ otophora与铜离子、速效钾和铵态氮呈正相关,与速效磷和pH呈负相关。Mycoplasma和Rhodococcus与铜离子、铵态氮、速效磷和速效钾呈正相关,与pH呈负相关。第三象限中,Planktothrix_NIVA-CYA_15、hgcI_clade和CL500-29_marine_group与铜离子、铵态氮、速效磷和速效钾呈正相关,与pH呈负相关。第四象限中,Leptospirillum、Rhodanobacter、Ferritrophicum和Defluviimonas与pH和速效磷呈正相关,与铜离子、铵态氮和速效钾呈负相关。环境因子的射线长度越长,其影响程度越大,结果表明pH值是影响细菌的主要因素。
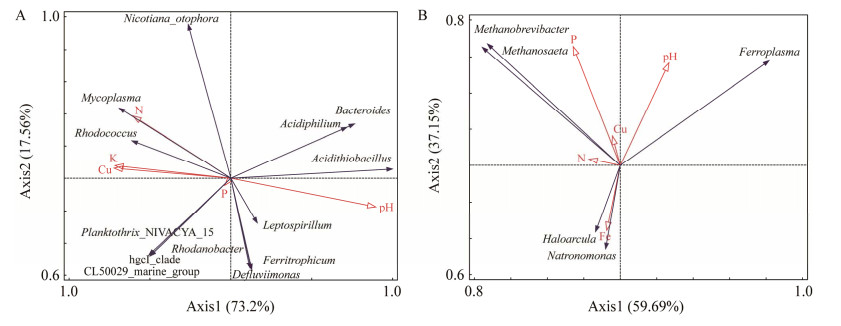
|
| 图 5 RDA分析 Figure 5 RDA analysis. A:细菌. B:古菌 A: Bacteria. B: Archaea. |
|
|
白银铜矿矿坑土壤古菌与环境因子的RDA分析如图 5B所示。第一象限中,Ferroplasma与pH、铜离子和速效磷呈正相关,与铵态氮和总铁呈负相关。第二象限中,Methanobrevibacter和Methanosaeta与铵态氮、速效磷、铜离子和pH呈正相关,与总铁呈负相关。第三象限中,Haloarcula和Natronomonas与总铁和铵态氮呈正相关,与速效磷、铜离子和pH呈负相关。分析表明速效磷是影响古菌的主要因素。
3 讨论与结论土壤坡度影响着细菌和古菌群落结构的复杂性,土壤的垂直空间驱使着微生物寻找适宜的居住环境,导致不同坡度的土壤中细菌和古菌多样性及丰度发生明显变化[19]。土壤坡度和坡向对土壤性质和植被状况也具有重要意义[20-21]。不同坡度的降水、温度和日晒会影响土壤性质如pH,也会影响土壤养分如铵态氮、速效磷和速效钾的含量,这对于土壤微生物群落会产生很大的间接影响[22]。土壤中细菌和古菌作为两大类群,在维系土壤结构、提高植物对干旱和重金属耐受方面具有关键意义[23-24]。土壤微生物的群落变化也与土壤生物量和土壤营养成分相关[25]。土壤pH也被广泛证明能够在水平尺度和垂直尺度影响土壤细菌群落[26-28]。本研究采集白银铜矿矿坑土壤样品,通过对其理化参数分析,白银铜矿为典型的酸性矿山,不同环境因子呈现不同趋势。从坡顶到坡底,pH整体呈现先降低后升高的趋势,铜离子和总铁随着坡度降低呈先升高后降低的趋势,铵态氮、速效磷和速效钾呈现波动式变化,硫化物含量呈平稳趋势。α多样性分析得出,坡度由顶到底,细菌呈现先升高后逐渐降低的趋势,古菌呈现先升高再降低再升高再降低的趋势,表明随着坡度的深入,土壤细菌和古菌具有坡度分布影响。土壤样品的群落组成表明,细菌样品相对丰度高的属为Acidithiobacillus,古菌样品相对丰度较高的属有uncultured_bacterium_f_Ferroplasmaceae和uncultured_bacterium_f_Nitrososphaeraceae。RDA分析得出,pH是主要调控细菌的因素,速效磷是主要调控古菌的因素。主要原因是白银铜矿酸性环境中古菌的群落组成和结构相对简单,而且Thermoplasmata对该环境适应性极强。
浸矿微生物普遍存在于强酸、金属含量高及高浓度硫酸盐的环境中,其涉及的微生物种类广泛[29]。目前,浸矿微生物主要包括古菌、细菌和真菌,根据对温度的适应性不同,可以分为中温菌(25−42 ℃)、中度嗜热菌(45−60 ℃)、嗜热菌(60−80 ℃)和极度嗜热菌(大于80 ℃);根据不同营养类型可以分为自养菌和异养菌,其中自养菌又可以分为铁氧化菌和硫氧化菌;根据不同生长位点又可以分为吸附菌和游离菌[30-31]。中度嗜热菌主要分为Acidithiobacillus、Sulfobacillus和古菌属的Ferroplasma[32]。白银铜矿的群落组成分析中,BY1、BY2、BY3和BY6主要分布在Acidithiobacillus中,这些浸矿微生物的存在导致矿山的铜和铁浸出,从而体现在土壤中铜离子和总铁含量高。Acidithiobacillus适应酸性环境,因其具有氧化硫化物和溶解金属的能力,广泛用于铜废渣中生物浸出[33]。从pH值印证Acidithiobacillus确实适应于酸性环境。亚马逊铜矿土壤细菌研究表明,其丰度较高的属有Bacillus、Alcaligenes和Lysinibacillus,与白银铜矿细菌分布具有显著差异[34]。对于自然界古菌分布而言,一般位于富含铁、硫的高温酸性热泉中,大多为Metallosphaera、Sulfolobus、Sulfurococcus和Acidianus[32]。然而白银铜矿矿坑土壤的古菌分布中,其丰度较高的属为uncultured_bacterium_f_Ferroplasmaceae和uncultured_bacterium_f_Nitrososphaeraceae,Methanosaeta和Ferroplasma也有一定含量。彭玙萍等[14]分析了紫金山铜矿矿坑微生物群落特征,发现矿坑水和浸出液中Leptospirillum为优势菌属,而回水中原核微生物Hydrogenophaga为优势菌属。对土壤样品细菌和古菌多样性与环境因子的分析表明,白银铜矿矿坑土壤细菌主要受pH调控,古菌主要受速效磷调控。谢学辉等[35]对德兴铜矿尾矿重金属污染与微生物群落多样性进行研究发现,Ag、Zn、As、Pb、Ni、Cr是影响土壤中微生物多样性的主要因素。对四川宜宾硫铁矿尾矿土壤细菌多样性进行的研究表明,细菌丰度和多样性均随着距尾砂距离的增加而逐渐增加,环境因子如总有机碳、pH、总磷和Cr是引起细菌群落变化的主要影响因素[36]。同样地,对山西运城铜尾矿土壤细菌多样性及不同垦殖年限土壤理化性质的研究表明,随着逐年垦殖,微生物多样性升高,而且pH和总碳影响细菌丰富度,Cu是调控细菌多样性的主要因素[37]。
综上所述,本文以甘肃白银铜矿矿坑土壤为研究对象,分析和研究了土壤中细菌和古菌的分布特征,探讨不同坡度对土壤中细菌和古菌的影响,得出以下结论:(1) 白银铜矿为强酸性铜矿,铜离子和总铁随着坡度从坑顶到坑底呈现先升高后降低的趋势,土壤中铵态氮、速效磷和速效钾含量较低且随坡度由顶到底呈现波动变化,硫化物含量最低且呈现平稳分布。(2) 多样性分析得出,从坑顶到坑底,细菌多样性呈现先升高后降低的趋势,古菌多样性呈现先升高再降低再升高再降低的趋势,其中细菌样品BY4丰富度最高,BY5多样性最高;古菌样品BY6丰富度最高,BY5多样性最高。白银铜矿矿坑土壤细菌样品BY1和BY2组成相似,BY4与其他样品差异显著,古菌样品BY1和BY3组成相似。白银铜矿矿坑土壤细菌丰度最高的属是Acidithiobacillus,古菌丰度较高的属是uncultured_bacterium_f_Ferroplasmaceae和uncultured_bacterium_f_Nitrososphaeraceae。(3) 白银铜矿矿坑土壤细菌和古菌多样性与其环境因子分析表明,细菌样品主要受pH驱动,其多样性随着pH降低而升高;古菌样品受速效磷驱动,其多样性变化与土壤中速效磷的趋势相同,随着坡度由顶到底呈现升高再降低再升高再降低的趋势。
| [1] |
DONG K. Petrogenic, metallogenetic environment and its exploration significance in baiyinchang copper deposit, Gansu Province[D]. Wuhan: Doctoral Dissertation of China University of Geosciences, 2018 (in Chinese). 董凯. 甘肃白银厂铜矿成岩—成矿环境及其找矿意义[D]. 武汉: 中国地质大学博士学位论文, 2018. |
| [2] |
JIANG K. The geological characteristics of baiyinchang copper deposit[J]. Science and Technology of West China, 2010, 9(35): 21-23. (in Chinese) 蒋坤. 白银厂铜矿床地质特征[J]. 中国西部科技, 2010, 9(35): 21-23. DOI:10.3969/j.issn.1671-6396.2010.35.010 |
| [3] |
YU JH, WANG JL, ZHANG X, WANG J. Research on normal temperature bacteria heap leaching of Baiyin copper sulfide dump[J]. World Nonferrous Metals, 2017(7): 226-228. (in Chinese) 余江鸿, 王进龙, 张析, 王军. 白银露天剥离硫化铜矿微生物堆浸工业试验研究[J]. 世界有色金属, 2017(7): 226-228. |
| [4] |
LI MJ. Microbial diversity in mine environment with metal pollution[D]. Xi՚an: Master՚s Thesis of Xi՚an University of Architecture and Technology, 2016 (in Chinese). 李梦杰. 重金属污染矿区微生物多样性分析[D]. 西安: 西安建筑科技大学硕士学位论文, 2016. |
| [5] |
SIBANDA T, SELVARAJAN R, MSAGATI T, VENKATACHALAM S, MEDDOWS-TAYLOR S. Defunct gold mine tailings are natural reservoir for unique bacterial communities revealed by high-throughput sequencing analysis[J]. Science of the Total Environment, 2019, 650(Pt 2): 2199-2209. |
| [6] |
LU H, YAO T, LI JH, MA WB, CHAI XH. Vegetation and soil microorganism characteristics of degraded grasslands[J]. Acta Prataculturae Sinica, 2015, 24(5): 34-43. (in Chinese) 卢虎, 姚拓, 李建宏, 马文彬, 柴晓虹. 高寒地区不同退化草地植被和土壤微生物特性及其相关性研究[J]. 草业学报, 2015, 24(5): 34-43. |
| [7] |
FUKE P, THANGARAJU MM, KUMAR M, SAWARKAR AD, PANDEY A, SINGH L. Role of microbial diversity to influence the growth and environmental remediation capacity of bamboo: a review[J]. Industrial Crops and Products, 2021, 167: 113567. DOI:10.1016/j.indcrop.2021.113567 |
| [8] |
DONG L, LI JJ, SUN J, YANG C. Soil degradation influences soil bacterial and fungal community diversity in overgrazed alpine meadows of the Qinghai-Tibet Plateau[J]. Scientific Reports, 2021, 11: 11538. DOI:10.1038/s41598-021-91182-7 |
| [9] |
ZHENG Q, HU YT, ZHANG SS, Noll L, Böckle T, Dietrich M, Herbold CW, Eichorst SA, Woebken D, Richter A, WANEK W. Soil multifunctionality is affected by the soil environment and by microbial community composition and diversity[J]. Soil Biology & Biochemistry, 2019, 136: 107521. |
| [10] |
BADANO EI, CAVIERES LA, MOLINA- MONTENEGRO MA, QUITOZ CL. Slope aspect influences plant association patterns in the Mediterranean matorral of central Chile[J]. Journal of Arid Environments, 2005, 62(1): 93-108. DOI:10.1016/j.jaridenv.2004.10.012 |
| [11] |
YUAN HZ, WU H, GE TD, LI KL, WU JS, WANG JR. Effects of long-term fertilization on bacterial and archaeal diversity and community structure within subtropical red paddy soils[J]. Chinese Journal of Applied Ecology, 2015, 26(6): 1807-1813. (in Chinese) 袁红朝, 吴昊, 葛体达, 李科林, 吴金水, 王久荣. 长期施肥对稻田土壤细菌、古菌多样性和群落结构的影响[J]. 应用生态学报, 2015, 26(6): 1807-1813. |
| [12] |
ZHAO HW, LI QL, JIN XT, LI D, ZHU ZQ, LI QX. Chiral enantiomers of the plant growth regulator paclobutrazol selectively affect community structure and diversity of soil microorganisms[J]. Science of the Total Environment, 2021, 797: 148942. DOI:10.1016/j.scitotenv.2021.148942 |
| [13] |
SICZEK A, FRAC M, GRYTA A. Forecrop effects on abundance and diversity of soil microorganisms during the growth of the subsequent crop[J]. Agronomy, 2020, 10(12): 1971. DOI:10.3390/agronomy10121971 |
| [14] |
PENG YP, ZENG WM. Diversity of microbial community in acid mine drainage from Zijinshan copper mine[J]. Microbiology China, 2020, 47(9): 2887-2896. (in Chinese) 彭玙萍, 曾伟民. 紫金山铜矿酸性矿山废水微生物群落多样性[J]. 微生物学通报, 2020, 47(9): 2887-2896. |
| [15] |
SAJJAD W, ZHENG GD, MA XX, RAFIQ M, IRFAN M, XU W, ALI B. Culture-dependent hunt and characterization of iron-oxidizing bacteria in Baiyin Copper Mine, China, and their application in metals extraction[J]. Journal of Basic Microbiology, 2019, 59(3): 323-336. DOI:10.1002/jobm.201800433 |
| [16] |
LI JY, CHEN QF, LI Q, ZHAO CS, FENG Y. Influence of plants and environmental variables on the diversity of soil microbial communities in the Yellow River Delta Wetland, China[J]. Chemosphere, 2021, 274: 129967. DOI:10.1016/j.chemosphere.2021.129967 |
| [17] |
YANG KN, LUO SW, HU LG, CHEN BB, XIE Z, MA BB, MA WB, DU GZ, MA XJ, LE ROUX X. Responses of soil ammonia-oxidizing bacteria and archaea diversity to N, P and NP fertilization: relationships with soil. environmental variables and plant community diversity[J]. Soil Biology and Biochemistry, 2020, 145: 107795. DOI:10.1016/j.soilbio.2020.107795 |
| [18] |
XU Y, LUO F, XU RY, REN H. Research on determination methods for pH value of agricultural soil in Sanya district[J]. Journal of Changjiang Vegetables, 2011(24): 50-51. (in Chinese) 许彦, 罗丰, 许如意, 任红. 三亚地区农业土壤pH值测定方法初探[J]. 长江蔬菜, 2011(24): 50-51. DOI:10.3865/j.issn.1001-3547.2011.24.020 |
| [19] |
DING CX. Analysis on soil microbial community and diversity of alfalfa cultivation area in western arid area[J]. Chinese Qinghai Journal of Animal and Veterinary Sciences, 2021, 51(5): 28-34, 42. (in Chinese) 丁成翔. 西部旱区紫花苜蓿地土壤微生物群落结构和多样性分析[J]. 青海畜牧兽医杂志, 2021, 51(5): 28-34, 42. DOI:10.3969/j.issn.1003-7950.2021.05.006 |
| [20] |
YANG L. Diversity of sulfur-oxidizing bacteria and their relationship to environmental factors in volcanoes and waterbodies of Wudalianchi volcanic group[D]. Daqing: Master՚s Thesis of Heilongjiang Bayi Agricultural University, 2020 (in Chinese). 杨磊. 五大连池火山群山体及水体硫氧化细菌多样性及其与环境因子的关系[D]. 大庆: 黑龙江八一农垦大学硕士学位论文, 2020. |
| [21] |
FENG HL, GUO JH, WANG WF, SONG XZ, YU SQ. Soil depth determines the composition and diversity of bacterial and archaeal communities in a poplar plantation[J]. Forests, 2019, 10(7): 550. DOI:10.3390/f10070550 |
| [22] |
CHU HY, XIANG XJ, YANG J, ADAMS JM, ZHANG KP, LI YT, SHI Y. Effects of slope aspects on soil bacterial and arbuscular fungal communities in a boreal forest in China[J]. Pedosphere, 2016, 26(2): 226-234. DOI:10.1016/S1002-0160(15)60037-6 |
| [23] |
RILLIG MC, MUMMEY DL. Mycorrhizas and soil structure[J]. New Phytologist, 2006, 171(1): 41-53. DOI:10.1111/j.1469-8137.2006.01750.x |
| [24] |
van der HEIJDEN MGA, BARDGETT RD, van STRAALEN NM. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems[J]. Ecology Letters, 2008, 11(3): 296-310. DOI:10.1111/j.1461-0248.2007.01139.x |
| [25] |
EILERS KG, DEBENPORT S, ANDERSON S, FIERER N. Digging deeper to find unique microbial communities: the strong effect of depth on the structure of bacterial and archaeal communities in soil[J]. Soil Biology and Biochemistry, 2012, 50: 58-65. DOI:10.1016/j.soilbio.2012.03.011 |
| [26] |
SHEN CC, XIONG JB, ZHANG HY, FENG YZ, LIN XG, LI XY, LIANG WJ, CHU HY. Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai Mountain[J]. Soil Biology and Biochemistry, 2013, 57: 204-211. DOI:10.1016/j.soilbio.2012.07.013 |
| [27] |
FIERER N, JACKSON RB. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 626-631. DOI:10.1073/pnas.0507535103 |
| [28] |
BAKER KL, LANGENHEDER S, NICOL GW, RICKETTS D, KILLHAM K, CAMPBELL CD, PROSSER JI. Environmental and spatial characterisation of bacterial community composition in soil to inform sampling strategies[J]. Soil Biology and Biochemistry, 2009, 41(11): 2292-2298. DOI:10.1016/j.soilbio.2009.08.010 |
| [29] |
LIU JC, LIU JH, XU LL, ZHOU YP, WEN XX. Recent research advances on microbial community structure in bioleaching[J]. Chinese Journal of Rare Metals, 2021, 45(10): 1258-1268. (in Chinese) 刘佳晨, 刘金辉, 徐玲玲, 周义朋, 文旭祥. 生物浸矿微生物群落结构研究进展[J]. 稀有金属, 2021, 45(10): 1258-1268. DOI:10.13373/j.cnki.cjrm.XY20050037 |
| [30] |
SHI LJ. The structure and dynamics of microbial community during bioleaching under pH stimulation[D]. Changsha: Master՚s Thesis of Central South University, 2014 (in Chinese). 石丽娟. 基于pH刺激的浸矿微生物群落结构及种群动态研究[D]. 长沙: 中南大学硕士学位论文, 2014. |
| [31] |
ZHENG HA. Study on the bioleaching mechanism and biodiversity of sulfide ore[D]. Shanghai: Doctoral Dissertation of Donghua University, 2015 (in Chinese). 郑红艾. 硫化矿生物浸出过程的氧化机理及生物多样性研究[D]. 上海: 东华大学博士学位论文, 2015. |
| [32] |
LIU S, LI JC, YANG YR. Acidophilic and thermophilic leaching microorganisms[J]. Genomics and Applied Biology, 2018, 37(12): 5355-5359. (in Chinese) 刘莎, 李俊成, 杨毅然. 嗜酸嗜热浸矿微生物[J]. 基因组学与应用生物学, 2018, 37(12): 5355-5359. DOI:10.13417/j.gab.037.005355 |
| [33] |
SRIAPORN C, CAMPBELL KA, van KRANENDONK MJ, HANDLEY KM. Genomic adaptations enabling Acidithiobacillus distribution across wide-ranging hot spring temperatures and pHs[J]. Microbiome, 2021, 9(1): 135. DOI:10.1186/s40168-021-01090-1 |
| [34] |
DOMINGUES VS, de SOUZA MONTEIRO A, JULIO ADL, QUEIROZ ALL, dos SANTOS VL. Diversity of metal-resistant and tensoactive-producing culturable heterotrophic bacteria isolated from a copper mine in Brazilian Amazonia[J]. Scientific Reports, 2020, 10: 6171. DOI:10.1038/s41598-020-62780-8 |
| [35] |
XIE XH, FAN FX, YUAN XW, ZHU WX, LIU N, PING J, LIU JS. Impact on microbial diversity of heavy metal pollution in soils near Dexing copper mine tailings[J]. Microbiology China, 2012, 39(5): 624-637, 14. (in Chinese) 谢学辉, 范凤霞, 袁学武, 朱文祥, 刘娜, 平婧, 柳建设. 德兴铜矿尾矿重金属污染对土壤中微生物多样性的影响[J]. 微生物学通报, 2012, 39(5): 624-637, 14. DOI:10.13344/j.microbiol.china.2012.05.003 |
| [36] |
WU BH, LUO HY, WANG XT, LIU HK, PENG H, SHENG MP, XU F, XU H. Effects of environmental factors on soil bacterial community structure and diversity in different contaminated districts of southwest China mine tailings[J]. Science of the Total Environment, 2022, 802: 149899. DOI:10.1016/j.scitotenv.2021.149899 |
| [37] |
JIA T, WANG R, CHAI B. Effects of heavy metal pollution on soil physicochemical properties and microbial diversity over different reclamation years in a copper tailings dam[J]. Journal of Soil and Water Conservation, 2019, 74(5): 439-448. DOI:10.2489/jswc.74.5.439 |
 2023, Vol. 50
2023, Vol. 50