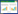扩展功能
文章信息
- 窦明德, 姚从禹, 吴敬, 夏伟, 陈晟
- DOU Mingde, YAO Congyu, WU Jing, XIA Wei, CHEN Sheng
- 多功能过氧化物酶介导Mn(Ⅲ)络合体系对酚类化合物的氧化降解
- Oxidative degradation of phenolic compounds by versatile peroxidase-mediated Mn(Ⅲ) complex system
- 微生物学通报, 2022, 49(9): 3631-3643
- Microbiology China, 2022, 49(9): 3631-3643
- DOI: 10.13344/j.microbiol.china.220047
-
文章历史
- 收稿日期: 2022-01-13
- 接受日期: 2022-03-23
- 网络首发日期: 2022-04-29
2. 江南大学生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122;
3. 江南大学教育部食品安全国际合作联合实验室,江苏 无锡 214122
2. Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China;
3. International Joint Laboratory on Food Safety, Ministry of Education, Jiangnan University, Wuxi 214122, Jiangsu, China
作为有机化学工业的基本原料,酚类化合物在高分子材料、染料、合成纤维、药物等方面应用广泛[1]。地表水中酚类化合物主要来自炼油、造纸、木材防腐和化工等工业废水,而且大多数酚类化合物在水中具有相当高的溶解度,使其成为主要的水体污染物之一[2-3]。含有酚类有机污染物的生活及工业废水若不经过处理直接排放,将严重危害生态环境和人民生命安全[4]。
酚类污染物的催化降解是环境化学领域的热点问题。酚类的生物降解无二次污染,去除率较高,安全可靠,是国内外研究的热点[5]。一些菌株已被鉴定为酚类物质的降解菌株,如红球菌属、丝袍酵母菌属、克雷伯氏菌和柠檬酸杆菌等[6]。报道称,红球菌B403在苯酚降解途径中的粘酸环异构酶、乙酰辅酶A酰基转移酶和邻苯二酚1, 2-双加氧酶表现出上调趋势[7]。漆酶和辣根过氧化物酶等相关酶类在酚类降解方面也取得了明显的效果,用磁性石墨烯固定化漆酶,催化氧化水中的双酚A,去除率可达到82.14%[8];此外,参与木质素降解的木质素过氧化物酶(lignin peroxidase,LiP)、锰过氧化物酶(manganese peroxidase,MnP)和多功能过氧化物酶(versatile peroxidase,VP)具有较强的催化氧化能力,对木质素中的芳香族化合物具有一定的降解作用[9-10]。由于酚类物质与木质素芳香族化合物具有结构上的相似性,上述木质素过氧化物酶被推测具有引发酚类污染物中C−C键断裂的潜能,与特异性强的酚类降解酶相比,过氧化物酶具有较强的底物广谱性,在众多污染物的降解方面展现出一定的潜能[11]。
Mn(Ⅲ)作为一种单电子转移反应的强氧化剂,在有机污染物的废水处理和生物地球化学氧化还原转化过程中发挥着重要作用,如反应式所示:2Mn3++2H2O=MnO2(s)+Mn2++4H+,自由态Mn(Ⅲ)极易发生歧化反应而失去氧化能力,而有机酸络合剂可以通过与Mn(Ⅲ)的络合作用有效防止自由态Mn(Ⅲ)的歧化[12]。自然界中能够催化Mn(Ⅲ)生成的酶有MnP和VP,其中VP是一种发现较晚的亚铁血红素过氧化物酶,是MnP和LiP的综合体,具有MnP特有的Mn2+结合位点及LiP特有的色氨酸催化位点,还有主要亚铁血红素通道中作用于低氧化还原电势底物的位点[13-17]。在H2O2的存在下VP可以将结合在锰离子位点的Mn2+氧化为Mn3+,产物Mn3+与有机酸络合剂形成Mn(Ⅲ)-有机酸络合物,从活性位点释放下来,Mn(Ⅲ)-有机酸络合物具有较高的氧化还原电位和稳定性,可作为酚类底物的扩散氧化剂[18]。
糙皮侧耳(Pleurotus eryngii)是自然界中有效降解木质素的白腐真菌之一,在环境污染物的生物修复方面具有较大的应用潜力,其分泌的VP能够高效氧化Mn2+、酚类和非酚类化合物,具有较强的底物广谱性[18-19]。因此,本研究利用包涵体蛋白体外复性的方式获得了Pleurotus eryngii来源的多功能过氧化物酶(PeVP)的活性蛋白,优化确定PeVP介导Mn(Ⅲ)-有机酸络合体系的最优反应条件,进一步探究了Mn(Ⅲ)-有机酸络合体系对酚类污染物的氧化能力,以期为酶催化Mn(Ⅲ)-有机酸络合体系广泛应用于酚类污染物降解方面提供参考意义。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒研究所用克隆菌株为大肠杆菌(Escherichia coli) JM109,表达菌株为E. coli BL21(DE3),均为实验室保藏菌株。P. eryngii来源的多功能过氧化物酶(PeVP,NCBI登录号为O94753.1),编码基因核苷酸序列根据大肠杆菌表达系统偏好性进行密码子优化后,由中国江苏天霖生物工程有限公司化学合成,以pET-24a(+)作为表达载体进行重组表达。
1.1.2 培养基LB培养基(g/L):蛋白胨10.0,酵母提取物5.0,NaCl 10.0。
TB培养基(g/L):蛋白胨12.0,酵母粉24.0,甘油5.0,KH2PO4 2.3,K2HPO4·3H2O 16.4。
1.1.3 主要试剂和仪器苹果酸、苹果酸钠、尿素、甘油、MnSO4、CaCl2、30% H2O2水溶液、愈创木酚、藜芦醇、丁香醛连氮、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、二硫苏糖醇(dithiothreitol,DTT)、2, 2-丁香醛连氮-双-3-乙基苯并噻唑啉-6-磺酸[2, 2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]、2, 6-二甲氧基苯酚(2, 6-dimethoxyphenol,DMP)、苯酚(phenol)、对苯二酚(hydroquinone)、间苯二酚(resorcinol)和对硝基苯酚(p-nitrophenol),中国医药集团有限公司;氧化型谷胱甘肽(GSSG),西安雅图生物科技有限公司;羟高铁血红素(hematin),生工生物工程(上海)股份有限公司。
紫外可见分光光度计,Shimadzu公司;高压匀浆破碎机和超声破碎仪,宁波新芝生物科技股份有限公司;蛋白电泳仪,Bio-Rad公司。
1.2 方法 1.2.1 重组E. coli BL21(DE3)-pET-24a(+)- PeVP构建及诱导表达将pET-24a(+)-PeVP重组质粒转化到E. coli BL21(DE3),选取阳性转化子接种至LB液体培养基中,37 ℃、200 r/min培养过夜,按照5%的接种量转接至50 mL TB培养基中。待OD600达到0.6时,分别加入0、0.2、0.4 mmol/L的IPTG,在25 ℃、200 r/min培养24 h,测定菌体OD600并做SDS-PAGE鉴定,观察不同IPTG浓度下的蛋白表达情况。在发酵培养过程中,控制卡那霉素的工作浓度为100 μg/mL。
1.2.2 重组酶PeVP包涵体变性于7 104×g离心10 min收集菌体,利用高压匀浆破碎机对菌体进行破壁处理并离心(8 000 r/min,10 min)收集包涵体沉淀。将PeVP包涵体沉淀溶于10 mL pH 8.5的50 mmol/L Tris-HCl缓冲液中,并加入8 mol/L尿素、1 mmol/L EDTA、5 mmol/L DTT和10% (质量体积分数)甘油,4 ℃静置4−5 h。利用Bradford蛋白浓度测定试剂盒检测PeVP包涵体溶液的蛋白浓度,适当稀释控制包涵体最终蛋白浓度在0.3−0.4 mg/mL。
1.2.3 重组酶PeVP包涵体复性如表 1所示,在50 mmol/L Tris-HCl缓冲液中加入0.5 mol/L尿素、0.5 mmol/L GSSG、0.1 mmol/L DTT、0.1 mmol/L EDTA、5 mmol/L CaCl2、5−10 μmol/L的hematin和0−10% (质量体积分数)的甘油。设置正交试验优化复性体系,探究Tris-HCl缓冲液pH、甘油浓度和hematin浓度对复性效果的影响[20]。取3 mL稀释后的PeVP包涵体变性溶液装入14 kDa的透析袋中,按体积比1:20放入60 mL复性液中,4 ℃静置透析24 h。在透析后的PeVP酶液中加入5 μmol/L hematin于4 ℃孵育12 h,7 104×g离心10 min,取上清即可获得复性PeVP酶液。
| No. | pH | Glycerol (%) | Hematin (µmol/L) | Urea (mol/L) | GSSG (mmol/L) | DTT (mmol/L) | CaCl2 (mmol/L) | EDTA (mmol/L) |
| 1 | 8.5 | 0.0 | 10.0 | 0.5 | 0.5 | 0.1 | 5.0 | 0.1 |
| 2 | 8.5 | 0.0 | 5.0 | 0.5 | 0.5 | 0.1 | 5.0 | 0.1 |
| 3 | 8.5 | 10.0 | 10.0 | 0.5 | 0.5 | 0.1 | 5.0 | 0.1 |
| 4 | 8.5 | 10.0 | 5.0 | 0.5 | 0.5 | 0.1 | 5.0 | 0.1 |
| 5 | 9.5 | 0.0 | 10.0 | 0.5 | 0.5 | 0.1 | 5.0 | 0.1 |
| 6 | 9.5 | 0.0 | 5.0 | 0.5 | 0.5 | 0.1 | 5.0 | 0.1 |
| 7 | 9.5 | 10.0 | 10.0 | 0.5 | 0.5 | 0.1 | 5.0 | 0.1 |
| 8 | 9.5 | 10.0 | 5.0 | 0.5 | 0.5 | 0.1 | 5.0 | 0.1 |
以苹果酸-苹果酸钠为缓冲液(pH 2.0−8.0),以1 mmol/L Mn2+、1 mmol/L ABTS、10 mmol/L DMP、10 mmol/L愈创木酚、10 mmol/L丁香醛连氮和20 mmol/L藜芦醇为底物,反应总体积为1 mL。在25 ℃下,添加0.1 mmol/L H2O2启动反应,利用紫外分光光度计动力学方法测定线性范围内(3−5 min) PeVP作用于不同底物的ΔOD,Mn2+、ABTS、DMP、愈创木酚、丁香醛连氮和藜芦醇的检测波长分别为240、420、468、465、525和310 nm[21]。在不同温度(20−80 ℃)和pH值(2.0−8.0)条件下进行酶活测定,确定PeVP作用于不同底物的最佳温度和pH值。取PeVP原酶液分别在不同温度(30−70 ℃)培养12、24、36、48、60 h,研究PeVP在不同温度下的热稳定性;取PeVP原酶液加入到不同pH (2.0−7.0)的苹果酸-苹果酸钠缓冲液中,30 ℃条件下分别培养24 h和48 h,研究PeVP的pH值稳定性。PeVP的温度和pH稳定性探究测定的均是PeVP的Mn2+活性。
PeVP的Mn2+活性测定方法:总反应体系为1 mL,包含50 mmol/L (pH 4.5)的苹果酸缓冲液、1.0 mmol/L MnSO2溶液和PeVP酶液50 μL。在25 ℃条件下,加入0.1 mmol/L的H2O2溶液启动反应,连续观察反应最初3 min内240 nm处吸光度的变化[EM240=6 500 L/(mol·cm)],PeVP的Mn2+酶活力定义为:每分钟使1 μmo1的Mn2+转化为Mn3+所需的酶量为1个酶活力单位(U)。
1.2.5 重组酶PeVP介导的Mn(Ⅲ)-有机酸络合体系优化Mn(Ⅲ)-有机酸络合体系的优化对于其氧化能力的提升及酚类污染物的持续降解意义重大。通过对有机酸种类(苹果酸、柠檬酸、琥珀酸、草酸、酒石酸、乙酸)、有机酸浓度(10−100 mmol/L)、Mn2+浓度(0−6 mmol/L)和H2O2浓度(0−0.6 mmol/L)进行优化,探究了PeVP介导的Mn(Ⅲ)-有机酸最优络合体系。
1.2.6 重组酶PeVP介导的Mn(Ⅲ)-有机酸络合体系催化酚类模式底物氧化为了比较不同pH条件下PeVP重组酶本身的低氧化还原位点及其介导的Mn(Ⅲ)-有机酸络合体系对酚类底物的氧化降解能力,选取ABTS、DMP、愈创木酚和丁香醛连氮作为酚类污染物的模式底物,探究不同条件下(pH 3.0、pH 4.5;添加Mn2+、未添加Mn2+) PeVP对酚类模式底物的氧化性能。在未添加Mn2+条件下[未形成Mn(Ⅲ)-有机酸络合体系],分别测定pH 3.0和pH 4.5条件下PeVP本身的低氧化还原电势位点对4种酚类模式底物的直接氧化活性;同时在添加Mn2+条件下[形成Mn(Ⅲ)-有机酸络合体系],分别测定pH 3.0和pH 4.5 PeVP介导的Mn(Ⅲ)-有机酸络合体系对4种酚类模式底物的催化活性。检测方法同1.2.4。
1.2.7 重组酶PeVP介导的Mn(Ⅲ)-有机酸络合体系催化常见酚类污染物氧化降解选择苯酚、对苯二酚、间苯二酚和对硝基苯酚4种常见的酚类污染物作为PeVP介导的Mn(Ⅲ)-有机酸络合体系的降解底物。取50 mL锥形瓶,加入10 mL PeVP介导的Mn(Ⅲ)-有机酸的最优络合体系,初始底物浓度为500 mg/L,VP加酶量为0.014 mg/mL,在30 ℃、200 r/min的水浴摇床反应16 h。分别在5、8、12和16 h取样1 mL反应液至EP管中,用甲醇等体积稀释2倍,10 656×g离心2 min后取上清液,经0.22 μm的有机相微孔滤膜过滤,高效液相色谱法测定酚类含量[22]。
4种酚类底物含量的测定:C18-wp (100 A,5 μm,4.6 mm×250 mm)色谱柱,体积分数为50%的甲醇溶液为流动相,流速为0.5 mL/min,柱温为25 ℃,进样量为10 μL,检测波长为270 nm。
2 结果与分析 2.1 重组酶PeVP的异源表达结果重组酶PeVP摇瓶发酵24 h后,测得OD600为10.5,不同IPTG诱导浓度下的蛋白表达情况如图 1所示,在破壁上清中(泳道1、3和5),重组酶PeVP有微弱的可溶性条带出现,但未检测到Mn2+活性和ABTS活性。目标蛋白大部分是以包涵体的形式存在于破壁沉淀中(泳道2、4和6),在IPTG浓度为0.4 mmol/L的诱导浓度下,包涵体条带最粗(泳道6),目标蛋白表达量最高。说明PeVP在E. coli BL21(DE3)中未能正确折叠。

|
| 图 1 E. coli BL21(DE3)-PeVP的SDS-PAGE图 Figure 1 SDS-PAGE of E. coli BL21(DE3)-PeVP. M:标准分子量标记;1、3、5:分别对应IPTG终浓度为0、0.2、0.4 mmol/L的PeVP细胞裂解上清液;2、4、6:分别对应IPTG终浓度为0、0.2、0.4 mmol/L的PeVP包涵体;7:PeVP复性溶液 Lanes: M: Standard molecular weight marker; 1, 3, 5: Cell fragmentation supernatant of PeVP induced by 0, 0.2 and 0.4 mmol/L IPTG, respectively; 2, 4, 6: Inclusion body of PeVP induced by 0, 0.2 and 0.4 mmol/L IPTG, respectively; 7: Renaturation solution of PeVP. |
|
|
由于结构中多对二硫键的存在及蛋白折叠的复杂性,目前VP的异源表达大多是以包涵体为主,需经过包涵体变性溶解后,再经过体外复性获得活性蛋白[23-24]。实验表明,重组酶PeVP包涵体复性的效果受pH、甘油浓度和hematin浓度影响较大。如图 2所示,8号为PeVP最佳复性条件:pH 9.5 Tris-HCl缓冲液、0.5 mol/L尿素、0.5 mmol/L GSSG、0.1 mmol/L DTT、0.1 mmol/L EDTA、5 mmol/L CaCl2、10%甘油、5 μmol/L hematin,4 ℃静置透析24 h,5 μmol/L hematin孵育12 h。复性PeVP出现了清晰可见的蛋白条带(图 1第7泳道)。复性PeVP的Mn2+催化活性为10.14 U/mL,蛋白浓度为0.29 mg/mL,比活为34.97 U/mg。
图 3A和3B均以PeVP对每种底物的最高酶活定义为100%相对酶活,图 3A测定的是PeVP对不同底物的最适pH,PeVP以Mn2+、ABTS、DMP、syringaldazine和guaiacol为底物的最高酶活分别为10.20、5.93、6.56、8.45和3.13 U/mL;图 3B测定的是PeVP对不同底物的最适温度,PeVP以Mn2+、ABTS、DMP、syringaldazine和guaiacol为底物的最高酶活分别为11.14、6.63、7.16、9.23和3.42 U/mL。图 3C和图 3D测定的是PeVP的Mn2+活性,以初始状态的酶活力定义为100%相对酶活,初始酶活均为10.20 U/mL。

|
| 图 3 PeVP的酶学性质 Figure 3 Determination of enzymatic properties of PeVP. A:pH对PeVP活性的影响;B:温度对PeVP活性的影响;C:PeVP热稳定性;D:PeVP pH稳定性 A: Effect of pH on the activity of PeVP; B: Effect of temperature on the activity of PeVP; C: Thermal stability of PeVP; D: pH stability of PeVP. |
|
|
PeVP对Mn2+的最适pH值为4.5,对ABTS、DMP、愈创木酚和丁香醛连氮的最适pH值均为3.0。在5种底物的最佳pH条件下,重组酶PeVP对Mn2+的最适温度为70 ℃,对ABTS、DMP、愈创木酚和丁香醛连氮的最适温度均为50 ℃。PeVP的Mn2+结合位点决定了Mn2+的催化活性,由于PeVP中存在作用于低氧化还原电位底物的主要亚铁血红素通道位点,因此对ABTS、DMP、愈创木酚和丁香醛连氮等低氧化还原电位底物具有一定的氧化作用。复性后的PeVP未检测到氧化藜芦醇的活性,怀疑复性后的PeVP未形成正确折叠的色氨酸催化位点。
在pH 4.5条件下,PeVP的热稳定性结果显示,PeVP在低温条件下相对稳定,温度越高PeVP的稳定性越差(图 3C)。30 ℃条件下,24 h PeVP的残留Mn2+活性为71.47%,半衰期在48−60 h之间;30 ℃和40 ℃条件下,重组酶PeVP 6 h的Mn2+活性出现显著升高,说明PeVP的Mn2+催化位点在30 ℃和40 ℃条件下存在一定的热激活效应。在30 ℃条件下,PeVP的pH稳定性结果如图 3D所示,在pH 5.5时PeVP的稳定性最好,相对酶活无明显下降;pH低于3.5或pH高于6.0时PeVP的稳定性较差,48 h后基本丧失Mn2+活性。
如图 4所示,在Tris-HCl缓冲液体系中,通过全波长扫描未检测到Mn(Ⅲ)及Mn(Ⅲ)-络合物,生成的Mn(Ⅲ)因不能与盐酸发生络合作用而迅速发生歧化反应;而在苹果酸缓冲液体系中,发现波长275 nm处出现明显的Mn(Ⅲ)-苹果酸络合物特征峰,说明苹果酸可以与PeVP介导生成的Mn(Ⅲ)发生络合作用,形成Mn(Ⅲ)-苹果酸络合物,防止Mn(Ⅲ)的歧化并保留了Mn(Ⅲ)的高氧化还原电位。因此,苹果酸对于PeVP介导生成的Mn(Ⅲ)具有重要的螯合保护作用,有利于维持Mn(Ⅲ)的高氧化还原电位,在后期酚类底物的氧化降解体系中发挥着重要的作用。
|
| 图 4 Mn(Ⅲ)-有机酸络合物紫外-可见吸收光谱分析 Figure 4 Mn(Ⅲ)-organic acid chelate as analyzed by UV-visible spectroscopy at the spectrums ranging from 200 to 500 nm. |
|
|
Mn(Ⅲ)-有机酸络合体系的氧化能力受缓冲液、Mn2+浓度和H2O2浓度的影响。如图 5所示,以PeVP的Mn2+最高酶活定义为100%相对酶活,图 5A−5D中的最高绝对酶活分别为10.29、11.18、13.98和17.04 U/mL。通过络合体系优化,确定了PeVP介导的最优的Mn(Ⅲ)-有机酸络合体系:75 mmol/L苹果酸缓冲液(图 5A和图 5B)、6 mmol/L Mn2+(图 5C)和0.2 mmol/L H2O2 (图 5D)。Mn(Ⅲ)-有机酸络合体系的催化活性随着Mn2+浓度的增大而升高,并逐步趋于平缓;在H2O2浓度为0.2 mmol/L时,Mn(Ⅲ)-有机酸络合体系的催化活性显示最高水平,过高的H2O2浓度会抑制Mn(Ⅲ)-有机酸络合体系的催化活性。

|
| 图 5 PeVP介导Mn(Ⅲ)-有机酸络合体系优化 Figure 5 Optimization of Mn(Ⅲ)-organic acid chelate system. A:有机酸缓冲液类型的优化;B:有机酸缓冲液浓度的优化;C:Mn2+浓度优化;D:H2O2浓度优化 A: Optimization of organic acid types; B: Optimization of malic acid concentration; C: Optimization of Mn2+ concentration; D: Optimization of H2O2 concentration. |
|
|
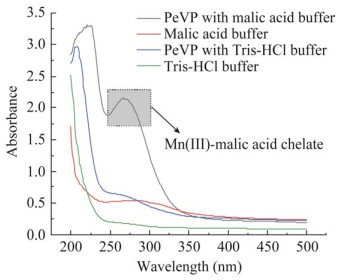
研究选取ABTS、DMP、愈创木酚和丁香醛连氮作为酚类污染物的模式底物,比较了不同pH条件下PeVP重组酶本身的低氧化还原位点及其介导的Mn(Ⅲ)-有机酸络合体系对酚类模式底物的催化能力。如图 6所示,以Mn(Ⅲ)-苹果酸络合体系对每种酚类底物的最高酶活定义为100%相对酶活,Mn(Ⅲ)-苹果酸络合体系对ABTS、DMP、guaiacol和syringaldazine的最高酶活分别为9.74、10.56、5.11和13.63 U/mL。在pH 3.0、添加Mn2+条件下,PeVP介导的Mn(Ⅲ)-苹果酸络合体系的氧化能力略低于PeVP本身亚铁血红素通道对于酚类底物的氧化能力,推测是Mn2+的加入在一定程度上抑制了PeVP的亚铁血红素通道位点的活性;而在pH 4.5、添加Mn2+条件下,Mn(Ⅲ)-苹果酸络合体系的氧化活性可提高至PeVP对酚类底体系直接氧化活性的1.5−7.5倍,说明弱酸环境(pH 4.5)对Mn(Ⅲ)-苹果酸络合体系氧化能力的重要性。未添加Mn2+时,PeVP在强酸性条件(pH 3.0)对4种酚类底物的直接氧化活性高于弱酸性条件,然而PeVP在强酸性条件下的稳定性较差(图 3D),24 h已经失去了全部的催化能力,相比之下酶在弱酸性条件下稳定性较好,48 h仍能保留60%活力以上,展现出较高的Mn2+催化活性。而且在水体污染物处理过程中,弱酸性条件相比强酸性条件更易实现,酶催化氧化可行性更高。因此,在弱酸性条件下(pH 4.5),PeVP介导的Mn(Ⅲ)-苹果酸络合体系相比强酸条件下(pH 3.0) PeVP本身的低氧化还原位点对酚类污染物的降解具有更大的应用价值。
|
| 图 6 Mn(Ⅲ)-苹果酸络合体系对酚类模式底物的氧化 Figure 6 Oxidation of phenolic model compounds by Mn(Ⅲ)-malic acid chelate system under different pH conditions. |
|
|
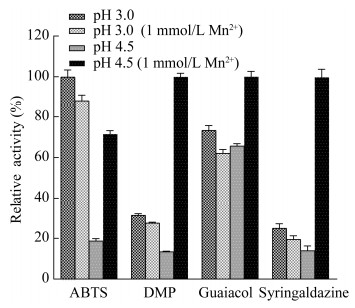
通过酚类模式底物的氧化探究可知,在较稳定的弱酸性环境中(pH 4.5),PeVP介导的Mn(Ⅲ)-有机酸络合体系对酚类污染物的降解具有较大的潜能。为了进一步确定PeVP在较稳定的弱酸性环境中(pH 4.5)对常规酚类污染物的氧化降解能力,以PeVP介导的Mn(Ⅲ)-苹果酸络合物为氧化介质,在pH 4.5的弱酸条件下对苯酚、对硝基苯酚、间苯二酚、对苯二酚4种酚类污染物进行催化氧化。如图 7所示,苯酚、对苯二酚、间苯二酚和对硝基苯酚的平均降解速率分别为10.91、10.69、6.50、5.71 mg/(L·h)。0−4 h内,酚类底物的降解速率较快,随着反应时间的延长,5−16 h酚类污染物的降解速率逐渐变慢,16 h之后已无明显降解现象。
|
| 图 7 Mn(Ⅲ)-苹果酸络合体系对酚类污染物的降解特性 Figure 7 Phenolic pollutants degradation characteristics of Mn(Ⅲ)-malic acid chelate system. |
|
|
目前,酚类污染物的生物降解大部分属于微生物降解[25]。利用矿质盐培养基溶液并以壬基酚为唯一碳源分离得到一株壬基酚高效降解菌NP-1,培养10 d时对壬基酚的降解率是65%,10 d以后基本不再降解[26];从李村河口底泥样品中分离出的两株真菌(W-1和W-2)培养28 d对壬基酚的降解率可达到95%[27]。尽管微生物对酚类物质的降解已取得明显效果,但微生物降解系统仍存在降解反应复杂、降解时间长、降解效率低等问题。辣根过氧化物酶和漆酶等相关酶类在酚类降解方面已取得了明显的效果[28-29],与其他酶类降解体系相比,本研究中PeVP介导的Mn(Ⅲ)-苹果酸络合体系在降解率方面暂未达到漆酶、辣根过氧化物酶的水平,但随着降解体系的进一步优化(加酶量和H2O2补加量),降解率会有所提高。Sun等近期的研究发现,使用亚硫酸氢钠还原高锰酸钾可生成非络合态的可溶性Mn(Ⅲ),在处理有机污染物过程中表现出较高的反应活性[30],而本研究提供了一种新的酚类污染物解决方案:由生物酶(PeVP)介导的Mn(Ⅲ)-苹果酸络合体系对酚类污染物的降解。
本研究成功实现了在较温和的弱酸性条件(pH 4.5)下对酚类污染物的氧化降解。在酚类污染物的降解过程中,Mn(Ⅲ)-苹果酸络合物的形成发挥着至关重要的作用,这一过程发生于PeVP的Mn2+结合催化位点[18],如图 8所示,PeVP、Mn2+、H2O2和苹果酸缓冲液组成了PeVP的催化循环体系,H2O2可以启动反应的发生,在PeVP的催化循环过程中,二价锰离子可以作为电子供体被氧化形成三价锰离子,三价锰离子迅速与溶液中的苹果酸形成Mn(Ⅲ)-苹果酸络合物,该Mn(Ⅲ)-苹果酸络合物具有较高的氧化还原电位,以实现对酚类底物的氧化降解[15, 18]。
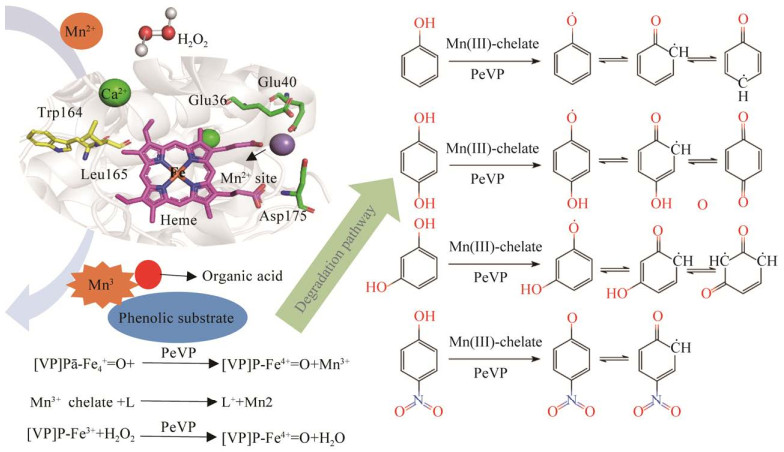
|
| 图 8 Mn(Ⅲ)-有机酸络合体系酚类化合物氧化途径 Figure 8 The oxidation pathway of phenols by Mn(Ⅲ)-organic acid chelate system. P:卟啉环;L:酚类底物 P: Porphyrin ring group; L: Phenolic substrate. |
|
|
漆酶具有能传递电子的铜离子,能将酚类化合物羟基上的电子脱去,使其形成酚氧自由基致使酚类化合物降解,而本研究中PeVP介导生成的Mn(Ⅲ)-苹果酸络合物具有更高的氧化还原电位和更强的传递电子的能力,因此推测Mn(Ⅲ)-苹果酸络合物同样可以夺取酚类污染物上的电子,产生酚氧自由基和苯环碳自由基中间体,一方面自由基中间体可以发生偶联聚合反应,另一方面自由基中间体经过电子重排和C−C键的断裂,可导致酚类物质的氧化降解,产生短链的低分子化合物。主要预测产物包括一些酚类聚合物和酮类、酸类、醛类等小分子断裂产物,与酚类污染物相比,这些降解产物生物毒性大大降低,对环境的污染较小。
如上所述,0−16 h内PeVP介导的Mn(Ⅲ)-有机酸络合体系对苯酚、对苯二酚、间苯二酚和对硝基苯酚这4种酚类污染物的平均降解速率分别为10.91、10.69、6.50、5.71 mg/(L·h)。本文为酚类有机污染物提供了新的生物解决方案及思路,为各种类型的VP和MnP应用于酚类污染物降解研究及筛选具有较强酚类污染物降解能力的Mn(Ⅲ)-有机酸络合体系奠定基础;同时,PeVP介导的Mn(Ⅲ)-苹果酸络合体系对酚类污染物的氧化降解,是由生物酶(PeVP)介导的一种催化剂[Mn(Ⅲ)-苹果酸络合物]所引发的一种催化循环机制,是介于生物酶类降解和化学催化降解之间的一种方法,综合了生物法和化学法的优点,可实现酶的循环利用,同时也避免了化学催化剂降解所造成的二次污染问题。因此,在未来的酚类污染物的降解中,Mn(Ⅲ)-有机酸络合体系将具有很大的应用潜力。
| [1] |
Cheng H, Li Y, Xing JL, Zhang SF, Zheng RX, Ying L, Cao LL, Mao LY. Research progress on detection methods of common phenolic compounds in aquatic products[J]. Journal of Food Safety & Quality, 2020, 11(2): 449-454. (in Chinese) 承海, 李杨, 邢家溧, 张书芬, 郑睿行, 应璐, 曹丽丽, 毛玲燕. 水产品中常见酚类化合物检测方法研究进展[J]. 食品安全质量检测学报, 2020, 11(2): 449-454. |
| [2] |
Zhao H, Ai SY, Ding KY, Hao Y, Sun J, Li JJ. Research progress on the detection of harm of phenolic compounds[J]. Journal of Inspection and Quarantine, 2015, 25(6): 66-68. (in Chinese) 赵晗, 艾仕云, 丁葵英, 郝莹, 孙军, 李建军. 酚类污染物的危害及其检测技术研究进展[J]. 检验检疫学刊, 2015, 25(6): 66-68. |
| [3] |
Tang XW, Jin YH, Zhang YH, Chi T, Qiteng XG. Alkyl pheols in tap water in Shenyang[J]. Journal of Environment and Health, 2005, 22(3): 190-191. (in Chinese) 汤先伟, 金一和, 张颖花, 池田, 齐藤宪光. 沈阳市自来水中的烷基酚类污染物[J]. 环境与健康杂志, 2005, 22(3): 190-191. DOI:10.3969/j.issn.1001-5914.2005.03.010 |
| [4] |
Luo SQ. Experimental study on photodegradation of phenolic organic pollutants in water[D]. Beijing: Master's Thesis of China University of Geosciences, 2017 (in Chinese) 罗舜钦. 环境水中酚类有机污染物的光降解实验研究[D]. 北京: 中国地质大学(北京)硕士学位论文, 2017 |
| [5] |
Liu TS, Jiang YL, Jiang YX, Deng HQ, Sun KF. Toxicity and algal biodegradation of alkylphenol and bisphenol A[J]. Guangdong Chemical Industry, 2021, 48(15): 146-148, 126. (in Chinese) 刘太胜, 姜沄林, 蒋宇霞, 邓瀚锵, 孙凯峰. 烷基酚和双酚A的生物毒性及藻类降解研究进展[J]. 广东化工, 2021, 48(15): 146-148, 126. DOI:10.3969/j.issn.1007-1865.2021.15.056 |
| [6] |
Sun QJ, Yang QZ. The research progress of biodegradation of phenolic pollutants[J]. Guangzhou Chemical Industry, 2013, 41(8): 47-49. (in Chinese) 孙秋谨, 杨亲正. 酚类污染物的生物降解研究进展[J]. 广州化工, 2013, 41(8): 47-49. DOI:10.3969/j.issn.1001-9677.2013.08.017 |
| [7] |
Xie XH, Liu JS, Jiang ZB, Li HN, Ye M, Pan H, Zhu JW, Song HT. The conversion of the nutrient condition alter the phenol degradation pathway by Rhodococcus biphenylivorans B403: a comparative transcriptomic and proteomic approach[J]. Environmental Science and Pollution Research, 2021, 28(40): 56152-56163. DOI:10.1007/s11356-021-14374-8 |
| [8] |
Ouyang K, Xie S, Zhao Y, Wang LC, Fang QH. Catalytic capacity and enzymatic characteristics of immobilized laccase on magnetic Fe3O4/graphene hybrids for bisphenol A degradation[J]. Ecology and Environmental Sciences, 2015, 24(1): 106-112. (in Chinese) 欧阳科, 谢珊, 赵雅, 王雷超, 方琪惠. 磁性Fe3O4/石墨烯异质结固定漆酶特性及其对水中双酚A的降解研究[J]. 生态环境学报, 2015, 24(1): 106-112. |
| [9] |
Yang J, Jiang JC, Zhang N, Xu H, Xie JC, Zhao J. Research progress on lignin degradation by microorganism[J]. Biomass Chemical Engineering, 2021, 55(3): 62-70. (in Chinese) 杨静, 蒋剑春, 张宁, 徐浩, 解静聪, 赵剑. 微生物降解木质素的研究进展[J]. 生物质化学工程, 2021, 55(3): 62-70. DOI:10.3969/j.issn.1673-5854.2021.03.010 |
| [10] |
Hatakka A. Lignin-modifying enzymes from selected white-rot fungi: production and role from in lignin degradation[J]. FEMS Microbiology Reviews, 1994, 13(2/3): 125-135. |
| [11] |
Jeyakumar D, Chirsteen J, Doble M. Synergistic effects of pretreatment and blending on fungi mediated biodegradation of polypropylenes[J]. Bioresource Technology, 2013, 148: 78-85. DOI:10.1016/j.biortech.2013.08.074 |
| [12] |
Zhang Y. Reaction mechanisms of dissolved Mn(Ⅱ) and typical organic contaminants[D]. Hangzhou: Master's Thesis of Zhejiang University of Technology, 2017 (in Chinese) 张亚. 可溶性Mn(Ⅲ)与典型有机污染物作用机理研究[D]. 杭州: 浙江工业大学硕士学位论文, 2017. |
| [13] |
Mohorčič M, Benčina M, Friedrich J, Jerala R. Expression of soluble versatile peroxidase of Bjerkandera adusta in Escherichia coli[J]. Bioresource Technology, 2009, 100(2): 851-858. DOI:10.1016/j.biortech.2008.07.005 |
| [14] |
Pérez-Boada M, Ruiz-Dueñas FJ, Pogni R, Basosi R, Choinowski T, Martínez MJ, Piontek K, Martínez AT. Versatile peroxidase oxidation of high redox potential aromatic compounds: site-directed mutagenesis, spectroscopic and crystallographic investigation of three long-range electron transfer pathways[J]. Journal of Molecular Biology, 2005, 354(2): 385-402. DOI:10.1016/j.jmb.2005.09.047 |
| [15] |
Ruiz-Dueñas FJ, Morales M, Pérez-Boada M, Choinowski T, Martínez MJ, Piontek K, Martínez AT. Manganese oxidation site in Pleurotus eryngii versatile peroxidase: a site-directed mutagenesis, kinetic, and crystallographic study[J]. Biochemistry, 2007, 46(1): 66-77. DOI:10.1021/bi061542h |
| [16] |
Mester T, Field JA. Characterization of a novel manganese peroxidase-lignin peroxidase hybrid isozyme produced by Bjerkandera species strain BOS55 in the absence of manganese[J]. Journal of Biological Chemistry, 1998, 273(25): 15412-15417. DOI:10.1074/jbc.273.25.15412 |
| [17] |
Ruiz-Dueñas FJ, Morales M, García E, Miki Y, Martínez MJ, Martínez AT. Substrate oxidation sites in versatile peroxidase and other basidiomycete peroxidases[J]. Journal of Experimental Botany, 2008, 60(2): 441-452. |
| [18] |
Hofrichter M, Ullrich R, Pecyna MJ, Liers C, Lundell T. New and classic families of secreted fungal heme peroxidases[J]. Applied Microbiology and Biotechnology, 2010, 87(3): 871-897. DOI:10.1007/s00253-010-2633-0 |
| [19] |
Ruiz-Dueñas FJ, Camarero S, Pérez-Boada M, Martínez MJ, Martínez AT. A new versatile peroxidase from Pleurotus[J]. Biochemical Society Transactions, 2001, 29(2): 116-122. DOI:10.1042/bst0290116 |
| [20] |
Wang N, Ren K, Jia R, Chen WT, Sun RR. Expression of a fungal manganese peroxidase in Escherichia coli: a comparison between the soluble and refolded enzymes[J]. BMC Biotechnology, 2016, 16(1): 87. DOI:10.1186/s12896-016-0317-2 |
| [21] |
Song Q, Deng Y, Song RQ. Expression of a Pleurotus ostreatus versatile peroxidase gene in Pichia pastoris and its degradation of corn stover lignin[J]. Journal of Jilin Agricultural University, 2022. (in Chinese) 宋倩, 邓勋, 宋瑞清. 糙皮侧耳多功能过氧化物酶基因异源表达及其对玉米秸秆木质素的降解[J]. 吉林农业大学学报, 2022. |
| [22] |
Ruan GH. Determination of phenol, benzenediol and benzenetriol in water by high performance liquid chromatography[J]. Journal of Environment and Health, 2002, 19(1): 64-65. (in Chinese) 阮国洪. 水中苯酚、苯二酚和苯三酚的高效液相色谱分析方法的研究[J]. 环境与健康杂志, 2002, 19(1): 64-65. DOI:10.3969/j.issn.1001-5914.2002.01.026 |
| [23] |
Eggenreich B, Willim M, Wurm DJ, Herwig C, Spadiut O. Production strategies for active heme-containing peroxidases from E. coli inclusion bodies: a review[J]. Biotechnology Reports, 2016, 10: 75-83. DOI:10.1016/j.btre.2016.03.005 |
| [24] |
Manavalan T, Manavalan A, Heese K. Characterization of lignocellulolytic enzymes from white-rot fungi[J]. Current Microbiology, 2015, 70(4): 485-498. DOI:10.1007/s00284-014-0743-0 |
| [25] |
Cai QQ, Ran XX, Guo NN, Zhang XQ, Tian JW. Construction of a high-efficient phenol degradation bacterial consortium and its application[J]. Contemporary Chemical Industry, 2021, 50(10): 2398-2402. (in Chinese) 蔡倩倩, 冉新新, 郭南南, 张心青, 田杰伟. 苯酚高效降解复合菌的构建及应用研究[J]. 当代化工, 2021, 50(10): 2398-2402. DOI:10.3969/j.issn.1671-0460.2021.10.029 |
| [26] |
Li XC, Liu GF, Ma J, Shao XL. Isolation, identification and biodegradation characteristics of a bacterial strain able to degrade nonylphenol[J]. Environmental Science, 2008, 29(1): 231-236. (in Chinese) 李旭春, 刘桂芳, 马军, 邵晓玲. 1株壬基酚降解菌的分离鉴定及其降解特性研究[J]. 环境科学, 2008, 29(1): 231-236. DOI:10.3321/j.issn:0250-3301.2008.01.039 |
| [27] |
Ma YY. The study of nonylphenol biodegradation by estuary sediment derived fungi from Licun river[D]. Qingdao: Master's Thesis of Ocean University of China, 2013 (in Chinese) 马燕燕. 李村河口底泥来源真菌对壬基酚的降解特性研究[D]. 青岛: 中国海洋大学硕士学位论文, 2013 |
| [28] |
Ning JL, Chen ZL, Wang CY, Xie WJ. Research progress of immobilized laccases for phenolic contaminants degradation in water[J]. Technology of Water Treatment, 2019, 45(2): 13-17. (in Chinese) 宁甲练, 陈志莉, 汪楚依, 谢文静. 固定化漆酶降解水中酚类污染物的研究进展[J]. 水处理技术, 2019, 45(2): 13-17. |
| [29] |
Zhang LH. Applications of horseradish peroxidase in the phenolic wastewater[J]. Journal of Shanxi Datong University: Natural Science Edition, 2012, 28(3): 35-39. (in Chinese) 张丽华. 辣根过氧化物酶在酚类废水中的应用[J]. 山西大同大学学报(自然科学版), 2012, 28(3): 35-39. DOI:10.3969/j.issn.1674-0874.2012.03.012 |
| [30] |
Sun B, Guan XH, Fang JY, Tratnyek PG. Activation of manganese oxidants with bisulfite for enhanced oxidation of organic contaminants: the involvement of Mn(Ⅲ)[J]. Environmental Science & Technology, 2015, 49(20): 12414-12421. |
 2022, Vol. 49
2022, Vol. 49