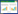扩展功能
文章信息
- 章文波, 杨琼, 廖森泰, 邢东旭, 肖阳, 周东来, 李庆荣
- ZHANG Wenbo, YANG Qiong, LIAO Sentai, XING Dongxu, XIAO Yang, ZHOU Donglai, LI Qingrong
- 一株具有植物促生作用的重金属铅吸附菌的筛选与鉴定
- Screening and identification of a heavy metal lead-adsorbing strain with plant growth-promoting activity
- 微生物学通报, 2022, 49(9): 3617-3630
- Microbiology China, 2022, 49(9): 3617-3630
- DOI: 10.13344/j.microbiol.china.220014
-
文章历史
- 收稿日期: 2021-01-05
- 接受日期: 2022-01-18
- 网络首发日期: 2022-04-15
2. 华南农业大学,广东 广州 510640
2. South China Agricultural University, Guangzhou 510640, Guangdong, China
随着城市化和工业化的发展,城市土壤[1]、农田土壤[2]、水域[3-4]甚至大气中[5]的重金属污染逐渐成为主要的环境污染之一,引起了社会的日益关注。重金属铅在自然环境中滞留时间较长、毒性大且很难被降解,可以通过食物链富集,对人体健康造成长期严重危害,如何高效治理重金属铅污染成为国内外学者们研究的热点之一[6]。重金属污染的修复方法主要包括物理化学法及生物修复法等,其中物理化学修复成本高、能耗大、操作困难且易产生二次污染,而生物技术修复尤其是微生物修复去除重金属污染则是利用微生物对重金属进行吸附、转化和代谢,具有经济、高效、环保、安全的优点,逐渐成为近些年来新兴的修复方法[7-9],筛选开发具有良好修复功能的微生物菌株具有重要的现实意义。
目前,国内外有关重金属耐受性微生物的分离及修复应用越来越受到关注。例如:Chung[10]发现细菌可以固定土壤中的铅;Chen等[11]研究发现用肠杆菌(Enterobacter sp.)强化生物炭固定溶液中Pb2+去除率较生物炭单独处理可提升60.85%。同时,从铅污染水中分离的耐受性菌株还可有效修复污染水体[12]。生物技术处理重金属污染具有广阔前景[13-14]。尽管目前已经报道了许多细菌菌株具有较好的重金属耐受性及钝化修复功能,但是对可以改善污染土壤中植物生长和产量的微生物资源的需求越来越迫切。因此,具有重金属耐受性的植物促生菌株(plant growth promoting bacteria,PGPB)的研究也越来越受到关注[15-19]。Efe[20]从铅锌矿区土壤中分离得到了9株具有不同植物促生特性的细菌菌株,例如吲哚乙酸、铁载体的产生及固氮和溶磷等,并评估了这9个菌株对铅、锌及铜等重金属的抗性。Mesa-Marín等[21]研究了植物促生细菌辅助分枝链霉菌进行重金属修复的效果,认为抗重金属的植物促生菌可以改善分枝链霉菌的能力,增加重金属修复的潜力。研究表明:一方面,PGPB具有溶磷、解钾、产生植物生长素和铁载体等功能,有助于抗重金属植物在贫瘠土壤中生存和生长[22-23];另一方面,PGPB通过增强酶促和非酶促抗氧化剂的合成来对抗植物氧化应激,帮助植物承受外部环境压力和增加植物对重金属的抗性[24-25]。此外,还有部分抗重金属PGPB直接作用于土壤重金属,通过还原重金属或者产生代谢物而形成重金属复合物以降低重金属毒性[26]。抗重金属的植物促生菌在微生物-植物联合修复中具有极其重要的地位。
水产养殖在我国的经济发展中占有重要的地位,但由于过去对经济效益的过度追求,高密度、低成本养殖模式成为水产尤其是名贵鱼种的主要养殖模式,养殖水体环境遭到严重破坏,农残污染、重金属污染严重。本文以污染严重的塘泥为材料,以微生物重金属铅吸附钝化筛选为着手点,分离具有良好重金属铅吸附效率的微生物菌株,并对菌株进行生理生化及分子生物学鉴定,分析其生长及促生功能特性,选择能够促进植物生长和重金属污染土壤植物修复的菌株,以期为生物修复和植物促生防病等综合开发利用提供微生物资源。
1 材料与方法 1.1 材料 1.1.1 样品供试病原菌层出镰刀菌(Fusarium proliferatum)和木贼镰刀菌(Fusarium equiseti)为广东省农业科学院蚕业与农产品加工研究所蚕桑与南药资源利用研究室保存菌种。
1.1.2 培养基无机磷筛选培养基(g/L):葡萄糖10.0,酵母提取物0.5,磷酸钙5.0,硫酸铵0.5,氯化钾0.2,硫酸镁0.1,硫酸锰0.000 1,硫酸亚铁0.000 1。
IAA培养基(g/L):牛肉膏3.0,蛋白胨5.0,NaCl 5.0,色氨酸1.0。
1.1.3 主要试剂和仪器酵母提取物、牛肉浸膏、盐酸金霉素、四环素、恩诺沙星、磺胺和氟苯尼考,麦克林公司;庆大霉素、青霉素、硫酸链霉素、卡那霉素、氯霉素、吲哚乙酸(indole-3-acetic acid,IAA)标准品和1-氨基环丙烷羧酸标准品,Sigma公司;细菌基因组DNA提取试剂盒,湖南艾科瑞生物工程有限公司。
梯度PCR仪,Thermo Fisher Scientific公司;高速冷冻离心机,Sigma公司;火焰原子吸收光谱仪,耶拿公司;紫外分光光度计,岛津公司。
1.2 重金属铅耐受性菌株分离取用2 g塘泥土样于研钵研磨混匀后,取上清液经梯度稀释后,接种于添加150−1 000 mg/L铅浓度的营养琼脂(nutrient agar,NA)培养基上,37 ℃培养48 h,挑取单菌落划线纯化,获得不同的单菌落。分别进行−80 ℃甘油冻存和4 ℃斜面保藏。
1.3 菌株的铅吸附特性测定以1%添加量接种于含Pb2+终浓度150 mg/L的100 mL液体培养基(NB)中,37 ℃、180 r/min振荡培养12−48 h,5 000 r/min离心10 min,取上清液测定Pb2+的浓度。
1.4 菌株生理生化鉴定菌株在营养琼脂固体平板37 ℃恒温培养30 h,记录菌落的大小、颜色、形状、透明度、湿润程度以及表面边缘隆起程度等。
根据《伯杰氏细菌鉴定手册》[27]和《微生物学实验教程》[28],对菌株进行革兰氏染色和芽孢染色、吲哚乙酸产生、甲基红、VP、明胶酶、淀粉酶、苯丙氨酸脱氢酶、氧化氢酶、尿素酶、蛋白水解酶及β-半乳糖苷酶等常规生理生化的特征鉴定。
采用细菌基因组DNA提取试剂盒进行菌株基因组DNA的提取。以提取的DNA作为模板,以细菌的通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492K(5′-GGTTACCTTGTTACGACTT-3′)对菌株的16S rRNA基因进行PCR扩增。1%的琼脂糖凝胶电泳检测。将PCR产物送往华大基因生物科技有限公司进行测序,测序结果在NCBI BLAST进行比对,通过软件MEGA-X进行序列相似性分析,并构建系统发育树。
1.5 菌株生长特性生长曲线的测定:菌株活化后,按1%比例接种到NB液体培养基,37 ℃、180 r/min振荡培养,采用比浊法,每隔2 h利用紫外分光光度计(UV-5100)测定OD600值。以培养时间为横坐标、OD600值为纵坐标绘制菌株生长曲线。
温度、pH、NaCl浓度及不同重金属对菌株生长的影响:分别配制培养基pH 4.0−10.0、NaCl浓度1%−5%的NB液体培养基,并调整培养温度(25−55 ℃)后,进行菌株生长曲线的测定。分析温度、pH和渗透压(NaCl浓度)对菌株SEM-15生长的影响。通过在NB培养基中添加不同浓度的重金属铅、镉、镍等进行梯度驯化,观察菌株的生长状态,分析菌株对不同重金属的耐受性。
1.6 菌株发酵过程中溶解无机磷能力测定将待检测菌株活化后,以1%比例接种于以磷酸钙作为唯一磷源的液体无机磷筛选培养基,37 ℃、180 r/min振荡培养3 d后开始取样,5 000 r/min离心10 min,取上清液检测可溶性磷浓度,直至14 d。实验中的对照菌株为巨大芽孢杆菌GW-1-0201-1305-04,购自广州微元生物科技有限公司,上清液中的磷浓度采用钼锑抗比色法[29]检测。
1.7 菌株发酵过程中IAA分泌水平测定菌株活化后,以1%比例接种于含色氨酸(100 mg/L)的NB培养基中,37 ℃、180 r/min振荡培养,分别在发酵培养的2–13 d取样。发酵液8 000 r/min离心10 min后,取上清液2 mL,加入50 μL 83% (体积分数)的正磷酸和4 mL Salkowski试剂[30],溶液变为粉红色即表示有IAA产生。菌株产生IAA的浓度采用比色法测定,以含色氨酸的无菌NA培养基为对照,测定菌株反应液在535 nm下的吸光值(OD535)。
1.8 菌株对镰刀菌拮抗性能测定采用平板对峙法[31]测定菌株对镰刀菌的拮抗效果。将待检测镰刀菌在PDA培养基上划线后,30 ℃倒置培养5 d待用。将供试菌株接种于NB培养基37 ℃、180 r/min振荡培养过夜。利用打孔器将镰刀菌打孔后,取培养菌体放置PDA培养板中央,在距离2 cm处放置无菌滤纸片,取5 μL活化的供试菌株悬液轻轻滴于滤纸偏上,待吸收后,30 ℃倒置培养。以未进行对峙培养的镰刀菌为对照,观察对峙培养后镰刀菌的生长情况。
1.9 药物敏感试验采用药敏纸片琼脂扩散法[32]检测菌株对不同抗生素的敏感性。将菌株悬液浓度调至约108 CFU/mL,用灭菌镊子依次将终含量为25 μg的青霉素、卡那霉素、氯霉素、链霉素、四环素、金霉素、硫酸庆大霉素、磺胺、恩诺沙星和苯氟尼考10种药敏纸片均匀放置在培养基上,静置一段时间至与培养基紧密相贴,每种抗生素更换镊子避免纸片药品交叉污染。每组设3个平行,接种后37 ℃培养24 h,用直尺测量其抑菌圈。
1.10 数据统计用Excel 2019和Origin 2021对数据、图表进行处理;采用分子生物学软件MEGA-X构建系统发育树。
2 结果与分析 2.1 耐铅菌株的筛选将塘泥梯度稀释后,获得了10株耐受150−300 mg/L Pb2+的菌株,分别编号为Pb1–10。利用原子吸收光谱法测定了各菌株在150 mg/L Pb2+的NB培养基中培养12 h后上清液中残留的Pb2+浓度,通过(对照浓度−残留浓度)/对照浓度×100%计算吸附率,结果如图 1A所示。10个菌株对可溶性Pb2+的吸附率差异较大,其中Pb10吸附钝化效果最好,可达90%以上,将该菌株命名为SEM-15。进一步分析菌株SEM-15接种在含有终浓度150 mg/L Pb2+的NB培养基培养不同时间的铅吸附率(图 1B),发现培养12−24 h达到最高,吸附率达90%以上。
|
| 图 1 菌株对重金属铅的吸附率 Figure 1 Adsorption effect of strains on heavy metal lead. A:不同菌株对培养基中重金属铅的吸附率;B:SEM-15 (Pb10)在150 mg/L的Pb2+浓度下的培养不同时间的铅吸附率 A: Adsorption efficiency of different strains on heavy metal lead in culture medium; B: Adsorption efficiency of the strain SEM-15 (Pb10) cultured at 150 mg/L lead concentration for different times. |
|
|
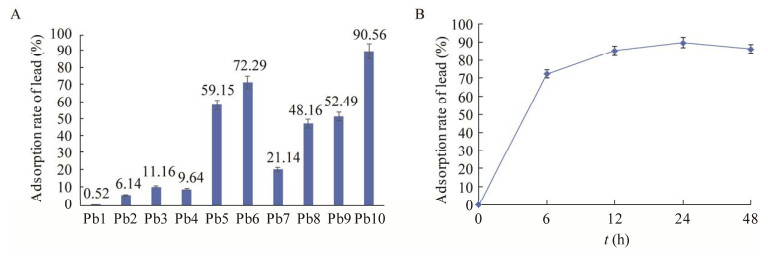
对菌株SEM-15进行了形态学观察、生理生化鉴定及16S rRNA基因分子鉴定,结果见图 2和表 1。菌株SEM-15的菌落形态呈圆形,边缘清晰,表面湿润光滑有光泽,有黏稠感,白色不透明(图 2A);革兰氏染色呈阳性,短直杆状,两端钝圆(图 2B);芽孢呈椭圆形,链状中生,不膨大(图 2C)。生理生化结果如表 1所示,菌株SEM-15为好氧菌,能分解淀粉、利用葡萄糖,甲基红试验、V-P试验、溶菌酶、硝酸盐还原和动力试验等测定结果均呈阳性,苯丙氨酸脱氨酶、尿素酶、β-半乳糖苷酶等试验结果则为阴性。
|
| 图 2 菌株SEM-15的形态鉴定 Figure 2 Morphological identification of the strain SEM-15. A:菌落形态;B:革兰氏染色;C:芽孢染色 A: Colony morphology; B: Grameen staining; C: Spore staining. |
|
|
| 生理生化反应指标 Physiological and biochemical reactions |
SEM-15 | 生理生化反应指标 Physiological and biochemical reactions |
SEM-15 | 生理生化反应指标 Physiological and biochemical reactions |
SEM-15 |
| 甲基红 Methyl red |
+ | 尿素 Urea |
+ | 乙酰葡萄糖胺同化 Acetylglucosamine assimilation |
+ |
| 淀粉水解 Starch hydrolysis |
+ | α葡萄糖苷酶 α-glucosidase |
+ | 麦芽糖同化 Maltose assimilation |
− |
| 葡萄糖 Glucose |
+ | 蛋白水解酶 Proteolytic enzyme |
+ | 葡萄糖酸钾同化 Potassium gluconate assimilation |
− |
| 运动能力 Motility |
+ | β-半乳糖苷酶 β-galactosidase |
− | 羊蜡酸同化 Sheep wax acid assimilation |
− |
| 硝酸盐还原 Nitrate reduction |
+ | 葡萄糖同化 Glucose assimilation |
+ | 己二酸同化 Adipic acid assimilation |
− |
| 溶菌酶 Lysozyme |
+ | 阿拉伯糖同化 Arabinose assimilation |
− | 苹果酸同化 Malic acid assimilation |
+ |
| 精氨酸二水解酶 Arginine dihydrolase |
+ | 甘露糖同化 Mannose assimilation |
− | 枸橼酸钠同化 Sodium citrate assimilation |
+ |
| 苯丙氨酸脱氨酶 Phenylalanine deaminase |
− | 甘露醇同化 Mannitol assimilation |
− | 苯乙酸同化 Phenylacetic acid assimilation |
− |
| V-P test | + | ||||
| Note: +: Positive; –: Negative. | |||||
利用细菌通用16S rRNA基因引物27F/1492R对菌株SEM-15的16S rRNA基因进行PCR扩增测序,利用NCBI-BLAST进行序列比对,发现菌株SEM-15与蜡样芽孢杆菌相似性达99%。采用MEGA-X构建了16S rRNA基因的系统发育树(图 3),该菌株与蜡样芽孢杆菌在同一分支。

|
| 图 3 基于16S rRNA基因序列构建的菌株SEM-15系统发育树 Figure 3 Phylogenetic tree of the stain SEM-15 strain based on 16S rRNA gene sequence. 图中括号内为菌株GenBank登录号;bootstrap次数设置为1 000;分支点上的数字表示bootstrap值;左下角标尺表示5%的序列进化差异 In the figure, the number of in brackets was the GenBank accession number for the strain; the number of bootstrap times was set to 1000; The number on the branch point represented the bootstrap value; The scale in the lower left corner represented 5% sequence evolution difference. |
|
|
基于生理生化鉴定结果和16S rRNA基因序列比对结果综合分析,参照《伯杰氏细菌鉴定手册》[27],初步鉴定该菌株为蜡样芽孢杆菌。
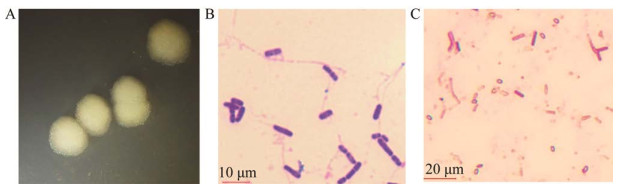
2.3 菌株SEM-15的生长特性通过检测菌株SEM-15不同生长时间的OD600值,分析了不同培养温度、pH及NaCl浓度对菌株SEM-15生长的影响。结果如图 4所示,该菌株具有一定的抗逆适应能力。菌株SEM-15的耐受pH值范围在6.0−10.0,最适生长pH值范围为6.0−8.0,最适生长温度范围为35−45 ℃;在NaCl浓度范围内生长情况显示,1%浓度下菌株的增殖速度最快,随着浓度升高,菌株增殖速度降低,在4%浓度时仍可生长繁殖,但超过该浓度后菌株难以增殖。
|
| 图 4 菌株SEM-15的生长特性分析 Figure 4 Growth characteristics of the strain SEM-15. A:pH;B:温度;C:NaCl浓度 A: pH; B: Temperature; C: NaCl concentration. |
|
|
通过在NA培养基中添加不同浓度的铅、镉、镍等重金属离子梯度驯化后,划线培养,发现菌株SEM-15可以分别在1 000 mg/L铅、20 mg/L镉及200 mg/L镍的环境下正常生长,说明菌株SEM-15具有较好的重金属耐受性。
2.4 菌株SEM-15溶解无机磷能力通过钼锑抗比色法对待检测菌株Pb2、Pb4、Pb5、Pb6、Pb7、Pb8、Pb9及SEM-15的溶解无机磷能力进行分析。结果发现,在以磷酸钙为唯一磷源的无机磷发酵培养基中进行发酵后,Pb2、Pb9及SEM-15这3个菌株在发酵4 d的发酵液中可溶性磷的浓度显著高于对照菌株,而菌株SEM-15的溶解磷酸钙能力最高(图 5A)。进一步测定了菌株SEM-15在发酵3–14 d期间发酵液中可溶性磷的浓度变化趋势。结果发现,在发酵的3–14 d内,发酵液中可溶性磷浓度范围由75 mg/L上升至110 mg/L左右(图 5B),而且随时间增加可溶性磷浓度呈上升趋势。
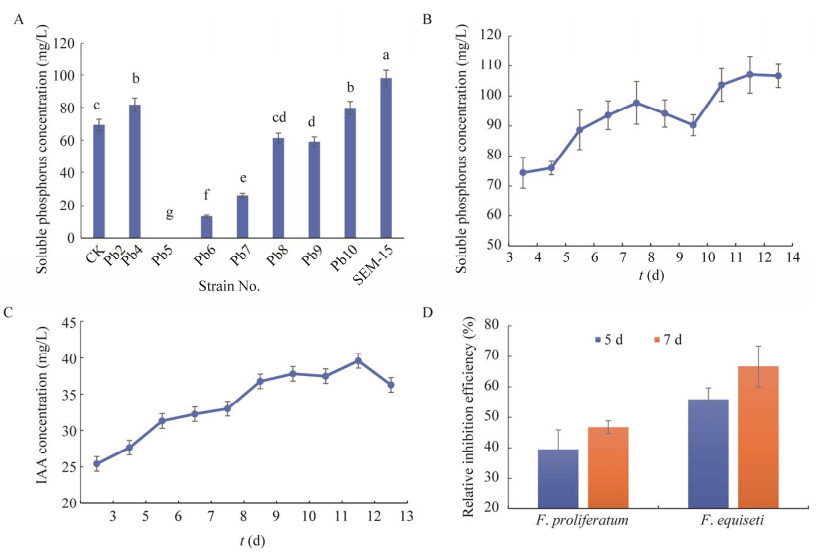
|
| 图 5 菌株溶磷、IAA分泌及拮抗镰刀菌功能分析 Figure 5 Function analysis of phosphorus solubilization, IAA secretion and antagonistic against Fusarium of the strains. A:不同菌株对磷酸钙的溶解能力差异分析,不同小写字母表示差异显著;B、C:菌株SEM-15在不同发酵时间中培养基中的可溶性磷浓度及IAA浓度的变化;D:菌株SEM-15在与镰刀菌对峙培养5−7 d后对镰刀菌菌丝生长的相对抑制效果 A: Difference of calcium phosphate solubilization ability of different strains, in which CK was the control strain of phosphorus solubilizing, and different lowercase letters on the column diagram indicated significant differences at the level of 0.05; B, C: Changes of soluble phosphorus concentration and IAA concentration in the culture medium of strain SEM-15 at different fermentation days; D: Relative inhibition effect of strain SEM-15 on the mycelial growth of Fusarium at the 5th and 7th days after confrontation culture with Fusarium. |
|
|
为进一步分析菌株SEM-15是否具有分泌吲哚乙酸的能力,采用Salkowski试剂定量检测不同发酵时间菌液中的IAA含量。菌株SEM-15在不同发酵时间的IAA分泌结果见图 5C。结果表明从第3天到第12天产生IAA的量不断增加,在第12天时达到了41.83 mg/L,而后趋于平稳。
2.6 菌株SEM-15对镰刀菌的拮抗功能利用平板对峙法分析了菌株SEM-15对镰刀菌的拮抗效果。拮抗结果表明,菌株SEM-15对层出镰刀菌和腐皮镰刀菌抑制效果较为显著。在对峙培养5、7 d测量镰刀菌的菌落半径后计算相对拮抗效率,发现在对峙培养的5−7 d,菌株SEM-15对层出镰刀菌和腐皮镰刀菌都有显著的拮抗效果,并且7 d的拮抗效果好于5 d (图 5D和图 6)。
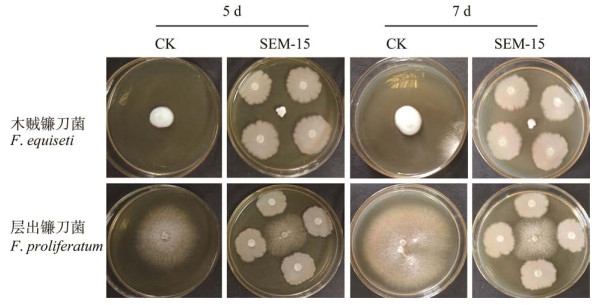
|
| 图 6 对峙培养法检测菌株SEM-15对镰刀菌的拮抗作用 Figure 6 The antagonist effect of strain SEM-15 on Fusarium by confrontation culture. |
|
|
通过药敏纸片琼脂扩散法检测了菌株SEM-15对四环素、金霉素、磺胺、恩诺沙星和苯氟尼考5种常用渔药及青霉素、链霉素、氯霉素、卡那霉素和硫酸庆大霉素5种常见环境污染抗生素的耐受性。结果如表 2所示,菌株SEM-15对青霉素和磺胺不敏感(耐药),对四环素、恩诺沙星、苯氟尼考、链霉素、氯霉素及卡那霉素的抑菌圈直径在16.00 mm以上,表现为敏感;对金霉素和硫酸庆大霉素的抑菌圈直径在10.00−16.00 mm之间,表现为中度敏感(低耐药)。
| 抗生素 Antibiotic | 抑菌圈直径 Diameter of inhibition zone (mm) | 敏感性 Sensitivity |
| 青霉素 Penicillin | 0 | R |
| 卡那霉素 Kanamycin | 22 | S |
| 氯霉素 Chloramphenicol | 16−22 | S |
| 链霉素 Streptomycin | 24 | S |
| 四环素 Tetracycline | 16−18 | S |
| 金霉素 Aureomycin | 12−16 | I |
| 硫酸庆大霉素 Gentamicin sulfate | 15 | I |
| 磺胺 Sulphanilamide | 0 | R |
| 恩诺沙星 Enrofloxacin | 24−28 | S |
| 苯氟尼考 Benflunicol | 24−28 | S |
| 注:DIZ=0 mm则为R,耐药;0 < DIZ≤16 mm则为I,中度敏感;DIZ > 16 mm则为S,高度敏感 Note: DIZ=0 mm, R, drug resistant; 0 < DIZ≤16 mm, I, moderately sensitive; DIZ > 16 mm, S, highly sensitive. | ||
本研究从污染严重的塘泥中筛选出一株生长适应性较强的对重金属铅有较好耐受性及吸附性的菌株SEM-15,通过形态学、生理生化及16S rRNA基因序列综合分析,鉴定其为蜡状芽孢杆菌。菌株SEM-15在1 000 mg/L的Pb2+浓度NA培养基中正常生长,说明菌株SEM-15对铅有很好的耐受性,而在150 mg/L Pb2+浓度下,菌株对重金属铅的吸附率达到90%以上。蜡状芽孢杆菌的重金属修复研究已有报道。阚洪媛等[33]在煤矸石山周围土壤分离的蜡状芽孢杆菌对铅、锌、铬等均有良好的耐受效果;邵云等[34]从铅厂周边麦田筛选到一株对铅有极好耐受性的蜡状芽孢杆菌。从对重金属铅的耐受性来看,上述几株已报道菌株均高于本研究筛选得到的菌株SEM-15,但是上述报道的蜡状芽孢杆菌的功能多体现在单一的重金属抗性及修复功能上,本研究的菌株SEM-15的功能特性还体现为在促进植物生长和病害防治上面具有较好的应用潜力。
研究发现,部分植物促生菌株可以通过IAA的产生、溶磷、解钾、铁载体的产生、ACC脱氨酶活性和固氮作用等促生功能间接促进植物对重金属的修复能力。例如,Efe[20]分离获得了9株对重金属铅有抗性的细菌,其中一株蜡状芽孢杆菌DE-1具有分泌IAA的能力,但是不具有溶磷、固氮及产生铁载体等其他促生功能;Ortiz-Ojeda等[35]筛选出的耐铅镉菌株具有较好的分泌IAA的能力,因环境温度差异,IAA分泌量在0.4−60.6 mg/L之间。Ma等[36]研究发现重金属耐受菌株芽孢杆菌SC2b的最大铅耐受浓度为1 400 mg/L,而且具有解磷(56.6 mg/L)、分泌IAA (64.8 mg/L)及铁载体的功能。Yu等[37]从攀枝花的尾矿土壤中分离获得了100多株细菌,这些菌株对重金属的耐受性不同,具有的促生能力如IAA分泌及铁载体合成等也有较大差异。Abdollahi等[38]从重金属污染的土壤中分离获得了5株具有较好抗重金属铅和铬的菌株,其中一株为蜡状芽孢杆菌,可以耐受3 500 mg/L的铅且对铅的钝化效率在60%左右,并具有溶磷(32.23 μg/mL)、解钾(42.67 μg/mL) 功能,发酵过程中有少量IAA (3.89 μg/mL) 分泌。
在本研究中,菌株SEM-15具有较好的溶解无机磷及分泌吲哚乙酸等功能,因此,可能具有较好的促进植物生长的潜力。通过钼锑抗比色法对不同菌株在以磷酸钙为唯一磷源的培养基中产生的可溶性磷进行检测分析,发现菌株SEM-15溶解无机磷的效率最高,能够达到110 mg/L,高于白变霞等[39]筛选到的蜡状芽孢杆菌CLY07的可溶性磷含量85.43 mg/L,也高于Ma等[36]及Abdollahi等[38]分离的抗重金属铅蜡状芽孢杆菌溶解无机磷的能力。同时该菌株分泌IAA的量最高可以达到41.83 mg/L,高于Abdollahi等[38]获得的5株抗重金属铅和铬的菌株(3–32 mg/L)及徐婧等[40]发现的克雷伯氏菌GMZB-12 (36.88 mg/L),略低于李培根等[41]报道的阿耶波多氏芽孢杆菌(Bacillus aryabhattai) HL379最高IAA产量47.8 mg/L及Ma等[36]发现的芽孢杆菌SC2b的IAA分泌量(64.8 mg/L)。然而,本研究中菌株SEM-15未检测到铁载体及ACC脱氨酶等活性,这也与文献中报道的不同菌株之间植物促生功能和重金属抗性也有较大差异相符。
本研究还利用平板对峙法分析了菌株SEM-15对木贼镰刀菌和腐皮镰刀菌的拮抗效果,发现该菌株对检测的2个病原菌均具有较强的拮抗能力,并且随着对峙培养时间的延长,镰刀菌菌落直接生长抑制率显著增加。对峙培养的第5天对木贼镰刀菌和腐皮镰刀菌的相对菌落直径抑制率分别为39.64%和62.5%,到第7天抑制率则达到了46.46%和69.77%。蜡状芽孢杆菌具有一定的拮抗植物病原菌的功能,在文献中也多有报道[42-44]。李进[42]筛选的一株蜡状芽孢杆菌对多种植物病原菌包括水稻纹枯病及稻曲病病菌等有较好的抑制效果;周京龙[43]也筛选获得的一株棉花内生蜡状芽孢杆菌对棉花的黄萎病具有较好的防治效果;付岗等[44]筛选到7株对香蕉炭疽病有显著抑制效果的菌株,其中蜡状芽孢杆菌Bc6301效果最好。
本研究对菌株SEM-15生长特性的实验结果表明:该菌株最适pH值为6.0−9.0,但是在pH 10.0的环境中菌株仍然生长良好,最适生长温度为35−45 ℃,在55 ℃时生长相对迟缓;可以在1%−4%的NaCl浓度下正常生长,但1%−2%时生长趋势最好。在最适生长条件下,尤其是最适pH和温度条件下,菌体快速达到对数生长期后容易发生聚集沉淀,因此OD600的数据会发生下降。推测原因可能是在对数生长期后,菌量增加快速,菌株分泌物骤增,引发菌体絮集,这种现象在前人的研究中也有报道[45]。杨洲平等[46]将粗毛栓菌和蜡状芽孢杆菌组合成共固定菌,发现能够充分发挥蜡状芽孢杆菌的降解能力,又可以解决蜡状芽孢杆菌的絮集问题。
本研究从污染严重的塘泥中筛选到一株不仅对重金属铅有较好耐受性及吸附效率,而且还具有较好的溶解无机磷、分泌IAA及拮抗镰刀菌等能力的菌,该菌株生长适应性强,可能具有较好的重金属铅污染修复及促生防病的应用潜力,尤其在重金属污染土壤联合植物修复的应用中具有较好的开发价值,但关于该菌株在重金属铅修复中的作用方式、应用技术及其效果评价还需要进一步的研究。
| [1] |
Dietrich M, Krekeler MPS, Kousehlar M, Widom E. Quantification of Pb pollution sources in complex urban environments through a multi-source isotope mixing model based on Pb isotopes in lichens and road sediment[J]. Environmental Pollution, 2021, 288: 117815. DOI:10.1016/j.envpol.2021.117815 |
| [2] |
Huang Y, Wang LY, Wang WJ, Li TQ, He ZL, Yang XE. Current status of agricultural soil pollution by heavy metals in China: a meta-analysis[J]. Science of the Total Environment, 2019, 651: 3034-3042. DOI:10.1016/j.scitotenv.2018.10.185 |
| [3] |
Mao ZL, Zhao HM, Qin ZP. Assessment of Cd–Pb pollution in soils of the youjiang river basin, South China[J]. Eurasian Soil Science, 2020, 53(6): 829-837. DOI:10.1134/S1064229320060150 |
| [4] |
Yan CY, Zhuang T, Bai JH, Wen XJ, Lu QQ, Zhang L. Assessment of As, Cd, Zn, Cu and Pb pollution and toxicity in river wetland sediments and artificial wetland soils affected by urbanization in a Chinese delta[J]. Wetlands, 2020, 40(6): 2799-2809. DOI:10.1007/s13157-020-01330-4 |
| [5] |
Tao ZH, Guo QJ, Wei RF, Dong XY, Han XK, Guo ZB. Atmospheric lead pollution in a typical megacity: evidence from lead isotopes[J]. Science of the Total Environment, 2021, 778: 145810. DOI:10.1016/j.scitotenv.2021.145810 |
| [6] |
Shi Y, Chen YJ. Research status and development direction of contaminated soil bioremediation technology in China[J]. World Sci-Tech R & D, 2017, 39(1): 24-32. (in Chinese) 石扬, 陈沅江. 我国污染土壤生物修复技术研究现状及发展展望[J]. 世界科技研究与发展, 2017, 39(1): 24-32. |
| [7] |
Su QQ, Xu QJ, Ding HJ, Ma S, Li L, Christopher R, Liu X. Microbial phosphate-solubilization and its application in lead-contaminated soils remediation[J]. Environmental Science & Technology, 2020, 43(12): 177-184. (in Chinese) 苏奇倩, 徐其静, 丁豪杰, 马晟, 李林, Rensing Christopher, 刘雪. 微生物解磷特性及其铅污染土壤修复应用[J]. 环境科学与技术, 2020, 43(12): 177-184. |
| [8] |
Sharma P, Pandey AK, Kim SH, Singh SP, Chaturvedi P, Varjani S. Critical review on microbial community during in situ bioremediation of heavy metals from industrial wastewater[J]. Environmental Technology & Innovation, 2021, 24: 101826. |
| [9] |
Li L, Liao ST, Li WM, Xing DX, Luo GQ, Li QR, Ye MQ, Xiao Y, Yang Q. Fingerprint of exhaust gases and database of microbial diversity during silkworm excrement composting[J]. Compost Science & Utilization, 2018, 26(1): 40-51. |
| [10] |
Chung JW. Bacterial-assisted immobilization of lead in soils: Implications to remediation[J]. Pedologist, 2011, 54(3): 162-174. |
| [11] |
Chen HM, Zhang JW, Tang LY, Su M, da Tian, Zhang L, Li Z, Hu SJ. Enhanced Pb immobilization via the combination of biochar and phosphate solubilizing bacteria[J]. Environment International, 2019, 127: 395-401. DOI:10.1016/j.envint.2019.03.068 |
| [12] |
Chatterjee S, Mukherjee A, Sarkar A, Roy P. Bioremediation of lead by lead-resistant microorganisms, isolated from industrial sample[J]. Advances in Bioscience and Biotechnology, 2012, 3(3): 290-295. DOI:10.4236/abb.2012.33041 |
| [13] |
Zhou SQ. Environmental Biotechnology[M]. Beijing: Science Press, 2003: 252-285. (in Chinese) 周少奇. 环境生物技术[M]. 北京: 科学出版社, 2003: 252-285. |
| [14] |
Duan CQ. Environmental Biology[M]. 2nd ed. Beijing: Science Press, 2010: 294-311. (in Chinese) 段昌群. 环境生物学[M]. 2版. 北京: 科学出版社, 2010: 294-311. |
| [15] |
Wenzel WW. Rhizosphere processes and management in plant-assisted bioremediation (phytoremediation) of soils[J]. Plant and Soil, 2009, 321(1/2): 385-408. |
| [16] |
Aafi NE, Brhada F, Dary M, Maltouf AF, Pajuelo E. Rhizostabilization of metals in soils using Lupinus luteus inoculated with the metal resistant rhizobacterium Serratia sp. msmc541[J]. International Journal of Phytoremediation, 2012, 14(3): 261-274. DOI:10.1080/15226514.2011.604693 |
| [17] |
Yang Q, Tu S, Wang G, Liao X, Yan X. Effectiveness of applying arsenate reducing bacteria to enhance arsenic removal from polluted soils by Pteris vittata L.[J]. International Journal of Phytoremediation, 2012, 14(1): 89-99. DOI:10.1080/15226510903567471 |
| [18] |
Tirry N, Joutey NT, Sayel H, Kouchou A, Bahafid W, Asri M, Ghachtouli NE. Screening of plant growth promoting traits in heavy metals resistant bacteria: prospects in phytoremediation[J]. Journal of Genetic Engineering and Biotechnology, 2018, 16(2): 613-619. DOI:10.1016/j.jgeb.2018.06.004 |
| [19] |
Vishnupradeep R, Bruno LB, Taj Z, Karthik C, Challabathula D, Tripti, Kumar A, Freitas H, Rajkumar M. Plant growth promoting bacteria improve growth and phytostabilization potential of Zea mays under chromium and drought stress by altering photosynthetic and antioxidant responses[J]. Environmental Technology & Innovation, 2022, 25: 102154. |
| [20] |
Efe D. Potential plant growth-promoting bacteria with heavy metal resistance[J]. Current Microbiology, 2020, 77(12): 3861-3868. DOI:10.1007/s00284-020-02208-8 |
| [21] |
Mesa-Marín J, Pérez-Romero JA, Redondo-Gómez S, Pajuelo E, Rodríguez-Llorente ID, Mateos-Naranjo E. Impact of plant growth promoting bacteria on Salicornia ramosissima ecophysiology and heavy metal phytoremediation capacity in estuarine soils[J]. Frontiers in Microbiology, 2020, 11: 553018. DOI:10.3389/fmicb.2020.553018 |
| [22] |
Gupta P, Kumar V, Usmani Z, Rani R, Chandra A, Gupta VK. A comparative evaluation towards the potential of Klebsiella sp. and Enterobacter sp. in plant growth promotion, oxidative stress tolerance and chromium uptake in Helianthus annuus (L.)[J]. Journal of Hazardous Materials, 2019, 377: 391-398. DOI:10.1016/j.jhazmat.2019.05.054 |
| [23] |
Sagar S, Dwivedi A, Yadav S, Tripathi M, Kaistha SD. Hexavalent chromium reduction and plant growth promotion by Staphylococcus arlettae strain Cr11[J]. Chemosphere, 2012, 86(8): 847-852. DOI:10.1016/j.chemosphere.2011.11.031 |
| [24] |
Islam F, Yasmeen T, Ali Q, Ali S, Arif MS, Hussain S, Rizvi H. Influence of Pseudomonas aeruginosa as PGPR on oxidative stress tolerance in wheat under Zn stress[J]. Ecotoxicology and Environmental Safety, 2014, 104: 285-293. DOI:10.1016/j.ecoenv.2014.03.008 |
| [25] |
Dahmani MA, Desrut A, Moumen B, Verdon J, Mermouri L, Kacem M, Coutos-Thévenot P, Kaid-Harche M, Bergès T, Vriet C. Unearthing the plant growth-promoting traits of Bacillus megaterium RmBm31, an endophytic bacterium isolated from root nodules of Retama monosperma[J]. Frontiers in Plant Science, 2020, 11: 124. DOI:10.3389/fpls.2020.00124 |
| [26] |
Teng ZD, Shao W, Zhang KY, Huo YQ, Li M. Characterization of phosphate solubilizing bacteria isolated from heavy metal contaminated soils and their potential for lead immobilization[J]. Journal of Environmental Management, 2019, 231: 189-197. |
| [27] |
Buchanan RE, Gibbons NE. Bergey's Manual of Determinative Bacteriology[M]. Institute of Microbiology, Chinese Academy of Sciences, trans. 8th ed. Beijing: Science Press, 1984 (in Chinese) Buchanan RE, Gibbons NE. 伯杰氏细菌鉴定手册[M]. 中国科学院微生物研究所, 译. 8版. 北京: 科学出版社, 1984 |
| [28] |
Xu DQ, Wang YM, Zhou DQ. Microbiology Experiment Course[M]. 4th ed. Beijing: Higher Education Press, 2019. (in Chinese) 徐德强, 王英明, 周德庆. 微生物学实验教程[M]. 4版. 北京: 高等教育出版社, 2019. |
| [29] |
Rice EW, Baird RB, Eaton AD, et al. Standard Methods for the Examination of Water and Wastewater, Phosphates[M]. Washington DC: American Public Health Association, 1995, pp: 150-152
|
| [30] |
Gordon SA, Weber RP. Colorimetric estimation of indoleacetic acid[J]. Plant Physiology, 1951, 26(1): 192-195. DOI:10.1104/pp.26.1.192 |
| [31] |
Wang JC, Sun XX, Luo LH, Liu JP. Isolation and identification of biocontrol bacteria against 4 soil-borne pathogens of mulberry[J]. Science of Sericulture, 2020, 46(1): 31-36. (in Chinese) 王继承, 孙勋勋, 罗龙辉, 刘吉平. 4种桑树土传病原生防细菌的分离与鉴定[J]. 蚕业科学, 2020, 46(1): 31-36. |
| [32] |
Chen R, Zhong MJ, Liu HE, Su K, Wang LY, Chen BT, Xie HQ, Zhang ML, Rao YZ. Screening identification and drug sensitivity test of two marine silt Bacillus strains[J]. Journal of Southern Agriculture, 2018, 49(12): 2551-2558. (in Chinese) 陈蓉, 钟敏娟, 刘洪锷, 苏凯, 王锂韫, 陈宝婷, 谢海琪, 张美玲, 饶颖竹. 两株海洋滩涂淤泥芽孢杆菌的筛选鉴定及药敏试验[J]. 南方农业学报, 2018, 49(12): 2551-2558. DOI:10.3969/j.issn.2095-1191.2018.12.29 |
| [33] |
Kan HY, Yang SX, Sun LL, Yang YW, Tang MZ, Gao Y, Liu ZL, Jia RL. Isolation, identification and adsorption capacity of a strain resistant to lead, zinc and chromium[J]. Microbiology China, 2020, 47(12): 3974-3986. (in Chinese) 阚洪媛, 杨世鑫, 孙梁伦, 杨月伟, 唐美珍, 高燕, 刘振路, 贾婼兰. 一株耐铅、锌、铬菌株的分离鉴定及其吸附能力[J]. 微生物学通报, 2020, 47(12): 3974-3986. |
| [34] |
Shao Y, Hao ZZ, Wang HL, Li XL, Wang WF, Chen JW, Wang JR. Screening of lead resistance strains and their absorption characteristics in wheat field soil[J]. Acta Agriculturae Boreali-Sinica, 2016, 31(6): 199-205. (in Chinese) 邵云, 郝真真, 王海磊, 李向力, 王文斐, 陈静雯, 王敬婼. 麦田土壤中抗铅菌株筛选及其吸附特性的研究[J]. 华北农学报, 2016, 31(6): 199-205. |
| [35] |
Ortiz-Ojeda P, Ogata-Gutiérrez K, Zúñiga-Dávila D. Evaluation of plant growth promoting activity and heavy metal tolerance of psychrotrophic bacteria associated with maca (Lepidium meyenii Walp.) rhizosphere[J]. AIMS Microbiology, 2017, 3(2): 279-292. DOI:10.3934/microbiol.2017.2.279 |
| [36] |
Ma Y, Oliveira RS, Wu L, Luo Y, Rajkumar M, Rocha I, Freitas H. Inoculation with metal-mobilizing plant-growth-promoting rhizobacterium Bacillus sp. SC2b and its role in rhizoremediation[J]. Journal of Toxicology and Environmental Health Part A, 2015, 78(13/14): 931-944. |
| [37] |
Yu XM, Li YM, Zhang C, Liu HY, Liu J, Zheng WW, Kang X, Leng XJ, Zhao K, Gu YF, et al. Culturable heavy metal-resistant and plant growth promoting bacteria in V-Ti magnetite mine tailing soil from Panzhihua, China[J]. PLoS One, 2014, 9(9): e106618. DOI:10.1371/journal.pone.0106618 |
| [38] |
Abdollahi S, Golchin A, Shahryari F. Lead and cadmium-resistant bacterial species isolated from heavy metal-contaminated soils show plant growth-promoting traits[J]. International Microbiology, 2020, 23(4): 625-640. DOI:10.1007/s10123-020-00133-1 |
| [39] |
Bai BX, Chen YB, Ren JH. Study on organophosphate-solubilizing characteristics of Bacillus cereus CLY07[J]. Journal of Southwest Forestry University, 2016, 36(4): 75-81. (in Chinese) 白变霞, 陈艳彬, 任嘉红. 蜡状芽孢杆菌CLY07菌株的解有机磷特性研究[J]. 西南林业大学学报, 2016, 36(4): 75-81. |
| [40] |
Xu J, Shao K, Li DF, Zhou J, Qian W, Qiu YX. Selection, identification of an IAA biosynthesis strain and the optimization of its culture medium[J]. Journal of Suzhou University of Science and Technology: Natural Science Edition, 2018, 35(2): 45-54. (in Chinese) 徐婧, 邵锴, 李东芳, 周捷, 钱玮, 邱业先. 产IAA菌的筛选、鉴定及其培养基的优化[J]. 苏州科技大学学报(自然科学版), 2018, 35(2): 45-54. |
| [41] |
Li PG, Yao YQ, Song JX, Wang TQ, Zhou B, Wang B, Lin RS. Isolation and identification of IAA-producing Bacillus sp. on potato rhizosphere and its growth-promoting effect[J]. Biotechnology Bulletin, 2020, 36(9): 109-116. (in Chinese) 李培根, 要雅倩, 宋吉祥, 王天琪, 周波, 王冰, 林榕姗. 马铃薯根际产IAA芽孢杆菌的分离鉴定及促生效果研究[J]. 生物技术通报, 2020, 36(9): 109-116. |
| [42] |
Li J. Research on inhibition effect of an Bacillus cereus against several important plant pathogenic fungus[D]. Changsha: Master's Thesis of Hunan Agricultural University, 2013 (in Chinese) 李进. 一株蜡状芽孢杆菌(Bacillus cereus)对几种重要植物病原真菌的抑制作用研究[D]. 长沙: 湖南农业大学硕士学位论文, 2013 |
| [43] |
Zhou JL. Biocontrol effect and mechanism of A cotton endophytic bacterium Bacillus cereus against both Verticillium and Fusarium wilts in Gossypium hirsutum[D]. Jingzhou: Master's Thesis of Yangtze University, 2017 (in Chinese) 周京龙. 一株棉花内生蜡状芽孢杆菌对棉花黄、枯萎病的防治作用及机理[D]. 荆州: 长江大学硕士学位论文, 2017 |
| [44] |
Fu G, Ye YF, Wu YG, Du CJ, Yan WH, Pan LF. Identification and control effect on banana anthracnose of seven antagonistic strains[J]. Chinese Journal of Tropical Crops, 2015, 36(2): 358-364. (in Chinese) 付岗, 叶云峰, 吴永官, 杜婵娟, 晏卫红, 潘连富. 7株拮抗菌的鉴定及其对香蕉炭疽病的防治作用[J]. 热带作物学报, 2015, 36(2): 358-364. DOI:10.3969/j.issn.1000-2561.2015.02.023 |
| [45] |
Nomura T, Narahara H, Tokumoto H, Konishi Y. The role of microbial surface properties and extracellular polymer in Lactococcus lactis aggregation[J]. Advanced Powder Technology, 2009, 20(6): 537-541. DOI:10.1016/j.apt.2009.07.003 |
| [46] |
Yang ZP, Chen P, Wang ZY, Hu R, Jing DJ, Huang QM. Lead adsorption by Trametes gallica, Bacillus cereus, and their co-immobilized biomaterial[J]. Chinese Journal of Applied Ecology, 2012, 23(8): 2212-2218. (in Chinese) 杨洲平, 陈平, 王振宇, 胡容, 靖德军, 黄乾明. 粗毛栓菌和蜡状芽孢杆菌及其共固定菌对Pb2+的吸附[J]. 应用生态学报, 2012, 23(8): 2212-2218. |
 2022, Vol. 49
2022, Vol. 49