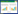扩展功能
文章信息
- 都美婧, 白亚南, 侯金秀, 周昕
- DU Meijing, BAI Ya’nan, HOU Jinxiu, ZHOU Xin
- 磁纳米散射探针暗场超灵敏检测具核梭杆菌
- Ultra-sensitive detection of Fusobacterium nucleatum with magnetic nanoparticle probe in dark-field
- 微生物学通报, 2022, 49(8): 3346-3357
- Microbiology China, 2022, 49(8): 3346-3357
- DOI: 10.13344/j.microbiol.china.211145
-
文章历史
- 收稿日期: 2021-12-02
- 接受日期: 2022-01-24
- 网络首发日期: 2022-02-17
具核梭杆菌(Fusobacterium nucleatum)属于梭杆菌科,是一种革兰氏阴性无芽孢专性厌氧杆菌,为口腔共生菌,可引起人类较严重的感染性口腔疾病[1]。近年来,F. nucleatum引起口腔外的感染性疾病越来越多,包括胃肠道疾病、不良妊娠反应和心血管疾病等[2],尤其是结直肠癌,引起了众多学者的广泛关注[3]。因此,需要一种快速、灵敏、低成本的方法检测F. nucleatum的感染。
随着科学技术的发展,对于F. nucleatum的检测方法也不断增加,目前常用的检测方法主要有细菌的分离培养与鉴定[4-5]、16S rRNA基因测序[6-7]、聚合酶链反应(PCR)[8]、荧光定量PCR (real-time fluorescence quantitative PCR,qPCR)[9-11]、环介导的等温核酸扩增技术(loop- mediated isothermal amplification,LAMP)[12-13]、酶联免疫吸附试验(enzyme-linked immunosorbnent assay,ELISA)[14]等。虽然这些方法已经普遍应用于检测F. nucleatum,但仍然存在费时费力、操作复杂、成本高等缺点,因此亟需一种超灵敏、快速、简单且低成本的方法以满足现场检测。
近年来出现的磁性纳米材料引起人们的广泛关注。磁性纳米材料具有粒径小、分布均匀、良好的磁导性、优良的生物兼容性、低毒性和可以结合各种功能分子等优势,被广泛用于靶向药物、细胞分离、生物检测、肿瘤治疗等生物医学领域,在生物领域和医疗领域具有很大的发展前景[15-17]。磁纳米颗粒表面化学修饰功能基团后,偶联抗体成为特异性探针,可以捕获病原体,在特殊显微镜下进行点样观察[18-20]。
在生物学各领域中,最常用的是普通光学显微镜,根据实验需求不同选择不同的显微镜。暗场显微镜是指光线通过暗场聚光镜斜射到标本上发生散射而对标本进行观察的显微镜。当光线斜射到物体轮廓时发生散射,使得物体的轮廓呈现明亮的形状,在暗背景下可直接识别出物体,而且暗视野的分辨率远高于明视野[21-24]。当纳米材料与病原体结合后,具有强散射光特征的纳米材料聚集在病原体外周,使病原体明亮度提高,从而清晰易辨。目前,基于纳米材料的暗场显微镜成像技术作为实现病原体高灵敏、低背景的检测手段已得到了广泛的应用[25-26]。
本研究基于protein G可以和抗体的Fc段特异性结合的特点,根据细菌大小选择合适的修饰有protein G的磁纳米颗粒(magnetic nanoparticle,MNP),与抗F. nucleatum多克隆抗体结合,制备可特异性标记F. nucleatum的MNP探针。通过制备成功的MNP探针与F. nucleatum共同孵育捕获F. nucleatum,在暗场显微镜下可快速灵敏地检测该菌,以期对防控F. nucleatum引起的疾病提供技术支撑。
1 材料与方法 1.1 材料 1.1.1 菌种和实验动物各种标准菌株:具核梭杆菌(F. nucleatum) ATCC25586,大肠杆菌(Escherichia coli) 2738和金黄色葡萄球菌(Staphylococcus aureus) ATCC44300。SPF级6周龄BALB/c小鼠和C57BL/6J小鼠购自扬州大学实验动物中心。
1.1.2 主要试剂和仪器厌氧产气袋、厌氧培养袋、脑心浸出液肉汤培养基(BHI),青岛海博生物技术有限公司;Protein A+G Agarose (Fast Flow)预装柱、5× SDS-PAGE蛋白上样缓冲液、考马斯亮蓝染色液,上海碧云天生物技术有限公司;磁纳米材料50 nm MNP@protein G,CD公司;10×磷酸盐缓冲液(PBS)、TMB显色试剂盒、蛋白Marker,江苏凯基生物技术股份有限公司;吐温-20,Biosharp公司;10% NCM Fast PAGE聚丙烯酰胺凝胶预混液,新赛美生物科技有限公司;2×Taq Master Mix、DNA Marker、ChamQ Universal SYBR RT-qPCR Master Mix,南京诺唯赞生物科技公司;引物由南京擎科生物有限公司合成;DNA提取试剂盒、质粒DNA小量试剂盒,康宁生命科学(吴江)有限公司。
微量紫外-可见光分光光度计,Implen公司;样品混合器HulaMixerTM,Life Technology公司;蛋白电泳仪、脱色摇床、水平凝胶电泳仪,北京六一生物科技有限公司;Tecani 12透射电子显微镜(transmission electron microscope,TEM),Royal Philips公司;荧光定量PCR仪LightCycler®480-Ⅱ,Roche公司;暗场显微镜,Nikon公司。
1.2 方法 1.2.1 菌株培养F. nucleatum接种于BHI液体培养基置于厌氧培养袋中在37 ℃静置培养8 h;E. coli和S. aureus接种于LB液体培养基中在37 ℃、220 r/min有氧培养8 h。
1.2.2 抗F. nucleatum多克隆抗体的制备与纯化取对数生长期(OD600约为0.6)的F. nucleatum,5 000 r/min离心5 min收集菌体,PBS清洗3次,用0.4%的甲醛溶液灭活48 h后,PBS清洗3次,通过微量紫外-可见光分光光度计用0.9%的生理盐水将浓度调整为1 µg/µL作为免疫原。经皮下多点注射免疫小鼠,每只小鼠注射剂量为100 µg,于第0、14、28天进行3次免疫,三免结束后7 d,通过小鼠尾静脉采血,分离血清后于−80 ℃保存备用。采用ELISA的方法测定小鼠抗体效价,具体步骤以F. nucleatum为抗原包被96孔酶标板,每孔100 µg。封闭后加入稀释的抗血清37 ℃孵育1 h。PBST (0.05% 吐温-20)缓冲液洗3次后加入HRP标记的山羊抗鼠抗体,37 ℃孵育45 min后用TMB显色,于酶标仪测OD450,P/N > 2.1视为阳性结果。采用Protein A+G Agarose (Fast Flow)预装柱进行抗体纯化,使用微量紫外-可见光分光光度计和SDS-PAGE测定纯化后抗体的浓度和纯度,纯化后的抗体于−80 ℃分装保存。
1.2.3 MNP探针的制备50 nm、protein G修饰的MNP探针制备方法如下:吸取20 µL MNP (浓度为1 μg/μL)置于500 µL低吸附离心管中,加入200 µL PBST稀释混匀,磁分离架上静置2 min,弃去上清液,PBST溶液清洗2遍后,用200 µL PBST重悬混匀。再加入2 µL抗F. nucleatum多克隆抗体(1 μg/μL),用样品混合器室温振荡孵育3 h后,利用磁分离架吸附结合的MNP探针,并用适量的PBST清洗3次以除去未结合的抗F. nucleatum多克隆抗体,最后用200 µL PBST重悬探针,振荡混匀后,于4 ℃保存备用。制备的MNP探针通过SDS-PAGE和TEM进行表征。
1.2.4 MNP探针结合F. nucleatum暗场显微镜观察吸取50 µL制备的MNP探针和100 µL F. nucleatum (浓度为1×103 copies/µL)混合于500 µL低吸附离心管中,再加入150 µL的PBST混匀,样品混合器室温振荡孵育30 min后,利用磁分离架弃去上清液,并用适量的PBST清洗3次,100 µL PBS重悬制备样品。
取5 µL样品滴于洁净的载玻片中央,静置5 min后以45°角轻轻推盖上盖玻片,采用暗场显微镜观察样品,同时设置未结合F. nucleatum的MNP探针和F. nucleatum样品作为阴性对照。
为了检测探针标记F. nucleatum的特异性,分别准备探针标记F. nucleatum样品、MNP、探针标记的E. coli溶液(浓度为1×103 copies/µL)混合样品和探针标记的S. aureus溶液(浓度为1×103 copies/µL)混合样品,通过TEM观察各个样品的结合状态。
1.2.5 磁纳米探针-暗场显微计数法检测F. nucleatum的灵敏度利用NCBI Primer-BLAST设计F. nucleatum特异性基因nusG (GenBank登录号AE009951.2)用于qPCR定量检测的引物,正向引物:5′-GGGTCAGAACCAACTCCT ACAA-3′;反向引物:5′-GCTTGAAATGGAAGCTACAAGAG A-3′,目的基因片段的长度为126 bp。将nusG序列及pET28a载体通过限制性内切酶EcoR I、Xho I双酶切,酶切产物通过T4 DNA连接酶进行连接后,得到的连接产物转化到大肠杆菌DH5α感受态细胞中,菌落PCR初步鉴定后进行测序,将阳性结果采用质粒DNA小量试剂盒提取质粒,作为阳性标准质粒。通过NanoDrop 8000测得质粒浓度,换算成质粒拷贝数,将已知拷贝数的重组质粒进行10倍倍比梯度稀释,共稀释5个梯度,以梯度稀释的质粒作为模板进行qPCR检测并绘制标准曲线。分别培养F. nucleatum、E. coli和S. aureus,采用DNA提取试剂盒提取基因组DNA,qPCR检测nusG引物的特异性。根据不同浓度样品进行qPCR后的Ct值绘制标准曲线并计算检测限。
梯度稀释后的F. nucleatum各取5 µL,分别加入制备好的探针工作液20 µL混合于500 µL低吸附离心管中,随后加入200 µL PBST,于样品混合器上室温孵育30 min后,用磁分离架吸附,适量的PBST清洗3次。将制备好的样品涂片于暗场显微镜下进行观察与计数,每个梯度设置3个重复样品,每次观察时随机挑选10个视野(5 µL样品制备的图片面积大约是200个暗场视野)。将其结果与qPCR结果进行对比,验证磁纳米探针-暗场显微计数法的灵敏度、准确性及效率。
1.2.6 F. nucleatum实际样本的检测将6只健康的雌性C57BL/6J小鼠分为实验组(3只)和对照组(3只)。PBS配制浓度为1×108 copies/µL的F. nucleatum溶液,采用灌肠给菌的方式,将1 mL菌液和PBS分别灌注到实验组和对照组小鼠的结直肠内,每周5次,共计8周。PCR鉴定实验组感染F. nucleatum后,取其结直肠组织进行冰浴研磨,直至组织完全破碎。将组织研磨液1 500 r/min离心5 min去除沉淀,然后12 000 r/min离心5 min,弃去上清,沉淀重悬于PBS缓冲液中。采用截留分子量为300 kDa的透析膜透析过夜,收集膜内液体作为待检样本。
取10 µL样本与20 µL制备好的MNP探针混合后置于暗场显微镜下观察。同时将样本与已建立的qPCR方法进行定量检测,与暗场定量结果作对比。
2 结果与分析 2.1 多克隆抗体的纯化结果Protein A+G Agarose (Fast Flow)预装柱纯化血清后,通过微量紫外-可见光分光光度计测得纯化后的抗体浓度约为13.25 µg/µL,SDS- PAGE鉴定纯化后的多克隆抗体在约55 kDa和25 kDa处有蛋白条带,与未纯化的抗血清相比,纯化后的抗血清中杂蛋白明显减少(图 1)。
|
| 图 1 SDS-PAGE鉴定多克隆抗体纯化效果 Figure 1 SDS-PAGE analysis of polyclonal antibody purification effect. M:蛋白Marker;1:纯化后的抗血清;2:未纯化的抗血清 M: Protein Marker; 1: Purified antiserum; 2: Unpurified antiserum. |
|
|
如表 1所示,间接ELISA方法检测抗体血清效价为1:128 000 (P/N > 2.1),表明抗体制备成功。
| 血清稀释度 Serum dilution |
阳性血清 Positive serum (OD450) |
阴性血清 Negative serum (OD450) |
P/N > 2.1 |
| 1:2 000 | 1.951 3 | 0.125 7 | 15.52 |
| 1:4 000 | 1.570 5 | 0.118 9 | 13.21 |
| 1:8 000 | 1.460 2 | 0.123 9 | 11.79 |
| 1:16 000 | 1.141 8 | 0.114 3 | 9.99 |
| 1:32 000 | 0.704 5 | 0.125 6 | 5.61 |
| 1:64 000 | 0.528 5 | 0.123 6 | 4.27 |
| 1:128 000 | 0.335 0 | 0.115 7 | 2.88 |
| 1:256 000 | 0.226 3 | 0.117 8 | 1.92 |
SDS-PAGE结果表明(图 2),在MNP探针样品中有2条带(一条55 kDa的抗体重链条带和一条约20 kDa的抗体轻链条带)。表明MNP与抗体结合,成功制备了MNP探针。

|
| 图 2 MNP探针的SDS-PAGE分析图 Figure 2 SDS-PAGE analysis of prepared MNP probes. M:蛋白Marker;1:20 µL MNP探针;2:2 µg抗体;3:20 µL MNP M: Protein Marker; 1: 20 µL MNP probes; 2: 2 µg antibody; 3: 20 µL MNP. |
|
|
TEM观察结果表明(图 3),与未修饰的MNP相比,MNP探针仍具有良好的分散性,可以用来构建病原体的检测体系。

|
| 图 3 TEM表征MNP探针 Figure 3 TEM of MNP probes. A:MNP;B:MNP探针 A: MNP; B: MNP probes. |
|
|
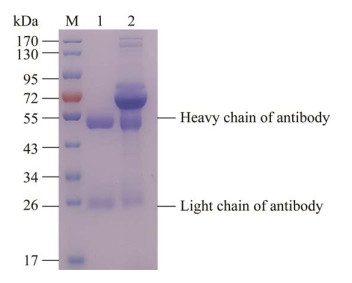
纯的F. nucleatum样品由于散射光弱,在暗场显微镜下则呈现出微亮的梭状结构(图 4A);50 nm的磁纳米颗粒在单分散状态下散射光很弱,暗场显微镜下不易观察到,可能由于团聚会出现发光点(图 4B)。MNP探针与F. nucleatum特异性结合后,探针会紧紧包裹在F. nucleatum周围,在暗场显微镜下会呈现出明亮的金黄色梭状结构(图 4C),明显区别于暗场背景和阴性对照(图 4D)。
|
| 图 4 暗场显微镜表征探针捕获的F. nucleatum Figure 4 Dark field microscope observation of probe capture of F. nucleatum. A:F. nucleatum;B:MNP探针;C:MNP探针结合F. nucleatum;D:MNP与F. nucleatum的混合液 A: F. nucleatum; B: MNP probes; C: MNP probes binded with F. nucleatum; D: MNP mixed with F. nucleatum. |
|
|
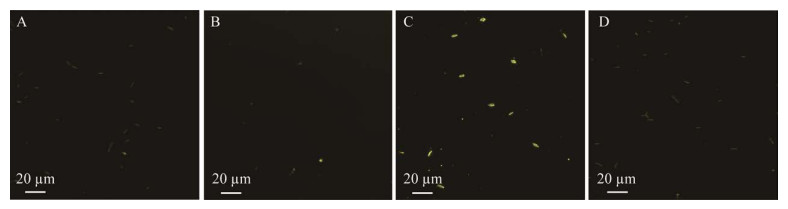
TEM表征结果显示,制备的MNP探针紧紧围绕在F. nucleatum周围(图 5A),而未结合抗体的MNP不能与F. nucleatum结合(图 5B),表明MNP与F. nucleatum不存在特异性吸附现象。将MNP探针与E. coli和S. aureus混合后,可以看到E. coli和S. aureus表面未结合任何探针颗粒,而是散落在菌体周围(图 5C和图 5D)。结果表明,制备的MNP探针可以特异性结合F. nucleatum。
|
| 图 5 TEM表征MNP探针的特异性 Figure 5 TEM images for specificity of MNP probes. A:MNP探针结合F. nucleatum样品;B:MNP与F. nucleatum混合;C:MNP探针与E. coli混合;D:MNP探针与S. aureus混合 A: MNP probes binded with F. nucleatum; B: MNP mixed with F. nucleatum; C: MNP probes mixed with E. coli; D: MNP probes mixed with S. aureus. |
|
|
以F. nucleatum和阴性对照组E. coli、S. aureus细菌基因组DNA为模板进行qPCR检测,结果显示仅F. nucleatum组有扩增(图 6A),有且仅有1个特异性吸收峰(图 6B),表明引物特异性好。通过NanoDrop 8000测得质粒核酸浓度,换算成质粒拷贝数为3.54×1010 copies/µL,10倍倍比梯度稀释5组,即3.54×104−3.54×108 copies/µL进行qPCR。由图 6C所示,各种梯度的扩增曲线为标准的“S”型,Ct值随着质粒浓度的降低而升高。通过计算得到标准曲线方程Y=–3.373X+ 42.77,相关系数R2=0.998 2 (图 6D),表明标准曲线线性关系良好。结果表明构建的qPCR检测体系有很高的特异性。
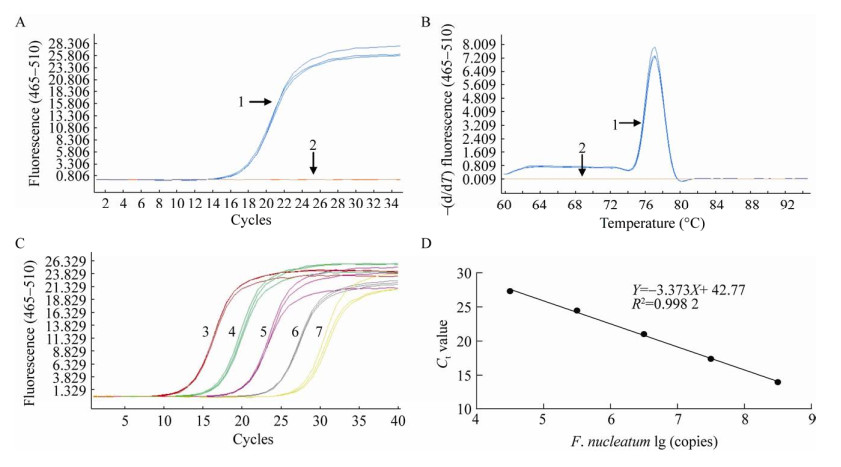
|
| 图 6 qPCR标准曲线的构建 Figure 6 Construction of qPCR standard curve. A:F. nucleatum、E. coli和S. aureus的扩增曲线;B:F. nucleatum、E. coli和S. aureus的溶解曲线;C:F. nucleatum基因的扩增曲线;D:F. nucleatum的标准曲线。1:F. nucleatum基因组;2:E. coli和S. aureus基因组(两条曲线重合);3−7:质粒浓度依次为3.54×108、3.54×107、3.54×106、3.54×105、3.54×104 copies/µL A: Amplification curve of F. nucleatum, E. coli and S. aureus; B: High resolution solution curve of F. nucleatum, E. coli and S. aureus; C: Amplification curve of F. nucleatum gene; D: Standard curve of F. nucleatum. 1: F. nucleatum genome; 2: E. coli genome and S. aureus genome; The plasmid concentrations of 3−7 were: 3.54×108, 3.54×107, 3.54×106, 3.54×105, 3.54×104 copies/µL. |
|
|
将F. nucleatum样品及10倍倍比梯度稀释后的F. nucleatum样品以1 µL为模板,通过建立的qPCR进行定量检测,得到Ct值代入标准曲线方程,计算得出F. nucleatum样品的DNA浓度为2.14×109 copies/µL。经计算发现在拷贝数为2.14×104 copies及以下时,通过标准曲线代入Ct值计算得出的样品浓度与实际浓度有显著差异(图 7A)。接下来将已知浓度的F. nucleatum样品梯度稀释,当样品浓度为3.42×101 copies/µL时,样品结果的Ct值与阴性对照(Ct > 35)无差异。结果表明qPCR的检测限约为1.71×102 copies/µL (图 7B)。
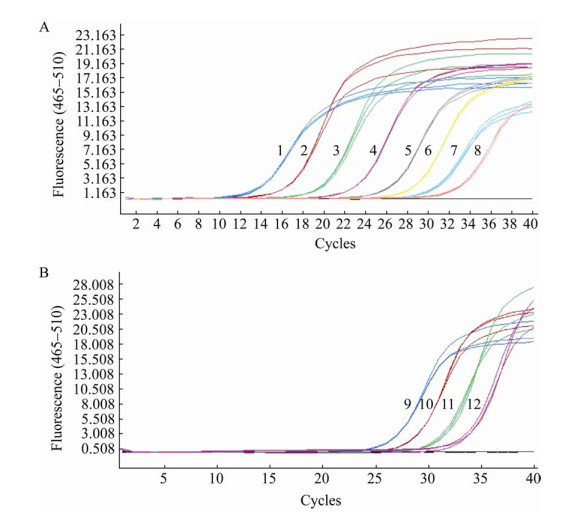
|
| 图 7 不同浓度F. nucleatum的qPCR扩增曲线 Figure 7 Amplification curves of qPCR with different concentrations of F. nucleatum. A:1−8:F. nucleatum样品10倍倍比梯度稀释浓度依次为:2.14×109、2.14×108、2.14×107、2.14×106、2.14×105、2.14×104、2.14×103和2.14×102 copies/µL;B:9−13:F. nucleatum浓度依次为:2.14×104、4.28×103、8.56×102、1.71×102和3.42×101 copies/µL A: The concentrations of 1−8 F. nucleatum: 2.14×109, 2.14×108, 2.14×107, 2.14×106, 2.14×105, 2.14×104, 2.14×103, 2.14×102 copies/µL; B: The concentrations of 9−13 F. nucleatum: 2.14×104, 4.28×103, 8.56×102, 1.71×102, 3.42×101 copies/µL. |
|
|
采用磁纳米探针-暗场显微计数法检测F. nucleatum溶液,暗场结果显示随着菌体浓度越来越低,暗场显微镜下观察到明亮的梭形结构数量越来越少。结果表明,当菌体溶度为4.28×103 copies/µL (图 8A)、8.56×102 copies/µL (图 8B)和1.71×102 copies/µL (图 8C)时,视野中会出现许多明亮的单分散梭形结构,通过计数发现其数量明显随着浓度变小而变少;当菌体溶度为3.42×101 copies/µL时(图 8D),在一定视野内也会出现单个明亮的梭形结构,而且与实际计数结果无明显差异。因此,磁纳米探针-暗场显微计数法的检测限为3.42×101 copies/µL。
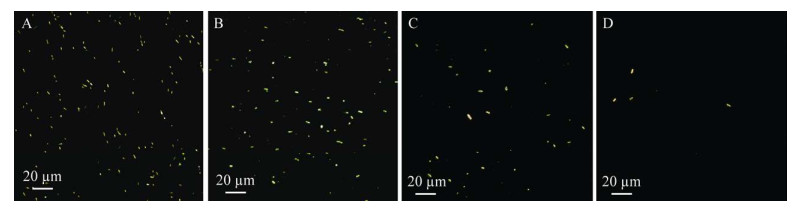
|
| 图 8 不同浓度F. nucleatum与MNP探针结合的暗场显微镜观察 Figure 8 Representative dark-field images of F. nucleatum at four concentrations. A: The F. nucleatum of 4.28×103 copies/µL; B: The F. nucleatum of 8.56×102 copies/µL; C: The F. nucleatum of 1.71×102 copies/µL; D: The F. nucleatum of 3.42×101 copies/µL. |
|
|
通过2种方法对3个重复样品进行计数,表 2结果表明在F. nucleatum样品浓度极低时(低于4.28×103 copies/µL),磁纳米探针-暗场显微计数法相对qPCR方法误差较低、准确性更高,具有一定优势。
| Sample No. | Number of qPCR (copies/µL) | Number of MNP-labeled dark-field count (copies/µL) | |||||||
| 2# | 3# | 4# | 5# | 2# | 3# | 4# | 5# | ||
| Theoretical concentration | 4.28×103 | 8.56×102 | 1.71×102 | 3.42×101 | 4.28×103 | 8.56×102 | 1.71×102 | 3.42×101 | |
| No. 1 | 4 265 | 1 175 | 282 | − | 4 329 | 879 | 178 | 35 | |
| No. 2 | 5 495 | 1 047 | 229 | − | 4 258 | 867 | 165 | 42 | |
| No. 3 | 4 466 | 1 122 | 268 | − | 4 423 | 886 | 182 | 38 | |
| Mean | 4 742 | 1 114 | 259 | − | 4 336 | 877 | 175 | 38 | |
| Standard deviation | 538 | 52 | 22 | − | 67 | 8 | 7 | 3 | |
| 注:2#:4.28×103 copies/µL F. nucleatum;3#:8.56×102 copies/µL F. nucleatum;4#:1.71×102 copies/µL F. nucleatum;5#:3.42×101 copies/µL F. nucleatum。−:Ct > 35结果忽略不计 Note: 2#: The F. nucleatum of 4.28×103 copies/µL; 3#: The F. nucleatum of 8.56×102 copies/µL; 4#: The F. nucleatum of 1.71×102 copies/µL; 5#: The F. nucleatum of 3.42×101 copies/µL; −: Ct > 35, results ignored. |
|||||||||
经PCR鉴定小鼠感染F. nucleatum后,通过MNP探针结合暗场显微镜定量检测样本中的F. nucleatum。结果显示,实验组的样本在暗场显微镜下可以清楚地看到明亮的梭状结构(图 9A),而对照组看不到(图 9B)。本研究建立的方法对实际样本的计数结果与qPCR对比显示,2种方法的检测结果保持一致(表 3),证明了磁纳米探针法应用于实际样本检测的可行性和准确性。

|
| 图 9 暗场显微镜下观察探针捕获实际样本中的F. nucleatum Figure 9 Detection of F. nucleatum by MNP probe-based counting strategy dark-field images of MNP probes F. nucleatum capture in real samples. A:实验组样本;B:对照组样本 A: Experimental samples; B: Control samples. |
|
|
| Samples | Number of MNP-labeled dark-field count (copies/µL) | Number of qPCR (copies/µL) |
| Sample No. 1 | 857 | 870 |
| Sample No. 2 | 1 193 | 1 230 |
| Sample No. 3 | 1 175 | 1 122 |
| Control | − | − |
| Note:−: No detected. | ||
早期发现病原体是预防医学的一个重要问题。由于厌氧菌难以培养,其检测方法很长时间一直未受到应有的关注。近年来,F. nucleatum作为一种厌氧的机会致病菌,其检测手段引起了广泛的关注。然而,传统的检测方法操作烦琐、耗时长、成本高、专业性强且容易出现假阳性的结果。
Chen等[27]利用金纳米颗粒在暗场显微镜下的光散射特性,对肺炎衣原体进行肉眼计数,结果证实金纳米颗粒标记的暗场计数策略快速方便且灵敏度高。Xu等[28]提出了一种基于暗场显微镜的单纳米颗粒识别与统计分析相结合的方法,用于检测样品中超灵敏生物毒素,结果表明该检测方法简单高效。因此,在本研究中,我们提出了一种MNP标记的暗场计数法来准确定量F. nucleatum,通过在暗场显微镜下用肉眼观察到梭状结构,以识别单个F. nucleatum。
F. nucleatum的TEM表征结果显示病原体大小在5−10 µm之间,通过对粒径大小及材料属性的筛选,最终选择了适用于标记F. nucleatum的50 nm的磁纳米颗粒,该纳米材料具有良好的分散性,在暗场显微镜下可以产生强烈的光散射,方便观察梭状结构并计数。其表面预修饰有protein G,利用protein G与抗体的Fc区域特异性结合这一特征,可以与制备的抗F. nucleatum多克隆抗体结合,制备特异性识别F. nucleatum的MNP探针。此外,MNP探针需要有较高的特异性和稳定性,才能在暗场视野中观察到明亮的梭状结构。通过SDS-PAGE结果并结合灰度值对比,20 µL MNP粒子可以结合1 µg抗体分子,MNP探针能够达到高特异性和稳定性要求。
MNP探针-暗场显微计数方法的灵敏度理论上可以达到1 copies/10 µL,但考虑到实际检测的便利性,本研究中检测限为3.42×101 copies/µL,而且可以计数到4.28×103 copies/µL左右,无需稀释即可覆盖大量的F. nucleatum样品。因此,本研究的检测方法对F. nucleatum的检测是一种有效的计数技术。为了证明本研究方法的灵敏度,与传统的qPCR检测方法进行了比较。结果显示,qPCR的检测限为1.71×102 copies/µL,而MNP探针-暗场显微计数方法的检测限为3.42×101 copies/µL,比qPCR方法的灵敏度高5倍左右。通过对真实样本的检测,本研究所建立的方法也表现出良好的准确性。这种新型的检测方法具有灵敏度高、操作简单、检测快速(仅需要30 min)、对设备要求低(只需要一台便携式显微镜)且不需要专业人员操作等优点,有可能成为一种通用平台,用于现场检测各种大小从数百纳米到微米的病原体。
综上所述,本研究通过纳米散射探针暗场超灵敏检测技术方法的优化,建立了MNP探针-暗场显微计数方法高灵敏度、高效率、检测快速,对于指导疑似F. nucleatum引起疾病的现场检测和相关疾病的临床检测具有重要意义,但仍存在一定的问题,需要进一步完善。
| [1] |
Han YW, Shi W, Huang GT, Kinder Haake S, Park NH, Kuramitsu H, Genco RJ. Interactions between periodontal bacteria and human oral epithelial cells: Fusobacterium nucleatum adheres to and invades epithelial cells[J]. Infecton and Immunity, 2000, 68(6): 3140-3146. DOI:10.1128/IAI.68.6.3140-3146.2000 |
| [2] |
Han YW. Fusobacterium nucleatum: a commensal- turned pathogen[J]. Current Opinion Microbiology, 2015, 23: 141-147. DOI:10.1016/j.mib.2014.11.013 |
| [3] |
Castellarin M, Warren RL, Freeman JD, Dreolini L, Krzywinski M, Strauss J, Barnes R, Watson P, Allen-Vercoe E, Moore RA, et al. Fusobacterium nucleatum infection is prevalent in human colorectal carcinoma[J]. Genome Research, 2012, 22(2): 299-306. DOI:10.1101/gr.126516.111 |
| [4] |
Brazier JS, Citron DM, Goldstein EJ. A selective medium for Fusobacterium spp.[J]. The Journal of Applied Bacteriology, 1991, 71(4): 343-346. DOI:10.1111/j.1365-2672.1991.tb03798.x |
| [5] |
Walker CB, Ratliff D, Muller D, Mandell R, Socransky SS. Medium for selective isolation of Fusobacterium nucleatum from human periodontal pockets[J]. Journal of Clinical Microbiology, 1979, 10(6): 844-849. DOI:10.1128/jcm.10.6.844-849.1979 |
| [6] |
Burns MB, Lynch J, Starr TK, Knights D, Blekhman R. Virulence genes are a signature of the microbiome in the colorectal tumor microenvironment[J]. Genome Medicine, 2015, 7(1): 55. DOI:10.1186/s13073-015-0177-8 |
| [7] |
Amitay EL, Werner S, Vital M, Pieper DH, Höfler D, Gierse IJ, Butt J, Balavarca Y, Cuk K, Brenner H. Fusobacterium and colorectal cancer: causal factor or passenger? results from a large colorectal cancer screening study[J]. Carcinogenesis, 2017, 38(8): 781-788. DOI:10.1093/carcin/bgx053 |
| [8] |
Feng Q, Liang SS, Jia HJ, Stadlmayr A, Tang L, Lan Z, Zhang D, Xia H, Xu X, Jie Z, et al. Gut microbiome development along the colorectal adenoma-carcinoma sequence[J]. Nature Communications, 2015, 6: 6528. DOI:10.1038/ncomms7528 |
| [9] |
Tahara T, Yamamoto E, Suzuki H, Maruyama R, Chung W, Garriga J, Jelinek J, Yamano HO, Sugai T, An B, et al. Fusobacterium in colonic flora and molecular features of colorectal carcinoma[J]. Cancer Research, 2014, 74(5): 1311-1318. DOI:10.1158/0008-5472.CAN-13-1865 |
| [10] |
Nosho K, Sukawa Y, Adachi Y, Ito M, Mitsuhashi K, Kurihara H, Kanno S, Yamamoto I, Ishigami K, Igarashi H, et al. Association of Fusobacterium nucleatum with immunity and molecular alterations in colorectal cancer[J]. World Journal of Gastroenterology, 2016, 22(2): 557-566. DOI:10.3748/wjg.v22.i2.557 |
| [11] |
Mehta RS, Nishihara R, Cao Y, Song M, Mima K, Qian ZR, Nowak JA, Kosumi K, Hamada T, Masugi Y, et al. Association of dietary patterns with risk of colorectal cancer subtypes classified by Fusobacterium nucleatum in tumor tissue[J]. JAMA Oncology, 2017, 3(7): 921-927. DOI:10.1001/jamaoncol.2016.6374 |
| [12] |
Notomi T, Okayama H, Masubuchi H, Yonekawa T, Watanabe K, Amino N, Hase T. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): e63. DOI:10.1093/nar/28.12.e63 |
| [13] |
Huang S, Yang Z, Zou DY, Dong D, Liu A, Liu W, Huang L. Rapid detection of nusG and fadA in Fusobacterium nucleatum by loop-mediated isothermal amplification[J]. Journal of Medical Microbiology, 2016, 65(8): 760-769. DOI:10.1099/jmm.0.000300 |
| [14] |
Wang HF, Li LF, Guo SH, Zeng QY, Ning F, Liu WL, Zhang G. Evaluation of antibody level against Fusobacterium nucleatum in the serological diagnosis of colorectal cancer[J]. Scientific Reports, 2016, 6: 33440. DOI:10.1038/srep33440 |
| [15] |
Moayeri A, Darvishi M, Amraei M. Homing of super paramagnetic iron oxide nanoparticles (SPIONs) labeled adipose-derived stem cells by magnetic attraction in a rat model of Parkinson's disease[J]. International Journal of Nanomedicine, 2020, 15: 1297-1308. DOI:10.2147/IJN.S238266 |
| [16] |
Moghimi H, Zohdiaghdam R, Riahialam N, Behrouzkia Z. The assessment of toxicity characteristics of cellular uptake of paramagnetic nanoparticles as a new magnetic resonance imaging contrast agent[J]. Iranian Journal of Pharmaceutical Research, 2019, 18(4): 2083-2092. |
| [17] |
Mokkath JH. Size and chemical order dependence of magnetic-ordering temperature and spin structure in Fe@Ni and Ni@Fe core-shell nanoparticles[J]. Physical Chemistry Chemical Physics, 2020, 22(11): 6275-6281. DOI:10.1039/C9CP06905D |
| [18] |
Niemirowicz-Laskowska K, Mystkowska J, Łysik D, Chmielewska S, Tokajuk G, Misztalewska-Turkowicz I, Wilczewska AZ, Bucki R. Antimicrobial and physicochemical properties of artificial saliva formulations supplemented with Core-Shell magnetic nanoparticles[J]. International Journal of Molecular Sciences, 2020, 21(6): 1979. DOI:10.3390/ijms21061979 |
| [19] |
Papaparaskeva G, Dinev MM, Krasia-Christoforou T, Turcu R, Porav SA, Balanean F, Socoliuc V. White magnetic paper with zero remanence based on electrospun cellulose microfibers doped with iron oxide nanoparticles[J]. Nanomaterials, 2020, 10(3): 517. DOI:10.3390/nano10030517 |
| [20] |
Parsian M, Mutlu P, Yalcin S, Gunduz U. Characterization of gemcitabine loaded polyhydroxybutyrate coated magnetic nanoparticles for targeted drug delivery[J]. Anti-Cancer Agents in Medicinal Chemistry, 2020, 20(10): 1233-1240. DOI:10.2174/1871520620666200310091026 |
| [21] |
Liu X, Huang Y, Kang JU. Dark-field illuminated reflectance fiber bundle endoscopic microscope[J]. Journal of Biomedical Optics, 2011, 16(4): 046003. DOI:10.1117/1.3560298 |
| [22] |
Liu MM, Chao J, Deng SH, Wang K, Li K, Fan CH. Dark-field microscopy in imaging of plasmon resonant nanoparticles[J]. Colloids and Surfaces B, Biointerfaces, 2014, 124: 111-117. DOI:10.1016/j.colsurfb.2014.06.001 |
| [23] |
Hu M, Novo C, Funston A, Wang HN, Staleva H, Zou SL, Mulvaney P, Xia YN, Hartland GV. Dark-field microscopy studies of single metal nanoparticles: understanding the factors that influence the linewidth of the localized surface plasmon resonance[J]. Journal of Materials Chemistry, 2008, 18(17): 1949-1960. DOI:10.1039/b714759g |
| [24] |
Kuhlmann AV, Houel J, Brunner D, Ludwig A, Reuter D, Wieck AD, Warburton RJ. A dark-field microscope for background-free detection of resonance fluorescence from single semiconductor quantum dots operating in a set-and-forget mode[J]. Review of Scientific Instruments, 2013, 84(7): 073905. DOI:10.1063/1.4813879 |
| [25] |
Lei G, He Y. Applications of single plasmonic nanoparticles in biochemical analysis and bioimaging[J]. Acta Physico-Chimica Sinica, 2018, 34(1): 11-21. (in Chinese) 雷刚, 何彦. 单个等离子体纳米颗粒在生化分析和生物成像中的应用[J]. 物理化学学报, 2018, 34(1): 11-21. |
| [26] |
Hao JR. Synthesis of composite nanomaterials and applications in chemical detection based on single molecule imaging[D]. Changsha: Master's Thesis of Hunan University, 2014 (in Chinese). 郝锦蕊. 复合纳米材料的合成及单分子成像技术在化学检测中的应用研究[D]. 长沙: 湖南大学硕士学位论文, 2014 |
| [27] |
Chen FL, Di T, Yang CT, Zhang TY, Thierry B, Zhou X. Naked-eye enumeration of single Chlamydia pneumoniae based on light scattering of gold nanoparticle probe[J]. ACS Sensors, 2020, 5(4): 1140-1148. DOI:10.1021/acssensors.0c00150 |
| [28] |
Xu SH, Guo LH, Chen LF, Luo F, Qiu B, Lin ZY. Dark field microscope-based single nanoparticle identification coupled with statistical analysis for ultrasensitive biotoxin detection in complex sample matrix[J]. Microchimica Acta, 2020, 187(7): 1-9. |
 2022, Vol. 49
2022, Vol. 49