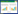扩展功能
文章信息
- 焦诗雨, 李旭东, 张婷婷, 马磊
- JIAO Shiyu, LI Xudong, ZHANG Tingting, MA Lei
- 一株羽毛针禾内生细菌的鉴定、功能及促生特性
- Identification, functions, and growth-promoting characteristics of an endophytic bacterium from Stipagrostis pennata
- 微生物学通报, 2022, 49(8): 3179-3191
- Microbiology China, 2022, 49(8): 3179-3191
- DOI: 10.13344/j.microbiol.china.211135
-
文章历史
- 收稿日期: 2021-11-30
- 接受日期: 2022-01-19
- 网络首发日期: 2022-03-31
羽毛针禾(Stipagrostis pennata)为禾本科芦竹亚科针禾属植物(Stipagrosits Nees),是多年生草本,常形成草丛,呈辐射状排列[1],集中繁殖分布于荒漠地带。由于其生长环境常年干燥、降水量少,风蚀严重且土地沙质化程度高[2],所以羽毛针禾有耐干燥、耐暴风侵蚀、耐沙土掩埋等沙漠适应性特点,可促进流沙的固定和改善沙漠土壤成分[3]。羽毛针禾被广泛誉为古尔班通古特沙漠流动、半流动沙地中重要的“先锋”植物,对荒漠等极端环境中优势群落的生物演替进程具有很重要的促进意义[4]。近年来,羽毛针禾因具有耐盐碱、耐干旱、抗逆性强等独特的适应性,在荒漠化治理和生态恢复等方面发挥重要作用而受到广泛的关注[5]。
植株内生细菌一般是指长期与健康植株或植物组织共存或寄生,不致病却可以和植株建立某种互利共存关系的细菌[6]。内生细菌在与宿主植物共同生长的协同进化过程中,逐渐地进化出一些与宿主相似度极高的物质特征,可提高植物在极端环境下的生存率并促进植株生长[7-8]。例如,从极端生境植物披碱草中分离出一株内生真菌LQ1230,制成菌剂施加后小麦发芽率剧增,改善了小麦幼苗的生长状况,显著增加了小麦幼苗的植株高度、根部长度、叶片宽度等指标,缓解了干旱对小麦幼苗根系的不良影响[9]。但是,关于羽毛针禾种子内生菌促生特性的研究却鲜有报道。
本研究从羽毛针禾种子中分离筛选得到一株内生细菌Z1,首先对其进行了初步鉴定,而后分别对其产吲哚乙酸(indole-3-acetic acid,IAA)、解磷、解钾、产铁载体功能进行了分析;对菌株生长培养基发酵条件进行选择优化,最后通过盆栽小麦幼苗试验验证菌株的促生效果。本研究旨在以植物-微生物互作关系为切入点,探究特殊生境下植物内生菌的特性,以期发掘能够增强宿主抗逆性和促进植物生长的植物内生菌,为荒漠生态环境的改善及土地沙化的治理提供研究思路。
1 材料与方法 1.1 材料 1.1.1 样品采集在新疆地区古尔班通古特沙漠收集健康无病害的羽毛针禾种子,装入无菌塑料袋,然后冷藏带回实验室并于12−24 h内完成种子内生菌的分离。
供试小麦为津农6号小麦,由石河子大学农学院李诚教授惠赠。
1.1.2 培养基含有机磷和无机磷的选择培养基[10]用于解磷功能菌的筛选,钾长石作为钾源的培养基用于筛选解钾功能菌[11],铬天青(chrome-azurol S,CAS)检测培养基用于产铁载体菌的筛选[12]。
1.1.3 主要试剂和仪器革兰氏染色试剂,北京索莱宝科技有限公司;双氧水,山东利尔康医疗科技股份有限公司;明胶粉,上海祥瑞生物科技有限公司;氯化钠,天津市致远化学试剂有限公司;甲基红指示剂,国药集团化学试剂有限公司;肌酸,尿素,国药集团化学试剂有限公司。
超净工作台,上海尚道仪器制造有限公司;高压灭菌锅,浙江新丰医疗器械有限公司;高速离心机,广州吉迪仪器有限公司;电子秤,上海浦春计量仪器有限公司、低速离心机,广州吉迪仪器有限公司、分光光度计,上海菁华科技有限公司。
1.2 方法 1.2.1 内生细菌的分离纯化将不同样地的羽毛针禾种子混合,称取4 g,装入干净的烧杯中,用无菌水搅拌清洗5遍,立即用75%酒精对小麦种子进行消毒,时长6 min。无菌烧杯中倒入无菌水用无菌玻璃棒搅拌清洗种子3遍,沥干水分放进无菌台,用紫外灭菌灯照射30 min以上。将无菌清水注入无菌烧杯中搅拌冲洗至1 min后,将清水倒净并反复3遍,将洗涤后的种子放入75%乙醇溶液中,在超净操作台中静置约5 min,倒掉无水乙醇;再向烧杯内倒入2%次氯酸钠溶液淹没种子,静置3 min;倒掉消毒液后,用无菌水将种子搅拌清洗6−8次保留最后一次清洗液,用于后续消毒检验。将彻底灭菌过的种子加无菌水研磨。
取研磨后液体和无菌水按1:10的比例混合成10%溶液,用稀释涂布平板法在37 ℃恒温培养箱对细菌进行培养,待菌落长出再用无菌接种环划线培养纯化细菌,分出单个菌并进行编号。
1.2.2 Z1菌株的形态学及生理生化指标鉴定(1) 菌落形态鉴定
用无菌接种环挑取单菌落至细菌液体培养基,37 ℃、180 r/min摇瓶培养到对数期(OD600约为1.0),使用无菌水将发酵液稀释1×1017倍,涂布到牛肉膏蛋白胨固体培养基上,待平板有菌落长成便可观察细菌菌落的形态。
(2) 革兰氏染色
以金黄色葡萄球菌为阳性对照,以大肠杆菌感染为阴性对照,取载玻片一张,滴3滴菌液,于酒精灯明火上固化后,首先用草酸铵结晶紫将细菌侵染60 s,用蒸馏水洗涤,碘液复染60 s,再洗涤,95%的乙醇重新洗涤20 s,再用番红复染1 min,用光学显微镜油镜观察结果。
(3) 菌体形态
用透射电子显微镜(transmission electron microscope,TEM)进一步观察细菌菌体形态结构。
(4) 生理生化指标鉴定
以金黄色葡萄球菌为阳性对照、大肠杆菌为阴性对照,将通过细菌纯化试验的Z1细菌菌株进行活化培养,37 ℃、180 r/min振荡培养24 h至对数期(OD600约为1.0),无菌接种环挑取单菌落,对照《常见细菌鉴定手册》[13]中鉴定细菌的试验方法对种子中内生细菌进行生理生化特性方面的详细鉴定。
1) 靛基质试验:挑取单菌落接入含蛋白胨的培养基,37 ℃、180 r/min培养48 h,细菌可将蛋白胨分解成吲哚,与显色剂混合反应阳性成红色,阴性为黄色。
2) 甲基红试验方法:用无菌接种环挑取单菌落,再转接于细菌营养液体培养基中,在37 ℃条件下180 r/min培养48 h后,用胶头滴管加指示剂数滴(甲基红),结果阳性显鲜红,阴性显淡黄或深黄色。
3) 氧化酶试验:选择洁净的滤纸片,蘸取少许菌苔,然后滴加反应试剂,细菌在与化学试剂接触后10 s内变为暗紫色溶液为阳性,无色为阴性。
4) 淀粉水解试验:用接种环,挑取待测菌的菌落后转接于淀粉肉汤液态培养基,经37 ℃、180 r/min摇瓶培养2 d,取2 mL的培养菌液于玻璃试管中,用胶头滴管滴加一滴碘液于试管中,观察试验现象,反应液无颜色变化为阳性,液体颜色为蓝色则为阴性。
5) V-P实验:用接种环挑取待测菌的菌落后转接于淀粉肉汤液态培养基,经37 ℃、180 r/min培养细菌48 h,随后将菌悬液和40% NaOH水溶液按1:1的配比均匀,并加入少许肌酸溶液,等反应大约10 min后,若反应液为红色则为阳性结果。
6) 明胶液化试验:将试验细菌接入37 ℃液化后的明胶培养基中,在37 ℃培养箱培养2 d,培养后将反应液放入4 ℃冰箱静置30 min后取出。明胶凝固为阴性,明胶不凝固则为阳性。
7) 尿素分解试验:将细菌接入液体尿素培养基中,37 ℃、180 r/min摇瓶培养18−24 h,取反应液2 mL于试管中,滴加一滴酚红指示剂,观察结果变红为阳性,不变红为阴性。
8) 触酶试验:取一张洁净载玻片,将试验所用细菌点接入H2O2水珠,立刻观察反应。形成的大量气泡的为阳性,完全没有气泡产生为阴性。
1.2.3 Z1菌株的分子鉴定采用菌落PCR的方法扩增菌株的16S rRNA基因片段(引物fD1:5′-AGAGTTTGATCC TGGCTCAG-3′;引物rP2:5′-ACGGCTACCTTG TTACGACTT-3′)。将扩增后的PCR产物送华大基因技术公司检测。将序列检测结果通过检索NCBI数据库查找相似序列,使用MEGA 7.0软件建立系统发育树。
1.2.4 Z1菌株的功能鉴定IAA测定:使用比色法[14]定性检测细菌产IAA的能力。将细菌菌悬液用移液枪按2%接种量接入含有L-色氨酸底物的液体细菌培养基,在37 ℃、180 r/min摇床培养条件下培养4 d,将培养液10 000 r/min离心10 min,取高速离心后的Z1细菌的上清液与试验所用的比色液试剂按照1:1比例混合(1 mL 0.5 mol/L FeCl3与49 mL 35% HClO4混匀),摇晃试管使液体充分混匀,放入暗箱反应30 min,对照则用无菌水与比色液混合,观察试验结果,红色、微红均为阳性,不变色则为阴性。
解有机磷测定:采用透明圈法[15],在解磷功能选择培养基上接种Z1细菌的菌株,并放置在28 ℃恒温培养箱培养4 d,当解磷选择培养基上的细菌菌落边缘有透明圈出现,则该细菌菌株存在解有机磷的能力,每组试验做3次重复。
解无机磷的试验方法:在无机磷培养基上用接种环点接细菌菌株,放于28 ℃的恒温培养箱中培养4 d后观察,如果在无机磷培养基上有细菌菌落形成,则该菌株存在解无机磷的能力,每组试验设置3次重复。
解钾试验方法:将已纯化的细菌用平板划线法接种在含有钾长石的选择培养固体培养基上,然后放入37 ℃的恒温培养箱中培养4 d,每天定时观察。若培养基表面有菌落生长,则试验菌具有解钾能力。
分泌铁载体:首先应用CAS检测平板法,在每块CAS检测平板上点接菌株,经28 ℃培养5 d,再观察菌体周围有无形成橙色晕圈,如形成了橙色晕圈则该菌株已具备了分泌铁载体的能力。
1.2.5 Z1菌株发酵条件优化Z1菌株生长曲线的测定:将细菌用无菌接种环挑取一环接到液体细胞培养基中,放入摇床中以37 ℃、180 r/min培育至对数期(OD600约为1.0),再取2%的发酵液接种上述细胞培养基,按上述方法传代培养细菌3代以上,在第4代细菌摇瓶培育期时每隔2 h采样4 mL,并测发酵液在600 nm波长的吸光度。将横坐标设定为时间,将纵坐标设定为吸收光度,制作Z1菌株的生长曲线。
初始pH对Z1细菌生长与发育的处理试验:将细菌液体培养基的pH值依次调至6.0、7.0、8.0和9.0这4个分散变化梯度,按2%的接种量接入细菌种子液,37 ℃、180 r/min振荡培养细菌至对数期(OD600约为1.0),再取4 mL的Z1菌发酵液,用紫外分光光度计测其OD600值,每组试验至少3次重复。
几种碳源的培养基均以加入10 g/L蛋白胨和2 g/L氯化钠为基础培养基,再分别以5 g/L可溶性淀粉、麦芽糖、乳糖作为碳源进行试验,试验对照组设置为不加碳源的培养基,调pH值为7.2−7.4。以2 g/L的接种剂量及37 ℃、180 r/min振荡培养细菌至对数期(OD600约为1.0),再取出4 mL发酵液用紫外分光光度计测其OD600值,每组试验至少3次重复。
不同的氮源培养基一般以先添加5 g/L蔗糖和2 g/L氯化钠溶液作为基础培养基,然后分别以10 g/L蛋白胨、硫酸铵和尿素作为氮源,无氮源作为对照,调pH值为7.2−7.4。按2%的接种量接入细菌种子液,37 ℃、180 r/min振荡培养至对数期(OD600约为1.0),取4 mL发酵液测其OD600值,每组试验至少3次重复。
不同的无机盐培养基均以加入10 g/L蛋白胨和5 g/L蔗糖作为基础培养基,分别加2 g/L氯化钠、碳酸钙、硫酸镁为无机盐,试验对照组设置为不加无机盐的培养基,调pH值为7.2−7.4。按2%的接种剂量接入细胞种子液,37 ℃、180 r/min振荡培养细菌至对数期(OD600约为1.0),再取出4 mL发酵液用紫外分光光度计测其OD600值,每组试验至少3次重复。
1.2.6 接种Z1菌株对小麦幼苗的影响盆栽试验:按2%的接种量将细菌种子液接入牛肉膏蛋白胨液体培养基中,37 ℃、180 r/min振荡培养至对数期(OD600约为1.0),将细菌发酵液装入30 mL离心管中,6 000 r/min离心5 min。将沉淀用无菌盐水制成菌细胞悬液(OD600约为1.0,约1.0×108 CFU/mL),用灭菌蒸馏水浸渍约10 h,将浸渍后的小麦种子加少许灭菌蒸馏水,放入恒压栽培箱中避光处理约16 h,种子萌动后将其栽入装含沙量60%的无菌土料的花盆中,以30粒每盆,每天浇灭菌蒸馏水100 mL,隔天再浇灌细菌悬液100 mL,以灭菌蒸馏水为对照组,如此反复3次;10 d后测其株高、根长度、叶长度[16]、叶片叶绿素(采用乙醇提取比色法)[17]、叶片氮含量(采用凯氏定氮法)[18]和可溶性蛋白质浓度(使用考马斯G-250法)[19]。
1.3 数据分析数据整理与分析采用SPSS和MEGA,绘图采用Origin、R等软件。
2 结果与分析 2.1 Z1菌株鉴定和特性分析结果 2.1.1 形态学和生理生化鉴定结果通过细菌培养、纯化,从羽毛针禾种子中分离得到一株内生细菌Z1。该菌菌落为黄色偏乳白色,呈圆形,中间部分微微隆起,边缘稍微褶皱,灯下光滑且湿润。光学显微镜检呈直杆状,大小为(0.5−1.0) μm×(1.0−3.0) μm,属革兰氏阳性杆菌且带鞭毛(图 1)。Z1在甲基红(methylred)测试中表现为阴性,在靛基质(indole)试验、氧化酶(oxidase)试验、淀粉水解试验、V-P试验和明胶液化试验中都表现为阳性(表 1)。
|
| 图 1 Z1细菌的形态学鉴定 Figure 1 Morphological identification of Z1 bacteria. A:Z1菌落形态特征;B:Z1革兰氏染色光学照片(1 000×);C:单个菌体形态的电镜照片;D:多个菌体形态的电镜照片 A: Colony morphological characteristics; B: Z1 Gram stain optical photo (1 000×); C: Electron micrograph of single cell morphology; D: Electron micrographs of multiple cells morphology. |
|
|
| 试验名称 Test names |
试验现象 Experimental phenomenon |
试验结果 Results |
| 革兰氏染色Gram staining test | 菌体呈紫色The cell is purple | + |
| 靛基质试验Imdole test | 反应液呈红色The reaction solution is red | + |
| 甲基红试验Methylred test | 反应液呈红色The reaction solution is red | − |
| 氧化酶试验Oxidase test | 反应液呈紫色The reaction solution is purple | + |
| 淀粉水解试验Starch hydrolysis test | 无颜色变化No color change | + |
| V-P试验V-P test | 培养液呈红色The culture medium is red | + |
| 明胶液化试验Gelatin test | 培养基4度呈液态The medium is liquid at 4 degrees | + |
| 尿素分解实验Urea decomposition test | 酚红指示剂未变红Phenol red indicator does not turn red | − |
| 触酶试验Contact enzyme test | 有气泡Bubble | + |
| Note: +: Positive, −: Negative | ||
通过比对NCBI数据库,Z1菌株属于泛菌属(Pantoea)。系统发育树显示,菌株Z1与成团泛菌(Pantoea agglomerans)亲缘关系较近。结合细菌形态学特征与其他生理生化结果,以及对16S rRNA基因的分子生物学分析,最终确认菌株Z1属于泛菌属(Pantoea)(图 2)。

|
| 图 2 待测菌株和参比菌株基于16S rRNA基因序列的系统发育树 Figure 2 The neighbor-joining phylogenetic tree based on 16 rRNA gene sequences of the tested strains and their closely related reference strains. 括号中序号为GenBank的登录号;基于1 000次重复的50%的bootstrap值标记于分支点处;标尺0.005表示0.5%的核苷酸差异 The serial number in brackets is the login number of GenBank; The bootstrap value ≥50% based on 1 000 repetitions is marked at the branch point; Scale 0.005 represents a nucleotide difference of 0.5%. |
|
|
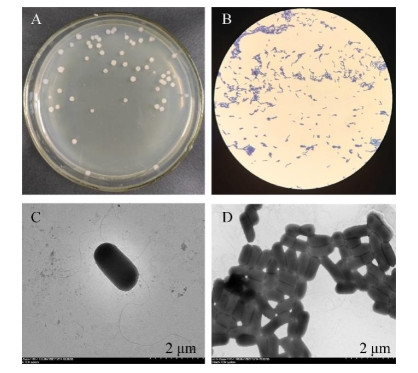
在解有机磷选择培养基平板和解无机磷选择培养基平板上,Z1菌株菌落附近都能形成透明圈,表明Z1菌株同时存在解有机磷和无机磷的能力(图 3A和3B)。用CAS检测平板法检查发现菌体周围有橙色晕圈的存在,表明细菌Z1具有产生铁载体物质的能力(图 3C)。菌株Z1能在解钾活性的试验培养基——硅酸盐培养基上生长,因而菌株Z1具有解钾能力(图 3D)。
|
| 图 3 Z1菌株在解有机磷、解无机磷、产铁载体、解钾培养基的生长表现和产IAA的试验现象 Figure 3 Growth performance and IAA production of strain Z1 in organic phosphorus, inorganic phosphorus, iron carrier and potassium medium. A:解有机磷培养基;B:解无机磷培养基;C:产铁载体培养基;D:解钾培养基;E:产IAA情况 A: Hydrolyzed organic phosphorus medium; B: Hydrolyzed in organic phosphorus medium; C: Iron producing carrier medium; D: Potassium dissolving medium; E: IAA auxin production. |
|
|
含Salkowski试剂的试管中,添加Z1菌株发酵液上清液的试管呈浑浊微粉红,未加Z1菌株发酵液上清液的试管清澈呈黄色,此现象说明Z1具有分泌IAA的能力,使用分光光度计通过对IAA定量检测发现,Z1菌株产IAA能力高达3.14 mg/L (图 3E)。
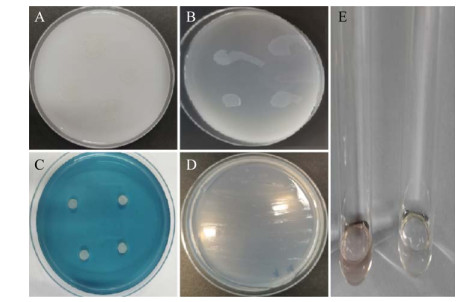
2.1.4 Z1菌株生长曲线由菌株Z1生长曲线图(图 4)得知,0点为细菌菌株生长起始点,摇瓶培养2 h后细菌进入对数期,随后生物量开始迅速增长,培养8 h后细菌生长缓慢,进入平台期。
|
| 图 4 Z1菌株生长曲线 Figure 4 Growth carve of strain Z1. |
|
|
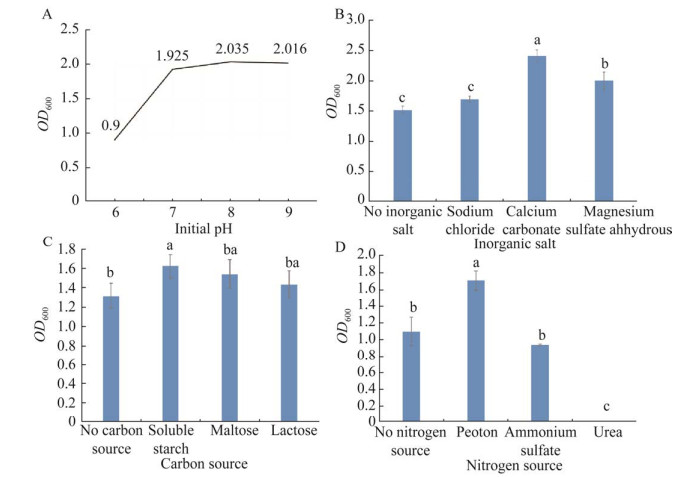
Z1菌株在试验所设置的4组酸碱条件下都能生长,生物量在pH 6.0时最低,并随pH值的增加而增加,在pH 9.0时,生物量达到峰值,为2.016,说明菌株Z1喜弱碱环境(图 5A)。
|
| 图 5 Z1菌株发酵条件的优化 Figure 5 Optimization of fermentation conditions of strain Z1. A:初始pH值对Z1生长发育的影响;B:各种水溶无机盐对Z1生长发育的影响;C:不同碳源对Z1生长发育的影响;D:不同氮源对Z1生长的影响。图中组间的差异显著用不同小写字母来表示(P < 0.05),误差棒代表偏离平均值±标准误,下同 A: The effect of initial pH value on the growth and development of Z1; B: The effect of various water-soluble inorganic salts on the growth and development of Z1; C: The effect of different carbon sources on the growth and development of Z1; D: The effect of different nitrogen sources on the growth level of Z1. The difference between the groups in the figure is significantly represented by different lowercase letters (P < 0.05), and the error bar represents a standard error deviating from the mean value, the same below. |
|
|
添加4种无机盐培养基对菌株生长的影响也各不相同。添加碳酸钙所培养产生的细菌生物量最高,而且与无无机盐对照组存在显著性差异,即在试验所用4种水溶性无机盐中碳酸钙为最适无机盐,其次是硫酸镁;添加NaCl的细菌生物量水平则稍高于对照组,而且与对照组比较无显著性差异(图 5B)。
当在缺少碳源培养基中加入可溶性淀粉时,菌株Z1的生物量较对照组有显著差异且达到了最大值,说明可溶性淀粉是几组试验中培养基碳源的最佳选择。不仅如此,加入麦芽糖时生物量位列第二,加入乳糖时位列第三,它们之间无显著性差异(图 5C)。
以蛋白胨为氮源的作用效果最好且与对照组有显著差异,所以蛋白胨为最适氮源。其中硫酸铵、尿素则显著低于对照(图 5D)。
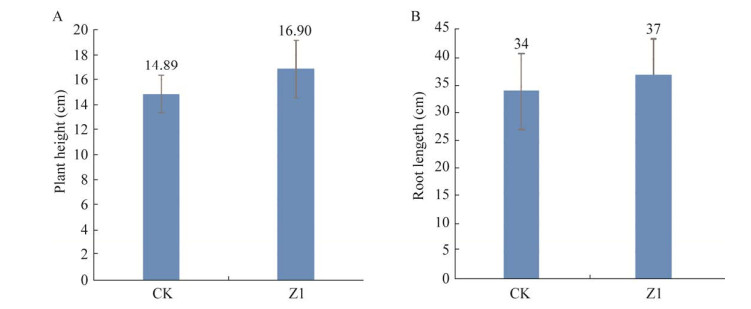
2.3 Z1菌株对小麦的促生效果分析 2.3.1 Z1菌株对小麦的促生效果分析接种菌株Z1至小麦幼苗生长后10 d以内,与对照组比较,株高和根长分别提高了13.5% (图 6A)和8.0% (图 6B),说明菌株Z1对小麦幼苗具有较显著的促进生长效果,而且对小麦株高的促生作用更明显。
|
| 图 6 接种菌株Z1处理对小麦幼苗株高(A)和对根长(B)的影响 Figure 6 Effect of strain Z1 on plant height (A) and root length (B) of wheat seedlings. |
|
|
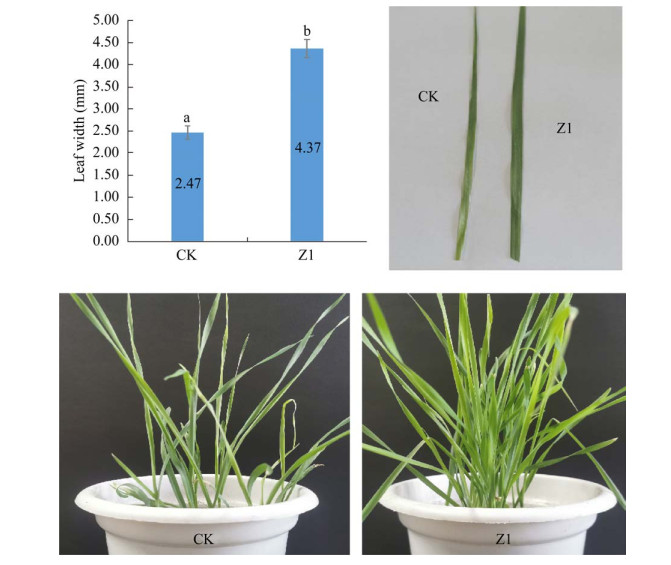
接种菌株Z1 10 d后,小麦幼苗的叶宽与对照组相比增加了60% (图 7),是未接菌对照组的近2倍,而且盆栽小麦整体长势较好,叶片分布较为均匀,小麦苗叶片的颜色也更深,说明菌株Z1对小麦幼苗有非常明显的促进生长的作用,具体体现在可显著增加其幼苗叶片的宽度。
|
| 图 7 接种菌株Z1处理对盆栽小麦幼苗叶宽的影响 Figure 7 Effect of inoculation strain Z1 on leaf width of potted wheat seedlings. |
|
|
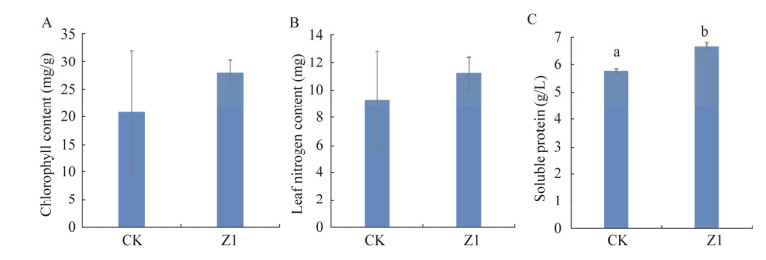
从盆栽小麦叶片中的叶绿素含量、氮含量、可溶性蛋白含量来看,浇灌菌组均较浇灌灭菌蒸馏水组(CK)大量增加,其中,加菌组叶绿素含量较未加菌对照组提高了34%,叶片氮含量提高了21%,叶片可溶性蛋白含量提高了15.7%,而且与对照组有显著性差异(图 8)。
|
| 图 8 接种菌株Z1对盆栽小麦幼苗生理指标的影响 Figure 8 Effects of strain Z1 on physiological indexes of potted wheat seedlings. A:盆栽小麦叶片叶绿素的含量(mg/g);B:盆栽小麦叶片含氮量;C:盆栽小麦叶片可溶性蛋白的含量 A: Chlorophyll content of wheat seedling leaves; B: Nitrogen content in leaves of wheat seedlings; C: Content of soluble protein in leaves of wheat seedlings. |
|
|
气候干燥、水资源稀缺等的恶劣生存环境,导致沙漠地区植被极其稀少,沙漠周围土地沙化愈演愈烈,沙漠土地面积也在不断扩张。如何开发沙漠的植物和微生物资源,是治理荒漠的重要研究方向之一。促生菌可以通过溶解有机磷、无机磷、解钾、分泌IAA、产铁载体等功能,帮助植物充分吸收利用所需营养物质,促进植物生长[20-23]。
本研究从荒漠植物羽毛针禾种子中分离出的内生菌Z1具有溶磷、解钾、产铁载体和分泌IAA等功能。与其他细菌相比[24],Z1的IAA产量偏低,这可能是因为菌株Z1源于荒漠,其生长特性仍待深究。然而,与其他促生小麦的细菌相比,菌株Z1对小麦幼苗株高的促生效果比较明显。例如,接种LQ1230的小麦株高增加了2%[25],但接种菌株Z1后小麦株高增加了13.5%。另外,在叶绿素方面,与其他沙地分离菌相比,Z1的促增效果也比较好。例如,沙地柏根中分离的根部内生细菌SDB9处理的绿豆其叶绿素增长了7.81%[26];而菌株Z1处理小麦幼苗后,叶绿素提高了34%。菌株Z1提升小麦幼苗的可溶性蛋白含量的水平接近其他内生菌的水平。例如,野生大豆内生细菌YDX14能提升小麦幼苗的可溶性蛋白含量至2.47倍[27],而Z1为1.16倍。
改善土壤营养物质代谢和促进植物生长的功能,是有益微生物改良土壤环境的前提条件。功能菌Z1菌株可通过溶磷、解钾、产铁载体而改善土壤环境,并且可以分泌生长素促进植物的生长。该菌株可作为潜在的促进植物生长和改良荒漠土壤的菌源。
4 结论Z1菌株是一株植物内生细菌,为泛生菌属(Pantoea),有溶解有机磷、无机磷及固氮功能,可以分泌IAA和产生铁离子。可溶性糖为碳源,蛋白胨为氮源,碳酸钙为无机盐,pH值为9.0时其发酵效果较优。施加Z1菌株菌悬液能提高小麦幼苗的生长速率。本研究可为改善荒漠环境、提高植物在极端环境中抗逆性的相关研究提供一定参考。
| [1] |
Zhang L, Wang SM, Zhang X, Xu HX, Lu JH. RAPD analysis of the genetic structure of Stipagrostis pennata populations[J]. Journal of Anhui Agricultural Sciences, 2011, 39(21): 12643-12645. (in Chinese) 张玲, 王绍明, 张霞, 徐海霞, 陆嘉惠. 羽毛针禾种群遗传多样性分析[J]. 安徽农业科学, 2011, 39(21): 12643-12645. DOI:10.3969/j.issn.0517-6611.2011.21.005 |
| [2] |
Qian YB, Wu ZN, Yang HF, Jiang C. Vegetation spatial heterogeneity across longitudinal dunes in the southern Gurbantunggut desert[J]. Journal of Desert Research, 2011, 31(2): 420-427. (in Chinese) 钱亦兵, 吴兆宁, 杨海峰, 蒋超. 古尔班通古特沙漠纵向沙垄植被空间异质性[J]. 中国沙漠, 2011, 31(2): 420-427. |
| [3] |
Wang JM, Zhang X, Wang SM. Germination characteristics of Stipagrostis pennata[J]. Seed, 2009, 28(5): 8-10, 14. (in Chinese) 王建明, 张霞, 王绍明. 羽毛针禾萌发特性研究[J]. 种子, 2009, 28(5): 8-10, 14. |
| [4] |
Qian YB, Zhang LY, Wu ZN. Destruction and regeneration of the desert vegetation in the engineering activities in the Gurbantunggut desert[J]. Arid Zone Research, 2001, 18(4): 47-51. (in Chinese) 钱亦兵, 张立运, 吴兆宁. 工程行为对古尔班通古特沙漠植被的破损及恢复[J]. 干旱区研究, 2001, 18(4): 47-51. |
| [5] |
Ding XX, Zhang TT, Ma L. Rapidly evolving genetic features for desert adaptations in Stipagrostis pennata[J]. BMC Genomics, 2021, 22(1): 846. DOI:10.1186/s12864-021-08124-w |
| [6] |
Zhang C, Ma X, Zhu RQ, Liu ZZ, Gu MM, Zhang JY, Li Y, Xu YY, Zhu DH. Analysis of the endophytic bacteria community structure and function of Panax notoginseng based on high-throughput sequencing[J]. Current Microbiology, 2020, 77(10): 2745-2750. DOI:10.1007/s00284-020-02068-2 |
| [7] |
Parvandi M, Rezadoost H, Farzaneh M. Introducing Alternaria tenuissima SBUp1, as an endophytic fungus of Ferula assa-foetida from Iran, which is a rich source of rosmarinic acid[J]. Letters in Applied Microbiology, 2021, 73(5): 569-578. DOI:10.1111/lam.13542 |
| [8] |
Li XD, Ma L, Zhang TT. Isolation, identification and phylogenetic tree analysis of endophytic bacteria from Stipagrostis pennata[J]. Northern Horticulture, 2020(3): 77-84. (in Chinese) 李旭东, 马磊, 张婷婷. 羽毛针禾内生细菌分离鉴定及系统发育树分析[J]. 北方园艺, 2020(3): 77-84. |
| [9] |
Zhang J. Research on diversity of endosymbiotic fungi in roots of Cymbidium[D]. Beijing: Master's Thesis of Chinese Academy of Forestry, 2012 (in Chinese) 张辑. 中国兰属植物内生菌多样性研究[D]. 北京: 中国林业科学研究院硕士学位论文, 2012 |
| [10] |
Pang FH, Du RQ, Wang T, Huang SL. Screening of wheat growth-promoting entophytic bacterial strains and correlation analysis of factors influencing wheat growth[J]. Journal of China Agricultural University, 2016, 21(1): 8-21. (in Chinese) 庞发虎, 杜瑞卿, 王坦, 黄思良. 小麦内生细菌促生菌株的筛选及其影响小麦生长的因子的相关性分析[J]. 中国农业大学学报, 2016, 21(1): 8-21. |
| [11] |
Chen L, Li KK, Mi GH, Hu D, Sui XH, Chen WX. Screening and identification of potassium-solubilizing bacteria and their promoting effects on maize in black soil of Northeast China[J]. Microbiology China, 2021, 48(5): 1560-1570. (in Chinese) 陈腊, 李可可, 米国华, 胡栋, 隋新华, 陈文新. 解钾促生菌的筛选鉴定及对东北黑土区玉米的促生效应[J]. 微生物学通报, 2021, 48(5): 1560-1570. |
| [12] |
He CP, Zhao LL, Sun L, Li R, Liang YQ, Zheng XL, Wu WH. Identification and drug resistant analysis of a strain of siderophores producting antagonist bacteria from rubber tree[J]. Chinese Journal of Tropical Crops, 2012, 33(12): 2240-2245. (in Chinese) 贺春萍, 赵璐璐, 孙亮, 李锐, 梁艳琼, 郑肖兰, 吴伟怀. 一株产铁载体橡胶树拮抗细菌的分离鉴定及耐药性分析[J]. 热带作物学报, 2012, 33(12): 2240-2245. DOI:10.3969/j.issn.1000-2561.2012.12.023 |
| [13] |
Cai MY, Dong XZ. Handbook for Identification of Common Bacterial Systems[M]. Beijing: Science Press, 2001. (in Chinese) 蔡妙英, 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [14] |
Yang M, Gao T, Li YJ, Wei CY, Gao M, Ma LJ. Isolation and screening of plant growth-promoting rhizobacteria in pepper and their disease-resistant growth-promoting characteristics[J]. Biotechnology Bulletin, 2020, 36(5): 104-109. (in Chinese) 杨茉, 高婷, 李滟璟, 魏崇瑶, 高淼, 马莲菊. 辣椒根际促生菌的分离筛选及抗病促生特性研究[J]. 生物技术通报, 2020, 36(5): 104-109. |
| [15] |
Guo Y, Yang P, Zhang DY, Liu YY, Ma LJ, Bu N. Screening, identification and growth-promoting effect of multifunction rhizosphere growth-promoting strain of wild soybean[J]. Biotechnology Bulletin, 2018, 34(10): 108-115. (in Chinese) 郭英, 杨萍, 张丹雨, 刘莹莹, 马莲菊, 卜宁. 野大豆多功能根际促生菌的筛选鉴定和促生效果研究[J]. 生物技术通报, 2018, 34(10): 108-115. |
| [16] |
Liu J. Study on the difference of root morphology and energy dissipation and its correlation with shoot characters of wheat microcore germplasm[D]. Henan: Master's Thesis of Henan Institute of Science and Technology, 2021 (in Chinese) 刘佳. 微核心种质小麦根系形态和耗能性差异及其与地上部性状相关性研究[D]. 新乡: 河南科技学院硕士学位论文, 2021 |
| [17] |
Cheng GW, Gong HE, Yan SB, Chen CS, Luo JD, Yuan XP, Wu JG. Comparison of chlorophyll extraction methods in Camellia oleifera[J]. Hubei Forestry Science and Technology, 2017, 46(6): 11-13, 58. (in Chinese) 程贵文, 龚洪恩, 颜送宝, 陈传松, 罗嘉东, 袁小平, 吴建国. 油茶叶绿素提取方法的比较研究[J]. 湖北林业科技, 2017, 46(6): 11-13, 58. DOI:10.3969/j.issn.1004-3020.2017.06.003 |
| [18] |
Jia P, Qian L, Luo SK, Zheng DJ, Li H, Chen WY, Chen Y. Chlorophyll content distribution and its relationship with nitrogen content in leaves of Bauhinia variegate[J]. Journal of Chinese Urban Forestry, 2019, 17(6): 13-17. (in Chinese) 贾朋, 钱磊, 罗树凯, 郑丹菁, 李浩, 陈婉颖, 陈勇. 洋紫荆叶绿素含量的分布特征及与叶片氮含量的关系[J]. 中国城市林业, 2019, 17(6): 13-17. |
| [19] |
Zou Q. Plant physiology experiment[M]. Beijing: Chinese Agriculture Press, 2000. (in Chinese) 邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000. |
| [20] |
Pan WW. Endophytic mycoflora of selaginella: diversity patterns and effect on drought tolerance in wheat[D]. Zhengzhou: Master's Thesis of Zhengzhou University, 2016 (in Chinese) 潘文文. 卷柏内生真菌多样性及其对小麦抗旱性的影响[D]. 郑州: 郑州大学硕士学位论文, 2016 |
| [21] |
Yang CG. Screening and application of functional bacteria for clubroot disease control[D]. Kunming: Master's Thesis of Yunnan University, 2018 (in Chinese) 杨成刚. 防治白菜根肿病的功能细菌筛选与应用[D]. 昆明: 云南大学硕士学位论文, 2018 |
| [22] |
Li FY, Liu XY, Yan JT, Cai YF. Isolation and identification of three indole-3-acetic acid producing plant-growth-promoting rhizosphere Bacillus sp. and their growth-promoting effects[J]. Acta Agriculturae Zhejiangensis, 2021, 33(5): 873-884. (in Chinese) 李福艳, 刘晓玉, 颜静婷, 蔡燕飞. 三株产吲哚乙酸根际促生芽孢杆菌的筛选鉴定及其促生作用[J]. 浙江农业学报, 2021, 33(5): 873-884. DOI:10.3969/j.issn.1004-1524.2021.05.13 |
| [23] |
Wang GS. Study on isolation and identification of endophytes from Chrysanthemum morifolium cv. Boju and their antibacterial and growth promoting functions[D]. Fuyang: Master's Thesis of Fuyang Normal University, 2018 (in Chinese) 王贵生. 亳菊内生菌的分离鉴定及抑菌促生功能研究[D]. 阜阳: 阜阳师范学院硕士学位论文, 2018 |
| [24] |
Xu FF, Yuan LM, Shao YF, Fan GH, Zhou XN, Zheng WL, Li DM, Feng FY. Effect of Enterobacter sp. FYP1101 on wheat seedling growth under salt stress[J]. Microbiology China, 2018, 45(1): 102-110. (in Chinese) 许芳芳, 袁立敏, 邵玉芳, 范国花, 周心爱, 郑文玲, 李冬梅, 冯福应. 肠杆菌FYP1101对盐胁迫下小麦幼苗的促生效应[J]. 微生物学通报, 2018, 45(1): 102-110. |
| [25] |
Qiang XJ. Mechanisms underlying the effects of endophytic fungi isolated from Elymus dahuricus on the drought resistance of wheat[D]. Beijing: Doctoral Dissertation of Chinese Academy of Agricultural Sciences, 2019 (in Chinese) 强晓晶. 披碱草内生真菌对小麦抗旱性的影响机制[D]. 北京: 中国农业科学院博士学位论文, 2019 |
| [26] |
Ai YT. Screening and identification of growth-promoting rhizobacteria from Sabina vulgaris[D]. Xi'an: Master's Thesis of Northwest University, 2019 (in Chinese) 艾银婷. 沙地柏根际促生细菌的筛选和功能鉴定[D]. 西安: 西北大学硕士学位论文, 2019 |
| [27] |
Zhao XY, Cao Y, Dong RM, Zhu MZ, Wang YN, Zhu M, Yu CM, Ma LJ. Isolation, identification and growth promoting effect of an endophytic bacteria YDX14 in wild soybean[J]. Soybean Science, 2021, 40(2): 224-231. (in Chinese) 赵晓妍, 曹越, 董芮萌, 朱梦卓, 汪雅楠, 朱淼, 于翠梅, 马莲菊. 一株野生大豆内生细菌YDX14菌株的分离、鉴定及促生效应研究[J]. 大豆科学, 2021, 40(2): 224-231. |
 2022, Vol. 49
2022, Vol. 49