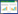扩展功能
文章信息
- 李华伟, 罗文彬, 许国春, 刘中华, 林志坚, 许泳清, 纪荣昌, 邱思鑫, 汤浩
- LI Huawei, LUO Wenbin, XU Guochun, LIU Zhonghua, LIN Zhijian, XU Yongqing, JI Rongchang, QIU Sixin, TANG Hao
- 基于高通量测序的福建北部马铃薯晚疫病株根际土壤细菌群落分析
- High-throughput sequencing of bacterial community in the rhizosphere soil of potato infected by late blight in northern Fujian province
- 微生物学通报, 2022, 49(3): 1017-1029
- Microbiology China, 2022, 49(3): 1017-1029
- DOI: 10.13344/j.microbiol.china.210532
-
文章历史
- 收稿日期: 2021-06-01
- 接受日期: 2021-11-16
- 网络首发日期: 2021-01-05
马铃薯(Solanum tuberosum L.)分布于全球158个国家和地区,既是全球重要的粮食作物,又是重要的经济作物[1]。由致病疫霉[Phytophthora infestans (Mont.) de Bary]引起的马铃薯晚疫病是世界上危害最重的马铃薯病害之一,其病原菌可危害马铃薯茎秆、叶和块茎,导致减产甚至绝产。该病的最大特点是病原菌的卵孢子(oospore)抗逆性强,能够生存在薯块、残枝及土壤中,带病薯块及土壤中的病菌是下一年初侵染源的主要来源之一,特别是南方冬作区残留在土壤的病菌是病害发生的最重要源头,晚疫病已成为南方冬作区生产中最主要的病害之一,严重影响马铃薯的产量和品质。
根际微生物群在植物营养和植物健康中起着重要的作用,其变化会影响植物生长和健康,植物病害的发生与土壤系统中的微生物菌群及多样性的变化具有一定的相关性[2-4]。当土壤生态系统中有害菌数量增加且有益菌数量降低时,植物病害发生率随之增加,当有益菌增加且多样性复杂时,植物病害的发生随之减低。细菌在土壤中含量最为丰富,分布最为广泛,在植物生长过程中,细菌利用根际分泌物作为营养物质与植物相互作用从而影响植物的生长[5],如土壤中欧文氏菌在植物根部生长并从植物根部获取养分而导致植物发病[6],而有些细菌可以通过分泌的有益物质或控制植物病原体的作用维持植物的健康生长,研究发现一些细菌菌株的抑制作用显著优于真菌和放线菌。研究表明从土壤中分离大量的马铃薯晚疫病拮抗菌如粘细菌菌株(B25-I-3、X6-II-1)、芽孢杆菌、假单胞杆菌等均能产生抗卵菌特性的活性成分,对马铃薯晚疫病和软腐病具有一定防治效果[7-11]。以上研究明确了从土壤中分离的细菌拮抗菌对晚疫病具有很好的抑制作用,但对于根际微生物群落组成和晚疫病之间关系的研究较少,因此,研究马铃薯晚疫病菌株根际土壤细菌群落结构和多样性有助于揭示晚疫病对土壤微生物群落的影响规律,为筛选马铃薯晚疫病的生防细菌提供理论参考。
福建省是我国最早种植马铃薯的省份之一,属于我国南方冬作区,春季、秋季和冬季均可种植,其中主要以冬种为主,占福建省种植面积的85%以上,冬种主要分布于东南沿海的平原一带,以沙土和砂壤土为主,主要采用水旱轮作的耕作制度[12]。由于冬种马铃薯生长期后期处于初春,随着气温的升高,降雨量增加,田间湿度大,病虫害寄主复杂,适宜各种病害的发生特别是马铃薯晚疫病的发生,晚疫病已成为福建省最重要的病害之一[13]。霞浦县位于福建省北部沿海,是福建省冬种马铃薯的主要产区之一,在整个生长季节中晚疫病是第一大病害,田间防治主要采用化学药剂防治为主,但在多雨的年份防治难度极大,给马铃薯生产带来严重危害。高通量测序方法为研究根际微生物组提供了最新研究手段,通过高通量测序产生高覆盖深度的rDNA ITS基因和16S rRNA基因的测序数据,分析和研究微生物群落的复杂性和多样性,对探索影响植物微生物组组成变化的因素提供了有力的证据[14-17]。有关马铃薯根际土壤微生物多样性已有报道[18-20],但福建省沙地马铃薯土壤根际微生物特别是病害发生后土壤微生物结构多样性未见报道。本研究选择福建省北部砂壤土为代表的冬种马铃薯,以感染马铃薯晚疫病和健康植株的根际土壤细菌群落为研究对象,采用高通量测序方法测定其根际土壤中细菌多样性的差异,以期了解马铃薯感染晚疫病后根际土壤微生物结构和多样性的变化情况。
1 材料与方法 1.1 样品采集2020年4月2日采自福建省宁德市霞浦县沙江镇屏南村试验基地(26°48′01″N,119°59′19″E,海拔50 m),该地块土壤为砂壤土,有机质含量为12.4 g/kg,N含量为72.3 mg/kg,P含量为87.3 mg/kg,K含量为156.0 mg/kg,pH值为4.7,前茬作物为水稻。选取晚疫病发病的马铃薯(品种“闽薯2号”,生育期薯块膨大期,晚疫病发生为初期)田块,随机选取3株晚疫病发病严重的马铃薯植株,收集马铃薯须根2 mm范围的根际土壤样品,编号为M2GA、M2GB和M2GC。随机选取3株健康马铃薯植株采集根际土壤,编号为M2JA、M2JB和M2JC。土壤样品分装于灭菌的15 mL离心管内于约0 ℃下低温保存,约5 h后运抵实验室,进行液氮处理,−80 ℃保存。所有样品置于低温保藏箱。
1.2 微生物菌落DNA提取、扩增微生物群落总DNA抽提根据土壤DNA提取试剂盒(E.Z.N.A.® Soil DNA Kit,Omega公司)说明书进行,使用1%的琼脂糖凝胶电泳检测提取DNA的质量、DNA浓度和纯度,A260/A280值要求在1.8−2.0之间。
以提取的土壤样品DNA为模板,使用细菌16S rRNA基因引物338F (5′-ACTCCTACGGG AGGCAGCAG-3′)和806R (5′-GGACTACHVG GGTWTCTAAT-3′)扩增其V3–V4可变区,PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,27个循环;72 ℃ 10 min;4 ℃保存。PCR反应体系:5×TransStart FastPfu缓冲液4 μL,dNTPs (2.5 mol/L) 2 μL,上、下游引物(5 μmol/L)各0.8 μL,TransStart FastPfu DNA聚合酶(1.25 U/μL) 0.4 μL,模板DNA 10 ng,补足至20 μL。
1.3 16S rRNA基因文库构建及高通量测序将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用凝胶回收试剂盒(AxyPrep DNA Gel Extraction Kit,Axygen公司)进行产物回收和纯化,并用荧光核酸测定仪定量检测回收产物。使用DNA建库试剂盒(Rapid DNA-Seq Kit,NEXTFLEX公司)进行建库。利用Illumina公司的MiSeq PE300平台进行测序(上海美吉生物医药科技有限公司)。
1.4 测序数据处理与分析数据质量过滤采用Trimmomatic和FLASH软件。平均质量分数低于20的低质量序列被过滤掉。任何与引物或条形码的不匹配、长度超过8个碱基的均聚物或包含的嵌合体都被排除在外。序列以97%的相似性阈值(对应于属级分辨率)被分到操作分类单元(OTU)中。最终得到具有代表性的OTU。利用RDP classifier (http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),置信度阈值设置为70%。分析马铃薯晚疫病对马铃薯植株根际土壤细菌群落结构和多样性的影响。该分析在上海美吉生物医药科技有限公司I-Sanger生信云网站平台(http://www.i-sanger.com/project/index.html)完成。
2 结果与分析 2.1 16S rRNA基因序列测序质量评估分析基于对未培养细菌的16S rRNA基因序列相似性大于97%定义为一个OTU,分析测序深度是否包括样品中多数细菌的物种。根据图 1所示的稀释曲线(dilution curve)分析显示,本研究2组6个样品抽取序列条数达到16 000条以上时曲线趋于平缓,测序结果反映了样品中95%以上的细菌种类,满足样品间细菌群落结构和多样性分析的要求。原始序列经优化处理后,健康植株根际土壤样品总序列数和总碱基数均显著高于感染晚疫病样品,序列平均长度均为417 bp (表 1)。
|
| 图 1 2组样品的稀释曲线 Figure 1 Dilution curves of two groups of samples. |
|
|
| 样本 Sample |
总序列数 Total sequence number |
总碱基数 Total base number |
序列平均长度 Mean length (bp) |
最短序列长度 Minimum length (bp) |
最长序列长度 Max length (bp) |
| M2G | 51 104 | 21 322 158 | 417 | 202 | 441 |
| M2J | 52 851 | 22 131 626 | 417 | 258 | 441 |
在97%相似性水平对样品序列进行OTU聚类,发病植株的样品共鉴定得出细菌分属于33门86纲211目352科672属1 420种4 498个OTU;健康植株样品共鉴定得出细菌36门106纲256目417科764属1 692种5 964个OTU (表 2),健康植株独有的OTU比发病植株多1 466个。健康植株根际土壤细菌的丰富度Chao1指数和多样性Shannon指数均显著高于发病植株根际土壤(表 3),表明发病植株根际土壤中细菌丰富度和多样性均显著低于健康植株。
| 样品Sample | 界Kingdom | 门Phylum | 纲Class | 目Order | 科Family | 属Genus | 种Species | 操作分类单元OTU |
| M2G | 1 | 33 | 86 | 211 | 352 | 672 | 1 420 | 4 498 |
| M2J | 1 | 36 | 106 | 256 | 417 | 764 | 1 692 | 5 964 |
| Total | 1 | 38 | 109 | 265 | 440 | 841 | 1 877 | 6 714 |
| 样品 Sample |
Chao1指数 Chao1 index |
香农指数 Shannon index |
辛普森指数 Simpson index |
ACE指数 ACE index |
覆盖度指数 Coverage index |
| M2G | 3 468.8±216.57b | 6.167±0.154b | 0.011±0.002b | 4 241±240b | 0.90±0.003b |
| M2J | 5 089.6±423.99a | 7.071±0.044a | 0.002±0.000a | 6 324±723a | 0.93±0.003a |
| 注:数据为平均值±标准差;不同小写字母表示处理间差异显著(P < 0.05) Note: Data in the table are mean±SD values; Different lowercase letters mean significant difference between treatments at P < 0.05 level. |
|||||
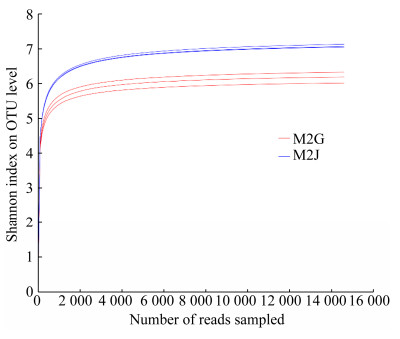
在OTU和属水平,发病植株与健康植株的根际土壤微生物的细菌菌落和种类比较接近,2组样品独有的OTU和属种类低于共有的种类,健康植株根际土壤微生物独有微生物种类显著高于发病植株(图 2)。从微生物门分类水平组成(图 3)看,发病植株和健康植株根际土壤中分离出的优势细菌门有12个,占比分别为:变形菌门(Proteobacteria) 50.01%和32.31%,均为主要类群,拟杆菌门(Bacteroidetes) 4.48%和13.78%,酸杆菌门(Acidobacteria) 7.40%和13.53%,放线菌门(Actinobacteria) 7.85%和12.13%,绿弯菌门(Chloroflexi) 5.81%和4.23%,芽单胞菌门(Gemmatimonadetes) 3.67%和5.08%,疣微菌门(Verrucomicrobia) 2.17%和5.28%,Patescibacteria 3.47%和2.45%,厚壁菌门(Firmicutes) 1.20%和1.72%,黏细菌门(Myxococcota) 0.99%和1.82%,蓝细菌门(Cyanobacteria) 1.69和0.84%,匿杆菌门(Latescibacteria) 0.23%和1.02%。由上述分析结果可知,马铃薯感染晚疫病后,其根际土壤细菌占比降低的优势门类主要有酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)、厚壁菌门(Firmicutes)、黏细菌门(Myxococcota)和匿杆菌门(Latescibacteria)。相对丰富度增加的优势菌门主要有变形杆菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、Patescibacteria、蓝细菌门(Cyanobacteria)。马铃薯晚疫病病菌侵染植株后导致其根际土壤中优势细菌门发生变化。

|
| 图 2 发病和健康植株根际土壤细菌OTU和属的韦恩图 Figure 2 Venn diagram of bacteria in rhizosphere soils of infected potato late blight and healthy potato at OTUs and genus level. |
|
|
|
| 图 3 发病植株和健康植株根际土壤细菌门分类水平组成 Figure 3 Bacterial community composition in rhizosphere soil of infected potato late blight and healthy potato at the phylum level. |
|
|
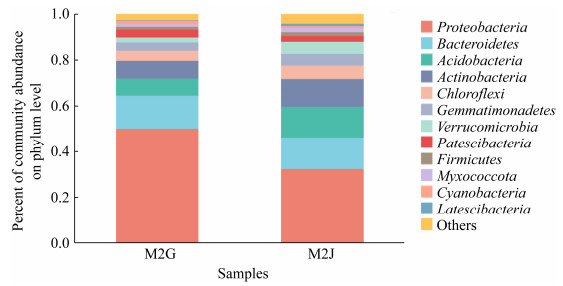
发病和健康样品t-test分析结果显示(图 4),健康植株的酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)、Patescibacteria、黏细菌门(Myxococcota)、厚壁菌门(Firmicutes)、匿杆菌门(Latescibacteria)显著高于发病植株。然而变形菌门(Proteobacteria)显著低于发病植株。
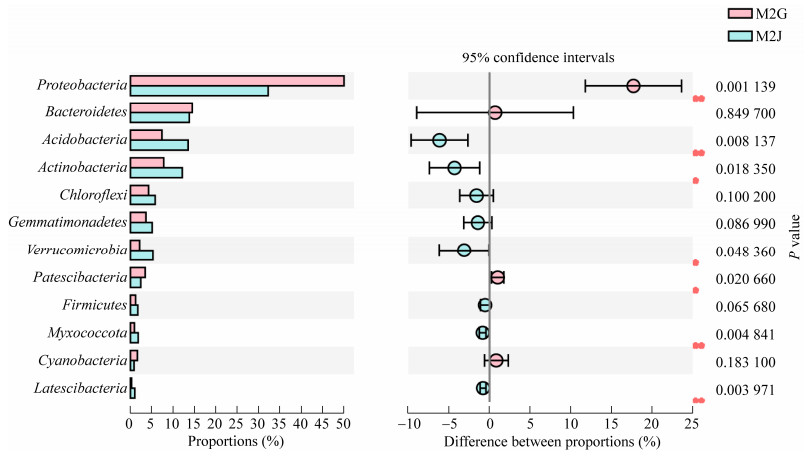
|
| 图 4 样品间细菌数量差异t-test比较(门水平) Figure 4 t-test comparison of differences in the number of bacteria between samples (phylum level). 数值前不同符号表示处理间差异显著(*:P < 0.05,**:P < 0.01) Data different symbol mean significant difference between treatments at P < 0.05 and P < 0.01 level. |
|
|
在属分类水平发现,发病植株和健康植株根际土壤中的优势菌群有(图 5):Rhodanobacter (11.56%、2.93%)、鞘氨醇单孢菌属(Sphingomonas) (6.83%、3.32%)、norank_f__Chitinophagaceae (2.75%、2.24%)、马赛菌属(Massilia) (3.17%、1.69%),norank_f__Vicinamibacteraceae (1.40%、3.04%)、norank_f__norank_o__Vicinamibacterales (1.32%、2.81%)、norank_f__Gemmatimonadaceae (1.57%、2.47%)、Chujaibacter、黄杆菌属(Flavobacterium) (1.70%、2.01%)、Luteimonas (2.20%、0.66%)。从发病植株根际土壤中优势细菌属的占比可知(图 5),发病植株根际土壤优势菌属norank_f__Vicinamibacteraceae、norank_ f__norank_o__Vicinamibacterales、norank_f__ Gemmatimonadaceae、Chujaibacter、黄杆菌属(Flavobacterium)较健康植株减少,而Rhodanobacter、鞘脂单孢菌属(Sphingomonas)、Chitinophagaceae、马赛菌属(Massilia)、Luteimonas菌属相应增加。发病植株根际土壤中优势细菌在属分类水平上表现出与门分类水平相同的变化趋势。由此推测,马铃薯根际土壤中优势细菌群落结构变化可能是由于感染马铃薯晚疫病后造成的。
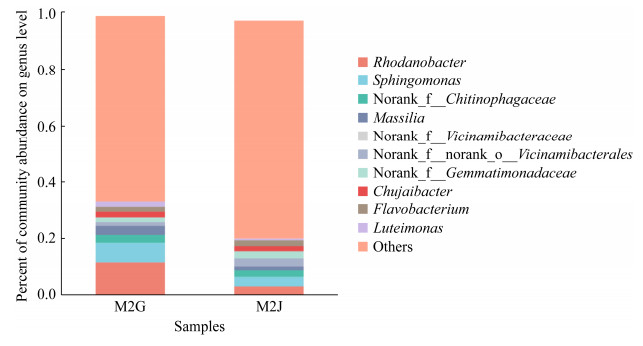
|
| 图 5 发病和健康植株根际土壤细菌属分类水平组成 Figure 5 Bacterial community structure in rhizosphere soil of infected and healthy potato at the genus level. |
|
|
发病和健康样品t-test分析结果显示(图 6),健康植株的根际土壤中的菌属norank_f__ Vicinamibacteraceae、norank_f__norank_o__ Vicinamibacterales、norank_f__Gemmatimonadaceae显著高于发病植株,而Rhodanobacter、马赛菌属(Massilia)和Luteimonas菌属显著低于发病植株,发病植株的Rhodanobacter是健康植株的3倍,Rhodanobacter为反硝化菌,其含量迅速升高可能和植株遭受病菌的侵染以适应新的环境变化,对减轻自身的损伤有一定的作用。
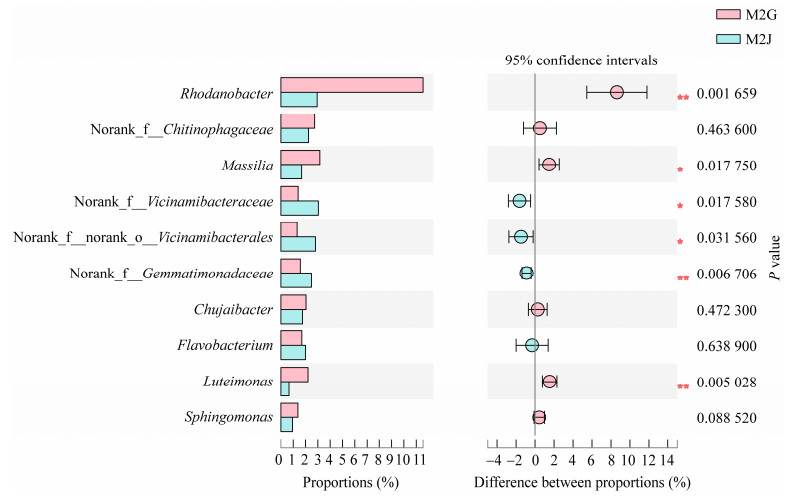
|
| 图 6 样品间细菌数量差异t-test比较(属水平) Figure 6 t-test comparison of differences in the number of bacteria between samples (genus level). 数值前不同符号表示处理间差异显著(*:P < 0.05,**:P < 0.01) Data different symbol mean significant difference between treatments at P < 0.05 and P < 0.01 level. |
|
|
主坐标分析(PCoA)表明(图 7):发病和健康马铃薯植株根际土壤比较,细菌群落具有很好的相似性,并且发病和健康马铃薯植株的根际土壤细菌群落产生明显分离。由PCoA可知第一主成分的贡献率为61.20%,第二主成分的贡献率为12.68%,发病植株根际土壤和健康植株根际土壤微生物菌群组成存在差异。
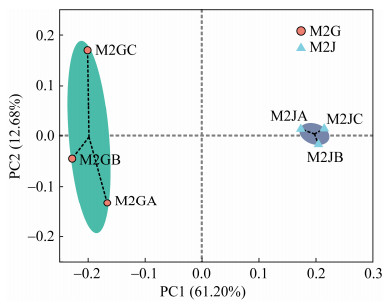
|
| 图 7 不同样品OTU水平主坐标分析 Figure 7 PCoA analysis diagram of different samples (OTU level). |
|
|
利用高通量测序技术研究植物健康植株和发病植株的土壤微生物多样性已有很多报道,杨尚东等研究了甘蔗宿根矮化病感病与非感病株根际土壤生物学性状及细菌群落结构特征,感病植株根际微环境中指示土壤肥力的生物学指标显著降低,细菌丰富度和多样性显著下降,部分优势细菌门属占比发生剧变可能是导致甘蔗宿根矮化病(ratoon stunting disease,RSD)发生的重要原因[18]。杨尚东等研究番茄青枯病非感病植株与感病植株根际微生物多样性发现,感病植物根际土壤细菌多样性低于健康植株,得出番茄青枯病病害的发生可能与作物根际土壤细菌多样性下降密切相关[19]。本研究通过Illumina MiSeq测序平台对马铃薯晚疫病发病植株和健康植株根际土壤进行宏基因组测序,获得了高质量序列片段数目,获得的健康植株的序列片段数目显著高于发病植株。发病样品和健康样品的16S rRNA基因V3–V4可变区进行PCR扩增与实际长度吻合(表 1)。测序共获得6 714个OTU,其中,健康植株根际细菌检测到5 964个OTU,发病植株检测到4 498个OTU;健康植株根际细菌特有的OTU占其总数的37.15%,发病植株特有OTU数目占其总数的16.67%。Chao1指数、Shannon指数、ACE指数和Coverage指数等4个指标均表明马铃薯健康植株根际土壤中的细菌多样性显著高于发病植株(表 2、表 3),说明感染晚疫病后导致了植株根际土壤微生物多样性变化,而最终导致植株病级加重,随着病害的蔓延,使整个田块的土壤细菌多样性下降。
在门水平上,研究表明在所有微生物菌种中变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和芽单胞菌门(Gemmatimonadetes)等为优势菌群[20],Proteobacteria是所有菌群中最为丰富的菌门,对土壤中的有机质、氮、磷、硫的循环都有显著的促进作用,但其包含大量的病原菌,病原菌侵染植物后使其相对丰富度急剧增加[21]。在本研究中发现发病植株与健康植株根际土壤中优势菌门主要为Proteobacteria、Bacteroidetes、Acidobacteria、Actinobacteria、Chloroflexi和Gemmatimonadetes,但发病植株的Proteobacteria相对丰度增加,并且和健康植株有极显著差异,其他优势菌门同样发生变化。Acidobacteria是新划分出的具有降解特征的细菌类群,广泛存在于自然界各个环境中,占土壤细菌群的5%–46%,在有些植物根系和土壤环境中比例仅次于Proteobacteria[22-23],Actinobacteria中包含许多可产抗生素、酶和有机酸等的细菌,其含量的高低可作为土壤健康状况的评价指标。本研究中Acidobacteria在发病植株中的相对丰度急剧降低,这可能是由于植株感染病菌后,有益菌降低,有害菌增加的原因。但是,由于本研究中未设置不同发病程度样品的处理,无法比较不同发病程度植株根际土壤细菌丰度和多样性的变化,只通过测序比较了发病和健康植株根际土壤微生物(Proteobacteria、Actinobacteria、Acidobacteria和Gemmatimonadetes)的变化情况,虽得出了发病植株和健康植株的优势菌门前后的变化,但是究竟是哪种优势菌门在发病植株的根际土壤细菌多样性中起决定作用还无法确定,因此还有待进一步研究不同发病程度植株根际土壤微生物多样性,以明确在晚疫病侵染马铃薯植株过程中根际土壤微生物的变化情况。
在属水平上,本研究发现马铃薯发病植株和健康植株根际土壤细菌群落中,Rhodanobacter、马赛菌属(Massilia)、Luteimonas、norank_f__ Vicinamibacteraceae、norank_f__norank_o__ Vicinamibacterales、norank_f__Gemmatimonadaceae存在显著差异。其中发病植株的Rhodanobacter丰度急剧增加,是健康植株的3倍多,Rhodanobacter具有反硝化和生物修复的功能,其含量急剧变化与外界环境呈显著相关性。Prakash等研究发现强压的土壤中(重金属、高盐、贫瘠) Rhodanobacter相对丰度高于正常土壤[24]。Hemme等研究了外界环境因子胁迫后导致产黄杆菌菌株占优势[25]。纪梦梦等研究发现过量施肥后土壤中富集了Rhodanobacter[26]。本研究同样也说明了马铃薯植株受到病害的胁迫,发病植株的Rhodanobacter丰度显著提高,由于取样时植物处于发病初期,可能是植物为了适应环境的变化其丰度急剧增加,但是随着病级的增加,后续的变化情况还需进一步研究。Sphingomonas是清理土壤中有毒物质最有效的微生物类群之一,由于其携带了能降解苯系及杂环物质的基因,能够有效抵御外界环境的变化,比如抗病性和抗逆性增强等[27-28]。在本研究中发现发病植株和健康植株根际细菌Sphingomonas发生相对变化,发病植株的丰度高于健康植株,但未达到显著差异,这可能与植株的发病时间和程度有一定的相关性,随着发病程度的增加,有害菌增加,植物为了清除有害菌,提高抗病性,Sphingomonas是否随着病程的增加而增加有待在以后实验中进一步研究。
研究表明,当植物受到病害侵染时,植物根际土壤微生物(真菌、细菌和放线菌)多样性指数均降低,真菌、细菌和放线菌菌落的变化均和环境变化有关(逆境胁迫、病害侵染),其中以细菌多样性变化最为丰富[29-31]。马铃薯晚疫病是由致病疫霉菌引起的卵菌性病害,卵菌均有真菌的一些特性,但又区别于真菌,因此,晚疫病侵染马铃薯植株时,其根际土壤真菌多样性应发生相应变化。研究发现,真菌、细菌和放线菌均对马铃薯致病疫霉具有拮抗能力,其中以细菌种类最多,真菌多样性指数低于细菌多样性指数[30-31]。本研究对马铃薯感染晚疫病病菌后其根际土壤细菌多样性进行了分析,发现发病植株的细菌多样性显著低于健康植株,说明细菌多样性的变化和病害发生有一定的相关性。
综上所述,马铃薯感染晚疫病后其根际土壤细菌菌群结构和多样性发生了改变,发病后植株的根际土壤菌群结构和多样性低于健康植株,根际土壤微生物生态平衡被破坏,导致病害加剧,其结果有助于了解感染晚疫病后马铃薯植株根际土壤细菌的群落结构及多样性的变化情况,可为进一步研究马铃薯晚疫病的防治奠定基础。今后需要继续就发病前、中、后期马铃薯根际土壤细菌群落结构的变化及土壤环境因子对此的影响等开展进一步研究。
| [1] |
Joshi M, Fogelman E, Belausov E, Ginzberg I. Potato root system development and factors that determine its architecture[J]. Journal of Plant Physiology, 2016, 205: 113-123. DOI:10.1016/j.jplph.2016.08.014 |
| [2] |
Berg G, Smalla K. Plant species and soil type cooperatively shape the structure and function of microbial communities in the rhizosphere[J]. FEMS Microbiology Ecology, 2009, 68(1): 1-13. DOI:10.1111/j.1574-6941.2009.00654.x |
| [3] |
Mendes R, Kruijt M, De Bruijn I, Dekkers E, Van Der Voort M, Schneider JHM, Piceno YM, DeSantis TZ, Andersen GL, Bakker PAHM, et al. Deciphering the rhizosphere microbiome for disease-suppressive bacteria[J]. Science, 2011, 332(6033): 1097-1100. DOI:10.1126/science.1203980 |
| [4] |
Pfeiffer S, Mitter B, Oswald A, Schloter-Hai B, Schloter M, Declerck S, Sessitsch A. Rhizosphere microbiomes of potato cultivated in the High Andes show stable and dynamic core microbiomes with different responses to plant development[J]. FEMS Microbiology Ecology, 2016, 93(2): fiw242. |
| [5] |
Hunziker L, Bönisch D, Groenhagen U, Bailly A, Schulz S, Weisskopf L. Pseudomonas strains naturally associated with potato plants produce volatiles with high potential for inhibition of Phytophthora infestans[J]. Applied and Environmental Microbiology, 2015, 81(3): 821-830. DOI:10.1128/AEM.02999-14 |
| [6] |
Marschner H. Plant-soil relationships: acquisition of mineral nutrients by roots from soils[J]. Plant Growth, 1991(43): 125-155. |
| [7] |
Wu ZH, Guo WW, Dong Y, Guo ZW, Wang XH, Liu HR. Isolation and identification of myxobacterial strain X6-Ⅱ-1 resistant to Phytophthora infestans and its antibiotic activity and optimal fermentation condition[J]. Journal of Agricultural Biotechnology, 2018, 26(9): 1467-1479. (in Chinese) 武志华, 郭维维, 董晔, 郭子文, 王雪寒, 刘惠荣. 抗马铃薯晚疫病菌的粘细菌菌株X6-Ⅱ-1的分离鉴定、拮抗活性及发酵条件的优化[J]. 农业生物技术学报, 2018, 26(9): 1467-1479. |
| [8] |
Wu ZH, Zhao PY, Ding YX, Ma Q, Wang XH, Liu HR. Identification and secondary metabolites of strain B25-I-3 against Phytophthora infestans[J]. Microbiology China, 2020, 47(11): 3586-3599. (in Chinese) 武志华, 赵璞钰, 丁一秀, 马强, 王雪寒, 刘惠荣. 致病疫霉拮抗菌株B25-I-3的鉴定及其次级代谢产物[J]. 微生物学通报, 2020, 47(11): 3586-3599. |
| [9] |
Van Der Voort M, Meijer HJG, Schmidt Y, Watrous J, Dekkers E, Mendes R, Dorrestein PC, Gross H, Raaijmakers JM. Genome mining and metabolic profiling of the rhizosphere bacterium Pseudomonas sp. SH-C52 for antimicrobial compounds[J]. Frontiers in Microbiology, 2015, 6: 693. |
| [10] |
Caulier S, Gillis A, Colau G, Licciardi F, Liépin M, Desoignies N, Modrie P, Legrève A, Mahillon J, Bragard C. Versatile antagonistic activities of soil-borne Bacillus spp. and Pseudomonas spp. against Phytophthora infestans and other potato pathogens[J]. Frontiers in Microbiology, 2018, 9: 143. DOI:10.3389/fmicb.2018.00143 |
| [11] |
Sbai Idrissi N, Ouarzane A, Elouazni L, Hmyene A, Elantri S, Amine A. Exploring rhizosphere and potato microbiome as potential antagonist to control blackleg and potato soft rot diseases in Morocco[J]. Egyptian Journal of Biological Pest Control, 2021, 31: 41. DOI:10.1186/s41938-021-00387-5 |
| [12] |
Tang H. Potato industrial actuality and development countermeasures in Fujian province[J]. Chinese Potato Journal, 2010, 24(6): 376-378. (in Chinese) 汤浩. 福建省马铃薯产业优势及发展对策[J]. 中国马铃薯, 2010, 24(6): 376-378. DOI:10.3969/j.issn.1672-3635.2010.06.016 |
| [13] |
Zhu W, Fu HJ, Yang LN, Chen QH, Weng QY, Zhan JS. Genetic variation of Phytophthora infestans in Fujian province[J]. Acta Laser Biology Sinica, 2013, 22(3): 267-272. (in Chinese) 祝雯, 付海静, 杨丽娜, 陈庆河, 翁启勇, 詹家绥. 福建省部分地区马铃薯致病疫霉群体遗传多样性分析[J]. 激光生物学报, 2013, 22(3): 267-272. DOI:10.3969/j.issn.1007-7146.2013.03.013 |
| [14] |
Xiong MZ, Chao YP, Zhao P, Song SW, Shi YY, Mo CB, Zhong NQ. Comparison of bacterial diversity in rhizosphere soil of potato in different habitats[J]. Acta Microbiologica Sinica, 2020, 60(11): 2434-2449. (in Chinese) 熊悯梓, 钞亚鹏, 赵盼, 宋双伟, 石莹莹, 莫乘宝, 仲乃琴. 不同生境马铃薯根际土壤细菌多样性分析[J]. 微生物学报, 2020, 60(11): 2434-2449. |
| [15] |
Zhao WS, Guo QG, Su ZH, Wang PP, Dong LH, Hu Q, Lu XY, Zhang XY, Li SZ, Ma P. Characterization of fungal community structure in the rhizosphere soil of healthy and diseased-Verticillium wilt potato plants and carbon source utilization[J]. Scientia Agricultura Sinica, 2021, 54(2): 296-309. (in Chinese) 赵卫松, 郭庆港, 苏振贺, 王培培, 董丽红, 胡卿, 鹿秀云, 张晓云, 李社增, 马平. 马铃薯健株与黄萎病株根际土壤真菌群落结构及其对碳源利用特征[J]. 中国农业科学, 2021, 54(2): 296-309. |
| [16] |
Wang XD, Li YH. Advances in studying water microbial ecology by molecular biological techniques[J]. Microbiology, 2007, 34(4): 777-781. (in Chinese) 王晓丹, 李艳红. 分子生物学方法在水体微生物生态研究中的应用[J]. 微生物学通报, 2007, 34(4): 777-781. DOI:10.3969/j.issn.0253-2654.2007.04.038 |
| [17] |
Ma K, Zhang L, Du Q, Song NP. Effect of potato continuous cropping on soil microorganism community structure and function[J]. Journal of Soil and Water Conservation, 2010, 24(4): 229-233. (in Chinese) 马琨, 张丽, 杜茜, 宋乃平. 马铃薯连作栽培对土壤微生物群落的影响[J]. 水土保持学报, 2010, 24(4): 229-233. |
| [18] |
Yang SD, Guo S, Ren KY, Pang SC, Zhang CJ, Wang SS, Tan HW. Soil biological properties and bacterial community structures in rhizosphere soil of canes infected and non-infected by ratoon stunting disease[J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(6): 910-916. (in Chinese) 杨尚东, 郭霜, 任奎喻, 庞师婵, 张传进, 王帅帅, 谭宏伟. 甘蔗宿根矮化病感病与非感病株根际土壤生物学性状及细菌群落结构特征[J]. 植物营养与肥料学报, 2019, 25(6): 910-916. |
| [19] |
Yang SD, Zhao JC, Guo YJ, Wu J, Long MH. Characterization of soils bacterial community structures in rhizospheres of tomatoes infected with bacterial wilt and its non-infected plants[J]. China Vegetables, 2014(8): 25-29. (in Chinese) 杨尚东, 赵久成, 郭伊娟, 吴俊, 龙明华. 番茄青枯病罹病植株和健康植株根际土壤细菌群落结构的初步分析[J]. 中国蔬菜, 2014(8): 25-29. DOI:10.3969/j.issn.1000-6346.2014.08.008 |
| [20] |
Fierer N, Jackson RB. The diversity and biogeography of soil bacterial communities[J]. PNAS, 2006, 103(3): 626-631. DOI:10.1073/pnas.0507535103 |
| [21] |
Ge YL, Liu ZL, Chen L, Luo L. Screening and identification of marine actinomycetes for biocontrol on Rhizoctonia cerealis[J]. Agrochemicals, 2018, 57(2): 111-113, 136. (in Chinese) 葛玉力, 刘兆良, 陈玲, 罗兰. 小麦纹枯病生防海洋放线菌的筛选与鉴定[J]. 农药, 2018, 57(2): 111-113, 136. |
| [22] |
Ellis RJ, Morgan P, Weightman AJ, Fry JC. Cultivation-dependent and-independent approaches for determining bacterial diversity in heavy-metal- contaminated soil[J]. Applied and Environmental Microbiology, 2003, 69(6): 3223-3230. DOI:10.1128/AEM.69.6.3223-3230.2003 |
| [23] |
Lee SH, Ka JO, Cho JC. Members of the phylum Acidobacteria are dominant and metabolically active in rhizosphere soil[J]. FEMS Microbiology Letters, 2008, 285(2): 263-269. DOI:10.1111/j.1574-6968.2008.01232.x |
| [24] |
Prakash O, Green SJ, Singh P, Jasrotia P, Kostka JE. Stress-related ecophysiology of members of the genus Rhodanobacter isolated from a mixed waste contaminated subsurface[J]. Frontiers of Environmental Science & Engineering, 2020, 15(2): 1-9. |
| [25] |
Hemme CL, Green SJ, Rishishwar L, Prakash O, Pettenato A, Chakraborty R, Deutschbauer AM, Van Nostrand JD, Wu LY, He ZL, et al. Lateral gene transfer in a heavy metal-contaminated-groundwater microbial community[J]. mBio, 2016, 7(2): e02234-e02215. |
| [26] |
Ji MM, Wu XG, Wu XX, Wu QY, Li J, Qin XC, Zhang XJ. Effect of overuse nitrogen fertilizer on bacterial community and N2O emission from greenhouse soil[J]. Microbiology China, 2018, 45(6): 1323-1332. (in Chinese) 纪梦梦, 吴晓刚, 吴欣欣, 吴巧玉, 李冀, 秦先超, 张晓君. 过量施肥对设施菜田土壤菌群结构及N2O产生的影响[J]. 微生物学通报, 2018, 45(6): 1323-1332. |
| [27] |
Eguchi M, Nishikawa T, MacDonald K, Cavicchioli R, Gottschal JC, Kjelleberg S. Responses to stress and nutrient availability by the marine ultramicrobacterium Sphingomonas sp. strain RB2256[J]. Applied and Environmental Microbiology, 1996, 62(4): 1284-1294. |
| [28] |
Ostrowski M, Cavicchioli R, Blaauw M, Gottschal JC. Specific growth rate plays a critical role in hydrogen peroxide resistance of the marine oligotrophic ultramicrobacterium Sphingomonas alaskensis strain RB2256[J]. Applied and Environmental Microbiology, 2001, 67(3): 1292-1299. DOI:10.1128/AEM.67.3.1292-1299.2001 |
| [29] |
Wang LY, Zhou C, Liu GZ, Di L, Yang H, Luo YC. Variation of arbuscular mycorrhiza fungal communities in the rhizosphere soil of Phoebe bournei (Hemsl.) Yang plantations based on high-throughput sequencing analysis[J]. Microbiology China, 2021, 48(5): 1461-1472. (in Chinese) 王丽艳, 周晨, 刘光正, 狄岚, 杨桦, 骆昱春. 基于高通量测序的闽楠幼林根际土壤丛枝菌根真菌群落变化[J]. 微生物学通报, 2021, 48(5): 1461-1472. |
| [30] |
Gao MY, Fu HY, Sun C, Wang YB, Liu CG, Ma YK, Yang FS. Antagonistic bacteria of Phytophthora infestans in potato: a review[J]. Chinese Agricultural Science Bulletin, 2021, 37(14): 136-140. (in Chinese) 高梦颖, 付海燕, 孙丛, 王颜波, 刘春光, 马玉堃, 杨峰山. 马铃薯致病疫霉拮抗细菌研究进展[J]. 中国农学通报, 2021, 37(14): 136-140. DOI:10.11924/j.issn.1000-6850.casb2020-0546 |
| [31] |
Ge YL, Sun T. Soil microbial community structure and diversity of potato in rhizosphere and non-rhizosphere soil[J]. Ecology and Environmental Sciences, 2020, 29(1): 141-148. (in Chinese) 葛应兰, 孙廷. 马铃薯根际与非根际土壤微生物群落结构及多样性特征[J]. 生态环境学报, 2020, 29(1): 141-148. |
 2022, Vol. 49
2022, Vol. 49