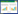扩展功能
文章信息
- 常婷婷, 赵妍, 杨焕玲, 宋晓霞, 董沁, 陈明杰
- CHANG Tingting, ZHAO Yan, YANG Huanling, SONG Xiaoxia, DONG Qin, CHEN Mingjie
- 香菇复配氨基酸培养基优化及其对香菇菌丝生长生理的影响
- Optimization of compound amino acid medium for Lentinula edodes and the effect on mycelial growth and physiology
- 微生物学通报, 2022, 49(2): 545-555
- Microbiology China, 2022, 49(2): 545-555
- DOI: 10.13344/j.microbiol.china.210779
-
文章历史
- 收稿日期: 2021-08-24
- 接受日期: 2021-10-03
- 网络首发日期: 2021-11-16
2. 上海市农业科学院食用菌研究所 农业农村部南方食用菌资源利用重点实验室 国家食用菌工程技术研究中心 国家食用菌加工技术研发分中心 上海市农业遗传育种重点开放实验室, 上海 201403
2. Institute of Edible Fungi, Shanghai Academy of Agricultural Sciences; Key Laboratory of Edible Fungi Resources and Utilization (South), Ministry of Agriculture and Rural Affairs; National Engineering Research Center of Edible Fungi; National R&D Center for Edible Fungi Processing; Shanghai Key Laboratory of Agricultural Genetics and Breeding, Shanghai 201403, China
香菇(Lentinula edodes)又名香蕈,隶属真菌界担子菌门(Basidiomycota)伞菌纲(Agaricomycetes)伞菌目(Agaricales)[1]。香菇营养丰富,有药用和保健双重功效,因而具有广大的消费市场。香菇是我国重要的农产品,具有土地产出率高、投资少、见效快等特点,是促进脱贫致富以及推动乡村振兴的重要载体[2]。随着栽培技术的不断发展,“十三五”期间我国香菇产量显著提高[3]。截至2018年,我国香菇产量占全球香菇总产量的90%以上,但实际生产中仍然存在因基质利用率低而导致单产低的现象[4]。“十四五”时期,香菇国内外的市场需求持续扩大,在供给侧结构改革的引导下,推动香菇产业增产的同时更应追求高质量的发展目标[3]。研究香菇生长基质的营养添加及科学优化配比对香菇产业的增产提质具有积极的发展意义。
目前,食用菌的外源添加物主要包括矿物质元素[5-6]、氨基酸类[7]、蛋白质类[8]及碳水化合物类[9]等,选择性地利用外源物质有效促进食用菌增产提质将是产业发展的重要推手。氨基酸是生物学上重要的有机含氮化合物,生物体的生命活动离不开其正常的生理代谢和运输转化[10]。氨基酸可以为食用菌的生长提供氮源,但不同氨基酸对不同食用菌生长的作用存在差异,一般来说,丙氨酸、天冬门氨酸、丝氨酸等可以被食用菌很好地吸收,而芳香族氨基酸和含硫氨基酸则需要混合使用才能得到更好的效果[11]。赵萍[7]在研究中发现适宜浓度下的Ala、Asn和Ser培养基可以有效促进黑木耳(Auricularia auricula)菌丝的生长。国内的研究中也有关于氨基酸水溶肥和小肽化合物等氨基酸类外源添加物促进食用菌菌丝生长的报道[4],例如氨基酸水溶肥会促进平菇(Pleurotus ostreatus)菌丝长势,提高生物学效率[12]。然而几种氨基酸单一及复配使用对香菇菌丝生长和生理代谢产生的影响目前尚不清楚。
香菇属于异养生物,需要从菌丝体外吸收碳、氮等营养物质。根据香菇菌丝对栽培基质的营养选择性,改良香菇培养基质的营养成分、优化营养物质的添加比例对香菇产业具有十分积极的生产意义。本研究旨在通过添加外源氨基酸的方式,研究各种氨基酸及其复配对香菇生长的影响,并筛选出促进香菇生长的氨基酸种类及适宜浓度,通过相关生理指标的测定阐明外源氨基酸促进香菇生长的可能代谢途径,以期更好地为实际生产提供有力指导。
1 材料与方法 1.1 材料 1.1.1 供试菌株香菇18菌株由上海市农业科学院食用菌研究所提供。
1.1.2 培养基和主要试剂、仪器马铃薯葡萄糖琼脂(PDA)、马铃薯葡萄糖肉汤(PDB),上海碧迪(BD)医疗器械有限公司;丙二醛(malondialdehyde,MDA)含量检测试剂盒、谷丙转氨酶(glutamic pyruvic transaminase,GPT)活性检测试剂盒、谷草转氨酶(glutamic oxaloacetic transaminase,GOT)活性检测试剂盒,北京索莱宝科技有限公司;丙酮酸(pyruvic acid,PA)含量检测试剂盒,苏州科铭生物技术有限公司;大型真菌蛋白提取试剂盒,BestBio贝博生物科技有限公司;SDS-PAGE预制胶、电泳液、蛋白上样缓冲液、BCA法蛋白浓度测定试剂盒及考马斯亮蓝染色试剂盒,上海碧云天生物技术有限公司;PageRulerTM Prestained Protein Ladder,宝林科(北京)生物科技有限公司;L-丝氨酸、L-天冬酰胺,国药集团化学试剂有限公司;L-丙氨酸,生工生物工程(上海)股份有限公司。
电热恒温水浴锅,北京一恒(上海)科学仪器有限公司;酶标仪,TECAN公司;彩色扫描仪,Veutron Corporation公司;电泳仪,Bio-Rad公司;台式高速离心机,Eppendorf公司。
1.2 方法 1.2.1 氨基酸母液的配制根据各氨基酸的溶解度差异,配制不同母液浓度的氨基酸溶液:丙氨酸溶液20 g/L,丝氨酸溶液20 g/L,天冬酰胺溶液浓度10 g/L。
1.2.2 生长速度的测定在PDA培养基中添加不同量的氨基酸母液,使之成为终浓度为0、10、100、200、1 000 mg/L的培养基,1×105 Pa高温灭菌20 min,倒平板备用。参考杨焕玲等[13]的方法稍有修改,在活化过的香菇18菌株菌丝边缘用1 mL枪头打孔,分别接种在3种氨基酸的不同浓度平板中央。在25 ℃培养箱中培养6 d,以菌块为中心点,在平板背面用直尺和记号笔画十字,在菌丝末端进行第一次划线,再放入25 ℃培养箱中继续培养2 d,进行第二次划线。用游标卡尺测量2次划线之间的距离L (mm),生长速度V (mm/d)=L/2,即为菌丝的生长速度。每个氨基酸浓度设置12组重复。
1.2.3 液体培养基的配制及菌丝的收集根据所需培养基浓度在PDB培养基中添加不同量的氨基酸母液,1×105 Pa高温灭菌20 min,备用。将在25 ℃培养14 d的香菇菌丝用均质仪打碎,分别接种在灭菌的3种氨基酸不同浓度的液体培养基中,25 ℃、150 r/min避光培养14 d,将无纺布过滤收集的香菇菌丝用液氮速冻后置于-80 ℃冰箱中备用。
1.2.4 生理生化指标测定PA含量测定:用液氮将菌丝研磨充分,称取约0.1 g研磨后的菌丝,加入1 mL的PA提取液,冰浴匀浆后静置30 min,25 ℃、8 000×g离心10 min后取上清待测,测定步骤按PA含量检测试剂盒说明书进行,测定520 nm处的吸光度A后计算PA含量。PA含量(μg/mg-prot)= 42.92×(A-0.0675)/Cpr,式中,A表示样本吸光度,Cpr表示样本蛋白浓度,下同。
GOT、GPT活性测定:用液氮将菌丝研磨充分,称取约0.1 g菌丝加入1 mL的GOT (GPT)提取液进行冰浴匀浆,4 ℃、3 500×g离心10 min后取上清置于冰上待测,活性测定按GOT、GPT活性测定试剂盒说明书进行,先进行标准曲线的绘制得到y=kx+b,然后计算GOT、GPT活性,GOT (GPT)活性(U/mg-prot)=12x/Cpr。
MDA含量测定:用液氮将菌丝研磨充分,称取约0.1 g菌丝加入1 mL的MDA提取液进行冰浴匀浆,4 ℃、8 000×g离心10 min后取上清置于冰上待测,加样顺序按MDA含量检测试剂盒说明书进行,分别测定各样本在450、532和600 nm的吸光度,计算MDA含量:MDA含量(nmol/mg-prot)= 5×[12.9(ΔA532-ΔA600)-1.12×ΔA450]/Cpr。
蛋白质提取、定量及SDS-PAGE电泳:用液氮将菌丝充分研磨,称取0.1 g菌丝于2 mL离心管中,加入预冷的真菌蛋白提取液,真菌蛋白提取液的配制及提取方法按照说明书进行。吸取20 μL的蛋白提取液进行蛋白浓度的测定。取菌丝蛋白提取液置于无菌离心管中,加入5×蛋白loading buffer,沸水浴10 min,以蛋白量为20 μg的上样量在12%预制胶的上样孔中注入一定体积的样品,电泳结束后按照试剂盒方法进行染色脱色处理,直至凝胶接近透明,可以清晰地观察到蛋白条带。使用Powerlook 2100XL-USB扫描仪拍照分析。
2 结果与分析 2.1 外源添加不同浓度氨基酸的单因素试验单因素试验结果显示(图 1),在试验浓度范围内,Ala在外源添加浓度为100 mg/L时菌丝生长速度达到最大值3.617 5 mm/d,当浓度超过100 mg/L时生长速度降低,当Ala浓度大于200 mg/L时菌丝生长速度趋于稳定;Asn同样在外源添加浓度为100 mg/L时菌丝生长速度达到最大值3.553 7 mm/d,但添加浓度超过200 mg/L时菌丝生长受到抑制;而Ser则在10 mg/L时菌丝生长速度达到最大值3.762 5 mm/d,在试验浓度范围内菌丝生长呈先促进后抑制的趋势。3种氨基酸对香菇菌丝的促进效果不同,分别与各自的对照组(0 mg/L)相比,最大生长速度下生长促进率大小排序为Ala (14.3%) > Ser (7.2%) > Asn (3.2%)。
|
| 图 1 不同浓度的氨基酸培养基对香菇菌丝生长速度的影响 Figure 1 Effect of different concentrations of amino acid medium on the growth rate of Lentinula edodes mycelia. |
|
|
为了识别和量化任意2个氨基酸之间复杂的交互作用,使用Design-Expert 11软件对试验进行设计和分析。
对菌丝生长速度结果进行显著性分析,基于3种氨基酸的单因素试验结果,根据Box-Behnken试验设计原理进行优化试验,取Ala、Ser、Asn这3个因素,以生长速度为响应值。选取氨基酸培养基低浓度作为低水平记作-1,高浓度培养基作为高水平记作1,软件自动生成中间值编码记作0。试验中具体因素水平对应的培养基浓度如表 1所示。
| 因素 Factors |
编码 Code |
编码水平Coding level | ||
| -1 | 0 | 1 | ||
| 丙氨酸浓度 Ala concentration (mg/L) |
A | 10 | 100 | 200 |
| 天冬酰胺浓度 Asn concentration (mg/L) |
B | 10 | 100 | 200 |
| 丝氨酸浓度 Ser concentration (mg/L) |
C | 0 | 10 | 20 |
在三因素三水平上对17个试验点进行生长速度的测定,利用Box-Behnken响应面模型进行的试验设计及试验结果如表 2所示。17个试验点中有5个重复是用来估算实验误差的零点,其余12个点是析因点。将表 2中得到的数据进行多元回归拟合,得到以香菇18菌丝生长速度为目标函数,关于各条件编码值的二次回归方程为:Y=4.07+0.110 9A+0.039 9B-0.132 9C- 0.063 8AB-0.102 8AC-0.140 1BC-0.098 0A2- 0.191 6B2-0.264 4C2。
| 试验号 Test No. |
A | B | C | 生长速度 Growth rate (mm/d) |
| 1 | -1 | -1 | 0 | 3.437 92 |
| 2 | 1 | -1 | 0 | 3.845 42 |
| 3 | -1 | 1 | 0 | 3.835 42 |
| 4 | 1 | 1 | 0 | 3.987 92 |
| 5 | -1 | 0 | -1 | 3.672 50 |
| 6 | 1 | 0 | -1 | 4.041 67 |
| 7 | -1 | 0 | 1 | 3.571 67 |
| 8 | 1 | 0 | 1 | 3.529 58 |
| 9 | 0 | -1 | -1 | 3.637 92 |
| 10 | 0 | 1 | -1 | 3.807 92 |
| 11 | 0 | -1 | 1 | 3.692 92 |
| 12 | 0 | 1 | 1 | 3.302 50 |
| 13 | 0 | 0 | 0 | 3.956 82 |
| 14 | 0 | 0 | 0 | 4.106 25 |
| 15 | 0 | 0 | 0 | 4.161 25 |
| 16 | 0 | 0 | 0 | 4.057 08 |
| 17 | 0 | 0 | 0 | 4.050 00 |
表 3中该回归模型差异极显著(P < 0.01),而且失拟项不显著(P=0.082 3 > 0.05),说明该试验可靠,模型具有统计意义。二次回归模型方差的一次项A、C均对响应值生长速度影响显著(P < 0.05),说明Ala、Ser二者对香菇18菌株菌丝生长速度的影响均较大,而Asn对香菇菌丝生长速度影响较小。二次项B2、C2对响应值均有显著影响(P < 0.05),而且C2对响应值的影响达到极显著水平(P < 0.01)。交互项AB、AC、BC对响应值的影响均不显著(P > 0.05),说明任意2种氨基酸的交互作用对香菇菌丝的生长影响较小。在所选的因素水平范围内,由P值可知3种氨基酸对香菇菌丝生长速度影响的大小顺序依次为丝氨酸(Ser) > 丙氨酸(Ala) > 天冬酰胺(Asn)。
| 来源 Source |
平方和 Sum of squares |
自由度 df |
均方 Mean square |
F value | P value | 显著性 Significance |
| 模型Model | 0.926 6 | 9 | 0.103 0 | 6.84 | 0.009 5 | ** |
| A-Ala | 0.098 4 | 1 | 0.098 4 | 6.54 | 0.037 7 | * |
| B-Asn | 0.012 8 | 1 | 0.012 8 | 0.848 6 | 0.387 6 | NS |
| C-Ser | 0.141 3 | 1 | 0.141 3 | 9.39 | 0.018 2 | * |
| AB | 0.016 3 | 1 | 0.016 3 | 1.08 | 0.333 1 | NS |
| AC | 0.042 3 | 1 | 0.042 3 | 2.81 | 0.137 6 | NS |
| BC | 0.078 5 | 1 | 0.078 5 | 5.22 | 0.056 3 | NS |
| A2 | 0.040 5 | 1 | 0.040 5 | 2.69 | 0.145 0 | NS |
| B2 | 0.154 5 | 1 | 0.154 5 | 10.27 | 0.015 0 | * |
| C2 | 0.294 3 | 1 | 0.294 3 | 19.56 | 0.003 1 | ** |
| 残差Residual | 0.105 3 | 7 | 0.015 0 | |||
| 失拟项Lack of fit | 0.082 4 | 3 | 0.027 5 | 4.79 | 0.082 3 | NS |
| 误差Error | 0.022 9 | 4 | 0.005 7 | |||
| 总和Sum | 1.03 | 16 | ||||
| 注:*:差异显著(P < 0.05);**:差异极显著(P < 0.01);NS:差异不显著 Note: *: Significant difference at P < 0.05; **: Significant difference at P < 0.01; NS: Difference is not significant. | ||||||
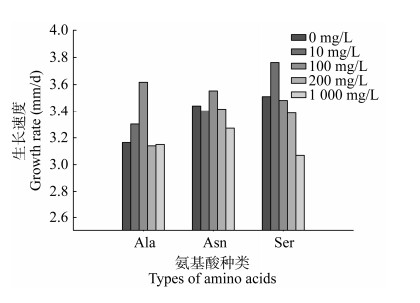
软件得到的三维响应面图和二维等高线图见图 2,可以直观地看出3个氨基酸因素对菌丝生长速度的影响及变化趋势。此回归模型在所选试验范围内存在最大值。忽略其他影响因素,利用软件预测的最佳氨基酸复配浓度为:Ala为174.711 mg/L、Asn为113.826 mg/L、Ser为5.661 mg/L,香菇菌丝理论生长速度为4.13 mm/d。
|
| 图 2 3种氨基酸交互作用图 Figure 2 Interaction diagram of three amino acids. A、B:Ala与Asn对菌丝生长速度的影响;C、D:Ala与Ser对菌丝生长速度的影响;E、F:Asn与Ser对菌丝生长的影响 A, B: Effects of Ala and Asn on the growth rate of mycelia; C, D: Effects of Ala and Ser on the growth rate of mycelia; E, F: Effects of Asn and Ser on the growth rate of mycelia. |
|
|
考虑到实际操作的可行性,将验证组外源添加浓度调整为:Ala为174.7 mg/L、Asn为113.8 mg/L、Ser为5.6 mg/L。对照组(PDA)与验证组(aa)各设置12组平行,测量香菇菌丝生长速度。对验证组和对照组菌丝生长速度采用独立样本t检验,判断验证组培养基是否对香菇18菌丝生长速度有影响,结果如表 4所示。
| 培养基类型 Type of medium |
生长速度 Growth rate (mm/d) |
t | P值 P value |
| PDA | 3.104 2 | -8.604 | < 0.01 |
| aa | 3.951 3 |
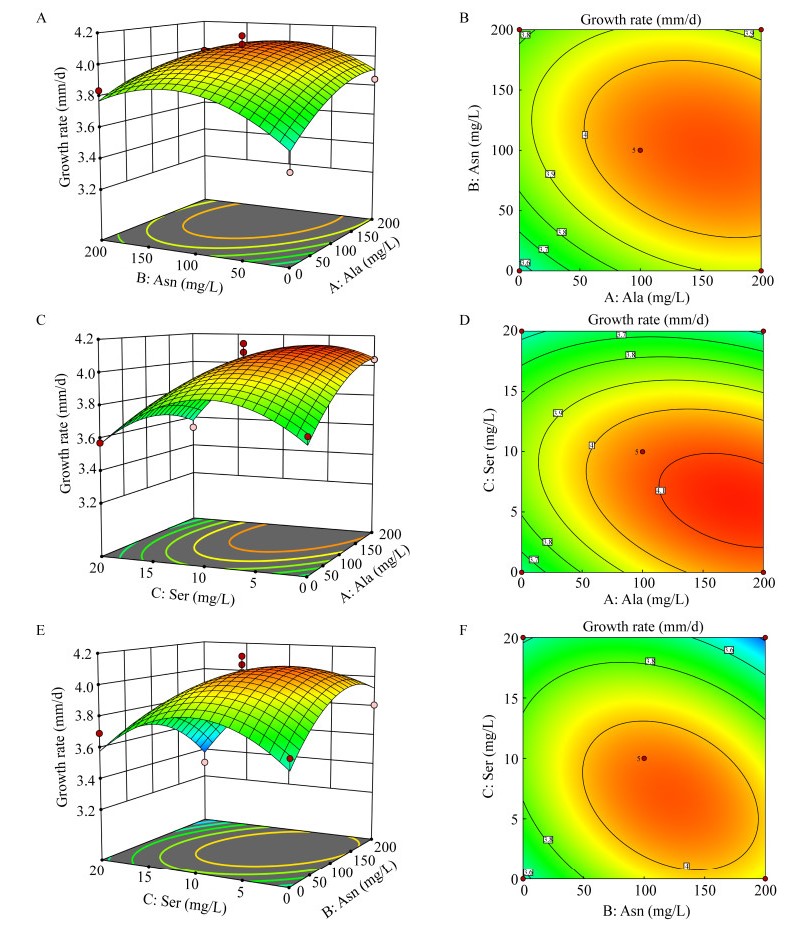
验证组菌丝实际生长速度均值为3.951 3 mm/d,与理论菌丝生长速度4.13 mm/d有较小差异,可能由于测量误差以及实验菌株不同传代次数之间菌丝生长速度存在一定差异的原因。验证组菌丝生长促进率达到27.3%,差异性检验结果显示:与对照组相比,验证组菌丝生长速度在P < 0.01水平下呈现差异,即验证组的菌丝生长速度明显快于对照组的菌丝生长速度。观察对照组和验证组菌丝生长形态(图 3)也可看出,验证组香菇菌丝长势好、形态均匀,说明此氨基酸复配配方对香菇18菌株菌丝的生长具有明显的促进效果。
|
| 图 3 验证组与对照组香菇菌丝生长7 d形态比较 Figure 3 Comparison of mycelial growth morphology for 7 days between the verification group and the control group. |
|
|
为探究复配氨基酸添加对香菇菌丝的生理影响,测定了丙酮酸(PA)和丙二醛(MDA)的含量以及谷草转氨酶(GOT)和谷丙转氨酶(GPT)的活性大小。与对照组(4.59 μg/mg-prot)相比,验证组(5.41 μg/mg-prot)菌丝体的PA含量增加17.8%,说明外源添加复配氨基酸的培养基可以提高菌丝体PA含量,但变化水平不显著(P > 0.05,图 4A)。对照组MDA含量为0.69 nmol/mg-prot,而验证组MDA含量为0.49 nmol/mg-prot,由此可以看出,复配氨基酸培养基可显著降低香菇菌丝体MDA含量来缓解脂质氧化损伤(P < 0.05,图 4B)。GOT、GPT是氨基酸代谢中的重要酶,与未添加复配氨基酸培养基的菌丝体相比,验证组菌丝体中GOT活性增加1.4倍(图 4C),GPT活性增加3.6倍(图 4D),因此复配氨基酸培养基可以显著提高香菇菌丝体氨基酸代谢中这2个重要酶的活性(P < 0.05)。
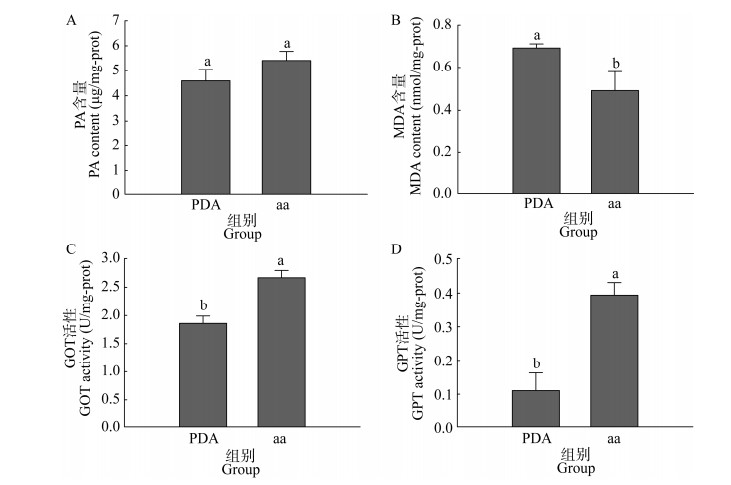
|
| 图 4 生理指标测定 Figure 4 Determination of physiological indexes. A:PA含量;B:MDA含量;C:GOT活性;D:GPT活性。不同小写字母表示差异显著(P < 0.05),下同 A: PA content; B: MDA content; C: GOT activity; D: GPT activity. Different lowercase letters indicate a significant difference at P < 0.05, the same below. |
|
|
与对照组相比,验证组菌丝蛋白质含量增加了7.75%,说明外源添加复配氨基酸可以显著提高香菇菌丝蛋白浓度(图 5A)。为了比较复配氨基酸添加是否会改变香菇菌丝的蛋白组成,提取菌丝蛋白进行SDS-PAGE电泳(图 5B)。验证组和对照组蛋白上样量均为20 μg,条带结果显示验证组和对照组蛋白条带组成基本一致。以上实验结果表明,外源添加复配氨基酸的培养基对香菇菌丝蛋白的组成并未产生影响,但会显著提高香菇菌丝的蛋白浓度。
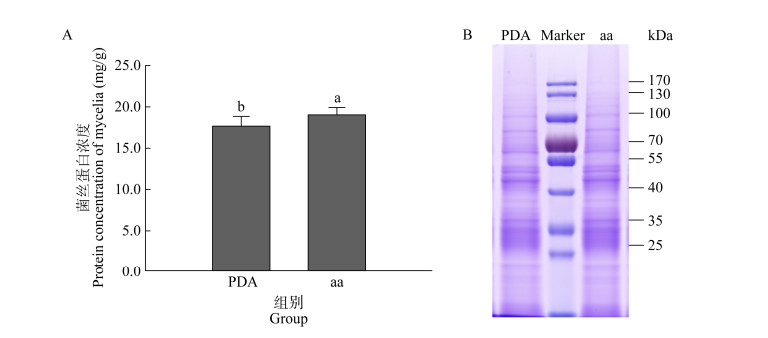
|
| 图 5 蛋白浓度测定(A)及SDS-PAGE电泳图(B) Figure 5 Protein concentration determination (A) and SDS-PAGE electrophoresis chart (B). |
|
|
氨基酸肥已广泛用于植物生长发育的研究,氨基酸含有碳、氮等元素,不仅可以参与能量代谢,还能为植物生长提供氮源。氨基酸液肥能增加甜玉米的叶绿素含量,促进根系生长发育[14];喷施适宜浓度的甘氨酸可以促进小油菜对氮、磷和钾等养分的吸收,提高产量[15]。为探究氨基酸对香菇菌丝生长的影响,进行不同浓度梯度的外源添加氨基酸单因素试验,并以菌丝生长速度作为考察指标。研究结果表明香菇菌丝可以很好地吸收利用Ala、Asn、Ser这3种氨基酸,菌丝生长都呈现先促进后抑制的趋势,这与赵萍[7]研究外源添加氨基酸对黑木耳菌丝生长影响的结果一致。
Delmas等[16]曾报道白黄侧耳(Pleurotus cornucopiae)在菌丝生长阶段需要混合氨基酸而在子实体阶段仅需要天冬酰胺。本研究在单因素试验的基础上分别筛选出3种氨基酸合适的浓度范围,在三因素三水平上,进行氨基酸浓度的响应面优化试验,以探究在香菇菌丝生长过程中氨基酸复配的最佳浓度及其互作关系。优化后的3种氨基酸复配培养基可以有效促进香菇菌丝的生长且形态良好,可以为香菇栽培基质的营养因子选择提供种类及添加量的理论依据。生理指标测定结果显示,外源添加混合氨基酸的香菇菌丝转氨酶活性明显高于对照组,这与张政[17]研究中的氨基酸处理可以促进黄瓜体内GOT和GPT活性的结果一致。GOT和GPT是氨基酸代谢中的重要酶,二者活性的高低可以反映生物体氮代谢的强弱,而氮代谢则会影响生物体的蛋白质代谢和生长发育[18]。外源氨基酸可以显著增加香菇菌丝的蛋白浓度,但并未改变菌丝的蛋白组成。这可能是因为氨基酸添加促进了转氨酶活性进而合成更多种类的氨基酸,为蛋白质的翻译过程提供了更多的构件分子[19]。
此外,外源氨基酸可以帮助生物体缓解外界各种胁迫的影响。如外源添加脯氨酸能够改善玉米和蚕豆因盐害而引起的生理变化[20];外源谷氨酸对铝胁迫下多花黑麦草幼苗的生长具有缓解作用[21],这说明逆境胁迫下外源氨基酸添加会改变植物体的生理代谢,启动相应的应激适应机制[22]。外源氨基酸能否在各种胁迫下为食用菌生长发育提供应激保护有待我们进一步探究。目前,在食用菌的氨基酸外源添加研究中,筛选有效的氨基酸种类、适宜的氨基酸浓度,并深入探究外源氨基酸对食用菌的生理影响,将为产业的高质量发展提供新的研究方向。
4 结论筛选出复配氨基酸的理论最佳添加浓度为:Ala为174.711 mg/L、Asn为113.826 mg/L、Ser为5.661 mg/L,而且验证试验表明该培养基可以显著促进香菇菌丝生长,促进生长率可达到27.3%。复配氨基酸培养基中香菇菌丝丙酮酸和蛋白质含量更高,该培养基可以显著提高香菇菌丝GOT、GPT活性,减少MDA的积累。
| [1] |
Bian YB. Edible Mushroom Cultivation[M]. 3rd ed. Beijing: Higher Education Press, 2017: 138. (in Chinese) 边银丙. 食用菌栽培学[M]. 3版. 北京: 高等教育出版社, 2017: 138. |
| [2] |
Cao B, Guo YY, Shang T. Study on development characteristics of Lentinus edodes industry in Japan based on the porter's five forces model[J]. Edible Fungi of China, 2019, 38(7): 85-90, 97. (in Chinese) 曹斌, 郭芸芸, 尚团. "波特五力分析"视阙下的日本香菇产业发展特点研究[J]. 中国食用菌, 2019, 38(7): 85-90, 97. |
| [3] |
Cao B. Prospects and implementation path of promoting high-quality development of Lentinula edodes industry in China during the 14th five-year plan period[J]. Acta Edulis Fungi, 2020, 27(4): 25-34. (in Chinese) 曹斌. "十四五"时期推进我国香菇产业高质量发展的前景和实现路径[J]. 食用菌学报, 2020, 27(4): 25-34. |
| [4] |
Liu XM, Chen Q, Wu XL, Huang CY. Usage of mineral and amino acid additives in edible mushroom cultivation[J]. Acta Edulis Fungi, 2018, 25(1): 120-125. (in Chinese) 刘秀明, 陈强, 邬向丽, 黄晨阳. 国内外食用菌增产添加物研究进展[J]. 食用菌学报, 2018, 25(1): 120-125. |
| [5] |
Wang XF, Dai CC, Jiang HL, Chen ZL, Shi HJ, Li J. The effect of the Se to the fruiting-body of Pleurotus ostreatus and nutrition composition[J]. Food Science, 2005, 26(8): 91-95. (in Chinese) 王新风, 戴传超, 蒋海龙, 陈珍丽, 石洪娟, 李晶. 硒对栽培平菇产量及营养成分影响的研究[J]. 食品科学, 2005, 26(8): 91-95. DOI:10.3321/j.issn:1002-6630.2005.08.015 |
| [6] |
Lu JJ. Effects of copper on growth and development of Pleurotus ostreatus[D]. Zhengzhou: Master's Thesis of Henan Agricultural University, 2015 (in Chinese) 卢娇娇. 铜(Cu2+)对糙皮侧耳生长发育的影响研究[D]. 郑州: 河南农业大学硕士学位论文, 2015 |
| [7] |
Zhao P. Effect of amino acids on growth and development of Auricularia auricula[J]. Journal of Gansu Agricultural University, 1997, 32(2): 61-64. (in Chinese) 赵萍. 氨基酸对黑木耳菌丝生长发育的影响[J]. 甘肃农业大学学报, 1997, 32(2): 61-64. |
| [8] |
Carroll AD, Jr., Schisler LC. Delayed release nutrients for mushroom culture: US3942969[P]. 1976-03-09
|
| [9] |
Shimokawa T, Nakamura M, Sekiya A, Hiroki A, Tamada M. Grifola froundosa yield-increasing agent, medium for Grifola froundosa fruit-body cultivation using the same, medium or culture medium for proliferating Grifola froundosa mycelium, and Grifola froundosa cultivating method: JP2009201465[P]. 2009-09-10
|
| [10] |
Song QC, Cao FQ, Gong YY, Cheng XY, Bi XY, Liu LH. Current research progresses of amino acids uptake, transport and their biological roles in higher plants[J]. Plant Nutrition and Fertilizer Science, 2012, 18(6): 1507-1517. (in Chinese) 宋奇超, 曹凤秋, 巩元勇, 程晓园, 毕昕媛, 刘来华. 高等植物氨基酸吸收与转运及生物学功能的研究进展[J]. 植物营养与肥料学报, 2012, 18(6): 1507-1517. |
| [11] |
Ling MZ. Nutritional conditions and environmental regulation of edible fungi cultivation[J]. Friendly Advisor of Wealth-malzing, 1994(10): 14-15. (in Chinese) 铃木彰. 食用菌栽培的营养条件与环境调控[J]. 致富之友, 1994(10): 14-15. |
| [12] |
Zhu W, An YP, Wei ZF, Zhang YX, Wen Q. Study on the Effect of amino acid water-soluble fertilizer on cultivation of Pleurotus ostreatus clinker[J]. Edible Fungi, 2019, 41(1): 27-29, 36. (in Chinese) 竹玮, 安运平, 魏忠方, 张应香, 文晴. 氨基酸水溶肥对平菇熟料栽培的影响研究[J]. 食用菌, 2019, 41(1): 27-29, 36. |
| [13] |
Yang HL, Zha L, Zhao X, Zhao Y, Wang Q, Yu CX, Chen MJ. Effect of adding trehalose to culture medium on the growth of Stropharia rugosoannulata and Hypsizigus marmoreus[J]. Microbiology China, 2019, 46(5): 1108-1114. (in Chinese) 杨焕玲, 查磊, 赵旭, 赵妍, 王倩, 余昌霞, 陈明杰. 培养基中添加海藻糖对大球盖菇、斑玉蕈菌丝生长的影响[J]. 微生物学通报, 2019, 46(5): 1108-1114. |
| [14] |
Wu YQ, Shi ZS, Li RH, Chen FY, Wang CN, Wang ZB. Effect of plant amino acid liquid fertilizer on the physiological index and yield of sweet corn[J]. Journal of Maize Sciences, 2006, 14(5): 130-133. (in Chinese) 吴玉群, 史振声, 李荣华, 陈凤玉, 王超男, 王志斌. 植物氨基酸液肥对甜玉米产量及生理指标的影响[J]. 玉米科学, 2006, 14(5): 130-133. DOI:10.3969/j.issn.1005-0906.2006.05.035 |
| [15] |
Yu HL, Lin ZA, Li YT, Yuan L, Zhao BQ. Effects of spraying low molecular organic compounds on growth and nutrients uptake of rape (Brassica Chinensis L.)[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(6): 1560-1568. (in Chinese) 于会丽, 林治安, 李燕婷, 袁亮, 赵秉强. 喷施小分子有机物对小油菜生长发育和养分吸收的影响[J]. 植物营养与肥料学报, 2014, 20(6): 1560-1568. |
| [16] |
Delmas J, Mamoun M. Study of some growth and fruiting factors of Pleurotus cornucopiae[J]. Comptes Rendus Des Seances De Lacademie, 1980, 66(3): 294-301. |
| [17] |
Zhang Z. Effects of amino acid nitrogen on cucumber growth[D]. Chongqing: Master's Thesis of Southwest Agricultural University, 2005 (in Chinese) 张政. 氨基酸态氮对黄瓜的营养效应[D]. 重庆: 西南农业大学硕士学位论文, 2005 |
| [18] |
Zhang JY. Effect of irrigation on nitrogen metabolism and yield of sown rice in cold-region[D]. Harbin: Master's Thesis of Northeast Agricultural University, 2019 (in Chinese) 张君颜. 灌溉方式对寒地直播稻氮代谢及产量的影响[D]. 哈尔滨: 东北农业大学硕士学位论文, 2019 |
| [19] |
Wang JY, Zhu SG, Xu CF. Biochemistry[M]. 3rd ed. Beijing: Higher Education Press, 2002: 123. (in Chinese) 王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 3版. 北京: 高等教育出版社, 2002: 123. |
| [20] |
El-Samad HMA, Shaddad MAK, Barakat N. Improvement of plants salt tolerance by exogenous application of amino acids[J]. Journal of Medicinal Plant Research, 2011, 5(24): 5692-5699. |
| [21] |
Shi YH, Huang YT, Shu FZ, Lu Y, Liu DL. Alleviation of exogenous glutamic acid on seedling growth of Italian ryegrass under aluminum stress[J]. Acta Agrestia Sinica, 2020, 28(6): 1605-1614. (in Chinese) 施燕华, 黄玉婷, 束方智, 陆叶, 刘大林. 外源谷氨酸对铝胁迫下多花黑麦草幼苗生长的缓解作用[J]. 草地学报, 2020, 28(6): 1605-1614. |
| [22] |
Teh CY, Ho CL, Shaharuddin NA, Lai KS, Mahmood M. Proteome of rice roots treated with exogenous proline[J]. 3 Biotech, 2019, 9(3): 1-8. |
 2022, Vol. 49
2022, Vol. 49