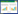扩展功能
文章信息
- 李响, 李倩, 高伟, 朱云瑾, 王汐月, 王绪敏, 郑立
- LI Xiang, LI Qian, GAO Wei, ZHU Yunjin, WANG Xiyue, WANG Xumin, ZHENG Li
- 深海热液生物共附生可培养硫氧化细菌的多样性及硫氧化特性
- Diversity and sulfur oxidation characteristics of culturable sulfur-oxidizing bacteria associated with benthic organisms in deep-sea hydrothermal area
- 微生物学通报, 2022, 49(2): 437-448
- Microbiology China, 2022, 49(2): 437-448
- DOI: 10.13344/j.microbiol.china.210746
-
文章历史
- 收稿日期: 2021-08-16
- 接受日期: 2021-09-19
- 网络首发日期: 2021-11-24
2. 自然资源部第一海洋研究所 自然资源部海洋生态环境科学与技术重点实验室, 山东 青岛 266061;
3. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266071
2. Key Laboratory of Marine Eco-Environmental Science and Technology, The First Institute of Oceanography, Ministry of Natural Resources, Qingdao 266061, Shandong, China;
3. Marine Ecology and Environmental Science Laboratory, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, Shandong, China
深海热液区是地球上最极端的环境之一,具有高/低温、高压、高硫含量等环境特点,造就了有别于浅海和陆地热液的特殊生态系统。热液区的生物群落中遍布着数十种管状蠕虫、以甲壳类动物为食的鱼类、依靠共附生微生物获取营养的软体动物及一些虾和螃蟹等,具有很高的生物多样性[1]。
多种证据表明,海底热液生态系统呈现出明显的大型生物与化学自养细菌、古菌等微生物共生的特征,特别是这种大型的底栖生物会通过与硫氧化细菌的共生以摄取营养[2]。已知一种无消化系统的管状蠕虫(Riftiapachyptila)[3]获取养分的唯一途径即是利用体内的硫氧化细菌,这些硫氧化细菌利用火山口释放的硫化氢气体作为地热能源进行化能自养生长,将二氧化碳转化为有机物,为热液群落中的共生生物提供食物来源。对冲绳海槽伊平屋热液活动区热液伴溢蛤(Calyptogena magnifica)的研究发现[4],其鳃组织内充满了共生的细菌,在显微镜下可观察到大量的无机硫磺晶体,经证实这些共生细菌中存在着硫氧化细菌,它们通过化能自养将热液环境中的硫化氢等还原性物质氧化而产生能量,为宿主提供营养。以上研究表明,硫氧化细菌在深海热液生物的生长中扮演着重要角色,基本所有的热液区无脊椎动物都需要通过与硫氧化细菌共生来获得营养[5],但热液环境中关于可培养硫氧化细菌的报道较少,多数是从附近的沉积物中分离,徐鈜绣等[6]从南大西洋深海热液硫化物及其附近的沉积物中分离纯化硫氧化细菌,结果表明硫氧化细菌多样性丰富且不同站位存在差异,主要隶属于Alphaproteobacteria、Gammaproteobacteria和Actinobacteria。杜瑞等[7]从冲绳海槽热液区沉积物中分离的硫氧化细菌,主要隶属于Actinobacteria、Firmicutes和Proteobacteria。目前还未见从深海热液生物中分离获得可培养共附生硫氧化细菌的报道,而开展这类细菌多样性和相关的能量代谢的研究对理解深海热液生态系统的维持具有重要的科学意义。
2019年4月,我国大洋科考第52航次在龙旂和天成2个活动热液区观测到大量底栖生物,通过海龙三号遥控无人潜水器(remote operated vehicles,ROV)采集到深海贻贝、芋螺、巨佩托螺和鳞脚螺等生物样本。本研究首次对这些生物样本鳃中的硫氧化细菌进行富集与分离,并对可培养共附生硫氧化细菌多样性进行分析,对不同属硫氧化细菌的硫氧化能力进行检测,探讨其在热液生物对极端环境硫化物解毒过程中发挥的作用及可能参与的代谢类型。
1 材料与方法 1.1 材料 1.1.1 样品的采集研究所用样品为2019年3月-5月大洋科考第52航次采集的西南印度洋中脊龙旂和天成2个热液区的生物样品,经鉴定分别为深海贻贝(Bathymodiolus platifrons)、芋螺(Phymorhynchus sp. Tiancheng)、巨佩托螺(Gigantopelta aegis)和鳞脚螺(Chrysomallon squamiferum)。取1 g采集样品生物的鳃组织用无菌海水振荡清洗3遍,去掉非紧密附生的微生物研磨成匀浆,用10 mL含30%甘油的海水重悬后置于-80 ℃冰箱保存,待航次结束后带回实验室进行富集培养。样品信息见表 1。
| Sample No. | Sample type | Depth (m) | Longtitude (E, °) | Latitude (S, °) | Area of hydrothermal vent |
| LQ-YB | Bathymodiolus platifrons | 2 792 | 49.650 26 | 37.784 04 | Longqi |
| TC-YB | Bathymodiolus platifrons | 2 756 | 63.923 10 | 27.850 81 | Tiancheng |
| TC-01-YL | Phymorhynchus sp. Tiancheng | 2 756 | 63.923 10 | 27.850 81 | Tiancheng |
| LQ-JPL | Gigantopelta aegis | 2 768 | 49.650 00 | 37.783 06 | Longqi |
| LQ-LJL | Chrysomallon squamiferum | 2 768 | 49.650 00 | 37.783 06 | Longqi |
| TC-LJL | Chrysomallon squamiferum | 2 762 | 63.923 15 | 27.850 78 | Tiancheng |
M1[6] (g/L):氯化钠25.00,酚红0.30,二水合氯化钙0.42,七水合硫酸镁1.50,硫酸铵1.00,微量元素(DSM141) 10.00 mL,pH调至7.0,1×105 Pa灭菌30 min,加入过滤除菌的终浓度为15 μg/L的VB12溶液,五水合硫代硫酸钠5.00,磷酸氢二钾0.50,最后调节pH值至7.0;SPG[7] (g/L):酚红0.003,1, 4-哌嗪二乙磺酸6.500,氯化钠25.000,七水合硫酸镁2.700,氯化钾0.500,氯化铵0.250,五水合硫代硫酸钠2.480,二水合氯化钙0.140,六水合氯化镁4.300,磷酸氢二钾0.140,六水合硫酸亚铁铵0.002,微量元素(DSM141) 1 mL,维生素溶液10 mL;pH值调至7.6,1×105 Pa灭菌30 min;SOB[7] (g/L):酚红0.004,微量元素1 mL,碳酸氢钠1.680,氯化钾0.700,磷酸氢二钾0.500,五水合硫代硫酸钠4.960,七水合硫酸镁1.500,二水合氯化钙0.400,氯化铵0.267 5,VB12溶液1 mL,单质硫0.640,海水1 L,pH值调至7.6,1×105 Pa灭菌30 min。
1.2 硫氧化细菌的富集和筛选[6-7] 1.2.1 硫氧化细菌的富集取2 mL样品分别加入50 mL M1、SPG、SOB培养基中,于100 mL锥形瓶中180 r/min、25 ℃进行避光好氧富集,当培养基颜色发生变化后,将1 mL的培养液转至新的培养基中,连续富集3次。
1.2.2 硫氧化细菌的分离、纯化与保藏根据培养基的颜色变化,30 d后将第3次转接的菌液做梯度稀释,稀释倍数为10-2、10-3和10-4,吸取100 μL菌液涂布到相应的平板培养基上,每个梯度2个平行,25 ℃培养;待菌落长出后,用牙签挑取形态、颜色有差异的单菌落,划线分离纯化3次得到纯菌,经相应液体培养基培养后,用30%甘油保种液进行保种并置于-80 ℃低温保藏。
1.3 细菌16S rRNA基因序列测定与系统发育分析分离得到的菌株交由擎科生物(青岛)公司进行16S rRNA基因序列测定,测序结果经剪接得到有效长度约1 500 bp的基因序列,经EzBioCloud数据库进行比对,模式菌株和目的菌株的16S rRNA基因序列采用MEGA 6.0构建系统发育树,方法参照文献[6]。
1.4 细菌硫氧化能力的初步检测将鉴定出来的代表菌株接种到SOB培养基中,选择在含硫培养基中长势较好的不同属的代表菌株,包括Dietzia cercidiphylli M1-TC-01- YL-6、Thioclava nitratireducens M1-LQ-LJL-11、Qipengyuania vulgaris M1-TC-YB-4、Halomonas axialensis SPG-TC-01-YL-7、Salipiger bermudensis SOB-TC-01-YL-5、Alteromonas abrolhosensis SOB-LQ-YB-5和Acinetobacter venetianus M1- TC-01-YL-12,大肠杆菌作为阴性对照,同时设置空白对照,每组3个平行,25 ℃条件下进行培养。通过检测硫代硫酸钠的氧化情况和菌株培养过程中的pH值变化来初步评估菌株的硫氧化能力,检测周期为2 d。由于菌株氧化途径的差异会使培养基的pH产生不同变化,若培养基颜色变红为产碱硫氧化细菌,氧化过程中产生中间代谢产物使pH升高;若培养基颜色变黄为产酸硫氧化细菌,氧化过程中将底物氧化生成硫酸盐使pH下降。硫代硫酸钠浓度采用碘量法进行检测[8],硫氧化能力以硫氧化率来表示,计算公式为:硫氧化率=(初始硫代硫酸钠浓度-剩余硫代硫酸钠浓度)/初始硫代硫酸钠浓度×100%。
2 结果与分析 2.1 菌株的分离与鉴定通过3种含硫培养基(M1、SPG、SOB)的富集和筛选,从2个热液区站点的6个生物样品中分离得到169株硫氧化细菌。
经过测序和EzBioCloud数据库的比对,169株硫氧化细菌属于2个门7个属,2个门分别为放线菌门(Actinobacteria)和变形菌门(Proteobacteria),其中变形菌门(Proteobacteria)为优势菌门,占所有菌株的97%,变形菌门中的γ-变形菌纲(Gammaproteobacteria)是优势菌纲,占84%。7个属包括迪茨氏菌属(Dietzia)、袁其鹏属(Qipengyuania)、粘液盐懒惰菌属(Salipiger)、硫克拉瓦属(Thioclava)、不动杆菌属(Acinetobacter)、盐单胞菌属(Halomonas)和交替单胞菌属(Alteromonas),可培养的细菌中占比最多的是盐单胞菌属(Halomonas),占75%。所有菌株经16S rRNA基因序列比对,确定不同菌株有33株,其中来自龙旂18株、天成15株,细菌的16S rRNA基因比对结果见表 2。
| 站点Sites | 菌株Strains | 登录号Accession No. | 相似菌株Closest strains in GenBank | 相似度Similarity (%) |
| LQ | SOB-LQ-YB-1 | MZ292945 | Alteromonas abrolhosensis PEL67E | 99.85 |
| SOB-LQ-YB-3 | MZ292946 | Alteromonas abrolhosensis PEL67E | 100.00 | |
| SOB-LQ-YB-5 | MZ292937 | Alteromonas abrolhosensis PEL67E | 98.52 | |
| SPG-LQ-YB-6 | MZ292960 | Alteromonas abrolhosensis PEL67E | 99.36 | |
| SPG-LQ-YB-1 | MZ292938 | Alteromonas abrolhosensis PEL67E | 99.51 | |
| SOB-LQ-YB-10 | MZ292939 | Alteromonas abrolhosensis PEL67E | 99.64 | |
| M1-LQ-YB-11 | MZ292950 | Halomonas axialensis Althf1 | 100.00 | |
| M1-LQ-YB-8 | MZ292947 | Halomonas meridiana DSM 5425 | 99.93 | |
| SPG-LQ-LJL-6 | MZ292957 | Halomonas axialensis Althf1 | 99.51 | |
| M1-LQ-LJL-3 | MZ292962 | Dietzia cercidiphylli YIM 65002 | 99.22 | |
| M1-LQ-JPL-11 | MZ292942 | Dietzia lutea YIM 80766 | 98.85 | |
| M1-LQ-JPL-13 | MZ292963 | Halomonas axialensis Althf1 | 99.44 | |
| SOB-LQ-JPL-9 | MZ292936 | Halomonas axialensis Althf1 | 98.95 | |
| M1-LQ-JPL-1 | MZ292948 | Salipiger bermudensis HTCC 2601 | 99.26 | |
| M1-LQ-JPL-3 | MZ292949 | Halomonas meridiana DSM 5425 | 99.78 | |
| SOB-LQ-JPL-2 | MZ292935 | Halomonas meridiana DSM 30161 | 99.93 | |
| M1-LQ-LJL-2 | MZ571942 | Halomonas meridiana DSM 5425 | 99.93 | |
| M1-LQ-LJL-11 | MZ642312 | Thioclava nitratireducens 25B10_4 | 99.27 | |
| TC | SOB-TC-01-YL-5 | MZ292964 | Salipiger bermudensis HTCC 2601 | 98.32 |
| M1-TC-01-YL-10 | MZ292958 | Halomonas meridiana DSM 5425 | 98.74 | |
| M1-TC-01-YL-11 | MZ292959 | Halomonas axialensis Althf1 | 98.88 | |
| SPG-TC-01-YL-7 | MZ292940 | Halomonas axialensis Althf1 | 99.58 | |
| M1-TC-01-YL-4-1 | MZ292941 | Halomonas axialensis Althf1 | 98.33 | |
| M1-TC-01-YL-7 | MZ292951 | Halomonas meridiana DSM 30161 | 99.85 | |
| SOB-TC-01-YL-8 | MZ292956 | Halomonas meridiana DSM 5425 | 99.85 | |
| M1-TC-01-YL-6 | MZ292955 | Dietzia cercidiphylli YIM 65002 | 100.00 | |
| M1-TC-YB-2 | MZ292954 | Dietzia maris DSM 43672 | 100.00 | |
| M1-TC-YB-4 | MZ292953 | Qipengyuania vulgaris 0222-10 | 99.92 | |
| M1-TC-YB-10 | MZ292952 | Dietzia maris DSM 43672 | 98.92 | |
| SOB-TC-YB-3 | MZ292943 | Salipiger bermudensis HTCC 2601 | 99.45 | |
| SOB-TC-LJL-5 | MZ292944 | Salipiger pacificus DSM 26894 | 99.70 | |
| M1-TC-LJL-8 | MZ292961 | Halomonas axialensis Althf1 | 98.96 | |
| M1-TC-01-YL-12 | MZ642310 | Acinetobacter venetianus RAG-1 | 99.24 |
将鉴定出的33株不同硫氧化细菌和模式菌株的16S rRNA基因序列用MEGA 6.0构建系统发育树(图 1),方法参照文献[6],从系统发育树中可以看到这33株不同的硫氧化细菌主要属于γ-变形菌纲(Gammaproteobacteria),其中盐单胞菌属(Halomonas)是主要的属且亲缘关系较近,次优势的属是交替单胞菌属(Alteromonas)。然而α-变形菌纲(Alphaproteobacteria)中的属多样性较高,包括袁其鹏属(Qipengyuania)、粘液盐懒惰菌属(Salipiger)、硫克拉瓦属(Thioclava)和红杆菌科(Rhodobacteraceae)的细菌;而属于放线菌门(Actinobacteria)的5株可培养硫氧化细菌都属于迪茨氏菌属(Dietzia)。
|
| 图 1 可培养硫氧化细菌的系统发育树 Figure 1 The phylogenetic tree of culturable sulfur oxidizing bacteria. 括号中的序号代表菌株的序列登录号;分支点数字代表亲缘关系的置信度;标尺长度代表遗传距离 The contents in parentheses are accession numbers of the strain; Branch point number represents the confidence level of kinship; Scale length represents genetic distance. |
|
|
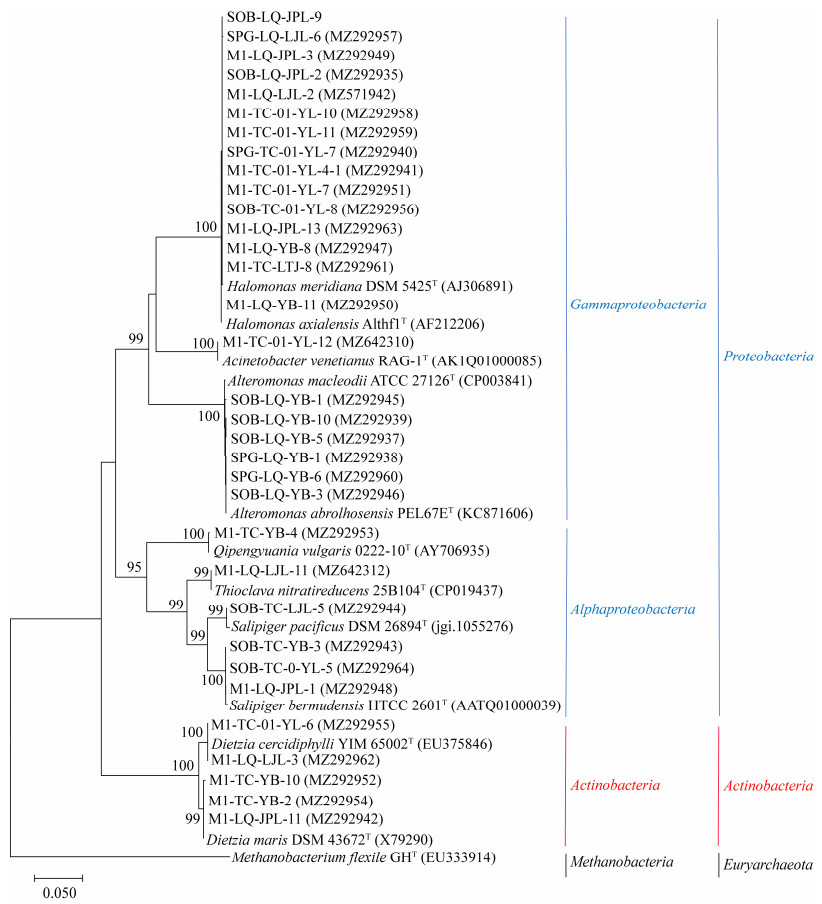
从6个样品TC-01-YL、TC-LJL、TC-YB、LQ-JPL、LQ-LJL和LQ-YB中分别获得30、25、26、32、22和34株菌株(表 3)。经过统计,Halomonas在6个样品中的分离率均为第一,分别占比为72%、74%、76%、81%、85%和62%。统计同一站点不同样品中获得菌株种水平的差异。结果显示,在天成站点中(图 2),不同生物样品中相同种的硫氧化细菌共有2种,属于Salipiger;鳞脚螺中特有的种有1种,属于Salipiger,芋螺中特有的种有4种,属于Halomonas、Dietzia和Thioclava,贻贝中特有的种有2种,属于Dietzia和Qipengyuania;龙旂站点中(图 3),不同生物样品中相同种的硫氧化细菌共有3种,属于Halomonas,贻贝中特有的种有1种,属于Alteromonas;鳞脚螺中特有的种有2种,属于Dietzia和Thioclava;巨佩螺中特有的种有2种,属于Dietzia和Halomonas。
| 样品Samples | 数量Numbers | 属Genera |
| TC-01-YL | 30 | Dietzia (1) Halomonas (22) Salipiger (5) Thioclava (1) Acinetobacter (1) |
| TC-LJL | 25 | Halomonas (18) Salipiger (7) |
| TC-YB | 26 | Dietzia (2) Qipengyuania (1) Halomonas (20) Salipiger (3) |
| LQ-JPL | 32 | Dietzia (1) Halomonas (26) Salipiger (5) |
| LQ-LJL | 22 | Dietzia (1) Halomonas (18) Salipiger (2) Thioclava (1) |
| LQ-YB | 34 | Alteromonas (11) Halomonas (21) Salipiger (2) |

|
| 图 2 天成站点不同生物样品分离硫氧化细菌的种数量 Figure 2 Species number of sulfur-oxidizing bacteria isolated from different samples in the Tiancheng hydrothermal area. |
|
|
|
| 图 3 龙旂站点不同生物样品分离硫氧化细菌的种数量 Figure 3 Species number of sulfur-oxidizing bacteria isolated from different samples in the Longqi hydrothermal area. |
|
|
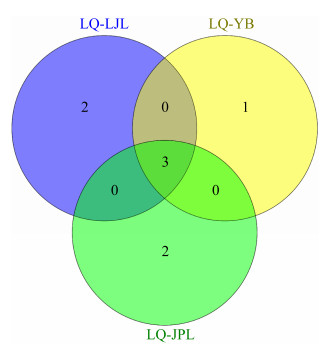
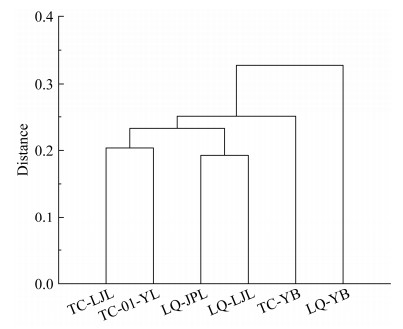
以每个样品获得的不同种的硫氧化细菌为聚类指标,使用Origin 8.0对热液区的6个样品进行系统聚类分析,聚类树状图如图 4所示。从聚类分析结果中可以看出,TC-LJL和TC-01-YL及LQ-JPL和LQ-LJL的物种分别聚为一类,而LQ-YB和TC-YB各自聚为一类。这说明可培养硫氧化细菌种类和采样站位相关,尽管龙旂和天成都采集到鳞脚螺这一物种,但从2个样品中筛选获得的硫氧化细菌却与相同站位的其他物种聚为一类。作为深海热液贻贝来说,由于其鳃体占整个组织的2/3,所以其中的可培养硫氧化细菌不同于其他种类,但来源于2个站点深海热液贻贝的硫氧化细菌也未聚在一起。
|
| 图 4 不同站点样品硫氧化细菌物种聚类分析 Figure 4 Clustering analysis of sample species from different sites. |
|
|
将6个样品按照硫底物浓度的不同将培养基分为M1、SPG和SOB,M1培养基硫底物浓度为5 g/L硫代硫酸钠;SPG培养基硫底物浓度为2.48 g/L硫代硫酸钠;SOB培养基硫底物浓度为4.96 g/L硫代硫酸钠和0.64 g/L的硫粉,3种培养基共获得33种不同的硫氧化细菌,获得菌株数量及种类占比如图 5所示,在M1中,获得10种菌株,属于Dietzia、Qipengyuania、Halomonas、Salipiger、Thioclava和Acinetobacter 6个属;在SPG中,获得3种菌株,属于Alteromonas和Halomonas 2个属;在SOB中,获得6种菌株,属于Halomonas、Salipiger和Halomonas 3个属。在3种培养基中细菌占比最多的是Halomonas,占所有菌株的22%,占比最少的是Qipengyuania和Acinetobacter,占所有菌株的0.6%,从数量和多样性结果来看,利用M1培养基筛选出来的细菌数量和属多样性是最高的。
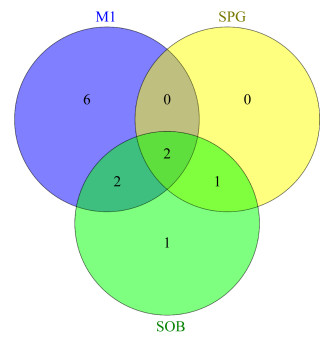
|
| 图 5 不同培养基(M1、SPG、SOB)分离硫氧化细菌的种类及数量 Figure 5 The genera and quantities of sulfur- oxidizing bacteria isolated from different media (M1, SPG, SOB). |
|
|
硫氧化活性检测采用的代表菌株为:非硫氧化细菌大肠杆菌(Escherichia coli);硫氧化细菌Salipiger bermudensis SOB-TC-01-YL-5、Alteromonas abrolhosensis SOB-LQ-YB-5、Dietzia cercidiphylli M1-TC-01-YL-6、Qipengyuania vulgaris M1-TC-YB-4、Halomonas axialensis SPG-TC-01-YL-7、Thioclava nitratireducens M1-LQ-LJL-11和Acinetobacter venetianus M1-TC-01-YL-12,SOB培养基作为空白对照。对以上硫氧化细菌在培养过程中培养液pH的变化进行检测发现,菌株Alteromonas abrolhosensis SOB-LQ-YB-5和Acinetobacter venetianus M1-TC-01-YL-12在培养过程中的pH值无明显变化;剩余硫氧化细菌在培养过程中的pH值呈现下降趋势,其中Salipiger bermudensis SOB-TC-01-YL-5终点pH值从最初的8.32下降到6.27,Thioclava nitratireducens M1-LQ-LJL-11下降到4.50,Halomonas axialensis SPG-TC-01- YL-7下降到5.12,Dietzia cercidiphylli M1-TC- 01-YL-6下降到4.36,降低程度最大(图 6)。通过对以上7株菌培养过程中菌液硫代硫酸钠浓度的检测发现(图 7),它们在培养过程中对硫代硫酸钠的氧化程度不同,氧化率为7%–80%,其中硫氧化细菌Qipengyuania vulgaris M1-TC-YB-4对硫代硫酸钠的氧化率接近80%,而对照组大肠杆菌E. coli的硫代硫酸钠浓度基本无变化。研究发现,硫氧化性较好的几株菌均为产酸硫氧化细菌,随着pH值的逐渐降低,对硫代硫酸钠的氧化率也越来越高。
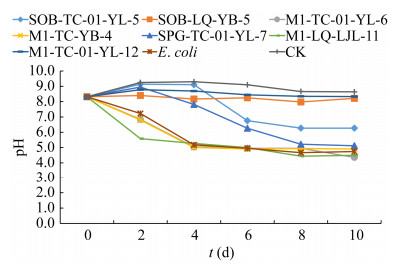
|
| 图 6 不同硫氧化细菌在培养过程中的pH值的变化 Figure 6 Changes in pH values of different sulfur-oxidizing strains during culture. |
|
|
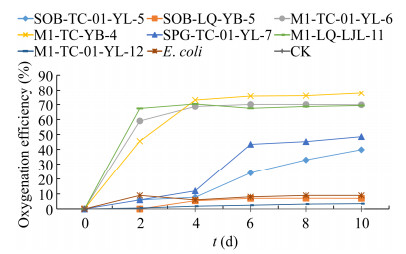
|
| 图 7 不同硫氧化细菌在培养过程中硫氧化率的变化趋势 Figure 7 Changes in sulfur oxidation rate of different sulfur-oxidizing strains during culture. |
|
|
本文以中国大洋科考第52航次获得的热液区生物样品为实验对象,分离得到可培养硫氧化细菌169株,分别属于Proteobacteria和Actinobacteria,其中优势门为Proteobacteria,占所有菌株的97%,其中Gammaproteobacteria是优势纲,占84%,可培养的细菌中占比最多的属是Halomonas,占所有菌株的75%,本研究结果与徐鈜绣等[6]的研究结果较为相近,他们以大洋科考第22航次中获得的沉积物为对象,研究了南大西洋热液区可培养硫氧化细菌的多样性,获得48株硫氧化细菌,分别属于Alphaproteobacteria、Gammaproteobacteria和Actinobacteria,优势菌属为Thalassospira、Martelell和Microbacterium,杜瑞等[7]从冲绳海槽热液区样品中分离得到85株硫氧化细菌,分别属于Firmicutes、Actinobacteria和Proteobacteria,优势属为Hydrogenovibrio、Labrenzia、Thalassospira和Marinobacter。本研究结果显示,可培养硫氧化细菌的优势属为Halomonas,这种在属水平上的差异,猜测可能是由于热液区站点、样品和培养方法不同造成的。对于热液底栖生物共附生硫氧化细菌的分离鉴定工作还未见报道,前人都是通过基因分析的方法证实热液生物中含有大量硫氧化细菌。Zbinden等[8]分析了热液盲虾虾鳃附生菌16S rRNA基因多样性,结果表明虾鳃附生菌中的主要类群属于Epsilonproteobacteria和Gammaproteobacteria,多数为不可培养菌株。侯佳林[9]基于宏基因组的组装方法从深海热液烟囱体中构建了Epsilonproteobacteria和Thermotogae EM3的高质量基因组,分析显示Epsilonproteobacteria具有化能自养的能力,可以将还原性硫和氢气转化为自身所需要的营养物质。我们的实验结果发现,优势硫氧化细菌为Gammaproteobacteria,并未培养出Epsilonproteobacteria的细菌,这主要是因为Epsilonproteobacteria的细菌多为难培养细菌。
对不同样品中分离得到的硫氧化细菌进行为期10 d的硫氧化能力的检测实验,结果发现3株菌有明显的硫氧化能力,分别为Thioclava nitratireducens M1-LQ-LJL-11、Qipengyuania vulgaris M1-TC-YB-4和Dietzia cercidiphylli M1-TC-01-YL-6,对硫化物的氧化率分别达到了70.4%、77.7%和69.8%。3株菌中Qipengyuania的硫氧化能力最高,Qipengyuania[10]是2015年首次发现的一个新属,分离自青藏高原羌塘盆地,在赤杆菌科中的种类较少,近年来在海洋环境中也曾发现[11]。在此前尚未见国内外关于Qipengyuania对硫氧化能力的实验研究,Gao等[12]通过全基因组测序分析其具有与硫酸盐代谢相关的基因,但无实验论证。本研究首次通过可培养的方法发现了Qipengyuania具有较强的硫氧化性,并通过碘量法研究表明其对硫代硫酸钠的氧化率接近80%。Thioclava有报道[13]具有硫氧化功能,可以以硫代硫酸盐为能量源自养生长或以有机酸和糖为能量异养生长。杜瑞等[7]从冲绳海槽热液中分离出Thioclava indica SOB107,通过碘量法研究发现,该菌株可以完全氧化硫代硫酸钠,本研究也发现生物共附生细菌中的Thioclava细菌具有较高的硫氧化能力。值得注意的是,本研究发现Dietzia的放线菌对硫代硫酸盐的氧化率也接近70%,此前尚无研究发现Dietzia具有硫氧化能力。蔡波波[14]从印度洋深海热液区沉积物中分离到一株砷抗性菌Dietzia maris AS-13-3,研究发现该菌具有在烷烃诱导下产生物表面活性物质的能力;谢燕荣[15]从东太平洋热液烟囱中分离到了一株Dietzia,研究证明其具有重金属抗性;Rahman等[16]从深海中分离到Dietzia的细菌,研究发现其可以产生生物表面活性剂,同时具有降解石油和烷烃的能力;而本研究首次发现Dietzia具有较好的硫氧化能力。这些研究结果说明这类细菌具有多种生态学功能以适应极端或胁迫环境。
深海热液环境中大量的硫氧化细菌与海洋生物的共生具有密不可分的关系,Goffredi[17]通过对热液环境中化能合成菌与无脊椎动物之间共生关系的研究发现,共生微生物自养代谢的能量来源于对环境中无机硫的氧化过程,细菌和无脊椎动物的共生关系促进了水生和陆生环境的生物多样性和高生产力。Cavanaugh等[3]通过对深海热液底栖生物的研究发现,这些群落食物链的主要或唯一能量来源是通过细菌的化能自养氧化从喷口排放的硫化氢获取能量。Nakagawa等[18]从日本冲绳县附近的热液沉积物中分离到一株硫氧化细菌Sulfurovum sp. strain NBC37-1,发现其不仅能将热液环境中的盐离子和气体作为合成其生长所需的电子受体和供体,还能够转移环境中毒性较强的重金属(砷酸盐、镉、铜等),据此他们认为该菌在热液沉积环境中大量存在,对底栖生物适应极端环境具有一定的解毒作用。Zbinden等[8]在大西洋无眼裂缝虾(Rimicaris exooculata)的鳃中发现了丰富的微生物群落,通过扫描电镜观察以及对功能基因如甲烷氧化酶基因pmoA和硫氧化酶(Aps)基因的分析表明,铁氧化、硫氧化和甲烷氧化这三类代谢均存在于盲虾虾鳃中并由相关微生物参与。Akerman等[19]通过对热液喷口流体中硫氧化细菌Epsilonproteobacteria的研究发现,它们以单质硫和硫化物的氧化作为主要的化能合成作用,为更高等的生物提供能量来源。本实验从深海热液底栖生物鳃组织样品中获得了大量的硫氧化细菌,也说明这些大型生物与硫氧化细菌通过硫的代谢作用形成了紧密的共生体系。
本研究对热液区底栖生物样品中的硫氧化细菌进行分离鉴定,结果发现这些可培养硫氧化细菌主要以变形菌门的Gammaproteobacteria为主,其中Thioclava、Qipengyuania和Dietzia这3个属的细菌具有较高的硫氧化能力,该研究加深了人们对深海热液生物共附生硫氧化细菌的了解和认识,为进一步研究深海热液共生菌群的功能及其对宿主在极端环境中的解毒作用奠定基础。
致谢: 本次研究感谢中国大洋科考第52航次的支持,感谢自然资源部第二海洋研究所周亚东博士对生物样品的鉴定,感谢中国海洋大学孙进博士提供生物鳃组织样品。| [1] |
Li Y. Hydrothermal organisms, a dark community of organisms in the deep sea[N]. China Mining News, 2020-07-14(4): 1-2 (in Chinese) 李筱. 深海中的黑暗生物群落: 热液生物[N]. 中国矿业报, 2020-07-14(4): 1-2 |
| [2] |
Kelley DS, Baross JA, Delaney JR. Volcanoes, fluids, and life at mid-ocean ridge spreading centers[J]. Annual Review of Earth and Planetary Sciences, 2002, 30(1): 385-491. DOI:10.1146/annurev.earth.30.091201.141331 |
| [3] |
Cavanaugh CM, Gardiner SL, Jones ML, Jannasch HW, Waterbury JB. Prokaryotic cells in the hydrothermal vent tube worm Riftia pachyptila Jones: possible chemoautotrophic symbionts[J]. Science, 1981, 213(4505): 340-342. DOI:10.1126/science.213.4505.340 |
| [4] |
Ma JY, Zhai SK. Biological communities of the hydrothermal area on the Iheya Bideg of Okinawa Trough[J]. Marine Sciences, 1996, 20(2): 30-34. (in Chinese) 马军英, 翟世奎. 冲绳海槽伊平屋海底热液活动区的生物群[J]. 海洋科学, 1996, 20(2): 30-34. |
| [5] |
Zhang L, Qin YS. The characteristic of deep sea hydrothermal ecosystem and their impact on the extreme microorganism[J]. Advances in Earth Science, 2017, 32(7): 696-706. (in Chinese) 张亮, 秦蕴珊. 深海热液生态系统特征及其对极端微生物的影响[J]. 地球科学进展, 2017, 32(7): 696-706. |
| [6] |
Xu HX, Jiang LJ, Li SN, Zhong TH, Lai QL, Shao ZZ. Diversity and sulfur oxidation characteristics of culturable sulfur-oxidizing bacteria in deep-sea hydrothermal vent environments of the South Atlantic[J]. Acta Microbiologica Sinica, 2016, 56(1): 88-100. (in Chinese) 徐鈜绣, 姜丽晶, 李少能, 钟添华, 赖其良, 邵宗泽. 南大西洋深海热液区可培养硫氧化微生物多样性及其硫氧化特性[J]. 微生物学报, 2016, 56(1): 88-100. |
| [7] |
Du R, Yu M, Cheng JG, Zhang JJ, Tian XR, Zhang XH. Diversity and sulfur oxidation characteristics of cultivable sulfur oxidizing bacteria in hydrothermal fields of Okinawa Trough[J]. Acta Microbiologica Sinica, 2019, 59(6): 1036-1049. (in Chinese) 杜瑞, 于敏, 程景广, 张静静, 田晓荣, 张晓华. 冲绳海槽热液区可培养硫氧化细菌多样性及其硫氧化特性[J]. 微生物学报, 2019, 59(6): 1036-1049. |
| [8] |
Zbinden M, Shillito B, Le Bris N, De Villardi De Montlaur C, Roussel E, Guyot F, Gaill F, Cambon-Bonavita MA. New insigths on the metabolic diversity among the epibiotic microbial communitiy of the hydrothermal shrimp Rimicaris exoculata[J]. Journal of Experimental Marine Biology and Ecology, 2008, 359(2): 131-140. DOI:10.1016/j.jembe.2008.03.009 |
| [9] |
Hou JL. Metagenomic study of the structure, evolution and metabolic potential of microbial communities inhabiting deep sea hydrothermal chimneys[D]. Shanghai: Master's Thesis of Shanghai Jiaotong University, 2018 (in Chinese) 侯佳林. 基于宏基因组学方法探究深海热液烟囱体微生物的群落结构, 演替和代谢潜能[D]. 上海: 上海交通大学硕士学位论文, 2018 |
| [10] |
Feng XM, Mo YX, Han L, Nogi Y, Zhu YH, Lü J. Qipengyuania sediminis gen. nov., sp. nov., a member of the family Erythrobacteraceae isolated from subterrestrial sediment[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(Pt_10): 3658-3665. |
| [11] |
Kristyanto S, Lee SD, Kim J. Porphyrobacter algicida sp. nov., an algalytic bacterium isolated from seawater[J]. International Journal of Systematic and Evolutionary Microbiology, 2017, 67(11): 4526-4533. |
| [12] |
Gao Y, Wu YH, Xu L, Cheng H, Wang CS, Xu XW. Complete genome sequence of Qipengyuania sediminis CGMCC 1.12928T, shed light on its role in matter-cycle and cold adaption mechanism of the genus Qipengyuania[J]. Current Microbiology, 2019, 76(9): 988-994. DOI:10.1007/s00284-019-01712-w |
| [13] |
Sorokin DY, Tourova TP, Spiridonova EM, Rainey FA, Muyzer G. Thioclava pacifica gen. nov., sp. nov., a novel facultatively autotrophic, marine, sulfur-oxidizing bacterium from a near-shore sulfidic hydrothermal area[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(3): 1069-1075. |
| [14] |
Cai BB. Biosurfactant production and genome analysis of Dietzia maris AS-13-3 isolated from deep sea hydrothermal field[D]. Xiamen: Master's Thesis of Xiamen University, 2014 (in Chinese) 蔡波波. 深海热液区来源细菌Dietzia maris AS-13-3产表面活性剂研究及基因组的初步分析[D]. 厦门: 厦门大学硕士学位论文, 2014 |
| [15] |
Xie YR. Diversity of heavy-metal resistant microorganisms in the hydrothermal sulfide of the eastern Pacific Ocean and the microbial community structures of the surface seawater across the south mid-Atlantic ridge[D]. Xiamen: Master's Thesis of Xiamen University, 2014 (in Chinese) 谢燕荣. 东太平洋热液烟囱硫化物中重金属抗性微生物及南大西洋跨洋中脊表层海水中微生物种群结构分析[D]. 厦门: 厦门大学硕士学位论文, 2014 |
| [16] |
Rahman PKSM, Sekhon Randhawa KK. Commentary: oil degradation and biosurfactant production by the deep sea bacterium Dietzia maris As-13-3[J]. Frontiers in Microbiology, 2015, 6: 1557. |
| [17] |
Goffredi SK. Indigenous ectosymbiotic bacteria associated with diverse hydrothermal vent invertebrates[J]. Environmental Microbiology Reports, 2010, 2(4): 479-488. |
| [18] |
Nakagawa S, Takaki Y, Shimamura S, Reysenbach AL, Ken TK, Horikoshi K. Deep-sea vent epsilon- proteobacterial genomes provide insights into emergence of pathogens[J]. PNAS, 2007, 104(29): 12146-12150. |
| [19] |
Akerman NH, Butterfield DA, Huber JA. Phylogenetic diversity and functional gene patterns of sulfur-oxidizing subseafloor Epsilonproteobacteria in diffuse hydrothermal vent fluids[J]. Frontiers in Microbiology, 2013, 4: 185. |
 2022, Vol. 49
2022, Vol. 49