扩展功能
文章信息
- 何慧芬, 张璐, 秦爱建, 钱琨
- HE Huifen, ZHANG Lu, QIN Aijian, QIAN Kun
- cGAS-STING信号通路在畜禽疾病中的研究进展
- Role of cGAS-STING signaling pathway in livestock and poultry diseases: a review
- 微生物学通报, 2022, 49(12): 5331-5341
- Microbiology China, 2022, 49(12): 5331-5341
- DOI: 10.13344/j.microbiol.china.220861
-
文章历史
- 收稿日期: 2022-09-06
- 接受日期: 2022-11-01
- 网络首发日期: 2022-11-15
2. 扬州大学江苏省动物预防医学重点实验室, 江苏 扬州 225009;
3. 江苏省动物重要疫病与人兽共患病防控协同创新中心, 江苏 扬州 225009
2. Key Laboratory of Jiangsu Preventive Veterinary Medicine, Yangzhou University, Yangzhou 225009, Jiangsu, China;
3. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, Jiangsu, China
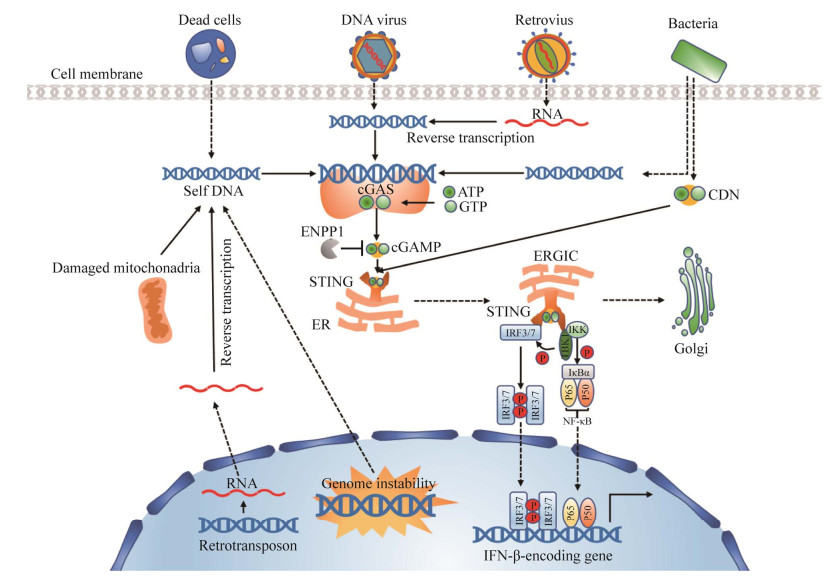
早在1963年,研究发现DNA不仅是遗传物质,而且能够作为信号分子刺激免疫系统识别并清除抗原,但直到近几年才将DNA如何参与细胞质传感并激活免疫应答的机制研究清楚[1]。2013年,Sun等确认了环磷酸鸟苷-腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS)为环鸟苷酸-腺苷酸(cyclin GMP-AMP,cGAMP)上游的关键合成酶,并发现cGAMP存在于哺乳动物细胞中[2]。cGAS是细胞必需的一种核苷酸转移酶,广泛存在于多种细胞中,作为胞质DNA感受器识别胞内多种DNA,从而诱导抗病毒天然免疫,是目前发现的胞内最主要的DNA模式识别受体[3-4],在免疫组织中表达较高[2]。cGAS能识别并结合胞质中的外源性和内源性双链DNA (dsDNA),使得自身酶活性激活,形成二聚体催化三磷酸鸟苷(GTP)和三磷酸腺苷(ATP)合成cGAMP[3-6],cGAMP为细胞质DNA在非特异性免疫信号传导过程中的第二信使,与下游干扰素基因刺激蛋白(stimulator of IFN genes,STING)特异性结合并使之发生构象变化[3, 7-8],活化后的STING从内质网膜转移到高尔基体,在此过程中招募并磷酸化TANK-结合激酶1 (TANK-binding kinase 1,TBK1),磷酸化的TBK1与干扰素调节因子3 (IFN regulatory factor 3,IRF3)相互作用,使其磷酸化和二聚化,从而诱导I型IFN (干扰素,interferon)的表达[9-11]。干扰素的高表达具有免疫调节作用从而抵抗病原体的入侵[9],进一步维护机体健康。目前已知的细胞内cGAS-STING信号通路的全过程见图 1。
|
| 图 1 cGAS-STING信号通路 Figure 1 cGAS-STING signaling pathway. |
|
|
微生物DNA入侵动物细胞质的信号将会通过胞质传感器传导,从而触发先天性免疫反应,激活与I型干扰素表达相关的信号通路,帮助宿主清除感染,保护机体健康[3-6]。2013年在细胞质中发现cGAS,并确定其为细胞质重要的DNA感受器[2]。cGAS属于核苷酸转移酶超家族,负责将磷酸基团从三磷酸核苷上转移至其他核酸或蛋白质上,生成单磷酸核苷[12]。cGAS是分子质量为60 kDa的蛋白质,大约由520个氨基酸构成,结构上包含与DNA结合的氨基端,具有催化性的核苷酸转移酶结构域,以及包含Mab21结构域高度保守的羧基末端,因而又被称为Mab-21 domain-containing protein 1 (MB21D1),属于Mab-21家族[2]。由于氨基端具有的一个或多个结合位点,cGAS能检测出各种来源的双链DNA (包括病毒和细菌的DNA、线粒体DNA以及细胞核DNA)并与之结合,使得cGAS构象发生改变后激活,由单体形式的自我抑制状态变为具备催化活性的复合体,诱导ATP和GTP环化后产生cGAMP[6, 11, 13-15]。cGAMP作为触发下游联级信号的第二信使,是多细胞动物中发现的第1个环状二核苷酸[7]。有研究表明,在被病毒侵袭的细胞中,cGAS催化合成的cGAMP搭载于病毒粒子及细胞外囊泡中,并被病毒粒子递送至靶细胞激活先天性免疫系统来抵抗病毒入侵[16]。cGAMP可以借助旁分泌途径靶向邻近细胞,以达到迅速活化细胞中STING蛋白的目的,最终上调干扰素的表达,激活免疫应答[5]。
2.2 DNA识别通路的关键蛋白STING干扰素基因刺激蛋白STING (又称为MPYS、MITA或ERIS)的发现早于cGAS,在2008年研究诱导抗病基因开放阅读框时便发现其存在,它由TMEM173基因编码,作为多种DNA识别受体的下游接头分子,已被鉴定为DNA识别过程中的中心干扰素介质[17-18]。人源STING由379个氨基酸构成,主要包含羧基末端结构域(carboxyl-terminal domain,CTD)和N端区域(1–154位残基,包含4个跨膜结构域) 2个结构部分,通过跨膜结构域嵌于内质网膜上的衔接蛋白STING处于静息状态,此时羧基末端(caxboxy-terminal tail,CTT)与c-di-GMP结合结构域(c-di-GMP binding domain,CBD)特异性结合,同时有大量的TBK1分子与STING二聚体结合形成STING-TBK1无活性复合物[19-20]。DNA识别受体cGAS感知病毒、催化产生cGAMP与STING-TBK1复合物结合后,破坏CTT与CBD的结合,STING二聚体经历构象变化并触发转录因子磷酸化,STING便从内质网经过高尔基体移动至核外周小体上,在这过程募集并激活TBK1和IKK激酶,进而激活下游细胞因子,上调I型干扰素表达水平,在细胞防御DNA病毒感染过程中发挥重要作用[21-23]。除了接受cGAMP的直接刺激外,有研究表明胞质中部分dsDNA及ssDNA能够被STING识别,并激活下游信号通路[24]。此外,STING还能激活诱导炎症因子表达的NF-κB信号通路打开,提升抗病毒的能力[17]。与此同时,STING还可以启动自噬,并在过氧化氢处理后的细胞中发现其仍可以通过维持正常的自噬活性来使细胞存活,但对于STING是如何诱导细胞自噬的机制尚未可知[25-26]。
2.3 免疫识别关键激酶TBK1TANK1因其具有激活NF-κB的能力,也称NF-κB活化激酶[27] (NF-κB-activating kinase,NAK),属于非经典IκB激酶家族成员,参与多种信号通路的信号转导,包括免疫反应、炎症、自噬、胰岛素信号和细胞增殖,是RLRs和DNA识别受体介导抗病毒信号通路关键的磷酸化蛋白,在先天性免疫中发挥重要作用[28-29]。作为宿主调节IFN-I产生的中心因子,其磷酸化后可激活IRF3和NF-κB,从而介导I型干扰素和促炎细胞因子的大量分泌,以响应急性病毒感染,防范病原微生物的入侵[9, 30]。当DNA病毒刺激时,细胞质DNA传感器cGAS识别双链DNA并通过膜相关接头蛋白STING启动一系列信号级联反应,再通过TBK1来促进IRF7或IRF3的磷酸化,使其进入细胞核启动IFN的表达,促进天然免疫发挥抗病毒作用[11]。
2.4 免疫应答相关转录因子IRF3,NF-κB当cGAS识别dsDNA形成cGAMP后,STING蛋白能够激活下游IFN和核因子NF-κB (nuclear factor kappa-light-chain-enhancer of activated B cells)的表达[9-10, 31]。IFN活化后介导数百个干扰素刺激基因(IFN-stimulated gene,ISG)的上调,随即促进多种促炎细胞因子分泌,而NF-κB作为一种转录因子,可以驱动包括细胞因子和趋化因子在内的促炎基因大量表达,以此达到限制病毒复制和诱导细胞凋亡的目的[32-34]。同时,被磷酸化TBK1激活的IRF3与BCL-2相关X蛋白结合形成复合物,将会直接诱导细胞凋亡[35]。
3 畜禽疾病中的cGAS-STING信号通路 3.1 cGAS-STING信号通路与家禽疾病虽然禽类模式识别受体大体上与哺乳动物相同,但一些关键的细胞因子仍然具有差异性。例如,作为TBK1下游因子的IRF3虽然在鸡体内并不表达,但通过基因组比较分析发现,鸡IRF7的功能与其具有很高的重合性[36-37]。鸡STING基因(chicken stimulator of interferon genes,chSTING)的序列与哺乳动物的相似性高,并且在多种组织中能够广泛地表达,尤其在免疫组织中表达最丰富,已报道的研究表明家禽cGAS-STING信号通路也发挥与哺乳动物类似的功能与作用[38]。目前cGAS-STING信号通路在哺乳动物的研究中得到了较为完整的阐述,而在鸡体内该通路cGAS和STING的功能直到最近才被确定[39-40]。
3.1.1 cGAS-STING信号通路与鸡马立克氏病家禽马立克氏病病毒(Marek՚s disease virus,MDV)是双链DNA疱疹病毒,能引起鸡的免疫抑制并产生肿瘤。MDV与家禽抗病毒先天性免疫的相互作用还知之甚少。研究者发现MDV可以通过破坏cGAS-STIMG通路的信号转导,从而阻碍通路介导抗病毒天然免疫的应答,并在此基础上,成功鉴定出多个对通路具有抑制作用的病毒编码蛋白(Meq、RLORF4、US3、UL46、VP23),其中Meq作为与MDV毒力相关的病毒编码蛋白,可以直接作用于接头蛋白STING,通过阻碍STING-TBK1-IRF7复合物的生成来遏制TBK1磷酸化IRF7,并使IFN-β启动子活性抑制,帮助病毒逃逸宿主天然免疫[41-42]。冯春进一步将Meq分段表达并与cGAS、STING共转染DF-1细胞,结果表明,Meq发挥抑制IFN-β的最短氨基酸序列位于271–281 aa,这一结果进一步验证了Meq的免疫抑制作用,并为MDV新型疫苗的研发提供新的靶点[43]。此外,高立发现MDV VP23蛋白通过抑制cGAS-STING信号通路免疫应答相关转录因子IRF7的磷酸二聚化入核,从而使得病毒侵袭过程中IFN的表达受到抑制,因此促进了病毒复制[42]。
3.1.2 cGAS-STING信号通路与鸡新城疫鸡新城疫病毒(Newcastle diseases virus,NDV)属于RNA囊膜病毒,具有高度接触传染性,强毒株感染可引起家禽高死亡率,严重威胁全球养禽业[44]。目前,研究发现通过STING- TBK1-IRF7-IFN-β信号轴激活IFN-β后,NDV在DF-1细胞中的复制受到抑制[45]。此外,研究发现新城疫病毒感染后的SPF鸡,其STING基因在脾脏、胸腺和法氏囊这些免疫器官中的表达水平均显示大幅上调,这提示STING在免疫器官中可能发挥抗病毒作用,这与鸡马立克氏病病毒编码的致瘤相关蛋白Meq对通路的作用靶点相似,均靶向STING接头蛋白[43]。研究表明,相较于中等毒力的Mukteswar毒株,作为NDV强毒株的F48E9可以介导维持时间更长、程度更高的免疫应答反应,在攻毒的鸡胚成纤维细胞中检测STING基因及其下游的I型干扰素(如IRT7、IFN-α和IFN-β)的表达量,结果表明随着感染时间的延长,这些基因的表达水平总体上表现为上调的趋势,而IFN-α的表达量则呈现先升后降的趋势;随着病毒滴度的提高,STING连同下游基因的表达量呈现上调,表明STING参与细胞抗DNA和RNA病毒反应,其应答机制有浓度与时间依赖性[38]。
3.1.3 cGAS-STING信号通路与禽痘病毒作为重要的经济动物,鸡会感染包括禽痘病毒(fowlpox virus,FWPV)在内的多种病毒,该病毒可引起皮肤损伤和呼吸道感染,并可靶向包括巨噬细胞在内的多种细胞类型,为了逃避宿主机体的免疫监测,FWPV可编码多种蛋白进行免疫调节,这些蛋白靶向模式受体相关的信号通路,阻止被感染细胞产生IFN,从而有助于病毒的增殖[46]。有研究发现,鸡巨噬细胞中的cGAS-STING通路可以感知FWPV感染,并且通过该通路上调干扰素相关因子的表达,可以使宿主有效防御FWPV感染[47]。
3.1.4 cGAS-STING信号通路与禽白血病病毒禽白血病病毒(avian leukosis virus,ALV)是一种免疫抑制病毒,引起鸡群生产性能下降,对养禽业危害严重。截至目前,对于ALV的免疫抑制机理知之甚少。本课题组深入研究了ALV对cGAS-STING信号通路的抑制效应,并发现病毒通过其编码的P15蛋白发挥对cGAS-STING信号通路的抑制效果,从而有利于病毒的复制和持续感染[48]。
3.2 cGAS-STING信号通路与猪病 3.2.1 cGAS-STING信号通路与猪圆环病毒病猪圆环病毒Ⅱ型(porcine circovirus Ⅱ,PCV2)以其诱导猪免疫抑制的能力而出名,在不引起细胞病变死亡的前提下,长期潜伏感染免疫细胞,并在其中不断复制繁殖,产生强烈的免疫抑制,降低宿主免疫防御力的同时致使其死亡。作为DNA病毒,PCV2进入细胞后能够被DNA感受器cGAS识别,并通过激活下游STING分子启动宿主的抗病毒天然免疫应答[49]。PCV2不仅能激活免疫通路,还能反向抑制cGAS- STING信号通路,PCV2感染后免疫通路IRF3的磷酸化水平大大降低,同样的情况出现在非洲猪瘟病毒编码的DP96R蛋白对通路的作用过程中[50],这可能是PCV2免疫逃逸的原因之一[49]。同时,PCV2感染可以通过gC1qR介导的PI3K/AKT信号磷酸化cGAS而使cGAS的催化活性被抑制,同时激活PKCδ信号以促进组蛋白脱乙酰酶6 (HDAC6)的激活,随后,磷酸化的cGAS促进cGAS泛素化,泛素化的cGAS蛋白被激活的HDAC6募集并转运至自溶酶体,从而最终导致受感染细胞中PCV2-cGAS的自噬降解[51]。
3.2.2 cGAS-STING信号通路与非洲猪瘟非洲猪瘟病毒(African swine fever virus,ASFV)可以引起各种猪的高度接触性出血性传染病,具有高死亡率的特征,目前尚无安全有效的非洲猪瘟疫苗或临床药物。ASFV是具有囊膜的双链DNA病毒,基因组长度为170–193 kb,主要在巨噬细胞中完成复制增殖[52-54]。研究发现,ASFV部分多基因家族(multigene family,MGF)蛋白通过下调I型干扰素表达来帮助病毒粒子从宿主天然免疫应答中逃逸[55]。目前的研究显示,ASFV编码的DP96R和MGF360-12L蛋白通过抑制cGAS-STING信号通路介导IFN-β的表达,有助于病毒在免疫细胞中的复制增殖,而且MGF360-12L能够调低IRF9总蛋白水平,使得需要IFN-β介导的JAK-STAT信号通路激活被抑制[56]。ASFV编码的毒力基因DP96R不仅能通过抑制cGAS-STING、TBK1、IKKβ诱导的NF-κB启动子的活化来逃逸抗病毒免疫,而且在与cGAS-STING共表达刺激前提下,抑制内源性和外源性TBK1蛋白水平的表达并降低IRF3磷酸化水平,从而抑制TBK1过表达后所能产生的抗病毒免疫应答[57]。另外有研究显示,ASFV编码的pS273R通过其酶活性靶向IKKε作为cGAS-STING通路的明显负调节因子,这显示了ASFV的一种新的免疫逃避机制[57]。ASFV编码的MGF-505-7R与STING相互作用通过自噬降解ASFV感染细胞中的STING或使得STING表达降低,抑制cGAS-STING信号通路的激活,在禽病的研究进展中新城疫病毒与马立克氏病病毒均能通过类似靶点对通路产生作用[38, 43],在MGF-505-7R缺失型ASFV感染细胞中,STING的表达显著上调[58]。此外,由D117L基因编码的p17也可以通过与STING的相互作用抑制cGAS-STING信号通路,表现出对TBK1和IRF3磷酸化、下游启动子活性、细胞mRNA转录及ISG56诱导抗病毒反应的抑制作用[59]。
3.2.3 cGAS-STING信号通路与猪伪狂犬病伪狂犬病病毒(pseudorabies virus,PRV)是一种DNA病毒,给养猪业造成巨大经济损失。其大约编码70种蛋白质,其中包括一些与逃避宿主免疫有关的蛋白质[60]。通过双荧光素酶报告基因检测系统,发现PRV编码蛋白UL24在转染细胞后不仅能够显著抑制cGAS-STING信号通路的激活;同时,TNF-α所介导的NF-κB信号通路也被抑制, 表明该蛋白可以通过多条信号通路途径参与病毒逃逸宿主抗病毒作用[60]。UL24缺失的猪伪狂犬病病毒菌株显著上调了I型IFN的转录水平;此外,PK15细胞中UL24过表达抑制了由poly (dA: dT)诱导或由cGAS- STING刺激的IFN-β活化,免疫共沉淀分析表明,UL24可以通过蛋白酶体途径以剂量依赖性方式与IRF7相互作用并降解P65蛋白[60]。总之,这些结果表明PRV UL24通过蛋白酶体途径与IRF7相互作用,阻止IRF7磷酸化入核,并拮抗cGAS-STING通路介导的IFN-β启动子激活,最终完成宿主天然免疫逃逸[60]。
4 总结与展望近年来,研究者深度探索了cGAS-STING通路的识别机制,早期对cGAS-STING通路的了解并不全面,相关研究也多集中于将病毒性疾病、癌症和自身免疫性疾病与cGAS-STING通路联系起来。随着对cGAS-STING通路研究的进一步深入,研究人员更倾向于研究cGAS-STING通路与慢性疾病的相互关系,希望能借此进一步了解疾病的发生发展,并应用于临床预防治疗中,但目前仍有许多问题需要继续深入研究解决。
STING作为免疫系统中一种具有多效性的新型分子,与自噬的介导有关,同时可以诱导多种促凋亡分子的表达,但对于其诱导自噬的机制尚未明确。对于信号通路之间的联级响应而言,cGAS除了作为细胞质中DNA的感受器外,是否能与其他通路之间相互协调或是具有其他的识别功能仍然需要继续探索。对于信号通路的功能而言,目前除了集中于通路诱导干扰素产生的抗病毒或治疗疾病的作用,也有研究人员开始研究不同器官中cGAS-STING通路所产生的作用,虽然cGAS-STING通路可以通过上调炎症因子等细胞因子来影响疾病过程,但通路与免疫细胞相关的各个方面及其机制尚未完全阐明。
cGAS-STING信号通路在畜禽疾病中的研究进展多集中于禽病和猪病。在与禽病的相互关系研究中发现通路常通过STING发挥作用,如马立克氏病病毒和新城疫病毒均能作用于通路的STING接头蛋白,从而抑制cGAS-STING信号通路的转导[38, 41-42]。禽白血病毒及其编码的P15蛋白均能抑制通路的激活,禽痘病毒的感染能使得鸡巨噬细胞中的cGAS-STING信号通路被激活,其机制均尚未明晰[48]。在与猪病的相互关系研究中发现病毒可以通过多种方式抑制通路,从关键因子STING到TBK1及IRF等均能被病毒所调控。例如,猪圆环病毒Ⅱ型可降低IRF3的磷酸化水平[50],非洲猪瘟病毒的多种编码蛋白通过靶向IRF9、TBK1、IRF3和STING等因子对cGAS-STING信号通路产生抑制作用[54-59],猪伪狂犬病UL24蛋白阻止IRF7磷酸化入核,拮抗cGAS-STING通路介导的IFN-β启动子激活,最终完成宿主天然免疫逃逸[61]。总而言之,cGAS-STING信号通路在猪病中的研究比禽病更加深入,禽病中的研究进展多停留在全病毒对通路的影响上,对于病毒蛋白的作用机制进展较为缓慢。
在疾病治疗方面,已有研究表明cGAS- STING通路与一些肿瘤的转移有关[60],提示通路调节疾病具有复杂性,谨慎合理地应用cGAS-STING通路相关药物治疗疾病十分必要。因此,对于cGAS-STING通路需要更加深入的探究,同时选择合理的方式才能有效地将其应用于畜禽疾病的预防与治疗。
| [1] |
Dempsey A, Bowie AG. Innate immune recognition of DNA: a recent history[J]. Virology, 2015, 479/480: 146-152. DOI:10.1016/j.virol.2015.03.013 |
| [2] |
Sun LJ, Wu JX, Du FH, Chen X, Chen ZJ. Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway[J]. Science, 2013, 339(6121): 786-791. DOI:10.1126/science.1232458 |
| [3] |
Zhang X, Shi HP, Wu JX, Zhang XW, Sun LJ, Chen C, Chen ZJ. Cyclic GMP-AMP containing mixed phosphodiester linkages is an endogenous high-affinity ligand for STING[J]. Molecular Cell, 2013, 51(2): 226-235. DOI:10.1016/j.molcel.2013.05.022 |
| [4] |
Diner EJ, Burdette DL, Wilson SC, Monroe KM, Kellenberger CA, Hyodo M, Hayakawa Y, Hammond MC, Vance RE. The innate immune DNA sensor cGAS produces a noncanonical cyclic dinucleotide that activates human STING[J]. Cell Reports, 2013, 3(5): 1355-1361. DOI:10.1016/j.celrep.2013.05.009 |
| [5] |
Ablasser A, Goldeck M, Cavlar T, Deimling T, Witte G, Röhl I, Hopfner KP, Ludwig J, Hornung V. cGAS produces a 2′-5′-linked cyclic dinucleotide second messenger that activates STING[J]. Nature, 2013, 498(7454): 380-384. DOI:10.1038/nature12306 |
| [6] |
Gao P, Ascano M, Wu Y, Barchet W, Gaffney BL, Zillinger T, Serganov AA, Liu YZ, Jones RA, Hartmann G, et al. Cyclic [G(2′, 5′)pA(3′, 5′)p] is the metazoan second messenger produced by DNA-activated cyclic GMP-AMP synthase[J]. Cell, 2013, 153(5): 1094-1107. DOI:10.1016/j.cell.2013.04.046 |
| [7] |
Wu JX, Sun LJ, Chen X, Du FH, Shi HP, Chen C, Chen ZJ. Cyclic GMP-AMP is an endogenous second messenger in innate immune signaling by cytosolic DNA[J]. Science, 2013, 339(6121): 826-830. DOI:10.1126/science.1229963 |
| [8] |
Barber GN. Cytoplasmic DNA innate immune pathways[J]. Immunological Reviews, 2011, 243(1): 99-108. DOI:10.1111/j.1600-065X.2011.01051.x |
| [9] |
Tanaka Y, Chen ZJ. STING specifies IRF3 phosphorylation by TBK1 in the cytosolic DNA signaling pathway[J]. Science Signaling, 2012, 5(214): ra20. |
| [10] |
Liu SQ, Cai X, Wu JX, Cong Q, Chen X, Li T, Du FH, Ren JY, Wu YT, Grishin NV, et al. Phosphorylation of innate immune adaptor proteins MAVS, STING, and TRIF induces IRF3 activation[J]. Science, 2015, 347(6227): aaa2630. DOI:10.1126/science.aaa2630 |
| [11] |
Chen Q, Sun LJ, Chen ZJ. Regulation and function of the cGAS–STING pathway of cytosolic DNA sensing[J]. Nature Immunology, 2016, 17(10): 1142-1149. DOI:10.1038/ni.3558 |
| [12] |
Aravind L, Koonin EV. DNA polymerase β-like nucleotidyltransferase superfamily: identification of three new families, classification and evolutionary history[J]. Nucleic Acids Research, 1999, 27(7): 1609-1618. DOI:10.1093/nar/27.7.1609 |
| [13] |
Civril F, Deimling T, de Oliveira Mann CC, Ablasser A, Moldt M, Witte G, Hornung V, Hopfner KP. Structural mechanism of cytosolic DNA sensing by cGAS[J]. Nature, 2013, 498(7454): 332-337. DOI:10.1038/nature12305 |
| [14] |
Zhang X, Wu JX, Du FH, Xu H, Sun LJ, Chen Z, Brautigam CA, Zhang XW, Chen ZJ. The cytosolic DNA sensor cGAS forms an oligomeric complex with DNA and undergoes switch-like conformational changes in the activation loop[J]. Cell Reports, 2014, 6(3): 421-430. DOI:10.1016/j.celrep.2014.01.003 |
| [15] |
Li X, Shu C, Yi GH, Chaton CT, Shelton CL, Diao JS, Zuo XB, Kao CC, Herr AB, Li PW. Cyclic GMP-AMP synthase is activated by double-stranded DNA-induced oligomerization[J]. Immunity, 2013, 39(6): 1019-1031. DOI:10.1016/j.immuni.2013.10.019 |
| [16] |
Gentili M, Kowal J, Tkach M, Satoh T, Lahaye X, Conrad C, Boyron M, Lombard B, Durand S, Kroemer G, et al. Transmission of innate immune signaling by packaging of cGAMP in viral particles[J]. Science, 2015, 349(6253): 1232-1236. DOI:10.1126/science.aab3628 |
| [17] |
Ishikawa H, Barber GN. STING is an endoplasmic reticulum adaptor that facilitates innate immune signalling[J]. Nature, 2008, 455(7213): 674-678. DOI:10.1038/nature07317 |
| [18] |
Zhong B, Yang Y, Li S, Wang YY, Li Y, Diao FC, Lei CQ, He X, Zhang L, Po TE, et al. The adaptor protein MITA links virus-sensing receptors to IRF3 transcription factor activation[J]. Immunity, 2008, 29(4): 538-550. DOI:10.1016/j.immuni.2008.09.003 |
| [19] |
Shang GJ, Zhang CG, Chen ZJ, Bai XC, Zhang XW. Cryo-EM structures of STING reveal its mechanism of activation by cyclic GMP–AMP[J]. Nature, 2019, 567(7748): 389-393. DOI:10.1038/s41586-019-0998-5 |
| [20] |
Zhang CG, Shang GJ, Gui X, Zhang XW, Bai XC, Chen ZJ. Structural basis of STING binding with and phosphorylation by TBK1[J]. Nature, 2019, 567(7748): 394-398. DOI:10.1038/s41586-019-1000-2 |
| [21] |
Yoneyama M, Kikuchi M, Natsukawa T, Shinobu N, Imaizumi T, Miyagishi M, Taira K, Akira S, Fujita T. The RNA helicase RIG-I has an essential function in double-stranded RNA-induced innate antiviral responses[J]. Nature Immunology, 2004, 5(7): 730-737. DOI:10.1038/ni1087 |
| [22] |
Andrejeva J, Childs KS, Young DF, Carlos TS, Stock N, Goodbourn S, Randall RE. The V proteins of paramyxoviruses bind the IFN-inducible RNA helicase, mda-5, and inhibit its activation of the IFN-beta promoter[J]. PNAS, 2004, 101(49): 17264-17269. DOI:10.1073/pnas.0407639101 |
| [23] |
Wu JX, Chen ZJ. Innate immune sensing and signaling of cytosolic nucleic acids[J]. Annual Review of Immunology, 2014, 32: 461-488. DOI:10.1146/annurev-immunol-032713-120156 |
| [24] |
Abe T, Harashima A, Xia TL, Konno H, Konno K, Morales A, Ahn J, Gutman D, Barber GN. STING recognition of cytoplasmic DNA instigates cellular defense[J]. Molecular Cell, 2013, 50(1): 5-15. DOI:10.1016/j.molcel.2013.01.039 |
| [25] |
Watson RO, Manzanillo PS, Cox JS. Extracellular M. tuberculosis DNA targets bacteria for autophagy by activating the host DNA-sensing pathway[J]. Cell, 2012, 150(4): 803-815. DOI:10.1016/j.cell.2012.06.040 |
| [26] |
Liu FP, Liu YD, Zhuang ZQ, Ma JP, Xu XH, Zhang WJ, Peng H, Yang LF, Zhang W, Pei ZH, et al. Beclin1 haploinsufficiency accentuates second-hand smoke exposure-induced myocardial remodeling and contractile dysfunction through a STING-mediated mechanism[J]. Journal of Molecular and Cellular Cardiology, 2020, 148: 78-88. DOI:10.1016/j.yjmcc.2020.08.016 |
| [27] |
Tojima Y, Fujimoto A, Delhase M, Chen Y, Hatakeyama S, Nakayama KI, Kaneko Y, Nimura Y, Motoyama N, Ikeda K, et al. NAK is an IκB kinase-activating kinase[J]. Nature, 2000, 404(6779): 778-782. DOI:10.1038/35008109 |
| [28] |
Tabtieng T, Degterev A, Gaglia MM. Caspase-dependent suppression of type I interferon signaling promotes Kaposi՚s sarcoma-associated herpesvirus lytic replication[J]. Journal of Virology, 2018, 92(10): e00078-e00018. |
| [29] |
Helgason E, Phung QT, Dueber EC. Recent insights into the complexity of tank-binding kinase 1 signaling networks: the emerging role of cellular localization in the activation and substrate specificity of TBK1[J]. FEBS Letters, 2013, 587(8): 1230-1237. DOI:10.1016/j.febslet.2013.01.059 |
| [30] |
Abe T, Barber GN. Cytosolic-DNA-mediated, STING-dependent proinflammatory gene induction necessitates canonical NF-κB activation through TBK1[J]. Journal of Virology, 2014, 88(10): 5328-5341. DOI:10.1128/JVI.00037-14 |
| [31] |
De Oliveira Mann CC, Orzalli MH, King DS, Kagan JC, Lee ASY, Kranzusch PJ. Modular architecture of the STING C-terminal tail allows interferon and NF-κB signaling adaptation[J]. Cell Reports, 2019, 27(4): 1165-1175.e5. DOI:10.1016/j.celrep.2019.03.098 |
| [32] |
González-Navajas JM, Lee J, David M, Raz E. Immunomodulatory functions of type I interferons[J]. Nature Reviews Immunology, 2012, 12(2): 125-135. DOI:10.1038/nri3133 |
| [33] |
Andrilenas KK, Ramlall V, Kurland J, Leung B, Harbaugh AG, Siggers T. DNA-binding landscape of IRF3, IRF5 and IRF7 dimers: implications for dimer-specific gene regulation[J]. Nucleic Acids Research, 2018, 46(5): 2509-2520. DOI:10.1093/nar/gky002 |
| [34] |
Schoggins JW, Wilson SJ, Panis M, Murphy MY, Jones CT, Bieniasz P, Rice CM. A diverse range of gene products are effectors of the type I interferon antiviral response[J]. Nature, 2011, 472(7344): 481-485. DOI:10.1038/nature09907 |
| [35] |
Chen DS, Tong JS, Yang LH, Wei L, Stolz DB, Yu J, Zhang JK, Zhang L. PUMA amplifies necroptosis signaling by activating cytosolic DNA sensors[J]. PNAS, 2018, 115(15): 3930-3935. DOI:10.1073/pnas.1717190115 |
| [36] |
Cormican P, Lloyd AT, Downing T, Connell SJ, Bradley D, O՚Farrelly C. The avian toll-like receptor pathway: subtle differences amidst general conformity[J]. Developmental and Comparative Immunology, 2009, 33(9): 967-973. DOI:10.1016/j.dci.2009.04.001 |
| [37] |
Huang B, Qi ZT, Xu Z, Nie P. Global characterization of interferon regulatory factor (IRF) genes in vertebrates: glimpse of the diversification in evolution[J]. BMC Immunology, 2010, 11: 22. DOI:10.1186/1471-2172-11-22 |
| [38] |
Jin J. Molecular characterization, expression and functional analysis of chicken STING[D]. Yaan: Master՚s Thesis of Sichuan Agricultural University, 2017 (in Chinese) 金洁. 鸡STING基因的克隆、表达及其抗病毒功能的研究[D]. 雅安: 四川农业大学硕士学位论文, 2017 |
| [39] |
Vitak N, Hume DA, Chappell KJ, Sester DP, Stacey KJ. Induction of interferon and cell death in response to cytosolic DNA in chicken macrophages[J]. Developmental & Comparative Immunology, 2016, 59: 145-152. |
| [40] |
Gao L, Li K, Zhang Y, Liu Y, Liu C, Zhang Y, Gao Y, Qi X, Cui H, Wang Y, et al. Inhibition of DNA-sensing pathway by Marek՚s disease virus VP23 protein through suppression of interferon regulatory factor 7 activation[J]. J Virol, 2019, 93(4): e01934-e01918. |
| [41] |
Liu YZ. Avian Marek's disease virus mediates the DNA-sensing pathway to escape host innate immune response[D]. Beijing: Doctoral Dissertation of Chinese Academy of Agricultural Sciences, 2019 (in Chinese) 刘永振. 鸡马立克氏病病毒调控DNA受体信号通路逃避宿主天然免疫反应的分子机制[D]. 北京: 中国农业科学院博士学位论文, 2019 |
| [42] |
Gao L. Inhibition of IFN-β production by Marek's disease virus VP23 protein through modulation of DNA sensing signaling pathway[D]. Beijing: Doctoral Dissertation of Chinese Academy of Agricultural Sciences, 2018 (in Chinese) 高立. 鸡马立克氏病病毒VP23蛋白调控DNA受体信号通路拮抗IFN-β产生的机制研究[D]. 北京: 中国农业科学院博士学位论文, 2018 |
| [43] |
Feng C. The study on relationship between cGAS-STING signaling pathway and MDV replication[D]. Yangzhou: Master՚s Thesis of Yangzhou University, 2020 (in Chinese) 冯春. cGAS-STING信号通路与马立克氏病病毒复制关系的研究[D]. 扬州: 扬州大学硕士学位论文, 2020 |
| [44] |
Boroomand Z, Jafari RA, Mayahi M. Molecular characterization and phylogenetic study of the fusion genes of Newcastle disease virus from the recent outbreaks in Ahvaz, Iran[J]. Virus Disease, 2016, 27(1): 102-105. |
| [45] |
Niu QN, Cheng YQ, Wang HG, Yan YX, Sun JH. Chicken DDX3X activates IFN-β via the chSTING-chIRF7-IFN-β signaling axis[J]. Frontiers in Immunology, 2019, 10: 822. DOI:10.3389/fimmu.2019.00822 |
| [46] |
Williams SM, Smith JA, Garcia M, Brinson D, Kiupel M, Hofacre C. Severe histiolymphocytic and heterophilic bronchopneumonia as a reaction to in ovo fowlpox vaccination in broiler chicks[J]. Veterinary Pathology, 2010, 47(1): 177-180. DOI:10.1177/0300985809353314 |
| [47] |
Oliveira M, Rodrigues DR, Guillory V, Kut E, Giotis ES, Skinner MA, Guabiraba R, Bryant CE, Ferguson BJ. Chicken cGAS senses fowlpox virus infection and regulates macrophage effector functions[J]. Frontiers in Immunology, 2021, 11: 613079. DOI:10.3389/fimmu.2020.613079 |
| [48] |
Shen K. Effects of ALV-J encoded proteins on the cGAS-STING signaling pathway and the underlying mechanism[D]. Yangzhou: Master՚s Thesis of Yangzhou University, 2021 (in Chinese) 沈逵. ALV-J编码蛋白对cGAS-STING信号通路的影响及其作用机制研究[D]. 扬州: 扬州大学硕士学位论文, 2021 |
| [49] |
Zhang BC. Studies on the immune regulation of cGAS-STING-STAT6 pathway in response to PCV2 invasion[D]. Fuzhou: Master՚s Thesis of Fujian Normal University, 2017 (in Chinese) 张冰晨. cGAS-STING-STAT6通路对猪圆环病毒Ⅱ型免疫调控的初步研究[D]. 福州: 福建师范大学硕士学位论文, 2017 |
| [50] |
Wang XX. Inhibition mechanisms of African swine fever virus protein on cGAS-STING-mediated signaling pathway[D]. Beijing: Doctoral Dissertation of Chinese Academy of Agricultural Sciences, 2019 (in Chinese) 王西西. 非洲猪瘟病毒蛋白对cGAS-STING信号通路抑制作用研究[D]. 北京: 中国农业科学院博士学位论文, 2019 |
| [51] |
Wang ZY, Chen J, Wu XC, Ma D, Zhang XH, Li RZ, Han C, Liu HX, Yin XR, Du Q, et al. PCV2 targets cGAS to inhibit type I interferon induction to promote other DNA virus infection[J]. PLoS Pathogens, 2021, 17(9): e1009940. DOI:10.1371/journal.ppat.1009940 |
| [52] |
Jia N, Ou YW, Pejsak Z, Zhang YG, Zhang J. Roles of African swine fever virus structural proteins in viral infection[J]. Journal of Veterinary Research, 2017, 61(2): 135-143. DOI:10.1515/jvetres-2017-0017 |
| [53] |
Alejo A, Matamoros T, Guerra M, Andrés G. A proteomic atlas of the African swine fever virus particle[J]. Journal of Virology, 2018, 92(23): e01293-e01218. |
| [54] |
Kessle C, Forth JH, Keil GM, Mettenleiter TC, Blome S, Karger A. The intracellular proteome of African swine fever virus[J]. Scientific Reports, 2018, 8: 14714. DOI:10.1038/s41598-018-32985-z |
| [55] |
Georgana I, Sumner RP, Towers GJ, Maluquer De Motes C. Virulent poxviruses inhibit DNA sensing by preventing STING activation[J]. Journal of Virology, 2018, 92(10): e02145-e02117. |
| [56] |
Wang XX, Wu J, Wu YT, Chen HJ, Zhang SF, Li JX, Xin T, Jia H, Hou SH, Jiang YT, et al. Inhibition of cGAS-STING-TBK1 signaling pathway by DP96R of ASFV China 2018/1[J]. Biochemical and Biophysical Research Communications, 2018, 506(3): 437-443. DOI:10.1016/j.bbrc.2018.10.103 |
| [57] |
Luo J, Zhang JJ, Ni JH, Jiang S, Xia NW, Guo YW, Shao Q, Cao Q, Zheng WL, Chen NH, et al. The African swine fever virus protease pS273R inhibits DNA sensing cGAS-STING pathway by targeting IKKε[J]. Virulence, 2022, 13(1): 740-756. DOI:10.1080/21505594.2022.2065962 |
| [58] |
Li D, Yang WP, Li LL, Li P, Ma Z, Zhang J, Qi XL, Ren JJ, Ru Y, Niu QL, et al. African swine fever virus MGF-505-7R negatively regulates cGAS-STING- mediated signaling pathway[J]. Journal of Immunology: Baltimore, Md: 1950, 2021, 206(8): 1844-1857. |
| [59] |
Zheng WL, Xia NW, Zhang JJ, Cao Q, Jiang S, Luo J, Wang H, Chen NH, Zhang Q, Meurens F, et al. African swine fever virus structural protein p17 inhibits cGAS-STING signaling pathway through interacting with STING[J]. Frontiers in Immunology, 2022, 13(1): 941579. |
| [60] |
Chen Q, Boire A, Jin X, Valiente M, Er EE, Lopez-Soto A, S Jacob L, Patwa R, Shah H, Xu K, et al. Carcinoma–astrocyte gap junctions promote brain metastasis by cGAMP transfer[J]. Nature, 2016, 533(7604): 493-498. DOI:10.1038/nature18268 |
| [61] |
Liu XL, Zhang ML, Ye C, Ruan KY, Xu AY, Gao F, Tong GZ, Zheng H. Inhibition of the DNA-Sensing pathway by pseudorabies virus UL24 protein via degradation of interferon regulatory factor 7[J]. Veterinary Microbiology, 2021, 255: 109023. DOI:10.1016/j.vetmic.2021.109023 |
 2022, Vol. 49
2022, Vol. 49