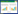扩展功能
文章信息
- 辛凌翔, 徐磊, 靳继惠, 任小侠, 朱良全, 程君生, 李俊平, 王团结, 王楠
- XIN Lingxiang, XU Lei, JIN Jihui, REN Xiaoxia, ZHU Liangquan, CHENG Junsheng, LI Junping, WANG Tuanjie, WANG Nan
- 禽分枝杆菌对豚鼠的致病性分析
- Pathogenicity of Mycobacterium avium to guinea pigs
- 微生物学通报, 2022, 49(12): 5277-5286
- Microbiology China, 2022, 49(12): 5277-5286
- DOI: 10.13344/j.microbiol.china.220882
-
文章历史
- 收稿日期: 2022-09-12
- 接受日期: 2022-10-13
- 网络首发日期: 2022-11-03
禽分枝杆菌属于鸟分枝杆菌复合群(Mycobacterium avium complex,MAC)成员,MAC是分枝杆菌属非结核分枝杆菌(non-tuberculous mycobacterium,NTM)的主要类群之一[1]。NTM广泛分布于自然界,并对人和多种动物均出现一定程度的致病性,禽分枝杆菌可使禽类患结核病,其中鸡、鸽最易感,鹅、鸭次之,也可感染猪、牛、马等家畜[2]。在1990年、2000年、2010年共3次的全国结核病流行病学抽样调查显示,我国结核病样患者中NTM的分离率分别为4.9%、11.1%及22.9%,NTM对人的感染呈明显的逐年上升趋势[3]。国内外学者报道,人感染NTM样本中,分离率最高的属于鸟分枝杆菌复合群[4-5]。
应用禽结核菌素的牛结核比较皮内变态反应和禽结核皮内变态反应是世界动物卫生组织(World Organization for Animal Health,WOAH)国际贸易中诊断牛结核和禽结核的指定方法之一,因此,禽结核菌素对牛结核病和禽结核病的诊断均具有重要价值,它是由一两种禽分枝杆菌液体培养物经灭活、过滤和浓缩等步骤制备而成的一类包含了蛋白质、多肽、多糖的混合物[6]。不同国家用于制造禽结核菌素的菌株各不相同,我国制造用菌株包括CVCC 68201、CVCC 68202和CVCC 68203株[7],均为1985年分离自禽结核病死鸡。
豚鼠对禽分枝杆菌非常敏感,较低剂量的感染可出现明显的皮内变态反应,是研究禽结核菌素较为理想的动物模型。本实验室前期已对菌种形态、生化特性、培养特性、分型鉴定等进行了研究。本文对3株菌的致病性开展了进一步研究,以期为禽分枝杆菌的制备和鉴定提供依据,也为牛结核病的鉴别诊断方法研究提供参考。
1 材料与方法 1.1 菌种禽分枝杆菌CVCC 68201、CVCC 68202、CVCC 68203于1985年9月1日冻干,由中国兽医药品监察所菌种保藏中心提供。
1.2 实验动物300–400 g无特定病原体(specific pathogen free,SPF)级豚鼠购自北京维通利华试验动物技术有限公司。本研究被中国兽医药品监察所实验动物福利与动物实验伦理委员会审核通过,编号为中监所(福) 2022第00014号。
1.3 培养基及主要试剂、仪器普通肉汤和苏通培养基,中海生物科技有限公司;分枝杆菌培养基,上海晶诺生物科技有限公司。抗酸快速染色试剂盒,索莱宝生物科技有限公司;禽型提纯结核菌素,中国兽医药品监察所。恒温恒湿培养箱,青岛海尔生物医疗股份有限公司;PCR仪,Bio-Rad公司;均质分散机,DLAB Scientific公司。
1.4 禽分枝杆菌的培养无菌打开CVCC 68201、CVCC 68202、CVCC 68203菌种,用0.2 mL普通肉汤溶解,划线接种2支/株配氏斜面培养基,置37 ℃培养箱中培养15–20 d以上。
1.5 豚鼠攻毒剂量及分组情况试验一共分为4组,分别为201组、202组、203组和空白组,每组5只豚鼠。用苏通培养基分别洗脱3株菌种的培养物,研磨器研磨均匀,以麦氏比浊管比浊并稀释到2.0×105 CFU/mL,豚鼠腹股沟皮下注射0.5 mL/只,空白组皮下注射生理盐水,0.5 mL/只。
1.6 禽分枝杆菌种型鉴定和进化分析按照十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)法提取基因组,利用琼脂糖凝胶电泳鉴定基因组完整性,通过全基因组测序比较核苷酸相似度(average nucleotide identity,ANI),并进行进化树分析。
1.7 称重、脏器病变评分和皮内变态反应比较注射后观察35 d,逐日观察豚鼠的健康状态、被毛情况、精神状态、饮食和死亡等情况。感染后第0、3和5周,分别对豚鼠进行称重。感染后第30天,用禽型结核菌素对每只豚鼠进行皮试试验,并于1 d后测量皮试部位红肿面积。感染后第5周解剖豚鼠,肉眼观察肝、脾和肺脏的病变程度,肿大为轻度,局部出血;淤血为中度,实质性病变;结节为重度。对3个实验组疑似有病变的脾和肺进行称重,与对照组进行统计学比较分析。按照脏器系数=脏器的重量/体重,计算肺脏和脾脏的脏器系数值。
1.8 病理学观察解剖感染后第5周的豚鼠,取疑似有病变的脾和肺,用10%的福尔马林固定后,按照常规方法处理,石蜡包埋,冷冻切片,进行苏木精-伊红(hematoxylin-eddyr,HE)染色和抗酸染色,光学显微镜下观察,采集图像并记录结果。
1.9 统计学方法豚鼠体重增重情况、脾脏和肺脏的脏器系数分析采用双侧t检验,分析差异时,P < 0.05表示有统计学意义,P < 0.01有显著的统计学差异,P < 0.001有极其显著的统计学差异。
2 结果与分析 2.1 禽分枝杆菌种型判定和进化树分析使用CTAB法提取3个菌株的基因组DNA,经琼脂糖凝胶电泳检测,结果目的条带单一,证明提取的DNA较为完整。基于Illumina测序平台对CVCC 68201、CVCC 68202和CVCC 68203进行全基因组测序并与NTM参考基因组进行ANI分析;以95%的相似度为阈值进行分枝杆菌种型判定,结果表明,3个菌株均属于鸟分枝杆菌复合群中的禽分枝杆菌,与禽分枝杆菌标准株ATCC 25291的核苷酸相似度分别为99.926 2%、99.928 9%、99.928 7%。NCBI中上传的禽分枝杆菌种内的不同菌株的基因组信息已有274份,经与已知序列的禽分枝杆菌种内274份基因组进行合并建树分析,如图 1的进化树分析结果显示,CVCC 68201、CVCC 68202、CVCC 68203均与Mycobacterium avium subsp. avium FDAARGOS_1608株相近,ANI相似度分别为99.982 9%、99.986 0%、99.981 9%。
|
| 图 1 CVCC 68201、CVCC 68202和CVCC 68203与禽分枝杆菌种内的274个基因组的进化树 Figure 1 Phylogenetic tree of CVCC 68201, CVCC 68202, CVCC 68203 and 274 genomes within Mycobacterium avium species. Tree scale: 0.01. |
|
|
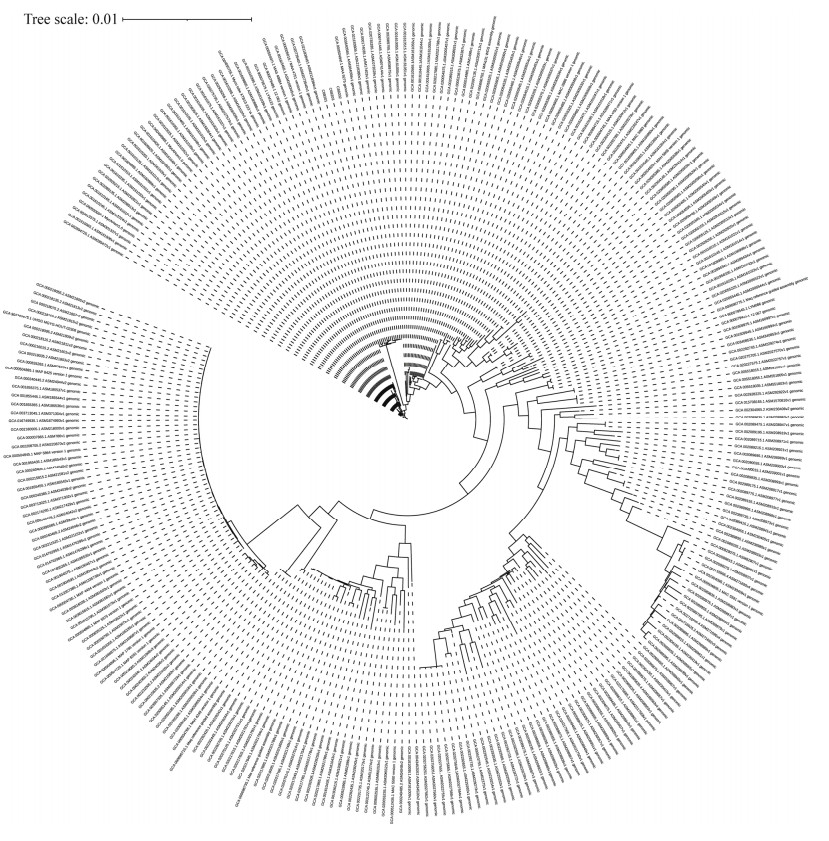
感染后逐日观察豚鼠健康状态,精神良好,饮食正常,被毛无明显凌乱现象,无死亡情况。在第0、3、5周,对感染组和空白组分别进行称重,各组别豚鼠体重增重情况不同。其中201组、202组的体重在感染第5周时,与空白组相比差异显著,P < 0.01;而203组体重与空白组相比,无统计学差异(P > 0.05) (图 2)。
|
| 图 2 不同菌株感染组豚鼠的体重变化情况 Figure 2 Changes in body weight of guinea pigs infected with different strains. |
|
|
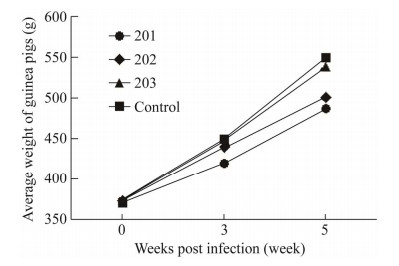
不同菌种感染后,用禽型提纯结核菌素对每只豚鼠进行皮内变态反应试验,并于1 d后测量皮试部位红肿面积。结果显示,201组豚鼠皮内变态反应导致的红肿面积明显大于202组和203组,空白组豚鼠在结核菌素皮内变态反应试验中均未发生皮肤红肿情况(图 3)。
|
| 图 3 不同菌株感染组豚鼠的皮内变态反应情况 Figure 3 Intradermal allergy of guinea pigs infected with different strains. **: P < 0.01. |
|
|
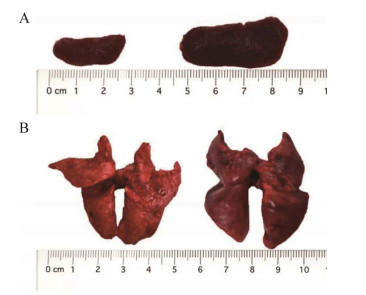
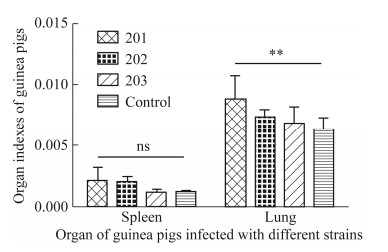
不同菌种感染后剖检观察豚鼠肺脏和脾脏大体病变,脾脏和肺脏均存在不同程度的肿大,少数脾脏出现轻微出血。感染组以201组为例,与空白组对比的脾脏和肺脏大体病变示意图如图 4所示。通过对豚鼠脾脏和肺脏称重、计算脏器系数发现,201组和202组较203组的脾脏和肺脏肿大程度强,其中201组肺脏肿大与对空白组相比差异显著(P < 0.01),脏器系数结果如图 5所示。
|
| 图 4 脾脏和肺脏的大体病变示意图 Figure 4 Clinical symptoms of the spleen and lung. A:脾脏大体病变,左为空白组,右为感染组(201组);B:肺脏大体病变,左为空白组,右为感染组(201组) A: Clinical symptoms of the spleen, control group on the left and infection group (201 group) on the right; B: Clinical symptoms of the lung, control group on the left and infection group (201 group) on the right. |
|
|
|
| 图 5 不同菌株感染组豚鼠的脏器系数情况 Figure 5 Organ indexes of guinea pigs infected with different strains. **:差异显著,P < 0.01;ns:无统计学差异 **: Significant difference, P < 0.01; ns: No significant difference. |
|
|
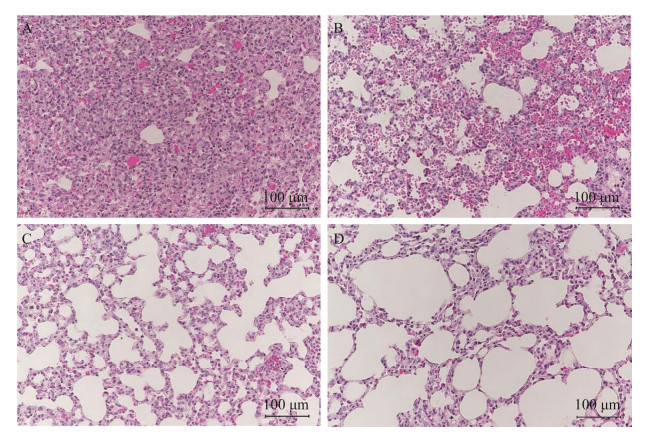
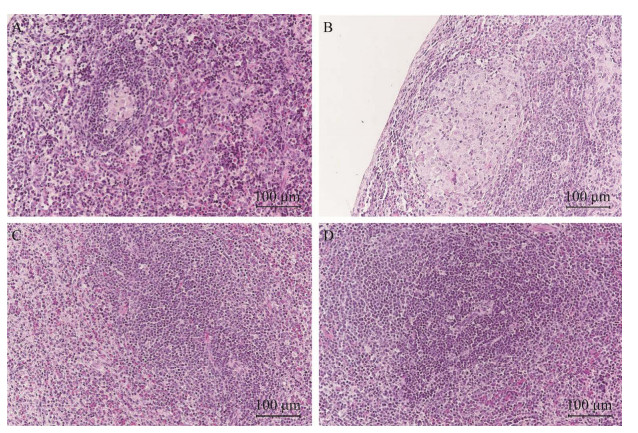
取疑似病变的肺和脾进行病理观察,201组、202组、203组肺脏和脾脏均可见明显的病理变化。肺脏HE染色可见,感染组病变部位结构比正常肺脏组织结构更为致密,其中201组肺脏显示了更严重的病变,可见肺泡隔血管充血,细胞增生,肺泡隔增厚,部分区域大面积实变,同时伴有炎性细胞浸润(图 6)。脾脏HE染色可见典型的结核结节,由上皮样细胞、多核巨细胞、巨噬细胞、淋巴细胞和少量反应性增生的成纤维细胞构成肉芽肿结构,外周与周围界限清晰,发展严重的中央存在均质红染的坏死组织(图 7)。由抗酸染色结果可见,豚鼠肺脏和脾脏均可见禽分枝杆菌分布,尤其在脾小梁、肺泡壁血管周围禽分枝杆菌分布较为密集(图 8和图 9)。3个感染组均存在不同程度的病理变化,203组变化程度较201组和202组相对较弱。
|
| 图 6 豚鼠肺脏HE染色结果(HE染色,200×) Figure 6 HE staining of guinea pig lung (HE staining, 200×). A:201组;B:202组;C:203组;D:对照组 A: 201 group; B: 202 group; C: 203 group; D: Control group. |
|
|
|
| 图 7 豚鼠脾脏HE染色结果(HE染色,200×) Figure 7 HE staining of guinea pig spleen (HE staining, 200×). A:201组;B:202组;C:203组;D:对照组 A: 201 group; B: 202 group; C: 203 group; D: Control group. |
|
|
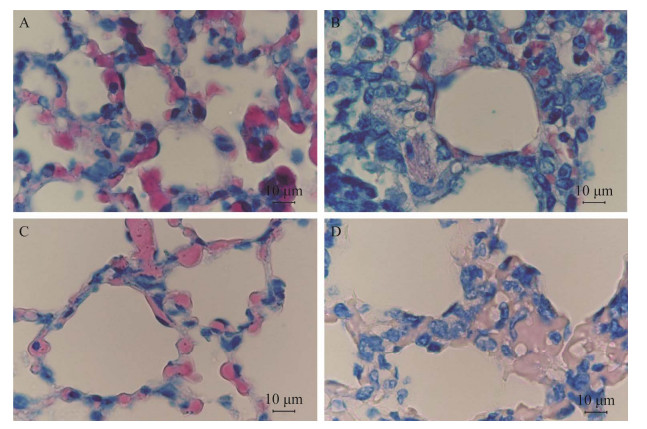
|
| 图 8 豚鼠肺脏抗酸染色结果(抗酸染色,1 000×) Figure 8 Acid-fast staining of guinea pig lung (acid-fast staining, 1 000×). A:201组;B:202组;C:203组;D:对照组 A: 201 group; B: 202 group; C: 203 group; D: Control group. |
|
|

|
| 图 9 豚鼠脾脏抗酸染色结果(抗酸染色,1 000×) Figure 9 Acid-fast staining of guinea pig spleen (acid-fast staining, 1 000×). A:201组;B:202组;C:203组;D:对照组 A: 201 group; B: 202 group; C: 203 group; D: Control group. |
|
|
禽分枝杆菌主要通过呼吸系统和消化系统感染动物,因属NTM,其致病能力明显弱于结核分枝杆菌,主要以继发或并发形式存在[8]。NTM致病呈机会性,通常发生在机体免疫力降低时[9]。已有的研究结果发现,禽结核病可分为3个时期:潜伏期在感染后7 d,无明显的组织损伤;发展期在感染后8–17 d,出现小结节,结节中含分枝杆菌;恶病质期在感染后18 d之后,出现大量结节,组织病变明显可见[10]。
豚鼠对禽分枝杆菌高度敏感,低剂量感染即可发展为典型的肉芽肿结构,病理切片可见朗格汉斯多核巨细胞。豚鼠感染后的病理变化与人感染相似,感染后存活率高,是建立结核病实验动物模型的适宜动物,在疫苗评价、筛选免疫蛋白和免疫佐剂等方面表现出明显优势[11]。本实验选取豚鼠为感染动物,采用腹股沟注射为感染途径,以我国制备禽型结核菌素所用CVCC 68201、CVCC 68202、CVCC 68203菌株作为研究对象,探究此类NTM对动物的致病性。通过基因组测序鉴定分析,明确CVCC 68201、CVCC 68202、CVCC 68203菌株均为禽分枝杆菌,平均核苷酸相似度均大于99.9%。
本研究发现,豚鼠在禽分枝杆菌感染期内,健康状态良好,无被毛凌乱现象,无死亡情况,在感染第5周时表现出对体重增重的影响,感染CVCC 68201、CVCC 68202株豚鼠的平均体重明显轻于未感染组。皮内变态反应试验表明,CVCC 68201株感染组较另外2组显现出更为强烈的迟发型变态反应。脏器大体病变显示,感染组表现出明显的脾脏和肺脏的肿大及出血,导致不同感染组的脾脏系数和肺脏系数均不同程度地高于未感染组,其中201组的肺脏系数显著高于未感染组(P < 0.01)。病理学观察发现,豚鼠肺脏可见明显病变,病变部位结构比正常肺脏组织结构更为致密,其中201组病变更为显著,肺脏大面积实变,并伴有炎性细胞浸润。肺、脾组织切片抗酸染色可见红色的分枝杆菌散在浸润,其中201组聚集程度更高、密度更大。以上结果表明,制备禽型结核菌素用的3株禽分枝杆菌对感染豚鼠均存在一定程度的致病性,可引发局部病变;其中CVCC 68201株对豚鼠的致病力明显强于CVCC 68202株和CVCC 68203株。
| [1] |
Zhang X, Chen CY, He G, Zhen PL. Progress of PCR-based molecular biology technology in detecting non-tuberculous mycobacteria[J]. Biomedical Engineering and Clinical Medicine, 2022, 26(4): 519-523. (in Chinese) 张娴, 陈春宇, 何纲, 甄沛林. 基于PCR的分子生物学技术在检测非结核分枝杆菌中的进展[J]. 生物医学工程与临床, 2022, 26(4): 519-523. |
| [2] |
Chen HX. The distribution of Mycobacterium avium subsp. avium in naturally infected Pekin ducks tissues and its resulting secondary amyloidosis[D]. Yaan: Master՚s Thesis of Sichuan Agricultural University, 2018 (in Chinese) 陈泓汐. 禽结核杆菌在自然感染北京鸭组织中的分布及其引起的鸭继发性淀粉样变[D]. 雅安: 四川农业大学硕士学位论文, 2018 |
| [3] |
Lu K, Chen SZ, Chen RC, Wang LW. Host factors of nontuberculous mycobacterial diseases[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2022, 45(7): 716-720. (in Chinese) 鲁阔, 陈善泽, 陈荣昌, 王凌伟. 非结核分枝杆菌病的宿主因素[J]. 中华结核和呼吸杂志, 2022, 45(7): 716-720. DOI:10.3760/cma.j.cn112147-20211210-00872 |
| [4] |
Xia DD, Wu LP. Analysis of identification results of 967 strains of non-tuberculosis mycobacteria in Wenzhou from 2016 to 2021[J]. Chinese Journal of Health Laboratory Technology, 2022, 32(9): 1065-1068. (in Chinese) 夏丹丹, 吴联朋. 2016‒2021年温州地区967株非结核分枝杆菌菌种鉴定结果分析[J]. 中国卫生检验杂志, 2022, 32(9): 1065-1068. |
| [5] |
Wang YY, Ou WZ, Xia MN, Huang J, Qin W, Meng J, Wang MD, Ming CY, Kang YQ. Prevalence analysis of nontuberculosis Mycobacterium in a hospital in Guiyang[J]. Journal of Guizhou Medical University, 2017, 42(3): 322-326. (in Chinese) 王颜颜, 欧维正, 夏茂宁, 黄劲, 秦万, 蒙俊, 王明栋, 明春艳, 康颖倩. 贵阳市某医院非结核分枝杆菌流行状况分析[J]. 贵州医科大学学报, 2017, 42(3): 322-326. |
| [6] |
Dhama K, Mahendran M, Tiwari R, Dayal Singh S, Kumar D, Singh S, Sawant PM. Tuberculosis in birds: insights into the Mycobacterium avium infections[J]. Veterinary Medicine International, 2011, 2011: 712369. |
| [7] |
Chen XJ, Mao KR, Luo YF. Diagnosis of avian tuberculosis with the avian tubercula plain agglutination test[J]. Chinese Journal of Veterinary Drug, 1999, 33(3): 3-5. (in Chinese) 陈向经, 毛开荣, 罗玉峰. 用禽型(结核)分枝杆菌平板凝集抗原诊断禽结核病的初步探讨[J]. 中国兽药杂志, 1999, 33(3): 3-5. |
| [8] |
Hong PR, Jiang HF, Tao DH, Su CY, Guo SP, Wu HY, Jiang YX, Ye YY. A case of T-cell large granular lymphocyte leukemia complicated with Mycobacterium avium meningitis together with literature review[J]. Chinese Journal of Antituberculosis, 2021, 43(6): 631-635. (in Chinese) 洪飘如, 蒋慧芳, 陶叠宏, 苏传勇, 郭淑萍, 吴海英, 蒋玉霞, 叶萤燕. 大颗粒淋巴细胞白血病并发鸟分枝杆菌脑膜炎一例并文献复习[J]. 中国防痨杂志, 2021, 43(6): 631-635. DOI:10.3969/j.issn.1000-6621.2021.06.019 |
| [9] |
Chinese medical association tuberculosis branch. Guidelines for diagnosis and treatment of nontuberculous mycobacterial diseases (2020 edition)[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2020, 43(11): 918-946. (in Chinese) 中华医学会结核病学分会. 非结核分枝杆菌病诊断与治疗指南(2020年版)[J]. 中华结核和呼吸杂志, 2020, 43(11): 918-946. DOI:10.3760/cma.j.cn112147-20200508-00570 |
| [10] |
Ge SM. Identification of NTM and study on the expression and immunity of Mycohacterium intracellulare HBHA[D]. Changchun: Doctoral Dissertation of Jilin Agricultural University, 2013 (in Chinese) 葛淑敏. 非结核分枝杆菌的鉴定及胞内分枝杆菌HBHA表达和实验免疫研究[D]. 长春: 吉林农业大学博士学位论文, 2013 |
| [11] |
Turenne CY, Wallace R Jr, Behr MA. Mycobacterium aviumin the postgenomic era[J]. Clinical Microbiology Reviews, 2007, 20(2): 205-229. |
 2022, Vol. 49
2022, Vol. 49