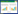扩展功能
文章信息
- 陈铭泽, 王彩虹, 张松松, 耿旭, 吴畏, 姜艳平, 丁国杰, 乔薪瑗
- CHEN Mingze, WANG Caihong, ZHANG Songsong, GENG Xu, WU Wei, JIANG Yanping, DING Guojie, QIAO Xinyuan
- 猪伪狂犬病病毒流行株HLJ-01的分离鉴定及致病性分析
- Isolation and pathogenicity of a pseudorabies virus variant HLJ-01
- 微生物学通报, 2022, 49(12): 5022-5033
- Microbiology China, 2022, 49(12): 5022-5033
- DOI: 10.13344/j.microbiol.china.220669
-
文章历史
- 收稿日期: 2022-07-19
- 接受日期: 2022-09-07
- 网络首发日期: 2022-10-24
2. 哈尔滨威科赛斯生物科技有限公司, 黑龙江 哈尔滨 150030
2. Harbin Weikesaisi Biological Technology, Harbin 150030, Heilongjiang, China
伪狂犬病(pseudorabies,PR)是一种能够感染多种动物的高度传染性疾病,能引起动物发热、瘙痒和神经症状,是一种在中国和许多发展中国家广泛流行的猪病毒性疾病;猪是该病的自然宿主,各品种均可感染;不同日龄猪的感染症状不同,新生仔猪主要感染中枢神经系统,感染后出现共济失调、转圈等神经症状,对仔猪具有较高的致死率,成年猪主要表现呼吸系统和消化系统症状[1-3]。妊娠母猪感染后临床主要表现为流产、死胎和木乃伊胎[2]。该病的突出特征为病毒在被感染猪的外周和中枢神经系统潜伏,损伤神经,当外界环境发生变化时,潜伏的病毒被激活,再次引起伪狂犬病的发生。
自2011年来,国内多个猪场出现伪狂犬病毒的暴发并迅速蔓延,感染猪的发病率和死亡率明显上升,随后国内多名学者相继分离出ZJ01、HeN1、JS、TJ和HN1201等PRV变异毒株,据报道这些分离毒株对小鼠和仔猪具有更强的致病能力。Yang等[4]比较了PRV变异毒株HN1201和经典毒株Fa,发现HN1201可导致广泛的组织损伤和仔猪100%死亡,但Fa株仅引起较弱的呼吸道症状。PRV在系统发育树上分为2种基因型:基因型I包含来自欧洲和美洲的分离株(Kapla、Becker),而基因型II包含主要来自中国和其他亚洲国家的分离株;国内经典毒株(Ea、Fa和SC)和新的变异毒株(HNX、ZJ01、HeN1、JS、TJ和HN1201)都属于基因型II[5-6]。很多研究发现,国内分离到的PRV流行变异株存在毒力增强、抗原变异。因此,从发病猪场分离和鉴定PRV流行毒株,进行相应疫苗的研发,是控制猪伪狂犬病流行的重要手段。
1 材料与方法 1.1 病料来源2020年,从黑龙江暴发疑似伪狂犬病某猪场送检的4头病死仔猪分别采取脑组织,进行PRV感染鉴定和病毒分离。
1.2 细胞及实验动物BHK-21细胞由本实验室保存;56日龄仔猪购于黑龙江某PRV阴性猪场,动物实验遵守相关实验动物福利规定,并获得东北农业大学动物实验伦理委员会批准(协议代码:NEAU2018024)。
1.3 主要试剂TaKaRa LA Taq酶及PCR反应液均购自宝生物工程(大连)有限公司;FastPure® Viral DNA/RNA Mini Kit购自南京诺维赞生物科技股份有限公司;胎牛血清(fetal bovine serum,FBS)购自Gibco公司;DMEM培养基购自上海源培生物公司;PRV特异性阳性血清为本实验室自制并鉴定;PRV gE单克隆抗体由实验室自制;FITC标记羊抗鼠二抗、小鼠IgG、DAPI细胞核染色剂购自上海碧云天生物技术公司。
1.4 方法 1.4.1 病料处理取发病猪脑组织剪碎,加入适量DMEM培养液,研磨成组织悬液。反复冻融3次,5 000 r/min离心5 min,取上清用0.22 μm滤器过滤,−80 ℃保存备用。
1.4.2 引物设计参照GenBank中PRV基因组序列(登录号为KJ789182),分别设计针对gB基因和gE基因内部序列的两对引物。同时,根据基因编码序列外两侧碱基,分别设计扩增gC和gE全长基因的引物。引物由吉林库美生物科技有限公司合成。引物序列见表 1。
| 引物 Primer |
引物序列 Primer sequence (5′→3′) |
产物片段大小 Fragment length (bp) |
退火温度 Annealing temperature (℃) |
| gB-F1 | GCCTTGTGCTCCTGCTGCT | 551 | 58 |
| gB-R1 | ACCCTGAACCTGACGCTGCT | ||
| gE-F1 | GCGCCCCCGGCCCATCTGGTG | 605 | 63 |
| gE-R1 | CTCGTACACGTAGTACAGCAGG | ||
| gC-F1 | TTCCTGATTCACGCCCACG | 1 783 | 62 |
| gC-R1 | CTGTTCCCCGACGACCAAT | ||
| gE-F2 | CCACCATCGCAGAAGAACAA | 2 069 | 62 |
| gE-R2 | GTCTCGTTGTCGCTCTCGCT |
将脑组织病料匀浆,根据DNA/RNA提取试剂盒说明书提取病毒核酸,以gB基因和gE基因保守序列的特异性引物对gB-F1/R1和gE-F1/R1进行PCR扩增。PCR反应体系:TaKaRa LA Taq (5 U/μL) 0.25 μL,2×GC Buffer I 12.5 μL,dNTPs Mixture (2.5 mmol/L) 4 μL,上、下游引物(10 μmol/L)各1.0 μL,DNA模板1.0 μL,ddH2O补足25 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s、退火(温度参考表 1) 1 min,72 ℃ 1 min,共35个循环;72 ℃ 10 min。PCR产物经1%琼脂糖凝胶电泳分析。
1.4.4 病毒的系统发育分析以提取的病毒基因组DNA为模板,以gC-F1/gC-1R和gE-F2/gE-R2两对引物,PCR扩增完整的gC和gE基因编码区。将PCR产物送测序公司测序,并用MEGA 7.0软件对核酸序列进行比对分析,分别以gC和gE基因序列建立系统发育树。
1.4.5 病毒的分离和纯化取过滤后的脑组织匀浆上清液0.5 mL接种BHK-21细胞。37 ℃、5% CO2孵育1 h后,弃液,加入含2% FBS的DMEM培养液,继续培养并观察细胞病变。待70%细胞发生病变时收获病毒液。经3次空斑纯化后,在BHK-21细胞上传代至稳定出现细胞病变(cytopathic effect,CPE)时收获病毒液。
1.4.6 电镜观察收集PRV的细胞培养液,20 000 r/min离心2 h,将沉淀的病毒用少量PBS悬浮,滴加到铜网,待干燥后用磷钨酸负染,进行电镜观察。
1.4.7 间接免疫荧光鉴定将病毒液进行10−5稀释,接种BHK-21细胞,37 ℃培养24 h后,弃去上清液,用预冷无水乙醇固定细胞,PBS洗3次。接毒孔和对照孔均分别加入1:200稀释的gE单克隆抗体50 μL和1:500稀释的小鼠IgG对照50 μL。室温孵育2 h后,PBS洗3次,加入50 μL 1:500稀释的FITC标记羊抗鼠IgG,37 ℃孵育1 h。PBS洗3次,用50 μL DAPI (0.2 μg/mL)染色5 min。然后PBS洗3次,通过荧光显微镜观察。
1.4.8 分离毒株的一步生长曲线测定将原液感染复数(multiplicity of infection,MOI)为0.1的分离毒株接种于BHK-21细胞上,37 ℃孵育2 h后,弃上清,PBS洗3次,补充含2% FBS的培养基继续培养。分别在感染6、12、18、24、30、36、42、48和54 h后收集细胞培养物。按照Reed-Muench法计算不同时间病毒的TCID50,并绘出病毒的生长曲线。
1.4.9 对仔猪的致病性分析将分离毒株用生理盐水稀释至107.0、106.0、105.0和104.0 TCID50这4个稀释度,分别经鼻腔接种56日龄PRV抗原和抗体阴性的健康仔猪各5头,每头2 mL;同时设5头健康猪接种PBS为对照;分别隔离饲养14 d。攻毒后每日定时测量体温,并观察采食、粪便及精神状态等。感染第14天后处死并剖检所有猪,观察各组织脏器的病理变化,并采集心、肝、脾、肺、肾、脑和淋巴结等组织进行病理组织学检查和病毒载量测定。
2 结果与分析 2.1 PCR鉴定结果提取病料DNA进行PCR检测。结果如图 1所示,从脑组织病料中扩增出与阳性对照大小一致的片段(551 bp和605 bp),经测序鉴定为PRV的gB和gE基因。由于该猪场使用的疫苗株缺失gE基因,gE基因PCR检测阳性则表明感染的PRV为野毒株。

|
| 图 1 PCR鉴定结果 Figure 1 PCR identification results. A:gB基因电泳图;M:DNA分子量标准;1:PRV gB基因片段;2:阴性对照;3:阳性对照。B:gE基因电泳图;M:DNA分子量标准;1:PRV gE基因片段;2:阴性对照;3:阳性对照 A: gB gene electropherogram; M: DNA molecular weight standard; 1: PRV gB gene fragment; 2: Negative control; 3: Positive control. B: gE gene electropherogram; M: DNA molecular weight standard; 1: PRV gE gene fragment; 2: Negative control; 3: Positive control. |
|
|
以gC-F1/gC-R1和gE-F2/gE-R2两对引物分别扩增了包含完整gC基因序列的1 783 bp片段和包含完整gE基因序列的2 069 bp片段(图 2)。测序分析显示,HLJ-01株gC基因全长为1 464 bp,gE基因全长为1 740 bp。将其核苷酸序列与参考毒株序列进行比对,结果发现HLJ-01株和2016年前后国内新分离的变异毒株位于遗传进化树的一个相对独立分支中,而且亲缘关系较近(图 3)。

|
| 图 2 gC和gE基因的PCR扩增结果 Figure 2 PCR amplification results of gC and gE genes. M:DNA分子量标准;1:PRV gC基因片段;2:PRV gE基因片段;3:阴性对照 M: DNA molecular weight standard; 1: PRV gC gene target fragment; 2: PRV gE gene target segment; 3: Negative control. |
|
|
|
| 图 3 分离株与经典株gC和gE基因遗传发育分析 Figure 3 Phylogenetic analysis of gC and gE genes of new isolate strains and classical strains. A:基于gC基因的遗传发育树;B:基于gE基因的遗传发育树。括号中的序号是相关菌株的登录号;分支点上的数字是bootstrap值;左下角的标尺表示序列的进化差异 A: Phylogenetic tree of gC gene; B: Phylogenetic tree of gE gene. Numbers in parentheses are the accession numbers of related strains; The number on the branch point represented the bootstrap value; The scale in the lower left corner represented evolution difference. |
|
|
同源性分析结果显示,HLJ-01株与参考毒株的gC基因相似性为94.3%−100.0%,与参考毒株的gE基因的同源性为97.1%−100.0%。HLJ-01株与其他已发表的变异株和经典株gE和gC氨基酸序列分别进行了比对分析,结果表明,其gE和gC氨基酸序列与之前报道的多株变异株相似。gE蛋白具有典型流行株的分子特征,即在第48位和第496位同时各有1个天冬氨酸的插入;gC氨基酸序列63−69位插入7个氨基酸(AAASTPA),而且在180−200位氨基酸有多个置换突变(图 4)。上述结果表明所分离的HLJ-01株属于PRV变异株。

|
| 图 4 分离株(HLJ-01)与经典株gC (A)和gE (B)基因编码氨基酸序列分析 Figure 4 Analysis of deduced amino acid sequences of HLJ-01 and reference strains. A:PRV gC基因的氨基酸序列分析;B:PRV gE基因的氨基酸序列分析 A: Amino acid sequence analysis based on PRV gC gene; B: Amino acid sequence analysis based on PRV gE gene. |
|
|
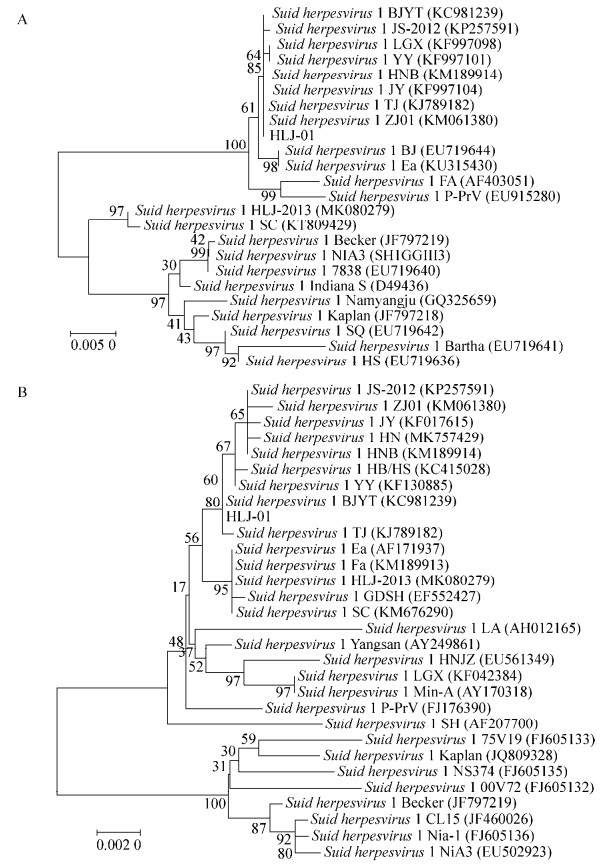
将PRV阳性病料的脑组织研磨液经滤器过滤后接种至BHK-21细胞,60 h后观察到典型的细胞病变,即细胞聚集、变圆、脱落并有合胞体形成(图 5)。用0.02%中性红对细胞进行染色后,挑取空斑并对其中的病毒进行PCR扩增gB和gE基因(图 6),经测序证明为PRV野生型毒株。
|
| 图 5 病料脑组织匀浆上清液感染BHK-21细胞引起的细胞病变 Figure 5 Cytopathic effect (CPE) of the infected brain homogenate on BHK-21 cells. A:病料上清感染的细胞(100×);B:对照细胞(100×) A: Cells infected with the supernatant of the diseased material (100×); B: Control (100×). |
|
|

|
| 图 6 空斑纯化后病毒液PCR鉴定 Figure 6 Confirmation of the viral strain selected by plaque purification. M:DNA分子量标准;1:伪狂犬病毒gB基因片段;2:阴性对照;3:gB基因阳性对照;4:伪狂犬病毒gE基因片段;5:阴性对照;6:gE基因阳性对照 M: DNA molecular weight standard; 1: Pseudorabies virus gB gene fragment; 2: Negative control; 3: gB gene positive control; 4: Pseudorabies virus gE gene fragment; 5: Negative control; 6: gE gene positive control. |
|
|
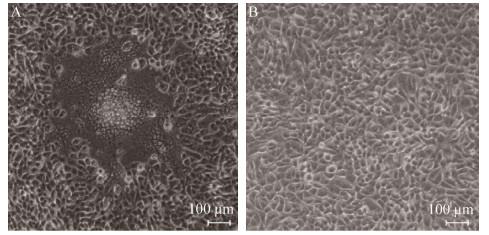
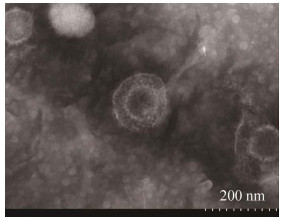
将培养的病毒液超速离心并负染,通过电镜观察,结果如图 7所示。病毒粒子呈球形,直径约150 nm,具有囊膜结构,囊膜外有放射状纤突,具有典型的PRV形态特征。
|
| 图 7 病毒粒子的电镜观察 Figure 7 Electron microscope image of viral particles. |
|
|
将纯化后的分离株感染BHK-21细胞后,用PRV gE单克隆抗体进行间接免疫荧光检测。病毒感染使细胞产生圆缩、聚集、形成合胞体等典型细胞病变。PRV gE单克隆抗体能与病变细胞的病毒结合,呈现特异性荧光,对照组无特异性荧光(图 8)。

|
| 图 8 病毒的间接免疫荧光检测(100×) Figure 8 Indirect immunofluorescence detection of virus (100×). |
|
|
PRV分离株接种BHK-21细胞后,分别测定6、12、18、24、30、36、42、48和54 h各时间点的病毒TCID50。绘制的生长曲线见图 9,病毒滴度在48 h达到最高,为108.5 TCID50/mL。

|
| 图 9 病毒生长曲线 Figure 9 Growth curve of virus. |
|
|
将分离纯化的HJL-01株以不同稀释度分别接种56日龄仔猪。感染1 d后,107.0 TCID50剂量组有1头仔猪发烧(41 ℃以上)。2−3 d后各攻毒组均出现3−5 d的稽留热(41 ℃以上),最高达到41.9 ℃,而且出现厌食、精神沉郁、呼吸困难,个别猪伴有腹泻、神经症状。107.0 TCID50剂量组感染3 d后出现死亡,5 d后全部(5/5)死亡;106.0 TCID50剂量组感染5 d后出现死亡,14 d时4/5死亡;105.0 TCID50剂量组攻毒6 d后出现死亡,14 d时3/5死亡;104.0 TCID50剂量组感染8 d后出现死亡,14 d时1/5死亡,表明分离的流行变异株对猪有较强的致病性。
剖检死亡猪,部分脾脏边缘有坏死,肝脏部分有白色坏死结节,淋巴结肿大出血,部分肺脏有少许实变,心脏和肾脏无明显变化,所有攻毒猪最典型剖检特征为脑部充血(图 10)。

|
| 图 10 PRV攻毒后仔猪的各个脏器病理变化 Figure 10 Pathologic changes of organs from piglets challenged with PRV. |
|
|
病理组织切片观察死亡猪的器官组织,结果如图 11所示,肺炎性细胞浸润,大量浆液性渗出;扁桃体结缔组织增生,淋巴细胞减少;脑胶质细胞轻度增生,神经元细胞大量变性;肝细胞广泛轻度变性,细胞萎缩,窦状间隙扩大,轻度瘀血,结缔组织增生;脾广泛性淋巴细胞减少;肾上皮细胞大量变性;心肌细胞萎缩,间质水肿,结缔组织增生;腹股沟淋巴结可见髓质出血,含铁血黄素沉积,淋巴细胞大量减少。对照组采食、饮水、体温等均正常,各器官和组织无病理变化。

|
| 图 11 各个组织器官病理组织学观察 Figure 11 Histological sections from tissues of piglets challenged with PRV. |
|
|
对105.0 TCID50剂量组的死亡猪进行取样,检测脑、肝脏、肺脏,脾脏、淋巴结和扁桃体的病毒载量,结果如图 12所示,死亡猪的各组织器官病毒载量均在106.0 copies/g以上,其中以脑和肺的病毒载量最高,PBS对照组中各组织器官中无病毒载量。

|
| 图 12 攻毒后不同组织样品中的病毒载量 Figure 12 Viral loads in different tissue samples after challenge. |
|
|
自2011年,我国开始出现了PRV变异毒株,国内多个省份规模化猪场出现大范围流行的PRV感染,多为突然发病且蔓延迅速,给我国养猪业造成了严重的经济损失[7]。有研究对流行变异毒株进行了致病性分析,发现流行变异毒株比经典毒株具有更强的致病力。Luo等[8]对2014年分离的PRV-TJ株与经典强毒SC株进行了致病力分析,结果表明,TJ株102.0 TCID50剂量组可使小鼠发病,而SC株则需要103.0 TCID50;以106.0 TCID50的TJ株和SC株分别接种6周龄仔猪,TJ株发病时间更早,致死率达80%,显著高于SC株,而且仔猪感染TJ株后表现出大脑和淋巴结出血等严重的病理变化。Gu等[9]对分离的变异毒株ZJ01株进行了致病力分析,106.0 TCID50可使80日龄仔猪100%死亡,并且脑有严重的水肿和出血,而传统强毒株LA株106.0 TCID50不能导致80日龄仔猪死亡。在本研究中,致病性结果显示,107.0 TCID50剂量感染组100%死亡;106.0 TCID50剂量感染组80%死亡;105.0 TCID50剂量感染组60%死亡,表明分离的流行变异株对动物具有很强的致病性。
近年来,我国多名学者相继分离了PRV变异流行毒株并进行了相关研究。Zheng等[10]分析了2012−2018年间在华中地区分离到的16株病毒,并对这16株病毒的gE、gC、gB和gD基因进行测序,分析这4个基因序列的遗传进化情况;根据gE、gC、gB和gD基因的遗传进化树分析,这16株病毒均与国内流行毒株同属一个分支,从氨基酸水平上分析发现,16株病毒的gE氨基酸序列中在48位和496位均有一个天冬氨酸的插入,在gC蛋白水平上发现在63−69位有7个氨基酸的插入;此外,发现有8个分离株在第280位(F到L)有1个额外的氨基酸取代,首次证明中国变异毒株的gC蛋白存在特征性的氨基酸替换(第280位)。这些氨基酸序列的改变是区分经典株与变异株的一个重要特征。
gE基因作为伪狂犬病毒的主要毒力基因,可以作为标志基因区别疫苗接种和野毒感染。gE蛋白不参与病毒的复制,属于非必需蛋白,但gE蛋白对病毒在细胞间的扩散和病毒侵染神经系统发挥着重要的作用,gE基因序列的改变影响病毒毒力及中和抗体的产生[11]。本研究将HLJ-01株gE基因与国内外经典毒株和变异毒株进行遗传进化分析和同源性分析,结果发现,gE基因与国内外经典毒株的相似性为97.1%−100%,其中与TJ株的相似性为100%。遗传进化树结果显示,该分离毒株与我国近几年分离的流行变异株位于同一分支,而与国内外经典毒株分处不同分支。氨基酸序列对比结果显示,HLJ-01株gE在48位和496位各有1个天冬氨酸的插入,符合变异毒株的特点。由于gE蛋白表面存在多个抗原表位,HLJ-01株与经典株相比,抗原表位区域的第48、54和496位氨基酸均有突变,这些氨基酸位点的改变是否会导致PRV抗原性的改变,还有待进一步研究。
gC基因是PRV基因序列中变异相对活跃的基因,该基因的变异可导致PRV生物学特性、致病力和毒力的改变,并促使PRV逃避感染宿主的免疫防御[10, 12]。有研究发现,PRV gC蛋白表面65−79位氨基酸(STPPVPPPSVSRRKP)、80−94位氨基酸(PRNNNRTRVHGDKAT)和85−99位氨基酸(RTRVHGDKATA HGRK)为抗原表位区[12]。本研究中发现,HLJ-01株与国内外经典毒株相比,gC蛋白的63−69位共插入7个氨基酸(AAASTPA),并且在180−200氨基酸位置有多个置换突变,影响了gC蛋白的抗原表位。Ren等[13]研究发现,流行毒株的gC蛋白是抗Bartha-K61血清对HB1201无效中和的主要原因,这导致Bartha-K61等经典疫苗株无法对我国当前流行的伪狂犬病毒提供有效保护。本研究通过对HLJ-01株的gC基因同源性和遗传进化树分析,进一步证明了HLJ-01株为变异毒株,而且与2011年后国内流行的变异毒株亲缘关系较近。
综上所述,本研究从黑龙江分离得到一株PRV流行变异株,对其进行了系统发育分析,并对其主要生物学特性进行了鉴定,可为PRV的遗传进化及流行病学分析提供实验数据。
| [1] |
Li SB, Ma FL, Ma ZY, Wang WC, Yin GD, Sun HL, Wei GS, Wang TD, Xuan H. Isolation and identification of porcine pseudorabies virus LA strain[J]. Liaoning Journal of Animal Husbandry and Veterinary Medicine, 2003(3): 6-8. (in Chinese) 李尚波, 马凤龙, 马振宇, 王文成, 尹广东, 孙洪丽, 卫广森, 王铁东, 宣华. 猪伪狂犬病病毒LA株的分离鉴定[J]. 辽宁畜牧兽医, 2003(3): 6-8. DOI:10.3969/j.issn.1672-9692.2003.03.003 |
| [2] |
Ren WK, Zhang L, Lu C, Chi JJ, Li XL, Tian XX, Sun Y, Li FQ, Qiu HJ, Yan MH. Biological characteristics and pathogenicity of pseudorabies variant virus R13028 strain[J]. Chinese Veterinary Science, 2021, 51(3): 314-321. (in Chinese) 任卫科, 张莉, 路超, 池晶晶, 李秀丽, 田向学, 孙元, 李富强, 仇华吉, 鄢明华. 猪伪狂犬病病毒变异株R13028株生物学特性及致病性的研究[J]. 中国兽医科学, 2021, 51(3): 314-321. |
| [3] |
Wang FQ. The isolation, identification, and pathogenicity research on pseudorabies virus strain GDHD-1[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2015 (in Chinese) 王凤求. 猪伪狂犬病毒GDHD-1株的分离鉴定与致病性研究[D]. 南京: 南京农业大学硕士学位论文, 2015 |
| [4] |
Yang QY, Sun Z, Tan FF, Guo LH, Wang YZ, Wang J, Wang ZY, Wang LL, Li XD, Xiao Y, et al. Pathogenicity of a currently circulating Chinese variant pseudorabies virus in pigs[J]. World Journal of Virology, 2016, 5(1): 23-30. DOI:10.5501/wjv.v5.i1.23 |
| [5] |
Zhou QQ, Zhang LF, Liu HY, Ye GQ, Huang L, Weng CJ. Isolation and characterization of two pseudorabies virus and evaluation of their effects on host natural immune responses and pathogenicity[J]. Viruses, 2022, 14(4): 712. DOI:10.3390/v14040712 |
| [6] |
Liu HM, Shi ZB, Liu CG, Wang PF, Wang M, Wang SD, Liu ZS, Wei LL, Sun ZZ, He XJ, et al. Implication of the identification of an earlier pseudorabies virus (PRV) strain HLJ-2013 to the evolution of Chinese PRVs[J]. Frontiers in Microbiology, 2020, 11: 612474. DOI:10.3389/fmicb.2020.612474 |
| [7] |
Luo Z. Current epidemic characteristics and control measures of pseudorabies in pigs[J]. Modern Animal Husbandry, 2018(1): 46-47. (in Chinese) 罗展. 当前猪伪狂犬病的流行特点及防控措施[J]. 当代畜禽养殖业, 2018(1): 46-47. DOI:10.3969/j.issn.1005-5959.2018.01.041 |
| [8] |
Luo YZ, Li N, Cong X, Wang CH, Du M, Li L, Zhao BB, Yuan J, Liu DD, Li S, et al. Pathogenicity and genomic characterization of a pseudorabies virus variant isolated from Bartha-K61-vaccinated swine population in China[J]. Veterinary Microbiology, 2014, 174(1/2): 107-115. |
| [9] |
Gu ZQ, Hou CC, Sun HF, Yang WP, Dong J, Bai J, Jiang P. Emergence of highly virulent pseudorabies virus in southern China[J]. Canadian Journal of Veterinary Research, 2015, 79(3): 221-228. |
| [10] |
Zheng HH, Bai YL, Xu T, Zheng LL, Li XS, Chen HY, Wang ZY. Isolation and phylogenetic analysis of reemerging pseudorabies virus within pig populations in central China during 2012 to 2019[J]. Frontiers in Veterinary Science, 2021, 8: 764982. DOI:10.3389/fvets.2021.764982 |
| [11] |
Zhao HY, Peng JM, An TQ, Li L, Leng CL, Chen JZ, Wang Q, Chang D, Zhang QY, Cai XH, et al. Identification of glycoprotein E characteristic in pseudorabies virus variants from swine[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(7): 506-509. (in Chinese) 赵鸿远, 彭金美, 安同庆, 李琳, 冷超粮, 陈家锃, 王倩, 常丹, 张秋月, 蔡雪辉, 等. 猪伪狂犬病病毒变异株的分离鉴定及其gE基因的分子特征[J]. 中国预防兽医学报, 2014, 36(7): 506-509. DOI:10.3969/j.issn.1008-0589.2014.07.02 |
| [12] |
Xia DL, Huang LP, Wei YW, Wang YP, Du WJ, Xie YX, Wu HL, Feng L, Liu CM. Molecular characterization of gC gene of pseudorabies virus epidemic isolates and their virulence test in mice[J]. Chinese Veterinary Science, 2017, 47(6): 713-720. (in Chinese) 夏德利, 黄立平, 危艳武, 王一平, 杜文娟, 谢永兴, 吴洪丽, 冯力, 刘长明. 猪伪狂犬病病毒流行毒株gC基因的分子特征及其对小鼠的毒力试验[J]. 中国兽医科学, 2017, 47(6): 713-720. |
| [13] |
Ren JL, Wang HB, Zhou L, Ge XN, Guo X, Han J, Yang HC. Glycoproteins C and D of PRV strain HB1201 contribute individually to the escape from bartha-K61 vaccine-induced immunity[J]. Frontiers in Microbiology, 2020, 11: 323. DOI:10.3389/fmicb.2020.00323 |
 2022, Vol. 49
2022, Vol. 49