扩展功能
文章信息
- 徐肖文, 项志杰, 王琛, 郭爱珍, 陈颖钰
- XU Xiaowen, XIANG Zhijie, WANG Chen, GUO Aizhen, CHEN Yingyu
- 牛呼吸疾病综合征主要病毒的检测、分离与鉴定
- Detection, isolation, and identification of the main viruses causing bovine respiratory disease complex
- 微生物学通报, 2022, 49(12): 4978-4986
- Microbiology China, 2022, 49(12): 4978-4986
- DOI: 10.13344/j.microbiol.china.220867
-
文章历史
- 收稿日期: 2022-09-08
- 接受日期: 2022-09-26
- 网络首发日期: 2022-10-28
2. 华中农业大学动物科技学院动物医学院, 湖北 武汉 430070;
3. 华中农业大学生猪健康养殖协同创新中心, 湖北 武汉 430070;
4. 华中农业大学湖北省兽医流行病学国际科技合作基地, 湖北 武汉 430070;
5. 华中农业大学湖北洪山实验室, 湖北 武汉 430070
2. College of Veterinary Medicine, College of Animal Sciences and Technology, Huazhong Agricultural University, Wuhan 430070, Hubei, China;
3. The Cooperative Innovation Center for Sustainable Pig Production, Huazhong Agricultural University, Wuhan 430070, Hubei, China;
4. Hubei International Science and Technology Cooperation Base of Veterinary Epidemiology, Huazhong Agricultural University, Wuhan 430070, Hubei, China;
5. Hubei Hongshan Laboratory, Huazhong Agricultural University, Wuhan 430070, Hubei, China
随着肉牛产业的不断发展,牛呼吸疾病综合征(bovine respiratory disease complex,BRDC)已成为肉牛产业兴起的重要阻碍因素,同时也是养牛业的常发病[1]。BRDC是由环境应激和病原(细菌、支原体及病毒等)共同作用所致。其病毒性病原主要包括牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)、牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)、牛呼吸道合胞体病毒(bovine respiratory syncytial virus,BRSV)和牛副流感病毒3型(bovine parainfluenza virus type 3,BPIV-3)等[2],这些病毒感染健康牛后常引起咳嗽、流鼻涕、食欲减退与呼吸困难等临床症状,严重影响生产性能。为了解我国BRDC的流行现状及优势病毒,本研究收集了来自湖北、湖南、安徽、河南、广东、广西和贵州等不同地区的病牛组织样本,利用反转录聚合酶链反应(reverse transcription- polymerase chain reaction,RT-PCR)技术对IBRV、BVDV、BRSV和BPIV-3四种病毒进行检测,并对阳性样品进行病毒的分离与鉴定,以期为疫苗研发和BRDC的防控提供重要依据。
1 材料与方法 1.1 材料 1.1.1 样本来源自2021年9月到2022年7月收集来自湖北、湖南、安徽、河南、广东、广西和贵州等地区21个牛场的179头具有呼吸道症状牛的196份样品,包括167份鼻拭子、13份肺脏组织、1份鼻黏液、5份气管拭子、1份唾液和9份血清。
1.1.2 细胞牛胚肾(madin-darby bovine kidney,MDBK)细胞购自中国兽医药品监察所。
1.1.3 主要试剂和仪器DMEM高糖(2×)培养液,吉林吉诺生物工程有限责任公司;低熔点琼脂糖粉,武汉普兰德生物技术有限公司;2×Taq Master Mix、DNA/RNA Extraction Kit、HiScript® Ⅱ 1st Strand cDNA Synthesis Kit,南京诺唯赞生物科技股份有限公司;1.1×S4 Fidelity PCR Mix,北京金沙生物科技有限公司。琼脂糖凝胶电泳仪,北京六一生物科技有限公司;全自动核酸提取仪,南京诺唯赞医疗科技有限公司;基因扩增仪,杭州博日科技有限公司。
1.2 方法 1.2.1 RT-PCR检测病毒提取病料的DNA/RNA,DNA病毒用PCR扩增检测IBRV,RNA病毒逆转录为cDNA后进行PCR扩增,检测BVDV、BPIV-3、BRSV。本研究所用引物如表 1所示,引物由北京擎科生物科技有限公司合成。PCR反应体系:2×Taq Master Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板2 μL,ddH2O 8.5 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 15 s,退火(BVDV、IBRV、BPIV-3退火温度分别为59.5、60.5、57.6 ℃,BRSV一轮和二轮退火温度分别为53、56 ℃) 15 s,72 ℃ 1 min,35个循环;72 ℃ 5 min。PCR产物用1%琼脂糖凝胶电泳检测,扩增出阳性条带的样本送公司测序,鉴定正确的样本进行病毒分离。
| Viruses | Target genes | Sequence (5′→3′) | Product size (bp) | References |
| BPIV-3 | N | F1: GAGAAAGACCCAGGAAGACAGA | 704 | [3] |
| R1: ACACCCATCGCATAACTCCAGA | ||||
| F2: CATCCATAGTTCCTTATGCATG | 153 | Designed by our laboratory | ||
| R2: TTGGGTCGCTCTGTTTCC | ||||
| F3: ACAGTATGTAACAGGACGGTCC | 126 | |||
| R3: GCCTCTTGTGTAATCCCCAA | ||||
| IBRV | TK | F: CCGACCGCCTCCTACACCAGATGCT | 868 | Designed by our laboratory |
| R: GGGTGTAGGCAAGCTCACCGCAACG | ||||
| BRSV | N | F1: CAAACTAAATGACACTTTCAACAAG | 566 | [4] |
| R1: CATTTCATTCCTTAGTACATTGTTG | ||||
| F2: CGTAGTACAGGTGACAACATTG | 422 | |||
| R2: ACCAAAGCAGCAACACATAGCAC | ||||
| BVDV | 5ʹUTR | F: TCAGCGAAGGCCGAAAAGAGG | 310 | [5] |
| R: TCCATGTGCCATGTACAGCAGAG |
阳性样品(病牛的肺组织样品充分匀浆后,8 000 r/min离心3 min取上清液)反复冻融后经0.22 μm滤器过滤,取适量滤液接种于长满单层的MDBK细胞,在37 ℃、5% CO2培养箱中感染2 h,弃去滤液,用PBS清洗后加入含有2%胎牛血清和1%青链霉素双抗的DMEM维持液,每日观察细胞病变。接毒3−5 d或细胞出现80%以上病变后收毒,反复冻融3次,4 ℃、4 000 r/min离心10 min,取上清并经0.22 μm滤器过滤后置−80 ℃备用。
1.2.3 PCR鉴定参照表 1引物序列,对盲传的每一代病毒液进行PCR鉴定。PCR反应体系:1.1×S4 Fidelity PCR Mix 21 μL,上、下游引物(10 μmol/L)各1 μL,模板2 μL。PCR反应条件:98 ℃ 2 min;95 ℃ 10 s,退火(BVDV、IBRV、BPIV-3退火温度分别为59.5、60.5、57.6 ℃,BRSV一轮和二轮退火温度分别为53、56 ℃) 15 s,72 ℃ 15 s,35个循环;72 ℃ 5 min。PCR产物用1%琼脂糖凝胶电泳检测,回收阳性条带产物进行测序。
1.2.4 噬斑纯化对1.2.3鉴定正确的病毒进行噬斑纯化,将病毒液进行10倍比稀释。选择10−3、10−4、10−5、10−6、10−7这5个稀释度接种长满单层MDBK细胞的6孔板,剩余1个孔为阴性对照,在37 ℃、含5% CO2培养箱中感染作用2 h,弃去滤液,加入2 mL提前准备好的含有2%胎牛血清、1%青霉素-链霉素双抗和DMEM培养液(2×)的低熔点琼脂糖,待彻底凝固后置37 ℃、含5% CO2培养箱中培养,每日观察病变,挑取单个噬斑进行扩大培养。
1.2.5 TCID50测定将MDBK细胞消化后以每孔200 μL接种于96孔板,待细胞长满单层后弃去细胞培养液,使用不含血清和双抗的DMEM培养液将病毒原液进行10倍比系列稀释,最高稀释到10−8,每个梯度做8个重复,每孔加入100 μL病毒液,在5% CO2、37 ℃培养箱中吸附2 h后补加100 μL维持液,放于培养箱中培养,于3−5 d后按照Reed-Muench法(TCID50≥50%病变的病毒最高稀释度的对数+距离比例,距离比指 > 50%的百分数−50%与 > 50%的百分数−低于50%的百分数之比)统计结果。
1.2.6 BPIV-3生长特性测定将已知病毒滴度的病毒以0.1 MOI (multiplicity of infection,原液感染复数)接种长满单层的MDBK细胞,分别于接毒后3、6、9、12、18、24、30、33、42、48、60、72 h收毒,反复冻融3次,测定各时间点的病毒滴度,绘制生长曲线。
2 结果与分析 2.1 BRSV、IBRV、BPIV-3、BVDV的阳性检出率利用RT-PCR对196份临床病料进行检测,结果显示,7.14% (95% CI:3.96,11.69) (14/196,14份鼻拭子样本)的临床样品检测到BRSV,6.63% (95% CI:3.58,11.07) (13/196,13份鼻拭子样本)的临床样品检测到BVDV,0.51% (95% CI:0.01,2.81) (1/196,1份鼻拭子样本)检测到IBRV,4.08% (95% CI:1.78,7.88) (8/196,6份鼻拭子样本及2份肺组织样本)检测到BPIV-3 (图 1−4)。

|
| 图 1 部分病料BPIV-3 RT-PCR扩增结果 Figure 1 BPIV-3 RT-PCR amplification results of some disease materials. M:DL2000 DNA Marker;1−5:不同病料BPIV-3病毒检测结果;6:阴性对照;7:阳性对照 M: DL2000 DNA Marker; 1−5: BPIV-3 virus test results of different disease materials; 6: Negative control; 7: Positive control. |
|
|
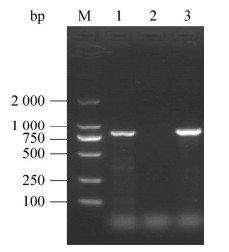
|
| 图 2 病料IBRV RT-PCR扩增结果 Figure 2 IBRV RT-PCR amplification result of the disease material. M:DL2000 DNA Marker;1:病料IBRV病毒检测结果;2:阴性对照;3:阳性对照 M: DL2000 DNA Marker; 1: IBRV virus test result of the disease material; 2: Negative control; 3: Positive control. |
|
|

|
| 图 3 部分病料BRSV RT-PCR扩增结果 Figure 3 BRSV RT-PCR amplification results of some disease materials. M:DL2000 DNA Marker;1−5:不同病料BRSV病毒检测结果;6:阴性对照;7:阳性对照 M: DL2000 DNA Marker; 1−5: BRSV virus test results of different disease materials; 6: Negative control; 7: Positive control. |
|
|

|
| 图 4 部分病料BVDV RT-PCR扩增结果 Figure 4 BVDV RT-PCR amplification results of some disease materials. M:DL2000 DNA Marker;1−3:不同病料BVDV病毒检测结果;4:阴性对照;5:阳性对照 M: DL2000 DNA Marker; 1−3: BVDV virus test results of different disease materials; 4: Negative control; 5: Positive control. |
|
|
在179头牛中,BRSV、IBRV、BPIV-3、BVDV这4种病毒的阳性检出率分别为7.82% (95% CI:4.34,12.77) (14/179)、0.56% (95% CI:0.01,3.07) (1/179)、4.47% (95% CI:1.95,8.62) (8/179)、7.26% (95% CI:3.92,12.10) (13/179);其中BVDV与BRSV在病牛中共感染的比例为0.56% (95% CI:0.01,3.07) (1/179)。
2.2 病毒的分离与鉴定对上述阳性样品进行病毒分离,接种细胞3−5代并经PCR鉴定后成功获得1株BVDV (non-cytopathic)与6株BPIV-3 (图 5和图 6)。光学显微镜下显示BPIV-3早期细胞变圆肿大,局部细胞脱落(图 7A);中期细胞逐渐融合脱落成圆形,部分细胞裂解为碎片(图 7B);后期细胞大面积融合形成拉网状(图 7C),最终细胞完全脱落。图 7D为正常MDBK细胞。

|
| 图 5 BPIV-3 PCR扩增结果 Figure 5 BPIV-3 PCR amplification results. M:DL2000 DNA Marker;1−6:不同样本BPIV-3病毒检测结果;7:阴性对照;8:阳性对照 M: DL2000 DNA Marker; 1−6: BPIV-3 virus test results of different disease samples; 7: Negative control; 8: Positive control. |
|
|

|
| 图 6 BVDV PCR扩增结果 Figure 6 BVDV PCR amplification results. M:DL2000 DNA Marker;1:样本BVDV病毒检测结果;2:阴性对照;3:阳性对照 M: DL2000 DNA Marker; 1: BVDV virus test result of sample; 2: Negative control; 3: Positive control. |
|
|

|
| 图 7 BPIV-3细胞病变 Figure 7 Cytopathy of BPIV-3. A:接毒后24 h (40×);B:接毒后48 h (40×);C:接毒后72 h (40×);D:阴性对照(40×) A: 24 h after receiving the poison (40×); B: 48 h after receiving the poison (40×); C: 72 h after receiving the poison (40×); D: Negative control (40×). |
|
|
使用分型引物(BPIV-3A上游引物:5'-CAT CCATAGTTCCTTATGCATG-3',下游引物:5'-T TGGGTCGCTCTGTTTCC-3';BPIV-3C上游引物:5'-ACAGTATGTAACAGGACGGTCC-3',下游引物:5'-GCCTCTTGTGTAATCCCCAA-3')进一步对所获得BPIV-3的病毒进行分型鉴定,发现6株BPIV-3病毒均能扩增出BPIV-3C目的条带,而且与预期大小一致(图 8),同时将其PCR产物送去测序,并将测序结果在NCBI上比对,结果也显示6株BPIV-3病毒为C型,而BVDV的PCR产物测序结果比对后结果显示为1d型。

|
| 图 8 BPIV-3C PCR扩增结果 Figure 8 BPIV-3C PCR amplification results. M:DL2000 DNA Marker;1−6:不同样本BPIV-3C病毒检测结果;7:阳性对照;8:阴性对照 M: DL2000 DNA Marker; 1−6: BPIV-3C virus test results of different disease samples; 7: Positive control; 8: Negative control. |
|
|
对6株BPIV-3C分别进行至少3次噬斑纯化,每次纯化挑取多个噬斑(图 9),并进行扩大培养,待80%以上病变后收毒,利用RT-PCR进行外源病毒检测鉴定,确定为纯净的BPIV-3C病毒。

|
| 图 9 BPIV-3C单个噬斑(100×) Figure 9 Single plaque of BPIV-3C (100×). |
|
|
接毒后3−5 d,按Reed-Muench计算法,得出6株BPIV-3C病毒滴度分别为107.55、108.1、107.43、107.2、107.47、107.8 TCID50/mL。
2.5 病毒生长曲线为了解病毒的生长特性,选取毒价较高的毒株,以0.1 MOI接毒测定生长曲线,结果表明,病毒在接毒后24 h时增殖达到峰值,病毒滴度达到108.52 TCID50/mL,24−30 h病毒复制进入短暂平台期,随后病毒滴度呈下降趋势(图 10)。

|
| 图 10 BPIV-3C生长曲线 Figure 10 Growth curve of BPIV-3C. |
|
|
BRDC对肉牛业与奶牛业健康发展的威胁日趋严重,由于BRDC的感染情况较为复杂,了解我国BRDC的流行现状及流行毒株对该病的防控具有重要意义。近年来,越来越多的研究人员对其主要病毒性病原进行了调查,但多是基于抗原甚至抗体的检测,难以反映疾病的真实情况。例如,肉牛BPIV-3的血清学阳性率为77.6%−91.08%[6-7];IBRV抗体阳性率为50.23%−52.77%,群体阳性率在70%以上[8]。BVDV抗原总阳性率为0.49%,抗体总阳性率为75.94%−80.97%[9-10]。部分奶牛群中IBRV、BVDV、BPIV-3、BRSV的个体阳性率则分别高达76.2%、60.5%、63.2%、45.4%,群体阳性率更是分别高达82.2%、75.0%、85.7%、89.3%[11]。本研究利用RT-PCR技术对该4种病原进行了病原学检测,结果也显示了IBRV、BVDV、BPIV-3、BRSV这4种病毒在我国肉牛群中确实存在不同程度的流行。而且在患有呼吸道疾病综合征的病牛中,BRSV和BVDV占有优势的地位,阳性检出率分别为7.82%和7.26%。表明我国肉牛呼吸道疾病综合征的防控中,应将BRSV和BVDV作为防控的要点。
此外,本研究还发现了BVDV与BRSV共感染的病例,这与许多学者的相关研究报道[11-13]一致,这4种病毒在临床上存在混合感染的情况,主要是因为某种病原感染健康牛后会导致饲养牛的抵抗力下降,甚至还会造成免疫抑制,从而易发生继发感染与混合感染。
为了有针对性地开发牛呼吸道疾病综合征病毒的高效疫苗,本研究对临床样本进行了病毒的分离,并鉴定了具体的亚型。发现在所调查的场群中,BVDV为1d型,BPIV-3为C型。目前国内流行的BVDV主要为1型[14],BPIV-3主要为A型与C型,鲜有B型报道[15],这也与本研究的结果一致。
综上所述,本研究揭示了华中、华南、西南等地区部分养殖场BRDC主要病毒性病原的流行情况,为BRDC的防控提供了参考依据,而且分离获得的毒株是当下国内较为流行的病毒亚型,能够作为相关疫苗研究的储备,具有良好的临床应用价值。
| [1] |
Guo AZ. The prevalence and control of bovine respiratory disease complex[J]. China Dairy Cattle, 2011(24): 7-11. (in Chinese) 郭爱珍. 牛呼吸疾病综合征及其防治[J]. 中国奶牛, 2011(24): 7-11. DOI:10.3969/j.issn.1004-4264.2011.24.002 |
| [2] |
Fulton RW. Bovine respiratory disease research (1983−2009)[J]. Animal Health Research Reviews, 2009, 10(2): 131-139. DOI:10.1017/S146625230999017X |
| [3] |
Liu P, Hou XL, Zhou YL, Piao FZ. Isolation and identification of bovine parainfluenza virus type 3[J]. Microbiology, 2009, 36(9): 1384-1389. (in Chinese) 刘鹏, 侯喜林, 周玉龙, 朴范泽. 牛副流感病毒3型的分离鉴定[J]. 微生物学通报, 2009, 36(9): 1384-1389. DOI:10.13344/j.microbiol.china.2009.09.029 |
| [4] |
Klima CL, Zaheer R, Cook SR, Booker CW, Hendrick S, Alexander TW, McAllister TA. Pathogens of bovine respiratory disease in north American feedlots conferring multidrug resistance via integrative conjugative elements[J]. Journal of Clinical Microbiology, 2014, 52(2): 438-448. DOI:10.1128/JCM.02485-13 |
| [5] |
Deng Y, Sun CQ, Cao SJ, Lin T, Yuan SS, Zhang HB, Zhai SL, Huang L, Shan TL, Zheng H, et al. High prevalence of bovine viral diarrhea virus 1 in Chinese swine herds[J]. Veterinary Microbiology, 2012, 159(3/4): 490-493. |
| [6] |
Wang HY, Tong Q, Wang W, Wu H. Serological survey of antibodies against bovine parainfluenza virus type 3 in 12 provinces[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(2): 154-156. (in Chinese) 王海勇, 童钦, 王炜, 武华. 我国牛副流感病毒3型血清学调查[J]. 中国预防兽医学报, 2014, 36(2): 154-156. DOI:10.3969/j.issn.1008-0589.2014.02.16 |
| [7] |
Huo ZY, Tong Q, Hu JX, Wang W. Serological survey of antibodies against bovine parainfluenza virus type 3 in three regiond of north China[J]. Progress in Veterinary Medicine, 2012, 33(9): 124-126. (in Chinese) 霍志云, 童钦, 胡嘉欣, 王炜. 北方三省(区)牛副流感病毒3型的血清学调查[J]. 动物医学进展, 2012, 33(9): 124-126. |
| [8] |
Qu P, Song XH, Dong H, Hu DM, Zhao BL, Sun Y, Zhang Q, Wang XY, Yang L. Serological investigation and analysis of infectious bovine rhinotracheitis in partial areas of China[J]. Progress in Veterinary Medicine, 2018, 39(3): 132-136. (in Chinese) 曲萍, 宋晓晖, 董浩, 胡冬梅, 赵柏林, 孙雨, 张倩, 王晓英, 杨林. 我国部分地区牛传染性鼻气管炎血清学调查与分析[J]. 动物医学进展, 2018, 39(3): 132-136. DOI:10.3969/j.issn.1007-5038.2018.03.028 |
| [9] |
Zhang YM, Wang JN, Chi LL, Li SF, Chen ZY, Wang K, Wang GH, Liu XW, Sun XX, Fan XX, Xu SZ. Serological investigation of bovine viral diarrhea virus infection in large-scale dairy farm in some areas of Shandong from 2018 to 2019[J]. Chinese Journal of Veterinary Medicine, 2021, 57(5): 10-14. (in Chinese) 张宇名, 王君娜, 迟丽丽, 李树凡, 陈志远, 王昆, 王广辉, 刘锡武, 孙翔翔, 樊晓旭, 徐守振. 2018–2019年山东部分地区规模化奶牛场牛病毒性腹泻病毒感染血清学调查[J]. 中国兽医杂志, 2021, 57(5): 10-14. |
| [10] |
Quan PH, Zhang ZD, Zhao LX, Gu Y, Wang XH, Han S, Zhou WG, Guan PY, Xu XJ. Serological investigation of five diaeasea in beef cattle in some areas of China[J]. Veterinary Orientation, 2022(1): 24-29. (in Chinese) 权璞宏, 张志丹, 赵丽霞, 谷玉, 王旭红, 韩硕, 周伟光, 关平原, 徐晓静. 我国部分地区肉牛5种病的血清流行病学调查[J]. 兽医导刊, 2022(1): 24-29. |
| [11] |
Bi YY, Song LL, Xue Y, Li JB, Li CH, Jia AQ, Song XF, Zhang LX, Wang L. Detection of serum antibodies against major pathogens leading to BRDC in large-scale dairy farms in four provinces, northern China[J]. China Animal Health Inspection, 2020, 37(12): 9-13. (in Chinese) 毕玉彧, 宋丽丽, 薛原, 李金波, 李春花, 贾爱琴, 宋晓飞, 张连秀, 王蕾. 我国北方4省部分规模奶牛场牛呼吸道疾病综合征主要病原血清抗体检测[J]. 中国动物检疫, 2020, 37(12): 9-13. |
| [12] |
Liu ZY, Liu ZK, Li ZJ, Guo L, Zhang JL. Investigation of BVDV, IBRV and BRSV infection in some cattle farms of Jilin province[J]. Animal Husbandry & Veterinary Medicine, 2019, 51(12): 101-105. (in Chinese) 刘泽余, 刘占悝, 李智杰, 郭利, 张加力. 吉林省部分牛场BVDV、IBRV、BRSV的感染情况调查[J]. 畜牧与兽医, 2019, 51(12): 101-105. |
| [13] |
Zhang XJ. Epidemiological survey of bovine respiratory viruses in Jiangsu province and evaluation of the immune efficacy of a recombinant BHV-1 vaccine expressing E2 gene of BVDV-2[D]. Yangzhou: Doctoral Dissertation of Yangzhou University, 2018 (in Chinese) 张信军. 江苏省牛常见呼吸道病毒病流行病学调查及表达BVDV-2 E2基因重组BHV-1疫苗的免疫效果评价[D]. 扬州: 扬州大学博士学位论文, 2018 |
| [14] |
Wang Q, He B, Ou YW, Liu LJ, Yang L, Pan Q, Zhang J. Establishment and application of duplex RT-PCR for genotypes of bovine viral diarrhea virus[J]. Progress in Veterinary Medicine, 2021, 42(9): 24-29. (in Chinese) 王勤, 何博, 欧云文, 刘俐君, 杨磊, 潘琴, 张杰. 牛病毒性腹泻病毒两种基因型双重RT-PCR检测方法的建立及应用[J]. 动物医学进展, 2021, 42(9): 24-29. |
| [15] |
Chu HM, Ren YC, Cheng KH, Xie XL, Zhang L, Sun YY, Yang HJ. Isolation, identification, and genome sequencing of a bovine parainfluenza virus type 3 strain[J]. Journal of Pathogen Biology, 2020, 15(9): 1038-1041. (in Chinese) 楚会萌, 任亚初, 程凯慧, 解晓莉, 张亮, 孙阳阳, 杨宏军. 一株牛副流感病毒3型的分离鉴定及基因组序列分析[J]. 中国病原生物学杂志, 2020, 15(9): 1038-1041. |
 2022, Vol. 49
2022, Vol. 49