扩展功能
文章信息
- 田龙艳, 黄华, 杨华, 黎子君, 邱华龙, 张春花, 徐金柱, 秦长生
- TIAN Longyan, HUANG Hua, YANG Hua, LI Zijun, QIU Hualong, ZHANG Chunhua, XU Jinzhu, QIN Changsheng
- 假单胞菌T1-3-2的抑菌特性及其对杉木的抗病促生作用
- Pseudomonas sp. T1-3-2 with antimicrobial activities improves the disease resistance and promotes the growth of Cunninghamia lanceolata
- 微生物学通报, 2022, 49(11): 4752-4765
- Microbiology China, 2022, 49(11): 4752-4765
- DOI: 10.13344/j.microbiol.china.220183
-
文章历史
- 收稿日期: 2022-02-23
- 接受日期: 2022-07-27
- 网络首发日期: 2022-09-02
2. 封开县林业局森林病虫害防治检疫站, 广东 肇庆 526599
2. Forest Pest Control and Quarantine Station of Fengkai Forestry Bureau, Zhaoqing 526599, Guangdong, China
杉木(Cunninghamia lanceolate)是我国南方各省重要的用材树种之一。近些年,随着杉木优良家系不断选育与推广,杉木人工林面积快速增长,病虫害危害频繁,受害面积逐年增长[1-2]。其中,以杉木炭疽病危害最为严重,该病害常发生于杉木球果、针叶、枝干多个部位,严重影响杉木正常生长;此外,杉苗猝倒病、杉木赤枯病、杉木溃疡病等真菌性病害的发生也较为普遍[2-5]。化学防治因其见效快,一直是杉木病害防治的主要手段[6-7]。但长期使用单一化学药剂导致一些病原菌产生抗药性,造成环境污染,甚至破坏生态平衡[8]。生物防治因其无污染、无公害、具长效性等优点成为植物病害防治的重要手段,是目前研究的热点[9]。
假单胞菌因适应能力强,可产生多种抗菌素,能诱导植物产生抗性,同时具有一定的促生作用,成为一类最具开发潜力的生防菌株,在农业领域已得到广泛关注及应用[10]。这类菌株主要通过分泌吩嗪-1-羧酸(phenazine-1-carboxylic acid,PCA)、藤黄绿菌素(pyoluteorin,Plt)、硝吡咯菌素(pyrrolnitrin,Prn)和氰化物等一种或多种代谢产物来抑制植物病原菌的繁殖[11-12]。目前我国登记注册有效的假单胞菌类商品有8种,主要应用于烟草、小麦、水稻等农作物的病害防治[13-14]。在美国环境保护局(Environmental Protection Agency)注册的用于防治植物病害假单胞菌属商业产品有9种,主要应用于柑橘、土豆等作物的采后贮藏期间,以及在温室作为土壤淋剂用于防治腐霉、立枯丝核菌和尖孢镰刀菌等土壤致病菌[12]。
生防菌的防病增产范围和稳定性受到温度、湿度、pH等环境因子的影响,这也是制约生防菌开发应用的主要因素之一。从杉木林中筛选高效的土著生防菌株更有利于杉木生防菌剂的后期开发及推广应用。广东省作为杉木主要种植区之一,有关本土杉木生防菌的研究鲜有报道。因此,本研究以分离自杉木球果的一株细菌T1-3-2为研究对象,对其分类学地位、抑菌效果及盆栽促生效果和防病效果等开展了研究,以期丰富杉木生防菌的种质资源并为杉木生防菌剂的开发应用奠定基础。
1 材料与方法 1.1 材料供试细菌菌株T1-3-2分离自广东省乐昌市龙山林场的杉木球果,菌株保藏于广东省微生物菌种保藏中心,菌株编号为GDMCC 61843。
供试的10株靶标菌株包括:炭疽菌属(Colletotrichum)菌株T3-2-1 (C. gloeosporioides)和T3-4-1 (C. fructicola),拟盘多毛孢属(Pestalotiopsis)菌株T3-5-1 (Pestalotiopsis sp.)和T2-1-2 (P. vismiae),镰刀菌属(Fusarium)菌株O10-3 (F. oxysporum)和SM-LK-b5a (F. solani),舟皮盘菌属(Ploioderm)菌株SM-KY-1 (P. destruens),葡萄座腔菌属(Botryosphaeria)菌株SM-KY-3(B. dothidea),以及黑孢霉属(Nigrospora)菌株O1-1 (N. oryzae)和O4-3-1 (N. oryzae),靶标菌株均分离自杉木病组织,保存于广东省林业科学研究院森林保护研究所。
振荡培养箱,上海知楚仪器有限公司;PCR仪智能恒温循环器,北京德天佑科技发展有限公司;旋转蒸发仪,广州星烁仪器有限公司;人工气候箱,宁波莱福科技有限公司。
Kings Medium B (KMB)液体培养基参照文献[15]配制,LB培养基和PDA培养基参照文献[16]配制。16S rRNA基因序列通用引物和Taq聚合酶购自生工生物工程(上海)股份有限公司。
1.2 细菌鉴定参照《常见细菌系统鉴定手册》[15]和《微生物学实验手册》[17]中介绍的方法观察菌落形态和大小,同时进行生理生化特性检测。
利用16S rRNA基因序列对菌株T1-3-2进行分子生物学鉴定。采用通用引物27F (5ʹ-AGAG TTTGATCCTGGCTCAG-3ʹ)和1492R (5ʹ-GGTT ACCTTGTTACGACTT-3ʹ)进行菌落PCR扩增目的基因片段,扩增产物由生工生物工程(上海)股份有限公司测序[18];序列经Chromas序列拼接软件校正,在NCBI (http://blast.ncbi.nlm.nih.gov/)数据库中进行同源性比对分析,采用MEGA 5.0软件运用Jukes-Cantor模型,采用邻接法构建系统发育树进行分析[19]。
1.3 拮抗菌抑菌特性研究 1.3.1 菌株抑菌效果测定采用平板对峙法测定菌株T1-3-2对靶标菌株的拮抗效果。挑取少许细菌于PDA平板上划线(2.0 cm长),28 ℃恒温培养1 d,将靶标菌株杉木炭疽病菌(T3-2-1)菌饼置于距离细菌2.5 cm处,28 ℃恒温倒置培养。PDA接入杉木炭疽病菌(T3-2-1)作为对照,设置3个重复。28 ℃恒温培养,测量R1、R2距离,计算菌落径向生长抑制率(percentage inhibition of radial growth,PIRG)。
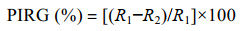
|
式中:R1表示空白对照组病原菌接种点距离沿平板边缘辐射生长的距离;R2表示处理组病原菌接种点距离沿拮抗菌方向辐射生长的距离。
同样,采用上述方法测定T1-3-2对其他靶标菌株的抑菌效果。
1.3.2 挥发性气体的抑菌效果测定采用平板倒扣法[20]测定菌株T1-3-2挥发性气体的抑菌效果。在PDA上活化菌株T1-3-2,28 ℃培养12 h;转接入KMB液体培养基中,28 ℃、200 r/min培养24 h,作为种子液;再将种子液按1:10的比例混入45 ℃左右的PDA培养基中,倒平板,28 ℃培养24 h。将靶标菌株菌饼接入空白PDA平板,与上述培养物平板对扣,作为处理组;将空白PDA平板与接入靶标菌株菌饼的PDA平板对扣,作为对照组。每组3个重复,置于28 ℃恒温培养。每天测量记录菌落直径,计算菌株T1-3-2挥发性气体对菌落径向生长抑制率。
1.3.3 次生代谢产物抑菌效果测定参考甲醇浸提法提取次生代谢产物[21]。在培养皿(Φ=15 cm)中加入50 mL PDA固体培养基,蘸取菌株T1-3-2菌液,在培养皿中画正方形(a=4 cm),培养13 d后去除菌体,冷冻抽干剩余培养物,液氮研磨至粉状;按1:5 (质量体积比)加入甲醇,在超声功率180 W、超声频率40 kHz、温度30 ℃超声清洗1 h,取上清;重复超声清洗3次,充分提取抑菌物质,收集合并后4 000 r/min离心10 min,取上清液45 ℃、200 r/min旋转蒸发,浓缩得粗提物,溶于200 μL的0.25%二甲基亚砜(dimethyl sulfoxide,DMSO)水溶液(体积分数),备用。
用菌丝生长速率和孢子萌发率进行效价测定。将粗提物按1:500、1:300、1:200 (体积比)分别混入45 ℃的PDA中,倒平板,接入指示菌T3-2-1;对照组为0.25%的DMSO水溶液。每隔2 d测量菌落直径,计算菌落生长抑制率。同时,用1:500、1:300、1:200粗提物稀释液分别处理杉木炭疽病菌(T3-2-1)分生孢子,滴至载玻片,放入铺有浸湿2层纱布的培养皿中保湿,每隔8 h计数孢子萌发数量,计算孢子萌发率。
1.4 室内防病与促生试验 1.4.1 拮抗菌株对杉木炭疽病的防效试验取生长势一致的杉木幼苗(90 d),用无菌水冲洗3次。喷雾对照组:在杉木幼苗茎叶上,喷雾1 mL的吐温水(1%)。喷雾处理组I:在杉木幼苗茎叶上,通过喷雾接种1 mL杉木炭疽菌T3-2-1孢子悬浮液(1%吐温水稀释,浓度为107 CFU/mL)。喷雾处理组Ⅱ:在杉木幼苗上,喷雾1 mL的菌株T1-3-2的菌悬液(OD600为0.638,对应的细菌活菌数为8×108 CFU/mL),2 d后,通过喷雾接种1 mL杉木炭疽病菌孢子悬浮液(1%吐温水稀释,浓度为107 CFU/mL)。灌根对照组:用1 mL吐温水(1%)蘸根处理杉木幼苗后,再种回原来的土壤中。灌根处理组I:用20 mL的吐温水(1%)蘸根处理杉木幼苗,种回土壤后,1 mL吐温水(1%)灌根处理,2 d后通过叶面喷雾接种杉木炭疽菌孢子悬浮液(107 CFU/mL)。灌根处理组Ⅱ:用OD600为0.638的T1-3-2的菌液蘸根处理杉木幼苗,种回土壤后,用剩余的菌液灌根(1 mL/株),2 d后在叶面接种浓度为杉木炭疽菌孢子悬浮液(107 CFU/mL),所有处理保湿处理5 d,每个处理20棵杉木幼苗,置于光照培养箱(光照强度80%,相对湿度60%,温度28 ℃ 12 h;光照强度0,相对湿度60%,温度25 ℃ 12 h)培养。每隔1个月调查发病率、病级,并计算防治效果。
分级标准以整株计算,杉木炭疽病发病程度分级标准:0级为整株针叶均无病症;I级为发病针叶与整株针叶比小于1/4;II级为发病针叶与整株针叶比介于1/4−1/2;III级为发病针叶与整株针叶介于1/2−3/4;IV级为3/4以上针叶出现病症[22]。发病率、病情指数和防治效果的计算公式如下:

|
菌株T1-3-2对杉木种芽的促生试验:将菌株T1-3-2接入KMB液体培养基,28 ℃、200 r/min培养48 h,用吐温水(1%)稀释为OD600为0.638 (对应的细菌活菌数是8×108 CFU/mL)和0.296 (对应的细菌活菌数是4×108 CFU/mL)的菌液,分别浸泡20杉木种芽(胚根长度约为2 cm) 24 h,无菌吐温水(1%)处理作为对照组,随后将杉木种芽放回无菌水,置于光照培养箱继续水培,每隔2 d换水,观察记录胚根生长状况,重复3次。
菌株T1-3-2对杉木幼苗促生试验:取生长势一致杉木幼苗(90 d),无菌水冲洗后备用。试验用吐温水浓度均为1%,T1-3-2菌悬液中吐温浓度均为1%。处理Ⅰ:在杉木幼苗茎叶上,喷雾1 mL的吐温水,再用吐温水灌根处理(1 mL/株);处理Ⅱ:在杉木幼苗茎叶上,喷雾1 mL的T1-3-2菌悬液(OD600为0.638,1 mL/株),再用吐温水灌根(1 mL/株);处理Ⅲ:在杉木幼苗茎叶上,喷雾吐温水(1 mL/株),再通过根部灌施1 mL的T1-3-2菌悬液(OD600为0.638,1 mL/株)。3个月后测定杉苗株高、针叶大小以及茎叶鲜重等指标,记录生长发育状况。
1.5 统计分析数据统计分析采用SPSS,方法为单因素方差分析和Duncan多重比较方法。
2 结果与分析 2.1 菌株T1-3-2的鉴定结果 2.1.1 菌株T1-3-2的生物学特性和生理生化特性菌株T1-3-2在PDA上初期呈米白色,3−4 d后逐渐呈红棕色,菌落扁平近圆形,不透明,菌落光滑,圆形,边缘完整,培养基内肉眼可见的黄绿色可扩散性物质;在LB培养基上长期呈米黄色,不透明,菌落光滑,圆形,边缘完整;在KMB培养基上菌落长期呈米白色(图 1A)。T1-3-2菌体无芽孢,在荧光显微镜的蓝色激发光下可见绿色荧光,端生丛鞭毛,革兰氏染色呈阴性(图 1B)。
|
| 图 1 菌落形态和菌体特征 Figure 1 Bacterial morphology and characteristics. A:菌株T1-3-2分别在PDA、LB、KMB上培养7 d的菌落形态;菌株T1-3-2在光学显微镜下(B)、荧光显微镜蓝色激发光(C)及革兰氏染色后光学显微镜下(D)的菌体形态 A: Colony morphology of T1-3-2 strain cultured on PDA, LB, and KMB medium for 7 days. Bacterial morphology of T1-3-2 strain on PDA under the light microscope (B), excited with blue light (C), or by Gram staining (D). |
|
|
该菌株的生长温度范围为4−37 ℃,最适生长温度为30 ℃;生长pH范围为5.0−8.0,在偏酸的条件下均生长良好,最适pH范围为6.0−7.0;能在0.01%−3.00% NaCl浓度的NB培养基中生长,最适NaCl浓度为0.01%−1.00%。其生理生化特性检测结果显示:氧化酶阴性,接触酶阳性,能分解葡萄糖,能利用柠檬酸盐,具有硝酸盐还原能力,能利用木糖,不能分解麦芽糖、甘露醇和乳糖,精氨酸双水解酶和硝酸盐还原试验均为阳性,DNA酶试验阴性。
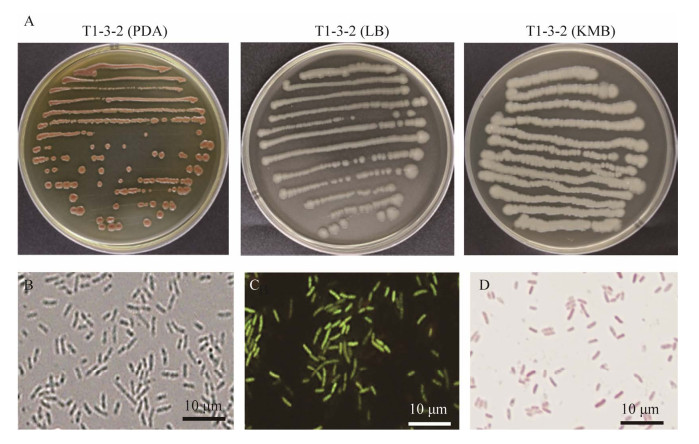
2.1.2 菌株T1-3-2的系统发育学分析将菌株T1-3-2的16S rRNA基因序列(GenBank登录号为OM920535),在NCBI数据库中进行比对,结果显示该菌与模式菌株Pseudomonas eucalypticola NP-1T (=CCTCCM2018494T=JCM 33572T)和Pseudomonas vancouverensis Dha-51T (=DSM 17555T)序列相似度高达99%以上。基于16S rRNA基因序列构建的系统发育结果显示:菌株T1-3-2与模式菌株P. eucalypticola NP-1T菌株聚在一簇,说明该菌同桉生假单胞菌(P. eucalypticola)亲缘性较近(图 2),确定菌株T1-3-2隶属于假单胞菌属。
|
| 图 2 基于16S rRNA基因序列构建的系统发育树 Figure 2 Phylogenetic tree based on 16S rRNA gene sequences. 图中拉丁名后为菌株编号及其相关基因的GenBank序列号;分支上的数字为bootstrap值,代表分类单位被聚在一起的概率;标尺代表碱基替换率 The numbers of corresponding strains and its GenBank accession numbers followed by Latin names; The numbers on the branches are bootstrap values, which indicate the probability that the taxa are clustered together; The scale represents base substitution. |
|
|
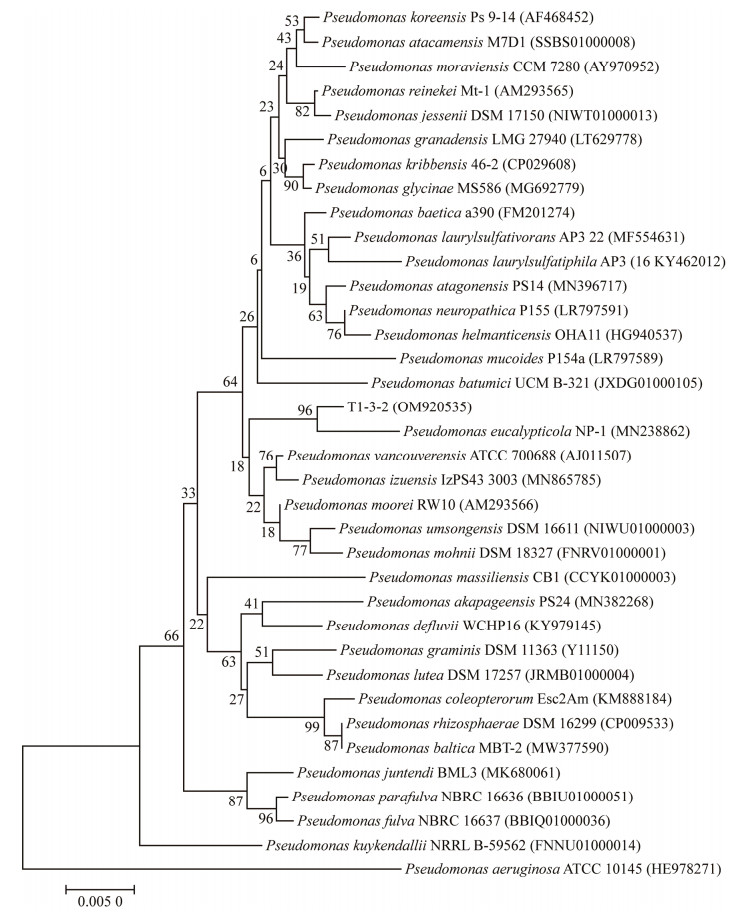
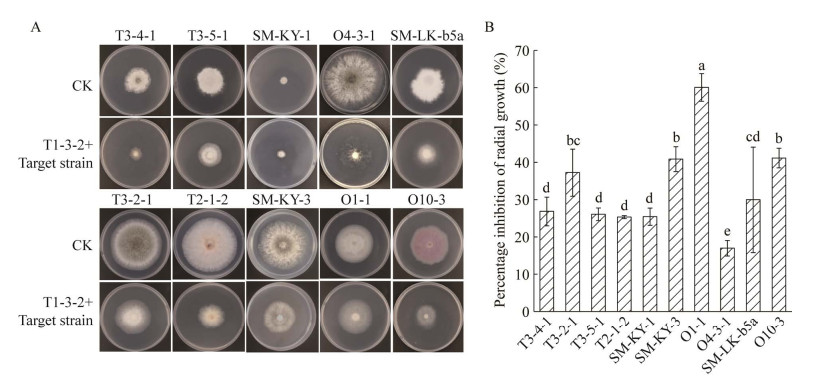
平板对峙结果显示(图 3),菌株T1-3-2菌体对杉木炭疽菌属菌株T3-4-1、T3-2-1和黑孢霉属菌株O1-1、O4-3-1的抑制作用最强,菌落径向生长抑制率可达95%以上;对拟盘多毛孢属菌株T3-5-1、T2-1-2和葡萄座腔菌属菌株SM-KY-3的抑菌效果次之,抑制率介于80%‒90%之间;对镰刀菌属菌株O10-3、SM-LK-b5a和舟皮盘菌属菌株SM-KY-1的抑制效果较其他靶标菌株弱,抑制率介于45%−70%之间。菌株T1-3-2对炭疽菌属、拟盘多毛孢属、舟皮盘菌属、葡萄座腔菌属等10个靶标菌株呈现不同程度的拮抗作用,表现出广谱性抑菌效果。
|
| 图 3 菌株T1-3-2对靶标菌株的拮抗效果 Figure 3 Bio-control effect of T1-3-2 strain on the target strains. A:菌株T1-3-2对靶标菌株的拮抗效果;B:菌株T1-3-2对10株靶标菌株的径向生长抑制率。图中不同的小写字母表示差异显著(P < 0.05) A: Antagonistic effect of strain T1-3-2 on target strains; B: The radial growth inhibition rate of strain T1-3-2 to each target strain. The different lowercase letter means significant difference (P < 0.05). |
|
|
菌株T1-3-2挥发性气体相较菌体的抑菌效果明显较弱,其挥发性气体对靶标菌株菌落生长抑制率介于20%−60%之间(图 4)。其中,菌株T1-3-2挥发性气体仅对黑孢霉属菌株O1-1表现出强抑制效果,抑制率可达60%,对其他靶标菌株抑制效果均低于40%。试验结果表明,菌株T1-3-2在生长过程中可产生抑菌挥发性气体,能有效抑制靶标菌株菌落生长。
|
| 图 4 菌株T1-3-2挥发性气体的抑菌效果 Figure 4 Bio-control effect of volatile of T1-3-2 strain. A:菌株T1-3-2挥发性气体对靶标菌株的抑制效果;B:菌株T1-3-2挥发性气体对靶标菌株生长抑制率。图中不同的小写字母表示差异显著(P < 0.05) A: Antagonistic effect of volatile gas of strain T1-3-2; B: The radial growth inhibition rate of volatile gas of strain T1-3-2. The different lowercase letter means significant difference (P < 0.05). |
|
|
菌株T1-3-2次生代谢产物粗提物的1:500、1:300和1:200倍的稀释液均可有效抑制杉木炭疽菌T3-2-1的生长,浓度越大抑菌效果越强。其中,1:200倍的粗提物稀释液对菌株的径向生长抑制率可达到100%,而且抑菌效果稳定,室温放置30 d仍未见菌丝生长(图 5A、5B);此外,1:200倍的粗提物稀释液对孢子的萌发抑制率可达95%以上,稀释倍数增大抑菌效果减弱(图 5C)。菌株T1-3-2次生代谢产物粗提物可有效抑制杉木炭疽病菌分生孢子的萌发与菌丝生长,对杉木炭疽病菌具有显著的抑制作用。

|
| 图 5 菌株T1-3-2次生代谢产物抑菌效果 Figure 5 Bio-control effect of sencondary metabolites of T1-3-2 strain. A:菌株T1-3-2次生代谢产物粗提物对杉木炭疽病菌T3-2-1的抑制效果;B:菌株T1-3-2次生代谢产物粗提物对杉木炭疽病菌T3-2-1的菌落径向生长抑制率;C:菌株T1-3-2次生代谢产物粗提物对杉木炭疽病菌T3-2-1的孢子萌发抑制率。图中不同小写字母表示差异显著(P < 0.05) A: The inhibitory effect of crude sencondary metabolites of T1-3-2 on Colletotrichum gloeosporioides T3-2-1 strain; B: The radial growth inhibition rate of crude sencondary metabolites of T1-3-2 strain against T3-2-1 strain; C: The inhibition rate of spore germination of the crude sencondary metabolites of strain T1-3-2 on strain T 3-2-1. The different lowercase letter means significant difference (P < 0.05). |
|
|
室内盆栽试验结果表明:灌根处理组Ⅱ的防治效果最好,发病率只有20.00%,防治效果高达85.71%;喷雾处理组Ⅱ的发病率为40.00%,防治效果可达74.20% (表 1)。研究结果发现,通过叶面喷施或灌根施用假单胞菌(Pseudomonas sp.) T1-3-2均可有效防止杉木炭疽病的发生。
| 处理 Treatments |
发病率 Disease incidence (%) |
病情指数 Disease index (%) |
防治效果 Control effect (%) |
| 喷雾对照 Control by spraying | 0.00 | 0.00 | 0.00 |
| 喷雾处理组I Treatment group I by spraying | 57.00 | 36.90 | 0.00 |
| 喷雾处理组Ⅱ Treatment group Ⅱ by spraying | 40.00 | 9.52 | 74.20 |
| 灌根对照组 Control by irrigation | 0.00 | 0.00 | 0.00 |
| 灌根处理组I Treatment group I by irrigation | 65.00 | 43.75 | 0.00 |
| 灌根处理组Ⅱ Treatment group Ⅱ | 20.00 | 6.25 | 85.71 |
| 注:喷雾对照:吐温水喷叶处理;喷雾处理组I:只接种杉木炭疽病菌T3-2-1;喷雾处理组Ⅱ:叶面喷施假单胞菌T1-3-2后,接种炭疽病菌T3-2-1;灌根对照组:吐温水蘸根+灌根处理;灌根处理组I:吐温水蘸根+灌根处理后,叶面喷雾接种炭疽病菌T3-2-1;灌根处理组Ⅱ:T1-3-2的菌液蘸根灌根处理后,叶面喷雾接种炭疽病菌T3-2-1 Note: The control by spraying: Spraying leaf with twine water; Treatment group I by spraying: Inoculation with Colletotrichum gloeosporioides T3-2-1 strain by foliage spray; Treatment group Ⅱ by spraying: Inoculation with C. gloeosporioides T3-2-1strain after foliage spraying with T1-3-2 suspension; The control by irrigation: Dipped and irrigated root with twine water; Treatment group I by irrigation: Inoculated C. gloeosporioides T3-2-1 strain after dipped and irrigated root with twine water; Treatment group Ⅱ by irrigation: Inoculated C. gloeosporioides T3-2-1 strain after dipping and irrigated root with T1-3-2 suspension. |
|||
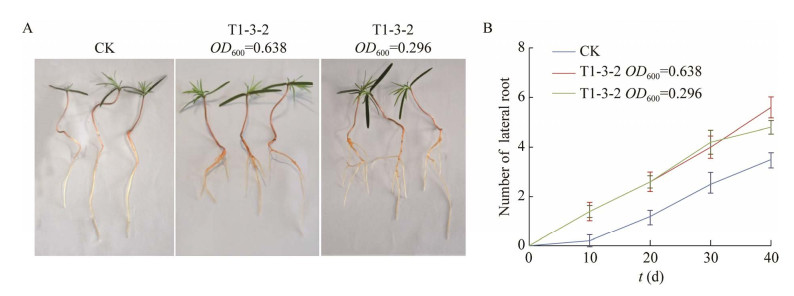
用不同浓度T1-3-2菌液处理的杉木种芽,其侧根数均显著增多(图 6)。通过叶面喷雾和灌根处理的杉木幼苗与对照组相比,其株高分别增加了71.05%和113.16%,茎叶鲜重分别增加了146.97%和180.81%,针叶长度增加了69.57%和91.30%,处理组杉木幼苗的多个生长指标显著高于对照组(P < 0.05) (图 7和表 2)。
|
| 图 6 菌株T1-3-2促进杉木胚根发育 Figure 6 T1-3-2 strain promoted the development of radicle of Cunninghamia lanceolata. A:菌株T1-3-2对杉木侧根的促生效果;B:杉木侧根数量 A: Growth promoting effect of strain T1-3-2 on lateral roots of Cunninghamia lanceolata; B: Number of lateral roots of Cunninghamia lanceolata. Data are mean±standard error (n=20). |
|
|

|
| 图 7 菌株T1-3-2对杉木苗茎叶生长性状的影响 Figure 7 T1-3-2 strain promoted the growth of stems and leaves of Cunninghamia lanceolata. |
|
|
| 处理 Treatment |
株高 Plant height (cm) |
茎叶鲜重 Shoot fresh weight (g) |
茎叶干重 Shoot dry weight (g) |
根长 Root length (cm) |
根鲜重 Root fresh weight (g) |
根干重 Root dry weight (g) |
针叶大小 Needle size (cm) |
| 处理组Ⅰ | 3.9±0.1 | 0.19±0.04 | 0.04±0.02 | 11.5±1.0 | 0.27±0.04 | 0.05±0.01 | 1.7±0.1 |
| 处理组Ⅱ | 6.0±0.5 | 0.43±0.06 | 0.10±0.03 | 19.2±7.9 | 0.44±0.01 | 0.07±0.01 | 3.3±0.3 |
| 处理组Ⅲ | 6.5±1.6 | 0.54±0.02 | 0.12±0.02 | 17.1±8.6 | 0.66±0.20 | 0.08±0.01 | 2.9±0.3 |
| 注:数据为平均值±标准误(n=20) Note: Data are mean±standard error (n=20). |
|||||||
在细菌鉴定中,16S rRNA基因序列因自身普遍性和较为保守的特性,可准确区分不同属[23];但在不同菌株中,该基因存在基因重组现象及自身特性无法实现一些细菌种及种下水平的准确鉴定[24]。本研究基于16S rRNA基因序列进行的系统发育分析判定菌株T1-3-2属于假单胞菌属,该菌株虽与模式菌株P. eucalypticola NP-1亲缘性较近,但菌株NP-1为端生单鞭毛,菌株T1-3-2为端生丛鞭毛,应为不同的种。由于假单胞菌属内物种多样性,系统鉴定一株假单胞菌,需要结合生理生化、化学分类学、多位点序列分析(multilocus sequence analysis,MLSA)和基因组比较多种方法[25-26],菌株T1-3-2具体分类地位仍需进一步研究。
有关杉木生防菌的研究中,20世纪已有学者报道以绿粘帚霉(Gliocladium virens)菌株F051[27]和哈茨木霉(Trichoderma harzianum)菌株F060[28]作为杉木生防真菌。近些年报道的杉木生防菌株主要包括:从湖南攸县杉木根际土壤和健康杉木枝条中筛选得到的地衣芽孢杆菌(Bacillus licheniformis) AM53[29]和枯草芽孢杆菌HY32[30],从福建健康杉木针叶分离的萎缩芽孢杆菌SM-1 (B. atrophaeus)[31],以及海洋细菌枯草芽孢杆菌3728 (B. subtilis)[32],均为芽孢杆菌属。本研究所用菌株T1-3-2隶属于假单胞菌属,丰富了杉木生防菌的种质资源。在假单胞菌的应用中,大多数菌株直接使用菌液或菌剂通过灌根或叶面喷雾的方式防治病害,但细菌的定殖受到温度、湿度、pH等环境因子的影响,定殖效果难以保证[33-34]。通过喷雾或灌根方式,T1-3-2的菌液对炭疽病均有较好的防效,可能由于土壤环境相较叶面稳定的缘故,灌根比叶面喷雾效果更加稳定。因此,解析生防菌抗菌物质合成途径、分子结构并开发稳定的生物农药将从根本上提高防治效果与稳定性。
假单胞菌作为植物根际促生菌中的主要类群,常具有抑菌、促生等多种特性[35]。本研究中的菌株T1-3-2对杉木幼苗炭疽病室内防效可达到74%以上,有显著的防病效果。已有报道的地衣芽孢杆菌AM53菌株,其新鲜发酵液对杉木炭疽病盆栽试验防效可达76.10%以上[29];枯草芽孢杆菌HY32新鲜发酵液对杉木炭疽病防治效果可达55.6%以上[30];萎缩芽孢杆菌SM-1无菌发酵液对杉木赤枯病的离体防效可达95%[31];此外,海洋细菌3782发酵液可抑制杉木根部镰刀菌数量下降20%以上[32]。另外,菌株T1-3-2对杉木不同器官的病原菌抑菌效果存在明显差异,对分离自叶部的菌株抑制率大于枝干或根部的;同时,菌株T1-3-2对不同属菌株抑菌率表现存在差异,抑菌率大小依次为:炭疽菌属/黑孢霉属 > 拟盘多毛孢属 > 镰刀菌属/舟皮盘菌属。此外,菌株T1-3-2的发酵菌液对杉木幼苗表现出极强的促生效果,其针叶长度、茎叶鲜重等生物量极显著高于对照组。已报道的具有促生作用的假单胞菌株YDX26[18]、菌株BP16[16]和菌株JD37[36],它们的促生作用主要归功于这些菌株可抑制致病微生物生长的抗生素、合成促生长激素及提高植物抗病能力,一些菌株同时还具溶磷、固氮、产铁载体等多种植物促生性状[37]。然而在假单胞菌属内,不同菌株的抑菌物质存在一定的差异[38],有关T1-3-2菌株的抑菌促生机理有待进一步研究。
| [1] |
Chen YW, Shi JS. Some fundamental problems in genetic improvement of Chinese fir[J]. Journal of Nanjing Forestry University, 1983, 7(4): 5-19. (in Chinese) 陈岳武, 施季森. 杉木遗传改良中的若干基本问题[J]. 南京林业大学学报(自然科学版), 1983, 7(4): 5-19. |
| [2] |
Zhu KG. Types and identification methods of Chinese fir diseases[J]. Forest Pest and Disease, 1992, 11(2): 42-43. (in Chinese) 朱克恭. 杉木病害的种类及识别方法[J]. 森林病虫通讯, 1992, 11(2): 42-43. |
| [3] |
Zeng SH. Summarizing the studies on fungal diseases of Cunninghamia lanceolata[J]. Journal of Fujian Forestry Science and Technology, 2001, 28(1): 35-39. (in Chinese) 曾思海. 杉木真菌病害研究概述[J]. 福建林业科技, 2001, 28(1): 35-39. DOI:10.3969/j.issn.1002-7351.2001.01.010 |
| [4] |
Xiao YG, Liu NJ. Laws of anthracnose of Chinese fir cones and the loss of its seeds[J]. Journal of Sichuan Forestry Science and Technology, 1993, 14(2): 22-26. (in Chinese) 肖育贵, 刘能敬. 杉木球果炭疽病发病规律及种子损失量的研究[J]. 四川林业科技, 1993, 14(2): 22-26. DOI:10.16779/j.cnki.1003-5508.1993.02.004 |
| [5] |
Tian LY, Lian T, Ke SK, Qin CS, Xu JZ, Zhao DY, Qiu HL, Yang H, Jin XF, Li NL. The fungal diseases of Chinese fir in northern Guangdong[J]. Forestry and Environmental Science, 2019, 35(4): 90-96. (in Chinese) 田龙艳, 练涛, 柯思恺, 秦长生, 徐金柱, 赵丹阳, 邱华龙, 杨华, 靳秀芳, 李南林. 粤北地区杉木真菌性病害种类[J]. 林业与环境科学, 2019, 35(4): 90-96. DOI:10.3969/j.issn.1006-4427.2019.04.015 |
| [6] |
Ma MC. Occurrence and control of anthracnose of Chinese fir[J]. Modernizing Agriculture, 2018(6): 6-7. (in Chinese) 马明臣. 杉木炭疽病的发生与防治[J]. 现代化农业, 2018(6): 6-7. DOI:10.3969/j.issn.1001-0254.2018.06.003 |
| [7] |
Chen DW. Occurrence and control of root rot anthracnose of Chinese fir[J]. Agriculture and Technology, 2018, 38(1): 83-84, 93. (in Chinese) 陈德旺. 杉木根腐性炭疽病的产生及防治[J]. 农业与技术, 2018, 38(1): 83-84, 93. |
| [8] |
Liu QS. Effects of chemical pesticides on the quality of agricultural products and environmental pollution and preventive measures[J]. Anhui Agriculture, 2008(12): 152-153. (in Chinese) 刘勤生. 化学农药的使用对农产品质量和环境污染的影响及防范对策[J]. 现代农业科技, 2008(12): 152-153. DOI:10.3969/j.issn.1007-5739.2008.12.104 |
| [9] |
Butt TM, Wang CS, Shah FA, Hall R. Degeneration of Entomogenous Fungi [A]//Progress in Biological Control[M]. Dordrecht: Springer Netherlands, 2007: 213-226
|
| [10] |
Sahu B, Singh J, Shankar G, Pradhan A. Pseudomonas fluorescens PGPR bacteria as well as biocontrol agent: a review. International Journal of Chemical Studies, 2018
|
| [11] |
Santoyo G, Orozco-Mosqueda MDC, Govindappa M. Mechanisms of biocontrol and plant growth-promoting activity in soil bacterial species of Bacillus and Pseudomonas: a review[J]. Biocontrol Science and Technology, 2012, 22(8): 855-872. DOI:10.1080/09583157.2012.694413 |
| [12] |
Stockwell VO, Stack JP. Using Pseudomonas spp. for integrated biological control[J]. Phytopathology, 2007, 97(2): 244-249. DOI:10.1094/PHYTO-97-2-0244 |
| [13] |
Zhang CM, Xu MJ, Li XW, Xing K, Qin S. Recent research advances and application potential in agriculture of Pseudomonas chlororaphis[J]. Acta Microbiologica Sinica, 2022, 62(2): 391-402. (in Chinese) 张春媚, 徐明洁, 李雪威, 邢珂, 秦盛. 绿针假单胞菌的研究进展及农业应用潜力[J]. 微生物学报, 2022, 62(2): 391-402. |
| [14] |
Chen L. Application of Pseudomonas in control of tobacco diseases and insect pests[J]. Journal of Anhui Agricultural Sciences, 2021, 49(2): 5-7. (in Chinese) 陈磊. 假单胞菌在烟草病虫害防治中的应用[J]. 安徽农业科学, 2021, 49(2): 5-7. DOI:10.3969/j.issn.0517-6611.2021.02.002 |
| [15] |
Dong XZ, Cai MY. Handbook of Identification of Common Bacterial Systems[M]. Beijing: Science Press, 2001. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [16] |
Yang SS, Li GG, Zhang SN, Lu XP, Ding Y, Guo QW, Tian ZM, Feng FY. Isolation and identification of Pseudomonas sp. BP16 and its plant growth-promoting traits and effects[J]. Microbiology China, 2018, 45(10): 2121-2130. (in Chinese) 杨杉杉, 李国光, 张胜男, 路晓培, 丁悦, 国情文, 田再民, 冯福应. 假单胞菌BP16的分离鉴定及其植物促生性状和效应[J]. 微生物学通报, 2018, 45(10): 2121-2130. |
| [17] |
Zhou DQ. Handbook of Microbiology Experiment[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1986. (in Chinese) 周德庆. 微生物学实验手册[M]. 上海: 上海科学技术出版社, 1986. |
| [18] |
Zhu MZ, Sun YY, Zhao XY, Dong RM, Zhu M, Wang YN, Wang LL, Yu CM, Ma LJ. Identification of endophytic Pseudomonas sp. YDX26 in Glycine soja and its growth-promoting and stress-resistant characteristics[J]. Microbiology China, 2021, 48(11): 4100-4110. (in Chinese) 朱梦卓, 孙洋洋, 赵晓妍, 董芮萌, 朱淼, 汪雅楠, 王兰兰, 于翠梅, 马莲菊. 野大豆内生假单胞菌YDX26的鉴定及促生抗逆特性[J]. 微生物学通报, 2021, 48(11): 4100-4110. |
| [19] |
Kumar S, Stecher G, Tamura K. MEGA 7: molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution, 2016, 33(7): 1870-1874. DOI:10.1093/molbev/msw054 |
| [20] |
Mu JJ, Jiao JG, Ge XC, Liu MQ, Li G, Hu F, Wu J, Li HX. Isolation and identification of a plant pathogenic fungi and broad-spectrum antagonistic bacterium Bacillus subtilis M29 and its antibiotic mechanism[J]. Journal of Nanjing Agricultural University, 2017, 40(1): 84-92. (in Chinese) 穆静娟, 焦加国, 葛新成, 刘满强, 李根, 胡锋, 武俊, 李辉信. 植物病原真菌广谱拮抗菌M29的筛选、鉴定及其抑菌机制[J]. 南京农业大学学报, 2017, 40(1): 84-92. |
| [21] |
Tang YJ. Study on anti-fungal pathogenic function from a defective strains HD13 of Pseudomonas diminuta and its bioactive components[D]. Guizhou: Master's Thesis of Guizhou University, 2016 (in Chinese) 唐远江. 缺陷假单胞菌HD13 (Pseudomonas diminuta)抗植物病原真菌及其活性组分的研究[D]. 贵阳: 贵州大学硕士学位论文, 2016 |
| [22] |
Zeng DP, Liu KL, He ZX, He MY, Fu QQ, Nie JG. A study on infection of anthracnose on Cunninghamia lanceolata (lamb.) hook[J]. Scientia Silvae Sinicae, 1981, 17(3): 250-257. (in Chinese) 曾大鹏, 刘开玲, 贺正兴, 何美云, 符绮群, 聂建国. 杉木炭疽病的研究[J]. 林业科学, 1981, 17(3): 250-257. |
| [23] |
Yang X, Chen L, Wang CQ. Advance in application of 16S rRNA gene in bacteriology[J]. Journal of Northwest A & F University: Natural Science Edition, 2008, 36(2): 55-60. (in Chinese) 杨霞, 陈陆, 王川庆. 16S rRNA基因序列分析技术在细菌分类中应用的研究进展[J]. 西北农林科技大学学报(自然科学版), 2008, 36(2): 55-60. |
| [24] |
Peter J, Young W, Haukka KE. Diversity and phylogeny of rhizobia[J]. New Phytologist, 1996, 133(1): 87-94. |
| [25] |
Gomila M, Peña A, Mulet M, Lalucat J, García-Valdés E. Phylogenomics and systematics in Pseudomonas[J]. Frontiers in Microbiology, 2015, 6: 214. |
| [26] |
Bennasar A, Mulet M, Lalucat J, García-Valdés E. PseudomLSA: a database for multigenic sequence analysis of Pseudomonas species[J]. BMC Microbiology, 2010, 10(1): 118. |
| [27] |
Lin SC, Qiu DX, Li YX. The resistant strain F051 controls the damping-off of Chinese fir seedlings[J]. Forest Pest and Disease, 1988, 7(2): 19-20. (in Chinese) 林述成, 邱德勋, 李远翔. 抗生菌株F051防治杉苗猝倒病[J]. 森林病虫通讯, 1988, 7(2): 19-20. |
| [28] |
Li BG, Zuo HQ, Wang ZS, Li YX. The combination of an isolate (Fo60) of Trichoderma harzianum and dexon in controlling the damping-off of Cunninghamia lanceolata[J]. Journal of Sichuan Agricultural University, 1992, 10(2): 301-306. (in Chinese) 李本国, 左华清, 王子顺, 李远翔. Trichoderma harzianum抗生菌株F060同敌克松联合防治杉苗猝倒病[J]. 四川农业大学学报, 1992, 10(2): 301-306. |
| [29] |
Yang J, Zhou GY, Tan YM, Lu ZY. Optimization of fermentation conditions of antagonistic bacterium AM53 against Colletotrichum gloeosporioides[J]. Biotechnology Bulletin, 2014(8): 164-168. (in Chinese) 杨菁, 周国英, 谭益民, 路宗岩. 杉木炭疽病拮抗菌AM53的发酵条件优化[J]. 生物技术通报, 2014(8): 164-168. |
| [30] |
Lu ZY, Zhou GY, Chen YH, Yan FL, Yan RK, Wu N. Screening and application of the antagonistic bacterium HY32 against Colletotrichum gloeosporioides[J]. Biotechnology Bulletin, 2013(3): 181-185. (in Chinese) 路宗岩, 周国英, 陈玉华, 闫法领, 闫瑞坤, 伍南. 杉木炭疽病拮抗菌HY32的筛选及其应用[J]. 生物技术通报, 2013(3): 181-185. |
| [31] |
Liu YJ, Zeng HL, Liang WK, Lu M, Zhu WY, Zhang L, Song Z, Zhang QH. Endophytic bacteria for biocontrol of copper blight on Cunninghamia lanceolate[J]. Fujian Journal of Agricultural Sciences, 2021, 36(5): 556-563. (in Chinese) 刘雨菁, 曾华龙, 梁炜康, 卢梦, 朱伟垚, 张蕾, 宋漳, 张清华. 杉木内生细菌SM-1的鉴定及其对杉木赤枯病的防治效果[J]. 福建农业学报, 2021, 36(5): 556-563. |
| [32] |
Xu HL, Hu JC, Wang SL, Liu L, Wang SJ. Screening of antagonistic bacteria against deleterious fungi Fusarium oxysporum in the rhizosphere soil during Chinese fir continuous planting[J]. Journal of Jilin Agricultural University, 2008, 30(3): 259-262. (in Chinese) 徐洪利, 胡江春, 汪思龙, 刘丽, 王书锦. 杉木连栽根际土壤致害Fusarium oxysporum拮抗菌的筛选[J]. 吉林农业大学学报, 2008, 30(3): 259-262. |
| [33] |
Sun GZ, Yao T, Zhao GQ, Lu H, Ma WB. Research progress and prospects for controlling plant diseases using Pseudomonas fluorescens[J]. Acta Prataculturae Sinica, 2015, 24(4): 174-190. (in Chinese) 孙广正, 姚拓, 赵桂琴, 卢虎, 马文彬. 荧光假单胞菌防治植物病害研究现状与展望[J]. 草业学报, 2015, 24(4): 174-190. |
| [34] |
Ding ZY. Photosynthetic bacterium Rhodopseudomonas palustris GJ-22 can induce systemic resistance against viruses and promote plant growth as a phyllosphere colonizer[D]. Changsha: Master's Thesis of Hunan Agricultural University, 2017 (in Chinese) 丁昭仪. 沼泽红假单胞菌GJ-22的叶际定殖与植物促生、抗病毒诱导作用[D]. 长沙: 湖南农业大学硕士学位论文, 2017 |
| [35] |
Singh HB, Sarma BK, Keswani C. Advances in PGPR Research[M]. Wallingford: CABI, 2017.
|
| [36] |
Zhang L, Chen WB, Jiang QY, Fei ZJ, Xiao M. Genome analysis of plant growth-promoting rhizobacterium Pseudomonas chlororaphis subsp. aurantiaca JD37 and insights from comparasion of genomics with three Pseudomonas strains[J]. Microbiological Research, 2020, 237: 126483. |
| [37] |
Preston GM. Plant perceptions of plant growth-promoting Pseudomonas[J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2004, 359(1446): 907-918. |
| [38] |
Chlebek D, Pinski A, Żur J, Michalska J, Hupert-Kocurek K. Genome mining and evaluation of the biocontrol potential of Pseudomonas fluorescens BRZ63, a new endophyte of oilseed rape (Brassica napus L.) against fungal pathogens[J]. International Journal of Molecular Sciences, 2020, 21(22): 8740. |
 2022, Vol. 49
2022, Vol. 49




