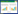扩展功能
文章信息
- 林浩澎, 孙慧明, 罗娉婷, 吴燊如, 蔡朗, 钟舒娴, 岳莎, 陈琼华, 舒琥
- LIN Haopeng, SUN Huiming, LUO Pingting, WU Shenru, CAI Lang, ZHONG Shuxian, YUE Sha, CHEN Qionghua, SHU Hu
- 一株耐碱变形假单胞菌ZY-3的鉴定及其脱氮特性
- Identification of an alkali-tolerant Pseudomonas plecoglossicida ZY-3 and its nitrogen removal characteristics
- 微生物学通报, 2022, 49(10): 4066-4079
- Microbiology China, 2022, 49(10): 4066-4079
- DOI: 10.13344/j.microbiol.china.220217
-
文章历史
- 收稿日期: 2022-03-02
- 接受日期: 2022-06-01
- 网络首发日期: 2022-06-27
我国是水产养殖大国,当前我国的水产养殖为高密度、集约化模式,该模式虽可增加单位面积的养殖效益[1],但同时也会给水质带来一定的影响,如造成水体中的残饵、排泄物富集,水体富营养化导致氨氮、亚硝酸盐等含氮有害物质积累引起水产动物病害等[2-4],不利于我国水产养殖业的长远发展。葛小君等[5]对近20年来广东农业污染负荷进行研究后发现,水产养殖对总氮(total nitrogen,TN)、总磷(total phosphorus,TP)污染的贡献率呈现逐年上升趋势,逐渐成为TN、TP污染负荷的主要来源。如何安全、高效地处理含氮养殖尾水并提高水产养殖的经济和环境效益已成为当前迫切需要解决的问题。
目前,治理含氮养殖尾水的有效脱氮方法主要包括物理处理法、化学处理法、生物处理法和循环水养殖技术等[6],其中生物脱氮作为一种新型水体脱氮技术,具有安全性高[6-7]、效果好[8-9]、成本低[10-11]的优点,被视为最有发展前景的技术之一。近年来,生物脱氮方法中所运用的好氧反硝化细菌(aerobic denitrification bacteria)由于兼备异养硝化与好氧反硝化能力,成为国内外的研究热点。好氧反硝化细菌是一类能够利用好氧反硝化酶的作用在有氧条件下进行反硝化作用的一类细菌,国内外研究者在养殖鱼塘底泥、污水处理厂、土壤等多种环境中均发现和筛选出该类细菌[9, 12-17]。其中,Padhi等[12]报道的一株于住宅区下水道分离得到的阴沟肠杆菌(Enterobacter cloacae)对浓度100 mg/L的铵态氮、硝态氮和亚硝酸盐的24 h去除率分别为81.0%、99.9%和92.8%,Li等[17]报道的于太湖底泥中分离得到的施氏假单胞菌(Pseudomonas stutzeri)对铵态氮、硝态氮和亚硝酸盐的去除率分别为88.30%、86.15%和70.83%,这充分证明了该类菌株具备强大的脱氮能力和广阔的应用前景。然而,在高氨氮浓度、高pH值等极端条件下,该类技术暴露出生物活性低、反应速度慢、处理效果差的技术瓶颈[18],难以在处理高碱性的工业、养殖废水中发挥作用。
为了能够获得一株能在高氮浓度、高pH值条件下脱氮的好氧反硝化细菌,本研究基于一株前期在广东省佛山市一罗非鱼养殖池塘底泥中分离得到的具有异养硝化-好氧反硝化能力的耐碱菌株ZY-3,对其进行菌株种属鉴定、生物安全性试验及脱氮特性研究,以期获得在水产养殖、工业废水与生活污水的处理有应用前景的菌种。
1 材料与方法 1.1 材料 1.1.1 菌株广东省佛山市(N22°50′34″,E113°57′25″)罗非鱼养殖池塘的水样及泥样经过筛选、分离纯化得到菌株ZY-3。使用甘油保藏法将菌株冻存于−80 ℃冷藏室中,使用前富集培养。
1.1.2 主要试剂和仪器及培养基化学试剂均为国产分析纯;Master Mix Taq酶,天津诺禾致源生物信息科技有限公司;通用型DNA小量提取试剂盒,广州迈宝生物科技有限公司;药敏试纸,杭州微生物试剂有限公司。
梯度PCR仪,Bio Tek Instruments公司;全自动多功能酶标仪,Tecan公司;紫外可见分光光度计,上海佑科仪表仪器有限公司;电子天平,上海梅特勒-托利多仪器有限公司;金属壳数显游标卡尺,永康市晶思达贸易有限公司;酸度计,上海赛多利斯科学仪器有限公司。
牛肉膏蛋白胨培养基、营养肉汤培养基和MHA培养基,广东环凯微生物科技有限公司。微量元素溶液、高浓度含氮模拟废水参考文献[15]配制。低浓度含氮模拟废水(1 L):KH2PO4 0.113 g,MgSO4·7H2O 0.200 g,NaHPO4 0.592 g,无水柠檬酸钠1.608 g,微量元素溶液2 mL,NH4Cl 0.100 g (或NaNO3 0.159 g或NaNO2 0.129 g),根据试验要求调整起始pH值为5.0、6.0、7.0、8.0、9.0、10.0与11.0。上述培养基使用高压蒸汽灭菌锅以98 kPa灭菌20 min。
1.2 菌株鉴定 1.2.1 菌株形态观察与生理生化试验将菌株ZY-3使用平板划线法接种于牛肉膏蛋白胨培养基中,于28 ℃培养24 h,观察菌落形态,并挑取菌落制作涂片进行革兰氏染色,使用光学显微镜观察菌体。通过扫描电镜观察菌株的个体形态。按照《Bergeyʼs Manual of Systematic Bacteriology》[19]及东秀珠等编写的《常见细菌系统鉴定手册》[20]中规定的项目及要求进行菌株ZY-3的生理生化鉴定。
1.2.2 16S rRNA基因序列分析使用细菌DNA提取试剂盒提取菌株ZY-3的基因组DNA,采用细菌16S rRNA基因通用引物27F (5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R (5′-TACGGYTACCTTGTTACGACTT-3′)进行保守序列的PCR扩增,使用2.0%琼脂糖凝胶进行电泳,分析扩增结果。所得PCR扩增产物送至生工生物工程(上海)股份有限公司广州合成测序服务网点进行测序。将返回的拼接序列提交至GenBank数据库,获得登录号。使用NCBI BLAST进行相似菌株的同源性比对,使用MEGA-X软件中的neighbor-joining法进行系统发育树的构建,以分析菌株的种属关系。
1.3 菌株的生物安全性试验 1.3.1 安全性试验选取体长在(2±1) cm范围内、健康的斑马鱼(Danio rerio)进行试验,方法参照农业行业标准(NY/T 315.4—2017)[21]和赵洋等[16]。试验开始前,将斑马鱼置于持续曝气的稳定缸内暂养14 d,期间每天定时喂食及定期换水。待斑马鱼稳定后,随机分配至15 L玻璃试验缸中,每缸30尾鱼。菌液经28 ℃、180 r/min培养过夜,3 000 r/min离心5 min后使用无菌PBS溶液洗涤菌体,重复2次后使用无菌水重悬菌体,测定OD600,计算菌液浓度与添加菌量。按照每试验缸菌浓度1×106 CFU/mL添加菌液,空白组仅添加无菌淡水。试验期间每天正常喂食斑马鱼,每3天将缸水体进行更换,后按上述方法重新添加菌液。每天统计斑马鱼的存活数量和记录异常现象,试验持续14 d。每组设置3个重复。使用SPSS Statistics 26软件进行最小显著性差异(least- significant difference,LSD)分析结果。
1.3.2 耐药试验参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)编写的《M100抗微生物药敏感性试验执行标准(第三十版)》[22]中铜绿假单胞菌属细菌的药敏试验项目进行试验抗生素种类的选择并进行结果判读;参照《M02-A10抗菌药物敏感试验纸片法执行标准(Vol. 32 No. 1)》[23]与《动物及其制品中细菌耐药性的测定—纸片扩散法》(SN/T 1944—2016)[24]进行菌株的抗生素纸片药敏试验。取营养肉汤中培养18 h的菌液,稀释至1×108 CFU/mL后使用无菌棉签均匀涂布于MHA培养基表面。平板放置15 min后,使用无菌镊子夹取药敏纸片,贴于平板表面。将平板置于37 ℃恒温培养箱中培养18 h,使用游标卡尺测量抑菌圈的大小。设置贴不含抗生素的无菌空白纸片的空白对照组,每组设置2个平行。
1.4 菌株脱氮性能测定 1.4.1 菌株在3种高浓度含氮模拟废水中的生长情况与脱氮性能测定将菌株接种于营养肉汤培养基中,于28 ℃、180 r/min恒温培养箱中培养16 h进行菌株活化,以1%接种量分别接种于含有NH4Cl、NaNO3、NaNO2的高浓度含氮模拟废水中,进行定时取样。试验时间为48 h,前12 h以4 h为间隔进行取样,后36 h以12 h间隔进行取样,测定发酵液中的生物量(以OD600表征),4 000 r/min离心5 min后取上清液测定NH4Cl、NaNO3、NaNO2的含量。设置不添加菌液的空白对照组,每组试验设置2个平行。
1.4.2 菌株于不同pH条件下的生长情况与脱氮性能测定使用低浓度含氮模拟废水进行菌株ZY-3在不同pH条件下的生长情况及脱氮性能的测定。配制低浓度含氮模拟废水时,使用浓度为1 mol/L的HCl和NaOH调整其pH值至5.0、6.0、7.0、8.0、9.0、10.0、11.0。试验时间为48 h,以8 h间隔进行取样,测定各时间段发酵液中的生物量,4 000 r/min离心5 min后取上清液分别测定NH4Cl、NaNO3、NaNO2的含量,并使用pH计测定各时间段中上清液的pH值。试验前菌株的活化方法、接种方法与氮含量测定方法同1.4.1。设置不添加菌液的空白对照组,每组试验设置2个平行。
1.4.3 氮素检测方法及脱氮率的计算采用纳氏试剂比色法(HJ 535—2009)[25]测定水体中的氨氮(NH4+-N)含量;采用紫外分光光度法(GBHJ/T 346—2007)[26]测定水体中硝态氮(NO3−-N)含量;采用N-(1-萘基)-乙二胺分光光度法(GB 7493—87)[27]测定水体中的亚硝态氮(NO2−-N)含量。
氮去除率按照以下公式进行计算:
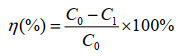
|
其中,C0表示0 h时水体中的相应氮浓度(mg/L),C1表示某时刻水体中的相应氮浓度(mg/L)。使用Origin 2021软件对试验结果进行统计分析。
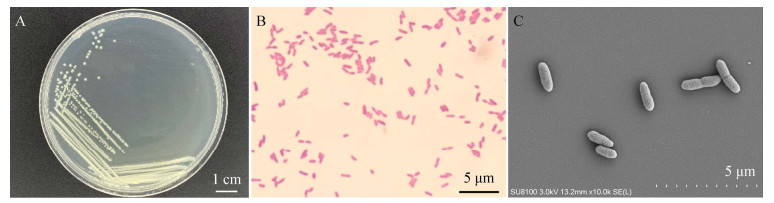
2 结果与分析 2.1 菌株鉴定结果 2.1.1 菌株形态学鉴定结果如图 1A所示,菌株ZY-3在营养琼脂培养基上培养24 h后菌落呈现淡黄色、半透明,边缘完整隆起呈现圆形,菌落表面湿润光滑,呈分散排列。如图 1B所示,菌株ZY-3革兰氏染色淡红色,呈阴性,光学显微镜视野中菌体呈长杆状,两端钝圆,分散排列。如图 1C所示,在扫描电镜下,菌体呈现直杆状,菌体两端圆滑,呈现分散排列;菌体长为(1.44±0.28) μm,菌体宽为(0.50±0.02) μm,无鞭毛结构。
|
| 图 1 菌株ZY-3的菌落形态(A)、革兰氏染色结果(B)及扫描电镜形态(C) Figure 1 Colony morphology(A), Gram stain (B) and scanning electron microscopic morphology (C) of strain ZY-3. |
|
|
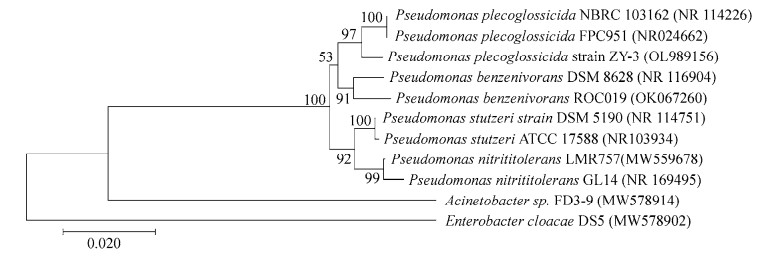
利用细菌基因组DNA作为模板,使用16S rRNA基因通用引物对27F/1492R扩增目的条带。PCR扩增产物经过2%琼脂糖凝胶电泳检测后回收并送测序,得到一段长度为1 424 bp的序列,提交至GenBank (登录号为OL989156)进行同源性分析,发现菌株ZY-3与假单胞菌属变形假单胞菌(P. plecoglossicida) NBRC 103162T (登录号为NR114226)和P. plecoglossicida FPC951 (登录号为NR024662)的相似性为99.01%。利用MEGA-X软件,使用neighbor-joining法,选择高相似性的模式菌株作为外群,构建系统发育树(图 2),结果发现菌株ZY-3与上述两菌株共处同一分支,可初步推测菌株ZY-3为假单胞菌属细菌(Pseudomonas sp.)。
|
| 图 2 ZY-3基于16S rRNA基因序列构建的系统发育树 Figure 2 Phylogenetic tree of strain ZY-3 based on 16S rRNA gene sequence. 括号中的序号为序列GenBank登录号;分支点数值代表进化树bootstrap值;分支长度代表进化距离,标尺为0.02 The GenBank accession number of aligned sequences are shown in the parenthesis; Values at branch nodes represent bootstrap value; The length of branch represents the evolutionary distance and the coefficient is 0.02. |
|
|
根据《Bergeyʼs Manual of Systematic Bacteriology Second Edition》[19]及《常见细菌系统鉴定手册》[20]进行菌株ZY-3的生理生化鉴定,结果如表 1所示。与变形假单胞菌模式菌株P. plecoglossicida NBRC 103162T进行比对,综合形态学、生理生化特征、16S rRNA基因序列和系统发育树分析,可以初步确定菌株ZY-3为变形假单胞菌P. plecoglossicida。
| 生理生化反应 Physiological and biochemical reaction |
反应特征 Reaction characteristics |
生理生化反应 Physiological and biochemical reaction |
反应特征 Reaction characteristics |
| 革兰氏反应Gram reaction | – | 酒石酸盐Potassium tartrate | – |
| 氧化酶反应Oxidase reaction | + | D-(+)-葡萄糖D-(+)-glucose | + |
| 明胶液化Gelatin liquefaction | – | 肌酸Creatine | + |
| 接触酶试验Catalase test | + | 甘油Glycerol | + |
| 淀粉水解Starch hydrolysis | – | D-(+)-麦芽糖D-(+)-maltose monohydrate | + |
| 吲哚生成Indole production | – | 乳糖Lactose | – |
| 甲基红Methyl red test | – | D-半乳糖D-galactose | – |
| V-P试验Vogs-Proskauer test | – | 甘露醇Mannitol | – |
| 脂酶Lipase (Tween-80 hydrolysis) | – | 甘氨酸Glycine | + |
| 4 ℃生长Growth at 4 ℃ | – | L-精氨酸L-arginine | – |
| 41 ℃生长Growth at 41 ℃ | + | D-果糖D-fructose | + |
| 反硝化Denitrification | – | 柠檬酸盐Citrate | + |
| 硝酸盐还原Nitrate reduction | + | L-(+)-阿拉伯糖L-arabinose | – |
| 注:+:阳性;–:阴性 Note: +: Positive; –: Negative. |
|||
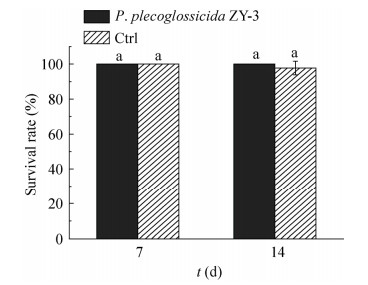
菌株ZY-3的安全性试验结果如图 3所示。在14 d的试验中,与对照组相比,水体菌液浓度为1×106的3个试验组的斑马鱼均未出现死亡,未出现行为异常情况,结果无显著性差异(P < 0.05),这初步表明ZY-3对水生生物的安全性较高。
|
| 图 3 菌株ZY-3的生物安全性试验结果 Figure 3 Biosafety assay of strain ZY-3. |
|
|
菌株ZY-3的耐药性试验结果如表 2所示。从表 2可以看出,菌株ZY-3对于CLSI-M100中对铜绿假单胞菌要求的A组抗微生物药物如庆大霉素、头孢他啶等药物均呈敏感。ZY-3在对其他临床常用抗生素如氨苄青霉素、氯霉素等则呈现耐药性,这与铜绿假单胞菌的天然抗菌谱一致[22],而且符合之前关于变形假单胞菌抗药性的报道[28],因此可推断ZY-3未出现明显耐药性状,属于未获得耐药机制的野生型(wild type)菌株。
| 抗菌药物名称 Antimicrobial agents |
抑菌圈直径 Inhibition diameter (mm) |
敏感程度 Sensitivity |
| 阿莫西林Amoxicillin | 0 | R |
| 氯霉素Chloramphenicol | 7.31±0.52 | R |
| 红霉素Erythromycin | 0 | R |
| 氨苄青霉素Ampicillin | 0 | R |
| 盐酸四环素Tetracycline hydrochloride | 23.10±0.10 | S |
| 头孢哌酮Cefperazone | 18.33±2.15 | I |
| 硫酸庆大霉素Gentamycin sulfate | 23.30±0.26 | S |
| 妥布霉素Tobramycin | 22.50±0.82 | S |
| 头孢他啶Ceftazidime | 23.12±0.71 | S |
| 哌拉西林-他唑巴坦Piperacillin and tazobactam | 27.00±2.34 | S |
| 注:S:敏感;I:中介;R:耐药 Note: S: Susceptible; I: Intermediate; R: Resistant. |
||
综上所述,ZY-3对水生生物无明显毒害作用,而且对多种临床常用抗生素敏感,具有多种生物防治手段,因此该菌株具有较高的安全性,具有较大的应用潜力。
2.3 菌株脱氮性能测定结果 2.3.1 菌株在3种高浓度含氮模拟废水中的生长情况与脱氮性能菌株ZY-3在3种高浓度单一氮源下(NH4+-N、NO3−-N、NO2−-N)的生长状况和脱氮特性如图 4所示。在以NH4+-N作为唯一氮源时,菌株在经过4 h的迟缓期后进入对数生长阶段,在24 h时生物量达到最大值,此时水体中NH4+-N浓度为30.10 mg/L,去除率为94.87%。在随后时间段中菌株生物量开始缓慢下降,氨氮去除率小幅波动,在48 h的终去除率为97.20%。试验期间,有少量硝态氮(NO3−-N)与亚硝态氮(NO2−-N)的生成,其含量在1−2 mg/L之间小幅变化。

|
| 图 4 菌株ZY-3在高浓度NH4+-N (A)、NO3−-N (B)、NO2−-N (C)模拟废水中的生长与脱氮特性 Figure 4 Growth and nitrogen removal characteristics of strain ZY-3 in three kinds of high concentration simulated wastewater. 初始无机氮浓度(C0, mg/L):氨氮:586.88;硝态氮:958.38;亚硝态氮:737.70 A: NH4+-N; B: NO3−-N; C: NO2−-N. Initial concentration (C0, mg/L): Ammonia: 586.88; Nitrate: 958.38; Nitrite: 737.70. |
|
|
在以NO3−-N作为唯一氮源时,菌株在经过4 h的迟缓期后进入对数生长阶段,在12 h时生物量达到最大值,此时水体中NO3−-N浓度为177.05 mg/L,去除率达到最大值,为81.44%。在12−32 h菌株生物量缓慢下降,在48 h时出现小幅上升。12 h后的NO3−-N去除率小幅波动,在48 h的终去除率为74.86%。试验期间,发现有反硝化产物NO2−-N的产生,其在0−8 h期间的含量迅速上升,最高达到28.04 mg/L;在12 h时其含量出现下降,并在之后保持稳定。
在以NO2−-N作为唯一氮源时,菌株在经过4 h的迟缓期后进入对数生长阶段,在24 h时生物量达到最大值,此时水体中NO2−-N浓度为8.92 mg/L,去除率为98.79%。在32−48 h时间段生物量出现大幅下降,但NO2−-N浓度保持稳定,在48 h的终去除率为99.87%。
综上所述,菌株ZY-3在3种高浓度单一氮源下(NH4+-N、NO3−-N和NO2−-N)的生长状况和脱氮特性基本相同,迟缓期为4 h,8 h后进入快速生长的对数期。在高浓度氮源浓度下菌株生物量与氮去除率趋势大致相同,菌株在3种高浓度含氮模拟废水中,12 h的氮去除率都能达到80%以上,这表明菌株生长速度快,具有快速脱氮能力。进入稳定期后,各试验组氮去除率稳定,未出现大幅波动。
2.3.2 菌株于不同初始pH条件下的生长情况与脱氮特性菌株ZY-3在不同初始pH梯度下的生长状况和脱氮特性如图 5所示。整体来看,菌株ZY-3在试验开始后的16 h内快速生长,生物量快速上升,并在16−24 h时达到生物量的最大值。最高氮去除率与生物量最大值并不同步出现,在pH 6.0−9.0的试验中,8 h时大多数试验组中的氮去除率已趋近100%,但生物量却未达到最大值,存在滞后现象,该现象在pH 10的试验组中更加明显。在菌株进入稳定期后,各试验组的氮去除率未出现明显波动。相较于高浓度氮试验,本试验各试验组中菌株生物量明显减小,各组最高生物量在OD600为0.8−1.0,远低于高浓度试验中各组最高生物量,这可能是由于培养基中低浓度氮源制约了菌株的生长。

|
| 图 5 菌株ZY-3在不同初始pH条件下的生长特性及培养基pH值随时间变化情况 Figure 5 Growth characteristics of strain ZY-3 under different initial pH value conditions and pH change of medium with time. |
|
|
菌株ZY-3在不同初始pH、不同单一氮源模拟废水中的脱氮特性存在差异:在弱酸性条件下(pH 6.0),以NO2−-N为唯一氮源的试验组经历了24 h的迟缓期,在24−32 h时间段才出现生物量的上升,相较于同pH的其他试验组其迟缓期延长,这可能表明亚硝酸盐还原相关酶对于酸性pH较敏感。在中性与弱碱条件下(pH 7.0−9.0),各试验组的氮去除率、生物量变化趋势大致相同,各组氮去除率在8 h均达到90%以上,之后保持稳定。在碱性条件下(pH 10.0),菌株生长受到明显抑制,迟缓期延长至8 h,在16 h进入对数生长期,氮去除率在16−24 h达到最高,之后保持稳定。
菌株ZY-3在不同初始pH、不同单一氮源模拟废水中生长,发酵液pH变化具有以下规律:在酸性与中性条件下,发酵液中pH值会随着氮的去除整体呈现先快速上升后平稳上升。这可能是由于细菌在执行反硝化进程、吸收同化无机氮源的过程中会释放大量OH−,进而使培养基的pH值上升[29-30]。在碱性条件下,可观察到在迟缓期时各培养基中的pH值下降,后进入对数生长期后随着氮去除率的上升而缓慢上升。这可能是由于处于迟缓期时菌株缓慢生长产生CO2等代谢产物,使培养液中的pH值降低,从而使环境pH值降低至菌株能够正常生长、发挥生理功能的pH范围内。
以上结果表明,菌株ZY-3在初始pH 6.0−10.0的各培养基中能够正常生长并发挥脱氮作用,其pH的耐受范围约为pH 6.0−10.0。
3 讨论与结论本文基于一株前期在广东省佛山市一罗非鱼养殖池塘底泥中分离得到的具有异养硝化-好氧反硝化能力的菌株ZY-3,对该菌株进一步研究。通过对其进行形态学观察、生理生化鉴定和16S rRNA基因序列分析,综合考虑各种鉴定方法结果后,初步鉴定菌株ZY-3为假单胞菌属变形假单胞菌(P. plecoglossicida)。
假单胞菌是水产养殖中常见的菌属之一,广泛存在于世界各地,近年来有众多关于其异养硝化-好氧反硝化能力的报道[13, 15, 31-34]。假单胞菌属细菌尽管对环境具有强大的适应性和好氧反硝化性能,但近年来有大量关于其对水产养殖动物具有致病性的报道,能够引起水产动物内脏白点病[35]、皮肤溃烂[36]、眼球异常增生[37],在高密度、集约化的养殖模式中会导致水产动物大批量死亡,这对水产动物及人类健康构成巨大威胁。因此,对投放用于养殖水体净化的菌株,进行生物安全性评估是十分重要的。生物安全性评估包括微生物对水生生物毒性试验、质粒编码的耐药基因检测及菌株对抗生素敏感性试验等[38]。本试验结合药敏试验与生物安全性试验对菌株ZY-3进行生物安全性评估。菌株ZY-3对多种临床常用抗生素包括妥布霉素、头孢他啶等呈现敏感,经CLSI-M100对比确定其属于无耐药性的野生型菌株;在斑马鱼的生物安全性试验中,斑马鱼14 d存活率为100%且无明显病变或异常,初步判定菌株ZY-3具有较高的生物安全性。若需要进一步确定菌株的安全性,应对菌株进行耐药基因的检测及耐药基因转移试验[28, 38],以排除菌株本身天然抗药性转移至环境其他菌体,引起抗药基因的水平传播。
好氧反硝化细菌的脱氮性能受到溶氧量(dissolved oxygen,DO)、碳源、氮源、pH等多种环境因素影响[16, 39-41]。其中pH值对于菌株反硝化进程的影响显著,其影响菌株进行反硝化的机理是溶液中的离子浓度会显著影响反硝化相关还原酶的活力[30, 42]与表达水平[43],碱性条件还会导致培养基中碳酸钙等离子的沉淀,改变培养基的营养成分,影响菌株生长[44],因此,大多数嗜中性反硝化细菌反硝化菌脱氮范围为pH 7.5−9.5[13, 30, 45-46]。Chen等[47]报道了一株具有广泛pH适应范围的气单胞菌属(Aeromonas) sp. HN-02,其在pH 2.3的强酸性环境和pH 11.0的强碱性环境中依然能够发挥一定的降氨氮作用,48 h NH4+-N去除率分别约为40%和25%,但该菌株在氮素初始浓度为150 mg/L、pH 7.0、30 ℃条件下24 h对NH4+-N、NO3−-N和NO2−-N的去除率分别为80.77%、56.80%和33.32%,存在生长周期较长的问题。Chen等[48]报道了一株能适应强碱的紫色杆菌属(Janthinobacterium svalbardensis) F19,该菌株能在pH 11.0的含40 mg/L NH4+-N的模拟废水中生长,36 h时的NH4+-N去除率为90%,但其在酸性条件(pH 6.0)下36 h时的NH4+-N去除率仅有60%,并且在所有pH试验组(pH 5.0−11.0)中24 h时的NH4+-N去除率均低于60%,同样存在生长周期长的问题。然而本试验筛选出的菌株ZY-3在环境pH 6.0−10.0之间,对于3种氮素(NH4Cl 100 mg/L、NaNO3 159 mg/L、NaNO2 129 mg/L)的24 h氮去除率总体达到90%以上,表明该菌株具有广泛的pH适应性,具备快速脱氮能力。
同时,本试验在进行菌株ZY-3于不同初始pH条件下的脱氮性能试验时,还于不同时间段进行培养液pH值的测定,结合生长曲线和氮浓度变化情况探究菌株耐碱原理。结果表明菌株ZY-3在进行反硝化过程中会使培养液的pH值升高,这与先前的研究报道结果[29]一致。异养硝化-好氧反硝化菌株在利用有机碳源进行异养增殖时会产生酸性代谢产物如CO2,CO2具有酸化作用,可以补偿OH–的碱化[30]。本试验观察到初始pH为碱性的模拟废水,其pH值随时间呈现先下降后上升的现象。这可能说明异养硝化-好氧反硝化细菌的脱氮进程中,菌株生长对数期为异养增殖占主导的时期,该时期菌株开始大量增殖,会导致培养基的pH值下降。由于高pH的抑制条件被消除,反硝化进程增强,不断释放OH−,培养基出现pH值上升的现象。这种培养基先酸化至适合菌株生长、正常发挥生理功能的pH范围内,可能是异养硝化-好氧反硝化细菌的耐碱机理之一。
本试验在进行菌株脱氮能力测试时,还发现菌株生物量增加,相较于氮去除率的上升存在滞后的现象。异养硝化-好氧反硝化细菌可以利用氨氮、亚硝态氮或硝态氮为氮源,通过同化作用转化为细胞有机氮[49],其中关键的代谢途径为异化还原为氨的途径(dissimilatory nitrate reduction to ammonia,DNRA)。在该途径中,菌株通过硝酸还原酶Nap与同化亚硝酸盐还原酶NirBD,将硝态氮逐步还原为氨,氨通过同化作用转化为生物氮,即:(NO3−-N)→ NO2−-N→NH4+-N→生物氮[50]。由该过程可知,由无机氮素的吸收、还原,到生物氮的形成,中间存在多步反应。中间若存在限速酶,便可能会导致氮含量首先下降生物量后上升现象的发生。试验中观察到的相应现象,可能印证了本菌株转化无机氮素为有机氮的过程是由DNRA的多步反应完成的。
本文综合运用形态学、生理生化鉴定方法和16S rRNA基因序列分析方法,对一株于罗非鱼养殖池塘底泥中分离得到的异养硝化-好氧反硝化菌株ZY-3进行菌株的种属鉴定,初步确定菌株ZY-3为变形假单胞菌并命名为P. plecoglossicida ZY-3。生物安全性试验与药敏试验表明,菌株ZY-3无明显耐药性且其对水生生物具有较高的生物安全性。在28 ℃、180 r/min、pH 7.4、C/N比为10的各高浓度含氮模拟废水中,其对NH4+-N、NO3—N和NO2−-N的12 h去除率分别可以达到94.87%、81.45%和98.02%。菌株ZY-3具有脱氮迅速、去除率高、pH耐受范围广的特点,其pH耐受范围为pH 6.0−10.0。后续将针对该菌在实际废水处理中的应用展开研究,探究其在实际养殖、工业含氮废水中的脱氮性能及应用前景。
| [1] |
Fang JG, Li ZJ, Jiang ZJ, Wang QD. Development strategy for ecological aquaculture and new mode of aquacultural farming[J]. Engineering Sciences, 2016, 18(3): 22-28. (in Chinese) 方建光, 李钟杰, 蒋增杰, 王齐东. 水产生态养殖与新养殖模式发展战略研究[J]. 中国工程科学, 2016, 18(3): 22-28. |
| [2] |
Guo PP. Effects of intensive freshwater aquaculture on water environment[J]. Nongmin Zhifuzhiyou Yuekan, 2017(14): 279. (in Chinese) 郭萍萍. 集约化淡水养殖对水环境的影响[J]. 农民致富之友, 2017(14): 279. |
| [3] |
Wang CH. Application of photosynthetic bacteria in aquaculture[J]. Fishery Guide to Be Rich, 2018(16): 52-53. (in Chinese) 王春华. 光合细菌在水产养殖中的应用[J]. 渔业致富指南, 2018(16): 52-53. |
| [4] |
Chen Y, Zhu X, Yang Y, Han D, Jin J, Xie S. Effect of dietary chitosan on growth performance, haematology, immune response, intestine morphology, intestine microbiota and disease resistance in gibel carp (Carassius auratus gibelio)[J]. Aquaculture Nutrition, 2014, 20(5): 532-546. DOI:10.1111/anu.12106 |
| [5] |
Ge XJ, Huang B, Yuan ZJ, Wang DD, Wang QQ, Chen JC, Xie ZY. Temporal and spatial variation characteristics and source analysis of agricultural non-point source pollution load in Guangdong during the past 20 years[J]. Environmental Science, 2022, 43(6): 3118-3127. (in Chinese) 葛小君, 黄斌, 袁再健, 王栋栋, 王泉泉, 陈佳村, 谢真越. 近20年来广东省农业面源污染负荷时空变化与来源分析[J]. 环境科学, 2022, 43(6): 3118-3127. |
| [6] |
Xu YX. Research progress on biological technology for aquaculture wastewater treatment[J]. Journal of Zhejiang Agricultural Sciences, 2019, 60(8): 1306-1310. (in Chinese) 许育新. 水产养殖废水生物处理技术研究进展[J]. 浙江农业科学, 2019, 60(8): 1306-1310. |
| [7] |
Chen Q, Zhang XX, Zhao H, Guan JF. Advance in research and application of microbial ecological agent in aquaculture[J]. Chinese Journal of Applied and Environmental Biology, 2012, 18(3): 524-530. (in Chinese) 陈谦, 张新雄, 赵海, 官家发. 用于水产养殖的微生态制剂的研究和应用进展[J]. 应用与环境生物学报, 2012, 18(3): 524-530. |
| [8] |
Xie WJ, Jiang HB. Application and research progress of microecological preparations in aquaculture[J]. Anhui Agricultural Science Bulletin, 2021, 27(22): 103-108. (in Chinese) 解维俊, 姜海滨. 微生态制剂在水产养殖中的应用研究进展[J]. 安徽农学通报, 2021, 27(22): 103-108. |
| [9] |
Padhi SK, Tripathy S, Sen R, Mahapatra AS, Mohanty S, Maiti NK. Characterisation of heterotrophic nitrifying and aerobic denitrifying Klebsiella pneumoniae CF-S9 strain for bioremediation of wastewater[J]. International Biodeterioration & Biodegradation, 2013, 78: 67-73. |
| [10] |
Si YY, Zhang ZT, Chen XH, Yu XY. Visual analysis of knowledge map of research on biological nitrogen removal in aquaculture[J]. Journal of Anhui Agricultural Sciences, 2021, 49(13): 236-240. (in Chinese) 司圆圆, 张卓婷, 陈兴汉, 余祥勇. 水产养殖生物脱氮领域研究的知识图谱可视化分析[J]. 安徽农业科学, 2021, 49(13): 236-240. |
| [11] |
Feng HL, Zhao MY, Ding SZ. Optimal control of biological nitrogen removal in A2/O process of WWTP[J]. China Water & Wastewater, 2021, 37(6): 102-106. (in Chinese) 冯红利, 赵梦月, 丁舒喆. 城市污水厂A2/O工艺生物脱氮过程优化控制[J]. 中国给水排水, 2021, 37(6): 102-106. |
| [12] |
Padhi SK, Tripathy S, Mohanty S, Maiti NK. Aerobic and heterotrophic nitrogen removal by Enterobacter cloacae CF-S27 with efficient utilization of hydroxylamine[J]. Bioresource Technology, 2017, 232: 285-296. |
| [13] |
Shu H, Sun HM, Huang W, Zhao Y, Ma YH, Chen W, Sun YP, Chen XY, Zhong P, Yang HR. Nitrogen removal characteristics and potential application of the heterotrophic nitrifying-aerobic denitrifying bacteria Pseudomonas mendocina S16 and Enterobacter cloacae DS'5 isolated from aquaculture wastewater ponds[J]. Bioresource Technology, 2022, 345: 126541. |
| [14] |
Cai X, Li KL, He TX, Wang YX, Zhang X, Xie EY, Ding NN, Li ZL. Characteristics of heterotrophic nitrifying and aerobic denitrifying Arthrobacter nicotianae D51 strain in the presence of copper[J]. Water, 2019, 11(3): 434. |
| [15] |
Li WF, Du LB, Liu SY, Weng MS, Shu H, Chen QH. Isolation and identification of an efficient aerobic denitrifying bacterium[J]. Biotechnology Bulletin, 2019, 35(9): 202-209. (in Chinese) 李文甫, 杜柳冰, 刘思莹, 翁美遂, 舒琥, 陈琼华. 一株高效好氧反硝化细菌的分离鉴定及脱氮性能研究[J]. 生物技术通报, 2019, 35(9): 202-209. |
| [16] |
Zhao Y, Sun HM, Lin HP, Luo PT, Zhu YT, Chen QH, Shu H. Biosafety and nitrogen removal performance of a safe and efficient aerobic denitrifying Pseudomonas stutzeri DZ11[J]. Biotechnology Bulletin, 2022. (in Chinese) 赵洋, 孙慧明, 林浩澎, 罗娉婷, 朱雅婷, 陈琼华, 舒琥. 一株安全高效的好氧反硝化菌Pseudomonas stutzeri DZ11的生物安全性及脱氮性能研究[J]. 生物技术通报, 2022. DOI:10.13560/j.cnki.biotech.bull.1985.2021-1084 |
| [17] |
Li CE, Yang JS, Wang X, Wang ET, Li BZ, He RX, Yuan HL. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a phosphate accumulating bacterium Pseudomonas stutzeri YG-24[J]. Bioresource Technology, 2015, 182: 18-25. |
| [18] |
Yuan JH, Zhao TT, Peng XY. Advances in heterotrophic nitrification-aerobic denitrifying bacteria for nitrogen removal under extreme conditions[J]. Chinese Journal of Biotechnology, 2019, 35(6): 942-955. (in Chinese) 袁建华, 赵天涛, 彭绪亚. 极端条件下异养硝化-好氧反硝化菌脱氮的研究进展[J]. 生物工程学报, 2019, 35(6): 942-955. |
| [19] |
Garrity G, Brenner DJ, Krieg NR, Staley JR. Bergeyʼs Manual of Systematic Bacteriology Volume 2: The Proteobacteria, Part B: The Gammaproteobacteria[M]. 2nd ed. New York: Springer, 2013.
|
| [20] |
Dong XZ, Cai MY. Manual for Systematic Identification of Common Bacteria[M]. Beijing: Science Press, 2001. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [21] |
Ministry of Agriculture and Rural Affairs of the Peopleʼs Republic of China. Risk Assessment Test Guidelines for Microbial Pesticide, Part 4: Fish Toxicity Test NY/T 3152.4-2017[S]. Beijing: China Agriculture Press, 2017 (in Chinese) 中华人民共和国农业部. 微生物农药: 环境风险评价准则第4部分: 鱼类毒性实验NY/T 3152.4-2017[S]. 北京: 中国农业出版社, 2017 |
| [22] |
CLSI. Performance Standards for Antimicrobial Susceptibility Testing[M]. 30th ed. Wayne, PA: Clinical and Laboratory Standards Institute, 2020: 42-45 (in Chinese) CLSI. M100抗微生物药敏感性试验执行标准[M]. 第30版. Wayne P: 美国临床和实验室标准协会, 2020: 42-45 |
| [23] |
CLSI. Performance Standards for Antimicrobial Disk Susceptibility Tests[M]. 11th ed. Wayne, PA: Clinical and Laboratory Standards Institute, 2012: 25-29.
|
| [24] |
State Administration for Marker Regulation. Detection of Antimicrobial Resistance of the Bacteria in Animal and Animal Products: Disk Diffusion Testing. SN/T 1944-2016[S]. Beijing: Standards Press of China, 2016 (in Chinese) 中华人民共和国国家质量监督检验检疫总局. 动物及其制品中细菌耐药性的测定-纸片扩散法SN/T 1944-2016[S]. 北京: 中国标准出版社, 2016 |
| [25] |
Ministry of Ecology and Environment of the Peopleʼs Republic of China. Water Quality — Determination of Ammonia Nitrogen — Nessler's Reagent Spectrophotometry. HJ 535-2009[S]. Beijing: China Environment Science Press, 2009 (in Chinese) 中华人民共和国环境保护部. 水质氨氮的测定-纳氏试剂分光光度法HJ 535-2009[S]. 北京: 中国环境科学出版社, 2009 |
| [26] |
Ministry of Ecology and Environment of the People's Republic of China. Water Quality — Determination of Nitrate-Nitrogen — Ultraviolet Spectrophotometry. HJ/T 346-2007[S]. Beijing: China Environment Science Press, 2007 (in Chinese) 国家环境保护总局. 水质硝酸盐氮的测定-紫外分光光度法HJ/T 346-2007[S]. 北京: 中国环境科学出版社, 2007 |
| [27] |
Ministry of Ecology and Environment of the People's Republic of China. Water Quality—Determination of Nitrogen(Nitrite)—Spectrophotometric Method. GB 7493-87[S]. Beijing: China Environment Science Press, 1987 (in Chinese) 国家环境保护局. 水质亚硝酸盐氮的测定分光光度法GB 7493-87[S]. 北京: 中国环境科学出版社, 1987 |
| [28] |
Devarajan N, Köhler T, Sivalingam P, Van Delden C, Mulaji CK, Mpiana PT, Ibelings BW, Poté J. Antibiotic resistant Pseudomonas spp. in the aquatic environment: a prevalence study under tropical and temperate climate conditions[J]. Water Research, 2017, 115: 256-265. |
| [29] |
Glass C, Silverstein J. Denitrification kinetics of high nitrate concentration water: pH effect on inhibition and nitrite accumulation[J]. Water Research, 1998, 32(3): 831-839. |
| [30] |
Albina P, Durban N, Bertron A, Albrecht A, Robinet JC, Erable B. Influence of hydrogen electron donor, alkaline pH, and high nitrate concentrations on microbial denitrification: a review[J]. International Journal of Molecular Sciences, 2019, 20(20): 5163. |
| [31] |
Chen LF, Lin JQ, Pan D, Ren YL, Zhang J, Zhou B, Chen LX, Lin JQ. Ammonium removal by a newly isolated heterotrophic nitrification-aerobic denitrification bacteria Pseudomonas stutzeri SDU10 and its potential in treatment of piggery wastewater[J]. Current Microbiology, 2020, 77(10): 2792-2801. |
| [32] |
Zhang W, Yan C, Shen JN, Wei RP, Gao Y, Miao AJ, Xiao L, Yang LY. Characterization of aerobic denitrifying bacterium Pseudomonas mendocina strain GL6 and its potential application in wastewater treatment plant effluent[J]. International Journal of Environmental Research and Public Health, 2019, 16(3): 364. |
| [33] |
Zhao B, Cheng DY, Tan P, An Q, Guo JS. Characterization of an aerobic denitrifier Pseudomonas stutzeri strain XL-2 to achieve efficient nitrate removal[J]. Bioresource Technology, 2018, 250: 564-573. |
| [34] |
He TX, Xie DT, Li ZL, Ni JP, Sun Q. Ammonium stimulates nitrate reduction during simultaneous nitrification and denitrification process by Arthrobacter arilaitensis Y-10[J]. Bioresource Technology, 2017, 239: 66-73. |
| [35] |
Zhou L. Studies on the pathogenicity of Pseudomonas plecoglossicida isolated from Pseudosciaen crocea[D]. Xiamen: Master's Thesis of Jimei University, 2015 (in Chinese) 周琳. 大黄鱼源变形假单胞菌的致病性研究[D]. 厦门: 集美大学硕士学位论文, 2015 |
| [36] |
Duan YJ, Huang XL, Zhan GR, Fan W, Duan J, Zhao YL, Deng YQ, Geng Y, Chen DF, Wang KY. Isolation, identification and pathological lesions of Pseudomonas putida from hybrid catfish[J]. Acta Hydrobiologica Sinica, 2017, 41(2): 371-378. (in Chinese) 段亚佼, 黄小丽, 詹瑰然, 樊威, 段靖, 赵一璘, 邓永强, 耿毅, 陈德芳, 汪开毓. 杂交鲇恶臭假单胞菌的分离鉴定及其病理损伤研究[J]. 水生生物学报, 2017, 41(2): 371-378. |
| [37] |
Qiao Q, Han NN, Chen C, Yang Z, Shi CY, Huang J, Li Q. Isolation and identification of pathogenic Pseudoalteromonas sp. and antibiotic sensitivity research[J]. Journal of Anhui Agricultural Sciences, 2010, 38(26): 14224-14226, 14232. (in Chinese) 乔迁, 韩娜娜, 陈超, 杨志, 史成银, 黄偼, 李琪. 致病性假交替单胞菌的分离鉴定及药敏特性研究[J]. 安徽农业科学, 2010, 38(26): 14224-14226, 14232. |
| [38] |
Ma QS, Li Y. Advances in screening and evaluation of aerobic denitrifying bacteria in aquaculture[J]. Chinese Journal of Animal Nutrition, 2021, 33(1): 20-32. (in Chinese) 马青山, 李艳. 水产养殖中好氧反硝化细菌的筛选及评价研究进展[J]. 动物营养学报, 2021, 33(1): 20-32. |
| [39] |
Sun YF, Song H. Study on treatment of nitrate nitrogen wastewater by biological denitrification and its influencing factors[J]. Cleaning World, 2021, 37(9): 4-7. (in Chinese) 孙玉凤, 宋晗. 生物反硝化处理硝酸盐氮废水及影响因素研究[J]. 清洗世界, 2021, 37(9): 4-7. |
| [40] |
Zhang HS. Study on the key influencing factors of sulfur autotrophic denitrification in high-concentration nitrate wastewater[D]. Lanzhou: Master's Thesis of Lanzhou Jiatong University, 2021 (in Chinese) 张翰澍. 高浓度硝酸盐废水的硫自养反硝化关键影响因素研究[D]. 兰州: 兰州交通大学硕士学位论文, 2021 |
| [41] |
Fang JJ, Ma CM, Liu CF. The advance of study on denitrifying bacteria[J]. Environmental Science & Technology, 2010, 33(S1): 206-210, 264. (in Chinese) 方晶晶, 马传明, 刘存富. 反硝化细菌研究进展[J]. 环境科学与技术, 2010, 33(S1): 206-210, 264. |
| [42] |
Kučera I, Matyášek R, Dadák V. The influence of pH on the kinetics of dissimilatory nitrite reduction in Paracoccus denitrificans[J]. Biochimica et Biophysica Acta: BBA - Bioenergetics, 1986, 848(1): 1-7. |
| [43] |
Saleh-Lakha S, Shannon KE, Henderson SL, Goyer C, Trevors JT, Zebarth BJ, Burton DL. Effect of pH and temperature on denitrification gene expression and activity in Pseudomonas mandelii[J]. Applied and Environmental Microbiology, 2009, 75(12): 3903-3911. |
| [44] |
Tang YN, Zhou C, Ziv-El M, Rittmann BE. A pH-control model for heterotrophic and hydrogen-based autotrophic denitrification[J]. Water Research, 2011, 45(1): 232-240. |
| [45] |
Huang F, Pan LQ, Lv N, Tang XM. Characterization of novel Bacillus strain N31 from mariculture water capable of halophilic heterotrophic nitrification-aerobic denitrification[J]. Journal of Bioscience and Bioengineering, 2017, 124(5): 564-571. |
| [46] |
Carneiro Fidélis Silva L, Santiago Lima H, Antônio de Oliveira Mendes T, Sartoratto A, De Paula Sousa M, Suhett De Souza R, Oliveira De Paula S, Maia De Oliveira V, Canêdo Da Silva C. Heterotrophic nitrifying/aerobic denitrifying bacteria: ammonium removal under different physical-chemical conditions and molecular characterization[J]. Journal of Environmental Management, 2019, 248: 109294. |
| [47] |
Chen MX, Wang WC, Feng Y, Zhu XH, Zhou HZ, Tan ZL, Li XD. Impact resistance of different factors on ammonia removal by heterotrophic nitrification-aerobic denitrification bacterium Aeromonas sp. HN-02[J]. Bioresource Technology, 2014, 167: 456-461. |
| [48] |
Chen YY, Jin P, Cui ZW, Xu T, Zhao RJ, Zheng ZW. Identification and characterization of Janthinobacterium svalbardensis F19, a novel low-C/N-tolerant denitrifying bacterium[J]. Applied Sciences, 2019, 9(9): 1937. |
| [49] |
Huang F, Pan LQ, He ZY, Zhang MY, Zhang MZ. Culturable heterotrophic nitrification-aerobic denitrification bacterial consortia with cooperative interactions for removing ammonia and nitrite nitrogen in mariculture effluents[J]. Aquaculture, 2020, 523: 735211. |
| [50] |
Zhao TT, Chen PP, Zhang S, Feng L. Research progress on nitrogen metabolism mechanism of heterotrophic nitrification aerobic denitrification bacteria[J]. Journal of Chongqing University of Technology: Natural Science, 2022, 36(1): 194-203. (in Chinese) 赵天涛, 陈沛沛, 张晟, 封丽. 异养硝化-好氧反硝化菌氮代谢机理的研究进展[J]. 重庆理工大学学报(自然科学), 2022, 36(1): 194-203. |
 2022, Vol. 49
2022, Vol. 49