扩展功能
文章信息
- 辛维岗, 江宇航, 陈诗雨, 徐美余, 周红兵, 张棋麟, 林连兵
- XIN Weigang, JIANG Yuhang, CHEN Shiyu, XU Meiyu, ZHOU Hongbing, ZHANG Qilin, LIN Lianbing
- 滇池金线鲃肠道产细菌素细菌的筛选鉴定及细菌素LSP01的抑菌作用
- Screening and identification of bacteriocin-producing bacteria in the intestines of Sinocyclocheilus grahami in Dianchi and the antibacterial effect of bacteriocin LSP01
- 微生物学通报, 2022, 49(1): 242-255
- Microbiology China, 2022, 49(1): 242-255
- DOI: 10.13344/j.microbiol.china.210290
-
文章历史
- 收稿日期: 2021-03-23
- 接受日期: 2021-06-24
- 网络首发日期: 2021-09-22
2. 云南省高校饲用抗生素替代技术工程研究中心 云南 昆明 650500;
3. 宜良健之源食品有限公司 云南 昆明 650500
2. Engineering Research Center for Replacement Technology of Feed Antibiotics of Yunnan College, Kunming 650500, Yunnan, China;
3. Yiliang Jianzhiyuan Food Limited Company, Kunming 650500, Yunnan, China
滇池金线鲃(Sinocyclocheilus grahami)是云南滇池(Dianchi)特有鱼种,营半穴居生活,长期以来作为一种经济鱼类被广泛养殖和食用,并被列为“云南四大名鱼”之首[1]。近几十年来,由于滇池生态环境受到影响,致使滇池金线鲃数量大幅下降,濒临灭绝。尽管滇池金线鲃目前已实现了人工繁育[2],但在过去较长一段时间中仍一直生活在有污染的滇池环境中,其肠道菌群可能产生更多抗菌活性物质以提高自身免疫力,帮助机体适应环境变化[3-4]。特别是鱼类长期生活在水体环境中,更易受到致病细菌的侵害,其肠道菌群可能为了有效地帮助鱼类抵抗病毒、致病性细菌和真菌的入侵,具有更为丰富的产抗菌活性细菌资源[5]。因此,滇池金线鲃为了更好地适应生存环境,其肠道内可能存在着多种高活性抑制致病菌的细菌素菌种资源。
细菌素是乳酸菌、芽孢杆菌等益生菌生长到稳定期后通过核糖体合成并分泌到环境中的一类具有抑菌活性的蛋白或者多肽,具有安全、高效及可降解等特性[6]。近年来,随着饲喂抗生素种类和剂量的不断增加,已经造成了农业养殖过程中诸多超级细菌的出现以及抗生素耐受现象的广泛频发[7-9]。值得注意的是,我国农业农村部明确指出将于2020年7月全面禁止抗生素在农业养殖端的使用,以保证食品安全和有效减缓抗生素的滥用。然而抗生素禁用后将会造成畜牧养殖过程中牲畜易生病、致死率上升、养殖效率低、经济收益率下降等问题,这使得寻找具有安全、高效、可广泛应用等特点的新型抗生素替代品迫在眉睫。此外,目前虽已经报道了部分抑制致病性细菌的细菌资源,但针对抑制鱼类重要病原菌嗜水气单胞菌(Aeromonas hydrophila)、副溶血弧菌(Vibrio parahaemolyt)等的细菌资源较为匮乏[10-11],特别是来源于环境较为恶劣的鱼类肠道具有潜在高抑菌活性的细菌资源。
本研究以云南滇池特有鱼类滇池金线鲃作为试验材料,筛选其肠道内产细菌素菌种资源,初步确定其抑菌活性成分,通过最小抑菌浓度(minimum inhibitory concentration,MIC)、温度及酸碱耐受性、抑菌广谱性等抑菌特性,并结合细胞膜通透性、2, 3-bis(2-methoxy-4-nitro-5- sulfonyl)-2h-tetrazolium-5-carboxanilide (XTT)还原性实验、扫描电子显微镜(scanning electron microscope,SEM)等探讨细菌素(LSP01)的抑菌作用,以期进一步扩充细菌素菌种资源,也为了解滇池金线鲃肠道内菌群结构提供有价值的参考信息。
1 材料与方法 1.1 菌株病原指示菌株:大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、福氏志贺氏菌(Shigella flexneri)、铜绿假单胞菌(Pseudomonas aeruginosa)、霍乱沙门氏菌(Salmonella choleraesuis)、副溶血弧菌(Vibrio parahaemolyticus)、无乳链球菌(Streptococcus agalactiae)均由昆明理工大学高校饲用抗生素替代技术工程研究中心提供;产酸克雷伯氏菌(Klebsiella oxytoca)、维氏气单胞菌(Aeromonas veronii)、嗜水气单胞菌(Aeromonas hydrophila)、弗氏柠檬酸杆菌(Citrobacter freundii)、土生拉乌尔菌(Raoultella terrigena)均前期分离自滇池金线鲃肠道,由昆明理工大学高校饲用抗生素替代技术工程研究中心保存。试验前利用无菌新鲜LB液体培养基将指示菌浓度调整为106−107 CFU/mL备用。
1.2 主要试剂和仪器及培养基盐酸、氢氧化钠、75%乙醇、胃蛋白酶、胰蛋白酶、碱性蛋白酶、蛋白酶K和过氧化氢酶,上海源叶生物科技有限公司;细菌基因组DNA提取试剂盒、PCR试剂和引物,生工生物工程(上海)股份有限公司。酸碱度pH计,雷磁-上海仪电科学仪器有限公司;台式高速离心机,Eppendorf公司;超净工作台,上海苏坤实业有限公司;恒温培养箱,三洋电器股份有限公司;冷冻干燥仪,日立公司。LB营养培养基(25.0 g/L)、乳酸细菌培养基(MRS,41.5 g/L)、哥伦比亚血琼脂培养基(CA,39.0 g/L),上海汉尼生物技术有限公司。
1.3 滇池金线鲃肠道细菌的分离与纯化滇池金线鲃由宜良健之源食品有限公司(云南,昆明)惠赠。首先,取6尾滇池金线鲃[(6.8±0.4) cm],实验前饥饿处理24 h后置于超净工作台上[12]。75%乙醇浸泡30 s,再用无菌水冲洗3次后迅速解剖收集肠道,使用无菌水反复冲洗肠道表面3次,置于装有2 mL无菌水(ddH2O)的4 mL已灭菌EP管中,用研磨棒充分研磨匀浆。取10−3、10−5、10−7这3个梯度稀释液各100 μL,均匀涂布于LB、MRS、CA这3种培养基,置于37 ℃恒温培养24 h,挑取单菌落进行4−5次划线培养以获得纯培养。最后,将分离得到的菌株根据菌落形态特征和革兰氏染色结果进行初步鉴定并编号,置于−80 ℃冰箱中保存备用。
1.4 产细菌素细菌的筛选将编号的各菌株以2%的接种量接种于对应培养基中,于37 ℃、150 r/min恒温培养24 h后,置于4 ℃、12 000 r/min离心10 min,收集上清液,弃去沉淀。通过0.22 μm的微孔滤膜进一步去除菌体细胞,得到不同菌株的无细胞培养液。随后参照以往实验方法[13],采用牛津杯双层平板法筛选得到具有抑制重要鱼类致病菌嗜水气单胞菌(107 CFU/mL)的产细菌素细菌。以等量高温灭活(1×105 Pa,2 h)后的各菌株对应发酵液上清作为对照[13],每组进行3次重复实验,以进一步明确各菌株的抑菌活性。后续研究选择抑菌活性最佳的菌株进行。
1.5 产细菌素细菌的DNA提取与菌种鉴定将具有抑制嗜水气单胞菌的产细菌素细菌,按照基因组DNA提取试剂盒的操作说明进行细菌基因组DNA提取[12]。16S rRNA基因序列的PCR扩增利用引物27F (5ʹ-AGAGTTTGAT CMTGGCTCAG-3ʹ)和1492R (5ʹ-TACGGYTAC CTTGTTACGACTT-3ʹ)。PCR反应体系(20 μL):2×Mix 10 μL,DNA模板(50 ng/μL) 1 μL,正、反向引物(5 μmol/L)各1 μL,ddH2O补足至20 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 50 s,30个循环;72 ℃ 10 min。PCR扩增产物经琼脂糖电泳后送至生工生物工程(上海)股份有限公司进行测序。测序结果在NCBI数据库利用BLAST进行同源性比对,选取序列一致性在99%以上的细菌种类作为目标物种。
1.6 细菌素的纯化与浓度测定将筛选得到抑制嗜水气单胞菌活性最佳的菌株(唾液乳杆菌S01)接种于MRS液体培养基中,37 ℃、150 r/min恒温摇床中培养24 h后,置于4 ℃、12 000 r/min离心10 min,收集上清液。使用0.22 μm的微孔滤膜进一步去除菌体细胞,将具有抑菌活性的无细胞上清液参照文献[6]的细菌素纯化方法,通过ÄKTA Pure结合Superdex 30 Increase进行纯化。洗脱方法:平衡体积为2个柱体积(column volume,CV),在pH 6.2条件下洗脱,洗脱体积为1.5 CV,通过UV 280 nm处检测细菌素含量,流速设为0.3 mL/min,每1.0 mL为一管进行收集。随后,借助牛津杯双层平板法测定收集液抑菌活性。收集初次纯化产物并将具有抑菌活性的洗脱液再次通过Superdex 30 Increase进行二次纯化,并测定其抑菌活性。最后,将收集测定得到的抑菌活性液体(以下简称LSP01)进行冷冻干燥,保存于4 ℃冰箱中备用。细菌素蛋白浓度测定:取1 mg干粉溶于1 mL ddH2O中,按照BCA蛋白检测试剂盒操作方法绘制标准曲线,测定得到每毫升溶液中的蛋白含量,实验重复3次。
1.7 细菌素LSP01的抑菌特性 1.7.1 细菌素LSP01酶敏感性分别向细菌素LSP01中加入终浓度为1 mg/mL的不同蛋白酶溶液(胃蛋白酶、胰蛋白酶、碱性蛋白酶、蛋白酶K、木瓜蛋白酶、过氧化氢酶),于37 ℃恒温水浴2 h后,80 ℃水浴10 min使酶变性失活。以未加酶处理的细菌素溶液作为对照,实验重复3次。
1.7.2 细菌素LSP01的热、酸碱稳定性分析将细菌素LSP01溶液分别按以下处理进行细菌素的热、酸碱稳定性测定:(1) 0、37、60、80、100、121 ℃处理30 min后,自然冷却至室温;(2) 以1 mol/L的HCl或NaOH溶液调节pH值为2.0、4.0、6.0、8.0、10.0、12.0,分别置于37 ℃温育2 h后调回pH 6.5。以未经处理的细菌素LSP01溶液作为对照,实验重复3次。
1.7.3 细菌素LSP01抑菌谱评估基于牛津杯双层平板法检测细菌素LSP01溶液对12种指示致病菌株(大肠杆菌、金黄色葡萄球菌、福氏志贺氏菌、铜绿假单胞菌、霍乱沙门氏菌、副溶血弧菌、无乳链球菌、产酸克雷伯氏菌、维氏气单胞菌、嗜水气单胞菌、弗氏柠檬酸杆菌、土生拉乌尔菌)的抑制效果。以灭活后(1×105 Pa,2 h)的细菌素LSP01溶液作为对照实验,实验重复3次。
1.7.4 细菌素LSP01的MIC值测定细菌素LSP01对嗜水气单胞菌的MIC值测定参照文献[9]。首先,将细菌素LSP01 (1.0 mg/mL)在无菌PBS (pH 7.2)中连续稀释,并将10 μL的不同浓度稀释液与90 μL含嗜水气单胞菌(10 μL)的LB培养基混合,在37 ℃孵育24 h后,于OD600处测定吸光度,每组重复3次。LSP01的MIC定义为:细菌素LSP01处理嗜水气单胞菌,在37 ℃培养24 h后测定能够完全抑制指示菌生长的浓度,实验重复3次。
1.8 细菌素LSP01抗嗜水气单胞菌的抑菌机制 1.8.1 细胞通透性测定细菌素LSP01作用于嗜水气单胞菌后的细胞膜通透性的测定:将1.0 mL嗜水气单胞菌(107 CFU/mL)添加到24孔板中,加入终浓度为0.5 mg/mL的细菌素LSP01溶液,利用LB液体培养基补齐至2 mL,置于37 ℃恒温培养箱中孵育20 min;将处理后的嗜水气单胞菌于8 000 r/min离心5 min,收集得到菌体;利用0.85%的氯化钠溶液悬浮后,再于8 000 r/min离心5 min,弃去上清液,重复此步骤3次;清洗后的菌体中再加入100 μL 0.85%的氯化钠溶液,按照ABP试剂盒(ABP biosciences, Rockville,USA)的步骤加入NucView Green和Propidium Lodide染料各1.0 μL,黑暗处染色15 min,置于荧光倒置显微镜下观察。以未加细菌素LSP01相同处理的嗜水气单胞菌菌体作为对照,实验重复3次。
1.8.2 XTT还原实验细菌素LSP01作用于嗜水气单胞菌后的代谢活性的测定:根据XTT分析试剂盒的操作说明,将100 μL浮游嗜水气单胞菌(107 CFU/ mL)添加到96孔板中,加入终浓度为0.5 mg/mL的细菌素LSP01溶液,利用LB液体培养基补齐至200 μL,置于37 ℃恒温培养箱中孵育1 h;然后将10 μL的XTT染色剂添加到每个孔中,再于37 ℃孵育2 h,其中XTT反应和介质的吸光度分别在450 nm和600 nm处测量;最后根据试剂盒操作说明,以XTT反应的吸光度(OD450)减去介质的吸光度(OD600),得到嗜水气单胞菌的最终代谢活性。以未加细菌素LSP01相同处理混合物作为对照,实验重复3次。
1.8.3 扫描电子显微镜观察细菌素LSP01作用于嗜水气单胞菌后的显微结构观察:将嗜水气单胞菌活化至对数期(107 CFU/mL),在4 ℃、4 000 r/min离心10 min收集菌体,PBS (pH 7.4)洗脱3次;实验组中加入1.0 mL终浓度为0.5 mg/mL的细菌素LSP01溶液,对照组加入灭活的1.0 mL终浓度为0.5 mg/mL的细菌素LSP01溶液,均分别置于37 ℃反应1 h后,在4 ℃、4 000 r/min离心10 min收集菌体,2 mL PBS洗脱3次;利用2 mL的2.5%戊二醛溶液固定6 h以上,置于4 ℃、4 000 r/min离心10 min,收集菌体,PBS洗脱3次;利用1.0 mL的30%、50%、60%、70%、80%、90%乙醇按次序分别梯度脱水1次,再利用无水乙醇脱水2次,每次脱水20 min;将脱水后的菌体均匀涂布到10 mm×10 mm硅片上(反光面),自然干燥24 h,将含有菌体的硅片用双面胶固定到样品台上,按顺序放入离子溅射金仪器中250 s后取出,进行SEM观察。
1.9 数据分析所有测得的数据均包含3次生物学重复,以平均值±标准差(SD)方式呈现。利用Origin 9.0和IBM SPSS 25.0统计软件分别对数据进行整理分析。数据对之间显著性检验利用t检验(student’s t test)进行;采用One-Way ANOVA进行单因素方差分析和最小显著差异法(least-significant difference,LSD)测验差异显著性。显著性水平阈值P=0.05。
2 结果与分析 2.1 滇池金线鲃肠道细菌的分离依据菌落大小、形状及颜色等表观特征,从滇池金线鲃肠道中分离获得了84株细菌,其中LB培养基上33株、MRS培养基上15株、CA培养基上36株。大部分单菌落呈圆形、椭圆形,部分为圆饼状;菌落表面饱满,少部分出现凹陷、褶皱;菌落颜色大部分为白色、乳白色,少部分为淡黄色。
2.2 产细菌素菌株的筛选通过牛津杯双层平板法筛选得到5株对嗜水气单胞菌具有较高抑菌活性的菌株(图 1、表 1)。结果显示,5株菌对嗜水气单胞菌的抑菌直径范围在(12.89±0.17) mm−(29.21±0.25) mm之间,与对照相比均存在显著差异(P < 0.05)。乳酸菌属中的菌株S49、S61和S01对嗜水气单胞菌的抑菌活性分别为(18.90±0.26) mm、(18.32±0.37) mm和(29.21±0.25) mm,其中菌株S01的抑菌活性最佳,因此选择该菌株作为后续主要研究对象。此外,芽孢杆菌属中的菌株S31和S22抑菌活性次之,分别为(12.89±0.17) mm和(15.56±0.38) mm。
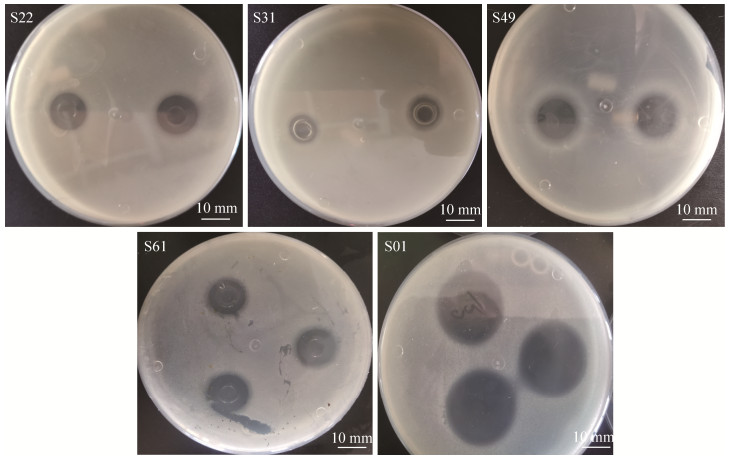
|
| 图 1 滇池金线鲃肠道产细菌素菌株的抑菌效果图 Figure 1 Inhibition effect of bacteriocin-producing bacteria in the intestine of Sinocyelocheilus grahami in Dianchi. |
|
|
| 编号 No. |
菌株 Strain |
抑菌圈直径 Diameter of bacteriostatic zone (mm) |
对照组 Control group (mm) |
| S22 | Bacillus subtilis | 15.56±0.38* | 8.05±0.07 |
| S31 | Bacillus subtilis | 12.89±0.17* | 8.02±0.03 |
| S49 | Lactobacillus sakei | 18.90±0.26* | 8.07±0.06 |
| S61 | Lactobacillus sakei | 18.32±0.37* | 8.04±0.06 |
| S01 | Lactobacillus salivarius | 29.21±0.25* | 8.06±0.05 |
| 注:*:差异显著(P < 0.05) Note: *: Significant difference (P < 0.05). |
|||
经牛津杯双层平板法筛选后,将获得的5株具有明显抑制嗜水气单胞菌活性细菌的16S rRNA基因序列提交到NCBI,通过在线BLAST工具在GenBank数据库中与已收录的细菌16S rRNA基因序列进行相似性比较,选取相似性在99%以上的细菌种类确定为目标物种。经16S rRNA基因序列分子鉴定后,发现5株菌属于2个属的3个不同种细菌,分别是芽孢杆菌属中的枯草芽孢杆菌(Bacillus subtilis)和乳杆菌属中的唾液乳杆菌(Lactobacillus salivarius)、沙克乳杆菌(Lactobacillus sakei)。
2.4 细菌素LSP01的抑菌特性 2.4.1 细菌素LSP01酶敏感性将抑菌活性最佳菌株S01产生的抑菌活性物质LSP01经多种酶溶液处理后,使用牛津杯双层平板法进行抑菌效果检测,结果如图 2所示。结果发现,经过氧化氢酶处理后的LSP01,抑菌圈直径与未加过氧化氢酶的对照相比,抑菌圈直径并未显著减小(P > 0.05),排除了过氧化氢是主要的抑菌活性物质。蛋白酶K和木瓜蛋白酶处理后,LSP01抑菌活性分别显著下降了35.26%和25.38% (P < 0.05);经碱性蛋白酶、胃蛋白酶和胰蛋白酶处理后,LSP01抑菌活性也发生了显著下降(P < 0.05),而且抑菌活性均低于30%。
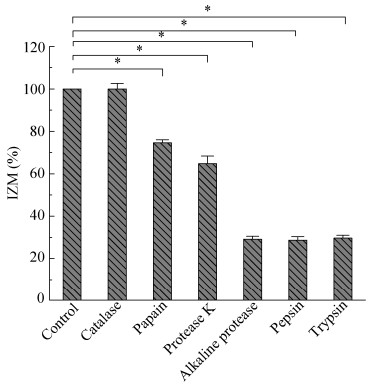
|
| 图 2 LSP01的酶敏感性 Figure 2 Enzyme sensitivity of LSP01. *:显著下降(P < 0.05) *: Significant decline (P < 0.05). |
|
|
对获得的细菌素LSP01进行热稳定性与酸碱耐受测试。结果发现,LSP01在0 ℃处理30 min后抑菌活性未发生明显变化;在37−121 ℃范围内处理30 min后,随着温度的升高抑菌活性逐渐下降,在高温区段(80、100、121 ℃)中活性损失的幅度最大;在80 ℃时抑菌活性为81.93%±2.79%,与对照组相比出现了显著差异(P < 0.05);在121 ℃时抑菌活性最低,仅为45.36%±1.86% (图 3A)。此外,在过酸(pH 2.0)和过碱(pH 10.0)处理后LSP01仍保持较高抑菌活性,在pH 2.0−6.0时LSP01对嗜水气单胞菌的抑菌活性未发生显著下降(P > 0.05);但随着pH值的逐渐上升,在pH 8.0−12.0时抑菌活性出现了大幅度下降,在pH 12.0时达到最低,仅保持了38.92%±1.60%的抑菌活性,与对照组相比存在显著差异(P < 0.05)(图 3B)。

|
| 图 3 LSP01的热稳定性(A)与酸碱耐受性(B) Figure 3 Thermal stability (A) and acid-base tolerance (B) of LSP01. *:显著下降(P < 0.05) *: Significant decline (P < 0.05). |
|
|
将经过ÄKTA Pure及Superdex 30 Increase纯化得到的具有抑菌活性的细菌素LSP01,在进行冷冻干燥后溶出,测定得到LSP01对嗜水气单胞菌的最小抑菌浓度为11.06 μg/mL。同时,对细菌素LSP01进行广谱抑菌效果测定。结果发现,LSP01对所选择的12株重要鱼类、食源性及人畜共患致病菌显示出了不同程度的抑制效果。LSP01对大肠杆菌、霍乱沙门氏菌、金黄色葡萄球菌、福氏志贺氏菌等4种食源性致病菌的抑制效果较明显,抑菌圈直径达到了20 mm以上,尤其是LSP01对金黄色葡萄球菌的抑菌效果最好,为(26.36±0.66) mm;LSP01对铜绿假单胞菌、产酸克雷伯氏菌、土生拉乌尔菌这3种人畜共患致病菌的抑菌效果也均达到24 mm以上,对产酸克雷伯氏菌抑菌最佳,为(27.16±0.36) mm;此外,LSP01对5种典型鱼类致病菌副溶血弧菌、维氏气单胞菌、嗜水气单胞菌、弗氏柠檬酸杆菌、无乳链球菌表现出了相对更优的抑菌效果,抑菌圈直径均达到25 mm以上(表 2)。
| 菌株 Strain |
抑菌圈直径 Diameter of bacteriostatic zone (mm) |
对照组 Control group (mm) |
| Escherichia coli | 21.24±0.31 | 8.06±0.11 |
| Salmonella choleraesuis | 22.31±0.34 | 8.02±0.07 |
| Shigella flexneri | 25.67±0.23 | 8.07±0.09 |
| Pseudomonas aeruginosa | 24.11±0.14 | 8.03±0.04 |
| Vibrio parahaemolyticus | 25.14±0.35 | 8.01±0.07 |
| Staphylococcus aureus | 26.36±0.66 | 8.03±0.08 |
| Streptococcus agalactiae | 27.47±0.24 | 8.06±0.11 |
| Klebsiella oxytoca | 27.16±0.36 | 8. 01±0.07 |
| Aeromonas veronii | 25.54±0.43 | 8.03±0.13 |
| Aeromonas hydrophila | 29.21±0.25 | 8.06±0.07 |
| Citrobacter freundii | 25.77±0.38 | 8.09±0.07 |
| Raoultella terrigena | 24.12±0.16 | 8.03±0.12 |
将嗜水气单胞菌经LSP01处理后,观察其细胞膜通透性变化。结果发现,对照组(图 4A)中呈现出大面积的绿色荧光且几乎未检测到红色荧光出现,而处理组(图 4B)中检测到大量红色、黄色荧光和少量绿色荧光。此外,借助XTT实验测定细胞代谢活性,结果发现,经LSP01处理后的嗜水气单胞菌代谢活性显著下降(P < 0.05),OD450减去OD600吸光度值由(1.093±0.070)下降至(0.396±0.090) (图 4C)。
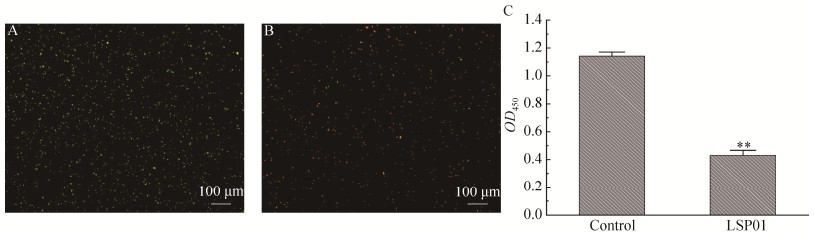
|
| 图 4 LSP01对细胞膜通透性(A、B)和细胞还原力的影响(C) Figure 4 The effect of LSP01 on cell membrane permeability (A, B) and cell reducing power (C). **:显著下降(P < 0.01) **: Significant decline (P < 0.01). |
|
|
为进一步观察细菌素LSP01处理后嗜水气单胞菌的显微结构变化,利用LSP01处理嗜水气单胞菌1 h后,在SEM下观察嗜水气单胞菌菌体细胞显微形态变化(图 5)。结果显示,对照组(图 5A、5B)中嗜水气单胞菌的菌体细胞呈现出均匀一致的短杆状结构,菌体细胞边缘整齐,轮廓清晰,细胞结构完整丰满,为典型嗜水气单胞菌显微细胞形态;而实验组(图 5C、5D)中嗜水气单胞菌菌体细胞有明显内容物溶出,菌体轮廓模糊,菌体出现孔洞,而且大部分菌体结构明显被破坏,出现菌体破裂。

|
| 图 5 LSP01作用前后的嗜水气单胞菌的SEM观察 Figure 5 SEM observation of Aeromonas hydrophila before and after LSP01. A1和A2:对照;B1和B2:处理 A1, A2: Control; B1, B2: Treatment. |
|
|
本研究以滇池金线鲃的保护与资源开发为导向[6],从其肠道中分离获得产细菌素菌株,经形态观察和16S rRNA基因序列分子鉴定发现产细菌素菌株主要是芽孢杆菌属和乳杆菌属细菌。这一结果与目前诸多鱼类肠道中挖掘得到的肠道菌群产细菌素细菌资源具有相似性[14-15],由此也说明乳酸菌属和芽孢杆菌属的细菌对于维持鱼类肠道细菌平衡和健康具有重要作用。同时,筛选得到的产高活性细菌素细菌中,主要是以乳酸菌属为主,其中唾液乳杆菌S01所产细菌素LSP01显示出了良好的抑菌效果,推测可能是由于嗜水气单胞菌与唾液乳杆菌两者都来自滇池金线鲃肠道中且长期对抗的结果[16-17]。虽然筛选获得的芽孢杆菌比乳酸菌对指示菌的抑菌活性较差,但仍表现出较高的抑菌活性[17-20],显现出滇池金线鲃肠道来源的产细菌素细菌具有高效抑制嗜水气单胞菌的能力。因此,本研究在挖掘滇池金线鲃肠道产细菌素菌种资源的同时,也为利用功能性益生菌对滇池金线鲃肠道健康的构建及保护滇池金线鲃提供了一定的理论基础。
细菌素的抑菌特性优良与否,往往决定着该细菌素的应用潜能[6, 21]。本研究以滇池金线鲃肠道内病原菌嗜水气单胞菌作为指示菌,评估抑菌活性最佳菌株S01所产LSP01的抑菌特性。结果发现,LSP01经过氧化氢酶处理后,其抑菌活性并未发现明显下降(P > 0.05),排除了过氧化氢酶的干扰[6]。经过多种蛋白酶溶液处理后,LSP01对嗜水气单胞菌的抑菌活性显著下降,推测唾液乳杆菌所产生的LSP01是一类蛋白物质[13]。同时,LSP01在pH值低于8.0和温度低于80 ℃处理后,抑菌活性未出现显著下降,显示出了较宽泛的酸碱、热耐受能力[22-23]。LSP01经过pH值高于8.0和温度高于80 ℃处理后,抑菌活性随着pH值和温度的上升而快速下降,在pH 12.0和温度为121 ℃时达到最低,与对照相比分别仅保留了45.36%±1.86%和38.92%±1.60%,受到了碱和高温条件的影响。这可能是由于LSP01是一类蛋白或多肽,在过碱和高温处理后,蛋白结构被破坏致使其变性失活[24-25]。虽然细菌素LSP01受到了过碱和高温的影响,但相比其他细菌素同pH值和温度处理后,其残留抑菌活性明显优于目前所发现的大多数细菌素[26-27],显示出了良好的应用潜能。另外,LSP01的MIC仅为11.06 μg/mL,这与De Sousa等报道的经典人源抗菌肽LL-37 (MIC值为250 μg/mL)和大多数细菌源抗菌肽抑制嗜水气单胞菌的MIC值相比更低[28-30]。此外,利用不同类型致病菌评估细菌素LSP01的抑菌谱后发现,细菌素LSP01不仅能够对鱼类致病菌显示出良好的抑菌活性,对于人畜共患致病菌和食源性致病菌也能够有效抑制,抑菌圈直径均高于20 mm,显示出了良好的广谱抑菌特性[31-32]。因此,本研究从滇池金线鲃肠道细菌中获得的LSP01,具有抑菌活性高、酸碱耐受性及热稳定性强等特点,还能够有效地抑制多种病原菌,显示出了优良的应用潜能。
嗜水气单胞菌是一种原发条件性病原菌,在鱼类养殖与生存过程中危害极大[10]。本研究为进一步了解LSP01对嗜水气单胞菌所造成的抑制或杀灭机制,首先,以终浓度为0.5 mg/mL的LSP01处理嗜水气单胞菌后,通过NucView Green和Propidium Lodide染色荧光显微观察处理后的嗜水气单胞菌在荧光显微镜视野下呈现出大量的红色和黄色荧光菌落。这代表LSP01处理后会提升指示菌细胞膜通透性,而细胞膜通透性上升可能也会对细胞内部结构造成极大破坏[6];同时,XTT实验显示以0.5 mg/mL的LSP01处理后细胞活性显著下降了73% (P < 0.05),而短杆乳酸菌DF01粗提物处理大肠杆菌和鼠伤寒沙门氏菌后细胞活力分别仅下降了29%和30%[33],这表明LSP01导致嗜水气单胞菌的细胞活性出现了大幅下降,表现出极强的抑制效果;此外,SEM观察结果显示,LSP01在嗜水气单胞菌细胞膜上形成孔道,使细胞液溶出,外部液体进入,甚至导致整个细胞破裂,最后造成细胞死亡[6, 8]。因此,LSP01对嗜水气单胞菌主要是通过增加细胞膜通透性、降低代谢活性及破坏细胞结构等多方面协调发挥作用,从而导致嗜水气单胞菌受到抑制和杀伤。
本研究首次对滇池金线鲃肠道产细菌素细菌进行分离鉴定,获得了5株抑菌活性优良的产细菌素菌种,在一定程度上丰富了对滇池金线鲃肠道内微生物资源的认识。同时,挖掘得到的LSP01显示出了较强的抑菌活性和热、酸碱耐受能力,对鱼类、食源性及人畜共患致病菌均具有良好的抑菌效果,特别是LSP01能够通过破坏细胞结构、降低细胞膜通透性及细胞代谢活性等方式有效抑制或杀伤嗜水气单胞菌。研究结果在一定程度上丰富了人们对滇池特有鱼种肠道菌群的认识,也为挖掘产细菌素菌种资源提供了新途径。此外,本研究虽然得到了滇池金线鲃肠道内部分产细菌素菌种资源,但动物肠道内为厌氧环境,其肠道内极有可能还存在大量厌氧或兼性厌氧的微生物资源。下一步将使用更多具有特异性的培养基及培养设备结合高通量测序数据,对滇池金线鲃肠道微生物资源进一步开发,以得到更丰富的微生物资源,也为滇池金线鲃的种质资源保护提供一定的研究基础。
| [1] |
Zhang YW, Wang XA, Yang JX, Pan XF. Growth performance and ploidy differences in reciprocal hybrids of Dianchi golden-line barbel (Sinocyclocheilus grahami) and barbless carp (Cyprinus pellegrini)[J]. Aquaculture Research, 2021, 52(3): 1332-1335. DOI:10.1111/are.14978 |
| [2] |
Yang J, Pan X, Li Z. Preliminary report on the successful breeding of the endangered fish Sinocyclocheilus graham endemic to Sinocyclocheilus graham[J]. Zoological Research, 2007, 28(3): 329-331. |
| [3] |
Zhang QL, Dong ZX, Luo ZW, Zhang M, Deng XY, Guo J, Wang F, Lin LB. The impact of mercury on the genome-wide transcription profile of zebrafish intestine[J]. Journal of Hazardous Materials, 2020, 389: 121842. DOI:10.1016/j.jhazmat.2019.121842 |
| [4] |
Zhang QL, Li HW, Wu W, Zhang M, Guo J, Deng XY, Wang F, Lin LB. The response of microbiota community to Streptococcus agalactiae infection in zebrafish intestine[J]. Frontiers in Microbiology, 2019, 10: 2848. DOI:10.3389/fmicb.2019.02848 |
| [5] |
Zhang QL, Jiang YH, Dong ZX, Luo ZW, Lin LB. Effects of mercury exposure on intestinal flora structure and liver antioxidant ability in adult zebrafish[J]. Ecology and Environmental Sciences, 2020, 29(8): 1645-1653. (in Chinese) 张棋麟, 江宇航, 董志祥, 罗智文, 林连兵. 汞暴露对斑马鱼肠道菌群结构和肝脏抗氧化指标的影响[J]. 生态环境学报, 2020, 29(8): 1645-1653. |
| [6] |
Li HW, Xiang YZ, Zhang M, Jiang YH, Zhang Y, Liu YY, Lin LB, Zhang QL. A novel bacteriocin from Lactobacillus salivarius against Staphylococcus aureus: isolation, purification, identification, antibacterial and antibiofilm activity[J]. LWT, 2021, 140: 110826. DOI:10.1016/j.lwt.2020.110826 |
| [7] |
Salazar F, Ortiz A, Sansinenea E. Characterisation of two novel bacteriocin-like substances produced by Bacillus amyloliquefaciens ELI149 with broad-spectrum antimicrobial activity[J]. Journal of Global Antimicrobial Resistance, 2017, 11: 177-182. DOI:10.1016/j.jgar.2017.08.008 |
| [8] |
Xu C, Fu YY, Liu F, Liu ZJ, Ma JG, Jiang R, Song CN, Jiang ZM, Hou JC. Purification and antimicrobial mechanism of a novel bacteriocin produced by Lactobacillus rhamnosus 1.0320[J]. LWT, 2021, 137: 110338. DOI:10.1016/j.lwt.2020.110338 |
| [9] |
Ma ZX, Lee S, Fan PX, Zhai YT, Lim J, Galvão KN, Nelson C, Jeong KC. Diverse β-lactam antibiotic-resistant bacteria and microbial community in milk from mastitic cows[J]. Applied Microbiology and Biotechnology, 2021, 105(5): 2109-2121. DOI:10.1007/s00253-021-11167-4 |
| [10] |
Islam MS, Yang XW, Euler CW, Han XQ, Liu JH, Hossen MI, Zhou Y, Li JQ. Application of a novel phage ZPAH7 for controlling multidrug-resistant Aeromonas hydrophila on lettuce and reducing biofilms[J]. Food Control, 2021, 122: 107785. DOI:10.1016/j.foodcont.2020.107785 |
| [11] |
Tsheten T, Tshering D, Gyem K, Dorji S, Wangchuk S, Tenzin T, Norbu L, Jamtsho T. An outbreak of Aeromonas hydrophila food poisoning in Deptsang village, Samdrup Jongkhar, Bhutan, 2016[J]. Journal of Research in Health Sciences, 2016, 16(4): 224-227. |
| [12] |
Jiang YH, Cai SB, Li HW, Lin LB, Zhang QL. Isolation and identification of intestinal fungus and screening of cellulolytic fungus in Dendrolimus houi (Lepidoptera: Lasiocampidae)[J]. Chinese Journal of Applied and Environmental Biology, 2020, 26(6): 1437-1442. (in Chinese) 江宇航, 蔡赛波, 李宏伟, 林连兵, 张棋麟. 云南松毛虫肠道真菌的分离鉴定及降解纤维素真菌的筛选[J]. 应用与环境生物学报, 2020, 26(6): 1437-1442. |
| [13] |
Jiang YH, Li HW, Yang XJ, Lin LB, Zhang QL. Screening and antibacterial activity of bacteriocin-producing bacteria in intestine of Dendrolimus punctatus[J]. Microbiology China, 2021, 48(1): 123-134. (in Chinese) 江宇航, 李宏伟, 杨晓洁, 林连兵, 张棋麟. 马尾松毛虫肠道产细菌素细菌的筛选及抑菌特性[J]. 微生物学通报, 2021, 48(1): 123-134. |
| [14] |
Guimarães MC, Silva Guimarães AIC, Natori MM, Alarcon MFF, Dias DDC, Ishikawa CM, Tapia-Paniagua S, Moriñigo MÁ, Moyano FJ, Tachibana L. Oral administration of Bacillus subtilis and Lactobacillus plantarum modulates the gut microbiota and increases the amylase activity of Nile tilapia (Oreochromis niloticus)[J]. Aquaculture International, 2021, 29(1): 91-104. DOI:10.1007/s10499-020-00612-2 |
| [15] |
Ma CC, Guo HY, Chang HB, Huang S, Jiang SM, Huo DX, Zhang JC, Zhu XP. The effects of exopolysaccharides and exopolysaccharide-producing Lactobacillus on the intestinal microbiome of zebrafish (Danio rerio)[J]. BMC Microbiology, 2020, 20(1): 300. DOI:10.1186/s12866-020-01990-6 |
| [16] |
Zhou SX, Xia Y, Zhu CM, Chu WH. Isolation of marine Bacillus sp. with antagonistic and organic-substances-degrading activities and its potential application as a fish probiotic[J]. Marine Drugs, 2018, 16(6): 196. DOI:10.3390/md16060196 |
| [17] |
Zhao HB, Cai CE, Liu XY, Jiao BH, Chen B, Cai MH, He PM. Secondary metabolites of Antarctic fungi antagonistic to aquatic pathogenic bacteria[J]. Open Life Sciences, 2018, 13(1): 11-21. DOI:10.1515/biol-2018-0002 |
| [18] |
Zhang Y, Yang JM, Liu Y, Wu YQ, Fang ZJ, Wang YL, Sun LJ, Deng Q, Gooneratne R, Xiao LX. A novel bacteriocin PE-ZYB1 produced by Pediococcus pentosaceus zy-B isolated from intestine of Mimachlamys nobilis: purification, identification and its anti-listerial action[J]. LWT, 2020, 118: 108760. DOI:10.1016/j.lwt.2019.108760 |
| [19] |
Lü X, Miao LH, Ma HH, Bai FL, Lin Y, Sun MT, Li JR. Purification, characterization and action mechanism of plantaricin JY22, a novel bacteriocin against Bacillus cereus produced by Lactobacillus plantarum JY22 from golden carp intestine[J]. Food Science and Biotechnology, 2018, 27(3): 695-703. DOI:10.1007/s10068-017-0280-2 |
| [20] |
Luo LL, Yi LH, Chen JX, Liu BF, Lü X. Antibacterial mechanisms of bacteriocin BM1157 against Escherichia coli and Cronobacter sakazakii[J]. Food Control, 2021, 123: 107730. DOI:10.1016/j.foodcont.2020.107730 |
| [21] |
Yan H, Lu YY, Li X, Yi YL, Wang X, Shan YY, Liu BF, Zhou Y, Lü X. Action mode of bacteriocin BM1829 against Escherichia coli and Staphylococcus aureus[J]. Food Bioscience, 2021, 39: 100794. DOI:10.1016/j.fbio.2020.100794 |
| [22] |
Meng FQ, Zhu XY, Zhao HZ, Nie T, Lu FX, Lu ZX, Lu YJ. A class Ⅲ bacteriocin with broad-spectrum antibacterial activity from Lactobacillus acidophilus NX2-6 and its preservation in milk and cheese[J]. Food Control, 2021, 121: 107597. DOI:10.1016/j.foodcont.2020.107597 |
| [23] |
Ng ZJ, Zarin MA, Lee CK, Phapugrangkul P, Tan JS. Isolation and characterization of Enterococcus faecium DSM 20477 with ability to secrete antimicrobial substance for the inhibition of oral pathogen Streptococcus mutans UKMCC 1019[J]. Archives of Oral Biology, 2020, 110: 104617. DOI:10.1016/j.archoralbio.2019.104617 |
| [24] |
Drider D, Fimland G, Héchard Y, McMullen LM, Prévost H. The continuing story of class IIa bacteriocins[J]. Microbiology and Molecular Biology Reviews, 2006, 70(2): 564-582. DOI:10.1128/MMBR.00016-05 |
| [25] |
Tamoliu̅nas K, Galamba N. Protein denaturation, zero entropy temperature, and the structure of water around hydrophobic and amphiphilic solutes[J]. The Journal of Physical Chemistry B, 2020, 124(48): 10994-11006. DOI:10.1021/acs.jpcb.0c08055 |
| [26] |
Golneshin A, Gor MC, Williamson N, Vezina B, Van TTH, May BK, Smith AT. Discovery and characterisation of circular bacteriocin plantacyclin B21AG from Lactiplantibacillus plantarum B21[J]. Heliyon, 2020, 6(8): e04715. DOI:10.1016/j.heliyon.2020.e04715 |
| [27] |
Zhao RX, Lu YQ, Ran JJ, Li G, Lei S, Zhu Y, Xu BC. Purification and characterization of bacteriocin produced by Lactobacillus rhamnosus zrx01[J]. Food Bioscience, 2020, 38: 100754. DOI:10.1016/j.fbio.2020.100754 |
| [28] |
Wang Y, Qin YX, Zhang Y, Wu RY, Li PL. Antibacterial mechanism of plantaricin LPL-1, a novel class IIa bacteriocin against Listeria monocytogenes[J]. Food Control, 2019, 97: 87-93. DOI:10.1016/j.foodcont.2018.10.025 |
| [29] |
Yi LH, Li X, Luo LL, Lu YY, Yan H, Qiao Z, Lü X. A novel bacteriocin BMP11 and its antibacterial mechanism on cell envelope of Listeria monocytogenes and Cronobacter sakazakii[J]. Food Control, 2018, 91: 160-169. DOI:10.1016/j.foodcont.2018.03.038 |
| [30] |
De Sousa EL, Assane IM, Santos-Filho NA, Cilli EM, De Jesus RB, Pilarski F. Haematological, biochemical and immunological biomarkers, antibacterial activity, and survival in Nile tilapia Oreochromis niloticus after treatment using antimicrobial peptide LL-37 against Streptococcus agalactiae[J]. Aquaculture, 2021, 533: 736181. DOI:10.1016/j.aquaculture.2020.736181 |
| [31] |
Peng SD, Song JJ, Zeng WY, Wang HW, Zhang Y, Xin JW, Suo HY. A broad-spectrum novel bacteriocin produced by Lactobacillus plantarum SHY 21-2 from yak yogurt: purification, antimicrobial characteristics and antibacterial mechanism[J]. LWT, 2021, 142: 110955. DOI:10.1016/j.lwt.2021.110955 |
| [32] |
Ye PX, Wang JW, Liu MM, Li P, Gu Q. Purification and characterization of a novel bacteriocin from Lactobacillus paracasei ZFM54[J]. LWT, 2021, 143: 111125. DOI:10.1016/j.lwt.2021.111125 |
| [33] |
Kim NN, Kim WJ, Kang SS. Anti-biofilm effect of crude bacteriocin derived from Lactobacillus brevis DF01 on Escherichia coli and Salmonella typhimurium[J]. Food Control, 2019, 98: 274-280. DOI:10.1016/j.foodcont.2018.11.004 |
 2022, Vol. 49
2022, Vol. 49


 ,
,