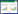扩展功能
文章信息
- 段倩倩, 李亮, 邢刚, 刘雪兰, 孙裴, 魏建忠, 李郁
- DUAN Qianqian, LI Liang, XING Gang, LIU Xuelan, SUN Pei, WEI Jianzhong, LI Yu
- 2018年我国19株猪链球菌4型分离株的病原学特征及分析
- Etiological characteristics and analysis of 19 isolates of Streptococcus suis serotype 4 in China, 2018
- 微生物学通报, 2022, 49(1): 202-216
- Microbiology China, 2022, 49(1): 202-216
- DOI: 10.13344/j.microbiol.china.210558
-
文章历史
- 收稿日期: 2021-06-22
- 接受日期: 2021-07-25
- 网络首发日期: 2021-10-26
2. 马鞍山史记动物健康管理有限公司 安徽 马鞍山 238251
2. Maanshan Shiji Animal Health Management Limited Company, Maanshan 238251, Anhui, China
猪链球菌病是由链球菌属中猪链球菌(Streptococcus suis,SS)、马链球菌类马亚种、马链球菌兽疫亚种和兰氏分群中D、E、L群链球菌引起的一种常见的猪传染病。发病猪常表现为败血症、关节炎、脑膜炎、心内膜炎和淋巴结脓肿。SS是世界范围内引起猪链球菌病最主要的病原,根据荚膜多糖抗原特性的不同可分为35种血清型,即1-34型和1/2型。从发病猪中分离到的SS大多属于1-9型,以SS2为主。然而SS致病菌株会随着时间的推移发生变化。近年来,尽管SS2菌株在临床发病猪中仍占主导地位,但是SS4菌株的分离率出现逐渐升高的态势[1-3]。除了引起猪发病外,SS4还可感染人。1988年Arends等[4]首次于荷兰分离到一株可引起人脑膜炎的SS4;2009-2012年Kerdsin等[5]又在泰国分离到一株可引起人败血症的SS4。鉴于目前SS4毒力因子、致病力、动物模型的系统性研究较少,因此,开展SS4的病原学生物特性研究,切实了解SS4的流行病学情况,对于养殖业和公共卫生安全十分重要。
本研究以19株分离自临床病例的SS4为试验菌株,以前期分离、鉴定和保存的2株SS2强毒株为参考菌株进行培养特性及形态学观察、生化试验、小鼠致病性试验、毒力基因检测、生物被膜形成能力测定和多位点序列分型,以期为SS病原学和分子流行病学研究提供科学依据。
1 材料与方法 1.1 材料 1.1.1 受试菌株19株SS4来源于安徽、江苏、河北地区临床发病猪,由安徽农业大学动物传染病研究室分离、鉴定和保存,菌株背景信息见表 1。
| 序号No. | 菌株Strain | 分离地区Region | 分离部位Material |
| 1 | AHshou18-1 | 安徽寿县Shouxian, Anhui | 脾Spleen |
| 2 | AHshou18-2 | 安徽寿县Shouxian, Anhui | 脑Brain |
| 3 | AHhuai18-7 | 安徽怀远Huaiyuan, Anhui | 肺Lung |
| 4 | AHhuai18-8 | 安徽怀远Huaiyuan, Anhui | 肝Liver |
| 5 | AHhuai18-10 | 安徽怀远Huaiyuan, Anhui | 脑Brain |
| 6 | JSfang18-1 | 江苏盐城Yancheng, Jiangsu | 脑Brain |
| 7 | JSlai18-1 | 江苏宿迁Suqian, Jiangsu | 心包积液Pericardial effusion |
| 8 | JSxi18-3 | 江苏盐城Yancheng, Jiangsu | 肺Lung |
| 9 | JSxu18-4 | 江苏盱眙Xuyi, Jiangsu | 肝Liver |
| 10 | JSxu18-5 | 江苏盱眙Xuyi, Jiangsu | 脾Spleen |
| 11 | JSxu18-6 | 江苏盱眙Xuyi, Jiangsu | 肺Lung |
| 12 | JSxu18-7 | 江苏盱眙Xuyi, Jiangsu | 肝Liver |
| 13 | JSxu18-8 | 江苏盱眙Xuyi, Jiangsu | 脾Spleen |
| 14 | JSxu18-9 | 江苏盱眙Xuyi, Jiangsu | 脑Brain |
| 15 | JSxu18-10 | 江苏盱眙Xuyi, Jiangsu | 心包积液Pericardial effusion |
| 16 | HBgu18-3 | 河北故城Gucheng, Hebei | 肺Lung |
| 17 | HBgu18-4 | 河北故城Gucheng, Hebei | 肝Liver |
| 18 | HBgu18-5 | 河北故城Gucheng, Hebei | 脾Spleen |
| 19 | HBgu18-6 | 河北故城Gucheng, Hebei | 脑Brain |
2株SS2强毒株由安徽农业大学动物传染病研究室分离、鉴定和保存,菌株背景信息见表 2。
| Item | HF2 | HF3 |
| 分离地区Region | 安徽合肥Hefei, Anhui | 安徽合肥Hefei, Anhui |
| 分离部位Material | 脾脏Spleen | 脾脏Spleen |
| 分离时间Time | 2010 | 2013 |
| 毒力基因型Virulence genotype | epf–mrp–sly+fbps+gapdh+orf2+ | epf+mrp–sly+fbps+gapdh+orf2+ |
| 序列型ST type | ST1 | ST7 |
| LD50 (CFU) | 1.50×108 | 9.72×107 |
460只体重18-22 g、6-8周龄清洁级雌性昆明鼠购自安徽医科大学实验动物中心。
1.1.4 主要试剂和仪器普通营养琼脂、0.6%酵母浸膏胰酪胨大豆肉汤(TSB-YE)、0.6%酵母浸膏胰酪胨大豆琼脂(TSA-YE)、纯化琼脂粉、生化微量反应管,绍兴天恒生物科技有限公司;脱纤维兔血、脱纤维马血,南京茂捷微生物科技有限公司;5%绵羊血琼脂,江门市凯林贸易有限公司;小牛血清,上海羽朵生物有限公司;DL2000 DNA Marker、2×Taq PCR Mix,天根生化科技有限公司。
5%小牛血清TSA:TSA-YE 4.8 g,纯化琼脂粉0.3 g,小牛血清5.0 mL,蒸馏水100.0 mL。5%兔血琼脂:TSA-YE 4.8 g,纯化琼脂粉0.3 g,脱纤维兔血5.0 mL,蒸馏水100.0 mL。5%马血琼脂:TSA-YE 4.8 g,纯化琼脂粉0.3 g,脱纤维马血5.0 mL,蒸馏水100.0 mL。
光学显微镜,广州明美光电技术有限公司;PCR仪,杭州晶格科学仪器有限公司;电泳仪,北京六一生物科技有限公司;凝胶成像系统,上海天能科技有限公司;临界点干燥仪,EMITECH公司;扫描电镜,日立Hitachi公司;全波长多功能酶标仪,伯腾仪器有限公司。
1.2 培养特性及形态学观察将保存的19株SS4受试菌株和2株SS2参考菌株划线接种于5%小牛血清TSA,37 ℃培养12 h,复苏后分别接种至普通营养琼脂、5%小牛血清TSA、5%绵羊血琼脂、5%兔血琼脂、5%马血琼脂,并分别在需氧、微需氧、厌氧条件下37 ℃恒温培养。观察细菌生长情况,并挑取单个菌落进行革兰氏染色,在光学显微镜下观察形态学特征。
1.3 生化试验参考生化微量反应管说明书进行操作和结果判定,观察SS4和SS2对葡萄糖、乳糖、蔗糖、棉子糖、菊糖、蕈糖、山梨醇和甘露醇的发酵情况,以及对七叶苷、水杨素、马尿酸钠的水解情况。
1.4 小鼠致病性试验取100只小鼠,随机分为20组,分别为19个试验组(对应19株SS4)和1个对照组,每组5只。试验组腹腔攻毒9.0×108 CFU/mL菌液,每只0.3 mL (即2.7×108 CFU/只),对照组注射等体积灭菌生理盐水。连续观察7 d,记录小鼠发病、死亡情况并回收细菌鉴定。从中筛选出致小鼠100%死亡的菌株,用累积法测定其对小鼠的LD50。每株菌设置5个剂量组,每个剂量组安排10只小鼠,腹腔攻毒0.3 mL菌液。另设10只小鼠作为对照组,注射等体积灭菌生理盐水。连续观察7 d,记录小鼠死亡情况,计算LD50[3]。对死亡小鼠及时剖检,采集肺、肝、脾、肾、胸腺、脑进行病理组织切片观察。
1.5 毒力基因检测检测6种毒力基因,包括胞外蛋白因子(epf)、溶菌酶释放蛋白(mrp)、溶血素(sly)、纤连蛋白结合蛋白(fbps)、3-磷酸甘油醛脱氢酶(gapdh)和毒力相关序列(orf2)[6]。
1.6 生物被膜形成能力测定采用结晶紫染色法测定生物被膜形成能力。生物被膜形成能力判定标准:以阴性对照OD600平均值加其3倍标准差为生物被膜形成能力临界点ODc。OD600≤ODc,无生物被膜形成为阴性(-);ODc < OD600 < 2ODc为弱阳性(1+);4ODc≥OD600≥2ODc为中等阳性(2+);OD600 > 4ODc为强阳性(3+)。在扫描电镜下观察生物被膜形态结构并拍摄照片[7]。
1.7 多位点序列分型扩增7个管家基因(aroA、cpn60、dpr、gki、mutS、recA、thrA)并测序,上传至SS MLST数据库(https://pubmlst.org/organisms/streptococcussuis)获得对应的ST型;拼接管家基因序列,应用MEGA 7.0和MegAlign软件进行相似性分析和系统进化分析[8]。
2 结果与分析 2.1 培养特性及形态学观察结果19株SS4和2株SS2在普通营养琼脂上均不能生长,在5%小牛血清TSA、5%绵羊血琼脂、5%兔血琼脂、5%马血琼脂上均能形成灰白色、半透明、表面光滑、边缘整齐的圆形露珠状隆起菌落。培养12 h后,SS2菌落直径达0.5 mm,SS4菌落直径达1.0 mm。当处于需氧、微需氧条件时,SS4和SS2在5%绵羊血琼脂上均为α溶血,在5%兔血琼脂和5%马血琼脂上均为β溶血;当处于厌氧条件时,在5%绵羊血琼脂、5%兔血琼脂和5%马血琼脂上均为γ溶血(图 1)。在光学显微镜下,SS4和SS2均为革兰氏阳性球菌,成对或短链存在,个别散在(图 2)。
|
| 图 1 SS4和SS2溶血特性 Figure 1 Hemolytic characteristics of SS4 and SS2 strains. A:从左到右依次为SS4在5%绵羊血琼脂(需氧,α溶血)、5%兔血琼脂(微需氧,β溶血)、5%马血琼脂(厌氧,γ溶血)上溶血情况;B:从左到右依次为SS2在5%绵羊血琼脂(需氧,α溶血)、5%兔血琼脂(微需氧,β溶血)、5%马血琼脂(厌氧,γ溶血)上溶血情况 A: From left to right, there were SS4 hemolytic characteristics on 5% sheep blood agar (aerobic, α-hemolysis), 5% cony blood agar (microaerophilic, β-hemolysis), 5% horse blood agar (anaerobic, γ-hemolysis); B: From left to right, there were SS2 colony characteristics on 5% sheep blood agar (aerobic, α-hemolysis), 5% cony blood agar (microaerophilic, β-hemolysis), 5% horse blood agar (anaerobic, γ-hemolysis). |
|
|

|
| 图 2 SS4和SS2镜检形态(革兰氏染色,1 000×) Figure 2 Morphology of SS4 and SS2 strains (Gram staining, 1 000×). A: SS4; B: SS2. |
|
|
由表 3可知,19株SS4和2株SS2均不发酵山梨醇和甘露醇,均可水解七叶苷和水杨素,均不水解马尿酸钠。SS4与SS2生化差异主要体现在糖发酵方面。19株SS4中,发酵6种糖类的菌株占68.4% (13/19),分别为AHhuai18-7、AHhuai18-8、AHhuai18-10、JSfang18-1、JSlai18-1、JSxi18-3、JSxu18-4、JSxu18-7、JSxu18-8、JSxu18-10、HBgu18-4、HBgu18-5和HBgu18-6;发酵5种糖类的菌株占15.8% (3/19),分别为AHshou18-2、JSxu18-5和JSxu18-9;发酵4种糖类的菌株占10.5% (2/19),分别为JSxu18-6和HBgu18-3;发酵3种糖类的菌株占5.3% (1/19),为AHshou18-1;而2株SS2 (HF2和HF3)均可发酵6种糖类。表明SS4糖发酵能力较SS2弱。
| 菌株 Strains |
项目Items | ||||||||||
| 葡萄糖 Glucose |
乳糖 Lactose |
蔗糖 Sucrose |
棉子糖 Raffinose |
菊糖 Synanthrin |
蕈糖 Mushroom sugar |
山梨醇 Sorbitol |
甘露醇 Mannitol |
水杨素 Salicin |
七叶苷 Esculin |
马尿酸钠 Sodium hippurate |
|
| AHshou18-1 | + | + | + | - | - | - | - | - | + | + | - |
| AHshou18-2 | + | - | + | + | + | + | - | - | + | + | - |
| AHhuai18-7 | + | + | + | + | + | + | - | - | + | + | - |
| AHhuai18-8 | + | + | + | + | + | + | - | - | + | + | - |
| AHhuai18-10 | + | + | + | + | + | + | - | - | + | + | - |
| JSfang18-1 | + | + | + | + | + | + | - | - | + | + | - |
| JSlai18-1 | + | + | + | + | + | + | - | - | + | + | - |
| JSxi18-3 | + | + | + | + | + | + | - | - | + | + | - |
| JSxu18-4 | + | + | + | + | + | + | - | - | + | + | - |
| JSxu18-5 | + | + | + | + | + | - | - | - | + | + | - |
| JSxu18-6 | + | + | + | + | - | - | - | - | + | + | - |
| JSxu18-7 | + | + | + | + | + | + | - | - | + | + | - |
| JSxu18-8 | + | + | + | + | + | + | - | - | + | + | - |
| JSxu18-9 | + | - | + | + | + | + | - | - | + | + | - |
| JSxu18-10 | + | + | + | + | + | + | - | - | + | + | - |
| HBgu18-3 | + | - | + | - | + | + | - | - | + | + | - |
| HBgu18-4 | + | + | + | + | + | + | - | - | + | + | - |
| HBgu18-5 | + | + | + | + | + | + | - | - | + | + | - |
| HBgu18-6 | + | + | + | + | + | + | - | - | + | + | - |
| HF2 | + | + | + | + | + | + | - | - | + | + | - |
| HF3 | + | + | + | + | + | + | - | - | + | + | - |
| 注:+:阳性;-:阴性 Note: +: Positive; -: Negative. |
|||||||||||
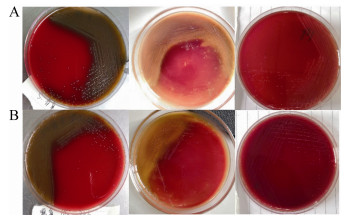
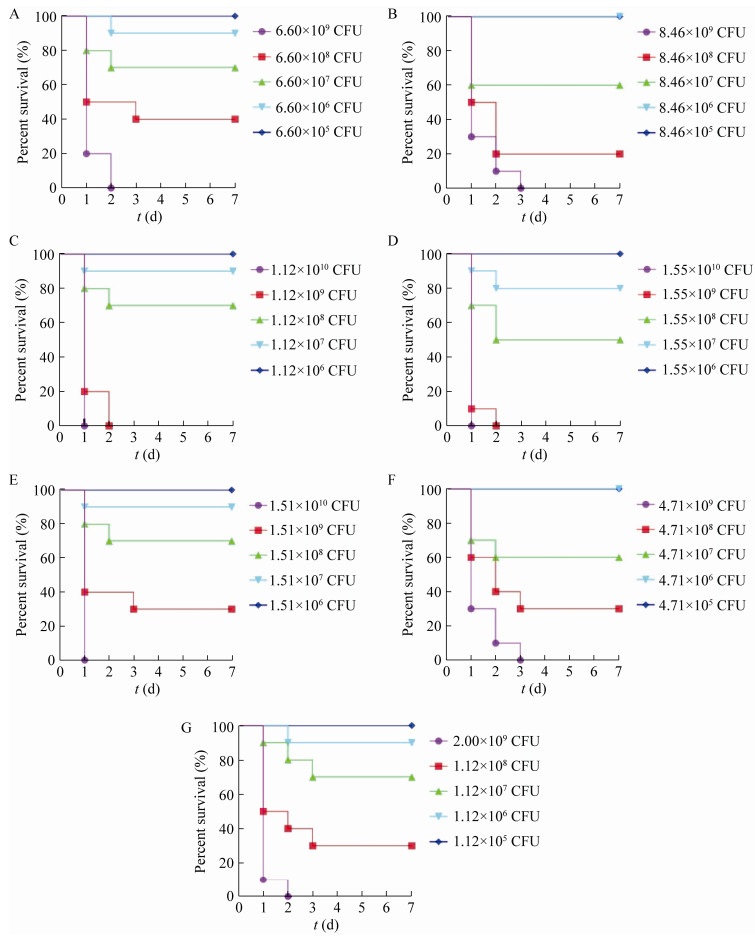
19株SS4攻毒后,除部分急性死亡未表现症状的小鼠外,多表现为精神沉郁、被毛粗乱、食欲下降、扎堆、转圈、死亡。19株SS4中有7株(占36.9%)对小鼠致死率为100% (5/5),分别为AHshou18-1、AHhuai18-8、AHhuai18-10、JSxu18-4、JSxu18-10、HBgu18-3和HBgu18-4。采用累积法测定7株SS4的LD50 (图 3和表 4),7株SS4的LD50在9.03×107-4.05×108 CFU/只范围内;而2株SS2参考菌株(HF2和HF3)的LD50分别为1.50×108 CFU/只和9.72×107 CFU/只[9],与7株毒力最强的SS4同处于107-108 CFU/只数量级,毒力相近。试验组小鼠肺脏充血明显,肺泡壁增厚,实质化;肝细胞结构疏松,水泡变性;脾脏中淋巴细胞稀疏,红白髓界限不清;肾小管上皮细胞疏松、水肿、脱落,肾小球分叶明显,局部出血明显;胸腺细胞排列疏松,皮质、髓质界限不清,局部组织坏死;脑组织中神经元细胞核固缩、坏死,神经胶质细胞弥漫性增生。对照组小鼠各脏器结构正常,未见明显炎症(图 4)。
|
| 图 3 小鼠生存曲线 Figure 3 Mouse survival curves. A: AHshou18-1; B: AHhuai18-8; C: AHhuai18-10; D: JSxu18-4; E: JSxu18-10; F: HBgu18-3; G: HBgu18-4. |
|
|
| 菌株 Strains |
攻毒剂量 Dose (CFU) |
死亡小鼠数目(只) Mortality |
存活小鼠数目(只) Survival |
累积死亡数目(只) Cumulative mortality |
累积存活数目(只) Cumulative survival |
累积死亡率 Cumulative mortality rate (%) |
LD50 (CFU) |
| AHshou18-1 | 6.60×109 6.60×108 6.60×107 6.60×106 6.60×105 |
10 6 3 1 0 |
0 4 7 9 10 |
20 10 4 1 0 |
0 4 11 20 30 |
100 71 27 5 0 |
2.19×108 |
| AHhuai18-8 | 8.46×109 8.46×108 8.46×107 8.46×106 8.46×105 |
10 8 4 0 0 |
0 2 6 10 10 |
22 12 4 0 0 |
0 2 8 18 28 |
100 86 33 0 0 |
1.76×108 |
| AHhuai18-10 | 1.12×1010 1.12×109 1.12×108 1.12×107 1.12×106 |
10 10 3 1 0 |
0 0 7 9 10 |
24 14 4 1 0 |
0 0 7 16 26 |
100 100 36 6 0 |
1.83×108 |
| JSxu18-4 | 1.55×1010 1.55×109 1.55×108 1.55×107 1.55×106 |
10 10 5 2 0 |
0 0 5 8 10 |
27 17 7 2 0 |
0 0 5 13 23 |
100 100 58 13 0 |
1.01×108 |
| JSxu18-10 | 1.51×1010 1.51×109 1.51×108 1.51×107 1.51×106 |
10 7 3 1 0 |
0 3 7 9 10 |
21 11 4 1 0 |
0 3 10 19 29 |
100 79 29 5 0 |
4.05×108 |
| HBgu18-3 | 4.71×109 4.71×108 4.71×107 4.71×106 4.71×105 |
10 7 4 0 0 |
0 3 6 10 10 |
21 11 4 0 0 |
0 3 9 19 29 |
100 79 31 0 0 |
1.19×108 |
| HBgu18-4 | 1.12×109 1.12×108 1.12×107 1.12×106 1.12×105 |
10 7 3 1 0 |
0 3 7 9 10 |
21 11 4 1 0 |
0 3 10 19 29 |
100 79 29 5 0 |
9.03×107 |
| 注:距离比例=(高于50%的累积死亡率-50)/(高于50%的累积死亡率-低于50%的累积死亡率);lgLD50=高于50%累积死亡率的稀释度倒数的对数+距离比例×稀释倍数的对数 Note: Distance ratio=(cumulative mortality rate above 50% - 50)/(cumulative mortality rate above 50% - cumulative mortality rate below 50%); lgLD50=logarithm of reciprocal dilution over 50% cumulative mortality+logarithm of distance ratio×dilution. |
|||||||
|
| 图 4 小鼠各脏器病理组织学变化(HE染色,200×) Figure 4 Histopathological changes of mouse organs (HE staining, 200×). A、C、E、G、I、K分别为试验组小鼠的肺、肝、脾、肾、胸腺、脑;B、D、F、H、J、L分别为对照组小鼠的肺、肝、脾、肾、胸腺、脑;黑色箭头表示病灶 A, C, E, G, I and K are the lung, liver, spleen, kidney, thymus and brain of the test group, respectively; B, D, F, H, J and L are the lung, liver, spleen, kidney, thymus and brain of the control group, respectively. Black arrows show lesions. |
|
|
由表 5可知,19株SS4中,携带2种毒力基因的菌株占5.3% (1/19),为AHshou18-2;携带3种毒力基因的菌株占15.8% (3/19),分别为JSlai18-1、JSxi18-3和HBgu18-5;携带4种毒力基因的菌株占10.5% (2/19),分别为AHhuai18-7和JSxu18-7;携带5种毒力基因的菌株占31.6% (6/19),分别为AHshou18-1、AHhuai18-8、AHhuai18-10、JSxu18-6、JSxu18-10和HBgu18-6;携带6种毒力基因的菌株占36.8% (7/19),分别为JSfang18-1、JSxu18-4、JSxu18-5、JSxu18-8、JSxu18-9、HBgu18-3和HBgu18-4;毒力较强的7株SS4均携带5-6种毒力基因;gapdh、fbps阳性率均为100% (19/19),orf2阳性率为94.7% (18/19),sly阳性率为78.9% (15/19),epf阳性率为68.4% (13/19),mrp阳性率为36.8% (7/19);共有5种毒力基因型,epf+mrp+sly+gapdh+fbps+orf2+占36.8% (7/19),epf+mrp–sly+gapdh+fbps+orf2+占31.6% (6/19),epf–mrp–sly–gapdh+fbps+orf2+占15.8% (3/19),epf–mrp–sly+gapdh+fbps+orf2+占10.5% (2/19),epf–mrp–sly–gapdh+fbps+orf2–占5.3% (1/19)。2株SS2分别携带4种和5种毒力基因;sly、gapdh、fbps、orf2阳性率均为100% (2/2),epf阳性率为50% (1/2),mrp阳性率为0 (0/2);共有2种毒力基因型,分别为epf–mrp–sly+gapdh+fbps+orf2+和epf+mrp–sly+gapdh+fbps+orf2+。
| 菌株 Strains |
毒力基因Virulence genes | 毒力基因检出数目 Number of virulence genes |
|||||
| epf | mrp | sly | gapdh | fbps | orf2 | ||
| AHshou18-1 | + | - | + | + | + | + | 5 |
| AHshou18-2 | - | - | - | + | + | - | 2 |
| AHhuai18-7 | - | - | + | + | + | + | 4 |
| AHhuai18-8 | + | - | + | + | + | + | 5 |
| AHhuai18-10 | + | - | + | + | + | + | 5 |
| JSfang18-1 | + | + | + | + | + | + | 6 |
| JSlai18-1 | - | - | - | + | + | + | 3 |
| JSxi18-3 | - | - | - | + | + | + | 3 |
| JSxu18-4 | + | + | + | + | + | + | 6 |
| JSxu18-5 | + | + | + | + | + | + | 6 |
| JSxu18-6 | + | - | + | + | + | + | 5 |
| JSxu18-7 | - | - | + | + | + | + | 4 |
| JSxu18-8 | + | + | + | + | + | + | 6 |
| JSxu18-9 | + | + | + | + | + | + | 6 |
| JSxu18-10 | + | - | + | + | + | + | 5 |
| HBgu18-3 | + | + | + | + | + | + | 6 |
| HBgu18-4 | + | + | + | + | + | + | 6 |
| HBgu18-5 | - | - | - | + | + | + | 3 |
| HBgu18-6 | + | - | + | + | + | + | 5 |
| HF2 | - | - | + | + | + | + | 4 |
| HF3 | + | - | + | + | + | + | 5 |
| 注:+:阳性;-:阴性 Note: +: Positive; -: Negative. |
|||||||
结晶紫染色结果显示,19株SS4均具有生物被膜形成能力,2株(JSxu18-4和JSxu18-10)生物被膜形成能力中等(2+),占10.5%;其余17株生物被膜形成能力弱(1+),占89.5%;2株SS2生物被膜形成能力均为中等(2+)。
扫描电镜观察结果(图 5)显示,生物被膜形成能力中等的2株SS4 (JSxu18-4和JSxu18-10)和2株SS2 (HF2和HF3)可在细胞爬片表面大量聚集,周围有黏液样物质包绕,形成凹凸不平的致密膜样结构,边缘模糊;生物被膜形成能力弱的2株SS4 (HBgu18-4和AHhuai18-10)分布较松散,周围黏液较少且边缘清晰。

|
| 图 5 SS4和SS2生物被膜扫描电镜观察结果(8 000×) Figure 5 SEM observation of SS4 and SS2 strains (8 000×). A: JSxu18-4 (2+); B: JSxu18-10 (2+); C: HF2 (2+); D: HF3 (2+); E: HBgu18-4 (1+); F: AHhuai18-10 (1+). |
|
|
由表 6可知,19株SS4共有3种ST型,ST94为优势ST型,占89.5% (17/19),其次是ST1158和ST1224,各占5.3% (1/19);2株SS2 (HF2和HF3)有2种ST型,分别为ST1和ST7。ST1、ST7、ST94均已报道过,而ST1158和ST1224均为本研究新发现的ST型。
| 菌株 Strains |
管家基因Housekeeping gene | ST type | ||||||
| aroA | cpn60 | dpr | gki | mutS | recA | thrA | ||
| AHshou18-1 | 16 | 169 | 74 | 1 | 212 | 37 | 81 | 1 224 |
| AHshou18-2 | 16 | 169 | 74 | 350 | 212 | 37 | 81 | 1 158 |
| AHhuai18-7 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| AHhuai18-8 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| AHhuai18-10 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| JSfang18-1 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| JSlai18-1 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| JSxi18-3 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| JSxu18-4 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| JSxu18-5 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| JSxu18-6 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| JSxu18-7 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| JSxu18-8 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| JSxu18-9 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| JSxu18-10 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| HBgu18-3 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| HBgu18-4 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| HBgu18-5 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| HBgu18-6 | 8 | 21 | 5 | 45 | 44 | 22 | 4 | 94 |
| HF2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| HF3 | 1 | 1 | 1 | 1 | 1 | 1 | 3 | 7 |
相似性分析和系统进化分析结果显示,SS4中2种新发现的ST型(ST1158和ST1224)相似率高达99.0%,处于同一小分支,亲缘关系相近;SS2中2种ST型(ST1和ST7)相似率约100%,处于同一小分支,亲缘关系相近。ST94与ST1、ST7间相似率均为97.1%,三者处于同一大分支,与ST1158、ST1224间相似率为96.3%-96.4%,不在同一分支(图 6)。

|
| 图 6 19株SS4和2株SS2 ST型UPGMA进化树 Figure 6 UPGMA evolution tree based on the STs of 19 SS4 and 2 SS2 strains. 各分支后依次为菌株编号和ST型 Strain number and ST type followed each clade. |
|
|
19株SS4和2株SS2均能在5%血清TSA、5%绵羊血琼脂、5%兔血琼脂、5%马血琼脂上形成灰白色、半透明、表面光滑、边缘整齐的圆形露珠状隆起菌落,但是在培养相同时间后,SS4菌落直径比SS2大。本研究中19株SS4均具有溶血性,但是并非所有菌株都携带编码SLY的sly基因,提示SS4中可能存在其他溶血相关蛋白。同一菌株在不同氧气条件下表现的溶血特性存在差异,在需氧、微需氧条件下表现为α溶血或β溶血,在厌氧条件下表现为γ溶血。这与牛源多杀性巴氏杆菌的溶血特性一致[10],究其原因可能是溶血相关基因的表达或溶血相关蛋白的活性受氧气影响。此外,同一菌株对不同动物红细胞所表现的溶血特性也存在差异。在需氧和微需氧条件下,SS4和SS2在绵羊血琼脂上均为α溶血,在兔血和马血琼脂上均为β溶血,表明SS4和SS2对绵羊血红细胞的敏感性比兔血、马血低。这和肠球菌的溶血特性一致[11],提示链球菌属的不同菌种间具有相似的溶血特性。
已有多项研究报道,SS4具有致病性,可致人和猪群发病[1, 4]。在本研究中,19株SS4感染小鼠后,除部分急性死亡的小鼠外,多出现转圈的典型神经症状,而且剖检可见脑充血、肿大,病理组织切片可见神经元核固缩、坏死,神经胶质细胞弥漫性增生。表明SS4可穿透小鼠血脑屏障而引起脑损伤。孙珂等[3]和Arends等[4]也报道过SS4引起新西兰兔和人脑膜炎。此外,SS4感染小鼠后可引起小鼠胸腺萎缩,病理组织切片可见胸腺细胞排列疏松,皮质、髓质界限不清,局部组织坏死。Wang等[12]研究发现,SS2感染小鼠后,通过p53和半胱天冬酶依赖性通路诱导胸腺细胞凋亡,而胸腺细胞的凋亡导致外周血中T细胞群体异常和细胞因子分泌失调,从而导致机体免疫抑制,这提示SS4或许也能通过攻击胸腺引起免疫抑制。毒力是病原微生物引起动物机体不同程度病变的能力。根据试验动物感染SS后表现的临床症状,可将其分为3类菌株:强致病力菌株(引起脑膜炎)、弱致病力菌株(引起肺炎、关节炎等)和无致病力菌株(不引起发病)[13]。Wei等[14]以小鼠为动物模型建立SS毒力判定方法:腹腔注射5×108 CFU/只剂量组,死亡率大于0的菌株判为强毒株;注射3×109 CFU/只剂量组死亡率达100%,而注射5×108 CFU/只剂量组死亡率为0的菌株判为中等毒力菌株;注射3×109 CFU/只剂量组发生死亡但死亡率小于100%判为弱毒株。根据上述方法可以判定19株SS4均为强毒株。虽同为强毒株,毒力也有差异。LD50是准确、直观评价菌株毒力大小的重要单位。本研究中毒力最强的7株SS4的LD50为9.03×107-4.05×108 CFU/只,2株SS2参考菌株(HF2和HF3)的LD50分别为1.50×108 CFU/只和9.72×107 CFU/只,同处于107-108 CFU/只数量级,表明SS4强毒株和SS2强毒株毒力相近。
SS毒力因子众多,可分为表面/分泌因子类、酶/蛋白酶类、转录/调节因子类和其他类,其协同影响SS致病性。本研究对常见的6种SS毒力基因进行检测,结果显示,19株SS4均携带2-6种毒力基因,毒力最强的7株菌(HBgu18-4、JSxu18-4、HBgu18-3、AHhuai18-8、AHhuai18-10、AHshou18-1和JSxu18-10)均携带5-6种毒力基因;共有5种毒力基因型,epf+mrp+sly+gapdh+fbps+orf2+型检出率最高。SS具有高度动态、开放的泛基因组,不同菌株之间常发生基因组大规模重排,因此,携带多种毒力基因且毒力基因型多样的SS对养殖业和人类的潜在威胁更大,值得关注。从毒力基因功能来看,与黏附、代谢功能密切相关的fbps、gapdh基因在SS4和SS2中检出率均为100%。同时,这2种毒力基因也广泛存在于其他血清型SS中[15]。表明黏附、代谢能力在SS生存、繁殖、感染宿主并致病的过程中起重要作用。epf、mrp、sly是SS的毒力标志基因,主要影响SS黏附力、侵袭力及在血液中的存活能力[16]。目前有关这3种毒力基因在SS4中分布情况的报道较少。Huan等[15]在一株分离自江苏淮安健康猪组织的SS4中未检测到epf、mrp、sly基因;孙珂等[3]对5株分离自上海、江苏、广东发病猪组织SS4和5株分离自江苏健康猪组织的SS4进行毒力基因检测,结果显示,epf、mrp、sly基因在发病猪分离株中阳性率分别为0%、0%、100%,在健康猪分离株中阳性率分别为0%、0%、40%。然而本研究中19株SS4均分离自发病猪组织,epf、mrp、sly基因检出率分别为68.4%、36.8%、78.9%,均高于上述报道,提示SS4中毒力标志基因分布情况可能与猪体健康状态相关。此外,mrp和sly基因编码的MRP和SLY均参与SS致脑膜炎过程。MRP可以与纤维蛋白原相互作用促使SS穿透血脑屏障,SLY能够特异性与脑微血管上皮细胞互作,结合胞外基质蛋白,利于细菌定殖,并且能刺激免疫细胞释放蛋白因子,提高脑微血管通透性[16-18]。在本研究中,mrp和sly基因在19株SS4中阳性率分别为36.8%和78.9%,但是所有菌株均能引起小鼠神经症状和全身感染。
SS为抵御不良环境常以被膜态形式存在。在本研究中,19株SS4和2株SS2均具有生物被膜形成能力,SS4以成膜力弱(1+)为主,SS2均为成膜力中等(2+)。SS生物被膜的形成与菌株黏附功能相关,受多种黏附基因调控,如fbps和gapdh[19]。本研究中19株SS4和2株SS2均携带fbps和gapdh基因,这从基因层面初步揭示了SS4和SS2均具有生物被膜形成能力的原因。此外,JSxu18-4 (2+)和JSxu18-5 (1+)同为fbps+gapdh+型菌株,生物被膜形成能力也有差异,提示SS生物被膜形成能力不仅与fbps和gapdh基因存在与否相关,还可能受基因表达量影响。细菌生物被膜形成能力与致病性密切相关。一方面,细菌可依靠生物被膜抵抗宿主免疫应答,同时持续、缓慢释放浮游菌,引发慢性感染;另一方面,生物被膜的存在会影响细菌释放毒力因子,从而导致菌株毒力减弱[7]。张寿明[20]研究发现SS生物被膜能促发小鼠脑膜炎,感染被膜态SS的小鼠表现为严重的共济失调、身体僵直和抽搐,而且脑膜炎相关细胞因子(CCL2、IL-6、TLR2)水平高。这为研究SS4引起小鼠脑膜炎的原因提供了新的参考。
国内外常用的SS分型方法有血清分型和多位点序列分型(multilocus sequence typing,MLST)。与基于荚膜多糖位点的血清分型相比,MLST可以对所有SS分离株分型,包括血清未定型菌株。SS的ST型多样,在不同血清型SS中流行情况各异,而且与血清型呈交叉相关。本研究结果显示,2株SS2参考菌株分别为ST1和ST7,这与国内外SS2分离株流行情况相符[2];19株SS4的优势ST型为ST94,这与国内外报道的SS4分离株流行情况并不完全相同。我国江沪和华南地区发病猪中SS4优势ST型为ST850,ST94仅检出1株,也来源于发病猪,健康猪中优势ST型为ST1006,泰国、美国发病猪中SS4分离株流行ST型均为ST94,与本研究结果一致[2-3, 5, 21]。表明SS4流行ST型与分离地区和猪体健康状态等因素相关。SS作为链球菌属成员,具有高度动态、开放的泛基因组,常通过选择、抗原变异和基因水平转移方式发生进化,因此基因型多样[22]。本研究中,19株SS4有3种ST型,除流行的ST94外,其余2种(ST1158和ST1224)均为新发现的ST型。在局部地区SS4分离株中流行的ST94菌株与同一血清型的ST1158和ST1224菌株管家基因相似率低,处于不同进化分支,亲缘关系远,与SS2中流行的ST1、ST7菌株管家基因相似率高,处于同一进化分支,亲缘关系近。说明SS4和SS2之间可能存在基因水平转移,使得不同血清型菌株间亲缘关系相近,也进一步说明MLST比血清分型更适用于跨区域地研究SS种群结构和遗传进化关系,可为疾病溯源提供理论依据。
4 结论19株SS4分离株的培养及形态学特性均一,生化特性多样,毒力基因型和ST型组成复杂,普遍具有生物被膜形成能力,对小鼠具有强致病性。
| [1] |
Prüfer T L, Rohde J, Verspohl J, Rohde M, De Greeff A, Willenborg J, Valentin-Weigand P. Molecular typing of Streptococcus suis strains isolated from diseased and healthy pigs between 1996–2016[J]. PLoS One, 2019, 14(1): e0210801. DOI:10.1371/journal.pone.0210801 |
| [2] |
Bojarska A, Janas K, Pejsak Z, Otulak-Kozieł K, Garbaczewska G, Hryniewicz W, Sadowy E. Diversity of serotypes and new cps loci variants among Streptococcus suis isolates from pigs in Poland and Belarus[J]. Veterinary Microbiology, 2020, 240: 108534. DOI:10.1016/j.vetmic.2019.108534 |
| [3] |
Sun K, Ni YX, Zhu HD, Wang DD, Guan L, Yu ZY, Zhou JM, Lyu LX, Wang CF, He KW. Study on biological characteristics of Streptococcus suis type 4 isolates[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(1): 80-88. (in Chinese) 孙珂, 倪艳秀, 祝昊丹, 王丹丹, 关琳, 俞正玉, 周俊明, 吕立新, 王春凤, 何孔旺. 猪链球菌4型分离株生物学特性研究[J]. 中国畜牧兽医, 2019, 46(1): 80-88. |
| [4] |
Arends JP, Zanen HC. Meningitis caused by Streptococcus suis in humans[J]. Clinical Infectious Diseases, 1988, 10(1): 131-137. DOI:10.1093/clinids/10.1.131 |
| [5] |
Kerdsin A, Akeda Y, Takeuchi D, Dejsirilert S, Gottschalk M, Oishi K. Genotypic diversity of Streptococcus suis strains isolated from humans in Thailand[J]. European Journal of Clinical Microbiology & Infectious Diseases, 2018, 37(5): 917-925. |
| [6] |
Li L, Huang LZ, Xie B, Zhang HL, Gu WJ. Isolation, identification and gene sequence analysis of Streptococcus suis serotype 9 strain from Guangdong[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(4): 1016-1026. (in Chinese) 李丽, 黄良宗, 谢博, 张海龙, 顾万军. 9型猪链球菌广东株的分离鉴定和基因序列分析[J]. 中国畜牧兽医, 2018, 45(4): 1016-1026. |
| [7] |
Chen CR, Han MM, Zhang NJ, Wang WB, Yao YB, Xiao S, Li Y. Association of biofilm formation with drug-resistance and virulence of Escherichia coli isolated from diarrhea piglet[J]. Microbiology China, 2016, 43(10): 2234-2241. (in Chinese) 陈传荣, 韩敏敏, 张乃嘉, 王婉冰, 姚焱彬, 肖珊, 李郁. 腹泻仔猪源致病性大肠杆菌生物膜与耐药性及毒力的相关性[J]. 微生物学通报, 2016, 43(10): 2234-2241. |
| [8] |
King SJ, Leigh JA, Heath PJ, Luque I, Tarradas C, Dowson CG, Whatmore AM. Development of a multilocus sequence typing scheme for the pig pathogen Streptococcus suis: identification of virulent clones and potential capsular serotype exchange[J]. Journal of Clinical Microbiology, 2002, 40(10): 3671-3680. DOI:10.1128/JCM.40.10.3671-3680.2002 |
| [9] |
Chen Z, Wu HJ, Mao TJ, Han YQ, Sun P, Wei JZ, Li DF, Li Y. Screening of strain for inactivated vaccine of Streptococcus suis type 2[J]. Acta Agriculturae Zhejiangensis, 2020, 32(1): 57-64. (in Chinese) 陈章, 吴华健, 毛天骄, 韩业芹, 孙裴, 魏建忠, 李东风, 李郁. 猪链球菌2型制苗用菌株的筛选[J]. 浙江农业学报, 2020, 32(1): 57-64. |
| [10] |
Zou LX. Characterisation of the haemolytic phenotype of bovine Pasteurella multocida serotype A and screening of the inactivated vaccine candidate strain[D]. Chongqing: Master's Thesis of Southwest University, 2013 (in Chinese) 邹灵秀. 牛源A型多杀性巴氏杆菌溶血特性分析及灭活疫苗候选菌株筛选[D]. 重庆: 西南大学硕士学位论文, 2013 |
| [11] |
Kang LC, Han SJ, Wang JM, Bo XW, Ma X. Detecting hematolysis of Enterococcus from sheep[J]. Acta Microbiologica Sinica, 2008, 48(7): 924-928. (in Chinese) 康立超, 韩素娟, 王静梅, 薄新文, 马勋. 羊源肠球菌溶血性的检测[J]. 微生物学报, 2008, 48(7): 924-928. DOI:10.3321/j.issn:0001-6209.2008.07.014 |
| [12] |
Wang SJ, Lyu C, Duan GX, Meng FD, Yang YB, Yu Y, He XJ, Wang ZZ, Gottschalk M, Li GW, et al. Streptococcus suis serotype 2 infection causes host immunomodulation through induction of thymic atrophy[J]. Infection and Immunity, 2020, 88(4): 1-22. |
| [13] |
Zhang ZP. Isolation and identification of pathogenic Streptococcus suis of the Huanghe river mouth area and detection of virulence associated factors by PCR assay[D]. Taian: Master's Thesis of Shandong Agricultural University, 2010 (in Chinese) 张振苹. 黄河口地区致病性猪链球菌分离鉴定与主要毒力因子的PCR检测[D]. 泰安: 山东农业大学硕士学位论文, 2010 |
| [14] |
Wei ZG, Li R, Zhang AD, He HK, Hua YF, Xia J, Cai XH, Chen HC, Jin ML. Characterization of Streptococcus suis isolates from the diseased pigs in China between 2003 and 2007[J]. Veterinary Microbiology, 2009, 137(1/2): 196-201. |
| [15] |
Huan H, Jiang L, Tang L, Wang Y, Guo S. Isolation and characterization of Streptococcus suis strains from swine in Jiangsu province, China[J]. Journal of Applied Microbiology, 2020, 128(6): 1606-1612. DOI:10.1111/jam.14591 |
| [16] |
Gottschalk M, Lacouture S, Bonifait L, Roy D, Fittipaldi N, Grenier D. Characterization of Streptococcus suis isolates recovered between 2008 and 2011 from diseased pigs in Québec, Canada[J]. Veterinary Microbiology, 2013, 162(2/3/4): 819-825. |
| [17] |
He ZX, Pian YY, Ren ZQ, Bi LL, Yuan Y, Zheng YL, Jiang YQ, Wang FK. Increased production of suilysin contributes to invasive infection of the Streptococcus suis strain 05ZYH33[J]. Molecular Medicine Reports, 2014, 10(6): 2819-2826. DOI:10.3892/mmr.2014.2586 |
| [18] |
Sun YY. Comparison of inflammatory cytokines secretion induced by meningitis and non-meningitis Streptococcus suis[D]. Changchun: Master's Thesis of Jilin University, 2016 (in Chinese) 孙莹莹. 脑膜炎型与非脑膜炎型猪链球菌诱导宿主炎性细胞因子分泌的比较[D]. 长春: 吉林大学硕士学位论文, 2016 |
| [19] |
Wang S. Rutin inhibits the formation of S. suis biofilm and its effects on the expression of cps gene cluster and virulence genes[D]. Harbin: Master's Thesis of Northeast Agricultural University, 2017 (in Chinese) 王帅. 芦丁干预S. suis生物被膜的形成及其对cps基因簇和毒力基因表达的影响[D]. 哈尔滨: 东北农业大学硕士学位论文, 2017 |
| [20] |
Zhang SM. Influence of biofilm on Streptococcus suis meningitis in a mouse model and MS2 purification technique for enriching Streptococcus suis RNA binding protein[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2018 (in Chinese) 张寿明. 生物被膜对猪链球菌脑膜炎形成的影响和MS2纯化技术筛选猪链球菌RNA结合蛋白[D]. 南京: 南京农业大学硕士学位论文, 2018 |
| [21] |
Estrada AA, Gottschalk M, Rossow S, Rendahl A, Gebhart C, Marthaler DG. Serotype and genotype (multilocus sequence type) of Streptococcus suis isolates from the United States serve as predictors of pathotype[J]. Journal of Clinical Microbiology, 2019, 57(9): 1-42. |
| [22] |
Shelyakin PV, Bochkareva OO, Karan AA, Gelfand MS. Micro-evolution of three Streptococcus species: selection, antigenic variation, and horizontal gene inflow[J]. BMC Evolutionary Biology, 2019, 19(1): 83. DOI:10.1186/s12862-019-1403-6 |
 2022, Vol. 49
2022, Vol. 49