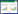扩展功能
文章信息
- 陈国浚, 杨翕淼, 彭欢, 王洁
- CHEN Guojun, YANG Ximiao, PENG Huan, WANG Jie
- 黑曲霉RAF106菌丝球形成的影响因素及对结晶紫的吸附作用
- The pellet-formation factors of Aspergillus niger RAF106 and its application in the biosorption of crystal violet
- 微生物学通报, 2022, 49(1): 72-87
- Microbiology China, 2022, 49(1): 72-87
- DOI: 10.13344/j.microbiol.china.210373
-
文章历史
- 收稿日期: 2021-04-29
- 接受日期: 2021-07-15
- 网络首发日期: 2021-09-10
丝状真菌是酶制剂、有机酸、抗生素等微生物发酵产品的重要表达体系[1]。在液体深层发酵体系中,丝状真菌的菌体形态存在分散的菌丝、菌丝团和菌丝球3种形式[2]。丝状真菌的形态变化是影响产物合成的核心因素,如土曲霉(Aspergillus terreus)的菌丝球越小越利于洛伐他汀的积累[3],构巢曲霉(Aspergillus nidulans)呈分散的菌丝形态比菌丝球能产更高的青霉素[4],菌丝球较分散的菌丝形态更有利于富含花生四烯酸油脂的大规模生产[5]。与此同时,丝状真菌形态也与发酵液黏稠、流变性质、营养分布等密切相关,如分散的菌丝使得介质黏度增加、发酵罐中营养分布极不均匀并会缠绕在叶轮上,造成堵塞并扩散到取样线和溢流线[6]; 菌丝球最大可以达到几毫米,而发酵液中的溶解氧及其他营养成分只能渗透入菌丝球表面约200 μm[7],这使得菌丝球内部菌体活性急剧下降,甚至失去活性[8]。这些问题的存在影响了丝状真菌的生长发育、物质代谢、废水处理等过程。因此,丝状真菌形态的形成过程、形成机理及控制因素等的深入研究对促进丝状真菌的工业化应用、提高目标物产量和提升废水处理能力等具有重要意义。
黑曲霉具有强大的代谢能力,已经广泛用于多种酶制剂和有机酸的生产,如蛋白酶、脂肪酶、糖化酶、纤维素酶和柠檬酸等[9-10]。研究表明,黑曲霉的形态与代谢物产量有着密切的联系,如:菌丝球的形成有利于柠檬酸的积累[8]; 分散菌丝状更利于呋喃果糖苷酶和葡萄糖化酶的表达[11]。除工业发酵应用外,黑曲霉也被应用于废水处理,如:黑曲霉AS3.3284对染料浓度为100 mg/mL的6种水溶性染料的废水脱色率均超过88%[12]; 黑曲霉B77对铜、锰、锌、镍、铁等重金属具有强大的吸附能力[13]等。然而黑曲霉对染料、重金属等的吸附能力与菌体形态的关系鲜有报道。
从普洱茶分离的黑曲霉RAF106除能合成蛋白酶、纤维素酶、果胶酶、柠檬酸外,还能降解黄曲霉毒素,将茶多酚生物转化成生物可利用度更高的具有抗氧化能力的小分子物质[14-15],但该菌的菌丝球形成过程、影响因素及对染料的吸附能力等都未见报道。因此,本文以黑曲霉RAF106为研究对象,通过对不同生长时间的黑曲霉菌体形态进行显微观察,明确黑曲霉RAF106菌丝球的形成过程及方式; 并通过改变培养条件,探究初始pH、温度、孢子接种量、摇床转速对菌体形态变化的影响; 同时比较不同菌体形态对结晶紫的吸附能力。
1 材料与方法 1.1 材料 1.1.1 菌株和培养条件黑曲霉ATCC 6257、黑曲霉RAF106 (CGMCC No. 9608)在马铃薯葡萄糖固体培养基(potato dextrose agar,PDA)上30 ℃培养5 d,在平板中加入吐温-80,收集孢子,用自制带棉花滤头过滤制得孢子悬液。将孢子悬液接种于100 mL马铃薯葡萄糖液体培养基(potato dextrose broth,PDB; 自然状态下pH 5.5)中,孢子终浓度5×105个/mL,30 ℃、180 r/min摇床培养2 d,观察菌体形态形成过程及动态变化。
1.1.2 主要试剂和仪器吐温-80,天津大茂化学试剂厂; 结晶紫、氢氧化钠,福晨(天津)化学试剂有限公司; 盐酸、蔗糖、硝酸钠,广州化学试剂厂; 乳糖,北京普博欣生物科技有限公司; D-果糖,北京索莱宝科技有限公司; 氯化铵,汕头市光华化学厂; 无水醋酸钠,天津市永大化学试剂有限公司; 酵母提取粉,广东环凯微生物科技有限公司; 胰蛋白胨,北京奥博星生物技术有限责任公司; 琼脂,Biofroxx公司。
恒温培养摇床,上海一恒科学仪器有限公司; 生化培养箱,天津市泰斯特仪器有限公司; 生物显微镜,麦克奥迪实业集团有限公司; 酶标仪,赛默飞世尔仪器有限公司; 离子酸度计,德国赛多利斯公司; 超低温高速离心机,Eppendorf公司。
1.2 方法 1.2.1 黑曲霉RAF106孢子及分散菌丝形成菌丝球的过程将黑曲霉孢子悬液接种于PDB中摇床30 ℃、180 r/min培养2 d,每隔2 h取样进行显微摄影,观察菌丝球形成过程; 同时,将5 g自由分散的菌丝接种于PDB,30 ℃、180 r/min摇床培养24 h,每隔2 h取样进行显微摄影,观察菌丝球形成过程。
1.2.2 培养条件对黑曲霉RAF106菌丝球大小的影响采用单因素变量法研究培养液初始pH、培养温度、摇床转速、孢子接种量、碳氮源对黑曲霉菌丝球大小的影响。初始pH分别设为4.0、5.0、6.0、7.0、8.0、9.0、10.0;培养温度分别设为25、30、35、40、45 ℃; 摇床转速分别设为140、160、180、200、220 r/min; 孢子接种量分别为5×104、1×105、5×105、1×106、5×106个/mL; 分别用果糖、蔗糖、乳糖、醋酸钠代替PDB中葡萄糖探究碳源对菌丝球的影响; 通过在PDB中额外添加酵母提取粉、胰蛋白胨、氯化铵、硝酸钠探究氮源对菌丝球的影响。培养24 h,取20个菌丝球排成一列,测量20个菌丝球的直径并取样进行显微摄影。同时,将培养所得的菌丝球烘干后称重。
1.2.3 黑曲霉菌丝球对结晶紫的吸附及吸附动力学模拟将黑曲霉孢子悬液接种于PDB中30 ℃、180 r/min培养24 h,于4 000 r/min离心5 min后去除培养液,并收集菌丝球。用无菌水将菌丝球清洗3次,以相同条件离心去除多余水分,称取5 g菌丝球放置于含有0.7 mg/mL结晶紫溶液中,每隔2 h摇匀吸取结晶紫溶液,采用酶标仪测量吸光度(OD590)。
1.2.4 黑曲霉形态对结晶紫吸附效果的影响将5 g分散菌丝及不同大小的菌丝球分别加入0.7 mg/mL结晶紫溶液中,吸附12 h后于4 000 r/min离心5 min,取上层溶液,采用酶标仪测量吸光度(OD590)。
1.2.5 数据分析实验重复3次,数据以平均值±方差显示,并使用DPS软件进行单因素方差分析,比较判断组间差异。P < 0.05代表样本间存在显著性差异。
2 结果与讨论 2.1 黑曲霉RAF106孢子及分散菌丝成球的过程根据成球过程的不同,丝状真菌的菌丝球形成机制分为凝聚型和非凝聚型2种类型,黑曲霉为典型的凝聚型丝状真菌,即:多个孢子首先聚集、膨胀,再生长出菌丝,由菌丝聚集缠绕形成菌丝球[16]。以黑曲霉ATCC 6257为例,孢子前4 h不断聚集,6 h孢子萌发、长出芽管,8 h明显可见菌丝缠绕、菌丝球初步成型; 随后,菌丝不断生长缠绕,菌丝球体积不断增大(图 1A)。将分散的黑曲霉RAF106孢子悬液接种于PDB的培养过程中发现,生长初期孢子不断聚集,6 h孢子开始萌发、长出芽管,8 h形成清晰可见的菌丝,10 h明显可见菌丝缠绕,12 h菌丝球初步成型,随后菌丝不断生长缠绕,菌丝球体积不断增大(图 1B),这与黑曲霉ATCC 6257的成球方式基本一致。说明黑曲霉RAF106菌丝球形成过程符合“接种孢子—孢子聚团—菌丝球形成”的孢子成球模型[17]。
|
| 图 1 黑曲霉ATCC 6257 (A)和RAF106 (B)孢子成球过程 Figure 1 ormation of pellets by spore inoculation of Aspergillus niger ATCC 6257 (A) and RAF106 (B). |
|
|
除孢子成球理论外,在海洋黑曲霉R3和黑曲霉ZJUBE-1中发现菌丝成球的现象[18-19]。为阐明黑曲霉RAF106是否也存在这一现象,将分散的菌丝直接接入PDB中培养,实时观察菌丝球形成过程。研究发现,分散菌丝不断聚集缠绕,6 h菌丝球初步成型,至24 h菌丝伸长,菌丝球体积增大,中心密度增大(图 2)。这些结果说明,在黑曲霉RAF106中,孢子接种和菌丝接种均可形成菌丝球,菌丝球的形成并不完全依赖于孢子的凝聚。

|
| 图 2 黑曲霉RAF106分散菌丝成球过程 Figure 2 Formation of pellets by inoculation of dispersed hyphae of Aspergillus niger RAF106. |
|
|
研究表明真菌菌丝球形态受到初始培养液pH、培养温度、摇床转速、孢子接种量等培养条件的影响[20]。本文探究了培养液初始pH、培养温度、孢子接种量、摇床转速以及不同碳氮源对黑曲霉RAF106菌丝球形成大小的影响。
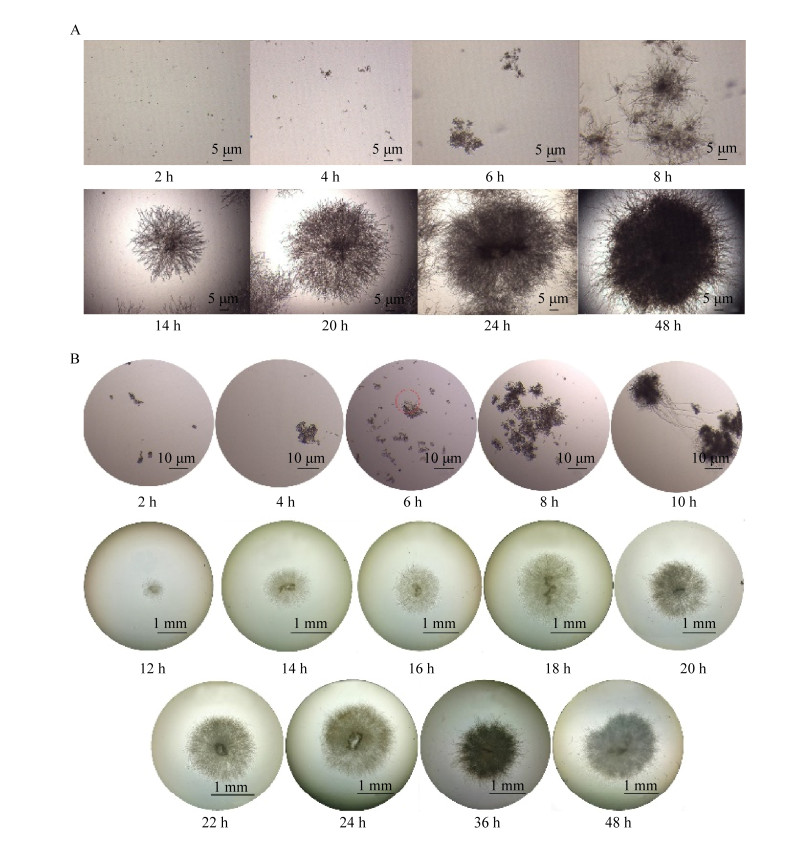
2.2.1 培养液初始pH对黑曲霉菌丝球大小的影响黑曲霉RAF106具有较好的耐酸性和耐碱性,在pH 4.0−10.0都可以生长且形成菌丝球(图 3A)。经比较,不同初始pH条件下黑曲霉的生长量没有显著差异,但菌丝球直径随pH值增大而减小(图 3B、3C)。与初始pH 4.0时直径5.80 cm相比,初始pH值为5.0、6.0、7.0、8.0、9.0、10.0时菌丝球直径分别减少了3.10%、12.24%、17.41%、22.59%、26.90%、33.97%,说明菌丝球大小与培养液初始pH值成反比; 这一现象与培养液初始pH值对冬虫夏草(Crodyceps sinensis Cs-Hk1)、橘青霉(Penicillium citrinum)成球影响结果一致[21-22],但与初始pH对黑曲霉MYA 135菌丝球大小影响相反,而且不同于海洋微紫青霉(Penicillium janthinellum)菌丝球直径随初始pH值增大呈先增大后减小再增大的趋势,青霉(Penicillium sp. L1)菌丝球直径则呈先增大后减小的趋势[23-25]。
|
| 图 3 培养液初始pH对菌丝球干重及大小的影响 Figure 3 Effects of different initial pH values on the dry weight and diameters of Aspergillus niger pellets. A:菌丝球图片; B:菌丝球干重; C:菌丝球直径大小。不同小写字母代表显著性差异(p < 0.05) A: Images of A. niger pellets; B: Dry weight of A. niger pellets; C: Diameters of A. niger pellets. Different lowercase letters indicate significant differences among the treatments (P < 0.05). |
|
|
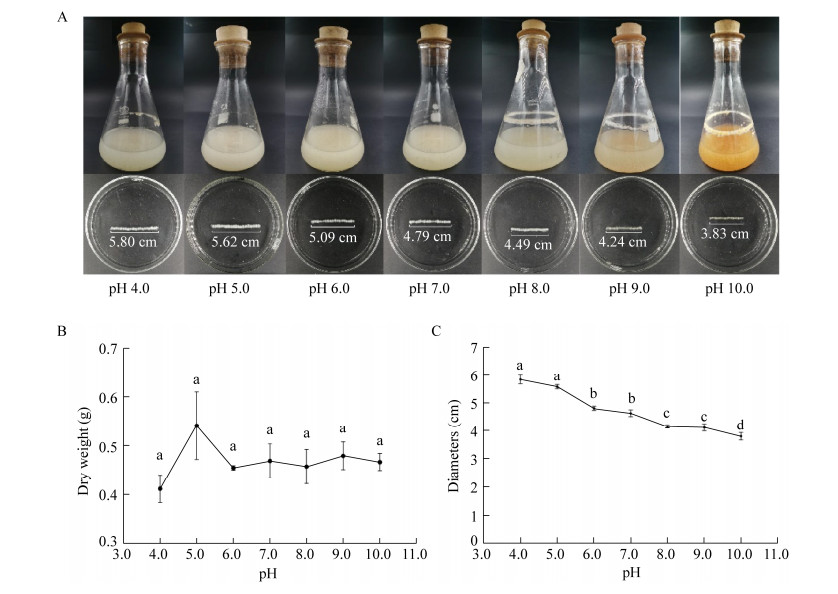
为了进一步探究pH对菌丝球大小的影响,将于初始pH 4.0的PDB中形成的菌丝球转移至pH 10.0的PDB中,初始pH 10.0的PDB中形成的菌丝球转移至pH 4.0的PDB中培养12 h,观察菌丝球大小变化(图 4)。结果表明,与继续在原pH条件下培养12 h的菌丝球大小相比,成球后改变pH并不能显著改变菌丝球大小。结合前人报道,我们推测初始pH抑制大菌丝球形成的可能原因在于pH影响孢子表面电荷,从而影响真菌菌体形态,即:随着pH值增大,孢子细胞壁表面负电荷增加,静电斥力增大,影响孢子聚集,从而抑制菌丝球形成[26-27]。
|
| 图 4 pH变换对黑曲霉菌丝球大小的影响 Figure 4 Effects of altered pH values on the diameters of Aspergillus niger pellets. A:菌丝球图片; B:菌丝球直径大小,不同小写字母代表显著性差异(p < 0.05) A: Images of A. niger pellets; B: Diameters of A. niger pellets. Different lowercase letters indicate significant differences among the treatments (P < 0.05). |
|
|
黑曲霉RAF106在温度胁迫下表现出良好的耐性,在培养温度为25−40 ℃均能较好地生长,其生长量无显著性差异(图 5A、5B); 菌丝球直径随温度升高呈先增后减的趋势(图 5A、5C)。35 ℃时菌丝球直径最大(7.30 cm),与之相比,25、30、37、40 ℃时的菌丝球直径分别下降了57.67%、22.88%、17.81%、25.62% (图 5C),说明黑曲霉菌丝球大小在小于35 ℃时与温度成正比,大于35 ℃时则成反比。当温度升高到在45 ℃,显微镜下仅能看到少量的孢子聚集及萌发(图 6),说明高温可能影响孢子聚集及减缓孢子萌发,导致黑曲霉菌丝球形成受到抑制。黑曲霉RAF106菌丝球大小随温度变化的趋势与产香真菌GS-1、青霉X5、土曲霉M11基本一致[28-30]。
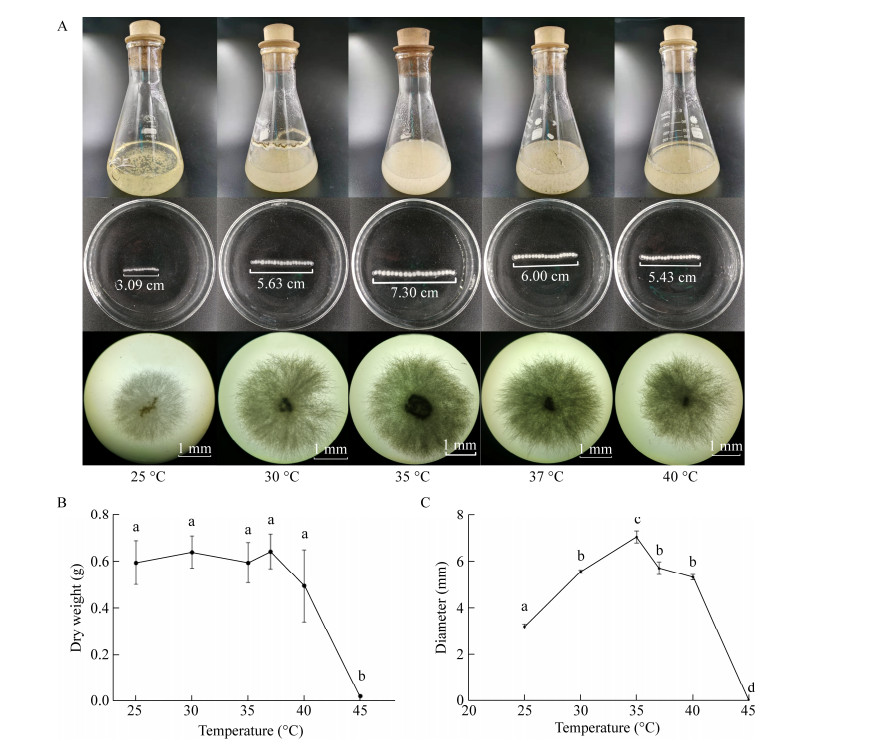
|
| 图 5 培养温度对菌丝球干重及大小的影响 Figure 5 Effects of different temperatures on the dry weight and diameters of Aspergillus niger pellets. A:菌丝球图片; B:菌丝球干重; C:菌丝球直径大小。不同小写字母代表显著性差异(p < 0.05) A: Images of A. niger pellets; B: Dry weight of A. niger pellets; C: Diameters of A. niger pellets. Different lowercase letters indicate significant differences among the treatments (P < 0.05). |
|
|
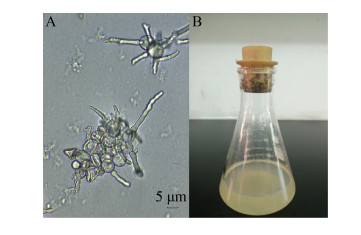
|
| 图 6 45 ℃下黑曲霉生长情况 Figure 6 Growth of Aspergillus niger at 45 ℃. A:黑曲霉显微摄影; B:液体培养情况 A: Images of A. niger observed under the microscope; B: Fungal morphology in PDB. |
|
|
不同摇床转速未显著性改变黑曲霉菌丝球大小及生物量(图 7)。在摇床转速为140−220 r/min条件下培养24 h所得的黑曲霉,20个菌丝球直径在4.39−5.29 cm之间,而平均生物量在0.24−0.36 g之间。这与转速对液体培养的元蘑(Hohenbuehelia serotina)及茶树菇(Agrocybe aegirita)菌丝球形态的影响相同[31-32],但不同于黑曲霉R3菌丝球直径与转速呈正比及黑曲霉HFM5A-1菌丝球直径随转速增大呈先增大后减小的趋势[18, 33]。转速升高不仅提高了培养基中的溶氧量,同时也促进了真菌养分的吸收,从而促进菌丝球的形成; 同时,高转速也意味着产生较大的剪切力,从而促使菌丝断裂,不利于菌丝球的形成,这导致摇床转速对不同丝状真菌菌丝球的形成具有不同的影响效果[33-35]。
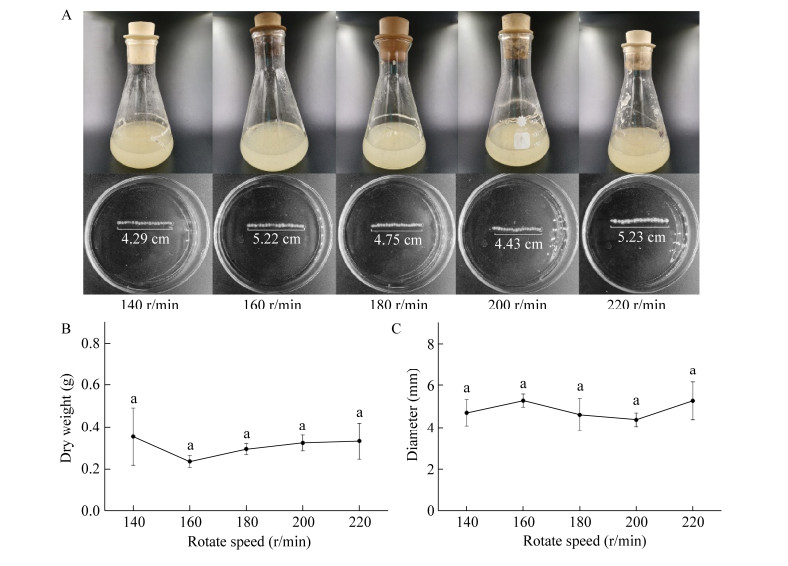
|
| 图 7 摇床转速对菌丝球干重及大小的影响 Figure 7 Effects of different agitation frequencies on the dry weight and diameters of Aspergillus niger pellets. A:菌丝球图片; B:菌丝球干重; C:菌丝球直径大小。不同小写字母代表显著性差异(p < 0.05) A: Images of A. niger pellets; B: Dry weight of A. niger pellets; C: Diameters of A. niger pellets. Different lowercase letters indicate significant differences among the treatments (P < 0.05). |
|
|
接种量显著影响黑曲霉菌丝球大小及生物量(图 8A、8B)。经比较,黑曲霉生物量随接种量的升高而升高,而菌丝球大小随接种量升高而下降(图 8B、8C)。与接种量为5×104个/mL时菌丝球生物量(0.067 g)相比,当接种量为1×105、5×105、1×106和5×106个/mL时,生物量分别增加了1.24、2.19、2.56和3.51倍(图 8B),这与孢子接种量对赭曲霉ATCC 3150 (Aspergillus ochraceus ATCC 3150)、黑曲霉557生物量的影响相同[36-37]。与接种量为5×104个/mL时菌丝球直径9.49 cm相比,当接种量为1×105、5×105、1×106和5×106个/mL时,所形成的菌丝球直径分别下降了15.70%、48.16%、51.74%和71.23%,这表明黑曲霉菌丝球大小与接种量成反比,这与孢子接种量对黑曲霉AB1.13、嗜热土曲霉M11菌丝球直径的影响相同[17, 37] (图 8C)。孢子接种量的增大,使得黑曲霉间对营养成分和生长空间的竞争加剧,从而限制了菌丝球增大[35]。
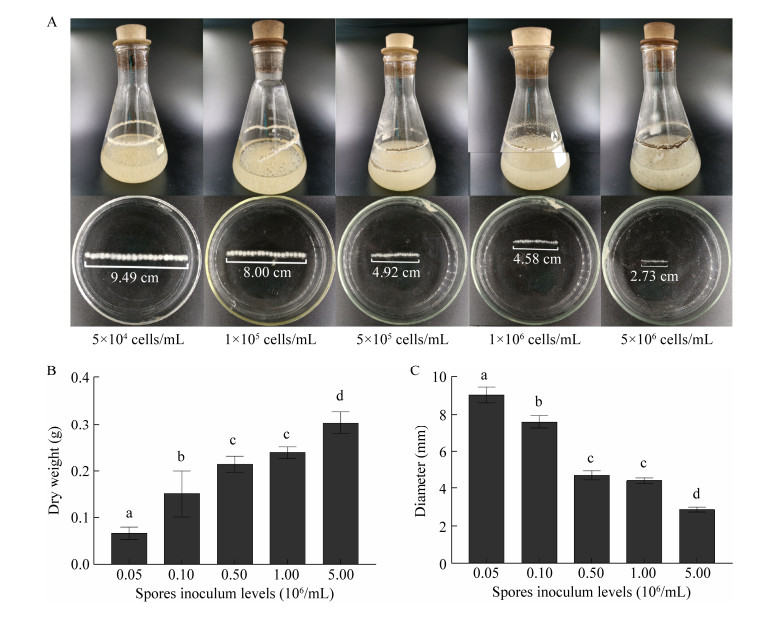
|
| 图 8 孢子接种量对菌丝球干重及大小的影响 Figure 8 Effects of different spore inoculum levels on the dry weight and diameters of Aspergillus niger pellets. A:菌丝球图片; B:菌丝球干重; C:菌丝球直径大小。不同小写字母代表显著性差异(p < 0.05) A: Images of A. niger pellets; B: Dry weight of A. niger pellets; C: Diameters of A. niger pellets. Different lowercase letters indicate significant differences among the treatments (P < 0.05). |
|
|
不同碳氮源能够影响黑曲霉的生长及菌丝球的大小(图 9A)。与葡萄糖组相比,蔗糖、果糖组生物量分别增加了4.14%、9.10%,而醋酸钠、乳糖组分别降低了65.00%、26.65% (图 9B),这与葡萄糖、蔗糖、乳糖对桔青霉和竹荪(Dictyophora indusiata)生物量的影响相同[38-39]; 蔗糖、醋酸钠、果糖和乳糖组菌丝球直径分别减小了14.67%、27.63%、27.87%和27.14% (图 9C),这与葡萄糖、蔗糖对黑曲霉Y3菌丝球直径的影响相同[40]。这些结果表明以葡萄糖为碳源最有利于菌丝球的形成,而以醋酸钠、乳糖为碳源不利于菌丝球形成,这可能因为黑曲霉对乳糖及醋酸钠利用率不高使得菌体生长过程中碳源匮乏所造成[24]。
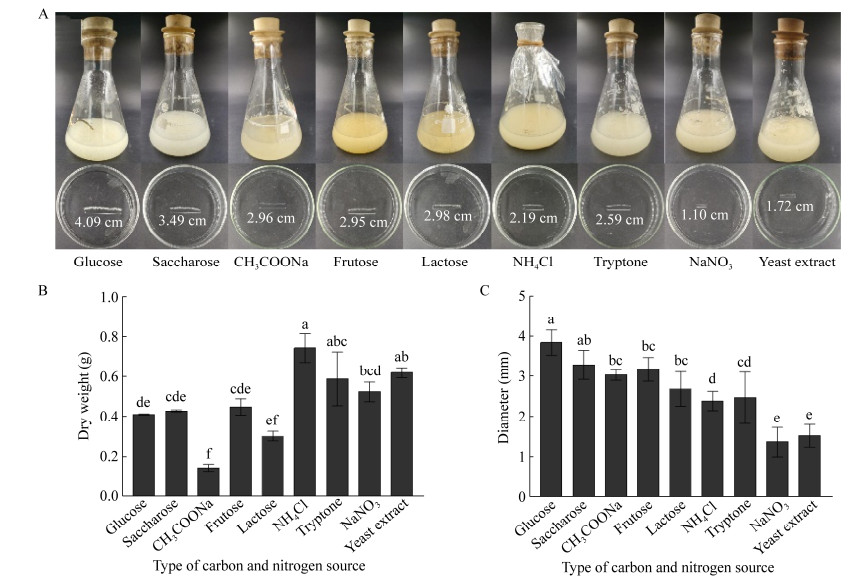
|
| 图 9 碳氮源对菌丝球干重及大小的影响 Figure 9 Effects of carbon and nitrogen sources on the dry weight and diameters of Aspergillus niger pellets. A:菌丝球图片; B:菌丝球干重; C:菌丝球直径大小。不同小写字母代表显著性差异(P < 0.05) A: Images of A. niger pellets; B: Dry weight of A. niger pellets; C: Diameters of A. niger pellets. Different lowercase letters indicate significant differences among the treatments (P < 0.05). |
|
|
与不添加额外氮源组相比,外源添加的氯化铵、胰蛋白胨、硝酸钠和酵母提取粉组生物量分别增加84.44%、43.07%、27.37%和50.71% (图 9B),这与氯化铵提高黑曲霉Y3生物量,蛋白胨、酵母提取粉促使土曲霉M11生物量增加的结果一致[30, 40],可能由于黑曲霉可以直接摄取无机氮供生长使用,也可以通过胞外酶将蛋白质等复杂氮源分解为小分子以满足生长所需,但对不同有机氮、无机氮的分解吸收效率不同[41]。然而,外源添加氯化铵、胰蛋白胨、硝酸钠和酵母提取粉所得菌丝球直径分别减小了46.45%、36.67%、73.10%和57.95% (图 9C),这与蛋白胨降低黑曲霉Y3直径,蛋白胨、氯化铵的添加使黑曲霉557粒径减少的结果相同[37, 40]。
2.3 黑曲霉对结晶紫的吸附应用 2.3.1 黑曲霉形态对结晶紫吸附能力的影响将黑曲霉菌丝球加入结晶紫溶液后发现,吸附初期,结晶紫浓度迅速下降,2 h后菌丝球对结晶紫吸附速率下降,6 h吸附趋于平衡(图 10)。说明黑曲霉RAF106除用于降解黄曲霉毒素B1、生物转化茶多酚外[14-15],还可用于废水处理。为了探究黑曲霉菌体形态对结晶紫吸附能力的影响,测定了不同直径的菌丝球及分散菌丝对结晶紫的吸附效果。结果表明菌丝球对结晶紫的吸附率随直径升高而降低。与直径为1.55 mm的菌丝球(其结晶紫吸附率为94.44%)相比,直径为2.16、3.63、3.75、4.71 mm的菌丝球对结晶紫的吸附率分别下降1.69%、1.92%、2.38%、2.54% (图 11);而分散菌丝对结晶紫的吸附率为94.89% (图 11),这表明黑曲霉菌丝球对结晶紫的吸附率与直径成反比,分散菌丝形态更有利于吸附结晶紫。这与不同粒径的微紫青霉菌丝球粉末对刚果红的吸附、海洋黑曲霉游离菌丝对染料的吸附结果相同[24, 42]。因为在湿重相同条件下,不同形态的黑曲霉比表面积越大,提供给染料的吸附位点相应增加,因此吸附量也增加[24]。
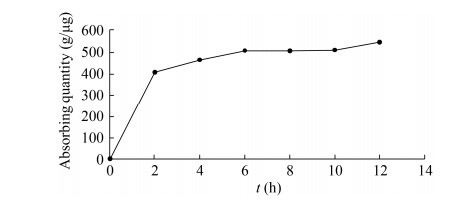
|
| 图 10 孵育12 h内黑曲霉菌丝球对结晶紫吸附 Figure 10 Biosorption of crystal violet with Aspergillus niger pellets during an incubation of 12 h. |
|
|
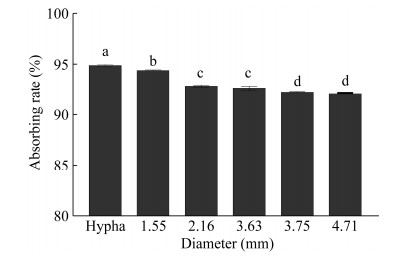
|
| 图 11 黑曲霉不同菌丝球大小及分散菌丝状对结晶紫的吸附效果 Figure 11 Biosorption of crystal violet with Aspergillus niger pellets with different diameters and dispersal hyphae. Different lowercase letters indicate significant differences among the treatments (P < 0.05). |
|
|
为进一步了解菌丝球吸附结晶紫的吸附机制,分别用准一级动力学模型(图 12A)、准二级动力学模型(图 12B)对所得数据进行模拟。结果表明用准二级动力学模拟拟合得到线性相关系数较高(R2 > 0.99),由此可知黑曲霉RAF106吸附结晶紫过程遵循准二级动力学模型。这与海洋黑曲霉ZJUBE-1菌丝球对刚果红的吸附、普鲁兰多糖菌丝球对亚甲基蓝和甲基橙的吸附、短刺小克银汉霉(Cuuninghamella echinulata)菌丝球对孔雀绿的吸附结果一致[43-45],表明染料吸附速率主要由化学吸附过程控制,与吸附剂和染料的化学性质有关。
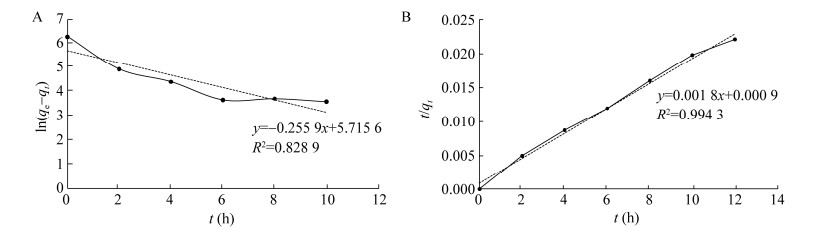
|
| 图 12 菌丝球对结晶紫吸附的准一级动力学拟合(A)和准二级动力学拟合(B) Figure 12 The plot for fitting the model of pseudo-first-order kinetic (A) and pseudo-second-order kinetic (B). |
|
|
黑曲霉RAF106以孢子成球及菌丝聚集成球2种方式形成菌丝球,形成菌丝球的大小与培养液初始pH和孢子接种量成反比,与摇床转速无关; 当温度低于35 ℃时与温度成正比,温度高于35 ℃时则与温度成反比; 以葡萄糖为碳源更有利于菌丝球的形成,而外源添加氮源不利于形成菌丝球。菌丝球生物量与初始pH、摇床转速及温度无关而与接种量成正比,而且受不同碳氮源的影响。
除用于黄曲霉毒素B1降解、茶多酚生物转化[14-15]外,黑曲霉RAF106还可以吸附结晶紫,其吸附能力与菌体形态密切相关。分散菌丝状较菌丝球更利于结晶紫吸附,而且菌丝球大小与结晶紫吸附能力成反比。通过动力学模拟发现,黑曲霉RAF106菌丝球对结晶紫的吸附更符合准二级动力学,说明黑曲霉RAF106对结晶紫的吸附属于化学吸附过程。本文研究结果将有利于优化发酵体系,控制黑曲霉菌体形态,提升黑曲霉的应用效能。
| [1] |
Meyer V. Genetic engineering of filamentous fungi: progress, obstacles and future trends[J]. Biotechnology Advances, 2008, 26(2): 177-185. DOI:10.1016/j.biotechadv.2007.12.001 |
| [2] |
Du LQ, Gao BL, Liang JF, Wang Y, Xiao YW, Zhu D. Microparticle-enhanced Chaetomium globosum DX-THS3 β-d-glucuronidase production by controlled fungal morphology in submerged fermentation[J]. 3 Biotech, 2020, 10(3): 100. DOI:10.1007/s13205-020-2068-y |
| [3] |
Saberi A, Jalili H, Nikfarjam A, Koohsorkhi J, Jarmoshti J, Bizukojc M. Monitoring of Aspergillus terreus morphology for the lovastatin production in submerge culture by impedimetry[J]. Biochemical Engineering Journal, 2020, 159: 107615. DOI:10.1016/j.bej.2020.107615 |
| [4] |
Moore J, Bushell ME. The effect of morphology and oxygen uptake on penicillin production by Aspergillus nidulans in submerged culture[J]. Mycological Research, 1997, 101(10): 1237-1241. DOI:10.1017/S0953756297003882 |
| [5] |
Ji XJ, Ren LJ, Nie ZK, Huang H, Ouyang PK. Fungal arachidonic acid-rich oil: research, development and industrialization[J]. Critical Reviews in Biotechnology, 2014, 34(3): 197-214. DOI:10.3109/07388551.2013.778229 |
| [6] |
Prosser JI, Tough AJ. Growth mechanisms and growth kinetics of filamentous microorganisms[J]. Critical Reviews in Biotechnology, 1991, 10(4): 253-274. DOI:10.3109/07388559109038211 |
| [7] |
Miyazawa K, Yoshimi A, Abe K. The mechanisms of hyphal pellet formation mediated by polysaccharides, α-1, 3-glucan and galactosaminogalactan, in Aspergillus species[J]. Fungal Biology and Biotechnology, 2020, 7(1): 10. DOI:10.1186/s40694-020-00101-4 |
| [8] |
Papagianni M, Mattey M. Morphological development of Aspergillus niger in submerged citric acid fermentation as a function of the spore inoculum level. Application of neural network and cluster analysis for characterization of mycelial morphology[J]. Microbial Cell Factories, 2006, 5: 3. DOI:10.1186/1475-2859-5-3 |
| [9] |
Dhillon GS, Brar SK, Kaur S, Verma M. Bioproduction and extraction optimization of citric acid from Aspergillus niger by rotating drum type solid-state bioreactor[J]. Industrial Crops and Products, 2013, 41: 78-84. DOI:10.1016/j.indcrop.2012.04.001 |
| [10] |
Patel H, Chapla D, Divecha J, Shah A. Improved yield of α-L-arabinofuranosidase by newly isolated Aspergillus niger ADH-11 and synergistic effect of crude enzyme on saccharification of maize stover[J]. Bioresources and Bioprocessing, 2015, 2(1): 11. DOI:10.1186/s40643-015-0039-7 |
| [11] |
Driouch H, Sommer B, Wittmann C. Morphology engineering of Aspergillus niger for improved enzyme production[J]. Biotechnology and Bioengineering, 2010, 105(6): 1058-1068. |
| [12] |
Liu XM, Xin BP, Xu WG, Li ZH, Li W. Study on adsorption of water soluble dyes by Aspergillus niger[J]. Environmental Protection of Chemical Industry, 2005, 25(5): 341-345. (in Chinese) 刘效梅, 辛宝平, 徐文国, 李智慧, 李玮. 黑曲霉对水溶性染料的吸附研究[J]. 化工环保, 2005, 25(5): 341-345. DOI:10.3969/j.issn.1006-1878.2005.05.002 |
| [13] |
Tsekova K, Todorova D, Ganeva S. Removal of heavy metals from industrial wastewater by free and immobilized cells of Aspergillus niger[J]. International Biodeterioration & Biodegradation, 2010, 64(6): 447-451. |
| [14] |
Fang X, Du MR, Liu T, Fang QA, Liao ZL, Zhong QP, Chen JW, Meng XL, Zhou SY, Wang J. Changes in the biotransformation of green tea catechins induced by different carbon and nitrogen sources in Aspergillus niger RAF106[J]. Frontiers in Microbiology, 2019, 10: 2521. DOI:10.3389/fmicb.2019.02521 |
| [15] |
Fang QA, Du MR, Chen JW, Liu T, Zheng Y, Liao ZL, Zhong QP, Wang L, Fang X, Wang J. Degradation and detoxification of aflatoxin B1 by tea-derived Aspergillus niger RAF106[J]. Toxins, 2020, 12(12): 777. DOI:10.3390/toxins12120777 |
| [16] |
Huang XJ, Diao NN, Zhang JG. Review on the formation of Aspergillus niger pellets and its application[J]. Food and Fermentation Industries, 2014, 40(11): 171-176. (in Chinese) 黄勋娟, 刁宁宁, 张建国. 黑曲霉菌丝球的形成及应用研究综述[J]. 食品与发酵工业, 2014, 40(11): 171-176. |
| [17] |
Grimm LH, Kelly S, Hengstler J, Göbel A, Krull R, Hempel DC. Kinetic studies on the aggregation of Aspergillus niger conidia[J]. Biotechnology and Bioengineering, 2004, 87(2): 213-218. DOI:10.1002/bit.20130 |
| [18] |
Paul GC, Priede MA, Thomas CR. Relationship between morphology and citric acid production in submerged Aspergillus niger fermentations[J]. Biochemical Engineering Journal, 1999, 3(2): 121-129. DOI:10.1016/S1369-703X(99)00012-1 |
| [19] |
Lu T. The pellet-formation mechanism of marine-derived Aspergillus niger and its applications in Dye-wastewater treatment[D]. Hangzhou: Doctoral Dissertation of Zhejiang University, 2016 (in Chinese) 陆涛. 海洋黑曲霉菌丝球的形成机理及其对含染料废水的脱色作用[D]. 杭州: 浙江大学博士学位论文, 2016 |
| [20] |
Krull R, Wucherpfennig T, Esfandabadi ME, Walisko R, Melzer G, Hempel DC, Kampen I, Kwade A, Wittmann C. Characterization and control of fungal morphology for improved production performance in biotechnology[J]. Journal of Biotechnology, 2013, 163(2): 112-123. DOI:10.1016/j.jbiotec.2012.06.024 |
| [21] |
Liu YS, Wu JY. Effects of Tween 80 and pH on mycelial pellets and exopolysaccharide production in liquid culture of a medicinal fungus[J]. Journal of Industrial Microbiology & Biotechnology, 2012, 39(4): 623-628. |
| [22] |
Zhang YZ, Wang QQ, Liu JS, Gan Q, Zhang L, Liu MX. Effect of culture conditions on forming mycelial pellets of Penicillium citrinum and its application for treatment of waste water[J]. Amino Acids & Biotic Resources, 2003, 25(1): 44-47. (in Chinese) 张一竹, 王清棋, 刘剑书, 甘泉, 张莉, 刘曼西. 橘青霉菌丝球形成条件及其处理废水的应用[J]. 氨基酸和生物资源, 2003, 25(1): 44-47. DOI:10.3969/j.issn.1006-8376.2003.01.015 |
| [23] |
Colin VL, Baigorí MD, Pera LM. Tailoring fungal morphology of Aspergillus niger MYA 135 by altering the hyphal morphology and the conidia adhesion capacity: biotechnological applications[J]. AMB Express, 2013, 3(1): 27. DOI:10.1186/2191-0855-3-27 |
| [24] |
Wang MX. Preparation of marine Penicillium janthinellum pellet and its application in biosorption of dyes[D]. Hangzhou: Master's Thesis of Zhejiang University, 2014 (in Chinese) 王明霞. 海洋微紫青霉菌丝球的制备及其对染料吸附性能的研究[D]. 杭州: 浙江大学硕士学位论文, 2014 |
| [25] |
Yuan X, Liu YX, Liang T. Globular conditions optimization of Penicillium sp. and its application in immobilization and decolorization[J]. Chinese Journal of Environmental Engineering, 2019, 13(10): 2434-2441. (in Chinese) 袁鑫, 刘玉香, 梁涛. 青霉成球条件优化及其在固定化和脱色中的应用[J]. 环境工程学报, 2019, 13(10): 2434-2441. DOI:10.12030/j.cjee.201812169 |
| [26] |
Papagianni M. Fungal morphology and metabolite production in submerged mycelial processes[J]. Biotechnology Advances, 2004, 22(3): 189-259. DOI:10.1016/j.biotechadv.2003.09.005 |
| [27] |
Braun S, Vecht-Lifshitz SE. Mycelial morphology and metabolite production[J]. Trends in Biotechnology, 1991, 9(1): 63-68. DOI:10.1016/0167-7799(91)90020-I |
| [28] |
Wang CS, Zhi YN, Zhao FP, Hou MY, Chen LJ. Research on biological characteristics of the aroma-producing fungus GS-1 strain[J]. Journal of Xinyang Agriculture and Forestry University, 2020, 30(4): 114-116, 125. (in Chinese) 王春生, 智亚楠, 赵付平, 侯梦圆, 陈利军. 产香真菌GS-1菌株的生物学特性研究[J]. 信阳农林学院学报, 2020, 30(4): 114-116, 125. |
| [29] |
Dong XJ, Chen J, Jin YB. The effects of physical and chemical conditions on forming mycelial pellet of Penicillum X5 and decolorization of dye[J]. Journal of Gansu Sciences, 2006, 18(1): 57-59. (in Chinese) 董新姣, 陈俊, 金煜彬. 青霉菌菌丝球形成条件及对染料脱色效果的研究[J]. 甘肃科学学报, 2006, 18(1): 57-59. DOI:10.3969/j.issn.1004-0366.2006.01.014 |
| [30] |
Wang HM. The relationship between mycelial pellets and the production of endo-β-1, 4-glucanase of thermoacidophilic Aspergillus terreus M11 under different submerged culture conditions[D]. Zhengzhou: Master's Thesis of Zhengzhou University, 2011 (in Chinese) 王会敏. 嗜热真菌土曲霉M11液体发酵时菌丝球形态与发酵产酶的关系[D]. 郑州: 郑州大学硕士学位论文, 2011 |
| [31] |
Chen SY. Study on the liquid culture condition of Camellia sinensis[J]. Journal of Hubei Normal University: Natural Science, 2004, 24(2): 69-71, 92. (in Chinese) 陈少英. 茶树菇液体培养条件的研究[J]. 湖北师范学院学报: 自然科学版, 2004, 24(2): 69-71, 92. |
| [32] |
Li YL, Chen WD, Teng SY, Gao SC. Optimized culture of liquid strains of Hohenbuehelia serotina[J]. Journal of Anhui Agricultural Sciences, 2016, 44(26): 1-3. (in Chinese) 李延雷, 陈炜东, 滕素岩, 高书成. 元蘑液体菌种的优化培养[J]. 安徽农业科学, 2016, 44(26): 1-3. |
| [33] |
Ibrahim D, Weloosamy H, Lim SH. Effect of agitation speed on the morphology of Aspergillus niger HFD5A-1 hyphae and its pectinase production in submerged fermentation[J]. World Journal of Biological Chemistry, 2015, 6(3): 265-271. DOI:10.4331/wjbc.v6.i3.265 |
| [34] |
Li W. Morphological engineering and fermentation process optimization of deep sea fungi against aflatoxin[D]. Harbin: Master's Thesis of Harbin Institute of Technology, 2018 (in Chinese) 李伟. 抗黄曲霉毒素的深海真菌的形态工程及发酵过程优化[D]. 哈尔滨: 哈尔滨工业大学硕士学位论文, 2018 |
| [35] |
Zhu WL. Effects of stirring speed on mycelial morphology and clavulanic acid yield in batch fermentation of Streptomyces clavulanicus[J]. China Academic Journal Electronic Publishing House, 1992, 13(2): 149-150. (in Chinese) 朱薇玲. 在棒状链霉菌分批发酵中搅拌转速对菌丝形态学及克拉维酸产量的影响[J]. 国外医药: 抗生素分册, 1992, 13(2): 149-150. |
| [36] |
Abd-Elsalam I IS. Role of the biomass and pelleted forms of Aspergillus ochraceus ATCC 3150 on the 11α-hydroxylation of progesterone[J]. Malaysian Journal of Microbiology, 2009, 5(2): 119-122. |
| [37] |
Wu CH. Study on the growth regulation and modification of mycelial pellets of Aspergillus niger 557 by optimized culture system[D]. Harbin: Master's Thesis of Harbin Institute of Technology, 2020 (in Chinese) 吴成昊. 优化扩培体系对黑曲557菌丝球的生长调控及改性研究[D]. 哈尔滨: 哈尔滨工业大学硕士学位论文, 2020 |
| [38] |
Zhang QY. Research of mycelium pellets' culture conditions optimization and it's biological carrier's characteristics[D]. Harbin: Master's Thesis of Harbin Institute of Technology, 2019 (in Chinese) 张晴宇. 菌丝球培养条件优化及其生物载体特性研究[D]. 哈尔滨: 哈尔滨工业大学硕士学位论文, 2019 |
| [39] |
Yan YL, Ma YH. Effects of different carbon and nitrogen sources on mycelial biomass in liquid culture of Bamboo Sun[J]. Edible Fungi, 2006, 28(S1): 26-27. (in Chinese) 闫永亮, 马艳弘. 不同碳氮源对竹荪液体培养菌丝生物量影响[J]. 食用菌, 2006, 28(S1): 26-27. |
| [40] |
Ma F, Zhang S, Shan D. Optimization of the medium composition for culturing of mycelia pellet of Aspergillus niger Y3[J]. China Environmental Science, 2008, 28(11): 989-993. (in Chinese) 马放, 张斯, 山丹. 黑曲霉Y3菌丝球培养基成分优化[J]. 中国环境科学, 2008, 28(11): 989-993. DOI:10.3321/j.issn:1000-6923.2008.11.006 |
| [41] |
Pei XY. Research on enhanced harvesting of Scenedesmus biomass by immobilization of Aspergillus niger mycelia pellet[D]. Harbin: Master's Thesis of Harbin Institute of Technology, 2017 (in Chinese) 裴轩瑗. 黑曲霉菌丝球固定栅藻强化生物量的采收[D]. 哈尔滨: 哈尔滨工业大学硕士学位论文, 2017 |
| [42] |
Lu T, Zhang QL. Yao SJ. Adsorption of dyes and insoluble particles by free hyphae of marine Aspergillus niger[A]//Proceedings of 2015 China Chemical Industry Society Annual Meeting[M]. Beijing: The Chemical Industry and Engineering Society of China, 2015 陆涛, 张其磊, 姚善泾. 海洋黑曲霉游离菌丝的对染料和不溶性颗粒的吸附[A]//2015年中国化工学会年会论文集[M]. 北京: 中国化工学会, 2015 |
| [43] |
Lu T, Zhang QL, Yao SJ. Efficient decolorization of dye-containing wastewater using mycelial pellets formed of marine-derived Aspergillus niger[J]. Chinese Journal of Chemical Engineering, 2017, 25(3): 330-337. DOI:10.1016/j.cjche.2016.08.010 |
| [44] |
Ruan XD, Zhang HW, Cai YH, Wang ZY, Su ZC. Adsorption of malachite green by Cuuninghamella echinulata mycelia pellets[J]. Technology of Water Treatment, 2009, 35(8): 50-54. (in Chinese) 阮晓东, 张惠文, 蔡颖慧, 王振宇, 苏振成. 短刺小克银汉霉菌丝球对孔雀绿的吸附研究[J]. 水处理技术, 2009, 35(8): 50-54. |
| [45] |
Chen J, Wei YX, Zhao Y, Zhao D. Adsorption properties of Pullulan pellets of methylene blue and methyl orange dye[J]. Guangzhou Chemical Industry, 2019, 47(17): 84-87, 99. (in Chinese) 陈洁, 魏云霞, 赵苑, 赵丹. 普鲁兰多糖菌丝球对亚甲基蓝和甲基橙染料的吸附[J]. 广州化工, 2019, 47(17): 84-87, 99. |
 2022, Vol. 49
2022, Vol. 49