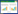扩展功能
文章信息
- 吴芷莹, 金泽源, 李万霞, 曾飞, 朱明卓, 陈少贤, 彭文仪, 徐艳萍, 童贻刚, 柏琴琴
- WU Zhiying, JIN Zeyuan, LI Wanxia, ZENG Fei, ZHU Mingzhuo, CHEN Shaoxian, PENG Wenyi, XU Yanping, TONG Yigang, BAI Qinqin
- PB1样铜绿假单胞菌噬菌体PHW2的生物学特性
- Characterization of a PB1-like phage PHW2 infecting Pseudomonas aeruginosa
- 微生物学通报, 2021, 48(9): 3205-3217
- Microbiology China, 2021, 48(9): 3205-3217
- DOI: 10.13344/j.microbiol.china.210205
-
文章历史
- 收稿日期: 2021-03-01
- 接受日期: 2021-07-06
- 网络首发日期: 2021-07-30
2. 北京化工大学生命科学与技术学院 北京 100029;
3. 军事科学院军事医学研究院微生物流行病研究所 病原微生物生物安全国家重点实验室 北京 100071
2. College of Life Science and Technology, Beijing University of Chemical Technology, Beijing 100029, China;
3. State Key Laboratory of Pathogenic Microbiology Safety, Institute of Microbiological Epidemiology, Institute of Military Medicine, Academy of Military Sciences, Beijing 100071, China
铜绿假单胞菌(Pseudomonas aeruginosa)是专性需氧非发酵革兰氏阴性杆菌,常引起医院感染,可致呼吸机相关肺炎局部化脓性炎症、角膜炎和中耳炎等疾病,其感染病灶可通过血行传播引发菌血症和败血症等[1]。根据2018年全国细菌耐药监测报告显示,尽管多重耐药铜绿假单胞菌(Multidrug Resistant Pseudomonas aeruginosa,MDRPA)的分离率总体呈下降趋势,但依然是引起严重医院感染的常见病因,世界卫生组织将碳青霉烯类耐药的铜绿假单胞菌列为急需研发新型抗菌药物的细菌之一[2-3]。因此,针对碳青霉烯类耐药的铜绿假单胞菌研发新型抗菌制剂成为目前的研究热点。
噬菌体是抗生素之外的另一可行选择,大量动物实验和部分临床治疗个案都显示了噬菌体治疗多重耐药铜绿假单胞菌的可行性[4-5]。最近的研究表明噬菌体能有效破坏铜绿假单胞菌生物膜[6]。然而,应用噬菌体治疗铜绿假单胞菌还面临着许多问题,例如宿主范围窄、细菌快速产生的噬菌体抗性等[7]。现有的研究表明噬菌体鸡尾酒疗法是可能的解决方案之一,尤其是利用不同受体的噬菌体的组合,既可以拓宽宿主范围又可以降低细菌耐受噬菌体频率,是当前临床治疗实验中常用的策略[8]。噬菌体鸡尾酒疗法的顺利开展依赖于已知生物学特性的噬菌体资源库的建立。本研究以碳青霉烯类耐药的铜绿假单胞菌为指示菌,采集环境水样分离烈性噬菌体,研究其生物学特性和基因组特征,并评价其作为生防制剂控制多重耐药铜绿假单胞菌感染的潜力,以期为铜绿假单胞菌的噬菌体治疗提供资源储备。
1 材料与方法 1.1 材料 1.1.1 菌株本实验所用10株铜绿假单胞菌、20株鲍曼不动杆菌和1株大肠埃希菌均由本实验室保存。
1.1.2 主要试剂和仪器LB培养基,北京索莱宝科技有限公司。
SM缓冲液:NaCl 5.8 g/L,MgSO4·7H2O 2.0 g/L,Tris-HCl (pH 7.5) 50 mmol/L,明胶0.1 g/L。
恒温培养箱,TAISETE公司;恒温振荡器,上海智诚分析仪器制造有限公司;高速冷冻离心机,安徽中科中佳科学仪器有限公司;VITEK2 Compact全自动细菌鉴定及药敏分析系统,梅里埃公司;透射电镜,HITACHI公司。
1.2 宿主菌的准备将滤纸法保存的菌种分别接种于LB液体培养基中,37 ℃、180 r/min振荡培养过夜,进行平板划线并挑单菌落接种于LB液体培养基中,37 ℃、180 r/min振荡培养至对数生长期(OD595约为0.3),4 ℃保存备用。
1.3 药敏试验采用VITEK2 Compact全自动细菌鉴定及药敏分析系统进行药敏试验,根据美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)的药敏试验标准(2016年版)判定结果,并依据李春辉等[9]的多重耐药(Multidrug Resistant,MDR)菌标准定义将结果进行分类。
1.4 噬菌体分离纯化用无菌带塞玻璃瓶采集水下10-15 cm处的水样,50 r/min振荡混匀15 min,4 ℃、10 000×g离心10 min。取50 mL离心处理后的水样上清加至50 mL含2 mmol/L CaCl2的2×LB液体培养基中,再加入1 mL培养过夜的混合宿主菌悬液,于37 ℃、150 r/min振荡培养过夜。4 ℃、10 000×g离心10 min,用0.22 μm滤膜过滤以除去细菌,将噬菌体滤液4 ℃保存待用。参照Beeton等[10]的方法,将样品滤液进行10倍梯度稀释,取100 μL稀释后的样品铺双层琼脂平板,37 ℃倒置培养过夜,直到长出单个噬菌斑。挑取单个噬菌斑,在1 mL SM缓冲液中混匀,4 ℃、4 000×g离心10 min,取0.1 mL经过10倍梯度稀释后用双层琼脂平板法纯化,重复上述过程3-5次。然后取100 μL纯化得到的单斑滤液与100 μL宿主菌混合铺双层琼脂平板。待平板上的噬菌斑完全融合生长,在平板上加入5 mL SM缓冲液,4 ℃、50 r/min摇床振荡4 h后,收集液体4 ℃、4 000×g离心10 min,0.22 μm滤膜过滤,4 ℃保存,并用双层琼脂平板法测定滴度。
1.5 噬菌体电镜观察及宿主范围测定取对数生长期(OD595约为0.3)的铜绿假单胞菌3 mL,加入300 μL浓度为1×107 PFU/mL的噬菌体滤液,37 ℃、180 r/min振荡培养10 h至液体澄清,将增殖液4 ℃、10 000×g离心10 min,0.22 μm滤膜过滤,使用100 kD超滤离心管4 ℃、3 000×g超滤离心10 min,得到噬菌体浓缩液,加入戊二醛使终浓度为2.5%,4 ℃灭活2 h后送至科学指南针实验室(www.shiyanjia.com)进行透射电镜观察,选取多个视野,记录噬菌体病毒粒子的形态结构。
选取10株铜绿假单胞菌、20株鲍曼不动杆菌、1株大肠埃希菌作为测试菌,参照Kutter等[11]的方法,用点滴法测试噬菌体PHW2的宿主范围。
1.6 噬菌体最佳感染复数(Multiplicity of Infection,MOI)、吸附曲线及一步生长曲线 1.6.1 噬菌体最佳感染复数参照Hyman等[12]的方法,并略做修改。取对数生长期(OD595为0.3)铜绿假单胞菌,将噬菌体稀释为1×109、1×108、1×107、1×106、1×105、1×104、1×103 PFU/mL,以感染复数分别为10、1、0.1、0.01、0.001、0.000 1、0.000 01的比例将宿主菌与噬菌体各200 μL混合,37 ℃、180 r/min振荡培养8 h,4 ℃、10 000×g离心3 min,0.22 μm滤膜过滤,双层琼脂平板法测定噬菌体效价,以培养末期噬菌体效价最高的MOI为最佳感染复数。
1.6.2 噬菌体吸附曲线吸附曲线测定参照Hyman等[12]进行。将宿主菌培养至对数生长期(OD595为0.3),取9 mL宿主菌与1 mL 1×105 PFU/mL的噬菌体混合,从0–10 min每隔2 min取样50 μL,用双层琼脂平板法测定上清液中噬菌体效价。以时间为横坐标,吸附率为纵坐标绘制吸附曲线。
1.6.3 噬菌体一步生长曲线参照Hyman等[12]测定噬菌体的一步生长曲线。将9 mL 1×108 CFU/mL细菌悬液与1 mL 1×108 PFU/mL噬菌体悬液(MOI=0.1)混合,37 ℃孵育10 min后于180 r/min振荡培养,从0时刻开始每隔50 min取样500 μL,立即4 ℃、10 000×g离心2 min,取上清测定噬菌体的效价。以取样时间为横坐标,噬菌体效价的对数为纵坐标绘制一步生长曲线,判断潜伏期、裂解期并计算裂解量。裂解量=裂解末期噬菌体效价/初始宿主菌浓度。
1.7 噬菌体对温度和pH的稳定性 1.7.1 噬菌体对温度的稳定性将1×106 PFU/mL的噬菌体悬液分别在25、37、50、60、70和80 ℃水浴20 min,用双层琼脂平板法测定噬菌体的效价,绘制噬菌体受温度影响的曲线。
1.7.2 噬菌体对pH的稳定性将10 μL 1×108 PFU/mL的噬菌体原液加入至990 μL不同pH的SM缓冲液中,4 ℃冰箱静置,分别在1、3、5 d时用双层琼脂法测定噬菌体效价,绘制噬菌体效价在不同保存时间受pH影响的曲线。
1.8 噬菌体对紫外线和氯仿的敏感性 1.8.1 噬菌体对紫外线的敏感性参照蔡俊鹏等[13]的方法,略有改动。取10 mL 1×106 PFU/mL噬菌体原液于培养皿中,放入超净工作台中,距离紫外灯30 cm,打开紫外灯照射,分别于0、1、2、3、4、5、7 min取样,用双层琼脂平板法测定噬菌体效价,绘制噬菌体效价受紫外线影响的曲线。
1.8.2 噬菌体对氯仿的敏感性参照Chen等[14]的方法,略有修改。取950 μL 1×105 PFU/mL噬菌体原液与50 μL氯仿混合,使混合液中氯仿浓度为5%,分别在0、20、40、80、100、120、140 min时用双层琼脂平板法测定噬菌体的效价,绘制噬菌体效价受氯仿影响的曲线。
1.9 噬菌体的全基因组测序及生物信息学分析将噬菌体送军事医学科学院微生物流行病研究所组学与生物信息学研究室构建文库,采用Illumina MiSeq平台进行测序,利用Newbler 3.0拼接序列。用GeneMarkS (http://exon.gatech.edu/GeneMark/genemarks.cgi)[15]对ORF进行预测,用BLASTp (https://blast.ncbi.nlm.nih.gov/Blast.cgi)在NCBI和UniProt数据库中逐一比对开放阅读框以核对注释。利用tRNAscan-SE V2.0 (http://trna.ucsc.edu/tRNAscan-SE/)预测tRNA[16]。使用软件Mauve 2.4.0[17]进行比较基因组分析,MEGA 6.0软件以Neighbor-Joining法构建进化树。
1.10 噬菌体PHW2对铜绿假单胞菌PA001生物被膜的影响 1.10.1 噬菌体PHW2对铜绿假单胞菌PA001生物被膜的抑制作用取待测菌的菌液1:100接种到LB液体培养基中,37 ℃、180 r/min培养过夜,用LB液体培养基1:100稀释后,每孔200 μL接种到含有2 mL LB液体培养基的24孔细胞培养板中,按照最佳感染复数将噬菌体与指示菌混合,37 ℃静置培养12、24、36及48 h。加入SM缓冲液的孔作为对照。培养结束后,吸弃上清,每孔加入500 μL灭菌磷酸盐缓冲溶液(Phosphate Buffered Saline,PBS)反复冲洗,以洗涤未黏附的浮游态细菌。自然风干后,每孔加入200 μL 0.1%结晶紫室温染色30 min。弃去染色液,再用200 μL/孔的灭菌PBS溶液洗涤3次。室温干燥后,每孔加入200 μL 33%乙酸处理30 min,测量OD595。实验重复3次。
1.10.2 噬菌体PHW2对铜绿假单胞菌PA001生物被膜的清除作用将待测菌液1:100稀释后接种于每孔含有2 mL LB液体培养基的24孔细胞培养板中。分别培养12 h和24 h后用500 μL灭菌的0.01 mol/L PBS反复冲洗细胞培养板,以最佳感染复数加入噬菌体PHW2悬液200 μL,加SM缓冲液的孔作为对照。培养结束后,通过结晶紫染色法检测噬菌体是否清除已形成的生物被膜。实验重复3次。
2 结果与分析 2.1 药敏试验药敏试验结果显示31株细菌中,8株铜绿假单胞菌、19株鲍曼不动杆菌和1株大肠埃希菌A002为多重耐药菌株。10株铜绿假单胞菌中,有8株对碳青霉烯类药物耐药(表 1)。
| 菌株 Strains |
编号 No. |
菌株样本来源 Samples of strains isolated |
耐药性 Drug resistance |
碳青霉烯类耐药 Carbapenem-resistance |
裂解性 Lytic ability |
| P. aeruginosa | PA001 | Blood | DR | S | ++++ |
| PAK389 | Sputum | MDR | R | ++++ | |
| PAK393 | Sputum | MDR | R | +++ | |
| PAK399 | Sputum | MDR | R | ++++ | |
| PAK407 | Sputum | MDR | R | ++++ | |
| PAK446 | Sputum | MDR | S | ++++ | |
| PAK452 | Sputum | MDR | R | +++ | |
| PAK460 | Sputum | MDR | R | +++ | |
| PAK461 | Sputum | MDR | R | - | |
| PAK484 | Sputum | DR | R | ++++ | |
| A. baumannii | Ab1 | Sputum | MDR | R | - |
| AB10 | Sputum | MDR | R | - | |
| AB12 | Blood | MDR | R | - | |
| AB13 | Wound secretion | MDR | R | - | |
| AB15 | Ascites fluid | DR | S | - | |
| AB93 | Urine | MDR | R | - | |
| AB94 | Sputum | MDR | R | - | |
| AB95 | Sputum | MDR | R | + | |
| AB96 | Sputum | MDR | R | - | |
| ABK0097 | Sputum | MDR | R | - | |
| ABK442 | Sputum | MDR | R | +++ | |
| ABK443 | Sputum | MDR | R | + | |
| ABK445 | Cerebrospinal fluid | MDR | R | - | |
| ABK447 | Sputum | MDR | R | ++ | |
| ABK448 | Sputum | MDR | R | - | |
| ABK450 | Sputum | MDR | R | - | |
| ABK451 | Sputum | MDR | R | - | |
| ABK454 | Cerebrospinal fluid | MDR | R | - | |
| ABK455 | Sputum | MDR | R | ++ | |
| ABK456 | Sputum | MDR | R | - | |
| E. coli | A002 | Blood | MDR | S | - |
| 注:-:无噬菌斑,不裂解;+:仅出现少量噬菌斑,极弱裂解性;++:半透明区域中有很多浊度,弱裂解性;+++:整个明亮但有些浊度,强裂解性;++++:完全透明,极强裂解性。S:敏感;R:抗性。DR:耐药;MDR:多重耐药 Note: -: No plaque, no lytic ability; +: Only a few single plaques appear, very weak lytic ability; ++: A lot of turbidity in the translucent area, weak lytic ability; +++: The whole plaques are bright but a little turbidity, strong lytic ability; ++++: Completely translucent, very strong lytic ability. S: Sensitive; R: Resistant. DR: Drug resistance; MDR: Multidrug resistance | |||||
在一份水样中分离得到一株噬菌体命名为PHW2,感染宿主PA001可形成边缘整齐、清晰透亮、周围有晕环的噬菌斑(图 1A)。电镜下,该噬菌体头部为正二十面体结构,直径在74-86 nm之间,尾部可伸缩,其长度为148-154 nm (图 1B)。形态符合肌尾病毒科噬菌体(Myoviridae)成员的特征。
|
| 图 1 噬菌体PHW2的噬斑(A)及显微形态(B) Figure 1 The plaque formed by PHW2 (A) and the morphology of phage PHW2 (B) |
|
|
PHW2对9株铜绿假单胞菌有强裂解作用(9/10,90%),包含7株碳青霉烯类耐药菌。对5株鲍曼不动杆菌也有不同程度的裂解能力(5/20,25%),均为碳青霉烯类耐药菌,不裂解大肠埃希菌A002 (表 1)。
2.4 最佳感染复数如表 2所示,MOI为0.1时,子代噬菌体浓度最高,之后随着MOI的降低噬菌体浓度降低,即PHW2的最佳感染复数为0.1。
| 噬菌体数 Numbers of phage (PFU/mL) |
菌落数 Numbers of bacteria (CFU/mL) |
感染复数 Multiplicity of infection (MOI) |
噬菌体效价 Phage titer (PFU/mL) |
| 109 | 108 | 10 | 9.75×109 |
| 108 | 108 | 1 | 1.25×1010 |
| 107 | 108 | 0.1 | 1.75×1010 |
| 106 | 108 | 0.01 | 2.25×109 |
| 105 | 108 | 0.001 | 8.75×108 |
| 104 | 108 | 0.000 1 | 2.50×108 |
| 103 | 108 | 0.000 01 | 2.00×108 |
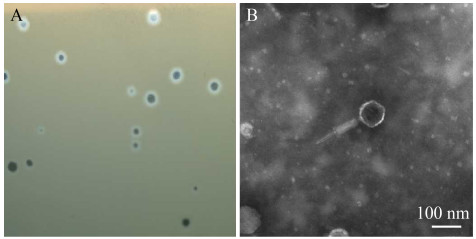
噬菌体PHW2对宿主菌有较强吸附能力(图 2A),其在2 min内可吸附70%,在6 min后可吸附80%,在10 min后可吸附95%。
|
| 图 2 噬菌体PHW2吸附曲线(A)和一步生长曲线(B) Figure 2 Adsorption curve (A) and one-step growth curve (B) of phage PHW2 |
|
|
MOI=0.1的一步生长曲线表明(图 2B),在100 min时噬菌体滴度开始上升,至460 min时滴度趋于平稳。噬菌体PHW2的潜伏期为100 min,裂解期为360 min。根据公式计算裂解量为25 PFU/cell。
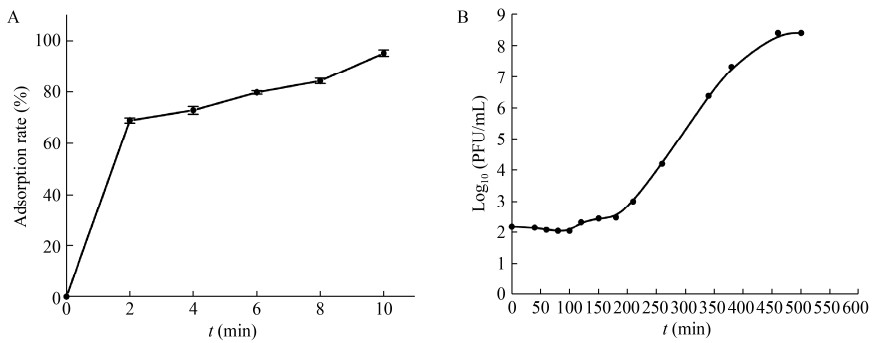
2.6 噬菌体对温度和pH的敏感性噬菌体PHW2在25-50 ℃较稳定(图 3A),在60 ℃处理20 min其浓度略有下降,在70 ℃处理20 min后其浓度低于1×105 PFU/mL。可见PHW2对热的耐受能力较好。噬菌体PHW2在pH 6.0-8.0的范围内显示较高的活性(图 3B),其中pH 7.0活性最高。
|
| 图 3 噬菌体PHW2对温度(A)和pH (B)敏感性 Figure 3 Thermostability (A) and pH (B) stability of phage PHW2 |
|
|
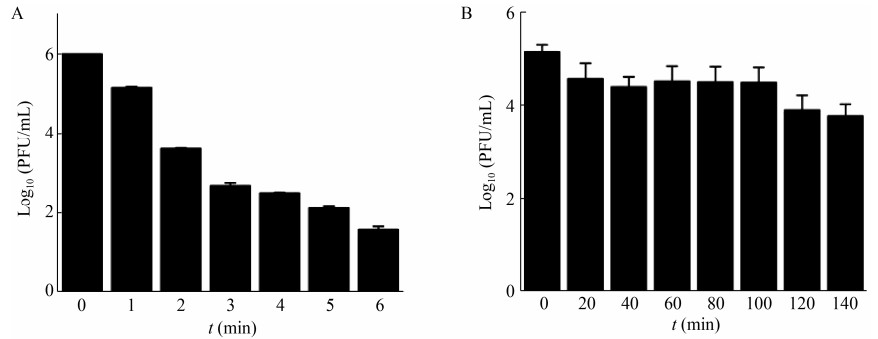
噬菌体PHW2对153.7 nm的紫外线十分敏感(图 4A),照射5 min后80%的噬菌体失活;照射6 min后PHW2活性受到显著影响,滴度下降4 Log10 (PFU/mL)。噬菌体PHW2对5%的氯仿不敏感(图 4B),但在保存超过100 min后,噬菌体滴度会有明显降低。表明在大量制备时,噬菌体PHW2可以应用5%的氯仿进行处理,但作用时间不可过长。
|
| 图 4 噬菌体PHW2对紫外线(A)和5%氯仿的敏感性(B) Figure 4 Sensitivity of PHW2 on ultraviolet ray (A) and 5% chloroform (B) |
|
|
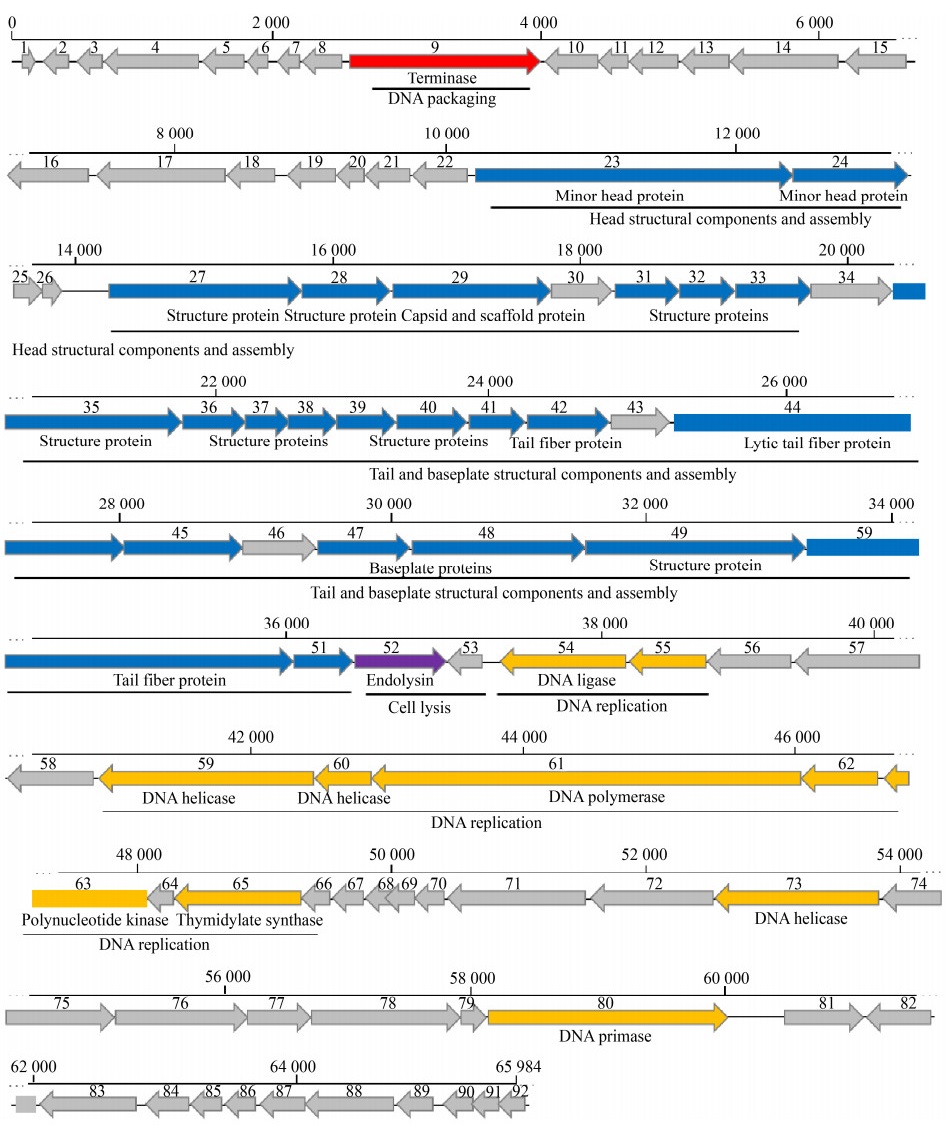
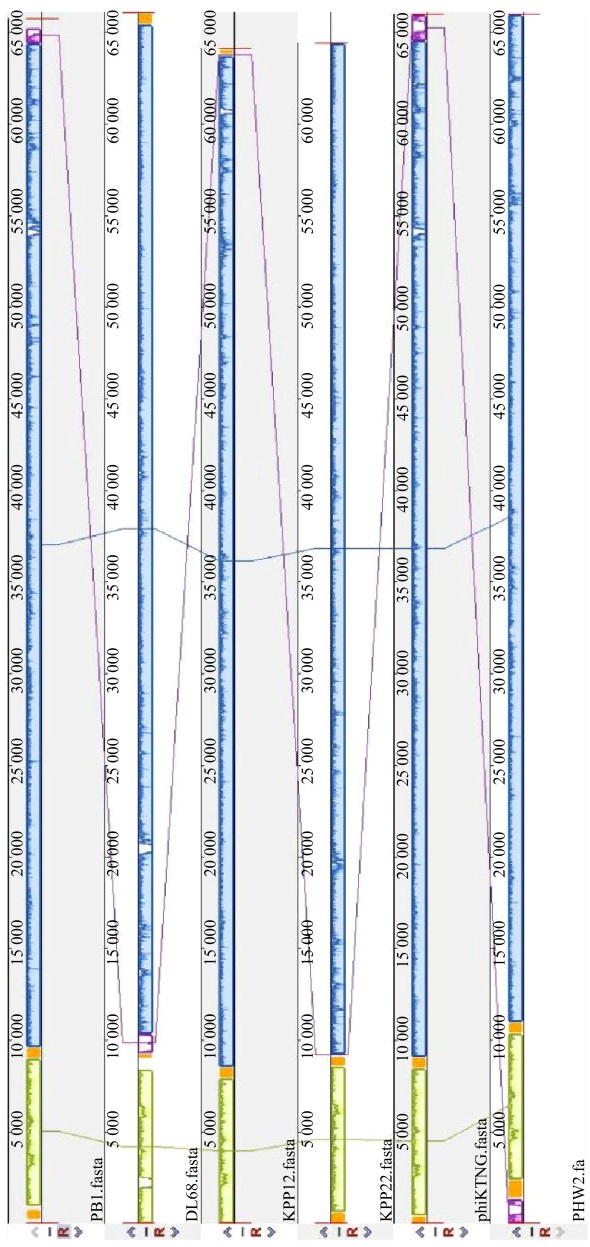
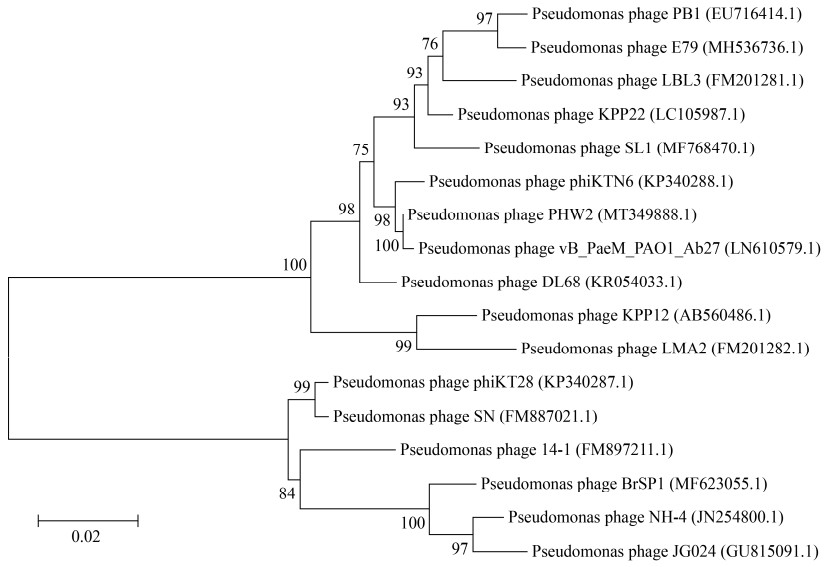
噬菌体PHW2的基因组为线状双股DNA,长65 984 bp,GC含量为55.69%,编码92个ORFs,不含tRNA。42个CDS在NCBI或UniProt数据库中有明确的基因功能注释,分别为噬菌体的结构、DNA包装、转录调控和裂解基因(图 5)。噬菌体PHW2全基因组核酸序列已经提交GenBank,登录号为MT349888.1。基因组比对结果显示PHW2与其他PB1样噬菌体高度相似(图 6)。gp52编码裂解酶,长220 aa,含Glyco_hydro_19结构域,属糖苷酶。gp50为预测的尾丝蛋白。比较不同国家和地区分离的PB1样噬菌体的尾丝蛋白序列发现,各尾丝蛋白的氨基酸序列间相似性达82.0%-99.7%。进化树分析显示PB1样噬菌体的尾丝蛋白形成了2个大的进化分支,其中gp50与噬菌体vB_PaeM_PAO1_Ab27的尾丝蛋白亲缘关系最近,虽与噬菌体PB1和KPP22的尾丝蛋白位于同一个大的进化分支,但有一定的遗传距离(图 7)。
|
| 图 5 噬菌体PHW2的全基因组图 Figure 5 Genomic map of phage PHW2 |
|
|
|
| 图 6 PHW2与PB1样噬菌体基因组比较 Figure 6 Comparison of PHW2 and PB1-like phages genome |
|
|
|
| 图 7 尾丝蛋白gp50的遗传进化分析 Figure 7 Phylogenetic tree constructed based on the tail fiber protein gp50 注:括号中的序号:GenBank序列号;分支点上的数字代表可信度,数值越接近100,可信度越强;标尺:代表遗传距离,标尺越短,亲缘关系越近 Note: The number in bracket: The GenBank accession number; The number at the branch point: The confidence level, the closer to 100 the bootstrap value is, the higher confidence level would be; Scale: The genetic distance, the shorter the scale is, the closer kinship would be |
|
|
将PA001单独培养12、24、36、48 h可以形成生物被膜,并且随时间增加生物被膜的数量也在增加。将PA001与噬菌体PHW2以最佳感染复数混合培养后发现,噬菌体PHW2能够显著抑制PA001生物被膜的形成(图 8)。
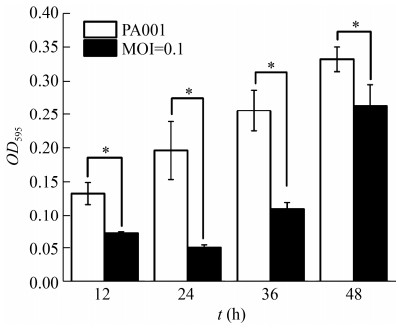
|
| 图 8 PHW2抑制PA001生物被膜的形成 Figure 8 The phage PHW2 inhibits the formation of PA001 biofilm 注:*:显著性差异,P < 0.05 Note: *: Significant difference, P < 0.05 |
|
|
将铜绿假单胞菌PA001培养12 h和24 h后,以最佳感染复数加入噬菌体PHW2后共培养4 h和12 h,发现噬菌体PHW2能够显著清除PA001已经形成的生物被膜(图 9),其中对12 h形成的生物被膜的清除效果较强。
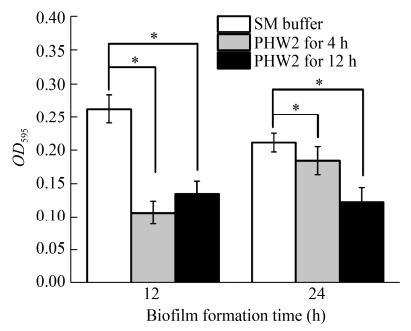
|
| 图 9 PHW2清除PA001已形成的生物被膜 Figure 9 The phage PHW2 removes the biofilm formed by PA001 注:*:显著性差异,P < 0.05 Note: *: Significant difference, P < 0.05 |
|
|
本研究从环境水样中分离到噬菌体PHW2,属于有尾病毒目(Caudovirales)肌尾噬菌体科(Myoviridae)成员,其宿主范围较宽,对MDRPA有很强的裂解能力,而且对部分鲍曼不动杆菌也有抑菌作用,在PHW2可裂解的14株耐药菌中有12株菌对碳青霉烯类药物耐药,提示该噬菌体在防治碳青霉烯类药物耐药的铜绿假单菌方面具有潜在应用价值。PHW2对宿主菌PA001有良好的吸附能力,可在6 min后吸附80%,10 min后可达到95%吸附。最佳MOI为0.1,即少量的噬菌体母液就可以产生大量的子代噬菌体,能够大大提高噬菌体抗菌剂的生产效率。Kalatzis等[18]报道了噬菌体ФSt2和ФGrn1的最佳MOI分别为10和100。曾林等[19]研究的溶藻弧菌噬菌体最佳MOI为10。本研究中的噬菌体PHW2的最佳MOI较低,但是比李明等[20]报道的噬菌体PaP1和张琳等[21]报道的噬菌体PaP4最佳MOI较高。宋增福等[22]报道最佳MOI低的噬菌体具有很强的裂解宿主菌的能力,说明PHW2对宿主菌PA001的裂解能力较强。PHW2的吸附速度较快,10 min有95%的噬菌体可吸附在细菌表面,强吸附能力可更多更快地裂解宿主菌。
PHW2的一步生长曲线显示其潜伏期为100 min、裂解期为360 min,裂解量较低。考虑PHW2较宽的宿主谱,其一步生长特征可能取决于宿主菌和生存环境,李明源等[23]报道的3株黄杆菌低温噬菌体也有类似的现象。PHW2对5%的氯仿耐受能力较强,提示在大量制备噬菌体的过程中可应用氯仿处理宿主菌。
基因组测序显示PHW2不含整合酶、阻遏蛋白等溶源相关基因,为严格毒性噬菌体。基因组比对结果显示PHW2为PB1样噬菌体。文献报道PB1样噬菌体在控制铜绿假单胞菌感染和生物被膜的形成方面有良好的效果,并适用于噬菌体治疗,尤其是噬菌体鸡尾酒疗法[24]。例如PB1样噬菌体NH-4与短尾噬菌体MR299的混合制剂6 h内可将鼠肺中P. aeruginosa的数量降低3-4个数量级[25];单剂量的PB1样噬菌体KPP12处理小鼠角膜炎可显著改善疾病预后,保留角膜结构的完整性和透明度,抑制中性粒细胞浸润,大大增加角膜中细菌的清除率[26];PB1样噬菌体KT28和KTN6可使PAO1菌株24-72 h形成的生物被膜菌的菌落数减少70%-90%[27]。这些研究提示本实验分离的PHW2具有治疗铜绿假单胞菌的潜力,但仍需开展进一步的体外和体内试验。铜绿假单胞菌广泛分布于医院环境,是医院感染的常见病原菌,其生物被膜是致病因素之一,尤其在慢性感染和抗生素耐药菌引起的感染方面发挥重要作用[28]。因此本研究初步探讨了PHW2对铜绿假单胞菌生物被膜的抑制作用及清除作用。结果表明,噬菌体PHW2可以明显抑制铜绿假单胞菌宿主菌PA001生物被膜的形成以及破解PA001已经形成的生物被膜,但对24 h后的生物被膜的破解效果相较12 h要弱。噬菌体对生物被膜破坏作用的机理主要有3个方面:(1) 编码胞外多糖解聚酶降解生物被膜基质中的胞外多糖;(2) 噬菌体裂解酶破坏细菌细胞壁导致细菌裂解,从而使生物被膜减少;(3) 噬菌体感染生物被膜内的细菌,导致细菌裂解[29]。本研究中PHW2裂解宿主菌PA001形成的噬菌斑周围有空晕,而且ORF44编码尾部蛋白具有糖苷酶结合域,是可能的解聚酶。因此,我们推测PHW2对铜绿假单胞菌PA001生物被膜的破坏作用可能与噬菌体对生物被膜菌的裂解及解聚酶对胞外多糖的降解有关。
综上分析,本研究分离鉴定了一株裂解碳青霉烯类耐药的铜绿假单胞菌的噬菌体PHW2,该噬菌体属于PB1样噬菌体,对铜绿假单胞菌的裂解能力强,对温度和pH均有较好的耐受能力,对紫外线敏感,对氯仿不敏感,能抑制铜绿假单胞菌PA001生物被膜的形成并且能清除已经形成的生物被膜,具有开发为生物制剂控制多重耐药铜绿假单胞菌感染的潜力。
| [1] |
Shortridge D, Gales AC, Streit JM, Huband MD, Tsakris A, Jones RN. Geographic and temporal patterns of antimicrobial resistance in Pseudomonas aeruginosa over 20 years from the SENTRY antimicrobial surveillance program, 1997-2016[J]. Open Forum Infectious Diseases, 2019, 6(Suppl 1): S63-S68. |
| [2] |
2018 National Bacterial Resistance Surveillance Report[J]. Chinese Journal of Rational Drug Use, 2020, 17(1): 1-10 (in Chinese) 2018年全国细菌耐药监测报告[J]. 中国合理用药探索, 2020, 17(1): 1-10 |
| [3] |
Shrivastava S, Shrivastava P, Ramasamy J. World health organization releases global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics[J]. Journal of Medical Society, 2018, 32(1): 76. DOI:10.4103/jms.jms_25_17 |
| [4] |
Lin DM, Koskella B, Lin HC. Phage therapy: an alternative to antibiotics in the age of multi-drug resistance[J]. World Journal of Gastrointestinal Pharmacology and Therapeutics, 2017, 8(3): 162-173. DOI:10.4292/wjgpt.v8.i3.162 |
| [5] |
Yang YH, Le S. Progress on Pseudomonas aeruginosa bacteriophage therapy[J]. Chinese Journal of Antibiotics, 2017, 42(10): 814-820. (in Chinese) 杨雨卉, 乐率. 铜绿假单胞菌噬菌体治疗的研究进展[J]. 中国抗生素杂志, 2017, 42(10): 814-820. DOI:10.3969/j.issn.1001-8689.2017.10.002 |
| [6] |
Chegini Z, Khoshbayan A, Taati Moghadam M, Farahani I, Jazireian P, Shariati A. Bacteriophage therapy against Pseudomonas aeruginosa biofilms: a review[J]. Annals of Clinical Microbiology and Antimicrobials, 2020, 19(1): 45. DOI:10.1186/s12941-020-00389-5 |
| [7] |
Bao HD, Zhu SJ, Zhang H, Zhou Y, Zhang XH, Pang MD, Sun LC, Li W, Wang R. Screening, identification and pathogenicity of phage-resistant strain of Salmonella[J]. Acta Microbiologica Sinica, 2020, 60(4): 759-768. (in Chinese) 包红朵, 朱树娇, 张辉, 周艳, 张旭晖, 庞茂达, 孙利厂, 李维, 王冉. 沙门菌噬菌体抗性菌的筛选鉴定及致病力研究[J]. 微生物学报, 2020, 60(4): 759-768. |
| [8] |
Gordillo Altamirano FL, Barr JJ. Phage therapy in the postantibiotic era[J]. Clinical Microbiology Reviews, 2019. DOI:10.1128/cmr.00066-18 |
| [9] |
Li CH, Wu AH. Multidrug resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquioed resistance[J]. Chinese Journal of Infection Control, 2014, 13(1): 62-64. (in Chinese) 李春辉, 吴安华. MDR、XDR、PDR多重耐药菌暂行标准定义: 国际专家建议[J]. 中国感染控制杂志, 2014, 13(1): 62-64. DOI:10.3969/j.issn.1671-9638.2014.01.018 |
| [10] |
Beeton ML, Alves DR, Enright MC, Jenkins ATA. Assessing phage therapy against Pseudomonas aeruginosa using a Galleria mellonella infection model[J]. International Journal of Antimicrobial Agents, 2015, 46(2): 196-200. DOI:10.1016/j.ijantimicag.2015.04.005 |
| [11] |
Kutter E. Phage host range and efficiency of plating[J]. Methods in Molecular Biology, 2009, 501: 141-149. |
| [12] |
Hyman P, Abedon ST. Practical Methods for Determining Phage Growth Parameters[M]. Bacteriophages, 2009. DOI: 10.1007/978-1-60327-164-6_18
|
| [13] |
Cai JP, Sun LY. Isolation and characterization of bacteriophages of Vibrio cholera from the red tide waters in Shenzhen[J]. Microbiology China, 2010, 37(1): 12-18. (in Chinese) 蔡俊鹏, 孙丽滢. 深圳赤潮中霍乱弧菌噬菌体的分离筛选及生物学特性分析[J]. 微生物学通报, 2010, 37(1): 12-18. |
| [14] |
Chen LK, Liu YL, Hu AR, Chang KC, Lin NT, Lai MJ, Tseng CC. Potential of bacteriophage ΦAB2 as an environmental biocontrol agent for the control of multidrug-resistant Acinetobacter baumannii[J]. BMC Microbiology, 2013, 13(1): 1-10. DOI:10.1186/1471-2180-13-1 |
| [15] |
Yang Y, Li X, Zhang YW, Liu JH, Hu XX, Nie TY, Yang XY, Wang XK, Li CR, You XF. Characterization of a hypervirulent multidrug-resistant ST23 Klebsiella pneumoniae carrying a blaCTX-M-24 IncFII plasmid and a pK2044-like plasmid[J]. Journal of Global Antimicrobial Resistance, 2020, 22: 674-679. DOI:10.1016/j.jgar.2020.05.004 |
| [16] |
Lowe TM, Chan PP. tRNAscan-SE On-line: integrating search and context for analysis of transfer RNA genes[J]. Nucleic Acids Research, 2016, 44(W1): W54-W57. DOI:10.1093/nar/gkw413 |
| [17] |
Darling ACE, Mau B, Blattner FR, Perna NT. Mauve: multiple alignment of conserved genomic sequence with rearrangements[J]. Genome Research, 2004, 14(7): 1394-1403. DOI:10.1101/gr.2289704 |
| [18] |
Kalatzis PG, Bastías R, Kokkari C, Katharios P. Isolation and characterization of two lytic bacteriophages, φSt2 and φGrn1; phage therapy application for biological control of Vibrio alginolyticus in aquaculture live feeds[J]. PLoS One, 2016, 11(3): e0151101. DOI:10.1371/journal.pone.0151101 |
| [19] |
Zeng L, Qiu DQ, Xie JH, Yu G. A study of the biochemical characteristics of the Vibrio alginolyticus bacteriophage[J]. Journal of Guangdong Ocean University, 2012, 32(1): 24-29. (in Chinese) 曾林, 邱德全, 谢警鸿, 于鸽. 一株溶藻弧菌噬菌体的生理特性研究[J]. 广东海洋大学学报, 2012, 32(1): 24-29. DOI:10.3969/j.issn.1673-9159.2012.01.004 |
| [20] |
Li M, Shen XD, Zhou YB, Huang JJ, Hu XM, Rao XC, Hu FQ. Study on biological characteristics of Pseudomonas aeruginosa phage PaP1[J]. Acta Academiae Medicinae Militaris Tertiae, 2005, 27(9): 860-863. (in Chinese) 李明, 申晓冬, 周莹冰, 黄建军, 胡晓梅, 饶贤才, 胡福泉. 铜绿假单胞菌噬菌体PaP1生物学特性的研究[J]. 第三军医大学学报, 2005, 27(9): 860-863. DOI:10.3321/j.issn:1000-5404.2005.09.016 |
| [21] |
Zhang L, Le S, Lu SG, Yao XY, Zhao Y, Wang J, Tan YL, Hu FQ, Li M. Isolation and identification a novel Pseudomonas aeruginosa phage PaP4[J]. Microbiology China, 2013, 40(4): 609-616. (in Chinese) 张琳, 乐率, 卢曙光, 姚新月, 赵岩, 王竞, 谭银玲, 胡福泉, 李明. 铜绿假单胞菌噬菌体PaP4的分离与鉴定[J]. 微生物学通报, 2013, 40(4): 609-616. |
| [22] |
Song ZF, Xu HD, Peng MF, Sun BC, Zhao Z, Zhang Y, Ren JF, Zhang QH. Isolation and identification of two lytic phages against Vibrio parahaemolyticus[J]. Acta Hydrobiologica Sinica, 2017, 41(4): 793-799. (in Chinese) 宋增福, 徐华东, 彭孟凡, 孙博超, 赵政, 张也, 任建峰, 张庆华. 两株副溶血弧菌烈性噬菌体的分离鉴定[J]. 水生生物学报, 2017, 41(4): 793-799. |
| [23] |
Li MY, Wang JL, Wei YL, Lu LL, Ji XL. Biological characteristics of three Flavobacterium cold-active bacteriophages from mingyong glacier[J]. Life Science Research, 2014, 18(2): 114-120. (in Chinese) 李明源, 王继莲, 魏云林, 卢磊磊, 季秀玲. 明永冰川三株黄杆菌低温噬菌体的生物学特性研究[J]. 生命科学研究, 2014, 18(2): 114-120. |
| [24] |
Alves DR, Perez-Esteban P, Kot W, Bean JE, Arnot T, Hansen LH, Enright MC, Jenkins ATA. A novel bacteriophage cocktail reduces and disperses Pseudomonas aeruginosa biofilms under static and flow conditions[J]. Microbial Biotechnology, 2016, 9(1): 61-74. DOI:10.1111/1751-7915.12316 |
| [25] |
Alemayehu D, Casey PG, McAuliffe O, Guinane CM, Martin JG, Shanahan F, Coffey A, Ross RP, Hill C. Bacteriophages φMR299-2 and φNH-4 can eliminate Pseudomonas aeruginosa in the murine lung and on cystic fibrosis lung airway cells[J]. mBio, 2012, 3(2): e00029-12. |
| [26] |
Fukuda K, Ishida W, Uchiyama J, Rashel M, Kato SI, Morita T, Muraoka A, Sumi T, Matsuzaki S, Daibata M, et al. Pseudomonas aeruginosa keratitis in mice: effects of topical bacteriophage KPP12 administration[J]. PLoS One, 2012, 7(10): e47742. DOI:10.1371/journal.pone.0047742 |
| [27] |
Danis-Wlodarczyk K, Olszak T, Arabski M, Wasik S, Majkowska-Skrobek G, Augustyniak D, Gula G, Briers Y, Jang HB, Vandenheuvel D, et al. Characterization of the newly isolated lytic bacteriophages KTN6 and KT28 and their efficacy against Pseudomonas aeruginosa biofilm[J]. PLoS One, 2015, 10(5): e0127603. DOI:10.1371/journal.pone.0127603 |
| [28] |
Alvi IA, Asif M, Ur Rehman S. A single dose of a virulent bacteriophage vB PaeP-SaPL, rescues bacteremic mice infected with multi drug resistant Pseudomonas aeruginosa[J]. Virus Research, 2021, 292: 198250. DOI:10.1016/j.virusres.2020.198250 |
| [29] |
Liu YN, Tong YG, Mi ZQ, Li PY, Bai CQ. Progress in the research of bacteriophage disrupting biofilms[J]. Chinese Journal of Antibiotics, 2017, 42(10): 821-826. (in Chinese) 刘艳楠, 童贻刚, 米志强, 李璞媛, 柏长青. 噬菌体作用细菌生物被膜的研究进展[J]. 中国抗生素杂志, 2017, 42(10): 821-826. DOI:10.3969/j.issn.1001-8689.2017.10.003 |
 2021, Vol. 48
2021, Vol. 48