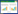扩展功能
文章信息
- 王合叶, 徐沁妍, 姜越, 张莉莉, 孙利厂, 王冉
- WANG Heye, XU Qinyan, JIANG Yue, ZHANG Lili, SUN Lichang, WANG Ran
- 噬菌体粉剂的制备及抗逆性与稳定性
- Preparation of phage powder and its stress resistance and stability
- 微生物学通报, 2021, 48(9): 3109-3115
- Microbiology China, 2021, 48(9): 3109-3115
- DOI: 10.13344/j.microbiol.china.210778
-
文章历史
- 收稿日期: 2021-08-24
- 接受日期: 2021-08-27
- 网络首发日期: 2021-08-31
2. 南京晓庄学院食品科学学院 江苏 南京 211171;
3. 江苏大学食品与生物工程学院 江苏 镇江 212013
2. School of Food Science, Nanjing Xiaozhuang University, Nanjing, Jiangsu 211171, China;
3. School of Food and Biological Engineering, Jiangsu University, Zhenjiang, Jiangsu 212013, China
细菌耐药性是全球重要的公共卫生问题,而养殖业是产生细菌耐药性的重要源头之一。养殖规模巨大、疫病流行复杂、耐药性问题突出及“超级耐药菌”不断出现已对我国公共卫生安全构成重大威胁,因此加强动物疫病防控是从源头上控制细菌耐药性和保障公共卫生安全的国家重大需求。为了应对细菌的耐药性和抗生素残留所导致的机体免疫力下降以及环境污染等问题,我国正在全力推进“减抗、限抗、禁抗”战略,这是破解抗生素长期应用引发系列问题的根本之策。这一战略的实施也对安全有效的新型替抗产品的研发提出新的需求。作为一种新型的对付耐药致病菌的潜在抗菌剂,噬菌体被认为是一个重要的突破口[1]。噬菌体在养殖领域是一种潜在的替抗产品,已经开始在畜牧行业研究和推广,如控制家禽和家畜出现的大肠杆菌[2-3]、沙门氏菌[4]、魏氏梭菌等感染[5]。
噬菌体通常被制成液体制剂,但其在溶液中的稳定性有限,需要低温才能保持活性,在加工和储存过程中噬菌体滴度也会显著下降,因此提高噬菌体的抗逆性和稳定性一直是噬菌体应用中需要面临的一个重要问题。噬菌体稳定化技术已成为噬菌体研究的重点与热点之一[6-9]。常用的微生态制剂如益生菌等,通常采用冷冻干燥的办法做成粉剂来保持微生物的活性。近年来的研究表明,通过冷冻干燥制备的噬菌体粉剂既可以提高噬菌体在长期储存中的稳定性[6],也可以在较宽的温度和pH值范围内表现出高稳定性[7]。然而冷冻干燥成本高、能耗大。低温喷雾干燥也可以制备噬菌体粉剂,提高噬菌体稳定性[8-9],同时较冷冻干燥效率更高,也可以降低一些成本;但该方法对于载体材料的水溶性要求高,必须是水溶性聚合物。这2种干燥方法都依赖于昂贵的设备,成本较高,难以在饲料中推广应用。
噬菌体包被技术因能提高噬菌体的环境抗逆性而备受关注[10-11]。沙门菌噬菌体包封在脂质体后在4 ℃条件下能储存3个月,可以加入饮用水和动物饲料使用[12]。将噬菌体包埋在壳聚糖中可以提高治疗效果[13-14],包被在海藻酸盐中提高热稳定性[15],但这些方法制备步骤烦琐,不利于工业化生产。嵌段式聚醚是一种热保护剂[16],常用于医药制剂。它是一种具有热敏凝胶性质的高分子聚合物,随着温度的升高,黏稠度增大,逐渐由液体变为胶体状[17-18]。嵌段式聚醚能够显著增强药物的生物利用度[19],但在噬菌体制剂里还没有引起关注。
本研究选用嵌段式聚醚F-68为包被剂,脱脂米糠为载体,使用实验室通用设备,制备得到噬菌体粉剂,并研究噬菌体粉剂的耐高温性能、pH稳定性和耐胃液、肠液性能及室温保存稳定性。
1 材料与方法 1.1 噬菌体及其宿主菌宿主菌大肠杆菌1-9A的对应噬菌体为BpEP4 (EP4),均分离自养鸡场粪便,并由本实验室保存。
1.2 主要试剂和仪器LB培养基,北京陆桥技术有限责任公司;琼脂粉、嵌段式聚醚F-68、牛胆盐、胰蛋白酶及胃蛋白酶等,生工生物工程(上海)股份有限公司。
生物安全柜,苏净安泰仪器设备有限公司;电热恒温培养箱,上海森信实验仪器有限公司;电热恒温鼓风干燥箱,上海精宏实验设备有限公司。
1.3 噬菌体粉剂制备与保存将嵌段式聚醚F-68粉按4%的质量体积比溶于噬菌体溶液,在37 ℃、180 r/min的条件下与噬菌体孵育2 h进行噬菌体包被。将包被好的噬菌体溶液以1:4 (质量比)的比例喷洒在载体脱脂米糠(过40目筛),一边喷洒一边搅拌,混合均匀,50 ℃干燥2 h,湿度 < 10%,过40目筛。四分法取样,10份样品噬菌体效价相对偏差 < 5%,常温保存。
1.4 噬菌体含量测定将3.0 g噬菌体粉剂溶于30 mL PBS中,37 ℃、180 r/min振荡2 h后用孔径0.22 μm无菌微孔滤膜过滤,测定溶液中噬菌体的效价,并计算1.0 g噬菌体粉剂中噬菌体的效价。
1.5 模拟胃液与模拟肠液的配制模拟胃液[20]:将0.1 mol/L磷酸钾缓冲液的pH值分别调为1.2、2.0、3.0、4.0、5.0、6.0和7.0,高压灭菌后再加入胃蛋白酶(10.0 g/L),混合使其充分溶解,得到模拟胃液。使用前进行37 ℃预热。
模拟肠液[20]:将磷酸钾缓冲液pH值调至6.8后灭菌,加入胰蛋白酶(10.0 g/L),分别加入不同浓度胆盐(0、0.3、1.5和3.0 g/L),混合使其充分溶解,得到模拟肠液。使用前进行37 ℃预热。
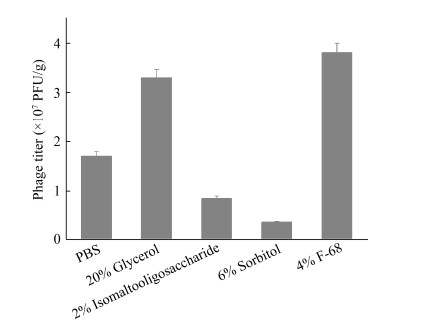
2 结果与讨论 2.1 噬菌体包被剂筛选我们选取了几种保护剂(甘油、低聚异麦芽糖、山梨醇、嵌段式聚醚F-68)对噬菌体进行包被。分别采用PBS (空白)、20%甘油、2%低聚异麦芽糖、6%山梨醇及4% F-68进行噬菌体包被,将包被好的噬菌体以1: 4 (质量比)的比例喷洒在脱脂米糠,混合均匀,烘干,得到噬菌体粉剂。然后采用PBS溶解释放出噬菌体,过滤后测定上层清液中噬菌体含量,进一步计算得到每克噬菌体粉剂中噬菌体的含量。如图 1所示,2%低聚异麦芽糖(Isomaltooligosaccharide)组与6%山梨醇(Sorbitol)组的噬菌体效价比空白组含量低,分别为空白组的50%与20%。4% F-68组与20%甘油(Glycerol)组比空白组效价高,其中4% F-68对于低温干燥条件下噬菌体的保护效果最好,是空白组的2.2倍,20%甘油组为空白组的1.9倍。20%甘油组虽然也能很好地保持噬菌体的活性,但由于甘油黏度大,低温烘干后呈硬块状,需要再次研磨成细粉,而F-68组低温烘干后呈粉状,具有良好的流动性。我们又比较了不同含量的F-68对噬菌体的保护效果。如图 2所示,随着F-68浓度的增加,噬菌体粉剂的噬菌体效价增大,考虑到F-68的溶解度和噬菌体粉剂的成本,我们没有进行更高F-68添加量的实验,最终选择4% F-68作为后续噬菌体粉剂的包被剂。
|
| 图 1 不同包被剂对于噬菌体效价的影响 Figure 1 The effect of different coating agents on the phage titer |
|
|
|
| 图 2 F-68浓度对于噬菌体效价的影响 Figure 2 The effect of concentration of F-68 on the phage titer |
|
|
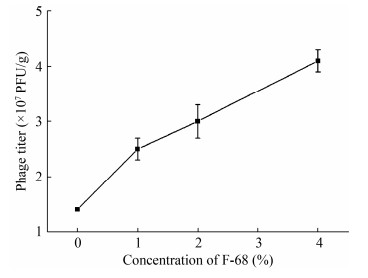
噬菌体经F-68包被后,分别采用等量的脱脂米糠、米糠与玉米芯粉为载体进行负载,烘干。如图 3所示,3种粉剂的噬菌体效价依次为3.80×107、9.55×106与1.51×106 PFU/g。脱脂米糠作载体组的噬菌体效价最高。此外,我们在测定噬菌体效价时,发现脱脂米糠较米糠和玉米芯粉的可溶性更好,更容易分散在水溶液中,也更容易释放噬菌体。这可能由于脱脂米糠经过脱脂处理后亲水性较米糠和玉米芯粉更好,同时粉剂更细,对于噬菌体的负载效果更好。脱脂米糠是米糠经过压榨以后生产,保留了米糠原有的营养成分并有芬芳的气味,不容易生虫和发霉,常用于兽药、添加剂、维生素等产品的生产原料[21]。此外,我国米糠资源丰富、成本低,因此脱脂米糠是噬菌体载体的理想选择。
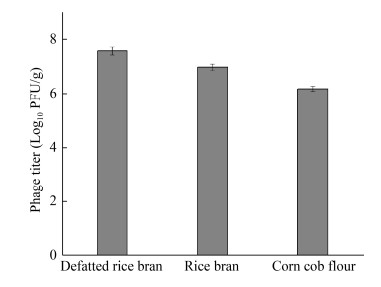
|
| 图 3 不同载体对于噬菌体效价的影响 Figure 3 The effect of different carriers on the phage titer |
|
|
良好的耐高温性能是噬菌体粉剂用于饲料加工的重要基础。我们研究了50−100 ℃范围内噬菌体粉剂的耐高温性能,同时以未经处理EP4液体噬菌体组、F-68包被的液体噬菌体组、脱脂米糠直接负载的EP4噬菌体粉剂组作为对照,结果表明(图 4),50−80 ℃分别加热3 min后4组的噬菌体效价无明显变化,说明噬菌体可以耐受80 ℃及以下的温度;90 ℃加热3 min后4个组出现了显著性差异,EP4液体组、EP4+F-68液体组、EP4+脱脂米糠粉剂组及EP4+F-68+脱脂米糠组分别下降4.3、3.2、1.8和1.2个数量级;100 ℃加热3 min后EP4组中噬菌体全部灭活,EP4+F-68、EP4+脱脂米糠及EP4+F-68+脱脂米糠分别剩余噬菌体1.99×103、3.98×104和3.98×105 PFU/g,说明F-68和脱脂米糠二者都显著提高了噬菌体的耐高温性能。饲料颗粒挤出加工过程中通常遇到的条件为95 ℃下2 min[22]。因此,EP4+F-68+脱脂米糠噬菌体粉剂优异的耐高温性能可以满足养殖业饲料制粒温度的要求。
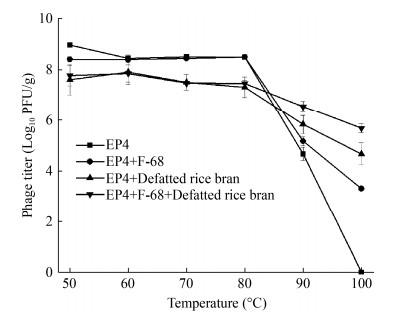
|
| 图 4 噬菌体粉剂和液体噬菌体的耐高温稳定性 Figure 4 The stability of phage powder and liquid phage against high temperature 注:EP4:液体噬菌体组;EP4+F-68:F-68包被的液体噬菌体组;EP4+Defatted rice bran:EP4负载脱脂米糠的噬菌体粉剂组;EP4+F-68+Defatted rice bran:F-68包被的EP4负载脱脂米糠的噬菌体粉剂组。下同 Note: EP4: Liquid phage group; EP4+F-68: Liquid F-68 coated phage group; EP4+Defatted rice bran: EP4 loaded defatted rice bran phage powder group; EP4+F-68+Defatted rice bran: F-68 coated EP4 loaded defatted rice bran phage powder group. The same below |
|
|
提高噬菌体在消化过程中的耐受力是噬菌体粉剂的关键技术需求[23-24],其中pH稳定性是噬菌体对于胃液耐受的重要评价指标。如图 5所示,液体噬菌体组(EP4)和F-68包被的液体噬菌体组(EP4+F-68)这2组pH耐受范围均为4.0−10.0,但在pH为4.0时F-68包被的液体噬菌体组比液体噬菌体组高2.3个数量级;噬菌体EP4直接负载脱脂米糠组(EP4+Defatted Rice Bran)与F-68包被的噬菌体负载脱脂米糠(EP4+Defatted Rice Bran)这2组固体粉剂pH耐受范围为2.0−12.0,并且在pH 8.0−12.0范围内,采用F-68包被的噬菌体粉剂组比未经F-68包被的噬菌体粉剂组效价高1个数量级。说明脱脂米糠可以显著拓宽噬菌体的pH耐受范围,而F-68包被可以提高噬菌体的耐酸碱性能。另外,我们还测定了pH 1.2−7.0范围内的模拟胃酸下的噬菌体粉剂的噬菌体活性,结果与图 5中pH 1.2−7.0结果一样,说明噬菌体粉剂在模拟胃酸中具有良好的噬菌体活性。
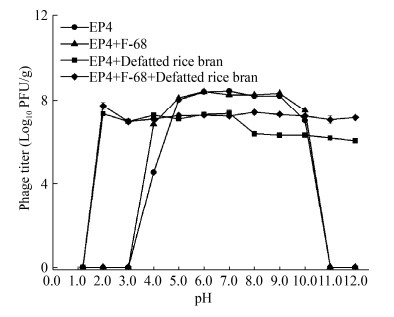
|
| 图 5 噬菌体粉剂和液体噬菌体的pH稳定性 Figure 5 pH stability of phage powder and liquid phage |
|
|
我们还研究了含不同胆盐浓度的模拟肠液中2组液体制剂和2组粉剂的噬菌体活性。结果表明(图 6),在无胆盐、低(0.03%)、中(0.15%)、高(0.3%)胆盐浓度的模拟肠液中,4组噬菌体无明显差异,存活率均在95%以上。说明胰蛋白酶、胆盐、模拟肠液对噬菌体活性的影响不显著。
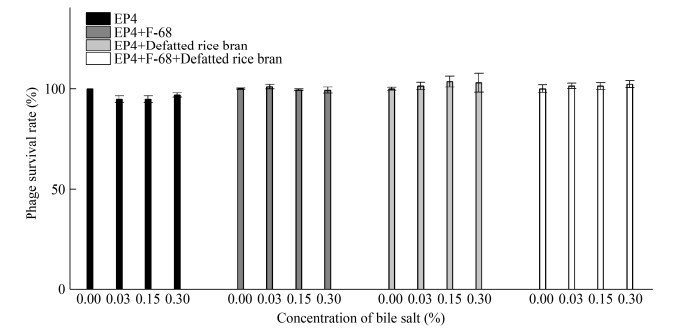
|
| 图 6 噬菌体粉剂和液体噬菌体在含不同胆盐浓度的模拟肠液中的稳定性 Figure 6 Stability of phage powder and liquid phage in simulated intestinal fluid with different concentrations of bile salt |
|
|
噬菌体在溶液中的稳定性有限,通常需要低温保存,常温储存过程中噬菌体滴度会显著下降。我们研究了噬菌体粉剂在常温下长期保存的稳定性。如图 7所示,将制备的噬菌体粉剂(EP4+F-68+ Defatted rice bran)与液体噬菌体(EP4)置于室温25 ℃保存,在第7、15、30、60和90天,分别测定2种制剂的噬菌体效价。如图 7所示,噬菌体粉剂保存1个月后噬菌体含量仅下降0.5个数量级,保存3个月后仅下降1个数量级;而液体噬菌体在保存1个月后噬菌体含量降低2个数量级,保存3个月后降低约4个数量级。说明在常温下噬菌体粉剂比液体噬菌体制剂能更好地保持噬菌体的活性,具有更好的稳定性。这与冷冻干燥法制备噬菌体粉剂能提高噬菌体保存稳定性的结论一致[6]。
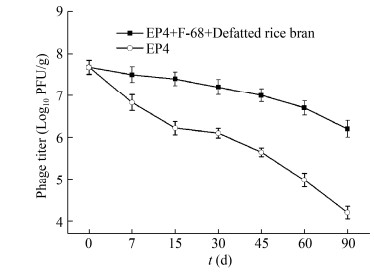
|
| 图 7 噬菌体粉剂和液体噬菌体的常温保存稳定性 Figure 7 Storage stability of phage powder and liquid phage at room temperature |
|
|
本研究采用嵌段式聚醚F-68对大肠杆菌噬菌体进行包被,然后负载脱脂米糠制备得到噬菌体粉剂,并对其耐高温性能、耐pH范围和在模拟胃液、肠液中的耐受性及常温保存稳定性进行了综合评价。该噬菌体粉剂在100 ℃的高温下仍保持很高的噬菌体活性;pH耐受范围为2.0−12.0;在模拟胃液、肠液中噬菌体成活率高;常温保存3个月后噬菌体效价无明显降低。由此可见,制备的噬菌体粉剂具有很好的抗逆性和稳定性。本研究将为噬菌体粉剂的制备和应用提供新思路。后续我们将结合动物实验,并研究饲料加工过程中其他相关成分的影响,进一步优化噬菌体粉剂的抗逆性和稳定性,为噬菌体作为饲料添加剂、保障畜牧和水产等养殖业的健康可持续发展提供技术指导。
| [1] |
Kutateladze M, Adamia R. Bacteriophages as potential new therapeutics to replace or supplement antibiotics[J]. Trends in Biotechnology, 2010, 28(12): 591-595. DOI:10.1016/j.tibtech.2010.08.001 |
| [2] |
Zhou Y, Bao HD, Zhang H, Wang R. Isolation and characterization of lytic phage vB_EcoM_JS09 against clinically isolated antibiotic-resistant avian pathogenic Escherichia coli and enterotoxigenic Escherichia coli[J]. Intervirology, 2015, 58(4): 218-231. DOI:10.1159/000437426 |
| [3] |
Fu LN, Xu YP, Li XY, Qu KL, Zhang N, Wang JN, Wang LL. Advances in phage control of pathogenic Escherichia coli[J]. Animal Husbandry & Veterinary Medicine, 2017, 49(12): 140-144. (in Chinese) 付丽娜, 徐永平, 李晓宇, 渠坤丽, 张楠, 王佳宁, 王丽丽. 噬菌体控制致病性大肠杆菌的研究进展[J]. 畜牧与兽医, 2017, 49(12): 140-144. |
| [4] |
Yu K, Cao ZZ, Wan M, Lu LZ, Luan XH. Application of bacteriophages in prevention and treatment of Salmonella infections in livestock and poultry[J]. Progress in Veterinary Medicine, 2021, 42(4): 115-119. (in Chinese) 于堃, 曹中赞, 万明, 卢立志, 栾新红. 噬菌体在防治畜禽沙门氏菌感染中的应用[J]. 动物医学进展, 2021, 42(4): 115-119. DOI:10.3969/j.issn.1007-5038.2021.04.023 |
| [5] |
Wei BD, Cong C, Li SY, Li JB, Yu W, Yang H, Xu YP, Wang X. Application of bcteriophage to prevent and control bacterial infection in livestock and poultry[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(1): 190-200. (in Chinese) 魏炳栋, 丛聪, 李淑英, 李纪彬, 于维, 杨欢, 徐永平, 王欣. 噬菌体在防控畜禽细菌性感染中的应用[J]. 中国畜牧兽医, 2020, 47(1): 190-200. |
| [6] |
El Haddad L, Lemay MJ, Khalil GE, Moineau S, Champagne CP. Microencapsulation of a Staphylococcus phage for concentration and long-term storage[J]. Food Microbiology, 2018, 76: 304-309. DOI:10.1016/j.fm.2018.06.002 |
| [7] |
Petsong K, Benjakul S, Vongkamjan K. Optimization of wall material for phage encapsulation via freeze-drying and antimicrobial efficacy of microencapsulated phage against Salmonella[J]. Journal of Food Science and Technology, 2021, 58(5): 1937-1946. DOI:10.1007/s13197-020-04705-x |
| [8] |
Malik DJ. Bacteriophage encapsulation using spray drying for phage therapy[J]. Current Issues in Molecular Biology, 2021, 40: 303-316. |
| [9] |
Vinner G, Rezaie-Yazdi Z, Leppanen M, Stapley A, Leaper M, Malik D. Microencapsulation of Salmonella-specific bacteriophage felix O1 using spray-drying in a pH-responsive formulation and direct compression tableting of powders into a solid oral dosage form[J]. Pharmaceuticals, 2019, 12(1): 43. DOI:10.3390/ph12010043 |
| [10] |
Choińska-Pulit A, Mituła P, Śliwka P, Łaba W, Skaradzińska A. Bacteriophage encapsulation: trends and potential applications[J]. Trends in Food Science & Technology, 2015, 45(2): 212-221. |
| [11] |
Hussain MA, Liu H, Wang Q, Zhong F, Guo Q, Balamurugan S. Use of encapsulated bacteriophages to enhance farm to fork food safety[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(13): 2801-2810. DOI:10.1080/10408398.2015.1069729 |
| [12] |
Colom J, Cano-Sarabia M, Otero J, Cortés P, Maspoch D, Llagostera M. Liposome-encapsulated bacteriophages for enhanced oral phage therapy against Salmonella spp.[J]. Applied and Environmental Microbiology, 2015, 81(14): 4841-4849. DOI:10.1128/AEM.00812-15 |
| [13] |
Ma YS, Pacan JC, Wang Q, Xu YP, Huang XQ, Korenevsky A, Sabour PM. Microencapsulation of bacteriophage felix O1 into chitosan-alginate microspheres for oral delivery[J]. Applied and Environmental Microbiology, 2008, 74(15): 4799-4805. DOI:10.1128/AEM.00246-08 |
| [14] |
Abdelsattar AS, Abdelrahman F, Dawoud A, Connerton IF, El-Shibiny A. Encapsulation of E. coli phage ZCEC5 in chitosan-alginate beads as a delivery system in phage therapy[J]. AMB Express, 2019, 9(1): 1-9. DOI:10.1186/s13568-018-0728-7 |
| [15] |
Colom J, Cano-Sarabia M, Otero J, Aríñez-Soriano J, Cortés P, Maspoch D, Llagostera M. Microencapsulation with alginate/CaCO3: a strategy for improved phage therapy[J]. Scientific Reports, 2017, 7: 41441. DOI:10.1038/srep41441 |
| [16] |
He CL, Kim SW, Lee DS. In situ gelling stimuli-sensitive block copolymer hydrogels for drug delivery[J]. Journal of Controlled Release, 2008, 127(3): 189-207. DOI:10.1016/j.jconrel.2008.01.005 |
| [17] |
Nanjawade BK, Manvi FV, Manjappa AS. In situ-forming hydrogels for sustained ophthalmic drug delivery[J]. Journal of Controlled Release, 2007, 122(2): 119-134. DOI:10.1016/j.jconrel.2007.07.009 |
| [18] |
Mayol L, Quaglia F, Borzacchiello A, Ambrosio L, Rotonda MIL. A novel poloxamers/hyaluronic acid in situ forming hydrogel for drug delivery: rheological, mucoadhesive and in vitro release properties[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2008, 70(1): 199-206. DOI:10.1016/j.ejpb.2008.04.025 |
| [19] |
Giuliano E, Paolino D, Fresta M, Cosco D. Mucosal applications of poloxamer 407-based hydrogels: an overview[J]. Pharmaceutics, 2018, 10(3): 159. DOI:10.3390/pharmaceutics10030159 |
| [20] |
Zhang LQ, Wang XR, Shi C, Peng YX, Du LP. Stability and tolerance to simulated gastrointestinal fluids of probiotics in powder preparation[J]. Food and Fermentation Industries, 2021, 47(13): 36-42. (in Chinese) 张林奇, 王晓蕊, 史畅, 彭禹熙, 杜丽平. 益生菌粉中活菌稳定性及其耐受模拟胃肠液的研究[J]. 食品与发酵工业, 2021, 47(13): 36-42. |
| [21] |
Pu G, Huang RH, Niu Q, Wang H, Fan LJ, Gao C, Niu PP, Zhang ZP, Wu CW, Zhou J, et al. Effects of dietary defatted rice bran substitute corn levels on growth performance, intestinal development and apparent digestibility of nutrients of suhuai pigs[J]. Chinese Journal of Animal and Veterinary Sciences, 2019, 50(4): 758-770. (in Chinese) 蒲广, 黄瑞华, 牛清, 王欢, 范丽娟, 高琛, 牛培培, 张总平, 吴承武, 周娟, 等. 日粮脱脂米糠替代玉米水平对苏淮猪生长性能、肠道发育及养分消化率的影响[J]. 畜牧兽医学报, 2019, 50(4): 758-770. |
| [22] |
Richards K, Malik DJ. Bacteriophage encapsulation in pH-responsive core-shell capsules as an animal feed additive[J]. Viruses, 2021, 13(6): 1131. DOI:10.3390/v13061131 |
| [23] |
Malik DJ, Sokolov IJ, Vinner GK, Mancuso F, Cinquerrui S, Vladisavljevic GT, Clokie MRJ, Garton NJ, Stapley AGF, Kirpichnikova A. Formulation, stabilisation and encapsulation of bacteriophage for phage therapy[J]. Advances in Colloid and Interface Science, 2017, 249: 100-133. DOI:10.1016/j.cis.2017.05.014 |
| [24] |
Yuan YY, Cong C, Qu KL, Li XY, Wang LL, Li SY, Xu YP. Research progress of phage in feed[J]. World Notes on Antibiotics, 2019, 40(5): 425-429. (in Chinese) 袁玉玉, 丛聪, 渠坤丽, 李晓宇, 王丽丽, 李淑英, 徐永平. 噬菌体在饲料中的应用及研究进展[J]. 国外医药: 抗生素分册, 2019, 40(5): 425-429. DOI:10.3969/j.issn.1001-8751.2019.05.004 |
 2021, Vol. 48
2021, Vol. 48