扩展功能
文章信息
- 史银银, 明红霞, 陈泉睿, 于颖, 樊景凤
- SHI Yinyin, MING Hongxia, CHEN Quanrui, YU Ying, FAN Jingfeng
- 亚硝酸盐氧化细菌的生态位以及对海洋环境变化的响应机制
- The niche of nitrite-oxidizing bacteria and its response mechanism to marine environmental changes
- 微生物学通报, 2021, 48(8): 2895-2901
- Microbiology China, 2021, 48(8): 2895-2901
- DOI: 10.13344/j.microbiol.china.201061
-
文章历史
- 收稿日期: 2020-11-11
- 接受日期: 2021-03-11
- 网络首发日期: 2021-03-26
2. 国家海洋环境监测中心 国家环境保护近岸海域生态环境重点实验室 辽宁 大连 116023;
3. 厦门大学海洋与地球学院 福建 厦门 361005
2. State Environmental Protection Key Laboratory of Coastal Ecosystem, National Marine Environmental Monitoring Center, Dalian, Liaoning 116023, China;
3. College of Ocean and Earth Sciences, Xiamen University, Xiamen, Fujian 361005, China
海洋是地球上最大的生态系统,约占地球表面的71%,同时也储存了大量的氮元素。氮元素是生命体合成核酸和蛋白质等关键细胞化合物不可缺少的必要元素,在生物学上具有高度多样的可利用性。自然界中的氮素以惰性气体N2的形式在大气中稳定存在,而生物体可利用的活泼含氮物质则在环境中十分罕见;氮素的地球化学循环几乎完全依赖于由微生物所参与的氮的氧化还原反应,因而硝酸盐、铵盐等活泼含氮物质经常作为限制性营养盐制约着海洋生态系统的初级生产力[1]。硝化作用以NO3−或NO2−作电子受体连接氮循环中的好氧及厌氧途径,进而影响异化硝酸盐还原、反硝化、厌氧氨氧化等过程[2]。
亚硝酸盐氧化细菌(Nitrite-Oxidizing Bacteria,NOB)是海洋微生物可利用氮的重要保护者,在微生物地球化学循环中占据关键地位,其代谢功能影响着海洋环境中碳、氮、硫的耦合关系[3]。NOB的产物硝酸盐是海洋初级生产者的主要氮源,可为海洋微生物的无氧呼吸提供电子受体[1, 4]。另外,NOB在NO的转化中也起着重要作用,被认为是生物圈中NO的主要贡献者和清除者[5]。完全氨氧化菌(Comammox)参与的硝化过程则使得氮元素的循环更加节能、高效。随着全球海洋脱氮作用的持续发生,微生物介导的氮保护过程无疑变得更加重要。在未来,对海洋环境中亚硝酸盐氧化过程更加清晰、全面的认识,将有助于我们更好地理解硝化微生物在海洋环境中的研究历程及其复杂的生理生态学特征,为NOB在海洋环境中的生态位分化提供理论依据,从而更好地认识微生物所参与的地球化学氮循环。
1 NOB的研究历程亚硝酸盐氧化是硝化作用的第2步,也是有氧生态系统中生物地球化学循环的关键过程。大多数的海洋无机固定氮(即硝酸盐、亚硝酸盐和铵盐)以硝化最终产物硝酸盐(99%)的形式存在,这表明氨氧化第一过程的产物亚硝酸盐会在氧化酶的作用下立即被氧化为硝酸盐,并以硝酸盐的形式存在于海洋环境中[1]。海洋微生物纷繁复杂,人类从海洋中分离培养出的自养微生物种群仅占海洋微生物群落很小的一部分。当前已鉴定出的NOB主要隶属于4个细菌门,即变形细菌门(Proteobacteria)、硝化螺旋菌门(Nitrospirae)、硝棘菌门(Nitrospinae)和绿弯菌门(Chloroflexi);含7个属,即硝化杆菌属(Nitrobacter)、Nitrotoga、硝化球菌属(Nitrococcus)、硝酸螺旋菌属(Nitrospira)、硝化刺菌属(Nitrospina)、Nitrolancea以及Candidatus Nitromaritima。
NOB中隶属于Nitrospirae的Nitrospira最早在1986年由Watson等从缅甸海湾中分离出,随后在淡水、土壤、地下水、地热泉、废水处理厂等多种环境中检测出,而且验证了该菌可在海生海绵中繁殖,或生长于植物的根部、叶表面[6]。Nitrococcus的纯培养物Nitrococcus mobilis最早分离于1971年[7],后续研究发现Nitrococcus mobilis的纯培养物可与氨氧化微生物合作,以甲酸盐、乙酸盐等有机物为碳源,将氨氧化为NO3−,进行异养或混合营养生长,而且该物种编码了多个复合底物结合酶催化亚基的α亚基(nxrA)[8]。Nitrospinae为化学自养型,在海洋中数量众多、分布广泛,而且参与了深海中碳的固定过程[9]。海洋中Nitrospina的纯培养物有2种,一种是从大西洋中分离出的Nitrospina gracilis[7],另一种是从黑海低氧区中分离出的Nitrospina watsonii[10],二者均为化学自养型细菌且系统发育密切相关,具有较高的生长速度。在热带海湾水和沉积物样品[11]、海洋沉积物[12-13]、沿海潮间带岩石栖息地[14]、低氧区海水[15]中也都检出了Nitrospina的基因组信息。
最初硝化作用被认为是由2个过程来完成的,海洋中的氨态氮在氨氧化微生物的作用下,经由羟胺氧化为亚硝酸盐,随后NOB将其氧化为硝酸盐。2006年,Costa等[16]从最优代谢路径的动力学理论出发,提出关于Comammox的假说,该假说认为在硝化微生物体内可以实现从氨到硝酸盐的完全氧化,而且该微生物具有较低的生长速率和高生长量,在与传统氨氧化细菌的竞争中更具优势。2015年,Daims等[17]在关于Nitrospira的富集培养中发现Nitrospira inopinata体内含有多个细胞器,参与且催化了完整的硝化过程,验证了Costa等[16]关于Comammox的假说。Comammox的发现为硝化过程的研究开辟了新的领域,表明硝化过程中代谢活动的分工并不是必需的,Comammox可以单独完成从铵盐到硝酸盐的转化。当前所有已知的Comammox都属于Nitrospira,其基因组包含了编码氨氧化以及亚硝酸盐氧化全过程的完整遗传物质,包括氨单加氧酶(Ammonia Monooxygenase,AMO)、羟胺脱氢酶(Hydroxylamine Oxidoreductase,HAO)、羟胺泛醌还原模块(Hydroxylamine Ubiquinone Reduction Module,HURM)以及亚硝酸盐氧化还原酶(Nitrite Oxidoreductase,NXR)[17-18]。尽管当前Comammox仅在海岸带地区被发现,远洋以及深海中尚未检测到该物种的存在。然而相较于传统的氨氧化微生物,Comammox有着更具竞争力的生长机制,在同一生物体内将氨直接氧化为硝酸盐的行为使得氮的转化更加高效,同时节约了生物体的能量[16]。
2 NOB的主要生理生态学特征 2.1 NOB参与的反应代谢途径硝化过程是生物地球化学和全球氮循环的关键过程,NOB参与了好养硝化过程的第2步(NO2−转化为NO3−),这是氮转移以及生物体吸收获取能量的关键过程。式1和式2分别表示的是NH4+氧化为NO2−以及NO2−氧化为NO3−的过程。在Comammox发现以前,这2个反应是分2步由生理结构不同的微生物催化进行的。Van Kessel等[18]在对滴滤池厌氧室微生物浓度较低的生物膜及其他微生物聚集体的富集实验中进一步证实了单一生物体中存在将NH4+直接氧化为NO3−的完全硝化过程,并确定了能够催化该过程的方程式(式3)。
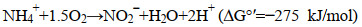
|
(1) |

|
(2) |

|
(3) |
从热力学角度分析,亚硝酸盐氧化所释放的吉布斯自由能为−74 kJ/mol,远小于氨氧化所释放的−275 kJ/mol。另外,有研究指出在厌氧条件下,NOB可将NO3−迅速还原为NO2−,并以NO2−作为电子受体来维持细胞的生命代谢[5]。催化NO2−氧化反应的NXR属于钼蝶呤辅因子结合酶的Ⅱ型二甲基亚砜还原酶,该酶有2种系统发育形式:一种是细胞质导向型,另一种为周质导向型[19-20]。这2种系统发育形式的酶均携带有周质型NXR操纵子,而且该操纵子的末端氮原子上带有可以同信号肽结合的α-亚基(NxrA,催化亚基位于细胞周质)、β-亚基(NxrB,含有Fe-S簇)、γ-亚基(NxrC,位于细胞质膜)以及一个类似TorD的伴侣亚基(NxrD,可能参与捕获辅助因子和亚基的组装)[19, 21]。硝化氮中的NXR活性位点位于细胞周质中,亚硝酸盐氧化过程中产生的质子释放到细胞周质中,可直接驱动质子原动力,促进ATP的产生,该代谢方式更加高效、节能[20, 22]。
2.2 海洋亚硝酸盐氧化过程在环境中的运行机制亚硝酸盐的氧化过程主要由NOB和Comammox来完成,Nitrospira可以将生态系统中的尿素或氰酸盐转化为铵盐和CO2,向尿素酶为阴性的氨氧化微生物提供可供反应的氮源[8]。氨氧化微生物以铵盐为底物进行氨氧化过程,并将其反应的底物NO2−提供给Nitrospira,从而形成了硝化细菌之间“交叉进料喂食(Reciprocal Feeding Interactions)”作用。这种相互作用机制可以促进Nitrospira在有尿素的栖息地生存,并减少了与其他NOB、反硝化细菌或是厌氧氨氧化菌对游离亚硝酸盐的竞争[8]。Nitrospina体内还含有编码cbb3型末端氧化酶的基因,该酶对氧气具有较高的亲和力和极强的依赖性,在低氧条件下也能够催化氮的氧化反应[22]。实验证明在低氧区中,Nitrospina凭借较强的氧亲和力可与厌氧菌(厌氧氨氧化菌、反硝化细菌)共存,并迅速占据优势,完成亚硝酸盐的转化,从而控制低氧区中氮的流失,具有较强的氧敏感性和环境适应性[23]。不同于Nitrospina对O2较高的亲和力,Nitrococcus编码了具有较低亲和力的aa3型细胞色素氧化酶[22]。在纳米比亚低氧区的海水中发现了大量的Nitrococcus,但奇特的是,在该海域并未检测到亚硝酸盐的存在,并且Nitrococcus的丰度与亚硝酸盐氧化速率不具有相关性,反而与硝酸盐还原速率显著相关[3]。该现象可以推断在纳米比亚的低氧海水中起到NO2−氧化作用的是Nitrospina,但Nitrococcus则可能发生了功能性转变,参与到海洋生化循环的其他过程中[3]。
对Comammox进一步研究发现,极端贫营养条件中的完全氨氧化菌Nitrospira inopinata与氨氧化微生物相比,对NH4+有着更强的亲和力[24]。这主要是因为在极端贫营养条件中,完全氨氧化单位摩尔的氨,产生的ATP可支持亚硝酸盐氧化,这与不完全氧化相比,完全氨氧化的过程具有较低的生长速率、更高的生长产量和更强的竞争力,在硝化作用中可以更好地发挥其氧化能力[16, 24]。同时,Comammox通过分解代谢反应与合成代谢反应之间有效的偶联作用,也可以提高自身的生长产量[24]。
2.3 NOB的生长策略NOB参与的硝化反应在有氧条件下能以CO2为碳源,利用氧气和硝酸盐作为末端电子受体进行亚硝酸盐的氧化[8, 25-26]。此外,NOB还可利用替代能源参与微生物的新陈代谢,例如NOB作为专性氧化菌以硫化物、甲酸或其他有机化合物为底物的代谢反应[3, 8]。氨氧化微生物利用氨完成硝化作用,其产物亚硝酸盐是NOB所必需的底物,二者在海洋中多为互利共生的关系[27],但二者在生理生化以及生长策略上不同,因此产生了明显差异的丰度[28-30]。Comammox主要以尿素等溶解有机氮的形式来满足其对有机氮同化的需求,其能量转换更为高效[4]。海洋中常见的亚硝酸盐氧化细菌Nitrospinae和Nitrospira,二者皆含有编码脲酶和氰化酶的基因,可将尿素和氰酸盐转化为NH4+和CO2[8-9]。与氨氧化菌相比NOB有更高的细胞增长率和死亡率,病毒裂解或浮游植物损伤都有可能造成NOB数量的减少[4]。此外,不同于化学自养型NOB,光氧自养型亚硝酸盐氧化菌Thiocapsa KS1可将亚硝酸盐作为电子供体进行产氧光合作用,这种独特的营养方式是独立于化学自养型NOB的进化分支而存在的[31]。除氮循环外,NOB也参与到了海洋中碳的固定中来[9],而且其固碳量要高于氨氧化微生物[1]。
3 影响NOB在海洋环境中生态位分化的因素海水温度上升、海洋酸化、低氧区O2流失等问题不断影响着微生物的生理状态和群落组成,进而改变海洋中的微生物平衡,有机物质的供应也间接影响或控制微生物的生存。微生物群落面对不断变化的海洋环境,通过长期的适应不断进化出了强大的功能适应性,进而更好地适应海洋生态位的分化。影响生态位分化的主要因素有养分、生物学相互作用、气候变化等。
3.1 养分亚硝酸盐的氧化通常被认为是专性有氧的过程,但在缺氧水域中亚硝酸盐氧化也在不断地发生。原位条件下海洋中的亚硝酸盐含量很低,这使得亚硝酸盐成为氧化过程的限制性底物。Chang等[32]通过采集辽河口沉积物柱状样品,得出亚硝化单胞菌属在硝化潜势高的站位占据优势地位,该菌在辽河口的硝化过程中发挥着重要的作用。Sun等[33]研究了东热带太平洋最小低氧区中O2和NO2−对亚硝酸盐氧化过程的调节作用,认为低氧区中的O2抑制了海洋亚硝酸盐的氧化,O2和NO2−很可能是造成海洋低氧区NOB差异的主要驱动力。Zhang等[34]认为随着海洋深度增加,NH4+和NO2−的浓度逐渐降低,NOB对NO2−具有更高的亲和力,并通过氮通量估算出每年全球NO2−氧化量约为(2.28±0.54)×1014 mol,而NOB在海洋中固定溶解无机碳的量大约是0.26×1013 mol。
3.2 生物学相互作用海洋微生物以庞大的种群规模、较短的世代周期、高度的遗传多样性,以及水平基因转移等属性共同完成微生物对海洋气候变化的适应[35]。人类活动影响并推动着海洋环境的变化,使微生物群落快速适应不断变化的环境,从根本上改变了海洋微生物的群落结构[36]。亚硝酸盐氧化的过程为许多浮游植物提供了主要的氮源,不同系统发育谱系的NOB有着不同的选择偏好,并通过不断增强其对生态环境的适应性而逐渐遍布全球。海洋生态系统中大多数NO3−都是由氨氧化微生物与NOB的耦合作用所产生[37]。在共培养实验中,微生物间的相互利用与合作才形成了硝化物种间典型的“交叉进料喂食”作用[8]。NOB也可能与其他硝化细菌之间存在复杂的相互作用,这种共生的机制可能为互惠共生,也有可能为竞争关系,它们共同影响着NOB在海洋生态系统中的生态位分配[38]。
3.3 气候变化温室效应改变了海洋浮游植物的生产力和群落组成,从而影响全球生物地球化学循环。美国佐治亚州萨佩洛岛附近海域的水温在20−30 ℃时,因硝化微生物对温度变化的响应不同,使得氨氧化与亚硝酸盐氧化过程停止耦合作用,NO2−得以短暂地积累[39]。也有研究指出,在未来海洋生物群落组成中,海洋酸化带来的影响将会超过气候变暖所带来的影响[40]。一项针对热带海洋生物群落结构在10年间的序列记录表明,大多数的物种已经适应了温度和光照的变化,但相对于硝酸盐的可利用性,大多数的物种仍未能改变其已经存在的生态位[41]。Ngugi等[21]从红海水域中分离出ca. nitromaritima,并指出NOB也许能够适应更高盐度和更广温度范围的海洋环境。在开放性的海洋酸化实验中,随海水pH的降低,氨氧化的底物NH3转变为NH4+的质子,硝化过程逐渐受到抑制,氨氧化速率也降低了8%−60%[42]。也有不同的观点认为在沿海水域或海洋沉积物中,pH值的降低仅对硝化作用有轻微的影响[43]。
环境因子对NOB的作用可能是单一的,也可能由多个环境因子综合作用。当前的研究多为人为设置单一的环境变量来讨论该变量对菌群的影响,但在海洋环境中,可能是多个环境因子的共同变化作用于海洋微生物。这种环境因子综合作用的效果对NOB可能表现出相加作用、协同作用或是拮抗作用。多重应激源刺激下菌群的最终作用效果还需要更多地探索。
4 总结与展望亚硝酸盐氧化产生的硝酸盐为海洋环境提供了可供微生物生命活动的可利用氮,同时NOB参与的海洋固碳过程也使其成为当今国内外研究的热点。NOB潜在的功能转化可以让其适应范围从海洋缺氧区到更为广阔的海洋资源,尽管NOB在海洋环境中具有多样化的系统发育以及广泛的分布范围,但是我们对于全球海洋生态系统中NOB的功能及生态作用的理解仍然落后于海洋氨氧化微生物,其原因主要有几个方面:(1) 实验技术限制了菌株的纯培养,菌株分离困难,而且NO2−并不会在海洋环境中富集,大多数NOB仍然是未富集培养的菌种[44]。(2) 关于菌株的潜在作用尚不明晰,参与硝化过程的微生物在原位条件下的硝化机理也有待更深入的研究。由于缺乏原位条件下NOB的生态信息,当前尚不清楚使氨和亚硝酸盐氧化速率保持平衡的原因。(3) 很少有研究者将海洋生态系统中的亚硝酸盐氧化作为一个独立的过程进行研究,因此,对海洋环境中NOB的定量实验也很少。(4) 海洋环境复杂多变,而当前的研究尚不能对多个复杂因子交替作用的亚硝酸盐氧化过程做出明确的判断。在未来,多个变量交叉研究将会占据更加重要的地位,从而更好地预测海洋中的硝化趋势以及做好氮预算。
将NOB与其他种群成员之间的空间相互作用更加精准地区分开来,需要开发新的研究方法,未来将会有更多的研究应用于NOB和Comammox在原位条件下的快速区分。今后的研究也将使用单细胞测序、宏基因组、宏转录组测序等分子生物学方法和信息技术,解析微生物的代谢途径和细胞的内部环境,更加深入地了解微生物功能特征及作用机理。尽管当前大多数的海洋硝化过程研究仍集中关注于氨氧化微生物,对NOB的关注较低,但我们相信,随着对海洋更为深入的探索,NOB也将受到越来越多的关注,带给我们新的发现和收获。
| [1] |
Kuypers MMM, Marchant HK, Kartal B. The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology, 2018, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9 |
| [2] |
Kraft B, Tegetmeyer HE, Sharma R, Klotz MG, Ferdelman TG, Hettich RL, Geelhoed JS, Strous M. The environmental controls that govern the end product of bacterial nitrate respiration[J]. Science, 2014, 345(6197): 676-679. DOI:10.1126/science.1254070 |
| [3] |
Füssel J, Lücker S, Yilmaz P, Nowka B, Van Kessel MAHJ, Bourceau P, Hach PF, Littmann S, Berg J, Spieck E, et al. Adaptability as the key to success for the ubiquitous marine nitrite oxidizer Nitrococcus[J]. Science Advances, 2017, 3(11): e1700807. DOI:10.1126/sciadv.1700807 |
| [4] |
Kitzinger K, Marchant HK, Bristow LA, Herbold CW, Padilla CC, Kidane AT, Littmann S, Daims H, Pjevac P, Stewart FJ, et al. Single cell analyses reveal contrasting life strategies of the two main nitrifiers in the ocean[J]. Nature Communications, 2020, 11: 767. DOI:10.1038/s41467-020-14542-3 |
| [5] |
Abeliovich A. The nitrite oxidizing bacteria[J]. New York, NY: Springer New York, 2006, 861-872. |
| [6] |
Watson SW, Bock E, Valois FW, Waterbury JB, Schlosser U. Nitrospira marina gen. nov. sp. nov.: a chemolithotrophic nitrite-oxidizing bacterium[J]. Archives of Microbiology, 1986, 144(1): 1-7. DOI:10.1007/BF00454947 |
| [7] |
Watson SW, Waterbury JB. Characteristics of two marine nitrite oxidizing bacteria, Nitrospina gracilis nov. gen. nov. sp. and Nitrococcus mobilis nov. gen. nov. sp.[J]. Archiv Für Mikrobiologie, 1971, 77(3): 203-230. DOI:10.1007/BF00408114 |
| [8] |
Koch H, Lücker S, Albertsen M, Kitzinger K, Herbold C, Spieck E, Nielsen PH, Wagner M, Daims H. Expanded metabolic versatility of ubiquitous nitrite-oxidizing bacteria from the genus Nitrospira[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(36): 11371-11376. DOI:10.1073/pnas.1506533112 |
| [9] |
Pachiadaki MG, Sintes E, Bergauer K, Brown JM, Record NR, Swan BK, Mathyer ME, Hallam SJ, Lopez-Garcia P, Takaki Y, et al. Major role of nitrite-oxidizing bacteria in dark ocean carbon fixation[J]. Science: New York, NY, 2017, 358(6366): 1046-1051. DOI:10.1126/science.aan8260 |
| [10] |
Spieck E, Keuter S, Wenzel T, Bock E, Ludwig W. Characterization of a new marine nitrite oxidizing bacterium, Nitrospina watsonii sp. nov., a member of the newly proposed phylum "Nitrospinae"[J]. Systematic and Applied Microbiology, 2014, 37(3): 170-176. DOI:10.1016/j.syapm.2013.12.005 |
| [11] |
Mao TQ, Li YQ, Dong HP, Yang WN, Hou LJ. Spatio-temporal variations in the abundance and community structure of Nitrospira in a tropical bay[J]. Current Microbiology, 2020, 77(11): 3492-3503. DOI:10.1007/s00284-020-02193-y |
| [12] |
Rani S, Koh HW, Rhee SK, Fujitani H, Park SJ. Detection and diversity of the nitrite oxidoreductase alpha subunit (nxrA) gene of Nitrospina in marine sediments[J]. Microbial Ecology, 2017, 73(1): 111-122. DOI:10.1007/s00248-016-0897-3 |
| [13] |
Su J, Ming HX, Chen QR, Zhang CX, Guan DM, Fan JF. Analysis on bacterial diversity in Nansha deep-sea sediments[J]. Journal of Biology, 2020, 37(1): 50-53. (in Chinese) 苏洁, 明红霞, 陈泉睿, 张春鑫, 关道明, 樊景凤. 南沙海区深海沉积物中细菌多样性分析[J]. 生物学杂志, 2020, 37(1): 50-53. |
| [14] |
Yepsen DV, Levipan HA, Molina V. Nitrospina bacteria in a rocky intertidal habitat (Quintay Bay, central Chile)[J]. Microbiology Open, 2019, 8(3): e00646. DOI:10.1002/mbo3.646 |
| [15] |
Sun X, Kop LFM, Lau MCY, Frank J, Jayakumar A, Lücker S, Ward BB. Uncultured Nitrospina-like species are major nitrite oxidizing bacteria in oxygen minimum zones[J]. The ISME Journal, 2019, 13(10): 2391-2402. DOI:10.1038/s41396-019-0443-7 |
| [16] |
Costa E, Pérez J, Kreft JU. Why is metabolic labour divided in nitrification?[J]. Trends in Microbiology, 2006, 14(5): 213-219. DOI:10.1016/j.tim.2006.03.006 |
| [17] |
Daims H, Lebedeva EV, Pjevac P, Han P, Herbold C, Albertsen M, Jehmlich N, Palatinszky M, Vierheilig J, Bulaev A, et al. Complete nitrification by Nitrospira bacteria[J]. Nature, 2015, 528(7583): 504-509. DOI:10.1038/nature16461 |
| [18] |
Van Kessel MAHJ, Speth DR, Albertsen M, Nielsen PH, Den Camp HJMO, Kartal B, Jetten MSM, Lücker S. Complete nitrification by a single microorganism[J]. Nature, 2015, 528(7583): 555-559. DOI:10.1038/nature16459 |
| [19] |
Meincke M, Bock E, Kastrau D, Kroneck PMH. Nitrite oxidoreductase from Nitrobacter hamburgensis: redox centers and their catalytic role[J]. Archives of Microbiology, 1992, 158(2): 127-131. DOI:10.1007/BF00245215 |
| [20] |
Lucker S, Wagner M, Maixner F, Pelletier E, Koch H, Vacherie B, Rattei T, Damste JSS, Spieck E, Le Paslier D, et al. A Nitrospira metagenome illuminates the physiology and evolution of globally important nitrite-oxidizing bacteria[J]. PNAS, 2010, 107(30): 13479-13484. DOI:10.1073/pnas.1003860107 |
| [21] |
Ngugi DK, Blom J, Stepanauskas R, Stingl U. Diversification and niche adaptations of Nitrospina-like bacteria in the polyextreme interfaces of Red Sea brines[J]. The ISME Journal, 2016, 10(6): 1383-1399. DOI:10.1038/ismej.2015.214 |
| [22] |
Lücker S, Nowka B, Rattei T, Spieck E, Daims H. The genome of Nitrospina gracilis illuminates the metabolism and evolution of the major marine nitrite oxidizer[J]. Frontiers in Microbiology, 2013, 4: 27. |
| [23] |
Bristow LA, Dalsgaard T, Tiano L, Mills DB, Bertagnolli AD, Wright JJ, Hallam SJ, Ulloa O, Canfield DE, Revsbech NP, et al. Ammonium and nitrite oxidation at nanomolar oxygen concentrations in oxygen minimum zone waters[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(38): 10601-10606. DOI:10.1073/pnas.1600359113 |
| [24] |
Dimitri Kits K, Sedlacek CJ, Lebedeva EV, Han P, Bulaev A, Pjevac P, Daebeler A, Romano S, Albertsen M, Stein LY, et al. Kinetic analysis of a complete nitrifier reveals an oligotrophic lifestyle[J]. Nature, 2017, 549(7671): 269-272. DOI:10.1038/nature23679 |
| [25] |
Palatinszky M, Herbold C, Jehmlich N, Pogoda M, Han P, Von Bergen M, Lagkouvardos I, Karst SM, Galushko A, Koch H, et al. Cyanate as an energy source for nitrifiers[J]. Nature, 2015, 524(7563): 105-108. DOI:10.1038/nature14856 |
| [26] |
Koch H, Galushko A, Albertsen M, Schintlmeister A, Gruber-Dorninger C, Lucker S, Pelletier E, Le Paslier D, Spieck E, Richter A, et al. Growth of nitrite-oxidizing bacteria by aerobic hydrogen oxidation[J]. Science, 2014, 345(6200): 1052-1054. DOI:10.1126/science.1256985 |
| [27] |
Stein, A rp. Loss of ammonia monooxygenase activity in Nitrosomonas europaea upon exposure to nitrite[J]. Applied and Environmental Microbiology, 1998, 64(10): 4098-4102. DOI:10.1128/AEM.64.10.4098-4102.1998 |
| [28] |
Beman JM, Leilei Shih J, Popp BN. Nitrite oxidation in the upper water column and oxygen minimum zone of the eastern tropical North Pacific Ocean[J]. The ISME Journal, 2013, 7(11): 2192-2205. DOI:10.1038/ismej.2013.96 |
| [29] |
Damashek J, Tolar BB, Liu Q, Okotie-Oyekan AO, Wallsgrove NJ, Popp BN, Hollibaugh JT. Microbial oxidation of nitrogen supplied as selected organic nitrogen compounds in the South Atlantic Bight[J]. Limnology and Oceanography, 2019, 64(3): 982-995. DOI:10.1002/lno.11089 |
| [30] |
Reji LT, Tolar BB, Smith JM, Chavez FP, Francis CA. Differential co-occurrence relationships shaping ecotype diversification within Thaumarchaeota populations in the coastal ocean water column[J]. The ISME Journal, 2019, 13(5): 1144-1158. DOI:10.1038/s41396-018-0311-x |
| [31] |
Hemp J, Lücker S, Schott J, Pace LA, Johnson JE, Schink B, Daims H, Fischer WW. Genomics of a phototrophic nitrite oxidizer: insights into the evolution of photosynthesis and nitrification[J]. The ISME Journal, 2016, 10(11): 2669-2678. DOI:10.1038/ismej.2016.56 |
| [32] |
Chang YK, Fan JF, Su J, Ming HX, Zhao W, Shi Y, Ji FY, Guo LM, Zan SJ, Li BC, et al. Spatial abundance, diversity, and activity of ammonia-oxidizing bacteria in coastal sediments of the Liaohe estuary[J]. Current Microbiology, 2017, 74(5): 632-640. DOI:10.1007/s00284-017-1226-x |
| [33] |
Sun X, Ji QX, Jayakumar A, Ward BB. Dependence of nitrite oxidation on nitrite and oxygen in low-oxygen seawater[J]. Geophysical Research Letters, 2017, 44(15): 7883-7891. DOI:10.1002/2017GL074355 |
| [34] |
Zhang Y, Qin W, Hou L, Zakem EJ, Wan XH, Zhao ZH, Liu L, Hunt KA, Jiao NZ, Kao SJ, et al. Nitrifier adaptation to low energy flux controls inventory of reduced nitrogen in the dark ocean[J]. PNAS, 2020, 117(9): 4823-4830. DOI:10.1073/pnas.1912367117 |
| [35] |
Reusch TBH, Boyd PW. Experimental evolution meets marine phytoplankton[J]. Evolution; International Journal of Organic Evolution, 2013, 67(7): 1849-1859. DOI:10.1111/evo.12035 |
| [36] |
Hutchins DA, Fu FX. Microorganisms and ocean global change[J]. Nature Microbiology, 2017, 2: 17058. DOI:10.1038/nmicrobiol.2017.58 |
| [37] |
Levipan HA, Molina V, Anguita C, Rain-Franco A, Belmar L, Fernandez C. Variability of nitrifying communities in surface coastal waters of the Eastern South Pacific (∼36° S)[J]. Environmental Microbiology Reports, 2016, 8(5): 851-864. DOI:10.1111/1758-2229.12448 |
| [38] |
Daebeler A, Kitzinger K, Koch H, Herbold CW, Steinfeder M, Schwarz J, Zechmeister T, Karst SM, Albertsen M, Nielsen PH, et al. Exploring the upper pH limits of nitrite oxidation: Diversity, ecophysiology, and adaptive traits of haloalkalitolerant Nitrospira[J]. The ISME Journal, 2020, 14(12): 2967-2979. DOI:10.1038/s41396-020-0724-1 |
| [39] |
Schaefer SC, Hollibaugh JT. Temperature decouples ammonium and nitrite oxidation in coastal waters[J]. Environmental Science & Technology, 2017, 51(6): 3157-3164. |
| [40] |
Dutkiewicz S, Jeffrey Morris J, Follows MJ, Scott J, Levitan O, Dyhrman ST, Berman-Frank I. Impact of ocean acidification on the structure of future phytoplankton communities[J]. Nature Climate Change, 2015, 5(11): 1002-1006. DOI:10.1038/nclimate2722 |
| [41] |
Irwin AJ, Finkel ZV, Müller-Karger FE, Troccoli Ghinaglia L. Phytoplankton adapt to changing ocean environments[J]. PNAS, 2015, 112(18): 5762-5766. DOI:10.1073/pnas.1414752112 |
| [42] |
Beman JM, Chow CE, King AL, Feng YY, Fuhrman JA, Andersson A, Bates NR, Popp BN, Hutchins DA. Global declines in oceanic nitrification rates as a consequence of ocean acidification[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(1): 208-213. DOI:10.1073/pnas.1011053108 |
| [43] |
Rees AP, Brown IJ, Jayakumar A, Ward BB. The inhibition of N2O production by ocean acidification in cold temperate and polar waters[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2016, 127: 93-101. DOI:10.1016/j.dsr2.2015.12.006 |
| [44] |
Daims H, Lücker S, Wagner M. A new perspective on microbes formerly known as nitrite-oxidizing bacteria[J]. Trends in Microbiology, 2016, 24(9): 699-712. DOI:10.1016/j.tim.2016.05.004 |
 2021, Vol. 48
2021, Vol. 48