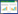扩展功能
文章信息
- 侯博, 王晨燕, 邵国青
- HOU Bo, WANG Chenyan, SHAO Guoqing
- 滑液囊支原体不同感染途径的致病力比较
- Comparison of pathogenicity to Mycoplasma synoviae with different infection routs
- 微生物学通报, 2021, 48(8): 2704-2713
- Microbiology China, 2021, 48(8): 2704-2713
- DOI: 10.13344/j.microbiol.china.210255
-
文章历史
- 收稿日期: 2021-03-16
- 接受日期: 2021-04-01
- 网络首发日期: 2021-04-28
2. 江苏省农业科学院兽医研究所 江苏 南京 210014
2. Institute of Veterinary Medicine, Jiangsu Academy of Agricultural Sciences, Nanjing, Jiangsu 210014, China
滑液囊支原体(Mycoplasma synoviae,MS)感染引起鸡和火鸡传染性滑膜炎、腱鞘炎及呼吸道症状,广泛存在于世界各地。自2010年以来,我国鸡群中MS的感染率不断增高,在2010-2015年对我国21省的44 395只非免疫鸡通过酶联免疫吸附法(Enzyme Linked Immunosorbent Assay,ELISA)检测发现MS能够感染任何年龄的鸡,总体流行率为41.19%,血清阳性率在不同年份从24.7%到57.20%不等[1]。2010-2015年我国16个省超过9 773个肉鸡群感染了MS,其中MS在多日龄混养的我国本土种鸡中广泛流行,在种鸡鸡胚中感染率高达16.29%[2]。2018年对宁夏石嘴山、银川、吴忠、中卫、固原5个地区鸡MS感染情况的调查中发现,MS抗体总阳性率为67.18%,各地区抗体阳性率为46.23%-89.67%[3]。因此,目前MS已广泛存在于我国不同种类的鸡群中,包括蛋鸡或种鸡、白羽肉鸡和黄鸡等。
在感染过程中,不同MS菌株对不同组织具有不同的嗜性[4],从滑液囊分离的MS更易引起滑液囊炎,致使关节肿胀、跛行、站立困难[5];输卵管型菌株引起蛋壳尖端异常(Eggshell Apex Abnormalities,EAA),使产蛋鸡产蛋量下降、蛋壳质量下降、蛋破损率上升,在种鸡中感染MS,则商品鸡的孵化率降低[6];呼吸型菌株主要造成亚临床的呼吸道疾病[5]。因此,MS是目前危害养鸡业最严重的细菌病原体之一。
本研究采用分离自上呼吸道的MS FZ株,以点眼、气管注射、爪垫注射、胸部皮下注射等不同途径感染56日龄无特定病原体(Specific Pathogen Free,SPF)鸡,通过临床症状和解剖病理变化观察、气管病原再分离、气管等组织病理损伤观察、感染后MS抗体检测比较MS不同感染途径对SPF鸡的感染能力和致病力,筛选MS人工感染后典型病理指征或致病力评价方法,建立MS人工感染56日龄SPF鸡的发病模型,以期为临床认识、诊断和有效防控MS在鸡群中的感染提供方法或依据。
1 材料与方法 1.1 主要试验材料MS的FZ分离株由福建省农业科学院畜牧兽医研究所保存;KM2支原体液体培养基由江苏省农业科学院兽医研究所提供;SPF种蛋,济南斯帕法斯家禽有限公司;SPF鸡饲料,北京科澳协力饲料有限公司;Mycoplasma synoviae Antibody Test Kit,BioChek公司。SPF鸡隔离器,苏州市冯氏实验动物设备有限公司;0.45 μm滤器,Millipore公司。
1.2 MS攻毒菌液的准备和半数颜色变化单位(Color Change Units 50,CCU50)测定将保存的P1代菌种以1:1 000接种新鲜KM2液体培养基,37 ℃静置培养1-3 d,待培养基颜色变为橙色或橙黄色时以不同途径进行人工感染试验,每羽鸡0.2 mL,同时测定CCU50。操作:取0.5 mL培养物加入到4.5 mL KM2培养基中,依次倍比稀释到10-10,每个稀释度的菌液分别移至4支不同的培养管中,每支1 mL,同时用无菌新鲜培养基设阴性对照,放入37 ℃培养箱中,5-10 d观察结果,当阴性对照培养基颜色不变色(玫瑰红色),而稀释菌液变色(变为黄色或橘黄色)则为支原体生长,记为阳性,按照Reed-Muench法计算攻毒菌株的CCU50/mL。
1.3 SPF鸡分组及人工感染试验安排SPF种蛋自行孵化,选取外观健康、初始体重接近的0日龄出壳雏鸡放入SPF鸡隔离器中饲养56日龄后,将72羽鸡随机分为6组,其中G1组点眼、G2组气管注射、G3组左爪爪垫注射、G4组胸部皮下注射、G5组在1、3、5 d以连续气管注射3次的方式分别对5组鸡进行人工感染,G6组的所有鸡用新鲜无菌培养基同时进行点眼、气管注射、胸部皮下注射、爪垫注射作为阴性对照。
1.4 感染后临床症状和大体解剖病理观察攻毒后对攻毒组、阴性对照组的鸡每日进行临床观察2次,主要观察是否出现咳喘、张口呼吸等呼吸道症状,以及胸部囊肿和爪垫肿胀程度。在攻毒后10 d和20 d每组随机各取6羽鸡采集血液将动物处死进行解剖,观察气囊炎、爪垫肿胀、胸部囊肿等发生情况并评分;另采集气管的下1/2段冻存于-70 ℃,用于MS再分离,气管的上1/2段和肿胀爪垫、胸部囊肿组织固定在10%福尔马林中,进行组织病理学分析。
1.5 组织病理损伤观察采集的病理组织经10%福尔马林固定后,逐级酒精脱水、透明、浸腊、包埋、切片,常规苏木精-伊红染色法(Hematoxylin-Eosin Staining,HE)染色,光镜下观察组织病理学损伤情况。所有组织形态学改变根据轻重进行评分,轻微、轻度、中度、重度分别评为1-4分,无病变记为0分。
1.6 感染后气管MS病原再分离将采集的气管加入KM2液体培养基3 mL后进行充分振荡,经0.45 μm滤器过滤后在37 ℃静置培养14 d,逐日观察培养基颜色变化,颜色由玫瑰红变为橘红色或黄色时,对发生颜色变化的培养物按照中华人民共和国行业标准NYT 553-2015禽支原体PCR检测方法进行鉴定,即以MS特异性引物对MS-F (5′-GAGAAGCAAAATAG TGATATCA-3′)和MS-R (5′-CAGTCGTCTCCGAA GTTAACAA-3′)进行PCR鉴定。
1.7 感染后MS抗体测定将动物处死前采集的血液于37 ℃放置3–4 h,然后2–8 ℃放置4-6 h,1 000 r/min离心10 min分离血清。采用Mycoplasma synoviae Antibody Test Kit按照试剂盒说明书对MS感染后血清样品进行MS抗体检测及阴性、阳性判定。
2 结果与分析 2.1 MS不同途径感染SPF鸡后临床症状及大体解剖病理变化MS FZ株新鲜培养物以107 CCU50/羽的剂量通过不同途径感染56日龄SPF鸡,在感染后的20 d,整个试验过程中未发现明显的呼吸道症状,但爪垫注射感染组的鸡出现了不同程度的爪垫肿胀,发病率为100%;在感染后10 d和20 d对肿胀的爪垫解剖发现有大量的肉芽组织增生,并出现了大量的黄色干酪样块状物质(图 1),部分还存在血红色样液体,根据肿胀严重程度进行评分,轻微、轻度、中度、重度分别为1-4分,无肿胀评为0分,各组爪垫肿胀发生情况以及评分见表 1。
|
| 图 1 MS FZ株以爪垫注射方式感染后与对照组爪垫损伤情况 Figure 1 Footpad lesions in birds challenged by footpad injection with MS FZ strain and non-challenged chickens Note: A and B: Lesion score 0, no foot-pad lesion was observed; C and D: Lesion score 3, foot-pad markedly swelling and inflamed, with proliferation of granulation tissue and the appearance of a large amount of yellow cheese-like mass |
|
|
| Groups | 10 DPI | 20 DPI | |||||
| Air sacculitis | Footpad swelling | Chest cyst | Air sacculitis | Footpad swelling | Chest cyst | ||
| G1 (Eye dropping) | 0/6* (0)** | 0/12 (0) | 2/12 (3) | 1/6 (1) | 0/6 (0) | 5/6 (10) | |
| G2 (Single tracheal injection) | 2/6 (8) | 0/12 (0) | 2/12 (2) | 0/6 (0) | 0/6 (0) | 3/6 (4) | |
| G3 (Footpad injection) | 0/6 (0) | 12/12 (33) | 2/12 (2) | 0/6 (0) | 6/6 (16) | 0/6 (0) | |
| G4 (Chest subcutaneous injection) | 0/6 (0) | 0/12 (0) | 12/12 (43) | 0/6 (0) | 0/6 (0) | 5/6 (20) | |
| G5 (Three consecutive tracheal injections) | 3/6 (24) | 0/12 (0) | 3/12 (3) | 1/6 (6) | 0/6 (0) | 2/6 (2) | |
| G6 (Control group) | 0/6 (0) | 0/12 (0) | 0/12 (0) | 0/6 (0) | 0/6 (0) | 2/6 (2) | |
| Note: *: Number of positive samples/Number of tested samples; **: Total lesion scores of tested chickens | |||||||
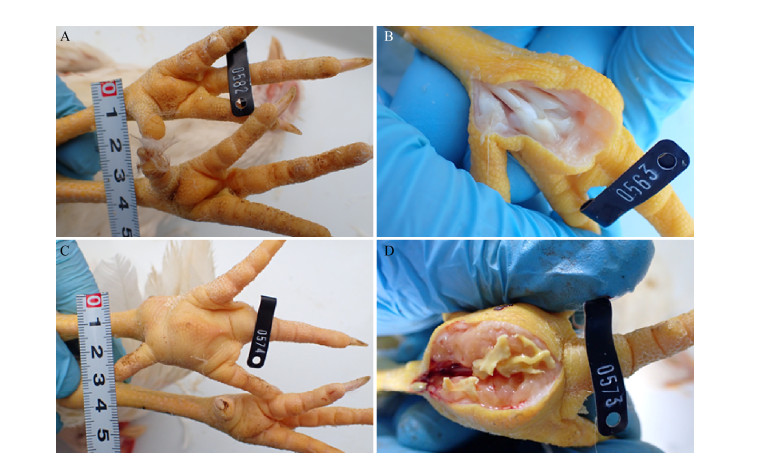
通过胸部皮下注射途径感染的鸡出现了严重的胸部囊肿现象。在感染后10 d时胸部囊肿发生率为100%,解剖后囊肿部位有大量的血红色样液体和黄色干酪样块状物质(图 2)。其余各组不同途径感染的少数鸡也出现了轻微的胸部囊肿现象,但解剖后仅存在少量的液体。点眼途径与其他各组相比较,在感染后20 d时大多数鸡(5/6)出现了轻度的胸骨囊肿现象。根据胸部囊肿严重程度进行评分,轻微、轻度、中度、重度分别为1-4分,无囊肿评为0分,各组胸部囊肿情况以及评分见表 1。
|
| 图 2 MS FZ株以胸部皮下注射方式感染后与对照组胸部囊肿损伤情况 Figure 2 Chest cyst lesions in birds challenged by chest subcutaneous injection with MS FZ strain and non-challenged chickens Note: A and B: Lesion score 0, no chest cyst lesion was observed; C and D: Lesion score 4, chest markedly swelling and inflamed, with a large amount of blood-red liquid and yellow cheese-like mass |
|
|
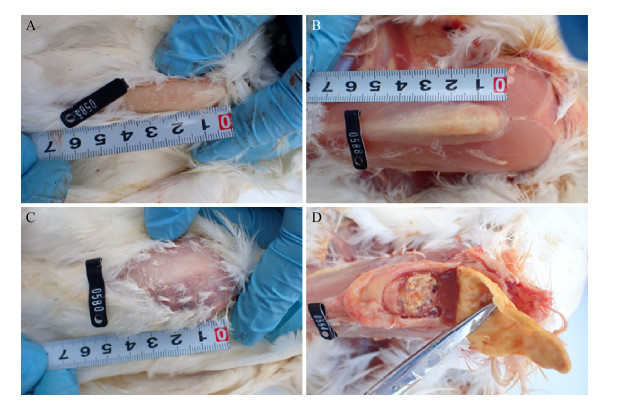
点眼和气管注射感染组在感染后10 d和20 d剖检时有不同数量的鸡出现了严重的气囊炎,其中点眼感染组在感染后20 d有1羽(1/6)鸡气囊出现滤泡增多,而单次气管注射或3次连续注射方式在感染后10 d时与20 d时相比,分别有2羽(2/6)和3羽(3/6)鸡在气囊上出现了大量的黄色块状干酪样物质(图 3)。根据参考文献[7]以气囊炎严重程度分别对胸气囊或腹气囊进行评分:0为未发现肉眼可见气囊损伤;1为可见淋巴滤泡病变或气囊轻度浑浊;2为气囊轻度增厚,通常有小的干酪样渗出物聚集;3为气囊明显增厚,透明度下降,有单一气囊具有大量干酪样渗出物;4同3,但是气囊损伤在胸气囊或腹气囊有2个或2个以上气囊中发现,根据评分表明气管连续注射3次感染组在感染后10 d时有50%的鸡出现了严重的气囊炎,各组气囊炎发生情况以及评分见表 1。
|
| 图 3 MS FZ株以气管注射方式感染后与对照组气囊损伤情况 Figure 3 Air sac lesions in birds challenged by tracheal injection with MS FZ strain and non-challenged chickens Note: A and C: Lesion score 0, no lesion was observed in thoracic air sac (A) and ventral air sac (C); B and D: Lesion score 4, thoracic air sac (B) and ventral air sac (D) markedly swelling and inflamed, with a large amount of yellow cheese-like mass |
|
|
采用分离培养的方法对气管进行MS病原再分离,结果显示气管注射途径(包括单次注射和连续3次注射)在感染后10 d和20 d的MS分离率均为100% (6/6),点眼途径在感染后10 d和20 d分别为66.7% (4/6)和100% (6/6),并且爪垫和胸部注射途径感染也可以从气管中分离到MS,不同感染时间各组的气管MS分离结果见表 2。
| Groups | Re-isolation at 10 DPI | Re-isolation at 20 DPI |
| G1 | 4/6* | 6/6 |
| G2 | 6/6 | 6/6 |
| G3 | 1/6 | 2/6 |
| G4 | 2/6 | 0/6 |
| G5 | 6/6 | 6/6 |
| G6 | 0/6 | 0/6 |
| Note: *: No. of positive samples/No. of tested samples | ||
点眼感染(G1)、胸部皮下注射感染组(G4)和阴性对照组(G6)气管组织结构正常完整,管壁分为3层,由内向外依次为黏膜、黏膜下层和外膜;黏膜由上皮和固有层构成,上皮为假复层柱状上皮,由纤毛细胞、杯状细胞、基细胞、刷细胞和弥散神经内分泌细胞构成;外膜正常;单次气管注射感染组(G2)和爪垫注射感染(G3)分别在感染后10 d和20 d各有1羽鸡气管见黏膜固有层/黏膜下层轻微局灶性炎细胞浸润,但连续3次气管注射组(G5)在感染后10 d和20 d分别有4羽鸡的气管黏膜固有层/黏膜下层发生轻微至轻度灶性炎细胞浸润(4/6)。对G3和G4组爪垫肿胀或胸骨囊肿形成的黄色干酪样块状物质及其附近病变组织进行病理学观察发现有大量的纤维组织和血管增生,同时伴有大量炎性细胞浸润,炎性细胞以单核细胞为主(图 4)。
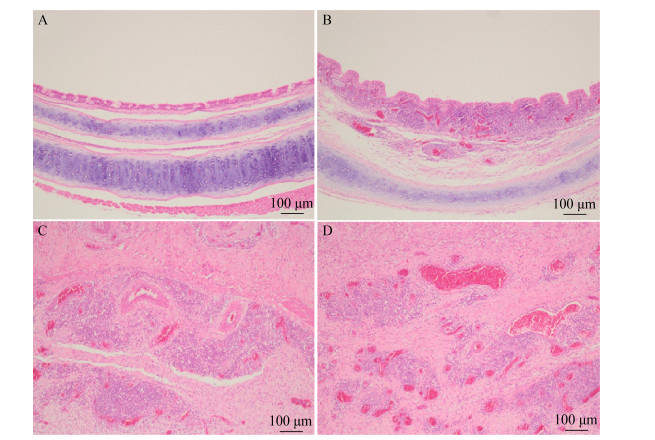
|
| 图 4 MS FZ株感染后气管、爪垫、胸部囊肿的病理损伤情况 Figure 4 Histopathological lesions of trachea, footpad swelling and chest cyst in MS FZ strain challenged and non-challenged chickens Note: A: Normal tracheal mucosa; B: Tracheal mucosa of chickens infected with MS FZ strain by three consecutive tracheal injections, showing marked thickening of mucosa associated with severe diffuse inflammatory cell infiltration in the lamina propria/submucosa of the tracheal mucosa; C and D: Showing a large number of fibrous tissue and blood vessel proliferation, accompanied by a large number of inflammatory cell infiltration (mainly monocytes) in footpad swelling (C) and chest cyst (D) |
|
|
对攻毒后10 d和20 d的鸡测定MS抗体发现,不同途径感染56日龄SPF鸡后血清阳性率不同,其中爪垫攻毒组在感染后10 d和20 d的血清阳性率均为100% (6/6),而点眼途径感染后20 d时出现1羽鸡抗体阳性。与单次气管注射相比,连续3次气管注射的方式攻毒可以提高抗体阳性率,各组抗体阳性率见表 3。
| Groups | ELISA of 10 DPI | ELISA of 20 DPI |
| G1 | 0/6* | 1/6 |
| G2 | 3/6 | 1/6 |
| G3 | 6/6 | 6/6 |
| G4 | 5/6 | 3/6 |
| G5 | 5/6 | 2/6 |
| G6 | 0/6 | 0/6 |
| Note: *: Number of positive samples/Number of tested samples (ELISA positive: S/P > 0.5) | ||
由于实施了鸡毒支原体的控制程序,现在MS已转变成为全球造成家禽生产经济损失的最重要的细菌病[8],各日龄的鸡和火鸡均可感染MS,尤以4-18周的鸡最易感。从2010年开始,MS在我国鸡群中的感染率持续上升,感染率有时高达100%且能够感染任何年龄的鸡,导致死亡率升高,药物成本和生产成本增加,使得蛋鸡滑液囊炎和肉鸡呼吸道疾病的预防和控制变得更为复杂和困难[1]。MS感染主要引起呼吸道疾病、滑液囊炎、EAA和亚临床感染,但不同MS菌株的致病力差异很大,有的MS菌株感染不一定表现出临床症状[4],通常需要其他因素进行诱发。本研究采用分离自上呼吸道的福建本地流行株FZ株为感染菌株,通过点眼、气管注射、爪垫注射、胸部皮下注射等不同途径感染56日龄SPF鸡,系统比较了不同感染途径MS对56日龄SPF鸡的致病力和典型病理指征。
不同MS分离株的感染性、组织嗜性和致病性不同,从呼吸道分离的菌株更易引起气囊炎等呼吸道症状,而从滑膜分离的菌株较易引起滑膜炎[5],对6株MS菌株分别通过爪垫注射和点眼2种不同途径感染1日龄鸡后进行组织病理变化观察和病原再分离,结果表明不同的菌株对不同组织具有不同的致病性,部分菌株通过点眼感染仅在上、下呼吸系统有MS存在并引发损伤,并且对同一菌株通过点眼或爪垫注射对不同的组织器官具有不同的病原分布和病理损伤[4]。对11日龄商品肉鸡以气溶胶和爪垫注射方式感染不同MS菌株,同时采用新城疫病毒和传染性支气管炎病毒二联活疫苗进行诱发,MS可以引起明显的爪垫肿胀,导致气管黏膜发生病理变化,而且不同菌株的致病力不同[9];MS感染影响产蛋量,降低产蛋数和平均重[10];对MS与产异常蛋之间的关系研究表明,有2株MS菌株通过气管接种在感染后21-42 d日产蛋量下降11%,EAA发生率增加到24.5%,同时出现了软壳蛋,其蛋壳表面发生结构变化[11]。本研究通过爪垫或胸部皮下注射途径均可使100%的鸡发病,出现爪垫肿胀或胸部囊肿;点眼、单次或连续3次气管注射感染鸡在感染10 d后的发病率分别为0.0%、33.3%和50.0%,因此,不仅不同MS菌株在感染过程中的感染性、组织嗜性和致病性有所不同,而且对同一菌株以不同途径感染,其发病率和临床病理变化也不同。本研究成功利用MS FZ株通过不同途径单独感染56日龄SPF鸡导致了明显的局部临床病理变化,并且脚垫和胸部皮下注射途径的发病率高,建立的感染模型可以用作新的MS防控方案有效性的评估。
通过对气管、肿胀爪垫和囊肿的胸部病变组织进行病理学观察,点眼、胸部皮下注射感染MS不影响气管组织结构,而单次气管注射和爪垫注射感染分别在感染后有个别鸡气管黏膜固有层/黏膜下层出现轻微局灶性炎细胞浸润,但连续3次气管注射在感染后10 d和20 d大部分鸡(4/6)的气管黏膜固有层/黏膜下层发生轻微至轻度灶性炎性细胞浸润,对11日龄商品肉鸡以气溶胶和爪垫注射方式感染MS后,采用新城疫病毒(Newcastle Disease Virus,NDV)和传染性支气管炎病毒(Infectious Bronchitis Virus,IBV)二联活疫苗诱发导致气管黏膜层增厚和炎性细胞浸润[9],因此,对气管造成病理损伤的严重程度不仅与感染方式相关,还与是否存在其他诱发因素相关。研究发现田间临床发生MS感染的病鸡主要以关节腔和爪垫大量脓液为主要特征,组织病理学以炎性细胞渗出、崩解、坏死为主[12],而本研究对肿胀爪垫或囊肿的胸部病变组织观察发现有大量的肉芽组织增生,以及纤维组织和血管增生,同时伴有大量炎性细胞浸润,炎细胞以单核细胞为主。因此本研究表明感染途径不同导致组织病理变化不同,在生产实践中导致MS感染后临床表现和解剖病变不同或许与感染途径相关。
MS感染很有可能作为原发因素继发蛋鸡感染大肠杆菌,促使蛋鸡大肠杆菌腹膜炎综合征复杂化[13],此外IBV可以促进鸡在MS气溶胶暴露下的滑液囊炎发生,并且关节病理损伤的发生率与IBV毒株具有依赖关系[14]。MS感染后免疫NDV活疫苗的鸡对NDV疫苗的抗体水平较低、持续时间短,表明免疫NDV疫苗前发生MS感染或许会造成免疫反应失败[15],而从MS感染鸡的上呼吸道进行病原分离更为可靠[5]。有研究报道NDV和IBV二联活疫苗可以加重11日龄商品肉鸡感染MS后的气管组织病理学损伤[9],而本研究中气管病原再分离试验结果表明气管注射途径(包括单次注射和连续3次注射)在感染后10 d和20 d的分离率均为100%,点眼途径在感染后10 d和20 d的分离率也可分别达到66.7%和100%,并且爪垫和胸部注射途径感染虽不能引起明显的气管组织病理变化,但少部分鸡气管中也存在MS,所以在田间不论发生何种途径的MS感染,均对其他疫苗的免疫效果具有潜在的威胁或影响,或与IBV和NDV混合感染促进和/或加重感染后的临床症状和病理损伤,导致更严重的经济损失,因此,在生产中当未有明显的MS感染临床症状而通过呼吸系统免疫弱毒活疫苗时,应当对MS感染情况进行病原学检测,正确使用疫苗,避免诱发MS临床症状的出现。
MS感染后3 d通过分离培养和/或PCR方法可以检测到病原体,而通过血清平板凝集(Serum Plate Agglutination,SPA)或ELISA方法在培养或PCR检测阳性后3-4周才可检测到血清抗体阳性[16]。本研究对不同途径攻毒10 d和20 d后的鸡测定MS抗体发现血清阳性率不同,其中爪垫攻毒组在感染后10 d和20 d的血清阳性率均为100%,胸部皮下注射组在感染后10 d和20 d的血清阳性率分别为83.3%和50.0%,而点眼途径感染后20 d时仅出现1羽鸡(16.7%)抗体阳性,与单次气管注射相比,连续3次气管注射的方式攻毒可以提高抗体阳性率,结果表明不同感染途径造成MS抗体开始出现阳性的时间不同。另外,通过对临床发生气囊炎、胸骨囊肿等病理症状的鸡进行MS抗体检测发现,临床病理症状出现与否和抗体阳性不具有相关性,因此与MS病原检测相比,当在生产实践中以MS抗体检测或临床症状作为诊断标准时,可能会造成延误诊断、假阴性或感染率偏低等问题,在临床中应当对这一问题给予足够重视。
通过MS不同方式感染56日龄SPF鸡的临床症状和临床病理变化、气管组织病理损伤、气管MS再分离和MS抗体检测,结果表明MS不同方式感染后出现的临床症状和发病率差异较大,其中点眼感染临床症状最轻、MS抗体转阳最迟,但气管组织也具有较高的病原再分离率,而气管注射、爪垫注射、胸部皮下注射等方式均可引起明显的局部临床病理变化或临床症状,具有很高的发病率,因此,本研究建立了可靠的8周龄SPF鸡的MS人工感染发病模型,筛选出了MS人工感染后典型的病理指征或致病力评价方法,其中点眼感染途径和气管注射途径以气管病原再分离作为主要指征,辅以气囊炎进行评价,而胸部皮下注射和爪垫注射途径分别以胸部囊肿和爪垫肿胀作为主要病理指征进行评价。本研究建立的人工发病模型将为临床认识、诊断和开发疫苗,而有效防控MS在鸡群中的感染提供科学方法或理论依据。
| [1] |
Xue J, Xu MY, Ma ZJ, Zhao J, Jin N, Zhang GZ. Serological investigation of Mycoplasma synoviae infection in China from 2010 to 2015[J]. Poultry Science, 2017, 96(9): 3109-3112. DOI:10.3382/ps/pex134 |
| [2] |
Sun SK, Lin X, Chen F, Wang DA, Lu JP, Qin JP, Luo TR. Epidemiological investigation of Mycoplasma synoviae in native chicken breeds in China[J]. BMC Veterinary Research, 2017, 13(115). DOI:10.1186/s12917-017-1029-0 |
| [3] |
Chen XH, Guo YN, Si DD, Xu JY, Jiang XJ, Guo L, He SH. Epidemiological investigation and analysis of Mycoplasma synoviae in infection in chickens in Ningxia region[J]. Chinese journal of preventive veterinary medicine, 2020, 42(3): 234-238. (in Chinese) 陈秀红, 郭亚男, 司朵朵, 徐婧祎, 姜肖军, 郭磊, 何生虎. 宁夏地区鸡滑液囊支原体病流行病学调查与分析[J]. 中国预防兽医学报, 2020, 42(3): 234-238. |
| [4] |
Lockaby SB, Hoerr FJ, Lauerman LH, Kleven SH. Pathogenicity of Mycoplasma synoviae in broiler chickens[J]. Veterinary Pathology, 1998, 35(3): 178-190. DOI:10.1177/030098589803500303 |
| [5] |
Kleven SH, Ferguson-Noel N. Mycoplasma synoviae infection[A]//Saif YM, Fadly AH, Glisson JR, McDougald JR, Nolan NK, Swayne DE. Diseases of Poultry[M]: 12th Edition. Ames, Iowa, USA: Blackwell Publishing, 2008: 845-856
|
| [6] |
Kursa O, Pakuła A, Tomczyk G, Paśko S, Sawicka A. Eggshell apex abnormalities caused by two different Mycoplasma synoviae genotypes and evaluation of eggshell anomalies by full-field optical coherence tomography[J]. BMC Veterinary Research, 2019. DOI:10.1186/s12917-018-1758-8 |
| [7] |
Kleven SH, King DD, Anderson DP. Airsacculitis in broilers from Mycoplasma synoviae: effect on air-sac lesions of vaccinating with infectious bronchitis and Newcastle virus[J]. Avian Diseases, 1972, 16(4): 915-924. DOI:10.2307/1588772 |
| [8] |
Zhu L, Shahid MA, Markham J, Browning GF, Noormohammadi AH, Marenda MS. Genome analysis of Mycoplasma synoviae strain MS-H, the most common M. synoviae strain with a worldwide distribution[J]. BMC Genomics, 2018. DOI:10.1186/s12864-018-4501-8 |
| [9] |
Gong XW, Chen QW, FergusonNoel NL, Zheng FY, Stipkovits L, Szathmary SS, Liu YS. Comparison the pathogenicity of three Mycoplasma synoviae isolates from broiler flocks[J]. Microbiology China, 2019, 46(4): 790-797. (in Chinese) 宫晓炜, 陈启伟, Ferguson-Noel Naola, 郑福英, Stipkovits Laszlo, Szathmary Susan, 刘永生. 3株禽滑液囊支原体分离株致病性的比较和评价[J]. 微生物学通报, 2019, 46(4): 790-797. |
| [10] |
Catania S, Gobbo F, Bilato D, et al. Two strains of Mycoplasma synoviae from chicken flocks on the same layer farm differ in their ability to produce eggshell apex abnormality[J]. Veterinary Microbiology, 2016, 193: 60-66. DOI:10.1016/j.vetmic.2016.08.007 |
| [11] |
Kursa O, Tomczyk G, Sawicka A. Prevalence and phylogenetic analysis of Mycoplasma synoviae strains isolated from Polish chicken layer flocks[J]. Journal of Veterinary Research, 2019, 63(1): 41-49. DOI:10.2478/jvetres-2019-0010 |
| [12] |
Ding MJ, Zhou YY, Zhang Y, Zhang D, Zhou YQ, Yin XF, Zhang XF. Pathological observation of Mycoplasma synoviae infecting chickens[J]. Animal Husbandry and Veterinary Medicine, 2020, 52(12): 66-69. (in Chinese) 丁美娟, 周永银, 张懿, 张丹, 周勇岐, 尹秀凤, 张小飞. 鸡感染滑液囊支原体的病理学观察[J]. 畜牧与兽医, 2020, 52(12): 66-69. |
| [13] |
Raviv Z, Ferguson-Noel N, Laibinis V, Wooten R, Kleven SH. Role of Mycoplasma synoviae in commercial layer Escherichia coli peritonitis syndrome[J]. Avian Diseases, 2007, 51(3): 685-690. DOI:10.1637/0005-2086(2007)51[685:ROMSIC]2.0.CO;2 |
| [14] |
Landman WJM, Feberwee A. Aerosol-induced Mycoplasma synoviae arthritis: the synergistic effect of infectious bronchitis virus infection[J]. Avian Pathology, 2004, 33(6): 591-598. DOI:10.1080/03079450400013170 |
| [15] |
De Cássia Figueira Silva R, Do Nascimento ER, De Almeida Pereira VL, Barreto ML, Do Nascimento MDGF. Mycoplasma synoviae infection on Newcastle disease vaccination of chickens[J]. Brazilian Journal of Microbiology, 2008, 39(2): 384-389. DOI:10.1590/S1517-83822008000200033 |
| [16] |
Ewing ML, Cookson KC, Phillips RA, Turner KR, Kleven SH. Experimental Infection and Transmissibility of Mycoplasma synoviae with Delayed Serologic Response in Chickens[J]. Avian Diseases, 1998, 42(2): 230-238. DOI:10.2307/1592472 |
 2021, Vol. 48
2021, Vol. 48