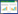扩展功能
文章信息
- 文玉康, 周冰倩, 陈政锟, 杨梅, 田亚琴, 丁红雷
- WEN Yukang, ZHOU Bingqian, CHEN Zhengkun, YANG Mei, TIAN Yaqin, DING Honglei
- 猪肺炎支原体Mhp366-N蛋白多克隆抗体的制备及应用
- Preparation and application of polyclonal antibody against Mhp366-N protein of Mycoplasma hyopneumoniae
- 微生物学通报, 2021, 48(8): 2695-2703
- Microbiology China, 2021, 48(8): 2695-2703
- DOI: 10.13344/j.microbiol.china.210332
-
文章历史
- 收稿日期: 2021-04-08
- 接受日期: 2021-05-20
- 网络首发日期: 2021-06-18
2. 西南大学医学研究院免疫学研究中心 重庆 400715
2. Immunology Research Center of Medical Research Institute, Southwest University, Chongqing 400715, China
猪肺炎支原体是引起猪支原体肺炎的病原,该菌广泛流行于世界各地的猪场[1]。在集约化的现代养猪生产中,猪支原体肺炎主要以隐性感染形式存在,通常不引起猪的死亡,但造成饲料转化率降低和生产性能下降。该病每年造成我国养猪业的经济损失至少100亿元,间接经济损失以数倍计。因此,应加强该病的基础理论和防控手段研究。Mhp366蛋白是猪肺炎支原体感染细胞后大量表达的一种蛋白,该蛋白编码的基因广泛存在于不同的猪肺炎支原体菌株[2],我们前期的研究也证明该蛋白是猪肺炎支原体的一种特异蛋白,与其他病原的血清没有交叉免疫反应[3],因此其抗体非常适合用于猪肺炎支原体的检测。基于此,本研究拟制备Mhp366蛋白的多克隆抗体,并确定抗体的应用范围和最佳稀释倍数,以期为猪肺炎支原体的相关研究提供技术手段。
1 材料与方法 1.1 材料 1.1.1 菌株重组菌Escherichia coli BL21(DE3)-pET28a(+)- mhp366-N由本实验室构建与保存[3]。猪肺炎支原体AH株由江苏省农业科学院兽医研究所邵国青研究员惠赠。
1.1.2 细胞株猪肺泡巨噬细胞系3D4/21购自美国模式菌种保藏中心。
1.1.3 实验动物SPF级6周龄昆明小鼠购自重庆恩斯维尔生物科技有限公司,共购买5只。
1.1.4 培养基、主要试剂和仪器KM2猪肺炎支原体肉汤培养基,山东拓普生物工程有限公司。猪血清,上海江莱生物科技有限公司;RPMI 1640培养液,Thermo Fisher公司;DMEM高糖培养液,HyClone公司;镍柱,GE Healthcare公司;HRP标记羊抗小鼠IgG (用于免疫组化试验),北京索莱宝科技有限公司;HRP标记山羊抗小鼠IgG (H+L) (用于免疫印迹试验),北京博奥森生物技术有限公司;β-Actin小鼠单克隆抗体、Alexa Fluor 488标记山羊抗小鼠IgG (H+L),Proteintech公司;VECTASTAIN® ABC免疫组化试剂盒,Vector Laboratories公司。化学发光成像系统,伯乐生命医学产品有限公司。
1.2 方法 1.2.1 Mhp366-N蛋白的原核表达与纯化取本实验室-80 ℃保存的重组菌E. coli BL21(DE3)-pET28a(+)-mhp366-N划线于Kan+ LB平板,37 ℃培养15 h。挑取单菌落接种Kan+ LB液体培养基,37 ℃、120 r/min培养过夜后,按1:100比例转接1 L Kan+ LB液体培养基,37 ℃、220 r/min培养至OD600为0.6-0.8,加入终浓度为1 mmol/L IPTG,16 ℃、180 r/min诱导表达20 h。室温5 000 r/min离心5 min收集菌体。
收集的菌体加入Binding Buffer,以12%的功率超声破菌30次(超声9 s,间歇9 s)后4 ℃、12 000 r/min离心30 min,取上清进行亲和层析纯化。纯化时依次用含0.05、0.1和0.25 mol/L咪唑的Washing Buffer洗去杂蛋白,最后用含0.5 mol/L咪唑的Elution Buffer洗脱纯化蛋白。纯化的蛋白加入透析袋与PBS透析置换,经离心浓缩,用BCA蛋白浓度测定试剂盒测定蛋白浓度。纯化后的蛋白-20 ℃保存备用。
1.2.2 Mhp366-N蛋白多克隆抗体的制备将纯化的Mhp366-N蛋白调整至浓度为2 mg/mL,取1 mL蛋白溶液与1 mL弗氏完全佐剂或弗氏不完全佐剂混合,在研钵研磨至油包水样乳剂。
购回的小鼠饲养1周适应环境。免疫前尾静脉采血(定为第0天)。分别在采血后第1、15、22、29天在小鼠腹股沟、背部皮下进行免疫,每只小鼠免疫0.2 mL。第1次免疫用Mhp366-N纯化蛋白与弗氏完全佐剂混合蛋白,第2、3次免疫用Mhp366-N纯化蛋白与弗氏不完全佐剂混合蛋白,第4次免疫浓度为1 mg/mL的纯化蛋白。第35天小鼠眼球取血。第0天和第35天采集的血液均5 000 r/min离心10 min分离血清,按1:1的比例加入甘油,-20 ℃保存。
1.2.3 Mhp366-N蛋白多克隆抗体效价测定用碳酸盐缓冲液调整纯化的Mhp366-N蛋白浓度至0.25 μg/mL,加入酶标板,每孔100 μL,37 ℃孵育1 h后4 ℃过夜;用含0.05%吐温-20的PBS (PBST)洗板5次,每次3 min;加入200 μL含2.5%脱脂奶粉的PBS 37 ℃封闭1 h后PBST洗涤5次,每次3 min;将5份血清均用封闭液分别按1:500、1:1 000、1:2 000、1:4 000、1:8 000、1:16 000、1:32 000、1:64 000、1:128 000、1:256 000、1:512 000、1:1 024 000的比例稀释,加入酶标板,每孔100 μL,免疫前小鼠血清作为阴性对照(封闭液1:500稀释),37 ℃孵育0.5 h后洗板;加入用封闭液按1:10 000比例稀释的HRP标记山羊抗小鼠IgG (H+L)酶标二抗,每孔100 μL,37 ℃孵育1 h;再次洗板后每孔加入底物液A、B各50 μL[3],混匀,室温避光显色15 min;加入50 μL终止液[3],10 min内酶标仪测定OD450。待测血清OD450测定数值记为S,阴性对照血清测定OD450数值记为N,以S/N≥2.1作为Cut-Off值。
1.2.4 猪肺炎支原体AH株生长曲线的测定将-80 ℃保存的猪肺炎支原体AH株按1:9的比例接种KM2液体培养基,37 ℃静置培养至培养基颜色刚刚由红色变为浅黄色。将培养的菌液再以1:9的比例接种1.8 mL KM2液体培养基,接种3管。置于37 ℃培养箱中培养。分别在培养的0、12、24、36、48、60、72、84 h取200 μL备用。同时,每管菌液再各取50 μL用分光光度计测定OD600吸光度。
取810支小试管,分为81组,每组10支试管。向每个试管加入KM2液体培养基450 μL。取备用菌液50 μL加入第一个试管,缓慢吸吹数次,使备用菌液与KM2液体培养基混合均匀,再吸取50 μL液体小心地移至第2支试管,如此连续稀释至第9支试管,备用菌液稀释倍数依次为1:10至1:109。第10支试管为阴性对照。每管备用菌液每个时间点做3个重复。稀释的菌液37 ℃培养7 d,以3个重复的平均颜色变化单位(Color Changing Unit,CCU)作为每管备用菌液每个时间点的CCU。
以样品不同时间点的平均OD600值为横坐标,以样品每个时间点的CCU对数(lgCCU)为纵坐标,绘制生长曲线。
1.2.5 猪肺炎支原体AH株感染3D4/21细胞最佳感染复数的确定取96孔细胞培养板,每孔加入103个3D4/21细胞,5% CO2细胞培养箱37 ℃培养过夜。
测定培养至颜色刚变黄的AH株菌液OD600值,计算CCU。13 000 r/min离心20 min,弃上清,PBS洗涤3次。用含10% FBS的DMEM培养基重悬AH株。
培养的3D4/21细胞PBS洗涤3次。按感染复数(Multiplicity of Infection,MOI)分别为5、10、100、200、500、1 000加入AH株。1 000 r/min离心40 min,在5% CO2细胞培养箱37 ℃培养24 h。取出细胞培养板,每孔加入10 μL CCK-8溶液,再于5% CO2细胞培养箱37 ℃培养2 h。酶标仪测定在OD450处的吸光度。根据测定的数值绘制细胞活力曲线。根据曲线确定AH株感染3D4/21细胞的最佳MOI。
1.2.6 Mhp366-N多克隆抗体用于免疫印迹试验最佳稀释倍数的确定3D4/21细胞接种24孔细胞培养板培养至70%-80%时,每孔加入最佳MOI的AH株,1 000 r/min离心40 min,5% CO2细胞培养箱37 ℃分别培养1、2和3 h后弃去培养液,PBS洗涤2次。加入160 μL细胞裂解液冰水浴30 min,10 000 r/min离心5 min,收集上清。BCA蛋白浓度测定试剂盒测定蛋白浓度后调整蛋白浓度,加入SDS-PAGE上样缓冲液,105 ℃煮沸8 min。SDS-PAGE后转PVDF膜,用含5%脱脂奶粉的Tris/吐温-20缓冲液(Tris-Buffered Saline Solution/Tween-20,TBST)室温封闭2 h。TBST洗涤5次,每次5 min。加入不同稀释比例的Mhp366-N多抗(1:1 000、1:10 000、1:100 000、1:1 000 000、1:10 000 000),4 ℃孵育过夜,TBST洗涤。加入1:5 000稀释的HRP标记山羊抗小鼠IgG (H+L),室温孵育1 h,TBST洗涤。eECL显色。β-Actin作为内参。
1.2.7 Mhp366-N多克隆抗体用于免疫荧光试验最佳稀释倍数的确定3D4/21细胞接种24孔细胞培养板培养至70%–80%时,每孔加入最佳MOI的AH株,1 000 r/min离心40 min,在5% CO2细胞培养箱37 ℃培养1 h。培养后的细胞弃去培养液,每孔加入200 μL 4%多聚甲醛,室温固定1 h,PBS洗涤3次,每次5 min。加入200 μL 0.2% Triton X-100,透化15 min,PBS洗涤。加入200 μL 5% BSA,室温封闭1 h,PBS洗涤。加入不同稀释比例的Mhp366-N多抗(1:1 000、1:10 000、1:100 000、1:1 000 000、1:10 000 000),4 ℃孵育过夜,PBS洗涤。加入Alexa Fluor 488标记山羊抗小鼠IgG (H+L) (1:300稀释),室温孵育1 h,PBS洗涤。加入200 μL DAPI,室温避光孵育5 min,PBS洗涤。取出细胞爬片,吸干水分,滴加抗荧光衰减封片剂封片。荧光倒置显微镜观察结果。
1.2.8 Mhp366-N多克隆抗体用于猪肺泡巨噬细胞中猪肺炎支原体的检测在屠宰场采集猪肺,分别取有典型猪支原体肺炎病变的猪肺和无任何病变的猪肺,用50 mL PBS灌洗猪肺后取肺泡灌洗液,1 500 r/min离心10 min分离猪肺泡巨噬细胞。分离的细胞分为3份,一份用巢式PCR检测猪肺炎支原体P36基因[4];一份经细胞裂解液裂解后加入SDS-PAGE上样缓冲液煮沸,按1.2.6确定的Mhp366-N多抗最佳稀释倍数进行免疫印迹试验;一份接种24孔细胞培养板,加入终浓度为100 U/mL青霉素、0.1 mg/mL链霉素和10% FBS的RPMI 1640培养基,在5% CO2细胞培养箱37 ℃培养10 h,按1.2.7确定的Mhp366-N多抗最佳稀释倍数进行免疫荧光试验。
1.2.9 用Mhp366-N多克隆抗体免疫组化检测临床肺组织样品中猪肺炎支原体在屠宰场采集猪肺,分别取有典型猪支原体肺炎病变和无任何病变的猪肺。每个猪肺均进行P36基因检测[4]。取P36基因检测阴性外表无猪支原体肺炎病变和P36基因检测阳性有猪支原体肺炎典型病变的核桃大小猪肺完全浸于10%福尔马林中固定,期间换液2次;一个月后将固定好的肺组织切成花生米大小并置于组织包埋盒中继续固定;切片后依次加入1:200稀释的Mhp366-N多抗和1:200稀释的HRP标记羊抗小鼠IgG并进行DAB显色。显微镜下观察肺组织细胞染色结果。
2 结果与分析 2.1 Mhp366-N蛋白的原核表达与纯化重组菌E. coli BL21(DE3)-pET28a(+)-mhp366-N破菌后离心,取上清进行纯化。SDS-PAGE电泳显示在40 kD处有一条清晰的目的条带。虽然在60 kD处有一条杂蛋白条带,但取8–14的蛋白进行浓缩,蛋白纯度仍在85%以上(图 1)。
|
| 图 1 Mhp366-N蛋白的纯化 Figure 1 Purification of Mhp366-N 注:M:Marker;1:超声破菌上清上样;2:含0.05 mol/L咪唑的洗脱缓冲液进行洗脱;3:含0.1 mol/L咪唑的洗脱缓冲液进行洗脱;4:含0.25 mol/L咪唑的洗脱缓冲液进行洗脱;5-14:纯化蛋白 Note: M: Marker; 1: Supernatant of ultrasonic bacterium; 2: Affinity purification with 0.05 mol/L imidazole; 3: Affinity purification with 0.1 mol/L imidazole; 4: Affinity purification with 0.25 mol/L imidazole; 5-14: Purified protein |
|
|
5只小鼠抗血清的抗体效价分别为1:128 000、1:128 000、1:512 000、1:256 000、1:128 000,表明免疫小鼠制备的Mhp366-N血清抗体效价均较高。选择抗体效价为1:512 000的抗血清用于后续试验。其余血清按1:1比例加入甘油-80 ℃保存备用。
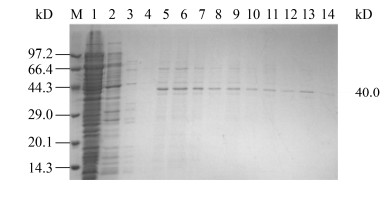
2.3 猪肺炎支原体AH株的生长曲线由图 2可知,猪肺炎支原体AH株的菌液浓度随培养时间延长逐渐增加,在培养的第58 h达到最大,之后随时间延长逐渐下降(图 2A);菌液的CCU开始也逐渐上升,并在培养的第60 h达到顶峰(图 2B)。以菌液浓度为横坐标,lgCCU为纵坐标绘制AH株生长曲线,lgCCU随菌液浓度生长曲线的趋势为y=161.01x–18.633,其中y为lgCCU,x为OD600 (图 2C)。
|
| 图 2 猪肺炎支原体AH株生长曲线及感染3D4/21细胞的最佳感染复数 Figure 2 Growth curve of M. hyopneumoniae AH strain and the optimal multiplicity of infection of 3D4/21 cells after AH strain infection 注:A:在不同培养时间OD600的曲线;B:在不同培养时间AH株的生长曲线;C:AH株随OD600变化的生长曲线;D:CCK-8试验测定AH株感染3D4/21细胞的细胞活力。细胞活力随着MOI的升高逐渐增加,在MOI=200时达到最高,之后随着MOI的升高逐渐下降。MOI=1 000时的细胞活力显著低于200时的细胞活力。每个试验3个重复。每个点代表平均值±3×标准差。统计学方法:单因素方差分析,**:P≤0.01 Note: A: The curve of OD600 in different culture time. B: Growth curve of AH strain in different culture time. C: Growth curve of AH strain with the change of OD600. D: Cell viability of 3D4/21 cells after AH strain infection was measured by CCK-8 assay. The cell viability increased with the increase of MOI. The cell viability was the highest when MOI was 200, and then decreased with the increase of MOI. The cell viability at MOI was 1 000 was significantly lower than that at MOI was 200. The data represent the mean±3SD. One-way ANOVA, **: P≤0.01 |
|
|
以不同的MOI感染3D4/21细胞,随着MOI的增加,在MOI=200时细胞活力最高,之后随着MOI增加细胞活力逐渐下降(图 2D)。
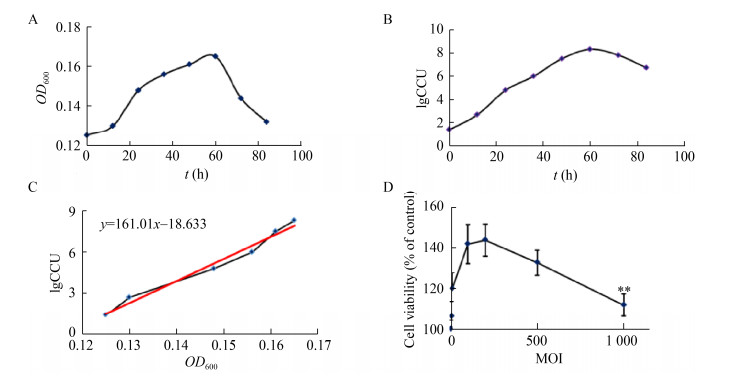
2.5 Mhp366-N多克隆抗体用于免疫印迹试验的最佳稀释倍数由图 3可见,将Mhp366-N多克隆抗体以1:1 000稀释,免疫印迹的条带最明显;以1:10 000、1:100 000稀释,也能看到清晰的条带;1:100 000稀释时,可看到2条条带。以1: 1 000 000、1:10 000 000稀释,由于稀释倍数过大,目的条带模糊不清(图 3)。由于Mhp366可进行自身切割,Western Blot试验可见2条条带[2],因此以1:100 000稀释作为最佳稀释倍数。此外,在感染0 h时,未检测到Mhp366蛋白,而感染后1 h,Mhp366蛋白即可表达。
|
| 图 3 Mhp366-N多克隆抗体用于免疫印迹试验的最佳稀释倍数 Figure 3 The optimal dilution of Mhp366-N polyclonal antibody for Western blot assay 注:Mhp366-N多抗从1:1 000开始进行10倍系列稀释后与膜进行反应。当1:100 000稀释时,能看到2条清晰的条带 Note: Mhp366-N polyclonal antibody used in the experiments was 10-fold serially diluted starting at 1:1 000 and then reacted with the membrane. Please note that at 1:100 000 dilution, two clear bands were picked up by the antibody |
|
|
以1:1 000–1:10 000 000稀释Mhp366-N多克隆抗体进行免疫荧光试验,均能检测到细胞内的AH株(图 4)。说明在免疫荧光试验中Mhp366-N多克隆抗体工作浓度范围较为宽泛。此外,还说明猪肺炎支原体感染细胞后1 h即能进入细胞内。
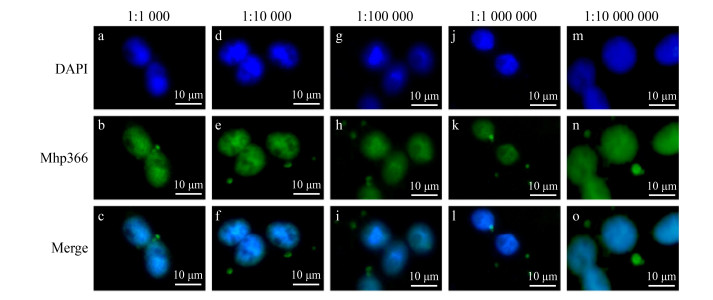
|
| 图 4 Mhp366-N多克隆抗体用于免疫荧光试验的最佳稀释倍数 Figure 4 The optimal dilution of Mhp366-N polyclonal antibody for immunofluorescence assay 注:在本实验中,Mhp366-N多克隆抗体进行10倍系列稀释,稀释比例从1:1 000到1:10 000 000 Note: Mhp366-N polyclonal antibody used in the experiments was 10-fold serially diluted starting at 1:1 000 to 1:10 000 000 |
|
|
分别采用免疫荧光和免疫印迹方法,以1:100 000的比例稀释Mhp366-N多克隆抗体,检测猪肺泡巨噬细胞中的Mhp366-N蛋白。在猪肺炎支原体阳性细胞中能观察到代表猪肺炎支原体的绿色荧光(图 5A),也能检测到清晰的Mhp366蛋白片段(图 5B);而在猪肺炎支原体阴性细胞中不能观察到绿色荧光(图 5A),也没有检测到Mhp366-N特异性的条带(图 5B),说明Mhp366-N多克隆抗体也能用免疫荧光和免疫印迹的方法检测临床样品中的猪肺炎支原体,而且用免疫印迹方法在临床样品中检测Mhp366-N蛋白比在3D4/21细胞中检测Mhp366-N蛋白的效果更好。
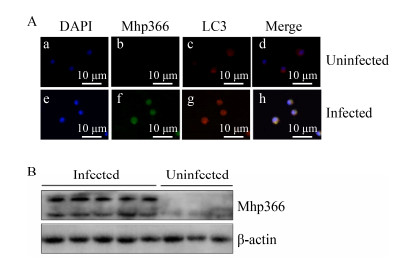
|
| 图 5 Mhp366-N多克隆抗体用于猪肺泡巨噬细胞中猪肺炎支原体的检测 Figure 5 Mhp366-N polyclonal antibody was used to detect M. hyopneumoniae in porcine alveolar macrophages collected clinically 注:A:以Mhp366-N多克隆抗体为一抗,免疫荧光检测猪肺泡巨噬细胞中的猪肺炎支原体;B:以Mhp366-N多克隆抗体为一抗,免疫印迹检测猪肺泡巨噬细胞中的猪肺炎支原体 Note: A: M. hyopneumoniae was detected by immunofluorescence assay with Mhp366-N polyclonal antibody as the first antibody in porcine alveolar macrophages; B: M. hyopneumoniae was detected by Western blot with Mhp366-N polyclonal antibody as the first antibody in porcine alveolar macrophages |
|
|
尝试以Mhp366-N多克隆抗体为一抗,利用免疫组化的方法检测猪肺组织细胞中的猪肺炎支原体,并确定猪肺炎支原体能存在的细胞。由图 6可知,制备的Mhp366-N多克隆抗体以1:200比例稀释可以用于免疫组化试验,而且发现猪肺炎支原体可以感染猪肺泡巨噬细胞、Ⅰ型和Ⅱ型肺泡细胞。
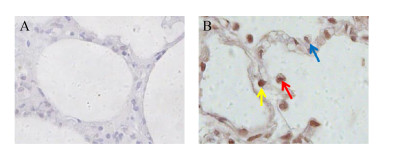
|
| 图 6 免疫组化试验检测猪肺炎支原体感染的肺细胞 Figure 6 Detection of M. hyopneumoniae in lung cells by immunohistochemistry 注:A:无猪肺炎支原体感染的肺组织;B:猪肺炎支原体感染的肺组织。红色箭头:猪肺泡巨噬细胞;蓝色箭头:Ⅰ型肺泡细胞;黄色箭头:Ⅱ型肺泡细胞 Note: A: Lung tissue without M. hyopneumoniae infection; B: Lung tissue infected with M. hyopneumoniae. Red arrow: Porcine alveolar macrophage; Blue arrow: Type Ⅰ alveolar cell; Yellow arrow: Type Ⅱ alveolar cell |
|
|
猪支原体肺炎是严重影响生猪生产性能的一种疾病,目前还没有很好的防控措施。商品灭活疫苗免疫后对于提高猪的生产性能仍存在较大疑问[1]。疫苗免疫后猪只仍然能够被感染[5-6],不能阻断猪肺炎支原体在免疫猪群的传播[5-7]。深入了解猪肺炎支原体致病机制可以为更好地研发猪肺炎支原体疫苗提供理论支撑。目前对猪肺炎支原体致病机制和免疫反应研究还较少,因此应加强猪肺炎支原体的基础研究。
我们通过临床观察发现在有猪支原体肺炎典型临床症状的猪群使用杀灭支原体的药物,停药一段时间后症状又会再次出现。Raymond等发现猪肺炎支原体与宿主细胞表面的整合素β1和纤连蛋白结合后能够通过细胞内吞进入猪肾细胞系PK-15细胞[8]。因此,我们推测猪肺炎支原体进入细胞后可能通过与细胞内蛋白分子的互作发挥致病作用,但相关研究还未见报道。为了开展猪肺炎支原体在胞内与宿主互作研究,我们首先需要制备猪肺炎支原体特异性抗体。Mhp366蛋白在体外培养的猪肺炎支原体中几乎不表达,本研究中的免疫印迹试验也印证了这一结果,却能在感染细胞后刺激机体产生强烈的体液免疫应答[2-3, 9]。免疫印迹和免疫荧光试验表明,在猪肺炎支原体感染细胞后1 h Mhp366蛋白即能够被检测到。此外,猪肺炎支原体在感染后1 h即能进入到细胞内。
我们选择Mhp366蛋白N端279个氨基酸的片段进行表达,该片段为Mhp366蛋白全长的一半。我们前期的试验结果表明该片段能够识别Mhp366抗体[3, 9]。因此,我们制备的Mhp366-N多克隆抗体也可以反过来用于检测Mhp366蛋白。纯化的Mhp366-N蛋白免疫昆明小鼠制备的多克隆抗体具有较高的效价,为了确定后续试验中抗体的稀释倍数,我们用不同比例稀释的Mhp366-N多克隆抗体与猪肺炎支原体AH株感染细胞反应,最终确定在免疫印迹试验中,最佳稀释比例为1:100 000;免疫荧光试验中稀释比例范围为1:1 000-1:10 000 000。此外,通过检测猪肺炎支原体感染的猪肺泡巨噬细胞,确定Mhp366-N多克隆抗体也可以用于临床样品中猪肺炎支原体的检测。这为后续的研究工作提供了Mhp366-N多克隆抗体的工作条件。
在进行免疫印迹和免疫荧光试验之前,为了确定AH株感染3D4/21细胞的最佳感染复数,为后续的猪肺炎支原体致病机制研究奠定基础,我们首先测定了AH株的生长曲线,接着利用生长曲线测定了AH株感染3D4/21细胞的最佳MOI。在后续的大多数试验中我们会以最佳MOI感染3D4/21细胞。
在免疫印迹试验中检测到2条明显的条带,其中较大的条带为64 kD,为Mhp366的原始分子量大小;另一条条带大约为45 kD,这可能是Mhp366蛋白翻译后被切割的片段。在Meens等的试验中也有相似的结果[2]。Mhp366蛋白在Western Blot中出现2条条带,这对试验结果的解释可能会带来争议。我们选用该蛋白主要有2点考虑:一是Mhp366在猪肺炎支原体高度保守,存在于所有猪肺炎支原体菌株,而在其他细菌没有同源蛋白;二是该蛋白只在猪肺炎支原体感染宿主细胞后才会表达,Meens等[2]的结果和本试验(图 3)也证明了这一点。上述这2点在检测临床样品中猪肺炎支原体感染时,有利于排除其他微生物混合感染造成的交叉反应。因为临床样品很难排除,有时也不需要排除其他病原的混合感染。由图 3和图 5B可知,用临床样品检测Mhp366蛋白的Western Blot图片比细胞样品的Western Blot图片更加清晰。课题组不同的成员多次重复均得到相同的结果。通过免疫荧光试验,我们采用3D4/21细胞验证了Meyns等[7]的研究结果,证明猪肺炎支原体能进入细胞,还发现猪肺炎支原体能感染猪肺泡巨噬细胞。我们还确定Mhp366-N多克隆抗体可用于免疫组化试验。通过免疫组化试验发现猪肺炎支原体除能够感染猪肺泡巨噬细胞之外,还能够感染猪Ⅰ型和Ⅱ型肺泡上皮细胞。这可能就是由于猪肺炎支原体能感染所有的肺泡细胞,导致在肺的前缘出现明显的“肉变”和“胰变”。在进行免疫组化试验时,我们同时用相同组织做了HE染色,以确定猪肺炎支原体感染的肺泡上皮细胞类型。
本试验中采集的猪肺,除了观察肺部大体病变,还用巢式PCR检测猪肺炎支原体特异性的P36基因,确认猪肺是否被猪肺炎支原体感染。在本试验中,临床肺组织是否有其他病原感染不影响试验结果,因此未进行其他病原检测。
综上,本研究制备了用于检测猪肺炎支原体的Mhp366-N多克隆抗体;确定了多克隆抗体用于免疫印迹和免疫荧光试验的最佳稀释倍数;以Mhp366-N多克隆抗体为工具,用免疫组化试验发现猪肺炎支原体除了能够感染猪肺泡巨噬细胞,还能感染猪Ⅰ型和Ⅱ型肺泡上皮细胞。
| [1] |
Leal Zimmer FMA, Paes JA, Zaha A, Ferreira HB. Pathogenicity & virulence of Mycoplasma hyopneumoniae[J]. Virulence, 2020, 11(1): 1600-1622. DOI:10.1080/21505594.2020.1842659 |
| [2] |
Meens J, Bolotin V, Frank R, Böhmer J, Gerlach GF. Characterization of a highly immunogenic Mycoplasma hyopneumoniae lipoprotein Mhp366 identified by peptide-spot array[J]. Veterinary Microbiology, 2010, 142(3/4): 293-302. |
| [3] |
Tian YQ, Xu ZB, Wen YK, Yang M, Ning YR, Wang ZD, Ding HL. Development of an indirect ELISA for detection of anti-Mycoplasma hyopneumoniae IgG in naturally infected pathogen-induced convalescent sera[J]. BMC Veterinary Research, 2021, 17(1): 1-10. DOI:10.1186/s12917-020-02730-8 |
| [4] |
Lu XM, Feng ZX, Liu MJ, Wu XS, Gan Y, Zhang Y, Shao GQ. Establishment of a nested PCR assay for detection of Mycoplasma hyopneumoniae[J]. Jiangsu Journal of Agricultural Sciences, 2010, 26(1): 91-95. (in Chinese) 逯晓敏, 冯志新, 刘茂军, 吴叙苏, 甘源, 张映, 邵国青. 猪肺炎支原体套式PCR检测方法的建立及应用[J]. 江苏农业学报, 2010, 26(1): 91-95. |
| [5] |
Villarreal I, Meyns T, Dewulf J, Vranckx K, Calus D, Pasmans F, Haesebrouck F, Maes D. The effect of vaccination on the transmission of Mycoplasma hyopneumoniae in pigs under field conditions[J]. The Veterinary Journal, 2011, 188(1): 48-52. DOI:10.1016/j.tvjl.2010.04.024 |
| [6] |
Villarreal I, Maes D, Vranckx K, Calus D, Pasmans F, Haesebrouck F. Effect of vaccination of pigs against experimental infection with high and low virulence Mycoplasma hyopneumoniae strains[J]. Vaccine, 2011, 29(9): 1731-1735. DOI:10.1016/j.vaccine.2011.01.002 |
| [7] |
Meyns T, Dewulf J, De Kruif A, Calus D, Haesebrouck F, Maes D. Comparison of transmission of Mycoplasma hyopneumoniae in vaccinated and non-vaccinated populations[J]. Vaccine, 2006, 24(49/50): 7081-7086. |
| [8] |
Raymond BBA, Turnbull L, Jenkins C, Madhkoor R, Schleicher I, Uphoff CC, Whitchurch CB, Rohde M, Djordjevic SP. Mycoplasma hyopneumoniae resides intracellularly within porcine epithelial cells[J]. Scientific Reports, 2018, 8: 17697. DOI:10.1038/s41598-018-36054-3 |
| [9] |
Ding HL, Zhou YQ, Wang HJ. Development of an indirect ELISA for detecting humoral immunodominant proteins of Mycoplasma hyopneumoniae which can discriminate between inactivated bacterin-induced hyperimmune sera and convalescent sera[J]. BMC Veterinary Research, 2019, 15(1): 327. |
 2021, Vol. 48
2021, Vol. 48