扩展功能
文章信息
- 叶樱琳, 蒋荣珍, 郭晓蒙, 张烨, 徐钦洋, 李明, 滕银成, 陶敏芳
- YE Yinglin, JIANG Rongzhen, GUO Xiaomeng, ZHANG Ye, XU Qinyang, LI Ming, TENG Yincheng, TAO Minfang
- 孕晚期肠道菌群与孕妇血糖血脂的临床相关性
- Correlations analysis of gut microbiota with blood glucose and lipids in the third trimester pregnancy
- 微生物学通报, 2021, 48(6): 2118-2130
- Microbiology China, 2021, 48(6): 2118-2130
- DOI: 10.13344/j.microbiol.china.201079
-
文章历史
- 收稿日期: 2020-11-17
- 接受日期: 2020-12-23
- 网络首发日期: 2021-03-11
肠道菌群与宿主互相依存、互利共生,在肠道壁细胞的能量代谢与营养吸收、机体免疫调节和体内健康平衡维持等生理过程中起重要作用[1]。机体内外环境发生变化均可引起肠道菌群失调;增加肠道通透性,导致脂多糖和乳糜微粒吸收增多;引起人体消化与吸收、免疫等系统疾病[2-3]。研究发现肠道菌群变化与非孕期体重过度增加导致的肥胖密切相关,而孕期体重增长异常与母胎代谢性疾病的发生密切相关[4],但是国内关于孕期肠道菌群变化是否参与孕期母胎增重与血糖血脂调控的研究较少。因此,本研究通过高通量测序技术检测不同孕期增重水平的孕妇肠道菌群多样性、群落结构和丰度差异,分析可能影响孕期增重、血糖血脂的肠道菌群,通过KEGG富集分析增重不同孕妇肠道菌群代谢通路的差异,以期为调控孕期增重与预防高脂高糖血症提供理论依据。
1 材料与方法 1.1 临床资料经由上海交通大学附属第六人民医院伦理委员会审核通过和受试对象知情同意后,收集2019年1-12月计划于上海交通大学附属第六人民医院生产的孕妇孕晚期(36-40周)粪便34例,收集其一般临床资料、孕晚期血糖血脂数据。根据美国医学研究所(Institute of Medicine,IOM)标准[5],按照孕期增重(Gestational Weight Gain,GWG)将孕妇分为增重不足(LGWG组,N=7)、增重正常(AGWG组,N=12)和增重过度组(HGWG组,N=15)。纳入标准:(1) 20-40岁足月单胎孕妇;(2) 取样前3个月内没有使用过抗生素;(3) 无妊娠前已存在的血液病、内分泌疾病、慢性肾病、肝功能不全、慢性高血压疾病等;(4) 无妊娠期高血压疾病、妊娠期糖尿病、妊娠剧吐等可能影响食欲的疾病。
1.2 主要试剂和仪器DNA抽提试剂盒、PCR产物回收试剂盒,Qiagen公司;实时荧光定量PCR试剂盒,TaKaRa公司;核酸纯化试剂盒,Beckman Coulter公司;所有引物由上海欧易生物医学科技有限公司合成。PCR仪、凝胶成像仪,Bio-Rad公司;微量分光光度计,Thermofisher公司;MiSeq测序仪器,Illumina公司。
1.3 样品收集、DNA提取和测序经孕妇同意后用无菌采样管收集孕妇粪便,样品置于-80 ℃冻存备用。用DNA抽提试剂盒对样本DNA进行提取,用微量分光光度计检测DNA浓度和纯度,1%琼脂糖凝胶电泳检测DNA质量。根据文献[6]选择引物,使用带Barcode的特异引物343F (5′-TACGGRAGGCAGCAG-3′)和798R (5′-AGGGTATCTAATCCT-3′),以样品菌群总DNA为模板,对细菌16S rRNA基因的V3-V4可变区进行PCR扩增。PCR反应体系(30 μL):2×Gflex PCR缓冲液15 μL,引物343F和798R (5 μmol/L)各1 μL,Tks Gflex聚合酶(1.25 U/μL) 0.6 μL,DNA模板50 ng,超纯水补足30 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 20 s,27个循环;72 ℃ 5 min。用2%琼脂糖凝胶电泳检测是否有条带及条带是否单一,用核酸纯化试剂盒和PCR产物回收试剂盒纯化并回收PCR产物。纯化定量后进行MiSeq文库构建和测序。
1.4 菌群多样性、群落结构和丰度分析对相似度大于97%的序列划分为一个操作分类单元(Operational Taxonomic Unit,OTU),采用RDP Classifier算法对OTU代表序列进行分类学物种分析。分析丰度占比超过0.01%的不同组之间肠道菌群结构和丰富度差异,利用Chao1指数、Shannon指数、Simpson指数代表α多样性,利用基于Weighted UniFrac距离的主坐标分析(Principal Co-Ordinates Analysis,PCoA)和非度量多维尺度分析(Nonmetric Multidimensional Scaling,NMDS)对β多样性进行分析。
1.5 孕期不同增重组肠道菌群基因功能预测分析将各组粪便样本中经测序得到的OTU标准化,与京都基因及基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库进行对比,得到孕期不同增重组的肠道菌群功能丰度谱,然后进行差异分析得到有统计学意义的功能通路。
1.6 统计学方法采用SPSS 23.0对数据进行统计分析,符合正态性分布的计量资料以x±SD表示,非正态性分布的计量资料和计数资料以中位数(M)、四分位数间距(P25-P75)表示。计量资料的正态性检验使用夏皮洛-威尔克检验(Shapiro-Wilk Test,S-W Test),符合正态分布的2组计量资料之间比较采用独立样本t检验,3组及以上计量资料的比较采用单因素方差分析。不符合正态分布的计量资料或计数资料2组之间的比较采用曼-惠特尼U检验(Mann-Whitney U Test),3组及以上的比较采用克鲁斯凯-沃里斯H检验(Kruskal-Wallis H Test)。将差异菌群与孕妇孕期增重、孕晚期体质指数(Body Mass Index,BMI)、孕妇血糖与血脂进行斯皮尔曼(Spearman)相关分析。以P < 0.05为差异有统计学意义。
2 结果与分析 2.1 资料参数正态性检验通过对计量资料进行正态检验,符合正态分布的参数有孕期增重、新生儿体重、胎盘重量、孕晚期母血指标(血糖、总胆固醇、高密度脂蛋白、低密度脂蛋白),采用统计值F和P值显示统计分析结果;不符合正态分布的有孕妇年龄、初诊孕周、分娩孕周、孕前体重、孕前BMI、孕晚期体重、孕晚期BMI、孕晚期母血甘油三酯,采用统计值H和P值显示统计分析结果。孕次、产次、α多样性指数、β多样性指数、菌群丰度指数、KEGG丰度参数属于计数资料,使用统计值H和P值显示统计分析结果。正态检验结果见表 1。
| Items | 统计值Statistics value | P值P value |
| 年龄Maternal age | 0.923 | 0.036 |
| 初诊孕周First visiting pregnant weeks | 0.846 | 0.001 |
| 分娩孕周Gestational age | 0.880 | 0.003 |
| 孕前体重Pre-pregnant weight | 0.721 | < 0.001 |
| 孕前BMI Pre-pregnant BMI | 0.696 | < 0.001 |
| 孕晚期体重Perinatal weight | 0.684 | < 0.001 |
| 孕晚期BMI Perinatal BMI | 0.618 | < 0.001 |
| 孕期增重GWG | 0.989 | 0.985 |
| 新生儿体重Birthweight | 0.931 | 0.059 |
| 胎盘重量Placental weight | 0.940 | 0.100 |
| 孕晚期母血血糖Maternal glucose | 0.962 | 0.358 |
| 孕晚期母血总胆固醇Maternal total cholesterol | 0.986 | 0.954 |
| 孕晚期甘油三酯Maternal triglycerides | 0.865 | 0.002 |
| 孕晚期高密度脂蛋白Maternal high density lipoprotein | 0.956 | 0.257 |
| 孕晚期低密度脂蛋白Maternal low density lipoprotein | 0.964 | 0.419 |
| 注:S-W test:夏皮洛-威尔克检验(Shapiro-Wilk test),简称SW检验,适用于小样本(N < 50)正态性检验;P value > 0.05,代表资料满足正态分布,P value < 0.05,资料不满足正态分布 Note: S-W test: Shapiro-Wilk test, applied to the normality test of small samples (N < 50); If P > 0.05, representative data meet normal distribution, P < 0.05, data do not meet normal distribution | ||
孕妇平均年龄为33岁,孕2次,产1次,新生儿平均体重为3 462.21±392.6 g,孕妇一般资料、孕晚期血糖血脂水平无显著统计学差异(P > 0.05),增重过度组孕期增重、孕晚期体重较增重正常组和增重不足组明显增加,增重不足组较增重正常组孕期增重明显减少,差异有统计学意义(P < 0.05),见表 2。
| 参数 Items |
增重不足组 LGWG (N=7) |
增重正常组 AGWG (N=12) |
增重过度组 HGWG (N=15) |
统计值 F or H value |
P值 P value |
| 年龄(岁) Age (years) | 35.0(30.0-36.0) | 30.0(27.5-34.0) | 33.0(28.0-36.0) | 2.254 | 0.324 |
| 孕次Parity | 2(1-4) | 2(1-3) | 2(1-3) | 3.259 | 0.353 |
| 产次Gestation | 1(0-1) | 0.5(0-1) | 1(0-1) | 5.567 | 0.135 |
| 初诊孕周First visiting pregnant weeks | 12.3(10.9-15.6) | 11.6(10.3-13.5) | 12.7(11.0-13.4) | 1.096 | 0.578 |
| 分娩孕周Gestational weeks (week) | 39.1(38.9-39.4) | 39.7(39.2-40.1) | 39.7(39.3-41.1) | 4.230 | 0.121 |
| 孕前体重Pre-pregnant weight (kg) | 54.0(49.6-67.0) | 51.5(45.5-59.9) | 55.0(51.0-70.0) | 2.235 | 0.327 |
| 孕前BMI Pre-pregnant BMI (kg/m2) | 21.2(20.9-28.6) | 19.4(18.4-22.6) | 22.0(19.7-26.7) | 4.122 | 0.127 |
| 孕晚期体重Perinatal weight (kg) | 63.0(59.6-72.0) | 65.0(60.5-72.0) | 77.0(69.5-83.0)*# | 10.456 | 0.005 |
| 孕晚期BMI Perinatal BMI (kg/m2) | 25.5(24.3-30.8) | 24.9(23.5-27.6) | 30.1(26.5-32.4)*# | 8.832 | 0.012 |
| 孕期增重GWG (kg) | 8.1±1.9*# | 13.6±2.1 | 18.5±3.5*# | 34.523 | < 0.001 |
| 新生儿体重Birthweight (g) | 3 241.4±343.8 | 3 483.3±330.1 | 3 548.3±440.9 | 1.533 | 0.232 |
| 胎盘重量Placental weight (g) | 613.6±113.6 | 578.4±54.5 | 608.1±108.6 | 0.408 | 0.669 |
| 孕晚期母血指标Maternal serum measures in third trimester | |||||
| 血糖Glucose (mmol/L) | 4.38±0.42 | 4.46±0.36 | 4.46±0.30 | 0.128 | 0.881 |
| 甘油三酯Triglycerides (mmol/L) | 3.05(2.70-3.48) | 3.34(2.89-4.60) | 3.49(3.12-4.17) | 2.697 | 0.260 |
| 总胆固醇Total cholesterol (mmol/L) | 6.68±1.32 | 7.01±1.21 | 6.51±1.56 | 0.413 | 0.666 |
| 高密度脂蛋白High density lipoprotein (mmol/L) | 1.80±0.52 | 1.85±0.59 | 1.81±0.56 | 0.022 | 0.978 |
| 低密度脂蛋白Low density lipoprotein (mmol/L) | 3.95±1.04 | 3.94±1.15 | 3.53±1.44 | 0.406 | 0.670 |
| 注:*:与AGWG相比有统计学差异;#:与LGWG相比有统计学差异 Note: *: Statistical difference compared with AGWG; #: Statistical difference compared with AGWG | |||||
通过对34例粪便样品测序后共得到1 162 675条原始序列,经质控处理后每个粪便样品的有效序列在10 254-37 026之间,每条序列的平均长度为419 bp。通过OTU的聚类和物种注释,增重不足组、增重正常组和增重过度组分别得到983、1 299和1 278个OTU。
2.3.2 多样性分析增重不足组、增重正常组和增重过度组组间肠道菌群的α多样性与β多样性无明显统计学差异(P > 0.05),在图 1主坐标分析(PCoA)中,各圆点之间没有明显区分开,提示不同组肠道菌群相对稳定,非度量多维尺度分析(NMDS)可得到相似结果(图 1)。增重正常组Observed_Apecies和Chao1指数均高于其余2组,差异无统计学意义(P > 0.05),见表 3。
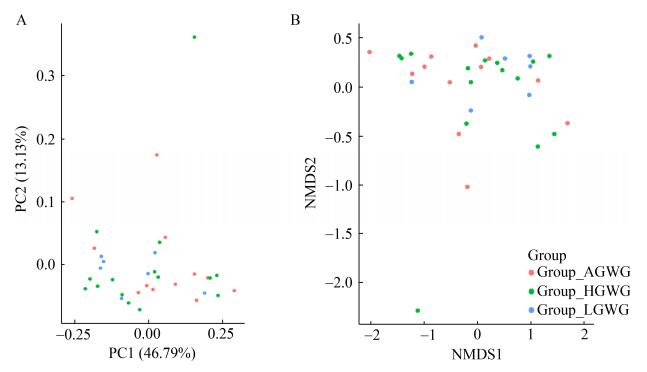
|
| 图 1 基于Weighted UniFrac距离算法的PCoA和NMDS分析 Figure 1 PCoA and NMDS analysis based on weighted UniFrac distance algorithm 注:A:主坐标分析(PCoA);B:非度量多维尺度分析(NMDS) Note: A: Principal co-ordinates analysis, PCoA; B: Nonmetric multidimensional scaling (NMDS) |
|
|
| 指数 Indexes |
增重不足组 LGWG (N=7) |
增重正常组 AGWG (N=12) |
增重过度组 HGWG (N=15) |
统计值 H value |
P值 P value |
| Goods coverage | 0.99±0.01 | 0.98±0.01 | 0.99±0.01 | 2.711 | 0.258 |
| Observed_species | 279.57±130.87 | 348.38±121.32 | 287.80±126.61 | 1.794 | 0.408 |
| Chao1 index | 405.27±209.21 | 553.69±202.65 | 454.30±221.74 | 2.062 | 0.357 |
| Shannon index | 5.41±0.85 | 5.28±0.92 | 4.84±1.07 | 1.784 | 0.410 |
| Simpson index | 0.94±0.03 | 0.93±0.06 | 0.88±0.10 | 4.227 | 0.121 |
门水平上,粪便样本优势肠道菌群以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)为主,组间未见显著统计学差异(P > 0.05);与增重正常组相比,增重不足组硝化螺旋菌门(Nitrospirae)、脱铁杆菌门(Deferribacteres)和芽单胞杆菌门(Gemmatimonadetes)占比明显降低,增重过度组酸杆菌门(Acidobacteria)占比降低,差异有统计学意义(P < 0.05)。属水平上,在菌群占比 > 0.01%的微生物中共发现14种差异菌群;与增重正常组相比,增重过度组降低的菌群有扭链胃球菌属(Ruminococcus_torques_group spp.)、厌氧菌属(Anaerostipes spp.)、伊格尔兹氏菌属(Eggerthella spp.);增重不足组升高的菌群有瘤胃球菌属UCG-014 (Ruminococcaceae_UCG-014 sp.)、丁酸单胞菌属(Butyricimonas spp.),降低的菌群有克雷伯氏菌属(Klebsiella spp.)、粘液杆菌属(Mucispirillum spp.)、螺杆菌属(Helicobacter spp.)、假单胞菌属(Pseudomonas spp.);与增重不足组相比,增重过度组毛螺菌属(Lachnospira spp.)、瘤胃球菌属2 (Ruminococcus_2 sp.)、Klebsiella spp.水平升高,另支菌属(Alistipes spp.)、副拟杆菌属(Parabacteroides spp.)、Ruminococcaceae_ UCG-014 sp.、罕见小球菌属(Subdoligranulum spp.)水平降低(表 4)。
| 菌群名称 Flora name |
增重不足组 LGWG (%) |
增重正常组 AGWG (%) |
增重过度组 HGWG (%) |
统计值 H value |
P值 P value |
| 门分类水平Phylum level | |||||
| 厚壁菌门Firmicutes | 42.50±15.69 | 51.63±21.02 | 46.21±20.00 | 1.626 | 0.444 |
| 拟杆菌门Bacteroidetes | 49.67±16.88 | 36.35±19.79 | 42.92±22.83 | 2.157 | 0.340 |
| 变形菌门Proteobacteria | 5.16±3.43 | 7.15±7.71 | 8.40±17.86 | 0.907 | 0.635 |
| 放线菌门Actinobacteria | 2.08±3.12 | 4.58±4.50 | 2.33±2.42* | 2.315 | 0.314 |
| 硝化螺旋菌门Nitrospirae | 0.01±0.02* | 0.07±0.05 | 0.04±0.04 | 6.128 | 0.047 |
| 脱铁杆菌门Deferribacteres | 0.00±0.00* | 0.04±0.04 | 0.02±0.02 | 7.333 | 0.026 |
| 芽单胞杆菌门Gemmatimonadetes | 0.00±0.00* | 0.03±0.03 | 0.02±0.02# | 8.901 | 0.012 |
| 酸杆菌门Acidobacteria | 0.01±0.01 | 0.01±0.01 | 0.00±0.01* | 7.234 | 0.027 |
| 属分类水平Genus level | |||||
| 毛螺菌属Lachnospira spp. | 0.38±0.62 | 2.87±4.91 | 3.56±6.16# | 4.363 | 0.113 |
| 另支菌属Alistipes spp. | 4.07±2.51 | 2.07±2.81 | 1.94±2.31# | 5.160 | 0.076 |
| 副拟杆菌属Parabacteroides spp. | 4.38±5.43 | 0.88±0.8 | 2.01±3.45# | 4.723 | 0.094 |
| 瘤胃球菌属UCG-014 Ruminococcaceae_UCG-014 sp. | 3.91±5.10* | 0.84±2.05# | 0.84±1.59# | 6.059 | 0.048 |
| 罕见小球菌属Subdoligranulum spp. | 1.17±0.60 | 1.30±0.98 | 0.74±0.83# | 4.727 | 0.094 |
| 扭链胃球菌属Ruminococcus_torques_group spp. | 0.48±0.54 | 1.51±1.51 | 0.65±0.99* | 5.322 | 0.070 |
| 厌氧菌属Anaerostipes spp. | 0.50±0.55 | 0.99±1.55 | 0.32±0.44* | 4.352 | 0.113 |
| 瘤胃球菌属2 Ruminococcus_2 sp. | 0.25±0.29 | 0.50±0.62 | 0.62±0.56# | 4.087 | 0.130 |
| 克雷伯氏菌属Klebsiella spp. | 0.01±0.02* | 1.20±3.87# | 0.13±0.20# | 8.505 | 0.014 |
| 丁酸单胞菌属Butyricimonas spp. | 0.59±0.32* | 0.36±0.76# | 0.36±0.47 | 5.757 | 0.056 |
| 伊格尔兹氏菌属Eggerthella spp. | 0.07±0.12 | 0.09±0.14 | 0.01±0.03* | 7.739 | 0.021 |
| 粘液杆菌属Mucispirillum spp. | 0.00±0.00* | 0.04±0.04# | 0.02±0.02 | 7.333 | 0.026 |
| 螺杆菌属Helicobacter spp. | 0.01±0.01* | 0.04±0.05# | 0.01±0.02 | 5.438 | 0.066 |
| 假单胞菌属Pseudomonas spp. | 0.01±0.01* | 0.02±0.02# | 0.02±0.02 | 4.241 | 0.120 |
| 注:*:与AGWG相比有统计学差异;#:与LGWG相比有统计学差异 Note: *: Statistical difference compared with AGWG; #: Statistical difference compared with AGWG | |||||
将筛选出来的属差异水平微生物与孕期增重、孕晚期BMI、孕妇血糖血脂进行相关性分析。发现Ruminococcaceae_UCG-014 sp.与孕晚期BMI呈负相关,r=-0.360,P=0.037;同时与孕期增重呈负相关,r=-0.423,P=0.013。Lachnospira spp.与孕晚期血糖呈负相关,r=-0.376,P=0.037。Alistipes spp.与甘油三酯呈负相关,r=-0.420,P=0.017。Ruminococcus_torques_group spp.与甘油三酯呈负相关,r=-0.482,P=0.005。Parabacteroides spp.与孕晚期HDL成正相关,r=0.374,P=0.035;同时与新生儿体重呈负相关,r=-0.397,P=0.020。然而Mucispirillum spp.与HDL呈负相关,r=-0.401,P=0.023,见图 2。
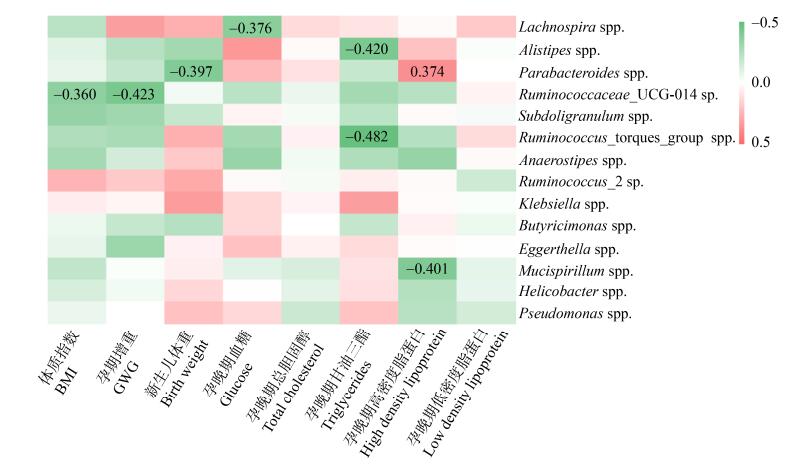
|
| 图 2 孕期增重、新生儿体重、孕晚期BMI和血糖血脂水平与差异肠道菌群的相关性分析 Figure 2 Correlation analysis of GWG, birth weight, maternal BMI, blood glucose and lipids level in late pregnnacy with differential gut microbiota |
|
|
通过将增重不足、增重正常和增重过度组的OTU数量标准化并与KEGG数据库进行比对,获得每个组的代谢通路功能丰度谱。在Level 3水平共富集到293条代谢通路,各组粪便样本共有的前50个代谢相关差异信号通路见图 3,统计分析结果见表 5。通过图 3可以发现,肠道微生物主要参与:(1) 多种物质的代谢途径,包括维生素、辅助因子、丙氨酸、天冬氨酸、谷氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、酪氨酸、色氨酸、甘氨酸、丝氨酸、苏氨酸、半胱氨酸、蛋氨酸、D-谷氨酰胺、D-谷氨酸、叶酸、烟酰胺、烟酸酯、硫胺素、碳水化合物、果糖、甘露糖、丙酮酸、戊糖、葡萄糖醛酸酯、半乳糖、淀粉、蔗糖、生物素、膦酸酯、次膦酸酯、丙酸酯、甘油磷脂、丁酸酯、甘油酯、脂质、泛酸、CoA、硫、氮、氨基苯甲酸酯、甲烷、肽聚糖、萜类骨架、维生素B6、谷胱甘肽、无机离子、托烷、哌啶、吡啶生物碱、硒、卟啉、叶绿素、玉米素、异喹啉生物碱、牛磺酸、次牛磺酸和苯甲酸酯;(2) 能量与信号通路代谢,包括柠檬酸循环、糖酵解、糖异生、能量代谢、过氧化物体、蛋白酶体、磷脂酰肌醇信号系统、PPAR信号通路和NOD样受体信号通路;(3) 蛋白质输出和细菌分泌系统。表明肠道微生物的主要功能是参与物质代谢与能量转移。此外,通过表 5组间比较发现,增重异常,包括增重不足和增重过度,肠道微生物的代谢功能主要与营养物质代谢如氨基酸、碳水化合物和脂质等功能降低有关,其次,细菌分泌及输出能量物质的能力也有所下降。
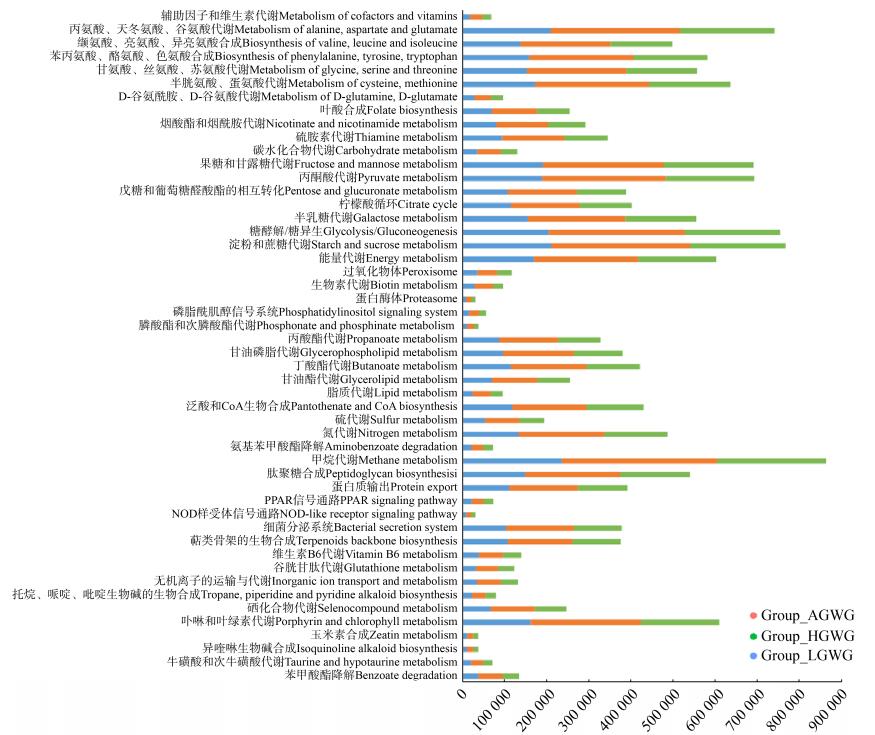
|
| 图 3 不同孕期增重组粪便样本前50差异代谢信号通路 Figure 3 Top 50 differential matabolic signal pathways of fecal samples from different gestational weight gain |
|
|
| 代谢通路名称 Metabolic pathway items |
相对丰度 The relative abundance of co-pathways |
统计值 H value |
P值 P value |
||
| LGWG | AGWG | HGWG | |||
| 辅助因子和维生素代谢Metabolism of cofactors and vitamins | 17 117 | 29 946 | 20 991 | 6.788 | 0.033 |
| 丙氨酸、天冬氨酸、谷氨酸代谢Metabolism of alanine, aspartate and glutamate | 209 018 | 308 405 | 224 227 | 8.485 | 0.014 |
| 缬氨酸、亮氨酸、异亮氨酸合成Biosynthesis of valine, leucine and isoleucine | 137 640 | 214 638 | 147 821 | 8.485 | 0.014 |
| 苯丙氨酸、酪氨酸、色氨酸合成Biosynthesis of phenylalanine, tyrosine, tryptophan | 158 056 | 249 454 | 174 403 | 8.142 | 0.017 |
| 甘氨酸、丝氨酸、苏氨酸代谢Metabolism of glycine, serine and threonine | 153 258 | 235 780 | 168 453 | 7.351 | 0.025 |
| 半胱氨酸、蛋氨酸代谢Metabolism of cysteine, methionine | 172 489 | 271 257 | 193 953 | 7.293 | 0.026 |
| D-谷氨酰胺、D-谷氨酸代谢Metabolism of D-glutamine, D-glutamate | 27 288 | 39 603 | 29 854 | 7.293 | 0.026 |
| 叶酸合成Folate biosynthesis | 69 472 | 107 499 | 77 692 | 7.789 | 0.020 |
| 烟酸酯、烟酰胺代谢Nicotinate and nicotinamide metabolism | 79 934 | 123 838 | 88 870 | 7.523 | 0.023 |
| 硫胺素代谢Thiamine metabolism | 93 731 | 147 736 | 103 658 | 8.378 | 0.015 |
| 碳水化合物代谢Carbohydrate metabolism | 34 739 | 56 728 | 37 939 | 6.798 | 0.033 |
| 果糖和甘露糖代谢Fructose and mannose metabolism | 190 528 | 287 290 | 213 994 | 6.846 | 0.033 |
| 丙酮酸代谢Pyruvate metabolism | 189 521 | 293 851 | 210 167 | 8.489 | 0.014 |
| 戊糖和葡萄糖醛酸酯的相互转化Pentose and glucuronate metabolism | 107 396 | 164 562 | 116 763 | 8.417 | 0.015 |
| 柠檬酸循环Citrate cycle | 114 907 | 163 497 | 124 287 | 8.175 | 0.017 |
| 半乳糖代谢Galactose metabolism | 155 412 | 231 758 | 168 750 | 8.142 | 0.017 |
| 糖酵解/糖异生Glycolysis/Gluconeogenesis | 205 103 | 324 097 | 225 877 | 7.643 | 0.022 |
| 淀粉和蔗糖代谢Starch and sucrose metabolism | 210 642 | 331 416 | 225 581 | 7.586 | 0.023 |
| 能量代谢Energy metabolism | 170 087 | 247 076 | 185 466 | 6.472 | 0.039 |
| 过氧化物体Peroxisome | 34 857 | 47 409 | 35 160 | 10.760 | 0.005 |
| 生物素代谢Biotin metabolism | 28 510 | 44 268 | 30 634 | 10.027 | 0.007 |
| 蛋白酶体Proteasome | 8 499 | 12 820 | 9 515 | 7.523 | 0.023 |
| 磷脂酰肌醇信号系统Phosphatidylinositol signaling system | 15 666 | 23 906 | 16 388 | 13.275 | 0.001 |
| 膦酸酯和次膦酸酯代谢Phosphonate and phosphinate metabolism | 10 123 | 16 246 | 11 022 | 11.769 | 0.003 |
| 丙酸酯代谢Propanoate metabolism | 86 280 | 140 437 | 101 136 | 7.953 | 0.019 |
| 甘油磷脂代谢Glycerophospholipid metabolism | 101 411 | 163 743 | 114 669 | 7.591 | 0.022 |
| 丁酸酯代谢Butanoate metabolism | 114 575 | 179 383 | 127 729 | 6.956 | 0.031 |
| 甘油酯代谢Glycerolipid metabolism | 68 668 | 109 421 | 77 860 | 6.380 | 0.041 |
| 脂质代谢Lipid metabolism | 23 969 | 42 847 | 27 791 | 6.317 | 0.042 |
| 泛酸和CoA生物合成Pantothenate and CoA biosynthesis | 118 439 | 181 366 | 130 334 | 7.239 | 0.027 |
| 硫代谢Sulfur metabolism | 53 387 | 82 129 | 58 558 | 8.241 | 0.016 |
| 氮代谢Nitrogen metabolism | 133 575 | 203 384 | 150 669 | 7.969 | 0.019 |
| 氨基苯甲酸酯降解Aminobenzoate degradation | 21 214 | 28 385 | 22 741 | 8.142 | 0.017 |
| 甲烷代谢Methane metabolism | 236 107 | 369 147 | 258 789 | 8.057 | 0.018 |
| 肽聚糖合成Peptidoglycan biosynthesisi | 148 838 | 226 733 | 165 558 | 7.867 | 0.019 |
| 蛋白质输出Protein export | 111 169 | 163 030 | 117 730 | 7.835 | 0.020 |
| PPAR信号通路PPAR signaling pathway | 21 820 | 28 783 | 22 313 | 7.398 | 0.025 |
| NOD样受体信号通路NOD-like receptor signaling pathway | 8 702 | 12 319 | 9 566 | 6.008 | 0.049 |
| 细菌分泌系统Bacterial secretion system | 102 738 | 162 449 | 113 471 | 7.351 | 0.025 |
| 萜类骨架的生物合成Terpenoids backbone biosynthesis | 107 165 | 153 877 | 115 213 | 7.321 | 0.026 |
| 维生素B6代谢Vitamin B6 metabolism | 38 856 | 56 722 | 43 361 | 7.164 | 0.028 |
| 谷胱甘肽代谢Glutathione metabolism | 31 401 | 53 116 | 37 841 | 7.015 | 0.030 |
| 无机离子的运输与代谢Inorganic ion transport and metabolism | 33 179 | 57 847 | 40 353 | 6.991 | 0.030 |
| 托烷、哌啶、吡啶生物碱的生物合成Tropane, piperidine and pyridine alkaloid biosynthesis | 22 396 | 32 624 | 23 936 | 6.956 | 0.031 |
| 硒化合物代谢Selenocompound metabolism | 66 725 | 104 961 | 75 206 | 6.679 | 0.035 |
| 卟啉和叶绿素代谢Porphyrin and chlorophyll metabolism | 162 288 | 261 070 | 187 544 | 6.537 | 0.038 |
| 玉米素合成Zeatin metabolism | 10 708 | 14 445 | 11 294 | 6.337 | 0.042 |
| 异喹啉生物碱合成Isoquinoline alkaloid biosynthesis | 10 258 | 15 311 | 11 454 | 6.197 | 0.045 |
| 牛磺酸和次牛磺酸代谢Taurine and hypotaurine metabolism | 19 973 | 28 693 | 21 857 | 6.165 | 0.046 |
| 苯甲酸酯降解Benzoate degradation | 36 794 | 57 364 | 40 336 | 6.094 | 0.048 |
随着生活方式的改变,全球营养过剩和肥胖已成为威胁人类健康的重要问题,孕妇肥胖及孕期增重对妊娠相关并发症具有重要影响,超重和肥胖孕妇妊娠代谢性并发症、心血管并发症、巨大儿与新生儿窒息等风险增加[7-8]。孕期营养摄入与母婴增重关系密切,而肠道菌群是影响肠道营养摄入的关键因素。有研究表明肠道菌群改变可能与肥胖的发生发展有关[9]。本研究结果中孕妇肠道优势菌群Firmicutes、Bacteroidetes、Proteobacteria和Actinobacteria占比大于99%,这与以往研究[10]一致。然而α多样性和β多样性组间未见明显区别,DiGulio等[11-12]对孕妇肠道菌群的分析发现妊娠期β多样性没有显著变化,α多样性仅有轻微的边缘性变化,这可能与采样频率方法、测序区域和研究对象有关。研究表明厚壁菌门/拟杆菌门的比值与BMI密切相关,高脂饮食人群中厚壁菌门/拟杆菌门比值显著增加[13]。然而本研究中增重正常组该比例最高,这可能与产检过程中孕期增重过度孕妇的饮食干预(如嘱孕妇少食多餐、多食纤维素含量多的食物、降低饮食进补的观念、养成健康的饮食习惯意识)有关,而忽略了对孕期增重不足和增重正常孕妇的饮食教育。因此,孕期饮食控制适用于所有孕期增重不同孕妇,控制饮食能在一定程度上缓解孕期增重对肠道菌群结构的影响。
在菌群门分类水平,与正常增重孕妇相比,孕期增重不足孕妇肠道中Nitrospirae、Deferribacteres和Gemmatimonadetes的丰富度降低,增重过度孕妇肠道中Acidobacteria丰富度降低。有研究表明过度暴露于PM2, 5能引起Acidobacteria、Deferribacteres和Gemmatimonadetes降低[14]。本研究中增重不足或增重过度也会导致这3种细菌降低,提示这几种细菌可能对外环境变化如饮食、体重和空气等较为敏感,可作为肠道健康状况的指示菌群。Nitrospirae是自然环境中的一种具有净化作用的菌群,能将亚硝酸盐氧化成硝酸盐,降低亚硝酸盐含量[15]。Deferribacteres是一种严格的嗜热厌氧菌,在系统发育上与Nitrospirae非常接近,这是因为Deferribacteres和Nitrospirae的同源祖先中基因转移非常普遍[16]。Deferribacteres能利用Fe3+、Mn4+、硫、硝酸盐等作为电子受体进行能量代谢[17]。此外,其还可调节CD103+树突状细胞,增强调节性T细胞活性,抑制食物过敏引起的免疫反应[18]。有研究发现小鼠饮食中添加蓝莓多酚提取物能增加Deferribacteres和Proteobacteria水平,降低Actinobacteria水平,从而调控脂代谢紊乱,减轻肥胖[19]。也有研究发现高脂饮食引起的肥胖小鼠粪便中,Deferribacteres和Mucispirillum spp.丰度增加[20]。Gemmatimonadetes和Acidobacteria是近年来发现的一类光源性细菌。Gemmatimonadetes广泛存在于自然界,能水解纤维素和半纤维素[21]。然而Gemmatimonadetes和Nitrospirae与人体体重的关系未见报道。Acidobacteria能利用不同碳源和氮源物质等作为能量来源,对环境中酸碱度pH值变化敏感,当pH低于5.5时活性降低;正常人群肠道pH偏中性,大量摄入肉类物质后pH升高[22]。有研究发现在高脂饮食所致肥胖小鼠肠道菌群中Acidobacteria占比下降[23]。本文中增重过度孕妇肠道中Acidobacteria占比也有所下降。这可能是增重过度孕妇肠道pH和饮食改变影响了Acidobacteria活性[22]。
本研究在属水平上发现14种差异菌属,包括Lachnospira spp.、Alistipes spp.、Parabacteroides spp.、Ruminococcaceae_UCG-014 sp.、Subdoligranulum spp.、Ruminococcus_torques_ group spp.、Anaerostipes spp.、Ruminococcus_2 sp.、Klebsiella spp.、Butyricimonas spp.、Eggerthella spp.、Mucispirillum spp.、Helicobacter spp.和Pseudomonas spp.。其中,Ruminococcaceae_ UCG-014 sp.、Lachnospira spp.、Ruminococcus_ torques_group spp.、Anaerostipes spp.、Ruminococcus_2 sp.和Subdoligranulum spp.属于厚壁菌门,Alistipes spp.、Parabacteroides spp.和Butyricimonas spp.属于拟杆菌门,Mucispirillum spp.属于脱铁杆菌门,Eggerthella spp.属于放线菌门,Klebsiella spp.和Pseudomonas spp.属于变形菌门,Helicobacter spp.属于大肠杆菌门,差异菌属主要集中在厚壁菌门和拟杆菌门。
本研究通过对差异菌属与孕妇血糖血脂作相关性分析,发现孕妇BMI和孕期增重与Ruminococcaceae_UCG-014 sp.呈负相关。Ruminococcaceae_UCG-014 sp.在消瘦人群中占比升高,这与以往研究[24]一致。Ruminococcaceae_ UCG-014 sp.是一种可以降解纤维素产生丁酸盐的益生菌,丁酸盐作为短链脂肪酸的一种,是结肠细胞的重要能量来源;短链脂肪酸可通过不同的机制影响能量吸收,例如通过促进肽YY分泌,抑制下丘脑弓状核中的神经肽Y和激活前阿黑皮素原(POMC)神经元来影响食欲和饱腹感,延迟胃排空,增加肌肉对能量的消耗等控制体重增长[25]。本研究发现孕晚期血糖与Lachnospira spp.呈负相关,Lachnospira spp.在增重过度组中丰度最高,这与以往研究[10]一致。Lachnospira spp.能产生短链脂肪酸和抗炎物质,刺激肠道吸收能量物质,调控血糖水平,缓解代谢性疾病的发展[26],其可能作为一种益生菌在调节糖脂紊乱、抵抗肥胖中具有重要作用。
本研究中甘油三酯与Ruminococcus_torques_ group spp.和Alistipes spp.呈负相关。Ruminococcus_torques_group spp.和Alistipes spp.可通过发酵产生短链脂肪酸,短链脂肪酸通过FFAR2受体信号转导抑制胰岛素刺激引起的脂质积累,调节血脂水平[27]。另外本研究中发现高密度脂蛋白与Parabacteroides spp.呈正相关,与Mucispirillum spp.呈负相关,同时Parabacteroides spp.与新生儿体重呈负相关。有研究发现Eggerthella spp.和Parabacteroides spp.与新生儿头围和体重呈负相关[28]。本研究中Parabacteroides spp.与母血孕晚期高密度脂蛋白呈正相关。高密度脂蛋白的代谢过程可以看作是胆固醇的逆向转运,高密度脂蛋白可将血液中的胆固醇转运至肝脏,通过转化为胆汁酸排出,与心血管疾病呈负相关,有抗炎调节胆固醇的作用。胆固醇通过胎盘转运,是新生儿宫内正常发育的重要能量物质之一。Parabacteroides spp.可通过调节高密度脂蛋白的浓度进而影响新生儿发育。Mucispirillum spp.与血清瘦素、体重增加及脂质储备呈正相关[28]。摄入肉类食物可显著增加Mucispirillum spp.和Oscillibacter的丰富度与脂肪合成;在肥胖人群中Mucispirillum spp.占比升高,在增重不足组中占比下降[29]。这与本研究一致。Subdoligranulum spp.和Anaerostipes spp.同属厚壁菌门,它们可帮助宿主降解碳水化合物,从而产生短链脂肪酸,而短链脂肪酸通常被认为对维持人类健康具有重要作用,例如作为肠上皮的特殊营养和能量成分,保护肠粘膜屏障,减少炎症和增强胃肠蠕动。本研究中Subdoligranulum spp.和Anaerostipes spp.丰度在增重正常组中最高,在增重不足和增重过度组中均有所下降。Kim等[30]发现Subdoligranulum spp.与腰围、体重、BMI成正相关。然而在Jia等[31]的研究中,Subdoligranulum spp.与BMI有负相关趋势,而且长期的地中海饮食能提高肠道中Subdoligranulum spp.的水平。Vazquez-Moreno等[32]研究发现Anaerostipes spp.的相对丰度与2型糖尿病的风险适度降低有关。Rodriguez等[33]发现BMI降低增加了阿克曼氏菌(Akkermansia)和丁酸球菌(Butyricicoccus)的含量,降低了Anaerostipes spp.的水平。Ruminococcus_2 sp.属于厚壁菌门瘤胃球菌科,本研究中增重过度组含量最高,然而其生物学特性可能与该科其他物种不同,饮食中添加抗性淀粉并不能增加Ruminococcus_2 sp.含量[34],其具体机制及与人体BMI的关系有待进一步研究。Butyricimonas spp.属于拟杆菌门,在本研究中其与甘油三酯具有负相关调控作用,这与以往研究[35]一致。Butyricimonas spp.可将碳水化合物转化为丁酸和异丁酸,从而对调控血脂控制体重具有积极作用[35]。Helicobacter spp.属于大肠杆菌门,本研究中Helicobacter spp.与孕妇BMI和孕期增重具有负相关趋势。以往研究发现Helicobacter spp.对孕期增重和新生儿出生体重具有负面影响,这可能与CagA阳性菌株引起的胃部炎症有关,从而引起妊娠恶心和怀孕初期呕吐[36]。Klebsiella spp.和Pseudomonas spp.同属变形菌门中的致病菌,它们均与甘油三酯成正相关趋势,在孕妇粪便中检出可能与医源性感染有关。
关于增重不同孕妇肠道菌群的富集分析鲜有报道,我们通过KEGG富集分析发现,孕期增重不足或过度的孕妇肠道菌群在营养物质如碳水化合物、氨基酸、核酸、脂质代谢,以及细胞信号转导、能量生产、基因复制与修复和细胞壁/膜/包膜生物发生等代谢通路中显著降低。说明孕期增重过度或不足可能会影响肠道微生物稳态,某些肠道菌群丰度减少降低了利用碳源、氮源等不同来源有机质的能力,能量转换和交换的能力下降,影响营养物质的代谢与吸收,进而调控血糖血脂水平[10, 28]。一项与孕妇BMI有关的代谢通路研究发现,肥胖孕妇次生代谢物的生物合成通路富集增多,但此通路内的次级通路和孕妇BMI却没有任何显著的统计学关联[37]。然而孕期增重相关的代谢通路改变有待进一步分析。
综上,本研究发现差异菌群与孕期增重、孕妇BMI和血糖血脂水平存在一定的相关性,后续有待进一步通过体外菌群移植实验验证差异菌群对血糖血脂的作用,为孕期补充有益菌调节孕期增重和血糖血脂水平、改善孕妇不良妊娠提供理论依据。
| [1] |
Lappan R, Classon C, Kumar S, Singh OP, De Almeida RV, Chakravarty J, Kumari P, Kansal S, Sundar S, Blackwell JM. Meta-taxonomic analysis of prokaryotic and eukaryotic gut flora in stool samples from visceral leishmaniasis cases and endemic controls in Bihar State India[J]. PLoS Neglected Tropical Diseases, 2019, 13(9): e0007444. DOI:10.1371/journal.pntd.0007444 |
| [2] |
Valdes AM, Walter J, Segal E, Spector TD. Role of the gut microbiota in nutrition and health[J]. BMJ, 2018, 361: k2179. |
| [3] |
Levy M, Kolodziejczyk AA, Thaiss CA, Elinav E. Dysbiosis and the immune system[J]. Nature Reviews Immunology, 2017, 17(4): 219-232. DOI:10.1038/nri.2017.7 |
| [4] |
Gérard P. Gut microbiota and obesity[J]. Cellular and Molecular Life Sciences, 2016, 73(1): 147-162. DOI:10.1007/s00018-015-2061-5 |
| [5] |
Rasmussen KM, Yaktine AL. Weight Gain During Pregnancy: Reexamining the Guidelines[M]. Washington DC: The National Academies Press, 2009: 160.
|
| [6] |
Nossa CW, Oberdorf WE, Yang LY, Aas JA, Paster BJ, DeSantis TZ, Brodie EL, Malamud D, Poles MA, Pei ZH. Design of 16S rRNA gene primers for 454 pyrosequencing of the human foregut microbiome[J]. World Journal of Gastroenterology, 2010, 16(33): 4135-4144. DOI:10.3748/wjg.v16.i33.4135 |
| [7] |
Goldstein RF, Abell SK, Ranasinha S, Misso M, Boyle JA, Black MH, Li N, Hu G, Corrado F, Rode L, et al. Association of gestational weight gain with maternal and infant outcomes: a systematic review and meta-analysis[J]. JAMA, 2017, 317(21): 2207-2225. DOI:10.1001/jama.2017.3635 |
| [8] |
Jiang X, Bian Z, Yuan L, Wang WL, Ying H. Influence of preconception over-weight and obesity on gestational weight gain and pregnancy related prognosis[J]. Journal of International Obstetrics and Gynecology, 2019, 46(3): 301-304. (in Chinese) 蒋湘, 卞政, 袁玲, 王伟琳, 应豪. 孕前超重及肥胖对孕期体质量控制及妊娠结局的影响[J]. 国际妇产科学杂志, 2019, 46(3): 301-304. DOI:10.3969/j.issn.1674-1870.2019.03.015 |
| [9] |
Gohir W, Ratcliffe EM, Sloboda DM. Of the bugs that shape us: maternal obesity, the gut microbiome, and long-term disease risk[J]. Pediatric Research, 2015, 77(1/2): 196-204. |
| [10] |
Stanislawski MA, Dabelea D, Wagner BD, Sontag MK, Lozupone CA, Eggesbø M. Pre-pregnancy weight, gestational weight gain, and the gut microbiota of mothers and their infants[J]. Microbiome, 2017, 5(1): 113. DOI:10.1186/s40168-017-0332-0 |
| [11] |
DiGiulio DB, Callahan BJ, McMurdie PJ, Costello EK, Lyell DJ, Robaczewska A, Sun CL, Goltsman DSA, Wong RJ, Shaw G, et al. Temporal and spatial variation of the human microbiota during pregnancy[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(35): 11060-11065. DOI:10.1073/pnas.1502875112 |
| [12] |
Bisanz JE, Enos MK, PrayGod G, Seney S, Macklaim JM, Chilton S, Willner D, Knight R, Fusch C, Fusch G, et al. Microbiota at multiple body sites during pregnancy in a rural Tanzanian population and effects of Moringa-supplemented probiotic yogurt[J]. Applied and Environmental Microbiology, 2015, 81(15): 4965-4975. DOI:10.1128/AEM.00780-15 |
| [13] |
Liu YY, Li T, Alim A, Ren DY, Zhao Y, Yang XB. Regulatory effects of stachyose on colonic and hepatic inflammation, gut microbiota dysbiosis, and peripheral CD4+ T cell distribution abnormality in high-fat diet-fed mice[J]. Journal of Agricultural and Food Chemistry, 2019, 67(42): 11665-11674. DOI:10.1021/acs.jafc.9b04731 |
| [14] |
Liu W, Zhou YL, Yong L, Qin Y, Yu LL, Li RJ, Chen YH, Xu YJ. Effects of PM2.5 exposure during gestation on maternal gut microbiota and pregnancy outcomes[J]. Chemosphere, 2020, 247: 125879. DOI:10.1016/j.chemosphere.2020.125879 |
| [15] |
Crowe W, Elliott CT, Green BD. A review of the in vivo evidence investigating the role of nitrite exposure from processed meat consumption in the development of colorectal cancer[J]. Nutrients, 2019, 11(11): 2673. DOI:10.3390/nu11112673 |
| [16] |
Kunisawa T. Inference of the phylogenetic position of the phylum Deferribacteres from gene order comparison[J]. Antonie van Leeuwenhoek, 2011, 99(2): 417-422. DOI:10.1007/s10482-010-9492-7 |
| [17] |
Gittel A, Kofoed MVW, Sørensen KB, Ingvorsen K, Schramm A. Succession of Deferribacteres and Epsilonproteobacteria through a nitrate-treated high-temperature oil production facility[J]. Systematic and Applied Microbiology, 2012, 35(3): 165-174. DOI:10.1016/j.syapm.2012.01.003 |
| [18] |
Ma JY, Zhang J, Li QH, Shi ZL, Wu HJ, Zhang HQ, Tang LP, Yi R, Su H, Sun X. Oral administration of a mixture of probiotics protects against food allergy via induction of CD103+ dendritic cells and modulates the intestinal microbiota[J]. Journal of Functional Foods, 2019, 55: 65-75. DOI:10.1016/j.jff.2019.02.010 |
| [19] |
Jiao XY, Wang YH, Lin Y, Lang YX, Li EH, Zhang XY, Zhang Q, Feng Y, Meng XJ, Li B. Blueberry polyphenols extract as a potential prebiotic with anti-obesity effects on C57BL/6 J mice by modulating the gut microbiota[J]. The Journal of Nutritional Biochemistry, 2019, 64: 88-100. DOI:10.1016/j.jnutbio.2018.07.008 |
| [20] |
Walker A, Pfitzner B, Neschen S, Kahle M, Harir M, Lucio M, Moritz F, Tziotis D, Witting M, Rothballer M, et al. Distinct signatures of host-microbial meta-metabolome and gut microbiome in two C57BL/6 strains under high-fat diet[J]. The ISME Journal, 2014, 8(12): 2380-2396. DOI:10.1038/ismej.2014.79 |
| [21] |
Halkjaer SI, Nilas L, Carlsen EM, Cortes D, Halldórsson TI, Olsen SF, Pedersen AE, Krogfelt KA, Petersen AM. Effects of probiotics (Vivomixx®) in obese pregnant women and their newborn: study protocol for a randomized controlled trial[J]. Trials, 2016, 17(1): 491. DOI:10.1186/s13063-016-1617-5 |
| [22] |
Kielak AM, Barreto CC, Kowalchuk GA, Van Veen JA, Kuramae EE. The ecology of Acidobacteria: moving beyond genes and genomes[J]. Frontiers in Microbiology, 2016, 7: 744. |
| [23] |
Si YC, Miao WN, He JY, Chen L, Wang YL, Ding WJ. Regulating gut flora dysbiosis in obese mice by electroacupuncture[J]. The American Journal of Chinese Medicine, 2018, 46(7): 1481-1497. DOI:10.1142/S0192415X18500763 |
| [24] |
Mancabelli L, Milani C, Lugli GA, Turroni F, Cocconi D, Van Sinderen D, Ventura M. Identification of universal gut microbial biomarkers of common human intestinal diseases by meta-analysis[J]. FEMS Microbiology Ecology, 2017, 93(12): fix153. |
| [25] |
Canfora EE, Jocken JW, Blaak EE. Short-chain fatty acids in control of body weight and insulin sensitivity[J]. Nature Reviews Endocrinology, 2015, 11(10): 577-591. DOI:10.1038/nrendo.2015.128 |
| [26] |
Gutiérrez-Repiso C, Hernández-García C, García-Almeida JM, Bellido D, Martín-Núñez GM, Sánchez-Alcoholado L, Alcaide-Torres J, Sajoux I, Tinahones FJ, Moreno-Indias I. Effect of synbiotic supplementation in a very-low-calorie ketogenic diet on weight loss achievement and gut microbiota: a randomized controlled pilot study[J]. Molecular Nutrition & Food Research, 2019, 63(19): 1900167. |
| [27] |
Morrison DJ, Preston T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism[J]. Gut Microbes, 2016, 7(3): 189-200. DOI:10.1080/19490976.2015.1134082 |
| [28] |
Lee J, Jang JY, Kwon MS, Lim SK, Kim N, Lee J, Park HK, Yun MS, Shin MY, Jo HE, et al. Mixture of two Lactobacillus plantarum strains modulates the gut microbiota structure and regulatory T cell response in diet-induced obese mice[J]. Molecular Nutrition & Food Research, 2018, 62(24): 1800329. |
| [29] |
Ahmad MI, Ijaz MU, Haq IU, Li CB. The role of meat protein in generation of oxidative stress and pathophysiology of metabolic syndromes[J]. Food Science of Animal Resources, 2020, 40(1): 1-10. DOI:10.5851/kosfa.2019.e96 |
| [30] |
Kim BS, Song MY, Kim H. The anti-obesity effect of Ephedra sinica through modulation of gut microbiota in obese Korean women[J]. Journal of Ethnopharmacology, 2014, 152(3): 532-539. DOI:10.1016/j.jep.2014.01.038 |
| [31] |
Jia WR, Zhen JH, Liu AJ, Yuan JY, Wu XL, Zhao PF, Zhao L, Li XL, Liu QG, Huang GR, et al. Long-term vegan meditation improved human gut microbiota[J]. Evidence-based Complementary and Alternative Medicine, 2020, 2020: 9517897. |
| [32] |
Vazquez-Moreno M, Perez-Herrera A, Locia-Morales D, Dizzel S, Meyre D, Stearns JC, Cruz M. Association of gut microbiome with fasting triglycerides, fasting insulin and obesity status in Mexican children[J]. Pediatric Obesity, 2020, e12748. |
| [33] |
Rodriguez J, Hiel S, Neyrinck AM, Le Roy T, Pötgens SA, Leyrolle Q, Pachikian BD, Gianfrancesco MA, Cani PD, Paquot N, et al. Discovery of the gut microbial signature driving the efficacy of prebiotic intervention in obese patients[J]. Gut Microbiota, 2020, 69(11): 1975-1987. |
| [34] |
Vital M, Howe A, Bergeron N, Krauss RM, Jansson JK, Tiedje JM. Metagenomic insights into the degradation of resistant starch by human gut microbiota[J]. Applied and Environmental Microbiology, 2018, 84(23): e01562-18. |
| [35] |
Pan YY, Zeng F, Guo WL, Li TT, Jia RB, Huang ZR, Lv XC, Zhang JC, Liu B. Effect of Grifola frondosa 95% ethanol extract on lipid metabolism and gut microbiota composition in high-fat diet-fed rats[J]. Food & Function, 2018, 9(12): 6268-6278. |
| [36] |
Grooten IJ, Den Hollander WJ, Roseboom TJ, Kuipers EJ, Jaddoe VW, Gaillard R, Painter RC. Helicobacter pylori infection: a predictor of vomiting severity in pregnancy and adverse birth outcome[J]. American Journal of Obstetrics and Gynecology, 2017, 216(5): 512.e1-512.e9. |
| [37] |
LeMay-Nedjelski L, Butcher J, Ley SH, Asbury MR, Hanley AJ, Kiss A, Unger S, Copeland JK, Wang PW, Zinman B, et al. Examining the relationship between maternal body size, gestational glucose tolerance status, mode of delivery and ethnicity on human milk microbiota at three months post-partum[J]. BMC Microbiology, 2020, 20(1): 219. DOI:10.1186/s12866-020-01901-9 |
 2021, Vol. 48
2021, Vol. 48




