扩展功能
文章信息
- 刘韶娜, 张斌, 相德才, 赵智勇, 赵彦光
- LIU Shaona, ZHANG Bin, XIANG Decai, ZHAO Zhiyong, ZHAO Yanguang
- 戊糖片球菌368对猪生长性能、粪菌结构和代谢产物的影响
- Effect of Pediococcus pentosaceus 368 on grow performance, fecal microbiota and metabolite in pigs
- 微生物学通报, 2021, 48(6): 2035-2048
- Microbiology China, 2021, 48(6): 2035-2048
- DOI: 10.13344/j.microbiol.china.200898
-
文章历史
- 收稿日期: 2020-09-07
- 接受日期: 2020-10-09
- 网络首发日期: 2020-12-30
鉴于抗生素的负面效应,如促进细菌耐药性增强[1]、畜产品中抗生素残留超标[2],国家农业农村部发布194号公告(http://www.xmsyj.moa.gov.cn/zcjd/201907/t20190710_6320678.htm),自2020年7月1日起,饲料生产企业停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料。因此,寻找抗生素替代品预防养殖过程中疾病的发生成为当前研究热点。益生菌因其来源广泛、应用广泛安全、生产成本低等优点,逐渐成为当前研究热点。常见的益生菌有芽孢杆菌、乳酸菌、酵母菌和双歧杆菌等[3-4]。戊糖片球菌属于链球菌科片球菌属,是革兰氏阳性菌,属于乳酸菌的一种。戊糖片球菌具有提高发酵后面团中总游离氨基酸和抗氧化活性作用[5],能够促进机体中铁的吸收[6],降低泡菜中亚硝酸的含量[7]。鸡的饲粮中添加戊糖片球菌后,提高了肠道内链脂肪酸水平、改善了鸡肉风味和调节了肠道菌群结构[8]。目前戊糖片球菌的主要研究方向为食品发酵以及青贮饲料等。戊糖片球菌对猪的生长性能、粪菌微生物结构和代谢的影响未见报道。为了进一步明确该菌的体内试验效果,明确其对育肥猪生长、代谢和粪菌多样性的影响,本试验开展了相关研究,以期为戊糖片球菌的应用、无抗饲料开发和猪的绿色养殖提供理论依据。
1 材料与方法 1.1 试验动物与设计按照日龄和体重相近原则从云南省畜牧兽医科学院云上飘香猪群中,选择无病史、体重(91.50±7.0) kg育肥猪(含太湖猪25%、迪庆藏猪50%和杜洛克血缘25%) 20头,按照完全随机分组设计分为2组,每组10头。基础日粮为参照肉脂型猪饲养标准(NY/T65-2004)[9]配制而成的颗粒饲料。试验组(P组)饲喂基础饲粮+1010 CFU/kg戊糖片球菌368,对照组(C组)饲喂基础饲粮。戊糖片球菌368保藏于中国普通微生物菌种保藏中心,保藏编号为CGMCC 18709。
1.2 饲养管理饲养试验在云南省畜牧兽医科学院种猪质量检验测试中心的种猪测定舍内进行,试验前进行空舍打扫与消毒。全阶段自由采食和自由饮水,其他管理按照管理程序进行,预试期为7 d,正试验为21 d。
1.3 试验测定于试验的第1、8、15、22天和最后一天对试验猪进行称重并记录(禁食12 h)。计算平均日增重、平均日采食量和料重比。试验结束前一天下午,每个重复随机选择3头猪,收集粪便样品(取刚排泄的粪便中间部分),液氮速冻,−80 ℃保存,用于进一步分析。
1.4 主要试剂和仪器DNA提取试剂盒,Omega公司;凝胶回收试剂盒,Axygen Biosciences公司;建库试剂盒,Bioo Scientific公司;测序试剂盒,Illumina公司。
全自动采食测定系统,ACEMO64公司;PCR仪、蓝色荧光定量系统、微型荧光计,Promega公司;液相色谱质谱联用仪、超微量分光光度计NanoDrop2000,Thermo Fisher Scientific公司;Illumina Miseq测序仪,Illumina公司。
1.5 高通量测序分析用DNA提取试剂盒提取样品中总DNA并用NanoDrop2000检测DNA纯度和浓度,采用引物338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5ʹ-GGACTACHVGGGTWTCTAAT-3ʹ)对16S rRNA基因V3−V4可变区进行PCR扩增。PCR反应体系:5×Buffer 4 µL,dNTPs (2.5 mmol/L) 2 µL,引物338F和806R (5 µmol/L)各0.8 µL,2×FastPfu Polymerase 0.4 µL,BSA 0.2 µL,DNA模板10 ng,补ddH2O至20 µL。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,共27个循环;72 ℃ 10 min;10 ℃保存。PCR产物使用2%琼脂糖凝胶电泳检测,并在纯化后用微型荧光计检测定量,利用Illumina公司的Miseq PE300平台进行测序。原始测序序列质控和拼接后,根据Illumina MiSeq平台构建PE300的文库。在97%的相似度水平下对序列进行操作分类单元(Operational Taxonomic Unit,OTU)聚类,通过I-Sanger云平台数据库进行物种分类注释。
1.6 代谢组学分析通过液质联用技术对样品进行检测,并使用Progenesis QI (Waters Corporation,Milford,USA)软件分析,进行代谢物注释、数据预处理等,采用偏最小二乘判别分析法(Partial Least Squares Discrimination Analysis,PLS-DA)分析样品间差异,结合t检验和变量重要性(Variable Importance,VIP)筛选出对模型贡献较大的差异代谢物,进一步对其生物学信息进行挖掘。
1.7 数据分析采用SPSS 17.0统计软件进行单因素方差分析(One-Way ANOVA)和LSD多重比较,P˂0.05为差异显著,P˂0.01为差异极显著。数据以平均值±标准差表示。
2 结果与分析 2.1 戊糖片球菌368对猪生长性能的影响由表 1可知,添加戊糖片球菌368后,提高了试验猪的终末体重、平均日采食量和平均日增重,但差异均不显著(P > 0.05)。
| 项目 Items |
P组 Group P |
C组 Group C |
| 初始体重 Initial Body Weight (kg) |
91.50±7.08 | 91.38±3.34 |
| 终末体重 Final Body Weight (kg) |
103.41±8.37 | 101.73±2.65 |
| 平均日采食量 ADFI (g/d) |
2 819.58±292.32 | 2 727.38±545.54 |
| 平均日增重 ADG (g/d) |
533.33±112.61 | 470.91 ±119.49 |
| 料重比 F/G |
5.91±0.83 | 6.37±0.67 |
根据OTU聚类分析,共获得1 036个OTU,聚类为17个门23个纲37个目67个科199个属350个种。
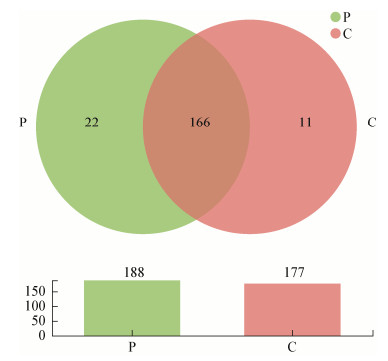
从图 1中可知,在属水平上,2组共有物种为166个,P组特有物种为22个,C组特有物种为11个。添加戊糖片球菌368后,提高了属水平上育肥猪粪菌中物种的数量。
|
| 图 1 基于属水平的韦恩图分析 Figure 1 Analysis of Venn based on genus 注:P组属水平上的差异菌群为Paraprevotella;norank_f__ norank_o__T2WK15B57;Alistipes:另枝菌属;Staphylococcus:葡萄球菌;Bilophila:嗜胆菌属;Syntrophomonas:互营单胞菌属;Helicobacter:螺杆菌属;[Bacteroides]_ pectinophilus_group:拟杆菌属pectinophilus群;Chlamydia:衣原体属;Z20;Actinobacillus:放线杆菌属;Pediococcus:片球菌属;norank_f__Family_XIII;unclassified_f_ Desulfovibrionaceae:未分类的脱疏弧菌科;Rhodococcus:红球菌属;unclassified_f__Erysipelotrichaceae:未分类的韦荣球菌科;Acidaminococcus:氨基酸球菌属;[Eubacterium]_ ventriosum_group:凸腹真杆菌;Lachnoclostridium_10;norank_f__Paracaedibacteraceae;Howardella;Parasutterella:副萨特氏菌属C组属水平上的差异菌群为Enterorhabdus:肠杆菌属;Roseburia:氏菌属;Bifidobacterium:双歧杆菌;norank_f__T34;Anaerofustis:厌氧梭菌属;norank_f__F082;Ruminococcaceae_UCG-001:瘤胃菌科_UCG-001;Ruminococcaceae_V9D2013_group:瘤胃菌科_V9D2013群;Cerasicoccus;Prevotella_7:普氏菌属_7;Tyzzerella_3 Note: Differences between the flora of group P on the genus level as follow: Paraprevotella; norank_f__norank_o__T2WK15B57; Alistipes; Staphylococcus; Bilophila; Syntrophomonas; Helicobacter; [Bacteroides]_pectinophilus_group; Chlamydia; Z20; Actinobacillus; Pediococcus; norank_f__Family_XIII; unclassified_f__Desulfovibrionaceae; Rhodococcus; Unclassified_f__Erysipelotrichaceae; Acidaminococcus; [Eubacterium]_ventriosum_group; Lachnoclostridium_10; norank_f__Paracaedibacteraceae; Howardella; Parasutterella Differences between the flora of group c on the genus level as follow: Enterorhabdus; Roseburia; Bifidobacterium; norank_f__ T34; Anaerofustis; Norank_f__F082; Ruminococcaceae_UCG-001; Ruminococcaceae_V9D2013_group; Cerasicoccus; Prevotella_7; Tyzzerella_3 |
|
|
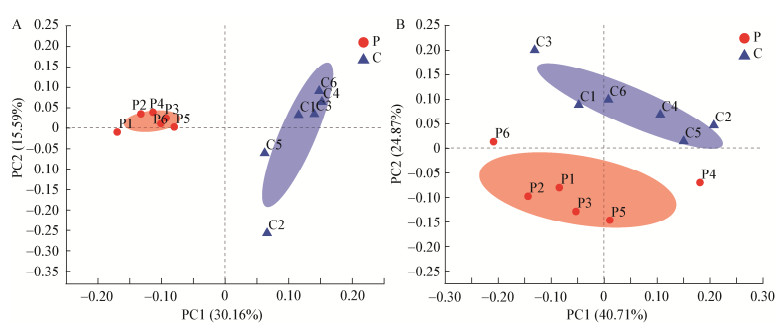
为了分析比较组间微生物群落间的物种多样性,探索群落组成的差异性,本研究基于Unweighted Unifrac和Weighted Unifrac加权距离主坐标分析(Proncipal Co-Ordinates Analysis,PCoA) 2组样品,结果如图 2所示,2组样品明显分开,2组样品菌群组成不同。添加戊糖片球菌368后,样品中菌群群落组成发生改变。
|
| 图 2 基于Unweighted unifrac (A)和Weighted unifrac (B)距离PCoA分析 Figure 2 Analysis of PCoA based on Unweighted unifrac distance (A) and weighted unifrac distance (B) |
|
|
由表 2可知,相对丰度大于1%的菌门共3个,分别为厚壁菌门、拟杆菌门和螺旋菌门。2组样品中厚壁菌门的相对丰度最高(P > 0.05),其次为拟杆菌门。添加了戊糖片球菌368后,极显著提高了样品中螺旋体门的相对丰度(P˂0.01),降低了厚壁菌门/拟杆菌门的比值。
| 菌门 Phylum |
组别Groups | |
| P | C | |
| 厚壁菌门 Firmicutes |
57.19±1.65 | 64.10±4.07 |
| 拟杆菌门 Bacteroidetes |
31.40±4.60 | 30.74±7.69 |
| 螺旋体门 Spirochaetes |
6.91±0.58A | 1.67±0.59B |
| 厚壁菌门/拟杆菌门 Firmicutes/Bacteroidetes |
1.82 | 2.09 |
| 注:同行不同小写字母表示差异显著(P˂0.05),不同大写字母表示差异极显著(P˂0.01)。下同 Note: In the same line, different lowercase letters mean significant difference (P˂0.05), different capital letters mean extremely difference (P˂0.01). The same below | ||
属水平上的优势菌群结构分析中相对丰度大于1%的物种见表 3,试验组和对照组相对丰度最高的菌属分别为乳杆菌属和链球菌属。添加戊糖片球菌368后,提高了样品中乳杆菌属、普氏菌属_1、Norank_f__Muribaculaceae、普雷沃氏菌科_NK3B31群、未分类的毛螺菌科和密螺旋体_2的相对丰度(P > 0.05)及狭义梭菌属(P˂0.05)、理研氏菌科RC9肠群(P˂0.05)和土孢菌属(P˂0.05)的相对丰度,降低了链球菌属(P˂0.01)、毛螺菌科_XPB1014群(P˂0.05)、Norank_f__p-251-o5 (P˂0.01)和瘤胃球菌科_NK4A214群(P˂0.05)的相对丰度。结果显示对照组的链球菌相对丰度过高,提示在饲养过程中可能感染链球菌,添加了戊糖片球菌368后,极显著降低了链球菌的相对丰度,并显著提高具有直接或间接抗病菌(狭义梭菌属和土孢菌属)的相对丰度。
| 菌属 Genus |
P组 Group P |
C组 Group C |
| 链球菌属 Streptococcus |
1.14A±0.49 | 16.98B±1.83 |
| 乳杆菌属 Lactobacillus |
10.89±5.42 | 7.66±3.51 |
| 毛螺菌科_XPB1014群 Lachnospiraceae_XPB1014_group |
2.01a±0.59 | 3.61b±0.97 |
| 普氏菌属_1 Prevotella_1 |
5.69±4.95 | 3.96±0.94 |
| norank_f__Muribaculaceae | 5.10±1.41 | 2.90±0.07 |
| 瘤胃球菌科UCG-005 Ruminococcaceae_UCG-005 |
3.07±0.34 | 3.02±0.67 |
| 普雷沃氏菌科_NK3B31群 Prevotellaceae_NK3B31_group |
4.84±3.62 | 3.20±0.45 |
| 未分类的毛螺菌科 Unclassified_f__Lachnospiraceae |
6.67±2.95 | 3.81±0.39 |
| 狭义梭菌属 Clostridium_sensu_stricto_1 |
7.13a±2.58 | 1.01b±0.07 |
| 密螺旋体_2 Treponema_2 |
4.29±2.39 | 2.86±1.25 |
| 土孢菌属 Terrisporobacter |
4.85a±2.61 | 0.55b±0.11 |
| 克里斯滕森菌科R-7群 Christensenellaceae_R-7_group |
1.71±0.40 | 2.77±0.22 |
| norank_f__p-251-o5 | 1.67a±0.92 | 9.30b±2.12 |
| 未分类的普雷沃氏菌科 unclassified_f__Prevotellaceae |
1.94±1.08 | 2.18±0.92 |
| 理研氏菌科RC9肠群 Rikenellaceae-RC9-gut-group |
2.89a±0.49 | 1.33b±0.20 |
| 普雷沃氏菌科UCG-003 Prevotellaceae_UCG-003 |
2.09±0.24 | 2.33±0.82 |
| 瘤胃球菌科_NK4A214群 Ruminococcaceae_NK4A214_group |
1.34a±0.31 | 2.48b±0.66 |
| 瘤胃球菌属_1 Ruminococcus_1 |
1.33±0.19 | 1.45±0.52 |
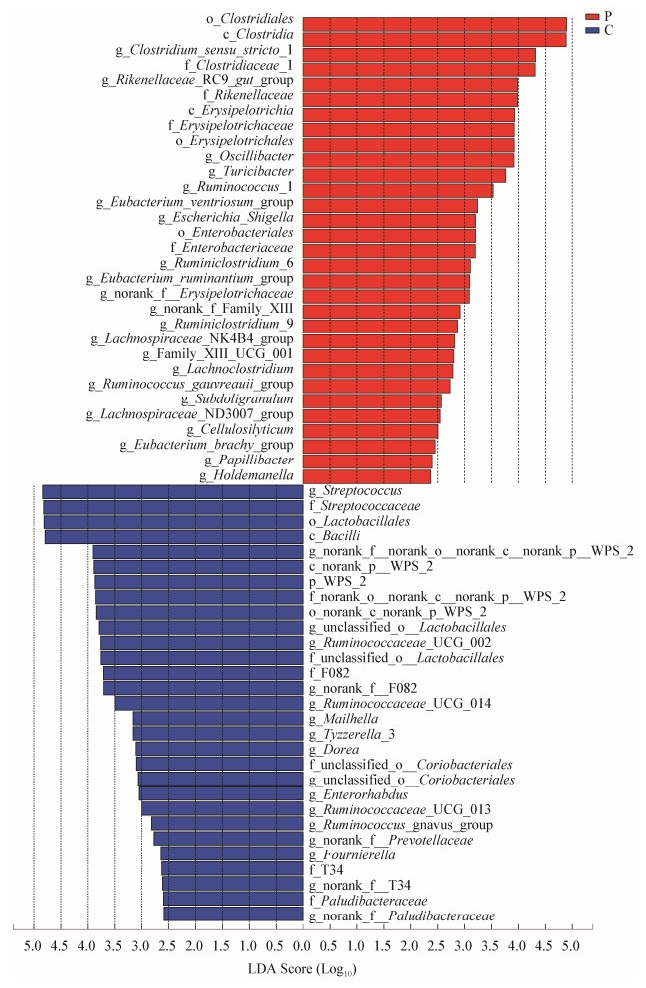
本研究采用了LEfSe方法研究添加戊糖片球菌368对猪粪便菌群组成的影响,结果如图 3所示,研究结果显示2组细菌群落差异显著,LDA值大于2.0时共获得60个生物标记物,其中P组获得31个生物标记物。C组内LDA值最大的是链球菌属(Streptococcus),P组LDA值最大的是梭菌目(Clostridiales),此二者是相对丰度差异最大的差异菌。门水平上,P组的WPS_2相对丰度显著低于C组;纲水平上,P组中芽孢杆菌纲(Bacilli)和未明确的WPS_2相对丰度低于C组,梭菌纲(Clostridia)和丹毒丝菌纲(Erysipelotrichia)则高于C组;目水平上,乳杆菌目(Lactobacillales)和未明确的WPS_2低于C组,梭菌目(Clostridiales)、丹毒丝菌目(Erysipelotrichales)和肠杆菌目(Enterobacteriales)则高于C组;属水平上,P组中链球菌属、未明确的WPS_2属、未分类的乳杆菌目(Unclassified_o__Lactobacillales)、瘤胃球菌科_UCG_002 (Ruminococcaceae_UCG_002)、未明确的F082、瘤胃球菌科_UCG_014 (Ruminococcaceae_UCG_014)、Tyzzerella_3、多雷亚菌属(Dorea)、未分类的红椿菌目(Unclassified_ o_Coriobacteriales)、瘤胃球菌科_UCG_013 (Ruminococcaceae_UCG_013)、瘤胃球菌属gnavus群(Ruminococcus_gnavus_group)、未明确的普雷沃氏菌科(Norank_f__Prevotellaceae)、Fournierella、未明确的T34菌科和未明确的Paludibacteraceae相对丰度下降,狭义梭菌属(Clostridium_sensu_ stricto_1)、理研氏菌科RC9肠群(Rikenellaceae_RC9_gut_group)、颤杆菌属(Oscillibacter)、瘤胃球菌属(Ruminococcus_1)、反刍真杆菌群(Eubacterium_ruminantium_group)、埃希氏-志贺菌属(Escherichia_Shigella)、Turicibacter、瘤胃梭菌属_6 (Ruminiclostridium_6)、短真杆菌群(Eubacterium_brachy_group)、丹毒丝菌科(Erysipelotrichaceae)、瘤胃梭菌属_9 (Ruminiclostridium_9)、毛螺菌科NK4B4群(Lachnospiraceae_NK4B4_group)、瘤胃球菌属gauvreauii群(Ruminococcus_gauvreauii_group)、毛螺菌科ND3007群(Lachnospiraceae_ND3007_ group)、Cellulosilyticum、霍尔德曼氏菌(Holdemanella)和Papillibacter相对丰度显著上升。
|
| 图 3 基于LDA的群落组成差异分析 Figure 3 Differences of microbiota composition based on LDA |
|
|
偏最小二乘判别分析法(PLS-DA)如图 4所示,正负离子模式下2组样品完全分开,分离度较大,提示在2种离子模式下分类效果显著,给猪饲喂戊糖片球菌368后显著改变了粪便中代谢物的成分。

|
| 图 4 正(A)、负(B)离子模式下的PLS-DA Figure 4 The PLS-DA chart of positive (A) and negative (B) ion mode |
|
|
表 4显示添加戊糖片球菌368后,育肥猪肠道中白喉酰胺、2-羟基十四烷酸、Furanofukinin、多巴醌、Avocadene、N-(1-脱氧-1-果糖基)脯氨酸和N-(1-脱氧-1-果糖基)甘氨酸均显著(P˂0.05)或极显著(P˂0.01)上升。24-脱氧维生素D3、Artonin U、1α, 25-二羟基-9, 11-麦角酸-3-脱氧-维生素D3则显著(P˂0.05)或极显著(P˂0.01)下降。其中N-(1-脱氧-1-果糖基)脯氨酸和N-(1-脱氧-1-果糖基)甘氨酸为重要的活性风味前体物质,与产品中的风味相关;白喉酰胺与肿瘤发生呈负相关,2-羟基十四烷酸与脂肪代谢相关,多巴醌则是黑色素前体物质,与黑色素形成相关。
| 代谢物 Metabolite |
差异表达倍数 FC (P/C) |
P值 P value |
| 24-脱氧维生素D3 24-Dehydropro vitamin D3 |
0.51 | 0.019 |
| 白喉酰胺Diphthamide | 1.54 | 0.001 0 |
| Artonin U | 0.43 | 0.021 |
| 1α, 25-二羟基-9, 11-麦角酸-3-脱氧-维生素D3
1α, 25-dihydroxy-9, 11-didehydro-3-deoxy-vitamin D3 |
0.74 | 0.006 4 |
| N-(1-脱氧-1-果糖基)脯氨酸N-(1-Deoxy-1-fructosyl)proline | 1.52 | 0.000 020 |
| N-(1-脱氧-1-果糖基)甘氨酸N-(1-Deoxy-1-fructosyl)glycine | 1.44 | 0.001 4 |
| 2-羟基十四烷酸2-Hydroxymyristic Acid | 1.21 | 0.001 5 |
| Furanofukinin | 1.33 | 0.042 |
| 多巴醌Dopaquinone | 1.24 | 0.038 |
| Avocadene | 1.29 | 0.045 |
| 注:差异表达倍数:代谢物在两组间的差异表达倍数(fold change) Note: FC(P/C): Expression multiples of metabolites between two groups (fold change) | ||
为了探究粪菌与代谢物之间的潜在关系,通过相关性分析挖掘潜在生物标志物。由图 5可知,理研氏菌科_RC9肠群(Rikenellaceae_RC9_gut_group)与羟喹啉和Artonin U显著负相关(P˂0.05),与N-(1-脱氧-1-果糖基)脯氨酸(P˂0.05) [N-(1-Deoxy-1-Fructosyl) Proline]、N-(1-脱氧-1-果糖基)甘氨酸[N-(1-Deoxy-1-Fructosyl) Glycine] (P˂0.01)、2-羟基十四烷酸(2-Hydroxymyristic Acid) (P˂0.01)和多巴醌(Dopaquinone) (P˂0.01)显著正相关,颤杆菌属(Oscillibacter)和颤杆菌属_1 (Oscillibacter_1)与Artonin U (P˂0.01)、24-脱氧维生素D3 (24-Dehydropro Vitamin D3) (P˂0.05)和1α, 25-二羟基-9, 11-麦角酸-3-脱氧-维生素D3 (1α, 25-Dihydroxy-9, 11-Didehydro-3-Deoxy-Vitamin D3) (P˂0.05)显著负相关,与2-羟基十四烷酸(P˂0.05)、Furanofukinin (P˂0.05)、Avocadene、N-(1-脱氧-1-果糖基)脯氨酸(P˂0.05)和N-(1-脱氧-1-果糖基)甘氨酸(P˂0.05)显著正相关;狭义梭菌属_1 (Clostridium_sensu_stricto_1)与Artonin U (P˂0.01)、24-脱氧维生素D3 (P˂0.01)和1α, 25-二羟基-9, 11-麦角酸-3-脱氧-维生素D3 (P˂0.05)显著负相关,与白喉酰胺(Diphthamide)和Avocadene显著正相关(P˂0.01);土孢菌属(Terrisporobacter)与Artonin U (P˂0.05)和1α, 25-二羟基-9, 11-麦角酸-3-脱氧-维生素D3(P˂0.05)显著负相关,与N-(1-脱氧-1-果糖基)甘氨酸显著负相关(P˂0.05);丹毒丝菌纲(Erysipelotrichia)与Artonin U、24-脱氧维生素D3和1α, 25-二羟基-9, 11-麦角酸-3-脱氧-维生素D3显著负相关(P˂0.05),与白喉酰胺(P˂0.01)和N-(1-脱氧-1-果糖基)甘氨酸(P˂0.05)显著正相关;芽孢杆菌纲(Bacilli)与Artonin U (P˂0.01)和1α, 25-二羟基-9, 11-麦角酸-3-脱氧-维生素D3 (P˂0.05)显著正相关,与N-(1-脱氧-1-果糖基)甘氨酸(P˂0.05)显著负相关;Turicibacter与Artonin U和24-脱氧维生素D3显著负相关(P˂0.05),与白喉酰胺和N-(1-脱氧-1-果糖基)甘氨酸显著正相关(P˂0.05);链球菌属(Streptococcus)与24-脱氧维生素D3显著正相关(P˂0.05),与Furanofukinin (P˂0.05)、多巴醌(P˂0.05)和N-(1-脱氧-1-果糖基)甘氨酸(P˂0.01)显著负相关;毛螺菌科_XPB1014群与多巴醌(P˂0.01)和N-(1-脱氧-1-果糖基)甘氨酸(P˂0.05)显著负相关。其中,链球菌属和毛螺菌科_XPB1014群(Lachnospiraceae_XPB1014_group)为粪菌中主要优势菌,添加戊糖片球菌368后,它们的相对丰度均显著下降,而且均与多巴醌和N-(1-脱氧-1-果糖基)甘氨酸显著负相关,与24-脱氧维生素D3和Artonin U显著正相关,狭义梭菌属、理研氏菌科RC9肠群和土孢菌属也是粪菌中主要优势菌且相对丰度显著提高(P˂0.05),它们与N-(1-脱氧-1-果糖基)脯氨酸、N-(1-脱氧-1-果糖基)甘氨酸、2-羟基十四烷酸、Furanofukinin、多巴醌和白喉酰胺正相关,与24-脱氧维生素D3、Artonin U、1α, 25-二羟基-9, 11-麦角酸-3-脱氧-维生素D3正相关。提示主要优势菌相对丰度的变化对代谢物的相对含量变化可能发挥了促进作用。

|
| 图 5 关联分析 Figure 5 Correlation analysis Note: *: P˂0.05; **: P˂0.01; ***: P˂0.001 |
|
|
益生菌具有促进营养物质代谢和吸收、促进生长的作用[10-12]。Blanton等发现肠道菌群通过多样性变化定位其成熟程度,从而影响机体的生长和代谢[13]。目前生产中常用的益生菌有酵母菌、乳酸菌、双歧杆菌、芽孢杆菌和粪球菌等。双歧杆菌能够促进其自身与人类的共生和共同进化[14];断奶前补充酵母能够调节肠道稳态和改善生长;植物乳杆菌通过N-乙酰基谷氨酰胺促进果蝇的生长[15]。本试验研究结果表明,添加戊糖片球菌368后,试验组中猪的终末体重、平均日采食量和平均日增重高于对照组,差异均不显著,极显著降低了链球菌的相对丰度,显著提高了Avocadene的相对含量和产短链脂肪酸菌的相对丰度(梭菌目等)。链球菌与婴儿的生长负相关[16]。短链脂肪酸能促进胃肠激素产生,从而通过神经递质经肠脑轴影响采食量[17]。Avocadene为一种脂肪醇,通过抑制脂肪酸氧化增加葡萄糖氧化和降低线粒体中的活性氧,从而改善葡萄糖耐受和利用率以及胰岛素敏感性,进而影响采食[18]。由此可见,添加戊糖片球菌368可能具有潜在的提高育肥后期猪生长性能的趋势,但还有待进一步证实。
肠道菌群通过代谢活动参与宿主的营养物质消化吸收,从而影响宿主的生长。如,肠道菌群可通过促进产生胰岛素样生长因子(IGF1)进而促进宿主生长,通过抵消营养不良的影响恢复营养不良儿童的成长,因此肠道菌群发育已被纳入儿童发育的评估环节[19];肠道菌群可显著改善胰岛素抵抗,降低体重和脂肪含量,改善肝脏炎症标记物;菌群导向的辅食能改善骨形成、免疫功能和神经发育[20]等。刚排泄的粪便,其微生物菌群能够间接地反映肠道微生物结构与多样性,同时能节约经费、减少应激因素和进行连续性试验,所以越来越多的学者通过关注粪菌来研究肠道微生物[21-22]。
厚壁菌门/拟杆菌门的比值与宿主脂肪的贮存[23-24]、体重、内脏脂肪和皮下脂肪[25-26]呈正相关,益生菌和益生元可降低厚壁菌门/拟杆菌门的比值。螺旋体门是肠道内常见菌门,Chen等通过肠道菌群-肠-脑轴分析发现螺旋体门与脂质代谢相关[27];严鸿林通过比较荣昌猪和大白猪发现密螺旋体属与肌内脂肪含量呈正比[28];Zheng等则发现Turicibacter与脂质代谢正相关[29];Pallister等研究发现真杆菌与脏脂肪重量及饮食分数呈正相关[30];朱瑾研究发现育肥猪饲粮中添加枯草芽孢杆菌能提高肌内脂肪含量[31];郑文涌等研究发现酿酒酵母培养物促进育肥猪粪菌中瘤胃球菌属、颤螺菌属和粪球菌属,促进脂质代谢,提高肌肉品质[32]。本研究发现,添加戊糖片球菌368后,粪菌中螺旋体门的相对丰度极显著上升,厚壁菌门/拟杆菌门的比值下降,短链脂肪酸产生菌和脂肪代谢相关菌(Turicibacter和短真杆菌)相对丰度提高,它们可参与脂肪生成,2-羟基十四烷酸相对含量极显著升高,提示添加戊糖片球菌368后可能影响了宿主的脂肪沉积和脂肪代谢,但还待进一步研究。
3.2 戊糖片球菌368对菌群的影响链球菌属于机会致病菌,也是肠道内优势菌[33],参与机体营养物质代谢和免疫反应[34];同时也能引发疾病,对生猪产业的健康发展具有负面影响[35]。常规的抗生素治疗,如强力霉素和庆大霉素容易形成停药后的持续性感染[36]。部分链球菌属对生长具有显著促进作用[3],消化链球菌通过代谢产物吲哚丙烯酸促进肠道上皮屏障功能[37],阻挡细菌通过黏液层[38],并缓解炎症反应。然而链球菌的相对丰度及物种结构对促进发病[39]具有潜在诱导作用,肝硬化不良结局患者[40]、高病毒感染者[41]、发育迟缓儿童[42]肠道内链球菌属显著升高,与结直肠癌发病显著相关[43]。口服抗生素(万古霉素、环丙沙星和甲硝唑)促进链球菌属过度生长[44],链球菌属与呼吸道炎症负相关[42],能够通过母体传播[45]。有研究结果提示链球菌与营养代谢、免疫和疾病相关,但如何调控其相对丰度和结构、促进机体健康和预防疾病,目前尚无有效措施。本研究结果显示,添加戊糖片球菌368后,试验组中的链球菌极显著降低,但前期体外试验结果显示,368对病原菌无显著拮抗效果,其发挥抑菌效果可能通过以下几个途径:(1) 添加戊糖片球菌368后提高了肠道内菌群的相对丰度,如螺旋体门、梭菌目、理研氏菌科、瘤胃梭菌属、毛螺菌科、瘤胃球菌属、短真杆菌属和土孢菌属等。瘤胃球菌代谢产生抗菌物质瘤胃球菌素C1 (RumC1),RumC1通过抑制核酸合成从而对多重耐药菌和致病性梭菌等发挥杀菌作用[46];毛螺菌科和梭菌目与病原菌负相关[40]。因此,添加戊糖片球菌368具有潜在促进肠道菌群抑制链球菌和促进有益菌相对丰度的趋势。(2) 添加368后显著提高了部分丁酸盐产生菌(毛螺菌科NK4B4群和梭菌目)的相对丰度,丁酸盐产生菌具有维持肠道菌群平衡的作用[47],从而可能通过潜在促进肠道菌群平衡减少某一菌种的失衡现象。(3) 添加368后改变了某些代谢产物(萜类化合物Furanofukinin)的相对含量,萜类物质具有改善肠道屏障、促进短链脂肪酸产生、调节肠道菌群组成,从而促进肠稳态的作用[48];添加368后或可能通过菌群代谢产物间接促进有益菌的相对丰度,从而降低了链球菌的相对丰度。综上所述,添加368后,可能通过调节肠道菌群结构及代谢物的相对含量,从而降低了肠道内链球菌的相对丰度,但还需后续的研究和验证工作来证明此推断结果。
3.3 戊糖片球菌368对代谢产物的影响肉的风味是评价肉质质量的重要指标之一,Wang等发现饲喂戊糖片球菌后,鸡胸肉中(E)-2-庚醛、(E, E)-2, 4-壬二烯醛和一些C6-C9不饱和脂肪酸等脂肪酸类风味物质含量提高,直接改善鸡肉风味[8]。本研究发现添加368后显著提高了猪的粪便中N-(1-脱氧-1-果糖基)脯氨酸和N-(1-脱氧-1-果糖基)甘氨酸等的相对含量,此二者是重要的风味前体物质;极显著降低了链球菌的相对丰度,Ren等发现链球菌与人类肌肉状态改善显著负相关[20]。结果提示,添加368后对肉质性能或具有潜在的改善功能,但还需进一步研究证明。
4 结论添加戊糖片球菌368对猪生长性能无显著影响;提高了猪粪菌的β多样性;在门水平上极显著提高了螺旋体门的相对丰度,降低了粪菌中厚壁菌门/拟杆菌门的比值;在属水平上提高了狭义梭菌属、理研氏菌科RC9肠群和土孢菌属的相对丰度,降低了毛螺菌科_XPB1014群、Norank_f_p-251-o5、瘤胃球菌科_NK4A214群和机会致病菌链球菌属的相对丰度;提高了白喉酰胺、2-羟基十四烷酸、Furanofukinin、多巴醌和Avocadene等的相对含量,具有潜在的提高风味前体物质[N-(1-脱氧-1-果糖基)脯氨酸和N-(1-脱氧-1-果糖基)甘氨酸]、降低维生素D3 (24-脱氧维生素D3和1α, 25-二羟基-9, 11-麦角酸-3-脱氧-维生素D3)的相对含量的作用。
| [1] |
Li W, Li JX, Li JP, Lyu BL, Zhang YL. Pollution characteristics of antibiotics in different environment media in China: a review[J]. Journal of Nanjing Forestry University (Natural Science Edition), 2020, 44(1): 205-214. (in Chinese) 李威, 李佳熙, 李吉平, 吕宝玲, 张银龙. 我国不同环境介质中的抗生素污染特征研究进展[J]. 南京林业大学学报: 自然科学版, 2020, 44(1): 205-214. |
| [2] |
Li X, Zeng J, Wang D, Xue YX, Zhao XL. Recent advances in the mechanism of bacterial resistance and tolerance[J]. Chinese Journal of Antibiotics, 2020, 45(2): 113-121. (in Chinese) 李昕, 曾洁, 王岱, 薛云新, 赵西林. 细菌耐药耐受性机制的最新研究进展[J]. 中国抗生素杂志, 2020, 45(2): 113-121. DOI:10.3969/j.issn.1001-8689.2020.02.003 |
| [3] |
Kozyrskyj AL, Tun HM, Bridgman SL. The gut microbiome and control of weight gain[A]//Freemark MS. Pediatric Obesity[M]. Cham: Humana Press, 2018: 63-78
|
| [4] |
Bottacini F, Van Sinderen D, Ventura M. Omics of bifidobacteria: research and insights into their health-promoting activities[J]. Biochemical Journal, 2017, 474(24): 4137-4152. DOI:10.1042/BCJ20160756 |
| [5] |
Verni M, Wang CY, Montemurro M, De Angelis M, Katina K, Rizzello CG, Coda R. Exploring the microbiota of faba bean: functional characterization of lactic acid bacteria[J]. Frontiers in Microbiology, 2017, 8: 2461. DOI:10.3389/fmicb.2017.02461 |
| [6] |
Paganini D, Uyoga MA, Cercamondi CI, Moretti D, Mwasi E, Schwab C, Bechtler S, Mutuku FM, Galetti V, Lacroix C, et al. Consumption of galacto-oligosaccharides increases iron absorption from a micronutrient powder containing ferrous fumarate and sodium iron EDTA: a stable-isotope study in Kenyan infants[J]. The American Journal of Clinical Nutrition, 2017, 106(4): 1020-1031. DOI:10.3945/ajcn.116.145060 |
| [7] |
Wang ZX, Shao YY. Effects of microbial diversity on nitrite concentration in pao cai, a naturally fermented cabbage product from China[J]. Food Microbiology, 2018, 72: 185-192. DOI:10.1016/j.fm.2017.12.003 |
| [8] |
Wang Y, Sun J, Zhong H, Li NZ, Xu HY, Zhu Q, Liu YP. Effect of probiotics on the meat flavour and gut microbiota of chicken[J]. Scientific Reports, 2017, 7: 6400. DOI:10.1038/s41598-017-06677-z |
| [9] |
Ministry of Agriculture of the PRC. NY/T 65-2004 Feeding standard of swine[S]. Beijing: China Agriculture Press, 2004(in Chinese) 中华人民共和国农业部. NY/T 65-2004猪饲养标准[S]. 北京: 中国农业出版社, 2004 |
| [10] |
Li XQ, Cui Y, Hao LK, Yang JJ, Gao M, Hu HL, Liu DC. Effects of compound bacteria culture on performance, immune function and antioxidant capacity of sows[J]. Chinese Journal of Animal Nutrition, 2019, 31(11): 5345-5353. (in Chinese) 李薛强, 崔莹, 郝凌魁, 杨晶晶, 高民, 胡红莲, 刘大程. 复合菌培养物对母猪生产性能、免疫功能及抗氧化能力的影响[J]. 动物营养学报, 2019, 31(11): 5345-5353. |
| [11] |
Robertson RC, Manges AR, Finlay BB, Prendergast AJ. The human microbiome and child growth-first 1000 days and beyond[J]. Trends in Microbiology, 2019, 27(2): 131-147. DOI:10.1016/j.tim.2018.09.008 |
| [12] |
Kiros TG, Derakhshani H, Pinloche E, D'Inca R, Marshall J, Auclair E, Khafipour E, Van Kessel A. Effect of live yeast Saccharomyces cerevisiae (Actisaf Sc47) supplementation on the performance and hindgut microbiota composition of weanling pigs[J]. Scientific Reports, 2018, 8(1): 5315. DOI:10.1038/s41598-018-23373-8 |
| [13] |
Blanton LV, Charbonneau MR, Salih T, Barratt MJ, Venkatesh S, Ilkaveya O, Subramanian S, Manary MJ, Trehan I, Jorgensen JM, et al. Gut bacteria that prevent growth impairments transmitted by microbiota from malnourished children[J]. Science, 2016, 351(6275): aad3311. DOI:10.1126/science.aad3311 |
| [14] |
Sakanaka M, Hansen ME, Gotoh A, Katoh T, Yoshida K, Odamaki T, Yachi H, Sugiyama Y, Kurihara S, Hirose J, et al. Evolutionary adaptation in fucosyllactose uptake systems supports bifidobacteria-infant symbiosis[J]. Science Advances, 2019, 5(8): eaaw7696. DOI:10.1126/sciadv.aaw7696 |
| [15] |
Martino ME, Joncour P, Leenay R, Gervais H, Shah M, Hughes S, Gillet B, Beisel C, Leulier F. Bacterial adaptation to the host's diet is a key evolutionary force shaping Drosophila-lactobacillus symbiosis[J]. Cell Host & Microbe, 2018, 24(1): 109-119. |
| [16] |
Du Toit A. Restoring healthy growth in infants[J]. Nature Reviews Microbiology, 2016, 14(4): 191. DOI:10.1038/nrmicro.2016.31 |
| [17] |
Cani PD, Van Hul M, Lefort C, Depommier C, Rastelli M, Everard A. Microbial regulation of organismal energy homeostasis[J]. Nature Metabolism, 2019, 1(1): 34-46. DOI:10.1038/s42255-018-0017-4 |
| [18] |
Ahmed N, Tcheng M, Roma A, Buraczynski M, Jayanth P, Rea K, Akhtar TA, Spagnuolo PA. Avocatin B protects against lipotoxicity and improves insulin sensitivity in diet-induced obesity[J]. Molecular Nutrition & Food Research, 2019, 63(24): 1900688. |
| [19] |
Subramanian S, Blanton LV, Frese SA, Charbonneau M, Mills DA, Gordon JI. Cultivating healthy growth and nutrition through the gut microbiota[J]. Cell, 2015, 161(1): 36-48. DOI:10.1016/j.cell.2015.03.013 |
| [20] |
Ren GX, Zhang JP, Li MH, Tang ZC, Yang ZN, Cheng GY, Wang JQ. Gut microbiota composition influences outcomes of skeletal muscle nutritional intervention via blended protein supplementation in posttransplant patients with hematological malignancies[J]. Clinical Nutrition, 2021, 40(1): 94-102. DOI:10.1016/j.clnu.2020.04.030 |
| [21] |
Nakayama J, Zhang HP, Lee YK. Asian gut microbiome[J]. Science Bulletin, 2017, 62(12): 816-817. DOI:10.1016/j.scib.2017.04.001 |
| [22] |
Raimondi MT, Albani D, Giordano C. An organ-on-a-chip engineered platform to study the microbiota-gut-brain axis in neurodegeneration[J]. Trends in Molecular Medicine, 2019, 25(9): 737-740. DOI:10.1016/j.molmed.2019.07.006 |
| [23] |
Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 |
| [24] |
Zhu JQ, Kong Y, Yu J, Shao S, Mao MF, Zhao MR, Yue SQ. Consumption of drinking water N-Nitrosamines mixture alters gut microbiome and increases the obesity risk in young male rats[J]. Environmental Pollution, 2019, 248: 388-396. DOI:10.1016/j.envpol.2019.02.012 |
| [25] |
Goffredo M, Mass K, Parks EJ, Wagner DA, McClure EA, Graf J, Savoye M, Pierpont B, Cline G, Santoro N. Role of gut microbiota and short chain fatty acids in modulating energy harvest and fat partitioning in youth[J]. The Journal of Clinical Endocrinology and Metabolism, 2016, 101(11): 4367-4376. DOI:10.1210/jc.2016-1797 |
| [26] |
Lee NY, Yoon SJ, Han DH, Gupta H, Youn GS, Shin MJ, Ham YL, Kwak MJ, Kim BY, Yu JS, et al. Lactobacillus and Pediococcus ameliorate progression of non-alcoholic fatty liver disease through modulation of the gut microbiome[J]. Gut Microbes, 2020, 11(4): 882-899. DOI:10.1080/19490976.2020.1712984 |
| [27] |
Chen TL, You YJ, Xie GX, Zheng XJ, Zhao AH, Liu JJ, Zhao Q, Wang SL, Huang FJ, Rajani C, et al. Strategy for an association study of the intestinal microbiome and brain metabolome across the lifespan of rats[J]. Analytical Chemistry, 2018, 90(4): 2475-2483. DOI:10.1021/acs.analchem.7b02859 |
| [28] |
Yan HL. Regulation of porcine skeletal muscle-phenotypes and metabolism by gut microbiota and its interaction with nutrition[D]. Yaan: Doctoral Dissertation of Sichuan Agricultural University, 2018(in Chinese) 严鸿林. 肠道微生物及其与营养互作对猪骨骼肌表型及代谢的调控[D]. 雅安: 四川农业大学博士学位论文, 2018 |
| [29] |
Zheng B, Wang TT, Wang HW, Chen L, Zhou ZK. Studies on nutritional intervention of rice starch-oleic acid complex (resistant starch type V) in rats fed by high-fat diet[J]. Carbohydrate Polymers, 2020, 246: 116637. DOI:10.1016/j.carbpol.2020.116637 |
| [30] |
Pallister T, Jackson MA, Martin TC, Glastonbury CA, Jennings A, Beaumont M, Mohney RP, Small KS, MacGregor A, Steves CJ, et al. Untangling the relationship between diet and visceral fat mass through blood metabolomics and gut microbiome profiling[J]. International Journal of Obesity, 2017, 41(7): 1106-1113. DOI:10.1038/ijo.2017.70 |
| [31] |
Zhu J, Kuang YH, Chen JF, Qu XY, He CQ, Guo SC, Jin LKH, Zhou XB. Effects of Bacillus subtilis on growth performance, meat quality and antioxidant capacity of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2019, 31(6): 2572-2578. (in Chinese) 朱瑾, 匡佑华, 陈继发, 曲湘勇, 贺长青, 郭松长, 今林宽和, 周学彬. 枯草芽孢杆菌对肥育猪生长性能、肉品质和抗氧化能力的影响[J]. 动物营养学报, 2019, 31(6): 2572-2578. |
| [32] |
Zheng WY, Yang T, Li SQ, Lv CX, Shi M, Ma LB, Yan XH. Novel Saccharomyces cerevisiae culture: effects on performance, muscle quality and intestinal microorganisms of fattening pig[J]. Chinese Agricultural Science Bulletin, 2020, 36(21): 145-154. (in Chinese) 郑文涌, 杨涛, 李双全, 吕常旭, 石敏, 马立保, 晏向华. 新型酿酒酵母培养物对育肥猪生产性能、肌肉品质和肠道微生物的影响[J]. 中国农学通报, 2020, 36(21): 145-154. |
| [33] |
Gu SL, Chen YF, Wu ZJ, Chen YB, Gao HN, Lv LX, Guo FF, Zhang XW, Luo R, Huang CJ, et al. Alterations of the gut microbiota in patients with COVID-19 or H1N1 influenza[J]. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, 2020, 71(10): 2669-2678. DOI:10.1093/cid/ciaa709 |
| [34] |
Li J, Xu HY, Sun ZH, Hou QC, Kwok LY, Laga WR, Wang YJ, Ma HM, Yu ZJ, Menghe B, et al. Effect of dietary interventions on the intestinal microbiota of Mongolian hosts[J]. Science Bulletin, 2016, 61(20): 1605-1614. DOI:10.1007/s11434-016-1173-0 |
| [35] |
Liu FX. Epidemic characteristics and clinical symptoms of Streptococcus suis disease[J]. Animals Breeding and Feed, 2020(6): 78-79. (in Chinese) 刘福祥. 猪链球菌病的流行特点与临床症状[J]. 养殖与饲料, 2020(6): 78-79. DOI:10.3969/j.issn.1671-427X.2020.06.033 |
| [36] |
Wang JY, Liu BB, Zhang GC, Li JP, Mao CL, Fan QY, Wang Y. Sub-MIC of doxycycline or gentamicin affect S. suis biofilm formation and virulence factors expression[J]. Chinese Journal of Preventive Veterinary Medicine, 2020, 42(5): 494-499. (in Chinese) 王嘉怡, 刘宝宝, 张港琛, 李金朋, 毛晨龙, 樊擎莹, 汪洋. 亚抑菌浓度强力霉素或庆大霉素影响猪链球菌生物被膜形成和毒力因子表达的研究[J]. 中国预防兽医学报, 2020, 42(5): 494-499. |
| [37] |
Birchenough G, Hansson GC. Bacteria tell us how to protect our intestine[J]. Cell Host & Microbe, 2017, 22(1): 3-4. |
| [38] |
Wlodarska M, Luo CW, Kolde R, D'Hennezel E, Annand JW, Heim CE, Krastel P, Schmitt EK, Omar AS, Creasey EA, et al. Indoleacrylic acid produced by commensal Peptostreptococcus species suppresses inflammation[J]. Cell Host & Microbe, 2017, 22(1): 25-37. |
| [39] |
Zheng CK. Contribution of the Spx regulators and NADH oxidase to the pathogenicity of Streptococcus suis serotype 2[D]. Wuhan: Doctoral Dissertation of Huazhong Agricultural University, 2017(in Chinese) 郑成坤. 猪链球菌2型Spx调节因子和NADH氧化酶的致病性研究[D]. 武汉: 华中农业大学博士学位论文, 2017 |
| [40] |
Bajaj JS, Vargas HE, Reddy KR, Lai JC, O'Leary JG, Tandon P, Wong F, Mitrani R, White MB, Kelly M, et al. Association between intestinal microbiota collected at hospital admission and outcomes of patients with cirrhosis[J]. Clinical Gastroenterology and Hepatology, 2019, 17(4): 756-765. DOI:10.1016/j.cgh.2018.07.022 |
| [41] |
Zuo T, Liu Q, Zhang F, Lui GCY, Tso EY, Yeoh YK, Chen ZG, Boon SS, Chan FK, Chan PK, et al. Depicting SARS-CoV-2 faecal viral activity in association with gut microbiota composition in patients with COVID-19[J]. Gut, 2021, 70(2): 276-284. |
| [42] |
Vonaesch P, Morien E, Andrianonimiadana L, Sanke H, Mbecko JR, Huus KE, Naharimanananirina T, Gondje BP, Nigatoloum SN, Vondo SS, et al. Stunted childhood growth is associated with decompartmentalization of the gastrointestinal tract and overgrowth of oropharyngeal taxa[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(36): E8489-E8498. DOI:10.1073/pnas.1806573115 |
| [43] |
Ternes D, Karta J, Tsenkova M, Wilmes P, Haan S, Letellier E. Microbiome in colorectal cancer: how to get from meta-omics to mechanism?[J]. Trends in Microbiology, 2020, 28(5): 401-423. DOI:10.1016/j.tim.2020.01.001 |
| [44] |
Haak BW, Lankelma JM, Hugenholtz F, Belzer C, De Vos WM, Wiersinga WJ. Long-term impact of oral vancomycin, ciprofloxacin and metronidazole on the gut microbiota in healthy humans[J]. Journal of Antimicrobial Chemotherapy, 2019, 74(3): 782-786. DOI:10.1093/jac/dky471 |
| [45] |
Fehr K, Moossavi S, Sbihi H, Boutin RCT, Bode L, Robertson B, Yonemitsu C, Field CJ, Becker AB, Mandhane PJ, et al. Breastmilk feeding practices are associated with the co-occurrence of bacteria in mothers' milk and the infant gut: the CHILD cohort study[J]. Cell Host & Microbe, 2020, 28(2): 285-297. |
| [46] |
Chiumento S, Roblin C, Kieffer-Jaquinod S, Tachon S, Leprètre C, Basset C, Aditiyarini D, Olleik H, Nicoletti C, Bornet O, et al. Ruminococcin C, a promising antibiotic produced by a human gut symbiont[J]. Science Advances, 2019, 5(9): eaaw9969. DOI:10.1126/sciadv.aaw9969 |
| [47] |
Martin-Gallausiaux C, Larraufie P, Jarry A, Béguet-Crespel F, Marinelli L, Ledue F, Reimann F, Blottière HM, Lapaque N. Butyrate produced by commensal bacteria down-regulates Indolamine 2, 3-dioxygenase 1(IDO-1) expression via a dual mechanism in human intestinal epithelial cells[J]. Frontiers in Immunology, 2018, 9: 2838. DOI:10.3389/fimmu.2018.02838 |
| [48] |
Martel J, Ojcius DM, Ko YF, Ke PY, Wu CY, Peng HH, Young JD. Hormetic effects of phytochemicals on health and longevity[J]. Trends in Endocrinology & Metabolism, 2019, 30(6): 335-346. |
 2021, Vol. 48
2021, Vol. 48




