扩展功能
文章信息
- 王亚娇, 栗秋生, 纪莉景, 肖颖, 孔令晓
- WANG Yajiao, LI Qiusheng, JI Lijing, XIAO Ying, KONG Lingxiao
- 一株西瓜枯萎病生防菌的鉴定与田间防效
- Identification and field control effect of an antagonistic bacterium against watermelon Fusarium wilt
- 微生物学通报, 2021, 48(6): 1976-1984
- Microbiology China, 2021, 48(6): 1976-1984
- DOI: 10.13344/j.microbiol.china.200912
-
文章历史
- 收稿日期: 2020-09-13
- 接受日期: 2020-10-19
- 网络首发日期: 2020-12-24
西瓜枯萎病(Watermelon Fusarium wilt)是西瓜的最主要病害之一,其病原菌为尖孢镰孢西瓜专化型(Fusarium oxysporum f. sp. niveum),经根毛或根部伤口侵入,在维管束导管内繁殖并扩散,产生毒素破坏细胞,堵塞导管影响水分的运输,从而导致植株萎蔫,对西瓜生产造成严重损失,已成为限制西瓜生产的主要因素之一[1]。近年来,由于单一种植模式土壤带菌的逐年累积和传统化学防治效果受到抗药性的削弱,使得西瓜枯萎病的防治效果越来越困难,发病严重年份可高达80%以上,甚至绝收[2]。
目前西瓜枯萎病的主要防治方法有抗病育种、嫁接、土壤消毒、化学防治和生物防治等[3],但是由于抗病育种所需要的时间比较长,西瓜枯萎病病菌分化类型较多,进行多位点抗性育种的难度较大[4]。20世纪80年代日本选育出抗尖孢镰孢南瓜专化型的南瓜品种‘Ren-shi’作为砧木能够有效地防治西瓜枯萎病,但嫁接的人工成本高,而且砧木会影响西瓜品质[5];土壤熏蒸能够有效地杀死土壤中的病原菌,但是对人畜毒性高,容易破坏土壤的微生态环境;目前常用的化学药剂有多菌灵、咪鲜胺、恶霉灵等具有见效快、防效高的优点,但也存在对环境污染大、易产生抗性、对人畜不安全等缺点[6];生物防治是筛选拮抗微生物并利用拮抗微生物抑制病原菌的增殖,从而达到防治的目的。生物农药具有药效明显、污染程度低等优点,符合可持续农业的发展要求,是该病害防治的方向[7-8]。孙洪宝等研究发现,链霉菌A02在温室盆栽条件下对西瓜枯萎病防治效果可达68.23%,同时其可通过提高净光合速率和植物内源激素含量,提高西瓜对枯萎病的抗性[9];李丹等筛选了2株解淀粉芽胞杆菌TR2和CE,它们在水培管培条件下对西瓜枯萎病的生防效果最高分别可达60%和63.6%[10];张丽荣等筛选到了一株对西瓜枯萎病菌具有抑制作用的木霉菌,其抑菌率可达83.29%,其产生的挥发性和非挥发性代谢物对病原菌的抑菌率分别为59.83%和90.60%[11]。虽然目前已经筛选到了一些西瓜枯萎病的生防菌,但是这些生防菌在田间的防效研究较少,而且防效稳定性较差,因此需要筛选出防效更好、更稳定的生防菌株,为西瓜枯萎病的生物防治打下基础。
本研究通过平板对峙和温室生测实验从西瓜田间根围土壤样品中分离生防菌,通过形态学及分子生物学手段进行鉴定,并检测其拮抗因子,以期为西瓜枯萎病的生物防治提供菌种资源和理论依据。
1 材料与方法 1.1 供试材料西瓜枯萎病病原菌尖孢镰孢西瓜专化型Fusarium oxysporum f. sp. niveum F0-7由本实验室保存。根围土壤采自河北、河南、山东、福建等地的西瓜田中。“Z”字取样,西瓜植株连根拔起,抖掉携带的大块土,用无菌毛刷刷下根围的土装入密封袋,冰上运回实验室,4 ℃保存。西瓜种子为京域二号,与当地农资市场购买。
培养基:NA培养基,PDA培养基,LB培养基。培养基配制见参考文献[10]。
基因组DNA提取试剂盒、2×Taq PCR Master Mix聚合酶,天根生化科技(北京)有限公司;80%多菌灵可湿性粉剂,山东海尔三利生物化工有限公司。PCR仪,Applied Biosystems公司;电泳仪、凝胶成像系统,Bio-Rad公司;恒温培养箱,上海博讯生物有限公司;显微镜,奥林巴斯公司。
1.2 生防菌的筛选 1.2.1 生防菌的分离和纯化采集河北、河南、山东和福建等地田间西瓜枯萎病株根围土壤,称取10 g土壤样品与100 mL无菌水混合,置于磁力搅拌器上,振荡24 h,静止15 min,作为10-1的土壤悬浮液,并以10-3、10-4和10-5稀释上清液;然后各取100 µL上清液涂布于NA培养基平板上,28 ℃恒温培养1-2 d,挑取不同形态的细菌菌落划线纯化,-20 ℃冰箱保存。
1.2.2 拮抗细菌的室内初步筛选以尖孢镰孢西瓜专化型作为指示菌株,采用平板对峙法,对纯化保存分离菌株的拮抗能力进行测定。将活化后的西瓜枯萎病病原菌打成6 mm菌饼置于PDA培养基的中央,在与指示菌饼相隔4 cm的圆周上等距离点接4次拮抗菌,3次重复,25 ℃下培养,5 d后测量抑菌带的宽度[9]。
1.2.3 西瓜枯萎病的盆栽防效试验将分离的生防菌分别用LB培养基进行扩繁,并稀释为109 CFU/mL的菌悬液,用于后续盆栽防效试验。
盆栽防效试验于河北农林科学院植物保护研究所温室中进行,温度控制在28-35 ℃,自然光照。将西瓜种子用75%的酒精表面消毒5 min,无菌水清洗3次。将种子种于盛有拌菌土的一次性塑料杯中(底土110 g/杯,含西瓜枯萎病菌孢子悬浮液5×105个孢子/g的中层菌土45 g/杯,表层覆土35 g/杯),5颗/杯,生防菌采用灌根处理,每杯灌入30 mL稀释10倍的生防菌液,每个处理5个重复,并以清水处理为对照。待对照发病后调查西瓜出苗率、株高及病株率,并计算生防菌的防治效果。防治效果(%)=(对照病株率-处理病株率)/对照病株率×100。
1.3 生防菌的鉴定 1.3.1 形态学鉴定将生防菌活化后分别接种于NA斜面、NA平板及NB培养液中,于28 ℃下培养3 d后观察培养性状,同时利用革兰氏染色法确定该菌的细胞壁类型[12]。
1.3.2 分子学鉴定釆用传统的CTAB法提取生防菌的基因组DNA,利用gyrB的特异性引物gyrB F (5′-GAAG TCATCATGACCGTTCTGCATGCCGGTGGAAAGTTCG-3′)和gyrB R (5′-GCAGGGTACGGATGTGC GAGCCATCTACGTCAGCGTCAGTCAT-3′)进行PCR扩增。PCR反应体系(50 µL):模板DNA 2 µL,上、下游引物(10 μmol/L)各2 µL,2×PCR Master Mix 25 µL,无菌水19 µL。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 10 min[12]。PCR产物经1.5%琼脂糖凝胶电泳检测,送生工生物工程(上海)股份有限公司进行测序。将菌株序列在NCBI网站上进行同源性比较,调取其中与之相似性较高的序列,利用软件ClustalW进行多重匹配排列分析,并构建UPGMA树(Unweighted Pair-Group Method with Arithmetic Means)分析进化关系。
1.4 生防菌拮抗因子胞外水解酶活力测定测定与拮抗作用相关的4种胞外水解酶——几丁质酶[13]、纤维素酶[14]、β-1, 3-葡聚糖酶和蛋白酶[15]的活性。取浓度为109 CFU/mL的生防菌菌液2 µL接种于4种选择性培养基平板,28 ℃恒温培养5 d,检测胞外酶活性。
1.5 生防菌发酵滤液对西瓜枯萎病菌的抑制作用向50 ℃左右的PDA培养基中加入生防菌的发酵滤液,制成含滤液浓度为20%、10%和5%的PDA平板,以不加发酵滤液(0%)的PDA为对照,将直径为6 mm西瓜枯萎病病原菌菌饼分别接种于上述制备的PDA平板正中央,25 ℃静置恒温培养5 d,观察并记录其菌落直径和菌丝形态。
1.6 生防菌对西瓜枯萎病的田间防治效果将筛选的生防菌分别用LB培养基进行扩繁,制成浓度为109 CFU/mL的生防制剂。生防菌的田间防治试验于2019年3-7月份在河北省保定市清苑县西瓜枯萎病常发地块及河北省农林科学院植物保护研究所的试验田中进行。伸蔓期采用根部喷雾的方法喷施生防菌制剂,以清水处理为空白对照,以80%多菌灵喷雾(2 000×)处理为化学药剂对照,同时检测了生防制剂与多菌灵混施的防效。待对照发病后调查枯萎病的病株率及病级,计算生防菌的防治效果。
西瓜幼苗期枯萎病分级标准:0级为茎内维管束正常,外部无症状;1级为茎内维管束25%以下变色;3级为茎内维管束25%-50%变色;5级为茎内维管束51%-75%变色;7级为茎内维管束75%以上变色,部分叶片萎蔫;9级为整株枯死[16]。病情指数=∑(各级病株数×该病级值)/(调查总株数×最高级值)×100;相对防效(%)=(对照组病情指数-处理组病情指数)/对照组病情指数×100。
2 结果与分析 2.1 生防菌的筛选 2.1.1 生防菌的初筛对采集的土壤样品中的细菌进行分离和纯化,共得到196株拮抗细菌。室内平板拮抗实验结果显示,对指示菌株尖孢镰孢F0-7具有一定抑制作用的菌株共有120株。其中抑菌带在1-2 mm的菌株为2株,抑菌带为2-4 mm的菌株共58株,抑菌带为4-6 mm的菌株共49株,抑菌带为6-8 mm的菌株共8株,抑菌带为8-10 mm的菌株共3株。
2.1.2 温室生物学测定复筛选取抑菌带大于4 mm的60个拮抗菌进行温室盆栽防治试验。通过综合考虑它们对西瓜出苗率、平均株高和对西瓜枯萎病的抑制率等因素,最终筛选出10株细菌。10株细菌处理后能使西瓜植株出苗齐整、植株生长健壮,同时又能够有效抑制西瓜枯萎病害的发生。实验结果见表 1,其中,菌株SFJ11的综合表现最好,其抑菌半径为8 mm;出苗率为95%,比对照增加18.75%;平均株高为9.17 cm,比对照增加8.33%;对西瓜枯萎病的防治效果为67.86%。同时从表 1可以看出,生防菌的防治效果和抑菌半径并不成正相关性。
| 菌株 Strains |
抑菌半径 Inhibition zone (mm) |
防效 Control effect (%) |
出苗率 Emergence (%) |
平均株高 Height (cm) |
| SFJ11 | 8.00±0.01 | 67.86a | 95.0ab | 9.17e |
| SFJ17 | 5.00±0.01 | 50.00b | 93.7ab | 8.43g |
| SFJ16 | 4.00±0.01 | 48.57c | 95.0ab | 12.00a |
| SFJ12 | 5.00±0.01 | 45.87c | 90.0ab | 10.40b |
| SFJ13 | 4.00±0.01 | 35.72d | 95.0ab | 10.25c |
| SFJ18 | 8.00±0.01 | 29.29e | 100.0b | 8.70f |
| SFJ1 | 6.00±0.01 | 27.78e | 95.0ab | 9.25e |
| SFJ3 | 8.00±0.01 | 27.78e | 95.0ab | 8.67f |
| SFJ15 | 4.00±0.01 | 25.57f | 90.0ab | 9.68d |
| SFJ30 | 7.00±0.01 | 22.86g | 95.0ab | 9.20e |
| CK | 80.0a | 8.45g | ||
| 注:同列数据后的不同小写字母表示差异显著(P < 0.05)。下同 Note: The different letter means significant difference (P < 0.05). The same below |
||||
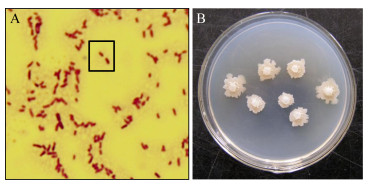
菌株SFJ11经革兰氏染色验证为阳性菌。芽孢形态椭圆至柱状,位于菌体中部(图 1A)。NA平板培养时,初期菌落乳白色,略呈圆形,边缘不齐整,表面湿润,有较大褶皱;中期菌落凸起,脓状;后期淡黄色,边缘不齐整,表面干燥,有大褶皱(图 1B)。
|
| 图 1 生防菌SFJ11的形态 Figure 1 Morphology of biocontrol agent SFJ11 注:A:革兰氏染色;B:单菌落 Note: A: Gram stain; B: Single colony |
|
|
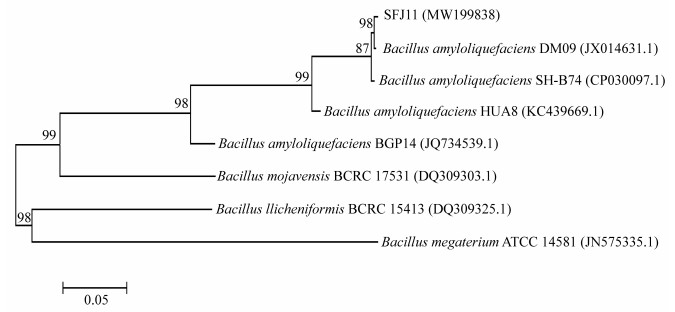
提取生防菌株SFJ11的基因组DNA,经gyrB特异性引物扩增获取目的片段,将该序列提交GenBank,获得登录号为MW199838。在NCBI网站用BLAST进行同源检测,发现与其亲缘关系相近的菌为解淀粉芽胞杆菌。从菌株SFJ11和参考菌株的系统发育(图 2)上分析,也可以看出SFJ11和解淀粉芽胞杆菌构成一个分支。因此,综合形态学和分子生物学鉴定结果,可以判断菌株SFJ11为解淀粉芽胞杆菌。
|
| 图 2 菌株SFJ11的gyrB基因系统发育树 Figure 2 Phylogenetic tree of strain SFJ11 gyrB gene 注:括号内的数字为GenBank登录号;进化树节点的数值表示Bootstrap值;比例尺为5%的序列差异 Note: Number in parenthesis represented GenBank accession number; Number at notes present bootstrap percentages (based on 1 000 sampling); Bar 0.05 represents sequence divergence |
|
|
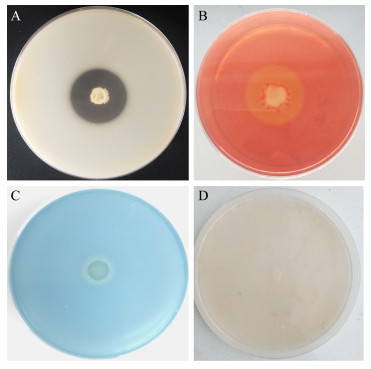
通过选择性培养基检测了生防菌胞外酶的活性,胞外酶活性与培养基上产生的透明圈大小呈正相关。检测结果显示(图 3),生防菌SFJ11在蛋白酶和纤维素酶选择性培养基上能够产生较大的降解圈(图 3A,3B),在β-1, 3-葡聚糖酶选择培养基上产生较小的降解圈(图 3C),在几丁质选择性培养基上则不能产生降解圈(图 3D),说明SFJ11能产生活性较高的蛋白酶和纤维素酶,产生活性较低的β-1, 3-葡聚糖酶,不能产生几丁质酶。
|
| 图 3 生防菌SFJ11拮抗因子的检测 Figure 3 Detection of antagonistic factors of strain SFJ11 注:A:蛋白酶;B:纤维素酶;C:β-1, 3-葡聚糖酶;D:几丁质酶 Note: A: Protease; B: Cellulase; C: β-1, 3-glucanase; D: Chitinase |
|
|
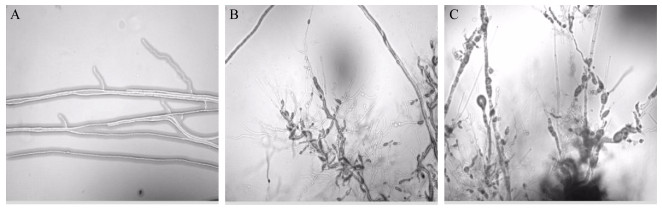
实验结果(表 2)显示:SFJ11的发酵上清液对西瓜枯萎病菌的抑制作用较强,而且随着浓度的增大抑制作用也逐渐变强;浓度为5%和10%时抑制率分别为62.61%和88.15%,浓度为20%时的抑制率可达到90%以上。同时,在400×倍显微镜下观察各浓度上清液对菌丝形态的影响发现(图 4):SFJ11上清液各个浓度下均能使菌丝发生弯曲变形、末端消解或不规则膨大,不能产生正常分枝;从5%浓度开始菌丝末端产生消解和膨大现象,浓度为10%时消解和膨大的现象更为严重,浓度为20%时几乎完全抑制菌丝生长。
| SFJ11滤液浓度 Concentration of SFJ11 filtrate (%) |
菌落直径 Colony diameter (cm) |
生长抑制率 Growth inhibition ratio (%) |
| 0 (CK) | 5.48±0.41a | |
| 5 | 2.05±0.13b | 62.61c |
| 10 | 0.65±0.06c | 88.15b |
| 20 | 0.25±0.06d | 95.44a |
|
| 图 4 生防菌SFJ11发酵滤液对菌丝生长的抑制作用 Figure 4 Inhibitory effect of SFJ11 fermentation filtrate on the growth of mycelia 注:A:对照;B:滤液浓度5%;C:滤液浓度10% Note: A: Control; B: 5% filtrate concentration; C: 10% filtrate concentration |
|
|
检测分离到的生防菌SFJ11在田间对西瓜枯萎病的防治作用,结果(表 3)表明生防菌SFJ11对西瓜枯萎病有显著的防治作用,喷施第25天时防效为77.51%,化学对照药剂80%多菌灵的防治效果为72.07%,两者无显著性差异;喷施第45天时防效降低为55.45%,但仍然略高于多菌灵的防效;当生防菌SFJ11与多菌灵混施时第25天的防效为100%,第45天的防效为91.7%,显著高于生防菌及多菌灵药剂的防效,而且防效比较稳定。
| 处理 Treatment |
25 d | 45 d | |||
| 病情指数 Disease index | 防效 Control effect (%) | 病情指数 Disease index | 防效 Control effect (%) | ||
| SFJ11 | 10.62±1.41b | 77.51b | 15.95±5.41b | 55.45b | |
| 多菌灵 Carbendazim | 13.19±2.11b | 72.07b | 23.93±3.75b | 41.00b | |
| SFJ11+多菌灵 SFJ11+Carbendazim |
0c | 100a | 4.37±1.67c | 91.70a | |
| CK | 47.22±4.65a | 52.65±6.55a | |||
目前室内生防菌筛选通常将较为直观的平板拮抗实验结果作为初步筛选的依据,即选取能够产生较大抑菌圈的菌株用于进一步的温室生物学测定、次生代谢产物的测定等研究。这种方法看似合理,实则在逻辑上已经将产生拮抗圈的大小与菌株的防治能力等同,也就将拮抗作用的本质单一地认定为是拮抗菌株与病原菌二者之间的相互作用,从而忽视了生防菌-病原菌-寄主植物三者之间的微妙的动态互作关系。比如,生防菌对寄主植物的促生作用诱导寄主系统抗性[17],改变土壤微生物环境等[18]。因此,平皿对峙及温室生物学测定实验因为兼顾到上述三者的相互作用,从而能更准确地检验拮抗菌的拮抗能力。本文是通过检测产生不同拮抗圈的菌株在温室生物学测定实验中的出苗率、抑菌率和植株株高3个指标,证实了上述结论,即拮抗菌的平板拮抗能力不能简单等同于该菌的生防能力,而温室生物学测定实验中的表现更能体现拮抗菌株通过寄主植物的促生或直接作用于病原菌对病原菌产生的抑制作用。
解淀粉芽孢杆菌被广泛应用于瓜果蔬菜病害的生物防治,如草莓炭疽病和根腐病[19]、枣黑斑病[20]、马铃薯茄镰孢菌干腐病[21]和西瓜枯萎病[10]等。生防菌在施用过程中时常受到温度、湿度、土壤pH值等外界因素的影响,因此防治效果不稳定。如解淀粉芽孢杆菌CE对西瓜枯萎病的防效随着时间的延长而逐渐降低,第3、7、15天的防效分别为63.6%、17.7%和20%。本研究筛选的生防菌SFJ11施用的第25天对西瓜枯萎病的防效为77.51%,防效高于生防菌CE,虽然第45天时防效下降至55.45%,但仍略高于化学药剂多菌灵的防效,同时我们研究发现,当生防菌与多菌灵混施时对西瓜枯萎病具有更高及更稳定的防治效果。因此针对单一生防菌防效不稳定问题,可以采用多种生防菌混施或生防菌与其他药剂混施的方法提高防效及稳定性。
已有研究表明,生防菌解淀粉芽孢杆菌可以定殖在土壤、植物根际、体表或体内,通过促进植物生长激发植物产生诱导系统抗性,与病原菌竞争营养和侵染空间位点,分泌抗菌物质抑制病原菌的生长和扩展,从而抵御病原菌侵染[22]。本研究筛选的生防菌SFJ11能够促进西瓜的出苗率及株高,分析其原因可能为施用该菌后改善了土壤的微生物生态环境,从而改良了植物的生长环境,或该菌在繁殖过程中产生生长素、细胞分裂素、赤霉素等物质[19]。本研究同时发现生防菌SFJ11能使菌丝发生弯曲变型、末端消解或不规则膨大,这可能与其分泌蛋白酶、纤维素酶和几丁质酶相关[23]。细胞壁10%的组成成分为蛋白质及糖蛋白构成,蛋白质包括负责细胞壁生长的酶、特定胞外酶和将多糖交联起来的结构蛋白。研究表明,当蛋白酶的浓度为5 µg/mL时可使真菌的细胞壁降解,菌丝变形[24];β-1, 3/1, 6-葡聚糖是真菌细胞壁的重要组成部分,能够被β-1, 3葡聚糖酶所降解,从而抑制菌丝的生长[25]。纤维素酶是多数生防菌株的重要拮抗因子,研究表明纤维素酶在生防菌Trichoderma viride抑制Pythium aphanidermatum菌丝生长中发挥重要作用[26]。
综上,研究表明解淀粉芽孢杆菌对西瓜枯萎病具有明显的防治效果,具有一定生防潜能。后期可进一步对菌株的发酵条件进行优化并分离鉴定抑菌活性产物,同时筛选合适的剂型,增加其稳定性及货架期,为西瓜枯萎病的防治奠定一定的研究基础。
| [1] |
Miller NF, Standish JR, Quesada-Ocampo LM. Sensitivity of Fusarium oxysporum f. sp. niveum to prothioconazole and pydiflumetofen in vitro and efficacy for Fusarium wilt management in watermelon[J]. Plant Health Progress, 2020, 21(1): 13-18. DOI:10.1094/PHP-08-19-0056-RS |
| [2] |
Wang CX, Ji LJ, Li QS, Li CC, Kong LX. Study on screening of fungicide and control effect of Fusarium wilt in watermelon[J]. Northern Horticulture, 2013(13): 154-157. (in Chinese) 王翠霞, 纪莉景, 栗秋生, 李聪聪, 孔令晓. 西瓜枯萎病药剂筛选及其防效研究[J]. 北方园艺, 2013(13): 154-157. |
| [3] |
Zhang ZZ, Lv LX, Huang BQ, Lin YZ. Research progress on the controlling technique of watermelon Fusarium wilt[J]. China Vegetables, 2005(7): 38-40. (in Chinese) 张志忠, 吕柳新, 黄碧琦, 林义章. 西瓜枯萎病防治技术研究进展[J]. 中国蔬菜, 2005(7): 38-40. |
| [4] |
Xu WH, Zhou Y, Wu FZ. Research progress on Fusarium wilt of watermelon[J]. China Vegetables, 2013(8): 4-11. (in Chinese) 徐伟慧, 周岩, 吴凤芝. 西瓜枯萎病的研究进展[J]. 中国蔬菜, 2013(8): 4-11. |
| [5] |
Sakata Y, Ohara T, Sugiyama M. The history and present state of the grafting of cucurbitaceous vegetables in Japan[J]. Acta Horticulturae, 2007, 731(731): 159-170. |
| [6] |
Everts KL, Egel DS, Langston D, Zhou XG. Chemical management of Fusarium wilt of watermelon[J]. Crop Protection, 2014, 66: 114-119. DOI:10.1016/j.cropro.2014.09.003 |
| [7] |
Li HW, Han WL, Wang MY, Luo M, Han J, Gu AX. Screening and identification of antagonistic bacteria Bacillus pumilus against cotton Fusarium wilt and biocontrol reserach[J]. Chinese Journal of Biological Control, 2018, 34(3): 440-448. (in Chinese) 李海薇, 韩万里, 王梦瑶, 罗明, 韩剑, 顾爱星. 棉花枯萎病拮抗短小芽胞杆菌筛选鉴定及生防研究[J]. 中国生物防治学报, 2018, 34(3): 440-448. |
| [8] |
Zhang T, Li XY, Yang HM, Chu M, Gao Y, Zeng J, Huo XD, Lin Q, Mathemuti OK, et al. Biocontrol effect and mechanism of four strains of antagonistic bacteria against cotton Verticillium wilt[J]. Chinese Journal of Biological Control, 2018, 34(6): 882-889 (in Chinese) 张涛, 李雪艳, 杨红梅, 楚敏, 高雁, 曾军, 霍向东, 张涛, 林青, 欧提库尔, 等. 4株拮抗细菌对棉花黄萎病的防治效果及机制[J]. 中国生物防治学报, 2018, 34(6): 882-889 |
| [9] |
Sun HB, Li MY, Wu HL, Guo SG, Zhang J, Ren Y, Zhang HY, Gong GY, Xu Y. Biocontrol and plant growth promoting effects of Streptomyces against Fusarium wilt in watermelon[J]. Science Technology and Engineering, 2020, 20(13): 5074-5079. (in Chinese) 孙洪宝, 李茂营, 吴慧玲, 郭绍贵, 张洁, 任毅, 张海英, 宫国义, 许勇. 生防菌链霉菌对西瓜枯萎病防治及幼苗生长的影响[J]. 科学技术与工程, 2020, 20(13): 5074-5079. DOI:10.3969/j.issn.1671-1815.2020.13.008 |
| [10] |
Li D, Li RM, Qin WY, Zhou Y, Shang QX, Ren ZG, Wei YM, Zhao XY. Control effects and related biocontrol factors detection of two Bacillus amyloliquefaciens strains on watermelon Fusarium wilt[J]. Chinese Journal of Biological Control, 2018, 34(5): 729-737. (in Chinese) 李丹, 李茸梅, 秦伟英, 周宇, 尚巧霞, 任争光, 魏艳敏, 赵晓燕. 两株解淀粉芽胞杆菌对西瓜枯萎病的防治作用及其相关生防因子检测[J]. 中国生物防治学报, 2018, 34(5): 729-737. |
| [11] |
Zhang LR, Li P, Kang PZ, Du YN, Chen H. Screening and antagonistic mechanism analysis of Trichoderma spp. against Fusarium wilt of watermelon in gravel-mulched land[J]. Journal of Henan Agricultural Sciences, 2018, 47(5): 75-78, 84. (in Chinese) 张丽荣, 李鹏, 康萍芝, 杜玉宁, 陈杭. 压砂西瓜枯萎病生防木霉菌筛选及其拮抗机制研究[J]. 河南农业科学, 2018, 47(5): 75-78, 84. |
| [12] |
Zhang SQ, Sun LP, Zhao TX, Xu LK, Geng XB, Li YG. Screening and application of bio-control bacterium against corn stalk rot caused by Fusarium graminearum[J]. Microbiology China, 2017, 44(10): 2345-2352. (in Chinese) 张思奇, 孙丽萍, 赵同雪, 徐澜坤, 耿肖兵, 李永刚. 玉米茎基腐病生防菌的筛选及应用[J]. 微生物学通报, 2017, 44(10): 2345-2352. |
| [13] |
Roberts WK, Selitrennikoff CP. Plant and bacterial chitinases differ in antifungal activity[J]. Microbiology, 1988, 134(1): 169-176. DOI:10.1099/00221287-134-1-169 |
| [14] |
Ghose TK. Measurement of cellulase activities[J]. Pure and Applied Chemistry, 1987, 59(2): 257-268. |
| [15] |
Wang F, Lyu S, Liu WQ, Zeng LS, Du CX, Zhou JK, Han XX, Liu JP. Screening of antagonistic bacteria against Fusarium oxysporum f. sp. cubense and analysis of the substances associated with biological control[J]. Acta Agriculturae Universitatis Jiangxiensis, 2014, 36(6): 1264-1269. (in Chinese) 王芳, 吕顺, 刘文清, 曾莉莎, 杜彩娴, 周建坤, 韩秀香, 刘建平. 香蕉枯萎病生防菌的筛选及生防物质分析[J]. 江西农业大学学报, 2014, 36(6): 1264-1269. |
| [16] |
Martyn RD. Fusarium oxysporum f. sp. niveum race 2: a highly aggressive race new to the United States[J]. Plant Disease, 1987, 71(3): 233-236. |
| [17] |
Jinal NH, Amaresan N. Evaluation of biocontrol Bacillus species on plant growth promotion and systemic-induced resistant potential against bacterial and fungal wilt-causing pathogens[J]. Archives of Microbiology, 2020, 202(7): 1785-1794. DOI:10.1007/s00203-020-01891-2 |
| [18] |
Ganuza M, Pastor N, Boccolini M, Erazo J, Palacios S, Oddino C, Reynoso MM, Rovera M, Torres AM. Evaluating the impact of the biocontrol agent Trichoderma harzianum ITEM 3636 on indigenous microbial communities from field soils[J]. Journal of Applied Microbiology, 2019, 126(2): 608-623. |
| [19] |
Qiu G, Zhang XF, Li JW, Fu Z, Lu F. Effect of Bacillus amyloliquefaciens B1619 on growth of strawberry seedlings[J]. Jiangsu Agricultural Sciences, 2019, 47(4): 98-100. (in Chinese) 邱光, 张新凤, 李建伟, 符泽, 陆凡. 解淀粉芽孢杆菌B1619对草莓保苗促生效果[J]. 江苏农业科学, 2019, 47(4): 98-100. |
| [20] |
Zhang XH, Li HM, Li QS. Bio-control efficiency of Bacillus amyloliquefaciens ZJ01 against Alternaria alternate in Chinese jujube[J]. Jiangsu Agricultural Sciences, 2019, 47(13): 137-139. (in Chinese) 张献辉, 李红敏, 李全胜. 解淀粉芽孢杆菌ZJ01及其复配制剂对枣黑斑病的防治效果[J]. 江苏农业科学, 2019, 47(13): 137-139. |
| [21] |
Liu ZH, Hao RR, Xu YF, Yang CD, Zhang JL. Screening, identification and biocontrol effect of microbial antagonist against Fusarium solani causing potato dry rot[J]. Acta Agriculturae Zhejiangensis, 2019, 31(7): 1105-1111. (in Chinese) 刘治会, 郝蓉蓉, 许永锋, 杨成德, 张俊莲. 马铃薯茄镰孢菌干腐病生防菌株的筛选、鉴定及其防效[J]. 浙江农业学报, 2019, 31(7): 1105-1111. |
| [22] |
Chen NN, Qin PW, Yin JY, Wang Y, Shi TR, Liu Y, Mo Y. Progress in research on antibacterial mechanisms of Bacillus amylolyticus[J]. Chinese Journal of Microecology, 2018, 30(12): 1464-1469. (in Chinese) 陈楠楠, 秦平伟, 尹珺伊, 王岩, 史同瑞, 刘宇, 莫岩. 解淀粉芽孢杆菌抗菌机制研究进展[J]. 中国微生态学杂志, 2018, 30(12): 1464-1469. |
| [23] |
Chen G, Zhang Y, Li J, Dunphy GB, Punja ZK, Webster JM. Chitinase activity of Xenorhabdus and Photorhabdus species, bacterial associates of entomopathogenic nematodes[J]. Journal of Invertebrate Pathology, 1996, 68(2): 101-108. |
| [24] |
Pliego C, Ramos C, De Vicente A, Cazorla FM. Screening for candidate bacterial biocontrol agents against soilborne fungal plant pathogens[J]. Plant and Soil, 2011, 340(1/2): 505-520. DOI:10.1007/s11104-010-0615-8 |
| [25] |
Cherkupally R, Amballa H, Bhoomi NR. In vitro screening for enzymatic activity of Trichoderma species for biocontrol potential[J]. Annals of Plant Sciences, 2017, 6(11): 1784. |
| [26] |
Maheswari NU, Sirchabai TP. Effect of Trichoderma species on Pythium aphanidermatum causing rhizome rot of turmeric[J]. Biosciences Biotechnology Research Asia, 2011, 8(2): 723-728. |
 2021, Vol. 48
2021, Vol. 48




