扩展功能
文章信息
- 钟文琳, 管景强, 牟丹, 曾召英, 邹晓
- ZHONG Wenlin, GUAN Jingqiang, MOU Dan, ZENG Zhaoying, ZOU Xiao
- 一种与蝉花易混淆虫草的鉴定及内菌核细菌群落分析
- Identification of a Cordyceps easily confused with Isaria cicadae Miquel and analysis of bacterial community in sclerotia
- 微生物学通报, 2021, 48(6): 1874-1882
- Microbiology China, 2021, 48(6): 1874-1882
- DOI: 10.13344/j.microbiol.china.200982
-
文章历史
- 收稿日期: 2020-10-08
- 接受日期: 2020-10-27
- 网络首发日期: 2020-12-29
2. 贵州大学真菌资源研究所 贵州 贵阳 550025
2. Guizhou University Fungi Resources Institute, Guiyang, Guizhou 550025, China
地球上真菌的数量据估计有14万种,人类已知的真菌物种数量仅占10%左右,而食用菌以营养丰富、口感佳的优势在人类饮食中占据重要地位[1]。食用菌既被作为食物来源,又被广泛应用于医药领域[2-4],少部分食用菌已实现人工栽培[5-6]。蝉花(Isaria cicadae Miquel)隶属子囊菌门肉座菌目虫草科棒束孢属,是蝉棒束孢寄生在蝉若虫所形成的虫菌复合体,是中国传统中药[7]和食品[8],公元五世纪的南北朝时期就有记载[9]。蝉花中含有多糖、核苷类及多球壳菌素等活性物质[10],有镇痛、镇静、改善肾功能等药用功能[11],其在中国华南地区被长期使用。浙江省是我国蝉花资源的重要产地,但当地也有一些寄生蝉若虫的虫草,如独角龙、大蝉草和小蝉草等[12],其中一种名为“雄蝉花”的虫草与雌蝉花易被混淆在一起食用(图 1),因此有必要为二者作出区分。

|
| 图 1 自然环境中采集到的蝉花和独角龙 Figure 1 Isaria cicadae Miquel and Dujiaolong collected in natural environment 注:A:蝉花;B:独角龙 Note: A: Isaria cicadae Miquel; B: Dujiaolong |
|
|
高通量测序技术现已被应用于探究虫草微生物群落多样性[13-15],屈青松等[16]对蝉花内菌核中的内生菌进行分析,揭示蝉花内生细菌的潜在利用价值。淳于彦洁[17]研究发现不同产地、不同部位的蝉花细菌群落各有特点,表明内菌核细菌群落对虫生真菌多样性研究具有重要意义,细菌所执行的生物学功能在虫草发育过程中起重要调控作用。由此推测,内菌核细菌群落丰富的生物多样性是否意味着复杂的生态关系,在分类上内菌核细菌微生物组或可作为蝉花等虫草鉴定的标记性信息。
本文从形态学和分子系统学方面对蝉花与独角龙进行区分,讨论二者的分类地位,并探讨二者内菌核细菌群落组成和功能,明确蝉花和独角龙的分类地位,以期为蝉花和独角龙的区分提供更丰富的数据支持。
1 材料与方法 1.1 材料蝉花和独角龙样品均来自位于东经119°663 1′、北纬30°085 7′的浙江省杭州市富阳区菖蒲村附近区域,该地区为亚热带季风气候,年平均气温16.6 ℃,年平均降雨量364.45 mm,雨水充沛。
马铃薯葡萄糖琼脂培养基(g/L):马铃薯200.0,葡萄糖20.0,琼脂粉18.0,pH自然。1×105 Pa灭菌30 min。
真菌基因组DNA提取试剂盒,无锡百泰克生物技术有限公司;2×A8 PCR Mix,艾德莱生物科技有限公司。PCR仪,Bio-Rad公司;光学显微镜,奥林巴斯公司;琼脂糖凝胶电泳仪,北京市六一生物技术有限公司;恒温恒湿箱,韶关市广智科技设备有限公司。
1.2 方法 1.2.1 菌株的分离及形态观察将蝉花和独角龙子实体剪掉,去除虫体表面杂质,用无菌水冲洗后浸泡在75%酒精中消毒2-3 min,无菌纸巾擦干虫体,采用内部组织分离法分别获得蝉花和独角龙菌株,采用点接法分别将蝉花和独角龙接种于PDA平板中央,25 ℃、RH 65%分别培养7 d和14 d后,拍照记录菌落形态及镜检观察微观结构。
1.2.2 内菌核的获得各取3株蝉花和独角龙样品,将子实体剪掉,去除虫体表面杂质,用无菌水冲洗后浸泡在75%酒精中2-3 min,在无菌状态下用无菌手术刀轻轻划开虫体,无菌镊子挑取内菌核,蝉花内菌核样品编号为ZJCH_1、ZJCH_2和ZJCH_3;独角龙内菌核样品编号为ZJDJL_1、ZJDJL_2和ZJDJL_3。
1.2.3 菌株DNA提取、rDNA-ITS序列扩增及测序刮取蝉花和独角龙平板菌落菌丝,按总DNA提取试剂盒进行样本DNA提取,采用引物对ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4 (5′-TC CTCCGCTTATTGATATGC-3′) PCR扩增rDNA ITS序列。PCR反应体系:真菌DNA 2 μL,2×A8 PCR Mix 12.5 μL,引物ITS1和ITS4 (5.5 nmol/OD)各1 μL,补ddH2O至20 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 10 min;10 ℃保存[18]。PCR扩增产物送至昆明擎科生物有限公司进行测序。
1.2.4 菌株分子系统发育分析PCR扩增产物测序结果标准化后,经NCBI中BLAST比对,选择下载相似性较高序列的rDNA ITS序列,利用MEGA 7.0软件采用ClustalX方法进行序列比对和手工校对,用Bootstrap进行1 000次检验,构建Neighbor-Joining系统发育树。
1.2.5 高通量测序及分类单元注释经MiSeq测序得到的双端序列数据,首先根据PE Reads间的Overlap关系进行拼接,将成对的Reads拼接成一条序列,同时进行Reads的质控和过滤,根据序列首尾两端的Barcode和引物序列区分样品得到有效序列,全部原始序列经过滤、优化、去除嵌合体后进行OTU聚类及基于代表序列做分类学分析。
1.2.6 细菌群落组成分析在细菌属水平上统计蝉花和独角龙样本的物种丰度,相对丰度为每组样本3个重复的平均值,通过柱形图直观展示细菌群落组成。
1.2.7 细菌功能预测分析蝉花和独角龙内菌核细菌群落功能。利用PICRUSt (http://picrust.github.io/picrust/)对细菌的16S rRNA基因序列进行KEGG和COG功能注释,获得OTU在KEGG、COG各功能水平的注释信息及各功能在不同样本中的丰度信息。
2 结果与分析 2.1 菌株形态蝉花和独角龙菌株在PDA培养基中生长良好,菌落形态均近似圆形,但菌落形态和显微形态差异显著(图 2)。培养7 d后,蝉花菌落直径约4.5 cm,形态呈圆形、平展,菌丝呈白色、粉状,菌落从中央到边缘整体呈放射状,正反面颜色均雪白,具体描述为分生孢子梗轮生,长10.0-11.8 μm,2-3个分枝,瓶梗基部膨大呈柱形,向上变细,(2.22-2.27) μm×(0.90-1.11) μm,颈长2.2 μm左右,分生孢子透明、光滑,呈长椭圆形,(6.9-5.9) μm× (1.6-2.2) μm,孢子排列成链状,鉴定为蝉棒束孢。
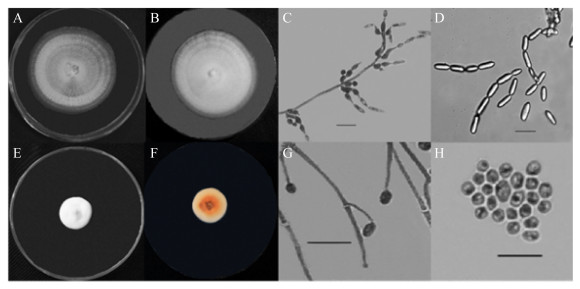
|
| 图 2 菌株形态 Figure 2 Strain morphology 注:A-D为蝉花形态;E-H为独角龙形态;A和E:菌落正面形态;B和F:菌落反面形态;C和G:菌株产孢结构;D和H:菌株孢子形态。Bar=10 μm Note: A-D: Morphology of Isaria cicadae Miquel; E-H: Morphology of Dujiaolong; A and E: Surface of colony; B and F: Back of colony; C and G: Spore-forming structure of strain; D and H: Spore morphology of strain. Bar=10 μm |
|
|
培养14 d后,独角龙菌落直径约1.7 cm,形态近似圆形,边缘不规则,菌落中央明显隆起,边缘略低,菌丝浓密呈绒毛状,正面颜色雪白,反面中央呈褐色,从中央至边缘褐色逐渐变淡,独角龙的显微结构菌丝体有隔,具有2种产孢结构:一种孢子的孢子梗较短,单生,倾斜,从基部到顶部逐渐变细,长5.8-9.6 μm,基部宽1.2-2.3 μm,顶部宽0.8-0.9 μm;另一种孢子直接单生于菌丝顶端,从基部到顶部逐渐变细,顶部宽1.2-1.9 μm,分生孢子透明,呈不规则球形,(5.0-7.7) μm×(2.7-2.72) μm,孢子聚集呈团状,鉴定为独角龙弯颈霉。
2.2 菌株系统发育分析通过与NCBI中已有的基因序列进行比对,结果表明蝉花与棒束孢属Isaria的rDNA ITS序列相似性最高,达到99%。选择粉棒束孢(I. farinosa)、环链棒束孢(I. cateniannulata)、玫烟色棒束孢(I. fumosorosea)、斜链棒束孢(I. cateniobliqua)、爪哇棒束孢(I. javanica)等ITS序列进行系统发育树构建,食蚜蝇虫霉(Entomophthora syrphi)作为外群,结果显示菌株的rDNA ITS序列与蝉棒束孢(I. cicadae)聚为一个分支,与其他棒束孢距离较远,结合形态学结果最终鉴定为蝉棒束孢(I. cicadae)。独角龙与弯颈霉属Tolypocladium的rDNA ITS序列相似性最高,达到98%。选择柱孢弯颈霉(T. cylindrosporum)、日本弯颈霉(T. japonicum)、长孢大团囊虫草(T. longisegmentum)、T. album、T. pustulatm等ITS序列进行系统发育树构建,结果显示独角龙ITS序列与独角龙弯颈霉(T. dujiaolongae)聚为一个分支,支持率为100%,与其他弯颈霉距离较远,结合形态学分析结果最终鉴定为独角龙弯颈霉(T. dujiaolongae) (图 3)。

|
| 图 3 基于目标菌株及相关菌株rDNA ITS序列构建的Neighbor-Joining系统发育树 Figure 3 Neighbor-Joining phylogenetic tree based on rDNA ITS sequences of target isolates and related isolates 注:系统发育树中括号中数字代表GenBank序列号;分支点上的数字代表计算1 000次聚类到一起的几率;标尺代表遗传距离 Note: In the phylogenetic trees, the numbers in brackets means the GenBank accession numbers; the number at the node means the percentage of occurrence in 1 000 boot-strapped trees; the scale means the genetic distance |
|
|
在属水平上,2种虫生真菌内菌核细菌群落组成差异较大(图 4)。蝉花内菌核样本优势细菌属为无色杆菌属(Achromobacter) (20.16%)、Diplorickettsiaceae未定名属(19.30%)和根瘤菌属(Rhizobium) (9.96%),其中Diplorickettsiaceae未定名属为蝉的内生细菌[19],此次在蝉花内菌核中被发现,由此推测此细菌可能来源于寄主昆虫。独角龙内菌核样本检测到优势属包括鞘氨醇杆菌属(Sphingobacterium) (30.46%)、Kosakonia (16.83%)、西地西菌属(Cedecea)(16.36%)和沙雷氏菌属(Serratia)(12.85%),其中鞘氨醇杆菌属和沙雷氏菌属为潜在的病原菌属。
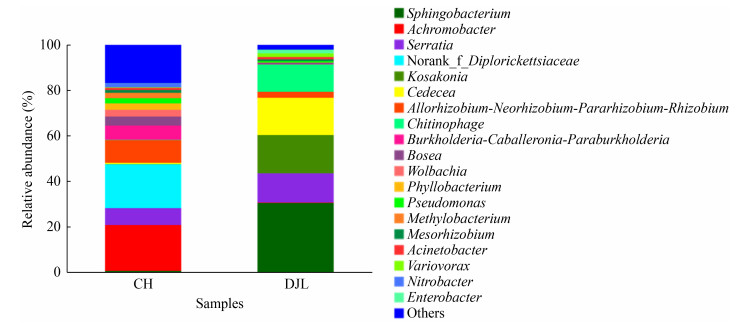
|
| 图 4 在属水平上蝉花和独角龙内菌核细菌群落组成及其相对丰度 Figure 4 Community composition and relative abundance of sclerotia bacteria in Isaria cicadae Miquel andDujiaolong at genus level 注:相对丰度小于1%的属归为其他 Note: Genera with relative abundance less than 1% are classified as other |
|
|
为获得蝉花和独角龙2组样本中的细菌功能,采用PICRUSt进行菌群功能预测分析。图 5表明2组样本经均值计算后,细菌COG数据库预测功能相似,KEGG Pathway丰度相近。COG数据库预测功能分类显示,细菌群落共计24个基因功能家族,它们的主要功能大多与转运和代谢相关,包括氨基酸转运与代谢(Amino Acid Transport and Metabolism,7.77%-10.18%)、转录(Transcription,8.01%-8.29%)、一般功能预测(General Function Prediction Only,7.99%-9.01%)、无机离子运输与代谢(Inorganic Ion Transport and Metabolism,6.87%-8.07%)、碳水化合物运输与代谢(Carbohydrate Transport and Metabolism,6.40%-7.67%)。

|
| 图 5 蝉花和独角龙16S rRNA基因功能预测分析 Figure 5 Prediction and analysis of 16S rRNA gene function of Isaria cicadae Miquel and Dujiaolong 注:A:OTU水平各样本细菌COG功能分类;B:OTU水平各样本细菌KEGG Pathway相对丰度 Note: A: COG functional classification of various bacteria at OTU level; B: Bacterial KEGG pathway relative abundance of different samples at OTU level |
|
|
内菌核细菌群落KEGG Pathway丰度统计结果显示,蝉花和独角龙2组样本中与新陈代谢(Metabolism)相关的丰度最大为57.94%-58.40%,与遗传信息处理(Genetic Information Processing)和环境信息处理(Environmental Information Processing)相关的丰度有所差异,蝉花中与遗传信息处理和环境信息处理相关的丰度分别为18.36%和16.09%,独角龙中分别为9.64%和22.34%。
3 讨论与结论近年来,随着分子生物学的发展,可以更加深入和准确地鉴定物种,给真菌的系统分类带来了生机[20],但依靠现行的鉴定方法无法准确识别所有物种[21]。蝉花、大蝉草、小蝉草和独角龙弯颈霉的寄主均为蝉若虫,在人们的认知里经常将它们混淆。蝉棒束孢(Isaria cicadae)曾被认为是大蝉草的无性型,曹玉朋[22]经鉴定否定了大蝉草的无性型为蝉棒束孢,将大蝉草归于Tolypocladium属,提出了大蝉草的新组合名(Tolypocladium cicade)(S.Z. Shing) Y.P. Cao & C.R. Li。大蝉草与小蝉草(Cordyceps sobolifera)(Hill ex Watson) Berk & Broome很相似,但微观特征明显不同,而且小蝉草有记载出现食物中毒的现象[23]。雄蝉花(独角龙)过去被部分学者认为是奇异弯颈霉(Tolypocladium paradoxum)[24-25],直到2018年Li等[26]对独角龙进行形态学和分子系统学鉴定,认为独角龙是奇异弯颈霉的近缘种,相似性为98.1%,将其重新描述为弯颈霉属一新种,定名为独角龙弯颈霉(Tolypocladium dujiaolongae),这一观点得到大多数真菌学家的认可。
我们经形态鉴定发现独角龙弯颈霉有2种产孢结构,可是张晓莹[27]在对大团囊虫草及其近缘种生物学研究中未提及该现象,而Li等[26]在研究中发现2种孢子形态,但未提及有2种产孢结构,孢子形态和产孢结构的差异是否和真菌成熟度有关,这一点有待后续研究证实。独角龙弯颈霉内菌核细菌群落检测到2种病原菌属,占内菌核细菌群落30.46%的鞘氨醇杆菌属细菌,作为病原性细菌可引起菌血症和溃疡感染[28-29];沙雷氏菌属作为条件致病菌逐渐受到人们的重视,该菌可导致免疫功能低下的人群发生尿道感染、呼吸道感染以及败血症[30-31]。2种虫生真菌的细菌COG数据库预测功能和KEGG Pathway丰度基本相似,内菌核细菌群落在虫生真菌生长过程中的转运和代谢及新陈代谢方面发挥重要作用。然而独角龙弯颈霉中的病原菌属参与了真菌生长的代谢过程,因此独角龙弯颈霉食用的安全性值得关注。
不同产地的蝉花内生细菌存在差异,安徽蝉花内生细菌的优势属为西地西菌属(Cedecea)和立克次体属(Rickettsia),浙江蝉花内生细菌的优势属为伯克氏菌属(Burkholderia)和无色杆菌属(Achromobacter)[16]。由此可知来自安徽省和浙江省的蝉花内生细菌优势属完全不同;本文浙江蝉花的内生细菌优势属主要为无色杆菌属(Achromobacter)和Diplorickettsiaceae未定名属,比较得出,同为来自浙江省的蝉花,内生细菌优势属均有无色杆菌属,但也存在差异,原因可能是蝉花生长的生境不同。因此,高通量数据可为虫草类真菌的鉴定提供更丰富的生态信息,如果将高通量数据与不同生境中的环境因子结合,可作为虫草类真菌的地域性标记特征等。
| [1] |
Hawksworth DL. Mushrooms: the extent of the unexplored potential[J]. International Journal of Medicinal Mushrooms, 2001, 3(4): 82. |
| [2] |
Wasser SP. Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J]. Applied Microbiology and Biotechnology, 2002, 60(3): 258-274. DOI:10.1007/s00253-002-1076-7 |
| [3] |
Lindequist U, Niedermeyer THJ, Jülich WD. The pharmacological potential of mushrooms[J]. Evidence-Based Complementary and Alternative Medicine, 2005, 2(3): 285-299. DOI:10.1093/ecam/neh107 |
| [4] |
Wasser SP. Medicinal mushroom science: history, current status, future trends, and unsolved problems[J]. International Journal of Medicinal Mushrooms, 2010, 12(1): 1-16. DOI:10.1615/IntJMedMushr.v12.i1.10 |
| [5] |
Liu QZ, Ma HS, Zhang Y, Dong CH. Artificial cultivation of true morels: current state, issues and perspectives[J]. Critical Reviews in Biotechnology, 2018, 38(2): 259-271. DOI:10.1080/07388551.2017.1333082 |
| [6] |
Roy S, Jahan MAA, Das KK, Munshi SK, Noor R. Artificial cultivation of Ganoderma lucidum (Reishi Medicinal Mushroom) using different sawdusts as substrates[J]. American Journal of BioScience, 2015, 3(5): 178-182. DOI:10.11648/j.ajbio.20150305.13 |
| [7] |
Wei YL, Yang MF, Zou X, Liu AY. Review on bioactive components from Isaria cicadae[J]. Guizhou Agricultural Sciences, 2014, 42(12): 142-148. (in Chinese) 卫亚丽, 杨茂发, 邹晓, 刘爱英. 蝉棒束孢菌的生物学活性研究进展[J]. 贵州农业科学, 2014, 42(12): 142-148. DOI:10.3969/j.issn.1001-3601.2014.12.034 |
| [8] |
Guo WC, Hu ZD, Liu JH. Review on bioactive components from Isaria cicadae[J]. Special Economic Animal and Plant, 2017, 20(11): 39-45. (in Chinese) 郭文场, 胡振东, 刘佳贺. 药食兼用虫草菌: 蝉花[J]. 特种经济动植物, 2017, 20(11): 39-45. DOI:10.3969/j.issn.1001-4713.2017.11.019 |
| [9] |
Peng F. Effects of strain degeneration on metabolism of vegetable cicada, Isaria cicadae[D]. Hefei: Doctoral Dissertation of Anhui Agricultural University, 2014 (in Chinese) 彭凡. 蝉花菌种退化对其代谢的影响[D]. 合肥: 安徽农业大学博士学位论文, 2014 |
| [10] |
Qin WP, Mu C, Yin SP. Research progress of chemical components and pharmacological effects of Isaria cicadae Miquel[J]. Chinese Journal of Library and Information Science for Traditional Chinese Medicine, 2019, 43(4): 73-76. (in Chinese) 秦文平, 慕程, 殷世鹏. 中药蝉花的化学成分及药理作用研究进展[J]. 中国中医药图书情报杂志, 2019, 43(4): 73-76. DOI:10.3969/j.issn.2095-5707.2019.04.019 |
| [11] |
Wang CL, Lu BZ, Hou GL. Study progress on Cordyceps cicadae in China[J]. Chinese Pharmaceutical Journal, 2006, 41(4): 244-247. (in Chinese) 王春雷, 芦柏震, 侯桂兰. 中国蝉花的研究进展[J]. 中国药学杂志, 2006, 41(4): 244-247. DOI:10.3321/j.issn:1001-2494.2006.04.002 |
| [12] |
Dong CH, Li WJ, Li ZZ, Yan WJ, Li TH, Liu XZ, Cai L, Zeng WB, Chai MQ, Chen SJ, et al. Cordyceps industry in China: current status, challenges and perspectives: Jinhu declaration for cordyceps industry development[J]. Mycosystema, 2016, 35(1): 1-15. (in Chinese) 董彩虹, 李文佳, 李增智, 闫文娟, 李泰辉, 刘杏忠, 蔡磊, 曾文波, 柴美清, 陈仕江, 等. 我国虫草产业发展现状、问题及展望: 虫草产业发展金湖宣言[J]. 菌物学报, 2016, 35(1): 1-15. |
| [13] |
Chunyu YJ, Lu ZM, Luo ZS, Li SS, Li H, Geng Y, Xu HY, Xu ZH, Shi JS. Promotion of metabolite synthesis in Isaria cicadae, a dominant species in the cicada flower microbiota, by cicada pupae[J]. Journal of Agricultural and Food Chemistry, 2019, 67(31): 8476-8484. DOI:10.1021/acs.jafc.9b02705 |
| [14] |
Chen YQ, Hu B, Xu F, Zhang WM, Zhou H, Qu LH. Genetic variation of Cordyceps sinensis, a fruit-body-producing entomopathogenic species from different geographical regions in China[J]. FEMS Microbiology Letters, 2004, 230(1): 153-158. DOI:10.1016/S0378-1097(03)00889-9 |
| [15] |
Xia F, Liu Y, Shen GR, Guo LX, Zhou XW. Investigation and analysis of microbiological communities in natural Ophiocordyceps sinensis[J]. Canadian Journal of Microbiology, 2015, 61(2): 104-111. DOI:10.1139/cjm-2014-0610 |
| [16] |
Qu QS, Yang F, Zhao CY, Wang JR, Zeng JH, Shi XY. Isolation and diversity of Cordyceps cicadae endophytic bacteria in Anhui and Zhejiang[J]. Journal of Chinese Medicinal Materials, 2019, 42(5): 992-999. (in Chinese) 屈青松, 杨芳, 赵崇妍, 王婧茹, 曾金花, 史新元. 安徽和浙江蝉花内生细菌的分离及其多样性研究[J]. 中药材, 2019, 42(5): 992-999. |
| [17] |
Chunyu YJ. Microbial community structure of cicada flowers and cultivation of the dominant fungus[D]. Wuxi: Master's Thesis of Jiangnan University, 2019 (in Chinese) 淳于彦洁. 蝉花微生物群落结构研究及优势真菌的分离培养[D]. 无锡: 江南大学硕士学位论文, 2019 |
| [18] |
Zheng H, Zhang ZY, Han YF, Chen WH, Liang ZQ. Community composition and ecological functional structural analysis of the endophytic fungi in Robinia pseudoacacia[J]. Mycosystema, 2018, 37(2): 256-263. (in Chinese) 郑欢, 张芝元, 韩燕峰, 陈万浩, 梁宗琦. 刺槐内生真菌群落组成及其生态功能结构分析[J]. 菌物学报, 2018, 37(2): 256-263. |
| [19] |
Ishii Y, Matsuura Y, Kakizawa S, Nikoh N, Fukatsu T. Diversity of bacterial endosymbionts associated with Macrosteles leafhoppers vectoring phytopathogenic phytoplasmas[J]. Applied and Environmental Microbiology, 2013, 79(16): 5013-5022. DOI:10.1128/AEM.01527-13 |
| [20] |
Niu YC. New techniques and approaches used in systematics and identification of fungi[J]. Journal of Beijing Forestry University, 1995, 17(2): 93-98. (in Chinese) 牛永春. 真菌系统分类与鉴定中的新方法[J]. 北京林业大学学报, 1995, 17(2): 93-98. DOI:10.3321/j.issn:1000-1522.1995.02.001 |
| [21] |
Widmer TL. Differences in virulence and sporulation of Phytophthora kernoviae isolates originating from two distinct geographical regions[J]. Plant Disease, 2015, 99(4): 460-466. DOI:10.1094/PDIS-09-14-0957-RE |
| [22] |
Cao YP. Studies on entomogenous fungi in the Anhui province and antimicrobial activities of strain RCEF6202[D]. Hefei: Master's Thesis of Anhui Agricultural University, 2014 (in Chinese) 曹玉朋. 安徽虫生真菌资源及RCEF6202菌株抗菌活性研究[D]. 合肥: 安徽农业大学硕士学位论文, 2014 |
| [23] |
Xing XQ. Whether Cordyceps sobolifera can be used as medicine remains to be confirmed[J]. Chinese Bulletin of Entomology, 1994, 31(4): 253. (in Chinese) 幸兴球. 小蝉草能否入药有待证实[J]. 昆虫知识, 1994, 31(4): 253. |
| [24] |
Tan YJ, Chen Z, Liu ML, Zeeshan K, Dong JF, Wang YQ, Sun CS, Bao XN, Li ZZ. Identification of Tolypocladium paradoxum and Ophiocordyceps yakusimensis from China[A]//Proceedings of the 8th International Conference on Mushroom Biology and Mushroom Products (ICMBMP8)[C]. New Delhi: ICAR-Directorate of Mushroom Research, 2014: 473-478
|
| [25] |
Huang HJ. Identification and cultivation of precious medicinal materials Cordyceps cicadae[J]. Agricultural Science-Technology and Information, 2017(10): 79-80. (in Chinese) 黄涵锦. 珍贵药材蝉虫草的鉴别与培育[J]. 农业科技与信息, 2017(10): 79-80. |
| [26] |
Li CR, Hywel-Jones N, Cao YP, Nam S, Li ZZ. Tolypocladium dujiaolongae sp. nov. and its allies[J]. Mycotaxon, 2018, 133(2): 229-241. DOI:10.5248/133.229 |
| [27] |
Zhang XY. A study on biology of Tolypocladium ophioglossoides and its relative species[D]. Kunming: Master's Thesis of Yunnan University, 2015 (in Chinese) 张晓莹. 大团囊虫草及其近缘种生物学研究[D]. 昆明: 云南大学硕士学位论文, 2015 |
| [28] |
Tronel H, Plesiat P, Ageron E, Grimont PAD. Bacteremia caused by a novel species of Sphingobacterium[J]. Clinical Microbiology and Infection, 2003, 9(12): 1242-1244. DOI:10.1111/j.1469-0691.2003.00801.x |
| [29] |
Pernas-Pardavila H, Vallejo-Alonso AM, Novo-Veleiro I, De La Cruz DN, González-Quintela A. Sphingobacterium multivorum: an atypical bacterium in an atypical place[J]. European Journal of Case Reports in Internal Medicine, 2019, 6(9): 001214. |
| [30] |
Galvis AE, Boyd K, Pecson IS. Rosai-dorfman disease in a patient with cervical lymphadenopathy and associated Serratia marcescens infection[J]. Clinical Infection in Practice, 2020, 7/8: 100036. DOI:10.1016/j.clinpr.2020.100036 |
| [31] |
Kimura M, Jin CH. Six. Progress in Japanese medicine Serratia[J]. Progress in Japanese Medicine, 1984, 5(12): 15. (in Chinese) 木村贞夫, 金成河. 六、沙雷氏菌属[J]. 日本医学介绍, 1984, 5(12): 15. |
 2021, Vol. 48
2021, Vol. 48




