扩展功能
文章信息
- 刘永晴, 师帅兵, 沈腾飞, 陈亮亮, 廖成水, 王臣
- LIU Yongqing, SHI Shuaibing, SHEN Tengfei, CHEN Liangliang, LIAO Chengshui, WANG Chen
- 猪源抗菌肽PMAP-36的序列设计及其结构优化的研究进展
- Sequence design and structural optimization of porcine myeloid antimicrobial peptide PMAP-36: a review
- 微生物学通报, 2021, 48(4): 1331-1339
- Microbiology China, 2021, 48(4): 1331-1339
- DOI: 10.13344/j.microbiol.china.200616
-
文章历史
- 收稿日期: 2020-06-17
- 接受日期: 2020-08-27
- 网络首发日期: 2020-11-06
抗生素抗性问题在全球日益普遍,由细菌耐药和药物残留引发的动物性食品安全卫生问题对全球公共卫生系统造成了巨大威胁[1-3]。世界卫生组织(World Health Organization)强调,抗生素耐药性问题到2050年将会导致1 000万人死亡[1, 4]。中国农业农村部也发文要求2020年饲料全面禁用抗生素。抗菌肽(Antimicrobial Peptides,AMPs)因其分子量小、不易产生耐药性、抗菌谱广等优点受到学者的广泛研究[5-6],是解决耐药性问题的一种有前景的新型抗菌药物[7]。
抗菌肽的来源十分广泛,在植物、昆虫、哺乳动物、两栖类动物等生物机体内均可分离得到,某些细菌也能产生并分泌抗菌肽。Cathelicidins是一类重要的抗菌肽,在多个物种中均有发现。猪源抗菌肽(Porcine Cathelicidins)是第一批分离到的哺乳动物抗菌肽[8]。截至目前已发现11种猪源抗菌肽,这11种猪源抗菌肽分别是富含脯氨酸和精氨酸的39个氨基酸肽(PR-39)、富含脯氨酸和苯丙氨酸的Prophenin-1 (PF-1)与Prophenin-2 (PF-2)、富含半胱氨酸的Protegrin-1 (PG-1)-Protegrin-5 (PG-5)以及3种猪源抗菌肽PMAP-23、PMAP-36和PMAP-37[9]。这些抗菌肽在空间结构、肽链长短、生物学特点等方面存在显著差异,但其特征几乎涵盖了所有高等脊椎动物类型的抗菌肽,并对革兰氏阳性菌和革兰氏阴性菌、真菌、病毒等表现出不同程度的杀伤效果[9-10]。其中,PMAP-36拥有丰富的螺旋构象和较高的正电荷,在其广谱抗菌活性方面发挥了重要作用,其优良的性质特点吸引了国内外学者对其进行系统研究[9]。然而,抗菌肽本身存在的抗菌活性低、带有溶血活性和细胞毒性等问题,限制了抗菌肽的实际应用[11]。
以性能优良的抗菌肽为模板,结合计算机软件辅助设计,通过替换氨基酸残基、提高疏水性、延长α-螺旋结构等方式对抗菌肽进行结构优化已成为新型抗菌肽研究的主要方向。我们课题组近年来从事抗菌肽的结构改造及其抗菌活性研究,根据天然抗菌肽Metalnikowin、Cecropin P1、猪源抗菌肽PMAP-23、PMAP-36、PMAP-37以及PMAP-GI24的作用机理和氨基酸结构,通过增加原肽正电荷或者疏水性、延长α螺旋等结构优化方式设计出了多条具有较好稳定性和较高抗菌活性的新型抗菌肽[12-19]。本文对猪源抗菌肽PMAP-36的序列设计及其结构优化做一综述,并对其前景进行展望。
1 PMAP-36的来源与结构PMAP-36是在1994年首次从猪骨髓RNA库中克隆得到的含有36个氨基酸的抗菌肽[20]。PMAP-36的氨基酸序列为:N-GRFRRLRKKTRKR LKKIGKVLKWIPPIVGSIPLGCG-C,其N端为富电荷区,含有13个正电荷氨基酸,阳离子氨基酸比例高达36%;C端为疏水区,含有21个疏水性氨基酸;序列中还包括2个不带电的极性氨基酸[20-21]。此外,PMAP-36的N端结构分析表明,PMAP-36是一个典型的两亲性α-螺旋结构的高阳离子抗菌肽[20-21]。由于第25和26位的2个脯氨酸(P)诱导形成了一个铰链区,中断了其α-螺旋结构(图 1)。
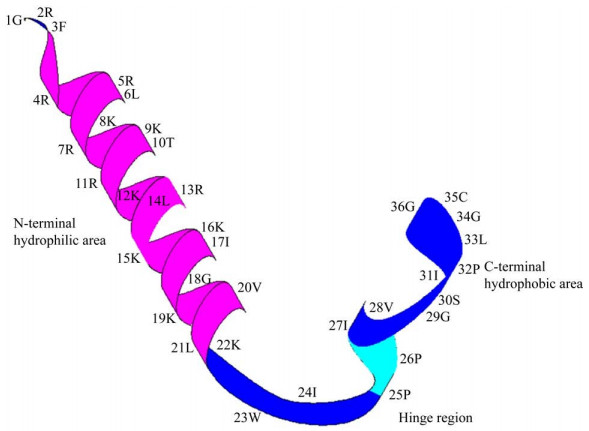
|
| 图 1 PMAP-36的三维结构模式图 Figure 1 3D structure pattern of PMAP-36 |
|
|
C末端的第35位半胱氨酸(C)被证明对PMAP-36的结构与功能具有重要作用,其可以通过分子间二硫键使PMAP-36二聚,以二聚体前体的形式存在于外周血白细胞和合成肽中[9]。与单体相比,二聚体构象稳定,与细菌的作用时间可能更持久,进而表现出增强的杀菌效果[9, 21]。
2 PMAP-36的抗菌机制Lv等通过研究抗菌肽PMAP-36及其N端活性区域GI24对细菌细胞膜和细胞形态的作用,发现PMAP-36和GI24以类似蜂毒肽的毯式机制损伤细菌细胞膜:首先,PMAP-36和GI24通过静电吸附作用与阴离子细菌膜结合,然后肽聚集在膜表面达到阈值浓度开始重新排列进而改变细菌膜的渗透性,接下来再插入膜的疏水核心促进跨膜孔样结构的形成,进而透化细菌细胞膜,使细胞内容物渗漏,细菌死亡(图 2);即使在低于其MIC的浓度下,PMAP-36和GI24也能快速透化大肠杆菌的外膜和内膜[22]。其他学者也证实了PMAP-36可通过透化细菌细胞膜起到杀菌作用[20, 23]。
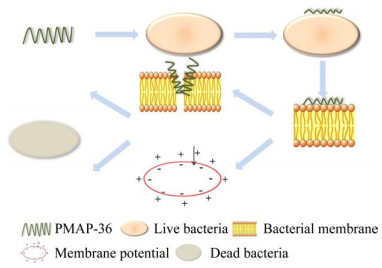
|
| 图 2 PMAP-36的抗菌机制 Figure 2 PMAP-36 antibacterial mechanism |
|
|
此外,Wang等通过观察抗菌肽PMAP-36和PRW4处理的大肠杆菌图像,发现细菌膜溶解随着肽疏水性的增加而增加,证明了疏水性对抗菌活性的重要性;进一步观察多肽的DNA结合,结果显示,PMAP-36先穿透细菌细胞壁到达细胞的内部结构,然后与DNA等细胞间靶点相互作用,这表明膜通透性增加可能不是细菌死亡的唯一原因,PMAP-36可能在细胞膜损伤后靶向细胞内分子,从而引发一系列的变化,最终导致细菌死亡[24]。
3 PMAP-36的生物学功能抗菌肽是由多种生物细胞特定基因编码产生的一类对抗外来病原体的防御性多肽活性物质,作为第一道防线,在先天性免疫中起着关键作用。PMAP-36作为一种猪源的α-螺旋结构的阳离子抗菌肽,除了具有高效广谱的抗菌活性,还具有多重免疫调节活性,主要包括:(1) 诱导趋化因子(CCL-2)的表达;(2) 中和脂多糖(Lipopolysaccharide,LPS),抑制LPS诱导的活化;(3) 中和脂磷壁酸(Lipoteichoic Acid,LTA),抑制LTA诱导的活化;(4) 增强DNA诱导的活化作用,促进肿瘤坏死因子TNF-α的分泌;(5) 抑制LPS诱导的巨噬细胞活化[25-28]。
抗菌肽PMAP-36还具有一定的控制细菌性精子症的作用。Bussalleu等通过在猪精液中添加AMPs研究对精液中细菌生长和精子质量的影响,结果表明,在猪精液中添加PMAP-36可以更好地保持精子活力,但不能避免细菌生长[29]。
此外,抗菌肽PMAP-36还具有成为新的疫苗候选物的可能性。Kim等研究发现,通过GI24裂解细菌(布氏杆菌、鼠伤寒沙门菌)细胞可作为一种疫苗候选物,对小鼠、犬和山羊进行免疫接种可诱导产生细胞或体液介导的免疫应答,分泌大量血清免疫球蛋白IgG和细胞因子,对免疫动物表现出明显的保护作用[30-32]。
4 PMAP-36的序列设计及结构优化 4.1 氨基酸的替换正电荷和疏水性在抗菌肽的抗菌活性上发挥着重要作用,带正电荷的抗菌肽先通过静电吸附作用与带负电的细菌细胞膜结合,接着抗菌肽的疏水部分插入细菌膜的磷脂层,进而在膜上形成离子通道或使细胞膜裂解,导致细菌死亡[33]。因此,在序列设计时可以通过改变抗菌肽的电荷数和疏水性来改变抗菌活性。Lv等通过疏水残基(V)替换GI24的3个和6个阳离子残基(R或K),设计了类似物GI24-V3和GI24-V6,结果发现疏水残基(V)的替换增加了GI24的疏水性,但没有改善GI24-V3或GI24-V6的抗菌活性,这可能是由于高疏水性肽具有较低的溶解度;Lv等又通过替换23位的W,设计了GI24的W-取代物(GI24-W23A、GI24-W23K、GI24-W23L),研究发现,通过A或K取代GI24的23位的单个W,导致GI24-W23A和GI24-W23K的平均疏水性值降低,其抗菌活性也显著降低;但当W被L取代后,GI24-W23L与GI24具有相同的平均疏水性,抑菌活性也恢复到原来GI24的抑菌水平[22]。
Zhou等通过用疏水残基(W)和带正电荷的氨基酸(K)替换第25和26位的脯氨酸(P)对PMAP-36进行结构优化,合成了新肽PMAP-36PW和PMAP-36PK,PMAP-36PW的疏水性值提高,PMAP-36PK的正电荷数增加,并且2种优化方式均延长了其α-螺旋结构;通过氨基酸替换,PMAP-36PW和PMAP-36PK增加了抗菌谱,对大肠杆菌K88表现出明显的杀菌效果,同时降低了对革兰氏阳性菌和革兰氏阴性菌的MIC值;此外,2条新肽在小鼠感染模型实验中,通过减轻肺脏和肝脏组织的炎症损伤、减少细菌基因拷贝数,降低了小鼠死亡率,表现出较好的治疗效果[16]。这些结果进一步表明,氨基酸替换是一种有效的设计策略,可以明显改善猪源抗菌肽PMAP-36的抗菌活性,为设计其他高效抗菌肽提供了参考依据。
4.2 肽链长度的改变肽链的长度也会影响抗菌肽的疏水性,进而影响其抗菌活性和溶血活性[34]。Liu等分别在GI24的C端增加2个色氨酸(W)和赖氨酸(K)的方式延长了肽链,合成了2条新肽PMAP-24WW和PMAP-24KK,同时也延伸α-螺旋区域,研究结果发现,PMAP-24WW和PMAP-24KK降低了MIC值,具有更高的抗菌活性;新肽的溶血活性均比PMAP-GI24有所增高,但没有显著性差异;此外,在小鼠感染模型实验中,PMAP-GI24类似物有效地减少了小鼠肝脏和肺部的细菌数量,减轻了炎症损伤,有效地降低了小鼠死亡率[17]。表明一定范围内延长肽链可以有效调节肽的抗菌活性和溶血活性。
理想的肽链长度可以通过增强分子内氢键作用而保持肽链的稳定性,进而发挥更好的抑菌效果[35]。研究表明,截短的肽链也能有效改善抗菌肽的抗菌活性。Lv等根据PMAP-36的结构特点和残基分布,截短PMAP-36设计合成了一系列类似肽(GI24、GK12、RI12、PG12),其中GI24显示出较高的抗菌活性,与亲本肽PMAP-36的抗菌活性相当;C端12残基PG12对所有测试菌均无抗菌活性,其他2个截短肽GK12和RI12的抗菌活性显著降低,但在测试浓度下,GK12和RI12均未显示出溶血活性;PMAP-36和GI24则表现出轻微的溶血活性剂量依赖性关系,这些结果表明肽链的长短会影响肽的抗菌活性和溶血活性[22]。Lyu等在保留GI24的高疏水性C-末端的同时删除了3个N-末端氨基酸,进一步设计了PMAP-36的截短肽(RI21、RI18、TI15、RI12),所有多肽在模拟膜环境中均表现出典型的α-螺旋结构,其中,RI21和RI18保留了PMAP-36的高抗菌活性,MIC为1-8 μmol/L;同时溶血活性也随着链长的减少而降低,RI18对宿主细胞上的病原体表现出最大的选择性毒性[36]。这些结果强调了肽截短的有效性。短肽对抗菌活性的影响依赖于亲本肽的活性区域,而且短肽更有利于降低溶血活性。这些研究为开发具有细胞选择性的高效抗菌药物提供了新思路。
4.3 重组杂合肽抗菌肽杂合是优化抗菌肽的常见方式。一般选择天然抗菌肽的活性区域,其具备亲本肽的功能,通过拼接化学合成具有更高效抗菌活性的杂合肽。RI16为PMAP-36抗菌肽的一段活性区域,保持着完美的两亲性、较低的杀菌活性和细胞毒性,徐蔚等将其中的一段序列RR7剔除并引入一段具有抗生物膜活性的序列FV7,得到了杂合肽R-FV-I16;R-FV-I16对多种革兰氏阳性和革兰氏阴性菌显示出较强的抗菌活性,表现出较低的溶血活性,并且继承了抗生物膜序列FV7的抗生物膜活性,表现出与FV7相似程度的抗生物膜活性[37]。此外,单安山等通过将RI16的第7和11位的氨基酸替换成色氨酸(W)得到抗菌肽PRW4,再将PRW4与Fowlicidin-2的N-末端前15个氨基酸杂合得到杂合肽PR-FO;将PR-FO的羧基末端酰胺化,发现PR-FO对革兰氏阳性菌和革兰氏阴性菌显示出很强的抑制活性[38]。毕重朋等通过截取猪源抗菌肽PR-39的活性片段,与PMAP-36的片段杂合获得了氨基酸长度为19的杂合抗菌肽PP-3[39]。马清泉等对PMAP-36的衍生肽与髓样分化蛋白-2的脂多糖绑定序列FSKGKYKCV进行杂合,以进一步增强衍生肽的细菌靶定能力,获得了衍生杂合肽MDP-3和MDP-4[40]。这种杂合肽为设计并筛选具有多种生物学活性的新型抗菌药物提供了一种新的模式。
除了人工合成杂合肽,还可以在毕赤酵母或大肠杆菌表达系统中进行蛋白融合形成重组肽。PMAP-36的二聚体对多种微生物具有高效、快速的杀菌活性。Wang等根据毕赤酵母(Pichia pastoris)的密码子偏爱性,设计了反平行二聚体(PMAP-36)2的编码基因,并用丝氨酸取代C-末端半胱氨酸对密码子进行了优化,防止形成分子间二硫键,随后在P. pastoris GS115菌株中进行重组蛋白的高效表达,重组肽(PMAP-36)2对革兰氏阳性菌和革兰氏阴性菌均具有抗菌活性,但不引起鸡红细胞溶血;此外,重组肽(PMAP-36)2能显著提高鸡血清IgM含量,提高肉鸡的免疫能力,促进肠道健康[41]。使用基因工程的方式不仅可以高效便捷地表达目的基因,还可以增强重组肽的抗菌活性并降低毒性,是优化抗菌肽的一种有效策略。
4.4 非完美两亲性肽两亲性是影响抗菌肽抗菌活性的重要因素之一。抗菌肽的两亲性与疏水性和螺旋度有关,当两亲性降低时,抗菌肽的抗菌活性和溶血活性也会降低[42]。研究表明,非完美的两亲性短肽比完美两亲性对映体具有更强的抗菌活性,而且短肽的毒性与完美/非完美两亲性结构无显著相关性[43]。PMAP-36的N端16个氨基酸序列RI16具有完美两亲性结构,朱鑫利用色氨酸(W)替换两亲性结构极性面中成对的赖氨酸(K)设计了一系列非完美两亲性肽(PRW3、PRW4、PRW5、PRW6),其中具有氢键连接的Trp改良肽PRW4具有较强的广谱抗菌活性,同时不具有细胞毒性,表明适度破坏抗菌肽的两亲性可以提高其抗菌活性,降低细胞毒性[44]。
4.5 其他优化方式除了在结构上设计优化抗菌肽的生物活性,运用微胶囊技术也可以制备具有稳定性好、抗菌活性更长久的抗菌肽。基于抗菌肽在生产和使用中存在的诸多问题,张磊等先对PMAP-36氨基酸序列进行了5处突变,分别是L7V、T11S、I18E、I25A和I32A,得到新的PMAP-36抗菌肽,氨基酸序列为N-VGRFRRVRKKSRKRLKKEGKVLKWAPPIVGSAPLGCG-C,随后将海藻酸钠水溶液、壳聚糖酸溶液和氯化钾溶液高速混匀形成一种缓释颗粒,并与200 μg/mL突变后的PMAP-36抗菌肽溶液一起混合,接着进行β-环糊精包埋,得到了猪源抗菌肽PMAP-36缓释胶囊,胶囊粒径为2 mm;与传统的非缓释胶囊的PMAP-36相比,该缓释胶囊在相同培养时间下产生的抑菌圈大于原始PMAP-36产生的抑菌圈,其MIC值为5-8 μg/mL,抗菌活性也比原始PMAP-36提高了1.0-2.6倍,表现出更持久的释放性能和更高的抗菌活性;在金黄色葡萄球菌和沙门氏菌所导致仔猪腹泻的治疗过程中,缓释胶囊肽PMAP-36灌服饮剂7 d,仔猪的痊愈率为90%,10 d后痊愈率为100%,抗生素组7 d和10 d的痊愈率分别为78%和96%,该缓释胶囊肽显示出与抗生素相近的治疗效果[45]。
5 抗菌肽不同优化途径的对比现针对PMAP-36的各种优化途径,在优化方式和优化效果方面对抗菌肽产生的影响进行了比较,结果见表 1。但抗菌肽来源众多、结构各异,不同的优化途径可能对其生物学特点和抗菌活性产生不同的影响,因此,对抗菌肽进行优化时要根据其结构功能选择合适的优化途径。
| 优化途径 Optimization approach |
优化方法 Optimization method |
优化效果 Optimization effect |
| 氨基酸的替换 Amino acid substitution |
用疏水性或带正电荷的氨基酸替换非活性位点的氨基酸来提高疏水性或增加正电荷数 Replace amino acids at inactive sites with hydrophobic or positively charged amino acids to increase hydrophobicity or positive charge |
提高抗菌活性,增加抗菌谱 Improve antibacterial activity and increase antibacterial spectrum |
| 肽链长度的改变 Changes in peptide chain length |
增加活性氨基酸适当延长肽链或截断非活性区域形成截短肽 Increase the active amino acid to appropriately extend the peptide chain or truncate the inactive region to form the truncated peptide |
提高抗菌活性,调节溶血活性 Improve antibacterial activity and regulate hemolytic activity |
| 抗菌肽的重组杂合 Recombination and heterozygosis of antimicrobial peptides |
将天然抗菌肽的活性区域进行拼接形成杂合抗菌肽或重新设计肽的基因,进行蛋白表达 The active regions of natural antimicrobial peptides were spliced to form heterozygous antimicrobial peptides or redesigned genes of peptide and expressed |
增加生物学活性,提高抗菌活性,降低细胞毒性 Increase biological activity, improve antibacterial activity and reduce cytotoxicity |
| 非完美两亲性肽 Imperfect amphiphilic peptides |
破坏两亲性结构极性面中成对的氨基酸形成非完美两亲性结构 Destroy the paired amino acids in the polar plane of amphiphilic structure to form imperfect amphiphilic structure |
提高抗菌活性,降低细胞毒性 Improve antibacterial activity and reduce cytotoxicity |
| 其他优化方式 Other optimization methods |
将抗菌肽溶液与缓释颗粒包埋形成缓释胶囊抗菌肽 Antibacterial peptide solution and sustained-release granules were embedded to form the sustained-release capsule antimicrobial peptide |
延长作用时间,提高抗菌活性 Prolong the action time and enhance the antibacterial activity |
猪源抗菌肽PMAP-36本身具有广谱的抗菌活性及多种免疫调节活性,其天然、优异的生物学活性受到人们的广泛关注。然而PMAP-36作为小分子多肽,在生物体内的稳定性和安全性依然是限制PMAP-36及其类似物临床应用的一大问题。此外,PMAP-36及其类似物对细菌膜电势、细胞壁通透性、膜内蛋白合成等方面的影响还不清楚,它们杀伤细菌的具体机制还有待研究。
国内外学者通过对PMAP-36氨基酸的替换、肽链的删减及杂合、基因的重组表达及药物递送系统方面的结构优化,设计得到了多条具有高抗菌活性、低毒性和较好体内治疗效果的PMAP-36类似物。除了以上几种方式,未来也有可能尝试利用脂肪酸修饰合成脂肽、运用纳米技术自组装或生物工程材料合成纳米肽。研究表明,脂肪酸修饰是一种改善抗菌肽治疗潜能的有效策略[46]。此外,应用纳米技术改造抗菌肽或者抗菌肽自组装成纳米制剂,可以控制药物在体内的释放、调节肽的化学稳定性、改善肽的代谢能力等[47]。因此,未来对PMAP-36进行脂肪酸的修饰或者合成纳米制剂,是PMAP-36结构优化的新的研究方向。相信通过科研人员的不断努力,一定会设计出安全有效的PMAP-36类似物,使其成为解决抗生素耐药问题的有效制剂。
| [1] |
Wang CH, Hsieh YH, Powers ZM, Kao CY. Defeating antibiotic-resistant bacteria: exploring alternative therapies for a post-antibiotic era[J]. International Journal of Molecular Sciences, 2020, 21(3): 1061. DOI:10.3390/ijms21031061 |
| [2] |
Li B, Zhou XZ, Cheng FS, Wei XJ, Wang WW, Zhang JY. Research progress on analysis and detection techniques of veterinary drug residues in animal foods[J]. Agricultural Biotechnology, 2019, 8(5): 60-64, 69. |
| [3] |
Cižman M, Srovin TP. Antibiotic consumption and resistance of Gram-negative pathogens (collateral damage)[J]. GMS Infectious Diseases, 2018, 6: Doc05. |
| [4] |
Zhen XM, Lundborg CS, Sun XS, Hu XQ, Dong HJ. Economic burden of antibiotic resistance in ESKAPE organisms: a systematic review[J]. Antimicrobial Resistance and Infection Control, 2019, 8: 137. DOI:10.1186/s13756-019-0590-7 |
| [5] |
Liu PF, Du HT. Antimicrobial peptides in pig production and immune-related genes: a review[J]. Feed Research, 2020, 43(1): 110-113. (in Chinese) 刘培峰, 杜海涛. 抗菌肽在猪生产及机体免疫相关基因方面的研究进展[J]. 饲料研究, 2020, 43(1): 110-113. |
| [6] |
Deslouches B, Di YP. Antimicrobial peptides: a potential therapeutic option for surgical site infections[J]. Clinics in Surgery, 2017, 2: 1740. |
| [7] |
Mwangi J, Hao X, Lai R, Zhang ZY. Antimicrobial peptides: new hope in the war against multidrug resistance[J]. Zoological Research, 2019, 40(6): 488-505. DOI:10.24272/j.issn.2095-8137.2019.062 |
| [8] |
Boman HG. Peptide antibiotics and their role in innate immunity[J]. Annual Review of Immunology, 1995, 13: 61-92. DOI:10.1146/annurev.iy.13.040195.000425 |
| [9] |
Sang YM, Blecha F. Porcine host defense peptides: Expanding repertoire and functions[J]. Developmental & Comparative Immunology, 2009, 33(3): 334-343. |
| [10] |
Zanetti M. The role of cathelicidins in the innate host defenses of mammals[J]. Current Issues in Molecular Biology, 2005, 7(2): 179-196. |
| [11] |
Meng DM, Liu QY, Guo YJ, Fan ZC, Yang R, Sheng JP. Research progress on molecular structure and functional characteristics of natural antimicrobial peptides[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(10): 342-350. (in Chinese) 孟德梅, 刘庆艳, 郭雅君, 樊振川, 杨瑞, 生吉萍. 天然抗菌肽的分子结构与功能特性研究进展[J]. 中国食品学报, 2019, 19(10): 342-350. |
| [12] |
Wang C, Liao CS, Niu MF, Guo XL, Chen PY. Molecular design and antibacterial activity determination of Metalnikowin-like antibacterial peptide[J]. Chinese Veterinary Science, 2016, 46(7): 841-846. (in Chinese) 王臣, 廖成水, 牛明福, 郭香玲, 陈溥言. Metalnikowin类抗菌肽MLP的设计及其抗菌活性的测定[J]. 中国兽医科学, 2016, 46(7): 841-846. |
| [13] |
Wang C, Zhang WF, Niu MF, Guo XL, Li DY, Chen PY. Molecular design and antibacterial activity of cecropin-like antibacterial peptide[J]. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(8): 600-604. (in Chinese) 王臣, 张巫凡, 牛明福, 郭香玲, 李德元, 陈溥言. 天蚕素类抗菌肽CLP的设计及其活性测定[J]. 中国预防兽医学报, 2016, 38(8): 600-604. |
| [14] |
Liu ZX, Shen TF, Cai KR, Wang C. Molecular design and antibacterial activity of antimicrobial peptide PMAP-23[J]. Chinese Journal of Preventive Veterinary Medicine, 2020, 42(8): 809-815. (in Chinese) 刘志新, 沈腾飞, 蔡开蕊, 王臣. 猪源抗菌肽PMAP-23的改造及其活性测定[J]. 中国预防兽医学报, 2020, 42(8): 809-815. |
| [15] |
Liu YQ, Shen TF, Chen LL, Zhou JF, Wang C. Analogs of the cathelicidin-derived antimicrobial peptide PMAP-23 exhibit improved stability and antibacterial activity[J]. Probiotics and Antimicrobial Proteins, 2021, 13(1): 273-286. DOI:10.1007/s12602-020-09686-z |
| [16] |
Zhou JF, Liu YQ, Shen TF, Chen LL, Zhang C, Cai KR, Liao CS, Wang C. Antimicrobial activity of the antibacterial peptide PMAP-36 and its analogues[J]. Microbial Pathogenesis, 2019, 136: 103712. DOI:10.1016/j.micpath.2019.103712 |
| [17] |
Liu YQ, Yan ZL, Chai J, Zhou JF, Wang C. Antimicrobial activity of the antibacterial peptide PMAP-GI24 and its analogs[J]. International Journal of Peptide Research and Therapeutics, 2020, 26(4): 2317-2331. DOI:10.1007/s10989-020-10026-6 |
| [18] |
Zhou JF, Liu YQ, Shen TF, Chen LL, Zhang C, Cai KR, Liu ZX, Meng XM, Zhang L, Liao CS, et al. Enhancing the antibacterial activity of PMAP-37 by increasing its hydrophobicity[J]. Chemical Biology & Drug Design, 2019, 94(5): 1986-1999. |
| [19] |
Zhou JF, Chen LL, Liu YQ, Shen TF, Zhang C, Liu ZX, Feng XL, Wang C. Antimicrobial peptide PMAP-37 analogs: Increasing the positive charge to enhance the antibacterial activity of PMAP-37[J]. Journal of Peptide Science, 2019, 25(12): e3220. |
| [20] |
Storici P, Scocchi M, Tossi A, Gennaro R, Zanetti M. Chemical synthesis and biological activity of a novel antibacterial peptide deduced from a pig myeloid cDNA[J]. FEBS Letters, 1994, 337(3): 303-307. DOI:10.1016/0014-5793(94)80214-9 |
| [21] |
Scocchi M, Zelezetsky I, Benincasa M, Gennaro R, Mazzoli A, Tossi A. Structural aspects and biological properties of the cathelicidin PMAP-36[J]. FEBS Journal, 2005, 272(17): 4398-4406. DOI:10.1111/j.1742-4658.2005.04852.x |
| [22] |
Lv YF, Wang JJ, Gao H, Wang ZY, Dong N, Ma QQ, Shan AS. Antimicrobial properties and membrane-active mechanism of a potential α-helical antimicrobial derived from cathelicidin PMAP-36[J]. PLoS One, 2014, 9(1): e86364. DOI:10.1371/journal.pone.0086364 |
| [23] |
Scheenstra MR, Van Den Belt M, Tjeerdsma-Van Bokhoven JLM, Schneider VAF, Ordonez SR, Van Dijk A, Veldhuizen EJA, Haagsman HP. Cathelicidins PMAP-36, LL-37 and CATH-2 are similar peptides with different modes of action[J]. Scientific Reports, 2019, 9(1): 4780. DOI:10.1038/s41598-019-41246-6 |
| [24] |
Wang ZY, Zhang LC, Wang J, Wei DD, Shi BM, Shan AS. Synergistic interaction of PMAP-36 and PRW4 with aminoglycoside antibiotics and their antibacterial mechanism[J]. World Journal of Microbiology and Biotechnology, 2014, 30(12): 3121-3128. DOI:10.1007/s11274-014-1739-4 |
| [25] |
Coorens M, Van Dijk A, Bikker F, Veldhuizen EJA, Haagsman HP. Importance of endosomal cathelicidin degradation to enhance DNA-induced chicken macrophage activation[J]. Journal of Immunology, 2015, 195(8): 3970-3977. DOI:10.4049/jimmunol.1501242 |
| [26] |
Coorens M, Scheenstra MR, Veldhuizen EJA, Haagsman HP. Interspecies cathelicidin comparison reveals divergence in antimicrobial activity, TLR modulation, chemokine induction and regulation of phagocytosis[J]. Scientific Reports, 2017, 7: 40874. DOI:10.1038/srep40874 |
| [27] |
Baumann A, Démoulins T, Python S, Summerfield A. Porcine cathelicidins efficiently complex and deliver nucleic acids to plasmacytoid dendritic cells and can thereby mediate bacteria-induced IFN-α responses[J]. The Journal of Immunology, 2014, 193(1): 364-371. DOI:10.4049/jimmunol.1303219 |
| [28] |
Scapinello S, Brooks AS, Macinnes JI, Hammermueller J, Clark ME, Caswell JL. Bactericidal activity of porcine neutrophil secretions[J]. Veterinary Immunology and Immunopathology, 2011, 139(2/3/4): 113-118. |
| [29] |
Bussalleu E, Sancho S, Briz MD, Yeste M, Bonet S. Do antimicrobial peptides PR-39, PMAP-36 and PMAP-37 have any effect on bacterial growth and quality of liquid-stored boar semen?[J]. Theriogenology, 2017, 89: 235-243. DOI:10.1016/j.theriogenology.2016.11.017 |
| [30] |
Kim WK, Moon JY, Cho JS, Ochirkhuyag E, Akanda MR, Park BY, Hur J. Protective efficacy of an inactivated Brucella abortus vaccine candidate lysed by GI24 against brucellosis in Korean black goats[J]. Canadian Journal of Veterinary Research, 2019, 83(1): 68-74. |
| [31] |
Kim WK, Moon JY, Cho JS, Akanda MR, Park BY, Eo SK, Park SY, Lee JH, Hur J. Brucella abortus lysed cells using GI24 induce robust immune response and provide effective protection in beagles[J]. Pathogens and Disease, 2018, 76(1): ftx124. |
| [32] |
Moon JY, Kim SY, Kim WK, Rao ZL, Park JH, Mun JY, Kim B, Choi HS, Hur J. Protective efficacy of a Salmonella typhimurium ghost vaccine candidate constructed with a recombinant lysozyme-PMAP36 fusion protein in a murine model[J]. Canadian Journal of Veterinary Research, 2017, 81(4): 297-303. |
| [33] |
Zhu M, Wei YC, Jiang S. Structure reformation strategy of antimicrobial peptides[J]. Journal of Liupanshui Normal University, 2019, 31(6): 7-11. (in Chinese) 朱淼, 韦云春, 蒋树. 抗菌肽结构改造研究进展[J]. 六盘水师范学院学报, 2019, 31(6): 7-11. |
| [34] |
Zhong C, Zhu NY, Zhu YW, Liu TQ, Gou SH, Xie JQ, Yao J, Ni JM. Antimicrobial peptides conjugated with fatty acids on the side chain of D-amino acid promises antimicrobial potency against multidrug-resistant bacteria[J]. European Journal of Pharmaceutical Sciences, 2020, 141: 105123. DOI:10.1016/j.ejps.2019.105123 |
| [35] |
Phambu N, Almarwani B, Garcia AM, Hamza NS, Muhsen A, Baidoo JE, Sunda-Meya A. Chain length effect on the structure and stability of antimicrobial peptides of the (RW)n series[J]. Biophysical Chemistry, 2017, 227: 8-13. DOI:10.1016/j.bpc.2017.05.009 |
| [36] |
Lyu YF, Yang Y, Lyu XT, Dong N, Shan AS. Antimicrobial activity, improved cell selectivity and mode of action of short PMAP-36-derived peptides against bacteria and Candida[J]. Scientific Reports, 2016, 6: 27258. DOI:10.1038/srep27258 |
| [37] |
Xu W, Tan TT, Wu D, Shan AS. Design of anti-biofilmn hybrid antimicrobial peptides based on PMAP36 and their biological activity[A]//Proceedings of the 7th Chinese Swine Nutrition Symposium of Animal Nutrition Branch of China Institute of Animal Husbandry and Veterinary Medicine[C]. Chongqing: Chinese Association of Animal Science and Veterinary Medicine, 2015: 167-175 (in Chinese) 徐蔚, 谭婷婷, 吴迪, 单安山. 基于PMAP36的抗生物膜杂合抗菌肽的设计及生物学活性的研究[A]//中国畜牧兽医学会动物营养分会第七届中国猪营养学术研讨会论文集[C]. 重庆: 中国畜牧兽医学会, 2015: 167-175 |
| [38] |
Shan AS, Ma Z, Zhu X. Heterozygosis alpha spiral swine antibacterial peptide, and preparation method and application thereof: CN, CN201610177981.6[P]. 2019-02-01 (in Chinese) 单安山, 马志, 朱鑫. 一种杂合α螺旋型猪源抗菌肽及其制备方法和应用: 中国, CN201610177981.6[P]. 2019-02-01 |
| [39] |
Bi CP, Ma QQ, Zhang LC, Shan AS, Feng XJ, Hu LL. Porcine-derived hybrid antibacterial peptide PP-1 as well as preparation method and application thereof: CN, CN201910629105.6[P]. 2020-04-10 (in Chinese) 毕重朋, 马清泉, 张丽聪, 单安山, 冯兴军, 胡琳琳. 猪源杂合抗菌肽PP-1及其制备方法和应用: 中国, CN201910629105.6[P]. 2020-04-10 |
| [40] |
Ma QQ, Meng QW, Li F, Chen ZH, Shan AS, Zhu JL. Swine derived hybrid antimicrobial peptide MDP-2 and preparation method and application thereof: CN, CN201910629136.1[P]. 2020-04-10 (in Chinese) 马清泉, 孟庆维, 李锋, 陈志辉, 单安山, 朱佳良. 一种猪源衍生杂合抗菌肽MDP-2及其制备方法和应用: 中国, CN201910629136.1[P]. 2020-04-10 |
| [41] |
Wang L, Zhang H, Jia ZQ, Ma QQ, Dong N, Shan AS. In vitro and in vivo activity of the dimer of PMAP-36 expressed in Pichia pastoris[J]. Journal of Molecular Microbiology and Biotechnology, 2014, 24(4): 234-240. DOI:10.1159/000365572 |
| [42] |
Pathak N, Salas-Auvert R, Ruche G, Janna MH, Mccarthy D, Harrison RG. Comparison of the effects of hydrophobicity, amphiphilicity, and alpha-helicity on the activities of antimicrobial peptides[J]. Proteins, 1995, 22(2): 182-186. DOI:10.1002/prot.340220210 |
| [43] |
Wang JJ. Studies on structure-function relationship and protease-resistant activity of imperfectly amphiphilic α-helical peptides[D]. Harbin: Doctoral Dissertation of Northeast Agricultural University, 2019 (in Chinese) 王家俊. 非完美两亲性α-螺旋肽的构效关系及其抗酶解活性的研究[D]. 哈尔滨: 东北农业大学博士学位论文, 2019 |
| [44] |
Zhu X. Study on molecular modification of the PMAP-36 and its mechanism of action[D]. Harbin: Doctoral Dissertation of Northeast Agricultural University, 2015 (in Chinese) 朱鑫. PMAP-36的分子改良及其作用机理的研究[D]. 哈尔滨: 东北农业大学博士学位论文, 2015 |
| [45] |
Zhang L, Zeng HH, Chen R, Zhang ZG. Sustained-release capsule of porcine antimicrobial peptide PMAP-36: CN, CN201810388044.4[P]. 2018-09-21 (in Chinese) 张磊, 曾和华, 陈瑞, 张志刚. 一种猪源抗菌肽PMAP-36缓释胶囊: 中国, CN201810388044.4[P]. 2018-09-21 |
| [46] |
Koh JJ, Lin SM, Beuerman RW, Liu SP. Recent advances in synthetic lipopeptides as anti-microbial agents: designs and synthetic approaches[J]. Amino Acids, 2017, 49(10): 1653-1677. DOI:10.1007/s00726-017-2476-4 |
| [47] |
Sandreschi S, Piras AM, Batoni G, Chiellini F. Perspectives on polymeric nanostructures for the therapeutic application of antimicrobial peptides[J]. Nanomedicine, 2016, 11(13): 1729-1744. DOI:10.2217/nnm-2016-0057 |
 2021, Vol. 48
2021, Vol. 48




