扩展功能
文章信息
- 徐山茸, 龚莉, 储文文, 周多奇
- XU Shanrong, GONG Li, CHU Wenwen, ZHOU Duoqi
- 12周高强度间歇性训练对人体肠道菌群的影响
- Effect of 12 weeks high-intensity interval training on gut microbiota
- 微生物学通报, 2021, 48(4): 1215-1226
- Microbiology China, 2021, 48(4): 1215-1226
- DOI: 10.13344/j.microbiol.china.200676
-
文章历史
- 收稿日期: 2020-07-02
- 接受日期: 2020-08-21
- 网络首发日期: 2020-10-30
2. 安庆师范大学体育学院 安徽 安庆 246133
2. College of Physical Education, Anqing Normal University, Anqing, Anhui 246133, China
人体肠道微生物数量庞大且很难在体外纯培养,它们与机体的密切关系在过去很长一段时间被忽略,后来得益于宏基因组、宏转录组、宏代谢组和16S rRNA基因等高通量测序技术的发展,人们对肠道菌群的研究逐渐深入,发现宿主与肠道菌群互利共生。一方面肠道菌群参与宿主的多种生理活动,对人体健康有着重大影响,肠道菌群的失衡在肥胖、糖尿病等代谢性疾病的发生发展过程中起着重要作用[1-2];另一方面,宿主基因、年龄、饮食等又会反过来影响肠道菌群的结构和组成[3-4],因此,调节肠道菌群可能对疾病有防治作用。随着经济的快速发展,人们生活方式发生改变,静坐少动和不良饮食引发的“三高”人群日益增加且年轻化,超重与肥胖群体急剧增加[5],这是一个严峻的信号,肥胖人群罹患高血压、糖尿病等代谢性综合征的概率比正常人群高[6]。青少年的健康是全球共同关注的话题,加大对青少年身体素质的关注以及找到有效调节肠道菌群的运动处方,或许能为预防和治疗肥胖等代谢性疾病奠定基础。
有氧运动被证明是促进身体健康的一种良好且经济的方式。大量研究表明,有氧运动可以通过提高氧气摄入量加速脂肪燃烧,从而达到减脂降重的功效[7]。在Matsumoto等[8]首次发现运动可以改变小鼠体内肠道菌群结构后,运动成为了影响肠道菌群的新兴环境因素。然而目前运动与肠道菌群的关系在动物体内研究比较多,对人体的研究相对较少,而且以往的研究大多集中在专业运动员及社会人群,研究对象的复杂性(性别、年龄、运动能力)以及运动频率、运动强度的不同,导致研究结果存在一些争议。国外学者发现在大鼠体内,运动可以提高厚壁菌门的丰度[9];然而Evans等发现运动后拟杆菌门的丰度增加,厚壁菌门丰度减少[10]。在人体实验中,Kern等[11]发现运动可以提高肠道菌群多样性,而Taniguchi等[12]却发现运动对肠道菌群多样性和组成没有影响,因此运动与肠道菌群之间的关系需要更多的探讨。高强度间歇性训练(High-Intensity Interval Training,HIIT)作为一种能在短时间内完成且容易坚持的运动方式,具有与传统有氧训练相同甚至更好的生理效果[13],也是目前有效提高心肺耐力和改善健康的有氧训练方法之一[14]。在小鼠体内发现HIIT对肠道菌群具有不同影响[15-16],但鲜有研究报道HIIT对人体肠道菌群的影响。
本研究将探讨HIIT是否可以有效改变人体肠道菌群的结构组成,从而为全民体质健康及运动干预治疗肠道菌群相关疾病提供理论基础。
1 材料与方法 1.1 研究对象 1.1.1 实验对象招募68名在校非体育专业大学生为研究对象,所有研究对象对实验内容知情同意,均完成了运动风险筛查问卷调查、体力活动问卷、身体活动危险性检查表、膳食调查问卷。实验得到伦理道德委员会批准。
1.1.2 筛选标准无规律运动,无严重传染病史,无肢体缺陷,无精神疾病,无严重器质性病变,至少一个月内未使用抗生素和抗腹泻药物。
1.1.3 志愿者基本信息68位志愿者完成了为期12周的高强度间歇性训练,其中男生28人,女生40人,见表 1。
| 性别 Gender |
人数 Number |
年龄 Age (years old) |
身高 Height (cm) |
体重 Weight (kg) |
| Boy | 28 | 20.00±0.94 | 176.21±5.72 | 70.51±10.19 |
| Girl | 40 | 20.33±1.16 | 161.08±5.68 | 53.27±6.70 |
Phusion High-Fidelity PCR Master Mix,NEB公司;PowerMax试剂盒,MO BIO Laboratories公司;Agencourt AMPure XP 60 mL Kit,Beckman Coulter公司;Axygen Gel Extraction Kit (250),Axygen公司;Qubit dsDNA HS Assay Kit,Life Technologies公司;Library Quant Kit Illumina GA Revised Primers-SYBR Fast Universal,KAPA公司;HiSeq 3000/4000 SBS Kit (300 cycle),Illumina公司。荧光定量PCR仪,Eppendorf公司;NanoDrop 2000C,Thermo公司;PCR仪,BIOER公司;凝胶成像系统,Bio-Rad公司;Qubit 2.0,Life Technologies公司;核酸分析仪,Agilent公司;高通量测序仪,Illumina公司。
1.3 方法 1.3.1 运动干预方案运动干预采用为期12周,每周3次每次28 min的高强度间歇性训练方案[14],分适应和提高2个阶段。适应阶段(1-4周):第1周受试者进行56组× 15 s间歇跑(在28 min的训练时间里进行15 s跑走交替的间歇训练),即受试者先进行15 s强度为90%-95% HRmax [心率大约为(180-190)±5 bpm]的跑步后,再进行15 s强度为70% HRmax (心率大约为140±6 bpm)的快走间歇,共计56组;第2周调整为28 min的30 s跑走交替的间歇训练;第3周调整为28 min的1 min跑走交替的间歇训练;第4周调整为28 min的2 min跑走交替的间歇训练。提高阶段(5-12周):进行4组×4 min间歇跑,即受试者先进行4 min强度为90%-95% HRmax [心率大约为(180-190)±5 bpm]的跑步后,再进行3 min强度为70% HRmax (140±6 bpm)的慢跑间歇,共计4组。每次训练开始前受试者先在操场进行10 min慢跑热身,热身结束后开始正式训练。每次训练结束后受试者进行3 min慢跑的积极休息,心率控制在70% HRmax (心率大约为140±6 bpm)。
受试者最大心率HRmax=196.86-0.74×年龄[17]。为受试者佩戴Polar表对训练过程进行心率实时监测,确保训练的安全性和有效性。
1.3.2 粪便DNA提取和16S rRNA基因扩增子测序事先对研究人员和受试者进行相关培训并告知注意事项,志愿者在运动前后使用采样器各采集一次新鲜粪便样本,做好标记常温保存。采用SDS裂解液冻融法通过PowerMax试剂盒提取粪便总DNA,在-20 ℃储存。采用NanoDrop 2000C分光光度计测定DNA的数量和质量。
16S rRNA基因作为可以对细菌进行种属鉴定的序列,包括10个保守区域和9个高变区域,高变区域可以体现细菌间的差异。本研究选择V4变异区的正向引物515F (5′-GTGCCAGCMGCCGCG GTAA-3′)和反向引物806R (5′-GGACTACHVGGG TWTCTAAT-3′)进行PCR扩增。PCR反应体系(50 μL):Phusion High-Fidelity PCR Master Mix with HF Buffer 25 μL,515F和806R引物(10 μmol/L)各3 μL,DNA模板10 μL,DMSO 3 μL,ddH2O 6 μL。PCR反应条件:98 ℃ 30 s;98 ℃ 15 s,58 ℃ 15 s,72 ℃ 15 s,25个循环;72 ℃ 1 min。得到的PCR扩增产物用Agencourt AMPure XP 60 mL Kit纯化,并使用Qubit dsDNA HS Assay Kit进行量化,最后使用Illlumina HiSeq 4000双末端(Pair-End) 2×150 bp平台进行测序。
1.3.3 高通量测序数据处理及生物信息学分析根据Barcode序列和引物序列把下机数据拆分为各个样本的数据。截去Barcode和引物序列后,使用VSEARCH V2.4.4对每个样品的Reads进行拼接,得到原始Tags数据(Raw Tags)。在此基础上对序列质量进行质控、过滤、去除嵌合体序列,得到有效数据,以97%的相似度进行OTU聚类和物种注释。根据聚类结果,使用QIIME和R软件,基于R包“Venn Diagram”生成韦恩图,比较不同组之间共有和特有的OTU数目;基于QIIME计算α多样性的值,采用R中的t test函数和Ape包进行组间香农-威纳指数(Shannon指数)比较并绘制主坐标分析(Principal Co-Ordinates Analysis,PCoA)图,对运动前后微生物群落结构进行显著性分析;不同分类水平的组间物种构成丰度图使用R包Barplot函数;组间差异物种使用LEfSe默认设置进行各组间分类单位上的检测。
1.3.4 统计学分析使用SPSS 19.0软件对数据进行差异性分析。符合正态分布的数据,描述采用均值±标准差表示,不符合正态分布的数据则采用M (P25,P75)表示;运动前后指标采用秩和检验或配对样本t检验。
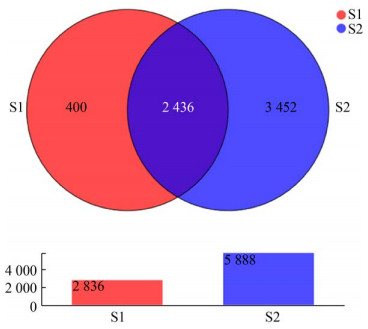
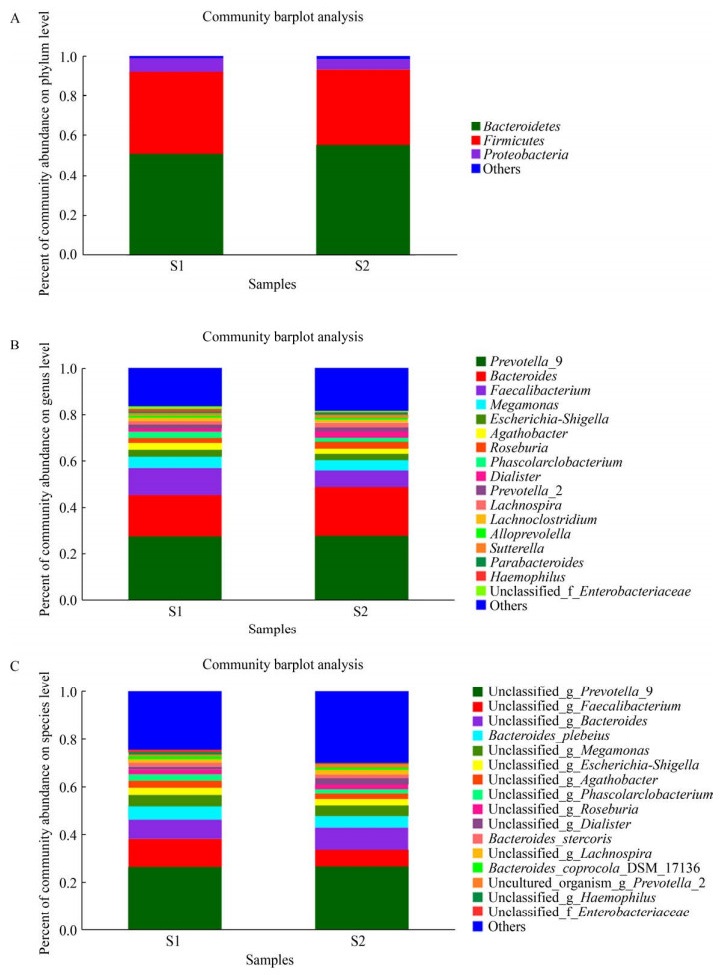
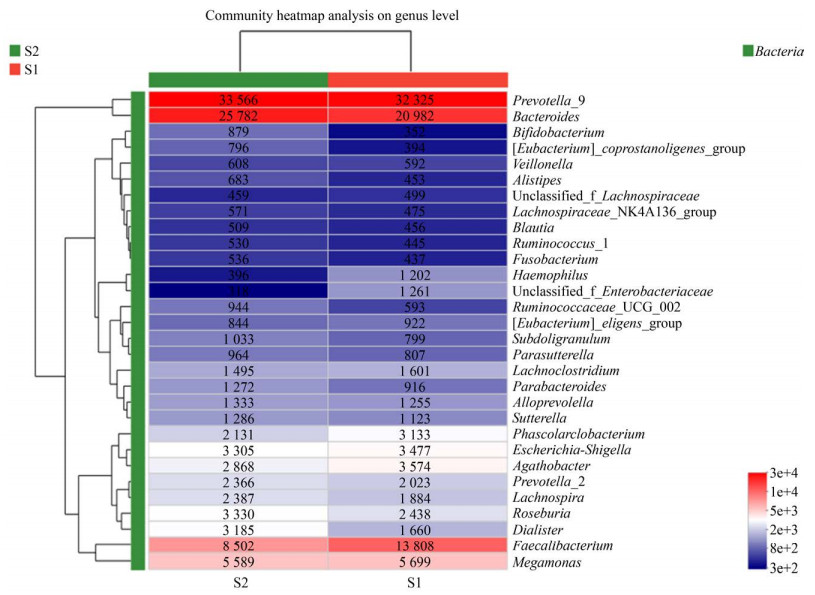
2 结果与分析 2.1 运动前后总体变化 2.1.1 运动前后肠道菌群物种组成丰度分析对136个样本进行测序,统计运动前后OTU数目以及分析运动前后2组的优势菌,Venn图可以展示不同组之间共有和差异OTU数目。由图 1可知,运动前OTU数目为2 836,运动后数目为5 888,共有数目为2 436,运动后OTU数目明显增加,提示运动可以提高物种丰富度。图 2显示运动前后各水平上优势菌是一样的,主要都由拟杆菌门、厚壁菌门和变形菌门组成,这提示运动不会对肠道菌群整体大结构产生影响,但是运动后拟杆菌门丰度提高,厚壁菌门和变形菌门的丰度降低,说明运动对肠道菌群具有调节作用,这与Morita等[18]的研究结果一致。为了了解组间及属水平上的群落构成相似性,选取丰度排名前30的属进行聚类分析,如图 3所示,在属水平上运动前后肠道菌群的物种丰度差异较大,需要对运动前后2组样本进一步分析。
|
| 图 1 运动前后的韦恩图 Figure 1 Venn before exercise and after exercise 注:S1:运动前;S2:运动后。下同 Note: S1: Before exercise; S2: After exercise. The same below |
|
|
|
| 图 2 在门水平(A)、属水平(B)、和种水平(C)的组间物种构成丰度图 Figure 2 Percent of community abundance on phylum level (A), genus level (B), and species level (C) |
|
|
|
| 图 3 属水平物种丰度聚类热图 Figure 3 Community heatmap analysis on genus level |
|
|
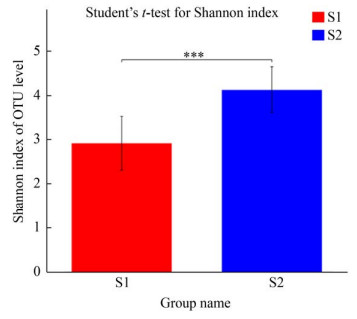
人体内微生物的多样性可以用其丰富度和均匀度来描述,即α多样性和β多样性,有研究表明物种多样性与表型健康呈正相关[19]。为分析运动前后OTU组成的差异,本研究进行了香农-威纳指数和主坐标分析。Shannon指数综合考虑了群落的丰富度和均匀度,通过对运动前后Shannon指数进行t检验发现,如图 4所示,运动后肠道菌群多样性提高。图 5是基于距离矩阵构建的PCoA,根据运动前后2组样本在二维坐标的距离远近反映样本组成结构的相似性,可知运动前后2组样本之间有明显区分。这提示运动前后肠道菌群的OTU组成差异比较大。
|
| 图 4 Shannon指数组间差异 Figure 4 The difference of Shannon index Note: ***: P≤0.001 |
|
|
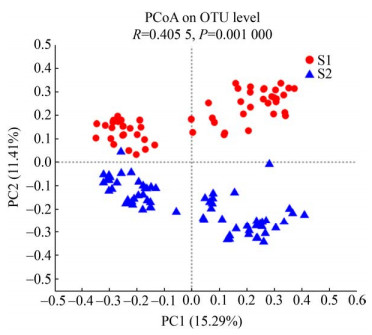
|
| 图 5 肠道菌群的主坐标分析图 Figure 5 PCoA of Human gut microbiota |
|
|
为了探索运动前后的差异物种,对运动前后物种进行LEfSe分析,图 6中不同颜色代表不同组之间的显著差异物种,其中显著差异的Logarithmic LDA Score设为2,值越大差异越显著,结果如图 6所示,运动前后在科、目、属水平上均存在显著差异的物种,运动前属水平上Faecalibacterium、Unclassified-f-Enterobacteriaceae、Lactobacillus、Unclassified-f-Pasteurellaceae、Acinetobacter和目水平上Enterobacteriales、Pseudomonadales及科水平上Enterobacteriaceae、Lactobacillaceae、Moraxellaceae丰度显著高于运动后;运动后属水平上Ruminococcaceae-UCG-014、Eubacterium-ruminantium-group、Lachnospiraceae- UCG-010、Tyzzerella-3、Unclassified-o-Bacteroidales和科水平上Unclassified-o-Bacteroidales的丰度显著提高。以往有研究报道,运动后显著增加的Ruminococcaceae-UCG-014与焦虑症呈负相关[20],Lachnospiraceae能产生对人体有益的丁酸类物质从而降低结肠癌的患病几率[21]。运动能调节肠道菌群结构,提示或许可以通过运动改善肠道菌群引起的相关疾病。
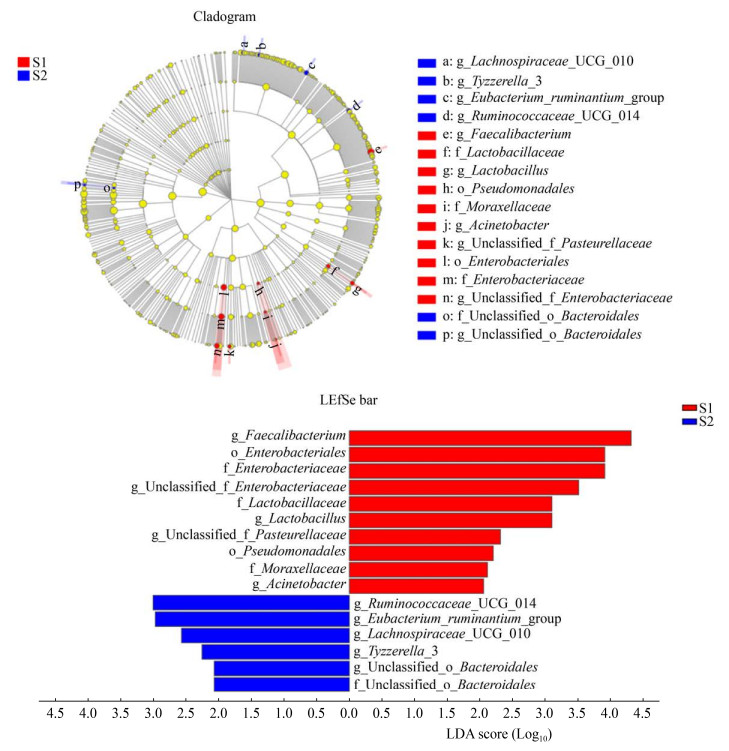
|
| 图 6 LEfSe及LDA值分布柱状图 Figure 6 LEfSe and LDA score |
|
|
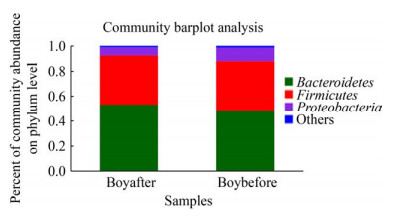
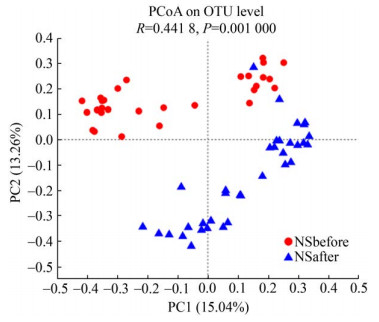
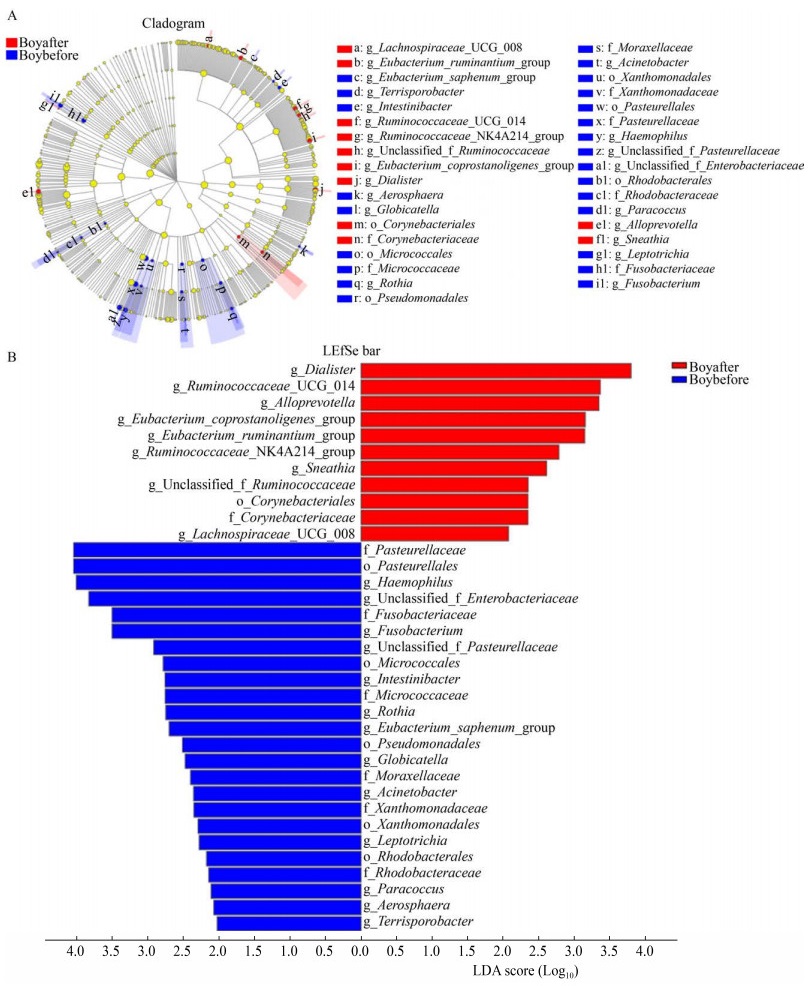
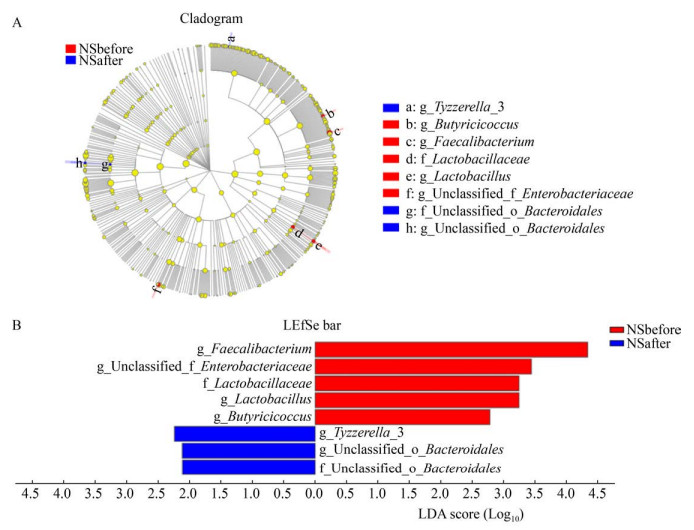
研究发现12周高强度间歇性训练对男生和女生肠道菌群的调节效果有所差异。如图 7、图 8所示,男女生组在门水平上物种组成结构大体相同,但运动后丰度变化具有差异,男生组运动后拟杆菌门丰度的增加比女生组高,而女生组运动后放线菌门丰度的增加比男生组多。女生组运动前后α多样性指数和β多样性指数均显著变化,如图 9、图 10所示,女生组运动前后在OTU水平上PCoA成两个簇集,运动后Shannon指数显著提高,这与国外学者研究结果[22]一致。然而由图 11、图 12可知,男生组差异物种比女生组多,运动对男生组有较好的调节作用。整体来说运动对男女生肠道菌群有不同效果,这种差异可能是由于男生样本量少以及男女生对训练的适应程度不同所导致。
|
| 图 7 男生组门水平物种构成丰度图 Figure 7 Boys percent of community abundance on phylum level 注:Boybefore:男生运动前;Boyafter:男生运动后 Note: Boybefore: Boys before exercise; Boyafter: Boys after exercise |
|
|

|
| 图 8 女生组门水平物种构成丰度图 Figure 8 Girls percent of community abundance on phylum level 注:NSbefore:女生运动前,NSafter:女生运动后 Note: NSbefore: Girls before exercise; NSafter: Girls after exercise |
|
|
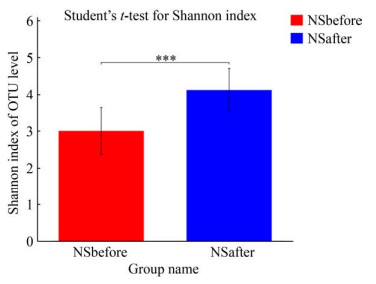
|
| 图 9 女生组Shannon指数差异 Figure 9 Girls difference of Shannon index Note: ***: P≤0.001 |
|
|
|
| 图 10 女生组主坐标分析图 Figure 10 PCoA of girls |
|
|
|
| 图 11 运动前后男生组LEfSe (A)及LDA (B)值分布柱状图 Figure 11 LEfSe (A) and LDA (B) score of boys |
|
|
|
| 图 12 运动前后女生组LEfSe (A)及LDA (B)值分布柱状图 Figure 12 LEfSe (A) and LDA (B) score of girls |
|
|
通过12周高强度间歇性训练的研究发现,运动前后肠道菌群结构存在显著差异,运动后有益菌增加且有害菌减少,其中拟杆菌丰度增加、厚壁菌丰度降低,且拟杆菌丰度高于厚壁菌,这与Morita等[18]研究结果一致,以往研究表明厚壁菌及厚壁菌/拟杆菌比值的增加与肥胖呈正相关[23]。同时运动还显著提升了肠道菌群多样性,这与Kern等[11]的一项随机运动实验及国内学者[24]中强度有氧运动实验可以增加肠道菌群多样性的结果一致,也有研究表示运动对肠道微生物的多样性和组成没有明显的影响[12],但是运动后属水平上Ruminococcus的丰度提高[25],这与本课题组实验结果相同。运动后Enterobacteriales、Pasteurellaceae、Pseudomonadales、Moraxellaceae、Acinetobacter、Faecalibacterium、Lactobacillaceae丰度显著降低,Ruminococcaceae-UCG-014、Eubacterium- ruminantium-group、Lachnospiraceae-UCG-010、Tyzzerella-3、Bacteroidales丰度增加,这与国外学者[26-27]发现运动导致Lachnospiraceae丰度提高、Enterobacteriaceae和Enterobacteriales丰度降低的研究结果一致。其中,Enterobacteriales的富集会增加肠道通透性从而导致代谢性疾病[28];Lachnospiraceae能产生对人体有益的丁酸类物质从而降低结肠癌的患病几率[21];在腹泻儿童体内,Lachnospiraceae减少,而Enterobacteriaceae和Moraxellaceae增多[29]。Campbell等[27]研究发现运动后Faecalibacterium这一有益菌丰度增加,而本实验表明运动后Faecalibacterium这一有益菌丰度降低。另外,Moraxellaceae和Acinetobacter与喉气管狭窄存在联系[30],Ruminococcaceae-UCG-014增加会减轻焦虑症状况[20]。本实验发现运动前后菌群丰度和结构具有明显差异,运动可以调节肠道菌群,这提示运动可能成为防治肠道菌群相关疾病的靶点。实验结果的不一致可能与运动频率、运动强度甚至受试人群的差异以及样本量有关,有研究对半程马拉松和全程马拉松运动员肠道菌群测序发现菌群变化不一致[31-32];Liu等[33]的研究发现对同种疾病患者进行运动干预,运动响应者和非响应者的肠道微生物变化具有差异;另外有研究表明,虽然运动对肠道菌群有调控作用,但是运动结束6周后肠道菌群便恢复基线水平[34],提示以后可能需要对运动结束一段时间后的肠道微生物做更多监测,将有助于全面了解运动对肠道菌群的调节效果并制定更适宜的运动处方。
尽管目前因为运动处方的不同对肠道菌群的影响也有所不同,但总体来说运动对肠道菌群结构有积极的改善作用。本研究证明了HIIT这种高效有益的运动方式可以显著提高肠道菌群多样性及丰度,增加有益菌群,对肠道菌群的结构组成有明显的调节作用。本研究可以让人们更多地了解运动及肠道菌群,如果运动可以作为预防和改善肠道菌群相关疾病的有效方法将运动科学与生命科学结合,不仅可以帮助患者减轻经济及身心压力,还将为全民体质健康做出贡献。由于本文研究对象是在校非体育专业大学生,受试者单一样本量较少且运动时间只有3个月,鉴于不同疾病菌群改变有所差异以及个体间运动响应的不同,期望未来可以对不同群体进行运动与肠道菌群关系的研究,根据不同疾病及个体差异制定出有针对性的运动处方。
致谢: 特别感谢杭州谷禾信息技术有限公司所有工作人员在肠道微生物测序及分析上所做的重要工作。| [1] |
Ussar S, Griffin NW, Bezy O, Fujisaka S, Vienberg S, Softic S, Deng LX, Bry L, Gordon JI, Kahn CR. Interactions between gut microbiota, host genetics and diet modulate the predisposition to obesity and metabolic syndrome[J]. Cell Metabolism, 2015, 22(3): 516-530. DOI:10.1016/j.cmet.2015.07.007 |
| [2] |
Harsch IA, Konturek PC. The role of gut microbiota in obesity and Type 2 and Type 1 diabetes mellitus: New insights into "Old" diseases[J]. Medical Sciences, 2018, 6(2): 32. DOI:10.3390/medsci6020032 |
| [3] |
Bonder MJ, Kurilshikov A, Tigchelaar EF, Mujagic Z, Imhann F, Vila AV, Deelen P, Vatanen T, Schirmer M, Smeekens SP, et al. The effect of host genetics on the gut microbiome[J]. Nature Genetics, 2016, 48(11): 1407-1412. DOI:10.1038/ng.3663 |
| [4] |
David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, Ling AV, Devlin AS, Varma Y, Fischbach MA, et al. Diet rapidly and reproducibly alters the human gut microbiome[J]. Nature, 2014, 505(7484): 559-563. DOI:10.1038/nature12820 |
| [5] |
Ng M, Fleming T, Robinson M, Thomson B, Graetz N, Margono C, Mullany EC, Biryukov S, Abbafati C, Abera SF, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: A systematic analysis for the Global Burden of Disease Study 2013[J]. The Lancet, 2014, 384(9945): 766-781. DOI:10.1016/S0140-6736(14)60460-8 |
| [6] |
Mokdad AH, Ford ES, Bowman BA, Dietz WH, Vinicor F, Bales VS, Marks JS. Prevalence of obesity, diabetes, and obesity-related health risk factors, 2001[J]. JAMA, 2003, 289(1): 76-79. DOI:10.1001/jama.289.1.76 |
| [7] |
Stoner L, Rowlands D, Morrison A, Credeur D, Hamlin M, Gaffney K, Lambrick D, Matheson A. Efficacy of exercise intervention for weight loss in overweight and obese adolescents: meta-analysis and implications[J]. Sports Medicine, 2016, 46(11): 1737-1751. DOI:10.1007/s40279-016-0537-6 |
| [8] |
Matsumoto M, Inoue R, Tsukahara T, Ushida K, Chiji H, Matsubara N, Hara H. Voluntary running exercise alters microbiota composition and increases n-butyrate concentration in the rat cecum[J]. Bioscience, Biotechnology, and Biochemistry, 2008, 72(2): 572-576. DOI:10.1271/bbb.70474 |
| [9] |
Choi JJ, Eum SY, Rampersaud E, Daunert S, Abreu MT, Toborek M. Exercise attenuates PCB-induced changes in the mouse gut microbiome[J]. Environmental Health Perspectives, 2013, 121(6): 725-730. DOI:10.1289/ehp.1306534 |
| [10] |
Evans CC, LePard KJ, Kwak JW, Stancukas MC, Laskowski S, Dougherty J, Moulton L, Glawe A, Wang YW, Leone V, et al. Exercise prevents weight gain and alters the gut microbiota in a mouse model of high fat diet-induced obesity[J]. PLoS One, 2014, 9(3): e92193. DOI:10.1371/journal.pone.0092193 |
| [11] |
Kern T, Blond MB, Hansen TH, Rosenkilde M, Quist JS, Gram AS, Ekstrøm CT, Hansen T, Stallknecht B. Structured exercise alters the gut microbiota in humans with overweight and obesity-A randomized controlled trial[J]. International Journal of Obesity, 2020, 44(1): 125-135. DOI:10.1038/s41366-019-0440-y |
| [12] |
Taniguchi H, Tanisawa K, Sun XM, Kubo T, Hoshino Y, Hosokawa M, Takeyama H, Higuchi M. Effects of short-term endurance exercise on gut microbiota in elderly men[J]. Physiological Reports, 2018, 6(23): e13935. DOI:10.14814/phy2.13935 |
| [13] |
Zhang G. High-intensity interval training: Research progress of exercise quantity and exercise effect[J]. Chinese Journal of Sports Medicine, 2016, 35(2): 184-188, 183. (in Chinese) 张戈. 高强度间歇训练: 运动量和锻炼效果研究进展[J]. 中国运动医学杂志, 2016, 35(2): 184-188, 183. |
| [14] |
Helgerud J, Høydal K, Wang E, Karlsen T, Berg P, Bjerkaas M, Simonsen T, Helgesen C, Hjorth N, Bach R, et al. Aerobic high-intensity intervals improve 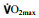 more than moderate training[J]. Medicine & Science in Sports & Exercise, 2007, 39(4): 665-671. more than moderate training[J]. Medicine & Science in Sports & Exercise, 2007, 39(4): 665-671. |
| [15] |
Maillard F, Vazeille E, Sauvanet P, Sirvent P, Combaret L, Sourdrille A, Chavanelle V, Bonnet R, Otero YF, Delcros G, et al. High intensity interval training promotes total and visceral fat mass loss in obese Zucker rats without modulating gut microbiota[J]. PLoS One, 2019, 14(4): e0214660. DOI:10.1371/journal.pone.0214660 |
| [16] |
Denou E, Marcinko K, Surette MG, Steinberg GR, Schertzer JD. High-intensity exercise training increases the diversity and metabolic capacity of the mouse distal gut microbiota during diet-induced obesity[J]. American Journal of Physiology-Endocrinology and Metabolism, 2016, 310(11): E982-E993. DOI:10.1152/ajpendo.00537.2015 |
| [17] |
Wang K, Zhang MJ, Gou B, Wang CP. The empirical research on HRmax and ATHR calculation formulas of healthy adults without regular exercise[J]. Journal of Xi'an Physical Education University, 2017, 34(6): 714-720, 768. (in Chinese) 王琨, 张明军, 苟波, 王翠萍. 无锻炼规律健康成年人最大心率与无氧阈心率推算公式的实证研究[J]. 西安体育学院学报, 2017, 34(6): 714-720, 768. |
| [18] |
Morita E, Yokoyama H, Imai D, Takeda R, Ota A, Kawai E, Hisada T, Emoto M, Suzuki Y, Okazaki K. Aerobic exercise training with brisk walking increases intestinal Bacteroides in healthy elderly women[J]. Nutrients, 2019, 11(4): 868. DOI:10.3390/nu11040868 |
| [19] |
Fabbiano S, Suárez-Zamorano N, Chevalier C, Lazarević V, Kieser S, Rigo D, Leo S, Veyrat-Durebex C, Gaïa N, Maresca M, et al. Functional gut microbiota remodeling contributes to the caloric restriction-induced metabolic improvements[J]. Cell Metabolism, 2018, 28(6): 907-921.e7. DOI:10.1016/j.cmet.2018.08.005 |
| [20] |
Chen YH, Bai J, Wu D, Yu SF, Qiang XL, Bai H, Wang HN, Peng ZW. Association between fecal microbiota and generalized anxiety disorder: Severity and early treatment response[J]. Journal of Affective Disorders, 2019, 259: 56-66. DOI:10.1016/j.jad.2019.08.014 |
| [21] |
Jiang XY, Zhao X, Zou LY, Pu XY. Moderate exercise induces shift in the composition of human gut microbiota[J]. Journal of Third Military Medical University, 2017, 39(18): 1824-1831. (in Chinese) 蒋兴宇, 赵霞, 邹凌云, 蒲晓允. 适度运动对人体肠道菌群结构的影响[J]. 第三军医大学学报, 2017, 39(18): 1824-1831. |
| [22] |
De La Cuesta-Zuluaga J, Kelley ST, Chen YF, Escobar JS, Mueller NT, Ley RE, McDonald D, Huang S, Swafford AD, Knight R, et al. Age- and sex-dependent patterns of gut microbial diversity in human adults[J]. MSystems, 2019, 4(4): e00261-19. |
| [23] |
Mitev K, Taleski V. Association between the gut microbiota and obesity[J]. Open Access Macedonian Journal of Medical Sciences, 2019, 7(12): 2050-2056. DOI:10.3889/oamjms.2019.586 |
| [24] |
Suo MH. Effects of 8 weeks aerobic exercise on serum inflammatory cytokines and gut microbiota in young obese volunteers[D]. Jinan: Master's Thesis of Shandong Sports Institute, 2018 (in Chinese) 索美华. 8周有氧运动对青年肥胖者部分血清炎性因子的调节作用及对其肠道菌群的影响[D]. 济南: 山东体育学院硕士学位论文, 2018 |
| [25] |
Zhou YJ, Mihindukulasuriya KA, Gao HY, La Rosa PS, Wylie KM, Martin JC, Kota K, Shannon WD, Mitreva M, Sodergren E, et al. Exploration of bacterial community classes in major human habitats[J]. Genome Biology, 2014, 15(5): R66. DOI:10.1186/gb-2014-15-5-r66 |
| [26] |
Whisner CM, Maldonado J, Dente B, Krajmalnik-Brown R, Bruening M. Diet, physical activity and screen time but not body mass index are associated with the gut microbiome of a diverse cohort of college students living in university housing: a cross-sectional study[J]. BMC Microbiology, 2018, 18(1): 210. DOI:10.1186/s12866-018-1362-x |
| [27] |
Campbell SC, Wisniewski PJ, Noji M, McGuinness LR, Häggblom MM, Lightfoot SA, Joseph LB, Kerkhof LJ. The effect of diet and exercise on intestinal integrity and microbial diversity in mice[J]. PLoS One, 2016, 11(3): e0150502. DOI:10.1371/journal.pone.0150502 |
| [28] |
Pedersen C, Ijaz UZ, Gallagher E, Horton F, Ellis RJ, Jaiyeola E, Duparc T, Russell-Jones D, Hinton P, Cani PD, et al. Fecal Enterobacteriales enrichment is associated with increased in vivo intestinal permeability in humans[J]. Physiological Reports, 2018, 6(7): e13649. DOI:10.14814/phy2.13649 |
| [29] |
Castro-Mejía JL, O'Ferrall S, Krych Ł, O'Mahony E, Namusoke H, Lanyero B, Kot W, Nabukeera-Barungi N, Michaelsen KF, Mølgaard C, et al. Restitution of gut microbiota in Ugandan children administered with probiotics (Lactobacillus rhamnosus GG and Bifidobacterium animalis subsp. lactis BB-12) during treatment for severe acute malnutrition[J]. Gut Microbes, 2020, 11(4): 855-867. DOI:10.1080/19490976.2020.1712982 |
| [30] |
Hillel AT, Tang SS, Carlos C, Skarlupka JH, Gowda M, Yin LX, Motz K, Currie CR, Suen G, Thibeault SL. Laryngotracheal microbiota in adult laryngotracheal stenosis[J]. mSphere, 2019, 4(3): e00211-e00219. |
| [31] |
Zhao X, Zhang ZJ, Hu B, Huang W, Yuan C, Zou LY. Response of gut microbiota to metabolite changes induced by endurance exercise[J]. Frontiers in Microbiology, 2018, 9: 765. DOI:10.3389/fmicb.2018.00765 |
| [32] |
Scheiman J, Luber JM, Chavkin TA, MacDonald T, Tung A, Pham LD, Wibowo MC, Wurth RC, Punthambaker S, Tierney BT, et al. Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism[J]. Nature Medicine, 2019, 25(7): 1104-1109. DOI:10.1038/s41591-019-0485-4 |
| [33] |
Liu Y, Wang Y, Ni YQ, Cheung CKY, Lam KSL, Wang Y, Xia ZY, Ye DW, Guo J, Tse MA, et al. Gut Microbiome fermentation determines the efficacy of exercise for diabetes prevention[J]. Cell Metabolism, 2020, 31(1): 77-91.e5. DOI:10.1016/j.cmet.2019.11.001 |
| [34] |
Allen JM, Mailing LJ, Niemiro GM, Moore R, Cook MD, White BA, Holscher HD, Woods JA. Exercise alters gut microbiota composition and function in lean and obese humans[J]. Medicine & Science in Sports & Exercise, 2018, 50(4): 747-757. |
 2021, Vol. 48
2021, Vol. 48




