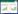扩展功能
文章信息
- 陈骐, 刘书渊, 杨晓暾, 万俊, 徐媛媛, 姚玥, 郑好轸, 葛立军
- CHEN Qi, LIU Shuyuan, YANG Xiaotun, WAN Jun, XU Yuanyuan, YAO Yue, Hojin JEONG, GE Lijun
- 红色红曲霉Mr-1的次级代谢产物生物活性成分分析
- Bioactive components of secondary metabolites from Monascus ruber Mr-1
- 微生物学通报, 2021, 48(3): 787-796
- Microbiology China, 2021, 48(3): 787-796
- DOI: 10.13344/j.microbiol.china.200900
-
文章历史
- 收稿日期: 2020-09-08
- 接受日期: 2020-10-19
- 网络首发日期: 2020-12-11
2. 佛山市真红生物制品有限公司 广东 佛山 528200
2. Foshan Zhen Hong Biological Products Company Limited, Foshan, Guangdong 528200, China
红曲霉(Monascus)是一类小型的丝状真菌,在中国、日本、泰国、菲律宾和印度尼西亚等东南亚国家被广泛应用,已有超千年的历史[1]。在中国的闽浙等地区,人们将红曲霉接种于蒸煮的大米上,利用固态发酵生产红曲米。根据Ainsworth真菌分类系统,红曲霉属于真菌界(Eumycete)真菌门(Eumycophyta)子囊菌亚门(Ascomycotina)不整囊菌纲(Plectomycetes)散囊菌目(Eurotiales)红曲菌科(Monascaceae)红曲霉属(Monascus)[2]。目前已被广泛接受的红曲霉属有9种,包括红色红曲霉(M. ruber)、紫色红曲霉(M. purpureus)、烟色红曲霉(M. fuliginosus)、安卡红曲霉(M. anka)、从毛红曲霉(M. pilosus)等[3]。现代研究发现红曲霉中富含多种酶类、红曲多糖、洛伐他汀(Lovastatin)、γ-氨基丁酸、二聚酸和红曲色素(Monascus Pigments,MPs)等[4-7]成分,具有抗氧化[8]、降血脂[9]、抑菌[10]、抗肿瘤[11]、降血糖[12]等功能。
我们对已发表的研究报道进行总结分析,发现红曲霉目前的研究主要集中在高产Lovastatin和MPs的菌株筛选、发酵工艺条件的优化和提取物生物活性的测定等方面,而对于红曲霉次级代谢产物中化学成分的报道却很少。为了进一步阐明红曲霉中的药效物质基础,本研究以自主筛选的红色红曲霉(Monascus ruber) Mr-1为研究对象,对其发酵液中的次级代谢产物进行分离和纯化,并对鉴定的化合物进行体外抗氧化、抑菌和抑制降血糖相关的α-葡萄糖苷酶活性研究,以期获得更多以红曲霉为来源的特殊活性成分,为将来对红曲霉资源大规模的开发与应用提供科学的理论依据。
1 材料与方法 1.1 材料 1.1.1 发酵菌株和供试病原菌发酵菌株是由本实验室自主筛选保藏的红色红曲霉(M. ruber) Mr-1菌株。供试病原菌为金黄色葡萄球菌(Staphylococcus aureus,ATCC 6538)和李斯特菌(Listeria monocytogenes,ATCC 19115),均购买于广东省微生物菌种保藏中心,现保藏于浙江中医药大学发酵工程实验室。
1.1.2 培养基LB培养基(g/L):胰蛋白胨10.0,酵母粉5.0,NaCl 10.0,pH 7.0。1×105 Pa高压灭菌20 min,备用。
PDA培养基(g/L):葡萄糖20.0,土豆200.0,琼脂糖20.0。1×105 Pa高压灭菌20 min,备用。
PD培养基(g/L):葡萄糖20.0,土豆200.0。1×105 Pa高压灭菌20 min,备用。
1.1.3 主要试剂和仪器2, 2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐(ABTS)、1, 1-二苯基-2-三硝基苯肼(DPPH)、阿卡波糖(Acarbose)和4-硝基苯基-α-D吡喃葡萄糖苷(pNPG),上海阿拉丁生化科技股份有限公司;α-葡萄糖苷酶,上海源叶生物科技有限公司。恒温培养箱,上海一恒科学仪器有限公司;液-质联用仪,Waters公司;核磁共振波谱仪,Bruker公司;紫外分光光度计,岛津公司。
1.2 红色红曲霉Mr-1的发酵培养将冷冻保藏的红色红曲霉Mr-1菌株取出至室温解冻,将解冻后的菌株用PDA培养基平板接种进行活化培养,28 ℃培养7 d。将活化好的红色红曲霉Mr-1菌株接种于装有50 mL PD液体培养液的250 mL三角锥形瓶中,28 ℃、160 r/min培养3 d得到种子液。将种子液转接到装有300 mL PD液体培养液的1 L三角锥形瓶中,28 ℃、160 r/min培养7 d即得红曲霉发酵液。
1.3 红色红曲霉Mr-1次级代谢产物的提取将红曲霉发酵液90 L用2−3层纱布过滤获得滤液,用乙酸乙酯进行萃取。将滤液与乙酸乙酯以1:2的体积比混合,用搅拌机搅拌30 min后静置,取萃取的上清液。反复萃取3次,合并所得萃取液进行减压浓缩,获得乙酸乙酯粗浸膏约38 g。
1.4 红色红曲霉Mr-1次级代谢产物的分离纯化与鉴定将乙酸乙酯粗浸膏用甲醇溶解后与硅胶(200−300目)等比例混匀拌样,以石油醚: 乙酸乙酯(20:1−0:100,体积比)、乙酸乙酯: 甲醇(20:1−20:5,体积比)梯度洗脱,通过薄层层析进行组分分析,共得到7个组分Fr.1 (3.1 g)、Fr.2 (2.7 g)、Fr.3 (2.2 g)、Fr.4 (3.1 g)、Fr.5 (2.5 g)、Fr.6 (2.2 g)和Fr.7 (3.2 g)。将Fr.2用硅胶(270 g,300−400目)柱层析分离,石油醚: 乙酸乙酯(10:1−0:1,体积比)分离获得组分Fr.2.1、Fr.2.2、Fr.2.3和Fr.2.4,Fr.2.3用Sephadex LH-20凝胶柱以甲醇: 氯仿(1:1,体积比)进行洗脱分离到化合物2 (21.3 mg);将Fr.3用硅胶(220 g,300−400目)柱层析分离,石油醚: 乙酸乙酯(10:1−0:1,体积比)分离获得组分Fr.3.1、Fr.3.2和Fr.3.3,将Fr.3.2用制备型薄层板反复制备,再用重结晶的方法提纯最终获得化合物1 (28.2 mg);Fr.5继续用硅胶(250 g,300−400目)柱层析分离,石油醚: 乙酸乙酯(10:1−0:1,体积比),获得组分Fr.5.1、Fr.5.2、Fr.5.3、Fr.5.4和Fr.5.5,将Fr.5.3组分继续用Sephadex LH-20凝胶柱以甲醇进行洗脱获得Fr.5.3.1、Fr.5.3.2、Fr.5.3.3和Fr.5.3.4。Fr.5.3.4继续用Sephadex LH-20凝胶柱以甲醇: 氯仿(1:1,体积比)进行洗脱分离到化合物3 (37.8 mg);Fr.7用制备型薄层板点样制备获得Fr.7.1、Fr.7.2、Fr.7.3、Fr.7.4和Fr.7.5,将Fr.7.3用Sephadex LH-20凝胶柱以乙醇进行洗脱获得Fr.7.3.1、Fr.7.3.2、Fr.7.3.3和Fr.7.3.4,将组分Fr.7.3.2继续用Sephadex LH-20凝胶柱以乙醇进行洗脱分离到化合物4 (19.6 mg)。分离纯化流程见图 1。通过化合物的波谱数据(1H-NMR、13C-NMR、HR-ESI-MS等谱图)分析,参考相对应的文献对单体化合物的结构进行鉴定。
|
| 图 1 乙酸乙酯提取物的分离纯化 Figure 1 Isolation and purification of ethyl acetate extract |
|
|
ABTS+自由基的测定参照文献[13]的方法并稍做修改。用去离子水将ABTS+粉末和过硫酸钾配制成浓度为7.4 mmol/L的ABTS+溶液和2.6 mmol/L的过硫酸钾溶液。将ABTS+溶液和过硫酸钾溶液按照1׃1等体积混合,在避光、常温的状态下放置12 h以上,形成ABTS+储备液。将ABTS+储备液用磷酸钠缓冲液(0.1 mol/L,pH 7.4)进行稀释制成ABTS+工作液,并使其在734 nm检测光处的吸光度值为0.70±0.02。取3 mL的ABTS+工作液与0.1 mL适当浓度(10−500 µg/mL)的化合物溶液涡旋混匀,室温避光反应10 min,用紫外分光光度计在734 nm处检测吸光度值,每个浓度梯度的溶液做3次平行重复。用Vc作为阳性对照,ABTS+自由基清除能力(%)按公式(1)计算,结果以IC50值来表示,即抑制50%的ABTS+自由基所需要的样品浓度(µg/mL)。

|
(1) |
式中:A0为空白孔的吸光度值;A1为测定孔的吸光度值。
1.5.2 1, 1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力的测定DPPH自由基清除能力测定参照文献[13]的方法稍做修改。取2 mL的DPPH乙醇溶液(0.1 mmol/L),加入2 mL适当浓度(10−200 µg/mL)的化合物溶液,涡旋混匀,在室温避光的条件下反应30 min,用紫外分光光度计在517 nm波长处检测吸光度值,每个浓度梯度的溶液做3次平行重复。用Vc作为阳性对照,DPPH自由基清除能力(%)按公式(2)计算,结果以IC50值来表示,即抑制50%的DPPH自由基所需要的样品浓度(µg/mL)。

|
(2) |
式中:A0为空白孔的吸光度值;A1为测定孔的吸光度值。
1.5.3 羟基(OH−)自由基清除能力的测定羟基(OH−)自由基清除能力测定参照文献[14]的方法稍做修改。在反应体系中加入适当浓度(10−100 µg/mL)的化合物溶液、6 mmol/L FeSO4溶液和6 mmol/L水杨酸溶液各2 mL,最后加入2 mL的6 mmol/L H2O2溶液,涡旋混匀,在37 ℃条件下反应30 min,用紫外分光光度计在510 nm波长处检测吸光度值,每个浓度梯度的溶液做3次平行重复。用Vc作为阳性对照,OH−自由基清除能力(%)按公式(3)计算,结果以IC50值来表示,即抑制50%的OH−自由基所需要的样品浓度(µg/mL)。

|
(3) |
式中:A0为空白孔的吸光度值;A1为测定孔的吸光度值。
1.6 抗细菌活性测定采用滤纸片法检测化合物的抗菌活性,将分离得到的单体化合物和阳性对照药物(氨苄青霉素)配制成浓度为5 mg/mL的溶液,用0.22 µm滤膜过滤后备用。将直径5 mm的无菌滤纸片平铺在无菌平板上,取6 µL溶液均匀洒在滤纸片上,将滤纸片贴在涂布有细菌悬浊液的平板上,在37 ℃恒温培养箱中倒置培养。
1.7 降血糖相关酶α-葡萄糖苷酶抑制活性的测定α-葡萄糖苷酶的测定参考文献[15]的方法稍做修改。用磷酸盐缓冲液(0.1 mol/L,pH 6.8)将α-葡萄糖苷酶和4-硝基苯基-α-D吡喃葡萄糖苷(pNPG)分别配制成0.5 U/mL的α-葡萄糖苷酶溶液和0.2 mg/mL的pNPG溶液。在反应体系中加入磷酸盐缓冲液、α-葡萄糖苷酶溶液和适当浓度(50−200 µg/mL)的单体化合物溶液各1 mL,涡旋混匀,在37 ℃条件下孵育30 min,再加入1 mL的pNPG溶液,充分混合,37 ℃条件下反应10 min,最后加入1 mL的碳酸钠溶液(1 mol/L)终止反应,用紫外分光光度计在405 nm波长处检测吸光度值,每个浓度梯度的溶液做3次平行重复。以阿卡波糖为阳性对照,α-葡萄糖苷酶抑制能力(%)按公式(4)计算,结果以IC50值来表示,即抑制50%的酶活力所需要的样品浓度(µg/mL)。

|
(4) |
式中:A0为对照组的吸光度值;A1为样品组吸光度值。
1.8 数据分析实验结果以平均值±标准差(Mean±SD)来表示。用Excel 2010进行数据处理,用SPSS 18.0计算IC50值。
2 结果与分析 2.1 活性代谢产物的结构鉴定采用多种色谱分离方法,从红色红曲霉Mr-1乙酸乙酯的粗提物中分离纯化得到4个单体化合物。通过对波谱数据的分析与文献报道比对,将分离纯化得到的4个单体化合物确定为Luteolin (1)、Hesperetin (2)、Glycitein (3)和Ursolic acid (4) (图 2)。
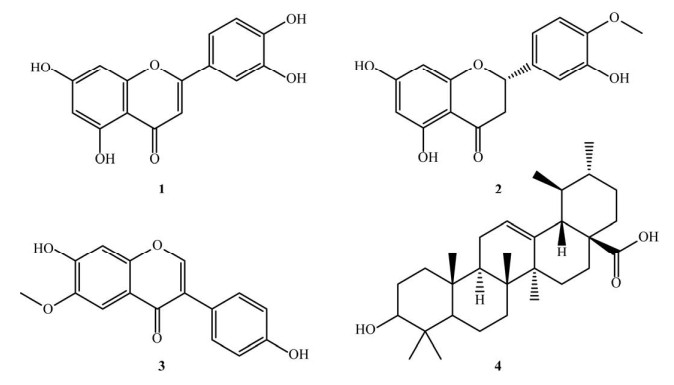
|
| 图 2 化合物1–4的结构图 Figure 2 Structures of compounds 1–4 |
|
|
化合物1 (28.2 mg):黄色粉末,溶于DMSO。经HR-ESI-MS分析可知m/z:[M+H]+ 287.055 5,分子式为C15H11O6,计算值为287.055 0,因此推测该化合物分子式为C15H10O5。1H NMR (600 MHz, DMSO-d6) δ 13.0 (s, 1H, 5-OH),10.8 (s, 1H, 7-OH),9.9 (s, 1H, 3′-OH),9.4 (s, 1H, 4′-OH),7.4 (m, 1H, H-2′),7.4 (d, J=2.0 Hz, 1H, H-6′),6.9 (d, J=8.2 Hz, 1H, H-5′),6.7 (s, 1H, H-3),6.4 (d, J=1.9 Hz, 1H, H-8),6.2 (d, J=1.9 Hz, 1H, H-6)。13C NMR (151 MHz, DMSO) δ 182.1 (s, C-4),164.6 (s, C-7),164.3 (s, C-2),161.9 (s, C-5),157.7 (s, C-9),150.1 (s, C-4′),146.2 (s, C-3′),122.0 (s, C-1′),119.4 (s, C-6′),116.5 (s, C-5′),113.8 (s, C-2′),104.2 (s, C-10),103.3 (s, C-3),99.3 (s, C-6),94.3 (s, C-8)。该结构的图谱数据与文献[16]的报道相一致,据此将该化合物最终鉴定为Luteolin。
化合物2 (21.3 mg):黄色粉末,溶于甲醇、DMSO。经HR-ESI-MS分析可知m/z:[M+H]+ 303.086 9,分子式为C16H15O6,计算值为303.086 3,因此推测该化合物分子式为C16H14O6。1H NMR (600 MHz, MeOD) δ 6.9−7.0 (m, 3H, H-2′, 5′, 6′),5.9 (m, 2H, H-6, 8),5.3 (dd, J=12.7, 2.9 Hz, 1H, H-2),4.9 (s, 3H, 4′-OCH3),3.0−3.1 (dd, J=17.1, 12.7 Hz, 1H, H-3a),2.7 (dd, J=17.1, 3.0 Hz, 1H, H-3b);13C NMR (151 MHz, MeOD) δ 196.2 (C-4),166.9 (C-7),164.0 (C-5),163.3 (C-9),147.9 (C-4′),146.4 (C-3′),131.7 (C-1′),117.6 (C-6′),113.1 (C-2′),111.2 (C-5′),102.0 (C-10),95.7 (C-6),94.8 (C-8),78.9 (C-2),55.0 (6-OMe),42.6 (C-3)。该结构的图谱数据与文献[17]的报道相一致,据此将该化合物最终鉴定为hesperetin。
化合物3 (37.8 mg):白色粉末,溶于DMSO。经HR-ESI-MS分析可知m/z:[M+H]+ 285.075 9,分子式为C16H13O5,计算值为285.075 7,因此推测该化合物分子式为C16H12O5。1H NMR (600 MHz, DMSO-d6) δ 10.6 (s, OH-4′),9.5 (s, OH-7),δ 8.3 (s, 1H, H-2),7.4 (s, 1H, H-5),7.4 (d, J=8.5 Hz, 2H, H-2′, 6′),6.9 (s, 1H, H-8),6.8 (d, J=8.5 Hz, 2H, H-3′, 5′),3.9 (s, 3H, 6-OCH3);13C NMR (151 MHz, DMSO) δ 174.8 (C-4),157.6 (C-4′),153.3 (C-7),152.9 (C-2),152.2 (C-9),147.4 (C-6),130.5 (C-2′),130.5 (C-6′),123.4 (C-3),123.3 (C-1′),116.7 (C-10),115.4 (C-3′),115.4 (C-5′),105.2 (C-5),103.3 (C-8),56.3 (6-OMe)。该结构的图谱数据与文献[18]的报道相一致,据此将该化合物最终鉴定为glycitein。
化合物4 (19.6 mg):白色粉末,溶于DMSO。经HR-ESI-MS分析可知m/z:[M+H]+ 457.367 0,分子式为C30H49O3,计算值为457.367 6,因此推测该化合物分子式为C30H48O3。1H NMR (600 MHz, DMSO-d6) δ 5.1 (t, J=3.4 Hz, 1H, H-12),4.3 (s, 1H, 3-OH),3.0 (d, J=5.5 Hz, 1H, H-3),2.1 (d, J=11.3 Hz, 1H, H-18),1.0 (s, 3H, 23-CH3),0.9 (s, 3H, 29-CH3),0.9 (s, 3H, 27-CH3),0.9 (s, 3H, 26-CH3),0.8 (d, J=6.4 Hz, 3H, 30-CH3),0.8 (s, 3H, 24-CH3),0.7 (s, 3H, 25-CH3);13C NMR (151 MHz, DMSO) δ 178.7 (C-28),138.7 (C-13),125.0 (C-12),77.3 (C-3),55.3 (C-5),52.8 (C-18),47.5 (C-17),47.3 (C-9), 42.1 (C-8),42.1 (C-14),38.9 (C-4),38.9 (C-19),38.8 (C-20),38.7 (C-1),37.0 (C-22),36.8 (C-10),33.2 (C-7),30.7 (C-21),28.7 (C-23),28.0 (C-15),27.5 (C-2),24.3 (C-16),23.7 (C-27),23.3 (C-11),21.6 (C-30),18.5 (C-6),17.5 (C-26),17.4 (C-29),16.6 (C-25),15.7 (C-24)。该结构的图谱数据与文献[19]的报道相一致,据此将该化合物最终鉴定为Ursolic acid。
2.2 单体化合物的抗氧化活性4种单体化合物的抗氧化活性如表 1所示。由表 1中结果可知,化合物1表现出较强的抗氧化能力,对ABTS+、DPPH和OH−自由基均具有较强的清除能力,IC50值分别为13.36±0.07、8.74±0.21和32.75±0.18 µg/mL,阳性对照Vc的IC50值分别为2.85±0.03、8.45±0.13和38.71±0.26 µg/mL。通过试验结果比对,化合物1对OH−自由基的清除能力略优于Vc的效果,其余3种化合物对3种自由基均表现出不同程度的清除能力。
| 体外抗氧化活性 In vitro antioxidant activity |
ABTS+清除能力 ABTS+ scavenging activity (IC50, µg/mL) |
DPPH清除能力 DPPH scavenging activity (IC50, µg/mL) |
OH−清除能力 OH-scavenging activity (IC50, µg/mL) |
| Compound 1 | 13.36±0.07 | 8.74±0.21 | 32.75±0.18 |
| Compound 2 | 30.29±0.16 | 196.91±1.11 | 97.66±0.89 |
| Compound 3 | 118.10±0.48 | 1 924.91±3.54 | 74.49±0.34 |
| Compound 4 | 621.72±2.93 | 1 240.91±4.22 | 524.86±1.08 |
| Vc | 2.85±0.03 | 8.45±0.13 | 38.71±0.26 |
| Note: Data derived from three independent experiments were statistically analyzed, and the results are presented as mean±SD (n=3) | |||
4种单体化合物的抗细菌活性如表 2所示。由表 2中结果可知,化合物4对S. aureus和L. monocytogenes的抑菌圈直径分别为13.4±0.2 mm和11.9±0.3 mm,表现出较强的抑菌性能;阳性对照Ampicillin对S. aureus和L. monocytogenes的抑菌圈直径分别为18.5±0.3 mm和18.7±0.2 mm,其余3种化合物对2种致病性细菌表现出中等强度的抑制能力。
| 抑菌活性 Antibacterial activity |
金黄色葡萄球菌 S. aureus (inhibition zone, mm) |
李斯特菌 L. monocytogenes (inhibition zone, mm) |
| Compound 1 | 8.6±0.1 | 10.5±0.2 |
| Compound 2 | 11.5±0.3 | 10.5±0.2 |
| Compound 3 | 9.3±0.3 | 10.7±0.2 |
| Compound 4 | 13.4±0.2 | 11.9±0.3 |
| Ampicillin | 18.5±0.3 | 18.7±0.2 |
| Note: Data derived from three independent experiments were statistically analyzed, and the results are presented as mean±SD (n=3) | ||
4种单体化合物对α-葡萄糖苷酶的抑制作用如表 3所示。由表 3中结果可知,化合物4对α-葡萄糖苷酶具有很强的抑制能力,IC50值为21.34±0.37 µg/mL,阳性对照Acarbose的IC50值为28.65±0.39 µg/mL。通过试验结果比对,化合物4对α-葡萄糖苷酶的抑制效果较优于阳性对照Acarbose,其余3种化合物在一定程度上均表现出对α-葡萄糖苷酶的抑制作用。
| 体外酶抑制试验 In vitro enzyme inhibition assay |
α-葡萄糖苷酶的抑制 α-glucosidase inhibition (IC50, µg/mL) |
| Compound 1 | 290.53±1.94 |
| Compound 2 | 1 194.31±7.35 |
| Compound 3 | 925.88±5.08 |
| Compound 4 | 21.34±0.37 |
| Acarbose | 28.65±0.39 |
| Note: Data derived from three independent experiments were statistically analyzed, and the results are presented as mean±SD (n=3) | |
利用多种色谱分离方法从红色红曲霉Mr-1次级代谢产物中分离纯化得到4个活性化合物,分别是luteolin (1)、hesperetin (2)、glycitein (3)和ursolic acid (4),化合物1、2和4为首次从红曲菌科中发现。化合物1主要存在于紫苏[20]等唇形科植物中,化合物2主要存在于芸香科柑橘类[21]植物中,化合物3主要存在于大豆[22]等豆科植物中,以上3种化合物均为黄酮类化合物。黄酮类化合物是指2个芳香环通过三碳链相互连接而成的一系列化合物,有共同的C6-C3-C6的骨架[23],根据其三碳链是否氧化成环、B环的位置和取代模式,划分出不同类型的黄酮类化合物[24],如黄酮、黄酮醇、黄烷酮、异黄酮等,具有抗氧化、抑菌、抗肿瘤、抗炎症等功能[25]。化合物4为萜类化合物,主要存在于女贞[26]等木犀科植物中。萜类化合物是以异戊二烯为基本组成单位的一类化合物的统称[27],具有驱虫、抗肿瘤、降血糖、抗炎症等功能[28-29]。
从抗氧化活性试验结果可知:4种化合物对ABTS+自由基的清除能力为1 > 2 > 3 > 4,对DPPH自由基的清除能力为1 > 2 > 3 > 4,对OH−自由基的清除能力为1 > 3 > 2 > 4。Seyoum等[30]研究了黄酮类化合物的抗氧化与结构间的构效关系。研究发现,黄酮类化合物A环和B环的相邻位点有2个或3个羟基取代时比单羟基取代或间位羟基取代时抗氧化活性更强;Promden等[31]对黄酮类化合物的研究发现A环上间羟基取代比单羟基取代的化合物抗氧化性更强。我们对ABTS+自由基和DPPH自由基的清除能力的测定结果与上述研究结果一致,黄酮类化合物B环具有C-3′, 4′相邻羟基取代的结构比单羟基取代或间位羟基取代的结构表现出更强的抗氧化活性;在清除Fenton反应产生的羟基自由基方面,黄酮类化合物的抗氧化能力却表现出化合物1 > 3 > 2,这可能是由于反应体系差异导致抑制机理不同所致。在Fenton反应中应更加注意金属的螯合作用,有研究认为有些化合物可能通过金属的螯合作用或改变铁的氧化还原反应来发挥保护作用[32]。化合物4属于乌苏烷型五环三萜类化合物,其结构特点是30个碳的骨架上连接有2个羟基和1个烯键,从体外抗氧化试验结果中可知其并未表现出较好的抗氧化活性。目前国内外相关文献中,对于化合物1抗炎症、降血糖等[33]方面的作用报道较多,而抗氧化活性方面鲜有报道。
从抑菌活性试验结果可知,化合物1−4对L. monocytogenes和S. aureus均表现出中等强度的抑菌效果,相较于阳性对照Ampicillin,它们的抗菌效果表现一般。由于受到分离化合物的含量限制,抗菌谱只检测了2种革兰氏阳性菌,这些化合物或许对其他类型的病原菌有较好的抑制作用,后续有待进一步验证。
从降血糖相关酶抑制试验结果可知,4种化合物对α-葡萄糖苷酶的抑制能力为4 > 1 > 3 > 2。Proenca等[34]研究了黄酮类化合物对α-葡萄糖苷酶的抑制能力与结构间的构效关系,黄酮类化合物A环或B环具有相邻的羟基时比单羟基或间位羟基取代时对α-葡萄糖苷酶的抑制作用更强;Sarian等[35]研究发现黄酮类化合物C环上C-2和C-3位置为双键时可以增强对α-葡萄糖苷酶的抑制作用。我们对α-葡萄糖苷酶抑制活性的测定结果与上述研究结果一致,黄酮类化合物B环上具有相邻羟基取代且C环上C-2和C-3位置为双键时表现出更强的α-葡萄糖苷酶抑制作用。Wang等[36]研究了化合物4对α-葡萄糖苷酶的抑制作用,发现化合物4主要是破坏了α-葡萄糖苷酶构象而起到抑制α-葡萄糖苷酶的活性,其活性测定结果与本文测定结果一致,化合物4对α-葡萄糖苷酶具有较强的抑制作用,其抑制效果优于Acarbose。
本研究从红色红曲霉Mr-1的次级代谢产物中分离出4个生物活性成分,其中3个活性成分为首次从红曲菌科中发现,丰富了红曲菌科中的生物活性成分种类,增加了对其药效物质基础的认识,并从构效关系上对生物活性成分的抗氧化活性和α-葡萄糖苷酶抑制作用进行了简单分析,为后续研究提供了参考性的依据。由于受到分离化合物含量的影响,本实验未能进一步测试化合物抗其他致病性菌的活性,但研究结果表明,红色红曲霉Mr-1是宝贵的微生物种质资源,是潜在的抗氧化剂、抑菌剂和降血糖抑制剂来源,具有开发成功能性食品原料的潜能。
| [1] |
Patakova P. Monascus secondary metabolites: production and biological activity[J]. Journal of Industrial Microbiology & Biotechnology, 2013, 40(2): 169-181. DOI:10.1007/s10295-012-1216-8 |
| [2] |
Shao YC, Xu L, Chen FS. Genetic diversity analysis of Monascus strains using SRAP and ISSR markers[J]. Mycoscience, 2011, 52(4): 224-233. DOI:10.1007/S10267-010-0087-Y |
| [3] |
Shao YC, Lei M, Mao ZJ, Zhou YX, Chen FS. Insights into Monascus biology at the genetic level[J]. Applied Microbiology and Biotechnology, 2014, 98(9): 3911-3922. DOI:10.1007/s00253-014-5608-8 |
| [4] |
Lin CH, Lin TH, Pan TM. Alleviation of metabolic syndrome by monascin and ankaflavin: the perspective of Monascus functional foods[J]. Food & Function, 2017, 8(6): 2102-2109. |
| [5] |
Li L, Chen S, Chen FS, Gao MX. Review on biosynthetic pathway of secondary metabolites and the related genes in Monascus spp.[J]. Microbiology China, 2013, 40(2): 294-303. (in Chinese) 李利, 陈莎, 陈福生, 高梦祥. 红曲菌次生代谢产物生物合成途径及相关基因的研究进展[J]. 微生物学通报, 2013, 40(2): 294-303. |
| [6] |
Feng YL, Yu X, Chen FS. Pigments production of Monascus sp. improved by glycerol utilization and its mechanism: a review[J]. Microbiology China, 2016, 43(10): 2277-2285. (in Chinese) 冯艳丽, 余翔, 陈福生. 红曲菌利用甘油促进色素产生及其机制的研究进展[J]. 微生物学通报, 2016, 43(10): 2277-2285. |
| [7] |
Yan L, Liu XH, Li YH. Resarch progress and application of metabolites from Monascus[J]. China Condiment, 2020, 45(7): 191-193. (in Chinese) 颜丽, 刘秀河, 李钰涵. 红曲霉代谢产物的研究进展与应用[J]. 中国调味品, 2020, 45(7): 191-193. |
| [8] |
Dhale MA, Javagal M, Puttananjaiah MKH. Protective and antioxidative effect of rubropunctatin against oxidative protein damage induced by metal catalyzed reaction[J]. International Journal of Biological Macromolecules, 2018, 116: 409-416. DOI:10.1016/j.ijbiomac.2018.04.170 |
| [9] |
Lee CL, Wen JY, Hsu YW, Pan TM. The blood lipid regulation of Monascus-produced monascin and ankaflavin via the suppression of low-density lipoprotein cholesterol assembly and stimulation of apolipoprotein A1 expression in the liver[J]. Journal of Microbiology, Immunology and Infection, 2018, 51(1): 27-37. DOI:10.1016/j.jmii.2016.06.003 |
| [10] |
Nozaki H, Date S, Kondo H, Kiyohara H, Takaoka D, Tada T, Nakayama M. Ankalactone, a new α, β-unsaturated γ-lactone from Monascus anka[J]. Agricultural and Biological Chemistry, 1991, 55(3): 899-900. |
| [11] |
Zheng YQ, Zhang Y, Chen DS, Chen HJ, Lin L, Zheng CZ, Guo YH. Monascus pigment rubropunctatin: a potential dual agent for cancer chemotherapy and phototherapy[J]. Journal of Agricultural and Food Chemistry, 2016, 64(12): 2541-2548. DOI:10.1021/acs.jafc.5b05343 |
| [12] |
Lin CP, Lin YL, Huang PH, Tsai HS, Chen YH. Inhibition of endothelial adhesion molecule expression by Monascus purpureus-fermented rice metabolites, monacolin K, ankaflavin, and monascin[J]. Journal of the Science of Food and Agriculture, 2011, 91(10): 1751-1758. DOI:10.1002/jsfa.4371 |
| [13] |
Kotora P, Šeršeň F, Filo J, Loos D, Gregáň J, Gregáň F. The scavenging of DPPH, galvinoxyl and ABTS radicals by imine analogs of resveratrol[J]. Molecules, 2016, 21(1): E127. DOI:10.3390/molecules21010127 |
| [14] |
Nie JY, Li R, Wang Y, Tan J, Tang SH, Jiang ZT. Antioxidant activity evaluation of rosemary ethanol extract and their cellular antioxidant activity toward HeLa cells[J]. Journal of Food Biochemistry, 2019, 43(7): e12851. |
| [15] |
Maher S, Choudhary MI, Saleem F, Rasheed S, Waheed I, Halim SA, Azeem M, Abdullah IB, Froeyen M, Mirza MU, et al. Isolation of antidiabetic withanolides from Withania coagulans dunal and their in vitro and in silico validation[J]. Biology, 2020, 9(8): 197. DOI:10.3390/biology9080197 |
| [16] |
Park Y, Moon BH, Lee E, Lee Y, Yoon Y, Ahn JH, Lim Y. 1H and 13C-NMR data of hydroxyflavone derivatives[J]. Magnetic Resonance in Chemistry, 2007, 45(8): 674-679. DOI:10.1002/mrc.2010 |
| [17] |
Correia-Da-Silva M, Sousa E, Duarte B, Marques F, Carvalho F, Cunha-Ribeiro LM, Pinto MMM. Flavonoids with an oligopolysulfated moiety: a new class of anticoagulant agents[J]. Journal of Medicinal Chemistry, 2011, 54(1): 95-106. DOI:10.1021/jm1013117 |
| [18] |
Soidinsalo O, Wähälä K. Synthesis of phytoestrogenic isoflavonoid disulfates[J]. Steroids, 2004, 69(10): 613-616. DOI:10.1016/j.steroids.2004.03.015 |
| [19] |
Seebacher W, Simic N, Weis R, Saf R, Kunert O. Complete assignments of 1H and 13C NMR resonances of oleanolic acid, 18α-oleanolic acid, ursolic acid and their 11-oxo derivatives[J]. Magnetic Resonance in Chemistry, 2003, 41(8): 636-638. DOI:10.1002/mrc.1214 |
| [20] |
Miguel LL. Distribution and biological activities of the flavonoid luteolin[J]. Mini-Reviews in Medicinal Chemistry, 2009, 9(1): 31-59. DOI:10.2174/138955709787001712 |
| [21] |
Barreca D, Gattuso G, Bellocco E, Calderaro A, Trombetta D, Smeriglio A, Lagana G, Daglia M, Meneghini S, Nabavi SM. Flavanones: citrus phytochemical with health-promoting properties[J]. Biofactors, 2017, 43(4): 495-506. DOI:10.1002/biof.1363 |
| [22] |
Dixon RA, Sumner LW. Legume natural products: understanding and manipulating complex pathways for human and animal health[J]. Plant Physiology, 2003, 131(3): 878-885. DOI:10.1104/pp.102.017319 |
| [23] |
Chen BB, Wang LL, Li L, Zhu RY, Liu HX, Liu CY, Ma RF, Jia QQ, Zhao DD, Niu JZ, et al. Fructus Ligustri Lucidi in osteoporosis: a review of its pharmacology, phytochemistry, pharmacokinetics and safety[J]. Molecules, 2017, 22(9): 1469. DOI:10.3390/molecules22091469 |
| [24] |
Bergman ME, Davis B, Phillips MA. Medically useful plant terpenoids: biosynthesis, occurrence, and mechanism of action[J]. Molecules, 2019, 24(21): 3961. DOI:10.3390/molecules24213961 |
| [25] |
Kumar S, Pandey AK. Chemistry and biological activities of flavonoids: an overview[J]. The Scientific World Journal, 2013, 2013: 162750. |
| [26] |
Das S, Rosazza JPN. Microbial and enzymatic transformations of flavonoids[J]. Journal of Natural Products, 2006, 69(3): 499-508. DOI:10.1021/np0504659 |
| [27] |
Santos-Buelga C, Feliciano AS. Flavonoids: from structure to health issues[J]. Molecules, 2017, 22(3): 477. DOI:10.3390/molecules22030477 |
| [28] |
Ashley EA, Pyae Phyo A, Woodrow CJ. Malaria[J]. The Lancet, 2018, 391(10130): 1608-1621. DOI:10.1016/S0140-6736(18)30324-6 |
| [29] |
Sharma SH, Thulasingam S, Nagarajan S. Terpenoids as anti-colon cancer agents-a comprehensive review on its mechanistic perspectives[J]. European Journal of Pharmacology, 2017, 795: 169-178. DOI:10.1016/j.ejphar.2016.12.008 |
| [30] |
Seyoum A, Asres K, El-Fiky FK. Structure-radical scavenging activity relationships of flavonoids[J]. Phytochemistry, 2006, 67(18): 2058-2070. DOI:10.1016/j.phytochem.2006.07.002 |
| [31] |
Promden W, Monthakantirat O, Umehara K, Noguchi H, De-Eknamkul W. Structure and antioxidant activity relationships of isoflavonoids from Dalbergia parviflora[J]. Molecules, 2014, 19(2): 2226-2237. DOI:10.3390/molecules19022226 |
| [32] |
Ruiz-larrea B, Leal AM, Martín C, Martínez R, Lacort M. Effects of estrogens on the redox chemistry of iron: a possible mechanism of the antioxidant action of estrogens[J]. Steroids, 1995, 60(11): 780-783. DOI:10.1016/0039-128X(95)00119-B |
| [33] |
Mlala S, Oyedeji AO, Gondwe M, Oyedeji OO. Ursolic acid and its derivatives as bioactive agents[J]. Molecules, 2019, 24(15): 2751. DOI:10.3390/molecules24152751 |
| [34] |
Proenca C, Freitas M, Ribeiro D, Oliveira EFT, Sousa JLC, Tome SM, Ramos MJ, Silva AMS, Fernandes PA, Fernandes E. α-Glucosidase inhibition by flavonoids: an in vitro and in silico structure-activity relationship study[J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2017, 32(1): 1216-1228. DOI:10.1080/14756366.2017.1368503 |
| [35] |
Sarian MN, Ahmed QU, Mat So'ad SZ, Alhassan AM, Murugesu S, Perumal V, Syed Mohamad SNA, Khatib A, Latip J. Antioxidant and antidiabetic effects of flavonoids: a structure-activity relationship based study[J]. Biomed Research International, 2017, 2017: 8386065. |
| [36] |
Wang J, Zhao J, Yan Y, Liu D, Wang CT, Wang H. Inhibition of glycosidase by ursolic acid: in vitro, in vivo and in silico study[J]. Journal of the Science of Food and Agriculture, 2020, 100(3): 986-994. DOI:10.1002/jsfa.10098 |
 2021, Vol. 48
2021, Vol. 48