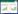扩展功能
文章信息
- 任建雯, 罗云艳, 冯印印, 韩猛, 安航, 崔传斌, 张家韬, 李斌, 杨洋, 安德荣
- REN Jianwen, LUO Yunyan, FENG Yinyin, HAN Meng, AN Hang, CUI Chuanbin, ZHANG Jiatao, LI Bin, YANG Yang, AN Derong
- 贝莱斯芽孢杆菌RJW-5-5的分离鉴定及细菌素、抗菌肽基因簇挖掘
- Isolation and identification of Bacillus velezensis RJW-5-5 and gene cluster mining of bacteriocin and RiPPs
- 微生物学通报, 2021, 48(3): 742-754
- Microbiology China, 2021, 48(3): 742-754
- DOI: 10.13344/j.microbiol.china.200457
-
文章历史
- 收稿日期: 2020-05-11
- 接受日期: 2020-06-23
- 网络首发日期: 2020-09-30
2. 陕西省烟草公司 陕西 汉中 723000;
3. 四川省烟草公司 四川 广元 628017
2. Shaanxi Tobacco Company, Hanzhong, Shaanxi 723000, China;
3. Sichuan Tobacco Company, Guangyuan, Sichuan 628017, China
近年来,芽孢杆菌在农作物病虫害防治方面起了重要作用,随着对芽孢杆菌的研究越来越深入,不同种类芽孢杆菌也逐渐被分离鉴定出来。2005年,Ruiz-García等从西班牙Vélez河的咸水样品中分离出菌株CR-502T,并通过DNA杂交证实其为新菌株,将其命名为贝莱斯芽孢杆菌(Bacillus velezensis)[1],贝莱斯芽孢杆菌菌体呈杆状,属于革兰氏阳性菌(G+),大小约1.5 μm,一般为单个或成对排列,有时也呈短链排列;芽孢呈椭圆状,位于非肿胀胞囊的中间或末端[2],贝莱斯芽孢杆菌普遍存在于自然界中,如植物组织[3]、土壤[4]、河水[1]、海洋[5]等。
细菌素是一些细菌在代谢过程中合成的具有抑菌活性的多肽类物质,是一种微生物源性天然防腐剂[6]。细菌素具有安全无毒、抑菌活性强及作用条件温和的特点,越来越受到青睐并有逐渐取代化学防腐剂的趋势,如丙酸杆菌素在芽菜防腐保鲜中的作用[7]。根据前人研究结果,贝莱斯芽孢杆菌的抗菌物质主要为脂肽类抗生素和聚酮类抗生素[8]。聚酮类化合物是由微生物、植物等产生的一大类天然产物,这类物质具有活性,对多种植物病原菌都具有拮抗活性,能够增强植物自身抵抗力[9]。芽孢杆菌核糖体途径合成的抗菌肽主要包括3类:小RiPPs[10]、未经修饰的细菌素和大分子抗菌蛋白。RiPPs包括所有在生物合成过程中经酶修饰而形成的特殊氨基酸或结构的多肽(例如:羊毛硫氨酸,脱水氨基酸残基,糖基化结构,环状结构,拉锁结构,头尾相接结构),这些特殊的结构通常与其生物活性有紧密联系[11]。小RiPPs主要包括羊毛硫抗菌肽(Lanthipeptides)、Sactipeptide、头尾环化肽、含线性唑的肽(Linear Azole-Containing Peptides,LAPs)、硫肽(Thiopeptides)、Glycocins、套索肽(Lasso Peptides)[12];未经修饰的细菌素包括Pediocin类似肽以及Cereins等未修饰的肽;大分子抗菌蛋白包括具有抗菌活性的大分子蛋白(分子量大于10 kD),这些蛋白的基因簇通常包含免疫基因和结构基因[13]。
本研究测定了菌株RJW-5-5对疫霉菌、菊池链格孢等多种植物病原菌的防治效果,对发挥生防细菌应有的潜力具有重要意义。通过全细胞脂肪酸和Biolog分析法以及分子生物学方法对该菌株进行了鉴定,为菌株鉴定方法提供了更多参考。通过第二代测序技术对菌株RJW-5-5进行了全基因组测序,并通过BAGEL4挖掘了其潜在的功能基因簇,其中Propionicin_SM1为首次在芽孢杆菌属中发现,为日后贝莱斯芽孢杆菌的抑菌物质研究提供更多的参考依据。
1 材料与方法 1.1 材料 1.1.1 主要试剂和仪器及培养基酵母、蛋白胨、琼脂、NaCl (分析纯)和葡萄糖,北京索莱宝科技有限公司;DNA提取试剂盒,生工生物工程(上海)股份有限公司。电子分析天平,上海越磁电子科技有限公司;PCR仪,Bio-Rad公司。
培养基:LB培养基、PDA培养基[14]、PDB培养基(PDA培养基不加琼脂)。
1.1.2 供试土壤从陕西秦岭原始森林、渭河、太白山森林公园、水杉根际、东沙河桥下以及杨凌农药研究所等地采用五点采样法采集土样,共计95份。
1.1.3 病原菌样品小麦根腐病病原菌及其他作物病原菌由本实验室分离,保存在30%甘油中。
1.2 菌株分离采用稀释涂布法[15],分别准确称取每份待测土壤样品10 g,按照10倍比连续稀释制成10-1-10-9一系列土壤悬浮液。静置后,每支试管各取0.1 mL稀释上清液,用涂布器在LB培养基上均匀涂抹,晾干后倒置于30 ℃培养箱中培养3-4 d。观察菌落生长情况,根据平板上长出的菌落的形态、颜色等特征挑取不同的细菌单菌落进行划线纯化,直至平板新长出的菌落为单一菌落。挑取单一菌落在LB斜面上进行划线,在培养箱中培养后保存于4 ℃冰箱。
1.3 拮抗小麦根腐病菌的筛选采用对峙培养法筛选[16],以小麦根腐病菌为指示菌,用5 mm的灭菌打孔器打取已活化好的指示菌菌饼,先将菌饼接在新鲜的PDA平板中央作指示菌,再将待测菌点接在离菌饼2.5 cm处(4处),以仅接菌饼的平板为对照。放入28 ℃恒温培养箱倒置培养5 d,测量抑菌带并筛选出抑菌带较宽的菌株,编号为RJW-5-5。
1.4 菌株RJW-5-5抑菌广谱性测定采用对峙培养法测定[17]生防菌RJW-5-5对不同病原菌(表 1)的抑制作用,在PDA培养基平板中央用打孔器接种6 mm的病原菌菌块,在其四周分别接种生防菌,以不加生防菌的平板为阴性对照,放置于28 ℃黑暗培养4-6 d,待对照板病原菌长满皿,观察实验组病原菌菌落形态变化,使用十字交叉法测量菌落直径,计算菌丝生长抑制率,试验重复3次。
| 菌株Strain | 寄主Host |
| 辣椒疫霉病菌Phytophthora capsici | 辣椒Capsicum annuum L. |
| 梨黑斑病菌Alternaria kikuchiana Tanaka | 梨Pyrus spp. |
| 马铃薯早疫病菌Alternaria solani | 马铃薯Solanum tuberosum L. |
| 棉花枯萎病菌Fusarium oxysporum f. sp. vasinfectum | 棉花Gossypium spp. |
| 西瓜炭疽病菌Colletotrichum orbiculare | 西瓜Citrullus lanatus (Thunb.) Matsum. et Nakai |
| 烟草赤星病菌Alteraria alternata | 烟草Nicotiana tabacum L. |
| 苹果炭疽病菌Colletotrichum gloeosporioides | 苹果Malus domestica |
| 玉米大斑病菌Setosphaeria turcica | 玉米Zea mays Linn. |
| 玉米茎基腐病菌Pythium aphanidermatum | 玉米Zea mays Linn. |
先将RJW-5-5菌株在LB平板上进行活化,然后转接于100 mL液体LB培养液中,35 ℃、150 r/min恒温振荡培养24 h制作菌悬液,再将菌悬液稀释后涂布于LB平板,35 ℃下培养12 h后进行革兰氏染色,36 h后进行芽孢染色,72 h后记录菌落的形态、颜色、质地、菌落大小等特征,并进行扫描电镜观察。
1.5.2 生理生化鉴定参照《常见细菌系统鉴定手册》[18]、《伯杰细菌鉴定手册》(第9版)[19]和《芽孢杆菌属》[20]的方法,通过微生物脂肪酸快速鉴定系统(Microbial Fatty Acid Rapid Identification System,MIDI)检测菌株RJW-5-5的脂肪酸组成,以及Biolog GENⅢ生理生化检测等进行鉴定。
1.5.3 分子生物学鉴定采用基因组DNA提取试剂盒提取RJW-5-5的基因组DNA,用细菌16S rRNA基因通用引物27F (5′-GTTTGATCMTGGCTCAG-3′)和1492R (5′-TAC GGYTACCTTGTTACGACTT-3′),以及细菌rpoB基因通用引物rpoB-F (5′-ATCGAAACGCCTGAA GGTCCAAACAT-3′)和rpoB-R (5′-ACACCCTTG TTACCGTGACGACC-3′)进行PCR扩增,PCR反应体系及条件参照文献[21]。PCR产物纯化后,送至生工生物工程(上海)股份有限公司进行测序分析。利用NCBI网站的BLAST功能对所测的16S rRNA基因和rpoB基因序列进行同源性分析,确定亲缘关系,最后使用MEGA 7.0软件的Neighbor- Joining法构建系统发育树。
1.6 菌株RJW-5-5全基因组序列的测定提取菌株RJW-5-5的基因组DNA,通过Illumina NovaSeq 6000平台进行全基因组序列测序,测序模式为双端(Paired-End)测序,测序读长为2×150 bp。
1.7 全基因组序列分析及功能基因挖掘使用在线软件BAGEL 4对菌株RJW-5-5全基因组中潜在的经核糖体途径合成和翻译后修饰的多肽(RiPPs)的合成基因簇进行挖掘。
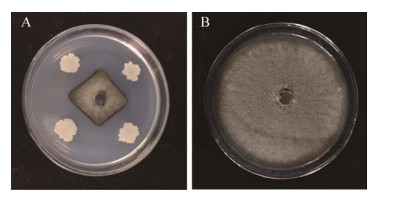
2 结果与分析 2.1 生防菌株的筛选以小麦根腐病菌为指示菌,对分离出的几种拮抗菌进行筛选,筛选出对小麦根腐病菌抑菌带最宽的菌株RJW-5-5,如图 1所示,测定此菌株的抑菌谱如图 2所示,RJW-5-5对梨黑斑病菌、玉米大斑病菌、烟草赤星病菌、马铃薯早疫病菌、西瓜炭疽病菌以及棉花枯萎病菌都有较好的抑制作用。
|
| 图 1 菌株RJW-5-5对小麦根腐病菌的抑制作用 Figure 1 Inhibitory effect of strain RJW-5-5 on wheat root rot 注:A:菌株RJW-5-5菌液与病原菌的对峙作用;B:空白对照 Note: A: Antagonistic effect of strain RJW-5-5 on the pathogen; B: Blank control |
|
|
|
| 图 2 菌株RJW-5-5的抑菌 Figure 2 Antibacterial spectrum of strain RJW-5-5 注:A:辣椒疫霉病菌;B:棉花枯萎病菌;C:梨黑斑病菌;D:马铃薯早疫病菌;E:西瓜炭疽病菌;F:苹果炭疽病菌;G:烟草赤星病菌;H:玉米大斑病菌;I:玉米茎基腐病菌 Note: A: P. capsici; B: F. oxysporum f. sp. vasinfectum; C: A. kikuchiana Tanaka; D: A. solani; E: C. orbiculare; F: C. gloeosporioides; G: A. alternata; H: S. turcica; I: P. aphanidermatum |
|
|
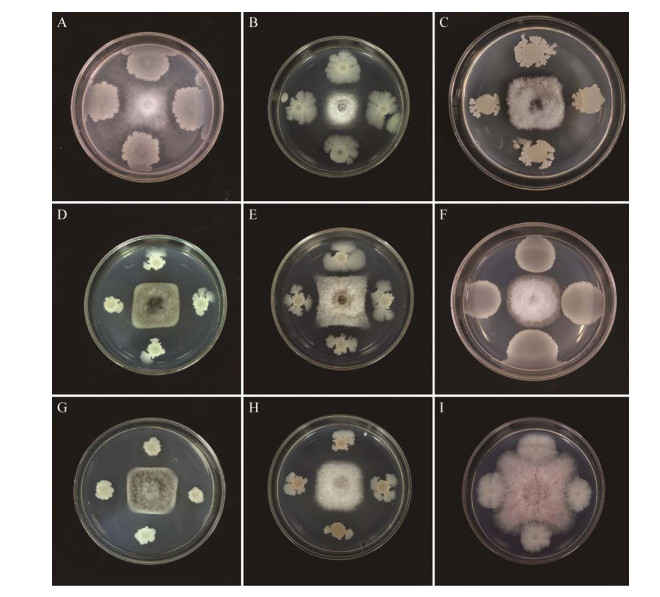
菌株RJW-5-5革兰氏染色呈阳性且形成芽胞,细胞呈短杆状,单个或成对,很少成链状(图 3A),扫描电镜图(图 3B)中菌株RJW-5-5呈杆状,大小在1.1-1.3 μm之间;在LB培养基上,细菌呈乳白色,菌落粗糙且边缘稍有不规则(图 3C、3D)。以上形态和革兰氏染色、电镜特征与芽孢杆菌属(Bacillus)的形态特征类似。
|
| 图 3 菌株RJW-5-5形态特征 Figure 3 Morphological characteristics of strain RJW-5-5 注:A:革兰氏染色菌体形态,LB培养基30 ℃培养24 h,标尺=10 μm;B:RJW-5-5扫描电镜图;C和D:LB培养基30 ℃培养24 h菌落形态 Note: A: Morphology of Gram staining bacteria, cultured in LB medium at 30 ℃ for 24 h, scale=10 μm; B: RJW-5-5 scanning electron microscopy; C and D: Colony morphology was cultured in LB medium at 30 ℃ for 24 h |
|
|
通过微生物脂肪酸鉴定系统检测菌株RJW-5-5的脂肪酸组成,可知待测菌株的主要脂肪酸为C15:0 anteiso、C15:0 iso、C17:0 anteiso和C17:0 iso,其含量分别为44.49%、20.40%、11.36%和6.67%,具体脂肪酸的结果见表 2。Biolog GENⅢ生理生化检测结果(表 3)显示阳性反应有蔗糖、pH 6.0、pH 5.0、1% NaCl、4% NaCl、8% NaCl、D-果糖、1%乳酸钠、D-山梨醇、D-果糖-6-PO4、利福霉素SV、盐酸胍、四唑蓝、L-乳酸、L-羟基丁二酸、氯化锂、亚碲酸钾、吐温-40、氨曲南和丁酸钠;弱阳性反应有葡聚糖、龙胆二糖、D-蜜三糖、葡糖醛酰胺、柠檬酸和甲酸,符合芽孢杆菌(Bacillus)的主要细胞脂肪酸特征和生化代谢特征。
| 脂肪酸种类Types of fatty acids | 含量Content (%) |
| C12:0 | 0.20 |
| C13:0 iso | 0.17 |
| C13:0 anteiso | 0.15 |
| C14:0 iso | 1.86 |
| C14:0 | 0.66 |
| C15:0 iso | 20.40 |
| C15:0 anteiso | 44.49 |
| C16:1 ω7c alcohol | 0.22 |
| C16:0 iso | 4.97 |
| C16:1 ω11c | 0.74 |
| C16:0 | 5.94 |
| C15:0 iso 3OH | 0.14 |
| C15:0 2OH | 0.28 |
| C17:1 iso ω10c | 0.57 |
| C17:0 iso | 6.67 |
| C17:0 anteiso | 11.36 |
| C17:0 | 0.15 |
| C18:0 | 0.32 |
| C17:0 2OH | 0.19 |
| 注:16:1ω7c和17:1 iso ω10c是指2种磷脂脂肪酸,脂肪酸常用的命名格式为:X: YωZ(c/t),其中,X是总碳数,后面跟一个冒号,Y表示双键数;ω表示甲基末端;Z是距离甲基端的距离;c表示顺式,t表示反式;iso和anteiso分别表示支链的反异构和异构 Note: 16:1ω7c and 17:1 iso ω10c refer to two phospholipid fatty acids. The commonly used naming format for fatty acids is: X: YωZ(c/t), where X is the total carbon number, followed by a colon, and Y represents double number of bonds; ω represents the methyl end; Z is the distance from the methyl end; c represents the cis form, t represents the trans form; iso and anteiso represent the branched anti-isomerism and isomerism respectively | |
| 生理生化指标Physiological and biochemical indicators | 结果Result | 生理生化指标Physiological and biochemical indicators | 结果Result | |
| 葡聚糖Dextrin | W | 柠檬酸Citric acid | W | |
| 龙胆二糖Gentiobiose | W | L-羟基丁二酸L-malic acid | + | |
| 蔗糖Sucrose | + | 氯化锂Lithium chloride | + | |
| D-蜜三糖D-raffinose | W | 亚碲酸钾Potassium tellurite | + | |
| D-果糖D-fructose | + | 吐温-40 Tween 40 | + | |
| 1%乳酸钠1% sodium lactate | + | 甲酸Formic acid | W | |
| D-山梨醇D-sorbitol | + | 氨曲南Aztreonam | + | |
| D-果糖-6-PO4 D-fructose-6-PO4 | + | 丁酸钠Sodium butyrate | + | |
| 利福霉素SV Rifamycin SV | + | 1% NaCl | + | |
| 盐酸胍Guanidine HCl | + | 4% NaCl | + | |
| 葡糖醛酰胺Glucuronamide | W | 8% NaCl | + | |
| 四唑蓝Tetrazolium blue | + | pH 6.0 | + | |
| L-乳酸L-lactic acid | + | pH 5.0 | + | |
| 注:+:阳性;–:阴性;W:弱阳性 Note: +: Positive reaction; –: Negative reaction; W: Weakly positive reaction | ||||
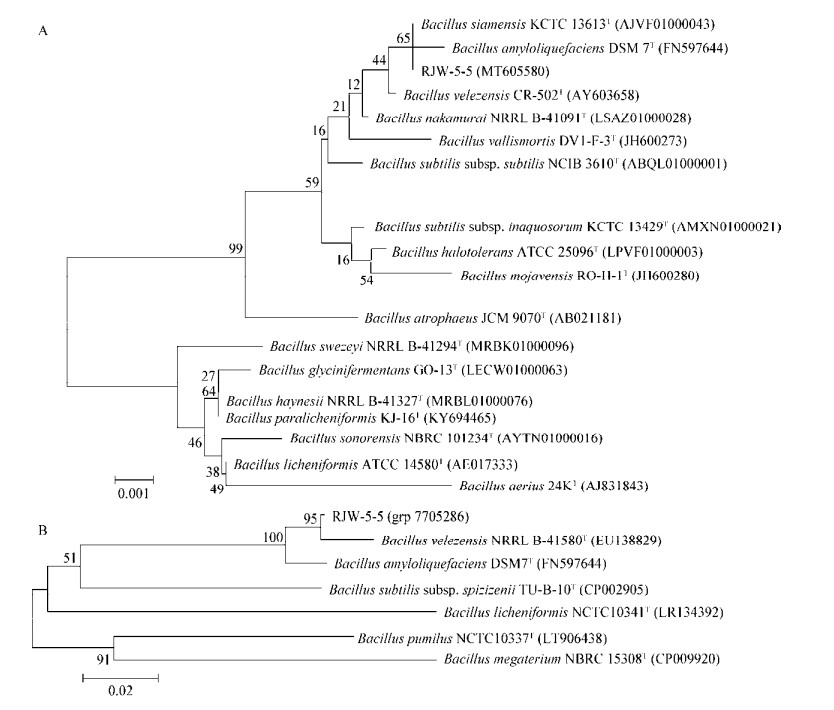
用细菌16S rRNA基因27F和1492R通用引物测定16S rRNA基因序列,获得1 390 bp的基因片段,登录号为MT605580,为了明确菌株RJW-5-5的分类地位,将RJW-5-5的16S rRNA基因序列在NCBI中进行BLAST分析,发现其与B. velezensis (AY603658)、B. siamensis (AJVF01000043)及B. subtilis subsp. subtilis (ABQL01000001)等菌株16S rRNA基因的一致性可达到99%以上(图 4A)。系统发育树结果显示,RJW-5-5与B. siamensis、B. amyloliquefaciens以及B. velezensis分支较近,但支持率较低,用细菌rpoB基因通用引物,测定rpoB保守基因序列为1 183 bp的基因片段,与已知B. velezensis模式种NRRL B-41580T相似性为98.54%,其序列与系统发育分析参见图 4B,可见菌株RJW-5-5与B. velezensis NRRL B-41580T以95%的支持率聚成同一分支。
|
| 图 4 基于16S rRNA (A)以及rpoB (B)基因序列由MEGA构建的菌株RJW-5-5邻接法系统发育树 Figure 4 Phylogenetic tree of strain RJW-5-5 constructed by MEGA based on 16S rRNA (A) and rpoB (B) gene sequence 注:括号中序号为GenBank登录号;进化树节点上的数据为Bootstrap值;标尺0.001和0.02代表序列间分歧度 Note: The serial number in parenthesis is the GenBank login number; The data on the node of the evolutionary tree is Bootstrap value; Ruler 0.001 and 0.02 represents the degree of divergence between sequences |
|
|
菌株RJW-5-5全基因组大小为4 034 335 bp,测序深度为541.0×,覆盖率为92.04%,GC含量为47.32%,菌株RJW-5-5的全基因组序列已提交至NCBI (登录号SRR11267609),菌株RJW-5-5测序碱基Q值都大于30,测序结果较为可信。
2.4 BAGEL4分析结果通过在线软件BAGEL4挖掘菌株RJW-5-5可能产生的细菌素或RiPPPs,结果注释到RJW-5-5的代谢产物中潜在的热点区域(Areas of Interest,AOI)有6个,4种产物分别为Lasso_peptide、Cerecidin、Sactipeptides以及Propionicin_SM1 (表 4)。
| AOI | Gene-start | Gene-end | Class |
| gnl-BIOEASY-contig000025.21.AOI-01 | 25 289 | 45 289 | Lasso_peptide |
| gnl-BIOEASY-contig000016.27.AOI-01 | 119 723 | 132 246 | 174.1; Cerecidin |
| gnl-BIOEASY-contig000004.41.AOI-01 | 294 419 | 314 419 | Sactipeptides |
| gnl-BIOEASY-contig000003.43.AOI-01 | 338 561 | 348 896 | 172.1; Cerecidin |
| gnl-BIOEASY-contig000009.44.AOI-01 | 189 274 | 216 388 | 186.2; Propionicin_SM1 |
| gnl-BIOEASY-contig000022.46.AOI-01 | 15 638 | 35 638 | Sactipeptides |
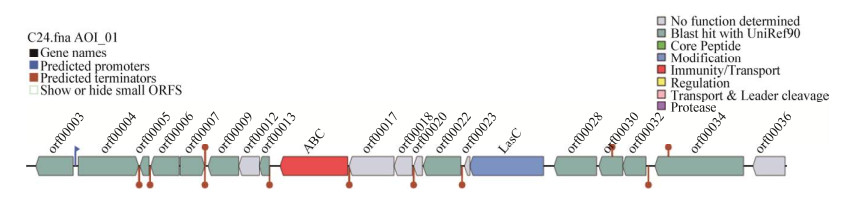
注释到的Lasso_peptide生物合成基因簇的具体信息如图 5所示。Lasso_peptide基因簇共有20个ORF,启动子在orf00003–orf00004之间,orf00003基因片段在吸收磷方面具有重要调控作用,orf00004调控合成三功能核苷酸磷酸酯酶YfkN蛋白,AOI_01:ABC基因在Contig25的第6 676–8 454碱基之间,编码合成异质囊分化ATP结合蛋白HepA。结构保守的ABC转运蛋白是套索肽合成的核心蛋白,分别编码前体肽A、半胱氨酸蛋白酶B和ATP依赖性内酰胺合成酶C的基因。ABC转运蛋白能使套索肽具有增强宿主免疫力的功能,因此,含有ABC转运蛋白的套索肽通常具有抗菌活性[22],AOI_01:LasC调控天冬酰胺合成酶的合成。
|
| 图 5 贝莱斯芽孢杆菌RJW-5-5中推定的Lasso_peptide基因簇 Figure 5 Presumed Lasso_peptide gene cluster in B. velezensis RJW-5-5 |
|
|
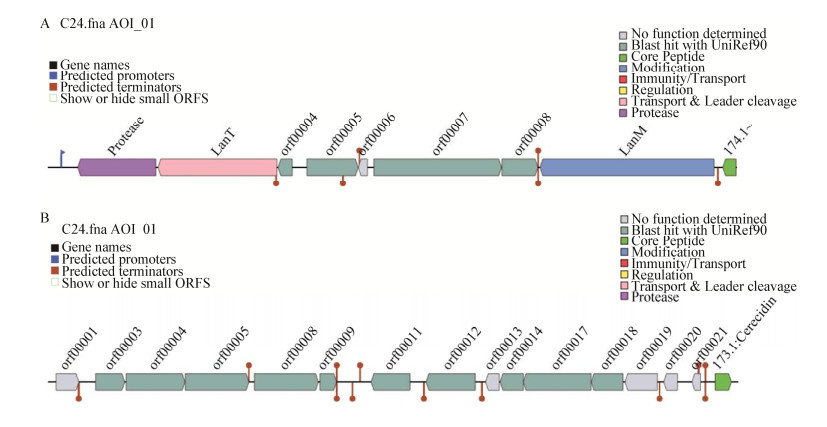
Cerecidin属于羊毛硫抗菌肽类,注释到的Cerecidin生物合成基因簇的具体信息如图 6所示。预测结果中,共有2个AOI片段可以编码合成Cerecidin,启动子位于Protease之前,其中,Contig000003:LanT调控羊毛硫菌酸酸转运蛋白系统,Contig000003:LanM调控合成羊毛硫抗生素修饰酶,核心肽Contig000003:174.1: Cerecidin及Contig000016:173.1:Cerecidin调节LE-DUF、LE-LAC481、LE-MER+2PEP、L_biotic_typeA、acteriocin_IIc、Mersacidin和Cerecidin的表达。
|
| 图 6 贝莱斯芽孢杆菌RJW-5-5中推定的Cerecidin基因簇 Figure 6 Putative cerecidin gene cluster in B. velezensis RJW-5-5 Note: A: 174.1: Cerecidin; B: 172.1: Cerecidin |
|
|
注释到的Sactipeptide基因簇具体信息如图 7所示,两段Sactipeptides基因簇AOI共有40个开放阅读框,其中预测启动子在Contig000022.46. AOI_01:orf00001–orf00002之间,根据UniRef90对比结果,Contig000004.41.AOI_01:orf00008位点调控合成铁硫团簇载体蛋白。Sactipeptide肽是一类具有半胱氨酸巯基与受体氨基的α-碳原子连接的分子内硫醚键的多肽,其以自由基S-腺苷甲硫氨酸(S-Adenosyl Methionine,SAM)酶对前导肽进行依赖性方式催化形成[23],这个独特的连接键与含有硫的氨基酸残基连到β-碳键完全不同[24]。

|
| 图 7 贝莱斯芽孢杆菌RJW-5-5中推定的Sactipeptides基因簇 Figure 7 The putative Sactipeptides gene cluster in B. velezensis RJW-5-5 注:A:Contig000004基因簇片段;B:Contig000022基因簇片段 Note: A: Contig000004 gene cluster fragment; B: Contig000022 gene cluster fragment |
|
|
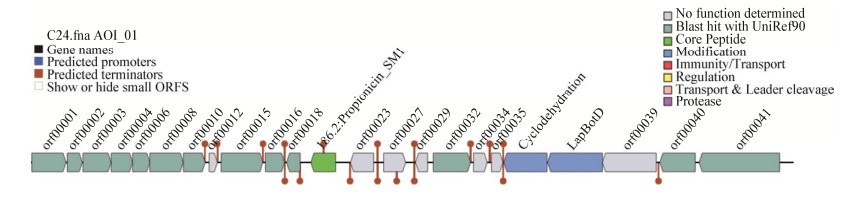
Propionicin_SM1属于一种新型细菌素,是Miescher等[25]从瑞士生牛奶分离的丙酸杆菌无细胞上清液中纯化的,注释到的Propionicin_SM1生物合成基因簇的具体信息如图 8所示,基因簇的注释信息详见表 5。
|
| 图 8 贝莱斯芽孢杆菌RJW-5-5中推定的Propionicin_SM1基因簇 Figure 8 The putative Propionicin_SM1 gene cluster in B. velezensis RJW-5-5 |
|
|
| 蛋白编码 Protein ID |
基因起始 Gene_start |
基因终点 Gene_end |
链 Strand |
功能 Function |
| Contig000009.44.AOI_01:orf00001 | 28 | 1 245 | + | Anthranilate synthase component 1 |
| Contig000009.44.AOI_01:orf00002 | 1 284 | 1 829 | + | Bifunctional protein TrpGD |
| Contig000009.44.AOI_01:orf00003 | 1 850 | 2 851 | + | Anthranilate phosphoribosyltransferase |
| Contig000009.44.AOI_01:orf00004 | 2 853 | 3 614 | + | Indole-3-glycerol phosphate synthase |
| Contig000009.44.AOI_01:orf00006 | 3 611 | 4 225 | + | N-(5ʹ-phosphoribosyl)anthranilate isomerase |
| Contig000009.44.AOI_01:orf00008 | 4 222 | 5 415 | + | Tryptophan synthase beta chain |
| Contig000009.44.AOI_01:orf00010 | 5 419 | 6 195 | + | Tryptophan synthase alpha chain |
| Contig000009.44.AOI_01:orf00012 | 6 333 | 6 629 | + | - |
| Contig000009.44.AOI_01:orf00015 | 6 758 | 8 245 | + | L-lactate permease |
| Contig000009.44.AOI_01:orf00016 | 8 336 | 9 019 | + | Uncharacterized protein YukJ |
| Contig000009.44.AOI_01:orf00018 | 9 087 | 9 572 | - | SPBc2 prophage-derived disulfide bond formation protein A n=5 RepID=BDBA_BACSU |
| Contig000009.44.AOI_01:186.2; Propionicin_SM1 | 9 949 | 10 830 | - | 186.2; Propionicin_SM1 |
| Contig000009.44.AOI_01:orf00023 | 11 354 | 12 187 | - | - |
| Contig000009.44.AOI_01:orf00027 | 12 537 | 13 322 | + | - |
| Contig000009.44.AOI_01:orf00029 | 13 669 | 14 100 | - | - |
| Contig000009.44.AOI_01:orf00032 | 14 298 | 15 632 | + | Coenzyme A disulfide reductase |
| Contig000009.44.AOI_01:orf00034 | 15 733 | 16 224 | + | - |
| Contig000009.44.AOI_01:orf00035 | 16 369 | 16 779 | + | - |
| Contig000009.44.AOI_01:Cyclodehydration | 16 810 | 18 351 | - | Putative nitroreductase MJ1384 |
| Contig000009.44.AOI_01:LapBotD | 18 368 | 20 317 | - | Uncharacterized protein in tfuA 3ʹ region |
| Contig000009.44.AOI_01:orf00039 | 20 314 | 22 233 | - | - |
| Contig000009.44.AOI_01:orf00040 | 22 358 | 23 617 | - | Dihydrolipoyllysine-residue succinyltransferase component of 2-oxoglutarate dehydrogenase complex |
| Contig000009.44.AOI_01:orf00041 | 23 751 | 26 618 | - | 2-oxoglutarate dehydrogenase E1 component |
近年来,化学农药的危害越来越被关注,随着进一步倡导“绿色、生态、健康、文明”发展,中国越来越重视化学药剂给环境带来的巨大负面影响。由于长期以及不合理地使用化学农药,我国乃至世界已经出现了严重的“3R”问题(Resistance,Recurrence,Residue)。基于绿色防控[26]的基本条件,本实验分离筛选出一株生防菌株RJW-5-5,其对梨黑斑病菌、玉米大斑病菌、烟草赤星病菌、马铃薯早疫病菌、西瓜炭疽病菌以及棉花枯萎病菌等都有较好的抑制作用,可为作物病害的防治提供一定的理论依据。
随着对抗生素生物合成过程的了解和基因组序列的积累,基因组挖掘的时代即将来临。尤其是近年来,通过对物种的全基因组挖掘,发现了大量已知或未知的芽孢杆菌抗生素基因簇,甚至包括被广泛研究的放线菌,其中许多放线菌被发现可产生羊毛硫抗生素[27]。此外,在某些不被认为是产生抗生素的类蜡样芽孢杆菌基因组中,一些隐藏的抗生素基因簇也很多[28]。本研究在贝莱斯芽孢杆菌RJW-5-5中共检测到4种功能基因簇,分别为Lasso_peptide、Cerecidin、Sactipeptides以及Propionicin_SM1。其中,Cerecidin属于II类羊毛硫抗菌肽,常为环状结构,II类羊毛硫抗菌肽通过单一的双功能羊毛硫氨酸修饰酶,LanM进行修饰[29]。Lasso_peptide以及Sactipeptides都属于RiPPs,该类型的Lasso_peptide在1991年首次被发现[30]。Lasso_peptide的结构特征是具有N-末端大内酰胺环,其被C-末端尾部穿过,产生独特的套索结构,即所谓的套索结[31]。套索结由甘氨酸、丙氨酸、丝氨酸或半胱氨酸的N-末端α-氨基与天冬氨酸或谷氨酸的羧酸侧链之间的异肽键形成[32]。已经发现的Lasso_peptide通过对酶的抑制作用显示抗菌活性[33],本次挖掘出的Lasso_peptide与其功能相似,也具有ABC转运蛋白。
本研究发现的Propionicin_SM1基因簇为首次在芽孢杆菌中发现,属于丙酸杆菌素,这是细菌素的一种,能够合成双功能蛋白TrpGD、二硫还原酶、2-氧戊二酸脱氢酶E1组分等。前人研究得知Propionicin_SM1的抑菌活性较强,100 ℃加热10 min、30 ℃保持2周后活性依旧稳定,在4 ℃冰箱中可冷藏保存6个月,耐酸碱值为pH 3.0-9.0[25]。其对詹氏丙酸杆菌和真菌的杀菌效果明显,可抑制多种食源性致病菌,如致病性大肠杆菌、铜绿假单胞菌、副溶血性弧菌、小肠结肠炎耶尔森氏菌和一株棒状杆菌[34],对其他詹氏丙酸杆菌的杀菌效果微弱,是第一个可以应用于遗传学方面研究的细菌素[23],在食物防腐方面研究较多,对大部分革兰氏阴性菌和部分阳性菌都有一定的抑制作用。这为以后芽孢杆菌量产Propionicin_SM1提供了理论依据,这些羊毛硫抗生素及其他RiPPs在贝莱斯芽孢杆菌中的合成机制和生物学活性有待进行深入的研究。
| [1] |
Ruiz-García C, Béjar V, Martínez-Checa F, Llamas I, Quesada E. Bacillus velezensis sp. nov., a surfactant-producing bacterium isolated from the River Vélez in Málaga, Southern Spain[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(1): 191-195. DOI:10.1099/ijs.0.63310-0 |
| [2] |
Cai GL, Zhang F, Ouyang YX, Zhao CS, Peng XH, Jiang AM. Research progress on Bacillus velezensis[J]. Northern Horticulture, 2018, 42(12): 162-167. (in Chinese) 蔡高磊, 张凡, 欧阳友香, 赵昌松, 彭宣和, 江爱明. 贝莱斯芽孢杆菌(Bacillus velezensis)研究进展[J]. 北方园艺, 2018, 42(12): 161-167. |
| [3] |
Gao ZF, Zhang BJ, Liu HP, Han JC, Zhang YJ. Identification of endophytic Bacillus velezensis ZSY-1 strain and antifungal activity of its volatile compounds against Alternaria solani and Botrytis cinerea[J]. Biological Control, 2017, 105: 27-39. DOI:10.1016/j.biocontrol.2016.11.007 |
| [4] |
Sun PP, Cui JC, Jia XH, Wang WH. Complete genome analysis of Bacillus velezensis L-1 and its inhibitory effect on pear gray and blue mold[J]. Acta Microbiologica Sinica, 2018, 58(9): 1637-1646. (in Chinese) 孙平平, 崔建潮, 贾晓辉, 王文辉. 贝莱斯芽孢杆菌L-1对梨灰霉和青霉病菌的抑制作用评价及全基因组分析[J]. 微生物学报, 2018, 58(9): 1637-1646. |
| [5] |
Yang K, Zheng KB, Huang XH, Yuan J, Chen J. Identification and antifungal activity of marine Bacillus velezensis strain TCS001[J]. Chinese Journal of Pesticide Science, 2018, 20(3): 333-339. (in Chinese) 杨可, 郑柯斌, 黄晓慧, 袁静, 陈杰. 海洋生境贝莱斯芽孢杆菌TCS001的鉴定及抑真菌活性[J]. 农药学学报, 2018, 20(3): 333-339. |
| [6] |
Gao P, Han JZ, Lu ZX, Lü FX, Zhao HZ, Zhang C, Bie XM. Isolation and identification of lactic acid bacterial strain with broad-spectrum antibacterial activity and extraction and purification of bacteriocin produced by it[J]. Food Science, 2016, 37(11): 160-166. (in Chinese) 高鹏, 韩金志, 陆兆新, 吕凤霞, 赵海珍, 张充, 别小妹. 广谱抗菌乳酸菌的分离鉴定及细菌素的提取和纯化[J]. 食品科学, 2016, 37(11): 160-166. DOI:10.7506/spkx1002-6630-201611028 |
| [7] |
Luo X, Fu L, Hao TY, Fang LY. Evaluation of antibacterial effects of propionibacterium bacteriocin on mung bean sprouts and its application in preservation[J]. Industrial Microbiology, 2018, 48(1): 37-42. (in Chinese) 罗欣, 傅亮, 郝天瑶, 方良月. 丙酸杆菌素抑菌效果评价及在芽菜保鲜中的应用[J]. 工业微生物, 2018, 48(1): 37-42. |
| [8] |
Tao YM, Pan HJ, Huang J, Xi X, Li P, Lu ZJ. Research and application of a novel bio-control microbial factor Bacillus velezensis[J]. China Plant Protection, 2019, 39(9): 26-33. (in Chinese) 陶永梅, 潘洪吉, 黄健, 席昕, 李鹏, 卢志军. 新型生防微生物因子贝莱斯芽孢杆菌(Bacillus velezensis)的研究与应用[J]. 中国植保导刊, 2019, 39(9): 26-33. |
| [9] |
Chowdhury SP, Hartmann A, Gao XW, Borriss R. Biocontrol mechanism by root-associated Bacillus amyloliquefaciens FZB42: a review[J]. Frontiers in Microbiology, 2015, 6: 780. |
| [10] |
Arnison PG, Bibb MJ, Bierbaum G, Bowers AA, Bugni TS, Bulaj G, Camarero JA, Campopiano DJ, Challis GL, Clardy J. Ribosomally synthesized and post-translationally modified peptide natural products: overview and recommendations for a universal nomenclature[J]. Natural product reports, 2013, 30(1): 108-160. DOI:10.1039/C2NP20085F |
| [11] |
Alvarez-Sieiro P, Montalbán-López M, Mu DD, Kuipers OP. Bacteriocins of lactic acid bacteria: extending the family[J]. Applied Microbiology and Biotechnology, 2016, 100(7): 2939-2951. DOI:10.1007/s00253-016-7343-9 |
| [12] |
Zhao X. Identification and characterization of antimicrobial compounds produced by Bacillus sp. BH072[D]. Tianjin: Doctoral Dissertation of Tianjin University, 2017 (in Chinese) 赵鑫. 芽胞杆菌BH072抗菌因子的鉴定及其抗菌活性的研究[D]. 天津: 天津大学博士学位论文, 2017 |
| [13] |
Wang GS. Antimicrobial Peptides: Discovery, Design, and Novel Therapeutic Strategies[M]. Wallingford: CABI Publishing, 2010
|
| [14] |
Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual[M]. 3rd ed. Beijing: Science Press, 2002.
|
| [15] |
Quan X, Xue BG, Yang LR, Sun H, Yan HX. Identification of biocontrol strain YB-81 and its biocontrol efficacy against tomato gray mold[J]. Plant Protection, 2010, 36(5): 57-60. (in Chinese) 全鑫, 薛保国, 杨丽荣, 孙虎, 闫海霞. 生防菌株YB-81的鉴定及其对番茄灰霉病的防效[J]. 植物保护, 2010, 36(5): 57-60. |
| [16] |
Feng SL, Wang RY, Lin KC, Zhang YM, Du LX, Fan XH, Cao WP. Identification of strain Bs-208 and its inhibition against plant pathogenic fungi[J]. Chinese Journal of Biological Control, 2003, 19(4): 171-174. (in Chinese) 冯书亮, 王容燕, 林开春, 张用梅, 杜立新, 范秀华, 曹伟平. 拮抗细菌Bs-208菌株鉴定及对几种植物病原菌的抑菌测定[J]. 中国生物防治, 2003, 19(4): 171-174. |
| [17] |
Lee KJ, Kamala-Kannan S, Sub HS, Seong CK, Lee GW. Biological control of Phytophthora blight in red pepper (Capsicum annuum L.) using Bacillus subtilis[J]. World Journal of Microbiology and Biotechnology, 2008, 24(7): 1139-1145. DOI:10.1007/s11274-007-9585-2 |
| [18] |
Dong XZ, Cai MY. Identification Manual of Common Bacterial System[M]. Beijing: Science Press, 2001. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [19] |
Buchanan RE, Gibbons NE. Bergey's Manual of Determinative bacteriology[M]. 9th ed. Beijing: Science Press, 1984.
|
| [20] |
Kloepper JW, Schroth MN, Miller TD. Effects of rhizosphere colonization by plant growth-promoting rhizobacteria on potato plant development and yield[J]. Phytopathology, 1980, 70(11): 1078-1082. |
| [21] |
Shi YY, Zhao P, Song SW, Xiong MZ, Mo CB, Zhong NQ. Isolation and characterization of the antagonistic bacterium YN-2-2 against potato common scab[J]. Microbiology China, 2020, 47(8): 2425-2435. (in Chinese) 石莹莹, 赵盼, 宋双伟, 熊悯梓, 莫乘宝, 仲乃琴. 马铃薯疮痂病拮抗菌YN-2-2的分离与鉴定[J]. 微生物学通报, 2020, 47(8): 2425-2435. |
| [22] |
Tietz JI, Schwalen CJ, Patel PS, Maxson T, Blair PM, Tai HC, Zakai UI, Mitchell DA. A new genome-mining tool redefines the lasso peptide biosynthetic landscape[J]. Nature Chemical Biology, 2017, 13(5): 470-478. |
| [23] |
Azevedo AC, Bento CBP, Ruiz JC, Queiroz MV, Mantovani HC. Distribution and genetic diversity of bacteriocin gene clusters in rumen microbial genomes[J]. Applied and Environmental Microbiology, 2015, 81(20): 7290-7304. |
| [24] |
Yang X, Van Der Donk WA. Ribosomally synthesized and post-translationally modified peptide natural products: new insights into the role of leader and core peptides during biosynthesis[J]. Chemistry, 2013, 19(24): 7662-7677. |
| [25] |
Miescher S, Stierli MP, Teuber M, Meile L. Propionicin SM1, a bacteriocin from Propionibacterium jensenii DF1: isolation and characterization of the protein and its gene[J]. Systematic and Applied Microbiology, 2000, 23(2): 174-184. |
| [26] |
Yang PY, Xiong YK, Yin Z, Shan XN. Progress and prospects on field demonstrations of green pest control technologies[J]. China Plant Protection, 2010, 30(4): 37-38. (in Chinese) 杨普云, 熊延坤, 尹哲, 单绪南. 绿色防控技术示范工作进展与展望[J]. 中国植保导刊, 2010, 30(4): 37-38. |
| [27] |
Foulston LC, Bibb MJ. Microbisporicin gene cluster reveals unusual features of lantibiotic biosynthesis in actinomycetes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(30): 13461-13466. |
| [28] |
Marsh AJ, O'Sullivan O, Ross RP, Cotter PD, Hill C. In silico analysis highlights the frequency and diversity of type 1 lantibiotic gene clusters in genome sequenced bacteria[J]. BMC Genomics, 2010, 11(1): 679. |
| [29] |
Begley M, Cotter PD, Hill C, Ross RP. Identification of a novel two-peptide lantibiotic, lichenicidin, following rational genome mining for LanM proteins[J]. Applied and Environmental Microbiology, 2009, 75(17): 5451-5460. |
| [30] |
Weber W, Fischli W, Hochuli E, Kupfer E, Weibel EK. Anantin: a peptide antagonist of the atrial natriuretic factor (ANF). I. Producing organism, fermentation, isolation and biological activity[J]. The Journal of Antibiotics, 1991, 44(2): 164-171. |
| [31] |
Hegemann JD, Zimmermann M, Xie XL, Marahiel MA. Lasso peptides: an intriguing class of bacterial natural products[J]. Accounts of Chemical Research, 2015, 48(7): 1909-1919. |
| [32] |
Velásquez JE, Van Der Donk WA. Genome mining for ribosomally synthesized natural products[J]. Current Opinion in Chemical Biology, 2011, 15(1): 11-21. |
| [33] |
Delgado MA, Rintoul MR, Farías RN, Salomón RA. Escherichia coli RNA polymerase is the target of the cyclopeptide antibiotic microcin J25[J]. Journal of Bacteriology, 2001, 183(15): 4543-4550. |
| [34] |
Mohamed SE, Tahoun MK. The expression of propionicin plg-1 gene (plg-1) by lactic starters[J]. Journal of Dairy research, 2015, 82(2): 209-214. |
 2021, Vol. 48
2021, Vol. 48